n2o3,hno2 ,ni3,nh5br. 2)водный раствор аммиака не
Химия
Выберитеникмен · 20.08.2019 20:00
Ответов: 2 Показать ответы
4 Обсудить
Ответы
Ответ разместил: Bananchik1234567u
10.03.2019 18:51
24,5 г 60 г, х г у л
h3so4 + 2nacl = na2so4 + 2hcl стрелка вверх
98 г 117 г 44,8 л
1) определим,какое из исходных веществ прореагирует полностью без остатка,приняв за х,например массу поваренной соли:
для взаимодействия 98 г кислоты необходимо 117 г соли,а
для — // — 24,5 г, откуда
х=24,5*117/98=29,25 г
2) так как соли дано в излишке,значит расчет объема хлороводорода ведем по массе кислоты:
при взаимодействии 98 г кислоты образуется 44,8 л хлороводорода,а
при — // — 24,5 г, откуда
у=24,5*44,8/98=11,2 л
ответ: 11,2 л хлороводорода выделится при взаимодействии 24,5 г серной кислоты с 60 г поваренной соли
Ответ разместил: aasybas
10. 03.2019 18:51
03.2019 18:51
якщо розчин солі дає лужну реакцію,то вона утворена сильною основою і слабкою кислотою — це калій сульфіт(k2so3)
Ответ разместил: Дарья1029канадола
10.03.2019 18:48
сн3cho + ag2o = ch4cooh + 2ag
n(ag) = m(ag)/m(ag) = 2,7/108 = 0,025 моль
по уравнению n(ch4cho) = n(ag)/2 = 0,025/2 = 0,0125 моль
m(ch4cho) = n(ch4cho)*m(ch4cho) = 0,0125*44 = 0,55 г
Ответ разместил: Anytohka0cosmos
20.08.2019 20:00
1)в каком из перечисленных соединений степень окисления азота равна -3: ответ: nh5br. ! в соединения солей аммония ст. окисления равна -3.2)водный раствор аммиака не реагирует: ответ: г. с гидроксидом кальция! вод. р-р аммиака имеет основные свойства и не будет реагировать с основаниями и основными .3)какой из данных оксидов азота не является кислотным: ответ: а. n2o несолеобразующие оксиды азота: n2o, no, остальные — кислотные4)до какого оксида азота окисляется аммиак в присутствии катализатора: ответ: в. no ! реакция: 4nh₃ + 5o₂ = 4no + 6h₂ o 5) какой оксид азота при растворении в воде образует одновременно две кислоты: ответ: г.
Другие вопросы по Химии
1) технический оксид ртути(ii)содержит примеси, массовая доля которых составляет 10%. определите массу и количество вещесва кислорода, который можно получить при разложении 43,4г т…
Химия
28.02.2019 18:40
4 ответ(ов)
Открыть
Fakla
Какое количество воды образуется в реакции кислорода количеством 1,6 моль с избытком кислорода?…
Химия
01.03.2019 18:40
2 ответ(ов)
Открыть
rast052
Вкаком направлении будет смещаться равновесие с понижением температуры и давления для следующей обратимой реакции: co2+2h3ch4oh 9(г) (н=+193,3 кдж\моль). ..
..
Химия
02.03.2019 01:20
3 ответ(ов)
Открыть
Natalye71
1) определите объем водорода, который может быть получен при взаимодействии с водой 5 г са, если выход водорода составляет 90% от теоретически возможного? 2)вычислите массу хлорид…
Химия
02.03.2019 04:00
3 ответ(ов)
Открыть
яна1766
Если вас не затруднит, то с 1) напишите уравнение реакций с которых можно осуществить превращения: — (- это стрелочка в право) a) cuo-cu-cuo-cu cl 2 b) fe 2 o 3-fe- fe cl 2 2)…
Химия
02.03.2019 11:40
4 ответ(ов)
Открыть
fantomidri
Вычислите количество вещества оксида (iv) который занимает объем 120 литров при температуре 27 градусов и давлении 166,2 кпа…
Химия
02.03.2019 17:00
3 ответ(ов)
Открыть
dimaschastny
1. вещество 2-метилбутадиен-1. 3, относится к классу углеводородов, общая формула которого а) cnh3n-2 cnh3n+2 c) cnh3n d) cnh3n-6…
3, относится к классу углеводородов, общая формула которого а) cnh3n-2 cnh3n+2 c) cnh3n d) cnh3n-6…
Химия
02.03.2019 20:40
3 ответ(ов)
Открыть
Razzey
Мне 1)как следует хранить известковую воду в открытом или в закрытом сосуде? ответ мотивируйте уравнением реакций! 2)написать уравнение реакций, котрорые будут происходить при…
Химия
03.03.2019 01:20
4 ответ(ов)
Открыть
afdsfdsafdsfdsf
Составить уравнение реакции: исходные вещества: сульфат алюминия и нитрат бария; продукты реакции: сульфат бария и нитрат алюминия…
Химия
03.03.2019 07:40
3 ответ(ов)
Открыть
Danika38
При сжигании дров в печи образуется зола. масса золы значительно меньше массы сгоревших дров. объясните, как это согласуется с законом сохранения массы веществ при реакциях….
Химия
03.03.2019 08:00
2 ответ(ов)
Открыть
FGHJER
Рассчитайте массу уксусной кислоты, содержащейся в столовом уксусе массой 500г. , если массовая доля кислоты в нём равна 6%….
, если массовая доля кислоты в нём равна 6%….
Химия
03.03.2019 08:00
4 ответ(ов)
Открыть
Вопросзнания
Вычислите объемы водорода и кислорода (н. у),которые образуются при разложении 90 г воды…
Химия
03.03.2019 08:00
4 ответ(ов)
Открыть
ариариииирпа
Оксид азота — формула, характеристика и свойства химического вещества » Kupuk.net
В науке известно несколько видов оксида азота. Некоторые из них используются в медицинской практике и промышленных целях. Часть соединений крайне неустойчивы и не имеют практического значения. Химические вещества этой группы оказывают воздействие на организм человека и принимают участие в обмене веществ.
Виды и свойства
Азот — вещество, которое образует несколько групп оксидов. Все они обладают разной молярной массой и физическими характеристиками. В группу солеобразующих входят:
 Химическая формула N2O3, кратность связи равна 3. Вещество имеет вид жидкости тёмно-синего цвета, плотность которой меньше плотности воды. Кристаллизуется при температуре -100 градусов. Этот кислотный оксид реагирует со щелочами, образуя соли. С водой образует азотистую кислоту: N2O3+h3O = 2HNO2.
Химическая формула N2O3, кратность связи равна 3. Вещество имеет вид жидкости тёмно-синего цвета, плотность которой меньше плотности воды. Кристаллизуется при температуре -100 градусов. Этот кислотный оксид реагирует со щелочами, образуя соли. С водой образует азотистую кислоту: N2O3+h3O = 2HNO2. Обладает свойствами окислителя и восстановителя.
Обладает свойствами окислителя и восстановителя.Связи атомов происходят по механизму «донор-акцептор». Атом азота отдаёт электрон и приобретает заряд со знаком «плюс». Кислород присоединяет электрон, приобретая отрицательный заряд.
Несолеобразующие соединения
Второй класс соединений — несолеобразующие. В неё входят оксид одновалентного и двухвалентного азота. Вещество с формулой N2O имеет линейное строение молекулы. Представляет собой газ, не имеющий цвета. В нормальных условиях вещество инертно. Обладает сладковатым вкусом и слабым запахом. Легко растворяется в воде, однако не вступает с ней в химические реакции. С водородом реагирует со взрывом. Не вступает в химические реакции с кислотами и основаниями.
При небольшом нагревании быстро разлагается, проявляет свойства окислителя.
Окисляет металлы, водород, сернистый газ и прочее. Растворяясь в воде, образует азотную кислоту. В результате таких реакций образуется свободная форма азота.
Вступая в контакт с окислителями, N2O выступает в роли восстановителя. К примеру, раствор перманганата в серной кислоте окисляет закись азота до образования монооксида. В водном растворе окисляет диоксид серы до серной кислоты.
Монооксид (II) — NO. При низких температурах молекулы димеризуются и образуют новое вещество. Окись азота представляет собой газ без цвета и запаха, малорастворимый в воде. В присутствии кислорода загорается, образуется диоксид — вещество коричневого цвета. Под действием хлора или озона легко окисляется. Жидкая и твёрдая форма имеет голубую окраску. Вступает во взаимодействие с основаниями и основными оксидами.
Вступает в химические связи с окислителями, водородом, активными металлами. Входит в состав выхлопных газов автомобилей в качестве побочного продукта.
Получение в природе и промышленности
В природе азот встречается преимущественно в чистом виде. Во время грозы азот и кислород вступают во взаимодействие при высокой температуре. Образуется монооксид: N2+O2 = 2NO.
В промышленных условиях получают следующие соединения:

Живые организмы также вырабатывают соединения азота. Растения способны вырабатывать монооксид азота несколькими способами:
Практическое применение
Химические свойства оксида азота нашли практическое применение. Их используют в медицинской практике, военной, пищевой и химической промышленности. Наиболее часто соединения используются в следующих целях:
Их используют в медицинской практике, военной, пищевой и химической промышленности. Наиболее часто соединения используются в следующих целях:

Влияние на живые организмы
В смеси с кислородом закись азота в малых концентрациях воздействует на нервную систему человека. Эффект напоминает опьянение лёгкой степени и сопровождается эйфорией. За это веществу дали название — «веселящий газ». В чистом виде вещество вызывает состояние опьянения и выраженную сонливость. При передозировке вначале вызывает приступ судорожного смеха, затем потерю сознания.
Монооксид азота — высокотоксичное соединение. Поступая в организм в больших концентрациях, способен изменить структуру гемоглобина, что взывает кислородное голодание. Оксид азота (IV) — крайне ядовитое вещество, представляющее опасность для здоровья и жизни.
Монооксид азота — вторичный посредник, который участвует в механизмах внутриклеточной и межклеточной передачи импульсов. Это вещество вырабатывают практически все живые организмы, от одноклеточных до млекопитающих.
Изначально окись азота была известна как эндотелиальный сосудорасширяющий фактор.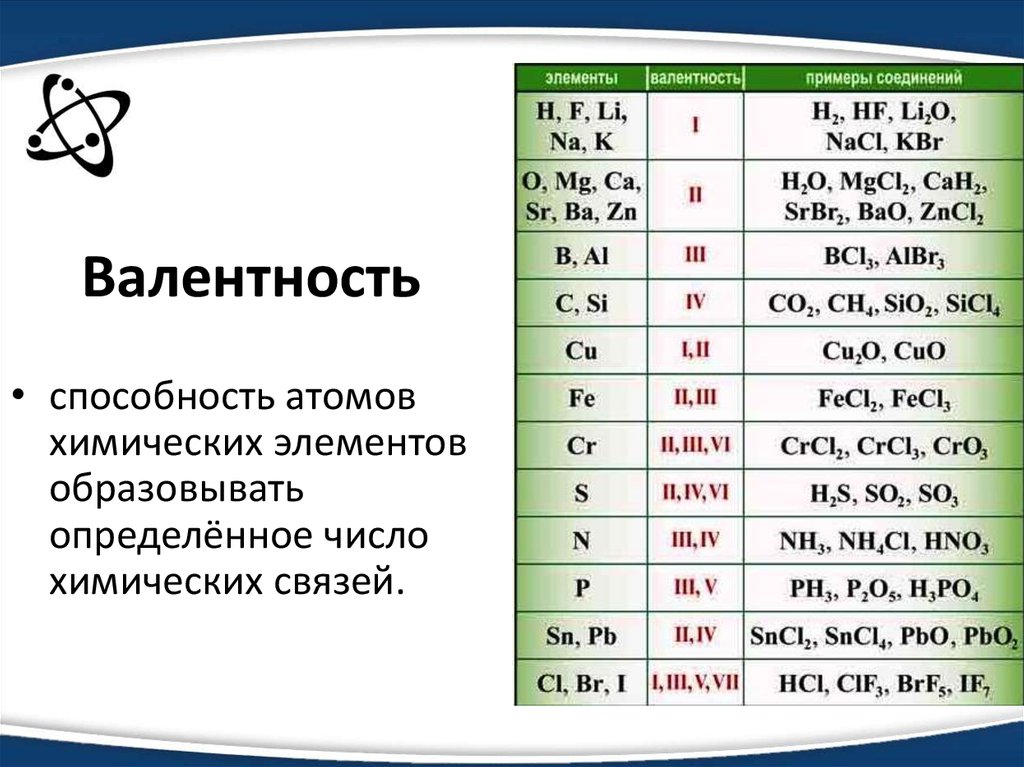 Она образовалась в организме из аминокислоты аргинина. В химическом процессе участвуют молекулы кислорода, НАДФ и синтаза оксида азота. Другой способ образования вещества — восстановление неорганических солей азотной кислоты.
Она образовалась в организме из аминокислоты аргинина. В химическом процессе участвуют молекулы кислорода, НАДФ и синтаза оксида азота. Другой способ образования вещества — восстановление неорганических солей азотной кислоты.
Эндотелиальные клетки сосудов передают сигнал гладкомышечным элементам, в результате сосуды расширяются и усиливается местный кровоток. Молекула оксида азота обладает способностью легко проникать через мембраны клеток. Благодаря этому она служит для обмена сигналами. Это благотворно влияет на состояние сердечно-сосудистой системы. Снижается риск ишемии миокарда и развития гипертонической болезни.
Уровень эндогенной окиси азота могут повышать растительные продукты — руккола, шпинат, свёкла, петрушка и прочие. Получение вещества из растительных продуктов требует присутствия сапрофитных микроорганизмов. В норме они живут в ротовой полости человека.
Азот — степени окисления, свойства и реакции
Азот (N2) — первый представитель V группы главной подгруппы и 2 периода периодической системы химических элементов Д. И. Менделеева. Если рассматривать местоположение азота в длиннопериодной таблице Менделеева, то там он занимает лидирующее место в 15 группе. Для представителей этой группы было предложено название пниктогены (от греческого корня πνῑ́γω — удушливый, плохо пахнущий). Явно это относится к водородным соединениям представителей данной группы.
И. Менделеева. Если рассматривать местоположение азота в длиннопериодной таблице Менделеева, то там он занимает лидирующее место в 15 группе. Для представителей этой группы было предложено название пниктогены (от греческого корня πνῑ́γω — удушливый, плохо пахнущий). Явно это относится к водородным соединениям представителей данной группы.
Электронное строение азота
Рассмотрим строение атома и электронную конфигурацию азота, а затем сделаем некоторые заключения.
Атомный или порядковый номер азота равен 7, что соответствует количеству электронов и протонов в ядре. Молярная масса равна 14,00728 г/моль, а количество нейтронов в атоме этого изотопа равно семи.
Теперь перейдем к электронному строению. В основном состоянии электронная формула азота: 1s2 2s2 2p3, в сокращенном виде — [He]2s2 2p3. На внешнем энергетическом уровне 5 валентных электронов, среди которых 3 неспаренных p-электрона.
Исходя из такой конфигурации, азот может образовывать только 3 связи по обменному механизму и еще одну по донорно-акцепторному механизму. Это связано с тем, что на втором подуровне у азота больше нет вакантных орбиталей, куда могли бы распариться электроны с 2s-подуровня. Отсюда вытекает максимальная валентность азота IV.
Важно
Валентности азота V нет!
Для азота характерен весь спектр возможных степеней окисления от −3 до +5.
Давайте рассмотрим шкалу, где отражены соединения азота в различных веществах.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Строение молекулы азота
Азот — двухатомная молекула, атомы которой связаны между собой прочной тройной связью. Длина связи — 0,110 нм.
Почему именно тройная связь и из чего она состоит?
Напомним, что у каждого атома в молекуле азота 3 неспаренных электрона, которые и образуют впоследствии тройную связь, которая, в свою очередь, состоит из одной сигма-связи и двух пи-связей.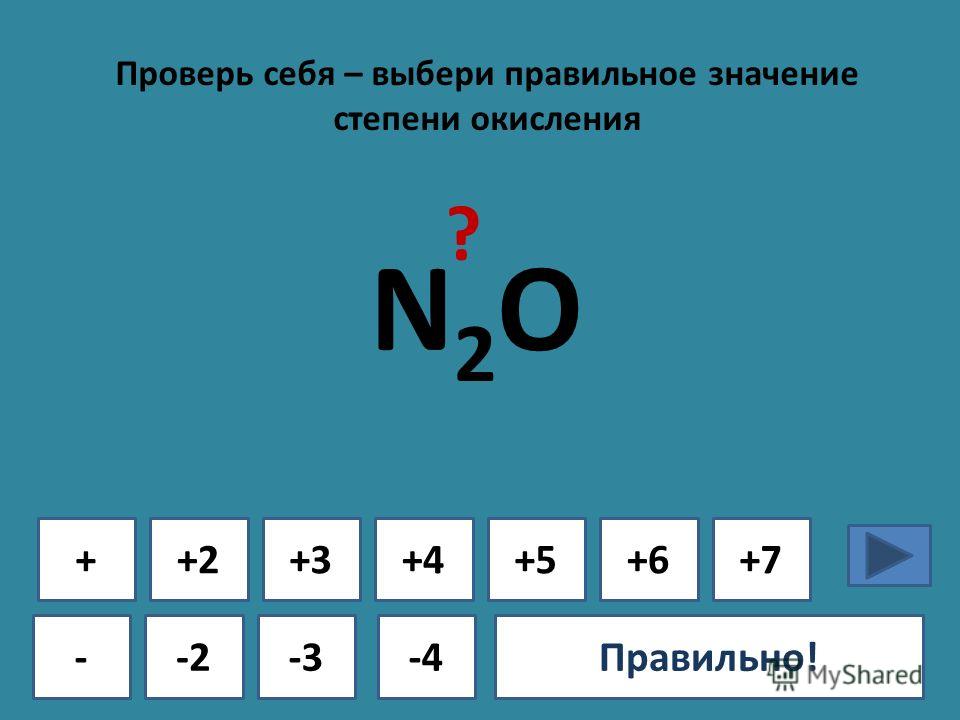
Физические свойства азота
Азот как простое вещество — бесцветный газ, который не имеет запаха и плохо растворяется в воде. По своей молярной массе азот легче, чем воздух. Благодаря наличию тройной неполярной связи и относительно маленьким радиусам атомов азот имеет низкие температуры кипения и плавления: tпл = −210 °С и tкип = −196 °С. Аллотропных модификаций азот не имеет. Несмотря на то, что основное состояние азота — газообразное, он бывает еще и жидким. Например, 1 литр жидкого азота при нагревании до 20 °С превращается в 700 литров газообразного азота. Более подробную информацию можно узнать в нашем видео:
Учёба без слёз (бесплатный гайд для родителей)
Пошаговый гайд от Екатерины Мурашовой о том, как перестать делать уроки за ребёнка и выстроить здоровые отношения с учёбой.
Химические свойства азота
Азот химически малоактивен из-за наличия все той же тройной связи. Она же обуславливает малую термическую устойчивость соединений азота при нагревании. В химических реакциях азот может проявлять себя и как окислитель, и как восстановитель благодаря широкому спектру возможных степеней окисления.
Как восстановитель азот реагирует:
Эти реакции проходят при температуре выше 1000 градусов Цельсия либо в электрическом заряде.
Как окислитель азот реагирует:
с металлами
N2 + 6Li = 2Li3Nазот реагирует при обычных условиях только с литием, а с щелочноземельными металлами — только при нагревании;
с водородом
N2 +3H2 = 2NH3реакция протекает обратимо в присутствии металлического железа в качестве катализатора.
Рассмотрим способы получения азота. В промышленности его получают фракционной перегонкой жидкого воздуха, а вот в лаборатории азот получают иначе.
Азот — основной компонент любого белка в организме человека. Давайте рассмотрим способы получения исходных компонентов для синтеза собственных белков.
Важнейшие соединения азота
Аммиак
В первую очередь поговорим о водородном соединении азота — аммиаке. Аммиак — бесцветный газ с характерным резким запахом. Давайте рассмотрим строение молекулы аммиака:
Аммиак имеет форму тригональной пирамиды. Этот газ очень ядовит и способен вызывать химический ожог глаз, а пары сильно раздражают слизистые оболочки органов дыхания. В то же время аммиак обладает достаточно высокой растворимостью в воде из-за образования водородных связей с молекулами воды. Вас когда-нибудь приводили в чувства после потери сознания ваткой, смоченной чем-то гадко пахнущим? Поздравляю, это было ваше первое знакомство с раствором аммиака в воде.
Поговорим теперь о химических свойствах этого газа.
В отличие от самого азота, аммиак является крайне реакционноспособным соединением.
Например, аммиак реагирует с кислородом (при нагревании):
Как видно из уравнений, аммиак вступает в реакции окисления, а продукты его окисления напрямую зависят от силы окислителя и условий проведения реакций.
Со сложными веществами — окислителями аммиак реагирует следующим образом:
С кислотами аммиак реагирует благодаря своим оснóвным свойствам, что приводит к образованию различных солей:
А теперь рассмотрим получение аммиака. Различают два типа способов: промышленный и лабораторный.
Промышленный способ — синтез из простых веществ:
Лабораторный способ:
В данном способе аммиак собирают в перевернутую вверх дном колбу, так как аммиак легче воздуха.
Азотная кислота
Азотная кислота — одна из важнейших неорганических кислот. Это летучая бесцветная жидкость с резким запахом, которая способна смешиваться с водой в любых пропорциях.
Это летучая бесцветная жидкость с резким запахом, которая способна смешиваться с водой в любых пропорциях.
Получают ее в промышленности в несколько этапов. Рассмотрим подробнее каждый из них:
Окисление аммиака кислородом воздуха на платиновом катализаторе
4NH3 + 5O2 = 4NO + 6H2OОкисление оксида азота (II)
2NO + O2 = 2NO2Поглощение образующегося оксида азота (IV) водой в избытке воздуха
4NO2 + O2 + 2H2O = 4HNO3
Для азотной кислоты характерны особые химические свойства исходя из ее концентрации.
Например, с металлами данная кислота никогда не будет реагировать с выделением газообразного водорода. Рассмотрим таблицу с примерами металлов с различными концентрациями азотной кислоты:
Также азотная кислота как сильный окислитель способна окислять некоторые неметаллы до их кислот. Давайте рассмотрим примеры:
Азотная кислота в соотношении 1:3 с соляной кислотой образуют смесь под названием царская водка. Это желтовато-оранжевая дымящаяся жидкость, которая получила свое название от алхимиков благодаря способности растворять «царские» металлы — золото и платину.
Это желтовато-оранжевая дымящаяся жидкость, которая получила свое название от алхимиков благодаря способности растворять «царские» металлы — золото и платину.
Оксиды азота
В отличие от других химических элементов, азот образует большое число оксидов: N2O, NO, N2O3, NO2, N2O4 и N2O5, каждый из которых является кислотным. В таблице показали, какой оксид какой кислоте соответствует:
Оксид азота (I) N2O. Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде. У этого оксида есть и другие названия, самое распространенное из них — закись азота. Оксид азота (I) применяли в медицине в качестве наркоза более 200 лет назад. При вдыхании этого газа человека охватывает радость и безудержный смех, отчего оксид получил еще одно название — веселящий газ.
Оксид азота (II) NO. Несолеобразующий оксид, который при нормальный условиях является бесцветным газом, плохо растворяется в воде и в больших концентрациях ядовит для человека.
Оксид азота (III) N2O3. Соединение очень неустойчивое и существует только при низких температурах. В твердом и жидком состоянии оксид азота (III) окрашен в ярко-синий цвет. При температуре выше 0 градусов разлагается до оксида азота (II) и оксида азота (IV).
Оксиды азота (IV) NO2 и N2O4. Твердый оксид азота (IV) бесцветный, так как состоит из молекул N2O4. При нагревании появляется коричневая окраска, которая усиливается с повышением температуры по мере увеличения NO2 в смеси. Эти оксиды хорошо растворимы в воде и взаимодействуют с ней.
Оксид азота (V) N2O5. Азотный ангидрид, который образуется в виде летучих бесцветных гигроскопичных кристаллов. Это крайне неустойчивое вещество, которое распадается в течение нескольких часов. При нагревании распадается со взрывом на оксид азота (IV) и газообразный кислород.
Это крайне неустойчивое вещество, которое распадается в течение нескольких часов. При нагревании распадается со взрывом на оксид азота (IV) и газообразный кислород.
Вопросы для самопроверки
Какую связь образуют между собой атомы азота?
Одинарную.
Двойную.
Тройную.
Выберите высшую и низшую степени окисления азота:
−3 и +5,
−5 и +3,
0 и +4,
−3 и +3.
Максимальная валентность азота равна:
V,
III,
IV,
II.
В каком качестве выступает аммиак в окислительно-восстановительных реакциях?
Только окислитель.
Только восстановитель.
И окислитель, и восстановитель.
Не участвует в реакциях с изменением степеней окисления.

Выберите формулу веселящего газа:
NO,
N2O3,
N2O,
N2O4.
Ответы
c
a
c
b
c
11 класс. Химия. Азот.Фосфор. — Азот
Комментарии преподавателя1. Электронное строение атома азота
Химический элемент азот расположен во втором периоде 5 группы, главной подгруппы. Электронная конфигурация атома азота – 1s22s22p3. На валентном энергетическом уровне атома азота нет вакантных орбиталей. Следовательно, электронная пара 2s-подуровня не может быть распарена. См. Рис. 1. Поэтому азот не может быть 5-ти валентным. Максимальная валентность азота в соединениях равна 4. При этом 3 связи образуются по обменному механизму, а одна – по донорно-акцепторному. Азот проявляет степени окисления от -3 до +5.
Азот проявляет степени окисления от -3 до +5.
Рис. 1
Примеры веществ с различной степенью окисления см. рис. 2.
Рис. 2
2. Азот – простое вещество
Для азота нехарактерна аллотропия. Он образует одно простое вещество, N2. Это молекулярное вещество, с ковалентной неполярной связью. Связь образована при помощи трёх общих электронных пар, тройная связь – одна сигма и 2 пи-связи. Тройная связь очень прочная. Это обуславливает низкую реакционно способность молекулярного азота.
Физические свойства
Азот – это газ без цвета и запаха, плохо растворим в воде, немного легче воздуха. Азот вступает в реакцию с некоторыми веществами, но условия проведения реакций очень жесткие (высокие температура и давление, использование катализатора). В обычных условиях азот взаимодействует только с литием, образуя нитрид лития.
6Li + N2 = 2Li3N, гидролизом которого можно получить аммиак.
Li3N + h3O = 3LiOH + Nh4↑ (аммиак)
Под действием электрического разряда азот способен окисляться
N2+O2 ⇄ 2NO
N2+h3 ⇄ 2Nh4 (t=5000С, Р= 1000 атм, катализатор Fe).
Получение азота
В промышленности азот получают перегонкой жидкого воздуха. Так как жидкий азот имеет tкип.= -1960С, то его используют в качестве охлаждающего средства для различных целей.
В лаборатории азот получают из нитрита аммония.
Nh5NO2 N2↑+ 2h3O
Азот применяется для создания инертной атмосферы в некоторых реакциях.
3. Получение и свойства аммиака
В молекуле аммиака атом азота находится в sp3-гибридизации. При помощи гибридных орбиталей образуется связь с атомами водорода. См. рис. 3.Четвертая гибридная орбиталь занята неподеленной парой. Поскольку понятие пространственной конфигурации молекул учитывает распределение атомов в пространстве и не учитывает распределение неподелённых электронных пар, то пространственная конфигурация молекулы азота – это тригональная пирамида с валентным углом 1070. Он отличается от тетраэдрического угла 1090. Это происходит вследствие отталкивания электронов, связывающих электронные пары, от неподеленной электронной пары атома азота.
Рис. 3
Физические свойства
Аммиак – это бесцветный газ, обладающий резким запахом. Он легче воздуха и очень хорошо растворим в воде. В одном объеме воды может раствориться до 700 объёмов аммиака. Разбавленный водный раствор аммиака с концентрацией от 3% до 10% называется нашатырным спиртом. Не путайте с нашатырем. Нашатырь – это хлорид аммония Nh5Cl. Концентрированный раствор аммиака с концентрацией от 18% до 20% называют аммиачной водой. Аммиак можно применять в качестве хладагента в холодильных установках.
Получение аммиака
В промышленности аммиак получают из азота и водорода. (Синтез Габера – Боша)
N2+h3 ⇄ 2Nh4 + Q (t=5000С, Р = 1000 атм, катализатор Fe).
Сырьем является азот, полученный перегонкой жидкого воздуха и водород, который получают разложением природного газа.
В лаборатории аммиак получают из солей аммония.
Nh5NO3 + NaOH Nh4↑ + h3O + NaNO3. Эта реакция является качественной на ион аммония. Её признак – это появление запаха аммиака.
Её признак – это появление запаха аммиака.
Химические свойства аммиака
Аммиак обладает только восстановительными свойствами, т. к. азот находится в своей низшей степени окисления -3.
1. Горение аммиака
4Nh4+3O2 = 2N2+6 h3O
2. Каталитическое окисление аммиака
4Nh4+5O2NO+6h3O
3. Восстановление металлов из их оксидов
3CuO +2Nh4 3CO + N2 +3h3O
4. Проявляет основные свойства. Водные растворы аммиака имеют щелочную реакцию. Взаимодействует с кислотами.
Поскольку в молекуле аммиака есть неподелённая электронная пара, он может образовывать связь по донорно-акцепторному механизму. Благодаря этому аммиак способен реагировать с кислотами, образуя соли аммония.
Nh4+ HCl = Nh5Cl (хлорид аммония)
2Nh4 + h3SO4 = (Nh5)2SO4 (сульфат аммония)
Nh4 + h3SO4 = Nh5HSO4 (гидросульфат аммония)
Соли аммония
Особенность солей аммония в том, что они легко разлагаются при нагревании.
Nh5Cl Nh4↑+ HCl
(Nh5)2CO3Nh4↑+ CO2↑+h3O
Nh5NO3N2O↑+ h3O
4. Получение и химические свойства азотной кислоты
Получение и химические свойства азотной кислоты
В азотной кислоте степень окисления азота равна N+5 — . HN+5O3
При обычных условиях азотная кислота – это бесцветная жидкость, в полтора раза тяжелее воды. Это сильная одноосновная кислота, которая проявляет типичные для кислот свойства.
Окислительные свойства азотной кислоты
Азотная кислота является очень сильным окислителем за счет азота N+5.
1. При взаимодействии азотной кислоты с металлами образуется нитрат металла, продукт восстановления азота и вода. В качестве продуктов восстановления могут быть оксиды азота (N2O, NO, NO2), азот N2, нитрат аммония Nh5NO3. Глубина восстановления азота в таких реакциях зависит от концентрации кислоты, от активности металла, от температуры. Понижение температуры способствует более глубокому восстановлению азота. Водород в реакциях кислоты с металлами не выделяется потому, что азотная кислота проявляет свои окислительные свойства не за счет Н+, а за счет N+5.
С азотной кислотой любой концентрации не реагируют благородные металлы, а с концентрированной ( не реагируют алюминий, хром и железо из-за пассивации.
Схема взаимодействия азотной кислоты с металлами. См. Рис. 4.
Рис. 4
Cu + 4HNO3(конц) = Cu (NO3)2 + 2NO2↑+ 2h3O
3Cu + 8HNO3(разб) = 3Cu (NO3)2 + 2NO↑+ 4h3O
2. Азотная кислота взаимодействует с неметаллами, способными проявлять восстановительные свойства.
С + 4HNO3 =CO2+ 4NO2+ 2h3O
3P + 5HNO3 + 2h3O =3h4PO4+ 5NO
При долгом хранении, на свету или при нагревании азотная кислота может разлагаться.
4HNO3= 4NO2+ 2h3O + О2
Получение азотной кислоты
В лаборатории азотную кислоту получают нагреванием кристаллических нитратов калия или натрия с концентрированной серной кислотой.
2KNO3 + h3SO4 (конц.) K2SO4 + 2HNO3↑
Промышленное получение азотной кислоты.
Сырьем для получения азотной кислоты является азот.
I стадия: N2+h3 ⇄ 2Nh4 + Q (t = 5000С, Р = 1000 атм, катализатор Fe).
II стадия: 4Nh4+5O2NO+6 h3O
III стадия: 2NO +О2⇄2 NO2
IV стадия 4NO2+ 2h3O + О2 ⇄ 4HNO3
Азотная кислота является одной из важнейших неорганических кислот, её используют для получения удобрений, при нитровании органических соединений. Продуктами нитрования может быть нитробензол. Продуктом восстановления нитробензола является анилин, из которого получают красители. При нитровании органических соединений получают тринитрофенол, тринитротолуол или тринитроглицерин. Это взрывчатые вещества.
Нитраты
Нитраты – это соли азотной кислоты. Они обладают ионным типом кристаллической решетки. Это твердые кристаллические вещества, хорошо растворимы в воде, температура плавления у нитратов сравнительно низкая. Они могут быть окрашены, но только за счет катионов соответствующего металла. Важной особенностью химических свойств нитратов является их способность разлагаться при нагревании.
Разложение нитратов
— Нитраты щелочных и щелочноземельных металлов (кроме Li) разлагаются по схеме:
Me+n(NO3)n Me+n(NO2)n+ O2↑
— Нитраты металлов, расположенных в ряду напряжений от Mg до Cu, и нитрат Li разлагаются по схеме:
Me+n(NO3)n Me+nO + NO2↑+ O2↑
— Нитраты металлов, расположенных в ряду напряжений правее Cu, разлагаются по схеме:
Me+n(NO3)n Me + NO2↑+ O2↑
— Разложение нитрата аммония
Nh5NO3N2O↑+ h3O
Горение черного пороха
При обычных условиях нитратный анион в нитратах, в отличие от азотной кислоты, не обладает ярко-выраженными окислительными свойствами. Но при нагревании или в расплавленном состоянии он их способен проявлять.
KNO3+ 3C + S N2↑ + 3CO2↑+ K2S
5. Закись азота, царская водка
Закись азота – веселящий газ
Веселящим газом называется закись азота N2O.
Nh5NO3N2O↑+ h3O
Исследованием этого вещества ученые занимаются давно. Его получают при разложении нитрата аммония. Разложение начинается при 1700С и сопровождается выделением тепла, чтобы не дать протекать ему слишком бурно, следует вовремя прекратить нагревание, т. к. при температурах более 3000С нитрат аммония разлагается со взрывом. При вдыхании N2O сначала наблюдается беспричинная веселость, и поэтому его назвали «веселящий газ», затем пропадает болевая чувствительность, а при вдыхании очень больших объемов начинаются галлюцинации. Закись азота в небольших количествах стали использовать в качестве обезболивающего. Он не оказывает вредного влияния на организм.
Его получают при разложении нитрата аммония. Разложение начинается при 1700С и сопровождается выделением тепла, чтобы не дать протекать ему слишком бурно, следует вовремя прекратить нагревание, т. к. при температурах более 3000С нитрат аммония разлагается со взрывом. При вдыхании N2O сначала наблюдается беспричинная веселость, и поэтому его назвали «веселящий газ», затем пропадает болевая чувствительность, а при вдыхании очень больших объемов начинаются галлюцинации. Закись азота в небольших количествах стали использовать в качестве обезболивающего. Он не оказывает вредного влияния на организм.
Царская водка
Смесь 3-х объемов концентрированной соляной кислоты и 1-го объема концентрированной азотной кислоты называется царской водкой. Она обладает окислительными свойствами ещё более сильными, чем концентрированная азотная кислота. Такая смесь способна растворять платину и «короля металлов» – золото.
HNO3 + 3HCl + Au = AuCl3 + 2h3O + NO
Подведение итога урока
На уроке вы познакомились с темой «Азот». Получили представление об азоте как простом веществе, аммиаке, азотной кислоте и нитратах. Были рассмотрены химические и физические свойства этих веществ, строение их молекул, реакции с другими веществами. Перечислены способы получения этих веществ лабораторным и промышленным путем, их применение в различных отраслях. Рассмотрели свойства и применение закиси азота и царской водки (соединение из трех частей соляной кислоты и одной части азотной).
Получили представление об азоте как простом веществе, аммиаке, азотной кислоте и нитратах. Были рассмотрены химические и физические свойства этих веществ, строение их молекул, реакции с другими веществами. Перечислены способы получения этих веществ лабораторным и промышленным путем, их применение в различных отраслях. Рассмотрели свойства и применение закиси азота и царской водки (соединение из трех частей соляной кислоты и одной части азотной).
источник видео — http://www.youtube.com/watch?t=810&v=sW7rQzXh0O4
http://www.youtube.com/watch?t=88&v=zwr7aGa7FKU
http://www.youtube.com/watch?t=6&v=94rw6X7gMyI
http://www.youtube.com/watch?t=792&v=R8zi1bqYT1Y
http://interneturok.ru/ru/school/chemistry/11-klass — конспект
http://orgchem.ru/chem5/index5.htm
источник презентации — http://ppt4web. ru/khimija/azot.html
ru/khimija/azot.html
http://www.youtube.com/watch?t=75&v=05AYIk-G97M — заставка
Ангидрид азотистой кислоты A N2O B NO C N2O3 D N класс 11 химия CBSE
Ответ
Проверено
200.7k+ просмотров
Подсказка: Рассчитайте заданную степень окисления атомов азота в азотистой кислоте и в оксидах азот. Затем найдите оксид азота, который имеет ту же степень окисления азота, что и азотистая кислота.
Полный ответ:
Вы можете записать химический символ азотистой кислоты как \[{\text{HN}}{{\text{O}}_{\text{2}}}\] .
Пусть X — степень окисления атомов азота в азотистой кислоте. Степени окисления водорода и кислорода равны +1 и -2 соответственно.
В нейтральной молекуле сумма степеней окисления всех элементов равна нулю.
Рассчитайте степень окисления атомов азота в азотной кислоте.
\[
\Rightarrow {\text{1 + X + 2}}\left( { — 2} \right) = 0 \\
\Rightarrow 1 + {\text{X}} — 4 = 0 \\
\Rightarrow {\text{X}} — 3 = 0 \\
\Rightarrow {\text{X}} = + 3
\]
Следовательно, степень окисления атомов азота в азотистой кислоте равна +3.
Пусть X — степень окисления атомов азота в \[{{\text{N}}_{\text{2}}}{\text{O}}\] . Степень окисления кислорода равна -2
. Вычислите степень окисления атомов азота в \[{{\text{N}}_{\text{2}}}{\text{O}}\] .
\[
\Rightarrow {\text{2X + 2}}\left( { — 2} \right) = 0 \\
\Rightarrow 2{\text{X}} — 4 = 0 \\
\Rightarrow { \text{2X}} — 4 = 0 \\
\Стрелка вправо {\text{X}} = + 2
\]
Следовательно, степень окисления атомов азота в \[{{\text{N}}_{\text{2}}}{\text{O}}\] равна +2.
Пусть X — степень окисления атомов азота в \[{\text{NO}}\] . Степень окисления кислорода равна -2
. В нейтральной молекуле сумма степеней окисления всех элементов равна нулю.
Рассчитайте степень окисления атомов азота в \[{\text{NO}}\] .
\[
\Стрелка вправо {\text{X +}}\влево( { — 2} \вправо) = 0 \\
\Стрелка вправо {\text{X}} — 2 = 0 \\
\Rightarrow {\text{X}} = + 2
\]
Следовательно, степень окисления атомов азота в \[{\text{NO}}\] равна +2.
Пусть X будет степенью окисления атома азота в \[{{\text{N}}_{\text{2}}}{{\text{O}}_{\text{3}}}\] . Степень окисления кислорода равна -2
. В нейтральной молекуле сумма степеней окисления всех элементов равна нулю.
Рассчитайте степень окисления атома азота в \[{{\text{N}}_{\text{2}}}{{\text{O}}_{\text{3}}}\] .
\[
\Rightarrow {\text{2X + 3}}\left( { — 2} \right) = 0 \\
\Rightarrow {\text{2X}} — 6 = 0 \\
\Rightarrow {\text{2X}} = + 6 \\
\Rightarrow {\text{X}} = + 3
\]
Следовательно, степень окисления атома азота в \[{{\text{N}}_{\text{2}}}{{\text{O}}_{\text{3}}}\] равна +3.
\[{{\text{N}}_{\text{2}}}{{\text{O}}_{\text{4}}}\]
Пусть X — степень окисления атома азота в \[{{\text{N}}_{\text{2}}}{{\text{O}}_{\text{4}}}\] . Степень окисления кислорода равна -2
. В нейтральной молекуле сумма степеней окисления всех элементов равна нулю.
Рассчитайте степень окисления атома азота в \[{{\text{N}}_{\text{2}}}{{\text{O}}_{\text{4}}}\] .
\[
\Rightarrow {\text{2X + 4}}\left( { — 2} \right) = 0 \\
\Rightarrow {\text{2X}} — 8 = 0 \\
\Rightarrow {\ text{2X}} = + 8 \\
\Rightarrow {\text{X}} = + 4
\]
Следовательно, степень окисления атома азота в \[{{\text{N}}_{\text {2}}}{{\text{O}}_{\text{4}}}\] равно +4.
Степень окисления азота одинакова в азотистой кислоте и в \[{{\text{N}}_{\text{2}}}{{\text{O}}_{\text{3}}} \]
Следовательно, ангидрид азотистой кислоты равен \[{{\text{N}}_{\text{2}}}{{\text{O}}_{\text{3}}}\]
Следовательно, правильным вариантом является вариант C.
Примечание:
Когда одна молекула \[{{\text{N}}_{\text{2}}}{{\text{O}}_{\ text{3}}}\] реагирует с одной молекулой воды, образуя две молекулы азотистой кислоты.
\[{{\text{N}}_{\text{2}}}{{\text{O}}_{\text{3}}} + {\text{ }}{{\text{H }}_2}{\text{O }} \to {\text{ 2 HN}}{{\text{O}}_{\text{2}}}\]
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из нижеперечисленного является истинным пероксидом A rmSrmOrm2 класс 12 по химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом A 11 класс по химии JEE_Main
Фосфин получают из следующей руды A Кальций 12 класса по химии JEE_Main
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из нижеперечисленного является истинным пероксидом A rmSrmOrm2 класс 12 по химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом A 11 класс по химии JEE_Main
Фосфин получают из следующей руды A Кальций 12 класса по химии JEE_Main
Trending doubts
Showing metabocard for Dinitrogen trioxide (HMDB0251419)
IdentificationTaxonomyOntologyPhysical propertiesSpectraBiological propertiesConcentrationsLinksReferencesXML
| Record Information | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Version | 5. 0 0 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Статус | Обнаружено, но не определено количественно | ||||||||||||||||||||||||||||||||||||||||||||||||
| Дата создания | 2021-09-11 08:46:41 UTC | ||||||||||||||||||||||||||||||||||||||||||||||||
| Дата обновления | 2021-09-26 23:03:25 UTC | ||||||||||||||||||||||||||||||||||||||||||||||||
| HMDB ID | |||||||||||||||||||||||||||||||||||||||||||||||||
| HMDB ID | HMDB0123 | ||||||||||||||||||||||||||||||||||||||||||||||||
| HMDB ID | 8 | ||||||||||||||||||||||||||||||||||||||||||||||||
| HMDB | 8 | ||||||||||||||||||||||||||||||||||||||||||||||||
| . None | |||||||||||||||||||||||||||||||||||||||||||||||||
| Metabolite Identification | |||||||||||||||||||||||||||||||||||||||||||||||||
| Common Name | Dinitrogen trioxide | ||||||||||||||||||||||||||||||||||||||||||||||||
| Description | dinitrogen trioxide, also known as O2NNO, belongs to the class of inorganic compounds known as other non-metal oxides. Это неорганические соединения, содержащие атом кислорода со степенью окисления -2, в которых самый тяжелый атом, связанный с кислородом, принадлежит к классу «других неметаллов». Некоторые другие оксиды азота также обладают длинными связями N–N, включая четырехокись азота (175 пм). Показанные ниже размеры взяты из микроволновой спектроскопии низкотемпературного газообразного N2O3: это ангидрид нестабильной азотистой кислоты (HNO2), который образуется при смешивании с водой. Это темно-синее твердое вещество является одним из простых оксидов азота. триоксид диазота является чрезвычайно слабым основным (по существу нейтральным) соединением (исходя из его pKa). Для истинного ангидрида можно было бы ожидать альтернативную структуру, т.е. ON-O-NO, но этот изомер не наблюдается. Как правило, связи N–N по длине аналогичны таковым в гидразине (145 пм). Однако триоксид диазота имеет необычно длинную связь N–N при 186 пм. При более высоких температурах равновесие благоприятствует составляющим газам, при этом Kdiss 193 кПа (25 °С). Если азотную кислоту не израсходовать быстро, она разлагается на окись азота и азотную кислоту. Триоксид азота представляет собой химическое соединение с формулой N2O3. Он образуется при смешивании равных частей оксида азота и диоксида азота и охлаждении смеси ниже -21 °C (-6 °F): NO + NO2 ⇌ N2O3 Триоксид азота выделяется только при низких температурах, т. е. в жидкой и твердой фазах. Это соединение было идентифицировано в крови человека, как сообщается (PMID: 31557052). Это темно-синее твердое вещество является одним из простых оксидов азота. триоксид диазота является чрезвычайно слабым основным (по существу нейтральным) соединением (исходя из его pKa). Для истинного ангидрида можно было бы ожидать альтернативную структуру, т.е. ON-O-NO, но этот изомер не наблюдается. Как правило, связи N–N по длине аналогичны таковым в гидразине (145 пм). Однако триоксид диазота имеет необычно длинную связь N–N при 186 пм. При более высоких температурах равновесие благоприятствует составляющим газам, при этом Kdiss 193 кПа (25 °С). Если азотную кислоту не израсходовать быстро, она разлагается на окись азота и азотную кислоту. Триоксид азота представляет собой химическое соединение с формулой N2O3. Он образуется при смешивании равных частей оксида азота и диоксида азота и охлаждении смеси ниже -21 °C (-6 °F): NO + NO2 ⇌ N2O3 Триоксид азота выделяется только при низких температурах, т. е. в жидкой и твердой фазах. Это соединение было идентифицировано в крови человека, как сообщается (PMID: 31557052). | ||||||||||||||||||||||||||||||||||||||||||||||||
| Structure | |||||||||||||||||||||||||||||||||||||||||||||||||
| Synonyms |
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Химическая формула | N 2 O 3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Average Molecular Weight | 76. 011 011 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Monoisotopic Molecular Weight | 75.9 | ||||||||||||||||||||||||||||||||||||||||||||||||
| IUPAC Name | (nitronitroso)amine | ||||||||||||||||||||||||||||||||||||||||||||||||
| Traditional Name | dinitrogen trioxide | ||||||||||||||||||||||||||||||||||||||||||||||||
| Регистрационный номер CAS | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| SMILES | O=NN(=O)=O | ||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификатор InChI | InChI=1S/N2O3/c3-1-2(4)5 | ||||||||||||||||||||||||||||||||||||||||||||||||
| InChI Key | LZDSILRDTDCIQT-UHFFFAOYSA-N | ||||||||||||||||||||||||||||||||||||||||||||||||
| Chemical Taxonomy | |||||||||||||||||||||||||||||||||||||||||||||||||
| Description | Belongs to the class of неорганические соединения, известные как оксиды других неметаллов. Это неорганические соединения, содержащие атом кислорода со степенью окисления -2, в которых самый тяжелый атом, связанный с кислородом, принадлежит к классу «других неметаллов». | ||||||||||||||||||||||||||||||||||||||||||||||||
| Kingdom | Inorganic compounds | ||||||||||||||||||||||||||||||||||||||||||||||||
| Super Class | Homogeneous non-metal compounds | ||||||||||||||||||||||||||||||||||||||||||||||||
| Class | Other non-metal organides | ||||||||||||||||||||||||||||||||||||||||||||||||
| Sub Class | Other non-metal oxides | ||||||||||||||||||||||||||||||||||||||||||||||||
| Direct Parent | Прочие оксиды неметаллов | ||||||||||||||||||||||||||||||||||||||||||||||||
| Альтернативные исходные вещества |
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Заместители |
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Molecular Framework | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||
| External Descriptors |
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Ontology | |||||||||||||||||||||||||||||||||||||||||||||||||
| Not Available | |||||||||||||||||||||||||||||||||||||||||||||||||
| Physical Properties | |||||||||||||||||||||||||||||||||||||||||||||||||
| Состояние | Нет в наличии | ||||||||||||||||||||||||||||||||||||||||||||||||
| Экспериментальные молекулярные свойства |
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Experimental Chromatographic Properties | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||
| Predicted Molecular Properties |
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Predicted Chromatographic Properties |
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Spectra | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Биологические свойства | |||||||||||||||||||||||||||||||||||||||||||||||||
| Клеточные местоположения | . | ||||||||||||||||||||||||||||||||||||||||||||||||
| 9 | 9 | .0104 | |||||||||||||||||||||||||||||||||||||||||||||||
| Tissue Locations | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pathways |
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Normal Concentrations | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Abnormal Concentrations | |||||||||||||||||||||||||||||||||||||||||||||||||
| Not Available | |||||||||||||||||||||||||||||||||||||||||||||||||
| Associated Disorders and Diseases | |||||||||||||||||||||||||||||||||||||||||||||||||
| Ссылки на болезни | Нет | ||||||||||||||||||||||||||||||||||||||||||||||||
| Связанные идентификаторы OMIM | Нет | ||||||||||||||||||||||||||||||||||||||||||||||||
| External Links | |||||||||||||||||||||||||||||||||||||||||||||||||
| DrugBank ID | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||
| Phenol Explorer Compound ID | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||
| FooDB ID | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||
| KNApSAcK ID | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||
| Chemspider ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| KEGG Compound ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| BioCyc ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| BiGG ID | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||
| Wikipedia Link | Dinitrogen trioxide | ||||||||||||||||||||||||||||||||||||||||||||||||
| METLIN ID | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem Compound | 61526 | ||||||||||||||||||||||||||||||||||||||||||||||||
| PDB ID | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||
| CheBI ID | 29799 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Food Biomarker Ontology | Нет в наличии | ||||||||||||||||||||||||||||||||||||||||||||||||
| VMH ID | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||
| MarkerDB ID | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||
| Good Scents ID | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||
| References | |||||||||||||||||||||||||||||||||||||||||||||||||
| Synthesis Reference | Not Available | ||||||||||||||||||||||||||||||||||||||||||||||||
| Material Safety Data Sheet (MSDS) | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| Общие ссылки |
| ||||||||||||||||||||||||||||||||||||||||||||||||
[PDF] Номера окисления — Скачать PDF бесплатно
Правило чисел окисления: числа окисления включают искусственные средства подсчета, в которых общие электроны подсчитываются с атомом с более высокой электроотрицательностью. Сумма степеней окисления всех атомов в частице должна равняться заряду частицы.
Метод A: 1. Нарисуйте точечную структуру Льюиса. 2. Используя таблицу электроотрицательностей, подсчитайте общие электроны с атомом с более высокой электроотрицательностью. Таблица электроотрицательностей 3. Запишите степени окисления.
Метод Б: 1. По электроотрицательности определить, какой атом положительный, а какой отрицательный. Таблица электроотрицательностей 2. По группам определите наиболее вероятные степени окисления.
По группам определите наиболее вероятные степени окисления.
group
1
2
3
4
5
6
7
8
lose electrons
+1
+2
+3
+4
+ 5
+6
+7
0
Усиление электронов
NA
NA
NA
-4
-3
-2
-1
0
Вышеуказанная таблица дает наиболее вероятные номера окисления, но количество окисления. в любом месте диапазона. Например, наиболее вероятные степени окисления азота -3 или +5, но также могут быть -2, -1, 0, +1, +2, +3 или +4.
Пример: h3O: Из электроотрицательности H должен быть положительным и, таким образом, может быть только +1; O должен быть отрицательным и, скорее всего, равен -2. Степени окисления (+1+1-2=0) составляют заряд. 3. Влияют ли степени окисления на заряд? Если да, все готово (как в случае с h3O выше). Если нет, как в случае с N2O3 ниже, перейдите к шагу 4. Пример: N2O3 a. N представляет собой +, O представляет собой b. N, скорее всего, +5, O, скорее всего, будет -2 c. Степени окисления в сумме составляют 2 (+5) + 3 (-2) = +4. Но молекула нейтральна. 4. Одна из степеней окисления атома будет наиболее вероятной, другая будет находиться в допустимых пределах. Если N равно +5, то O должно быть -31/3, чтобы сумма равнялась 0. Но O не может быть -31/3, потому что оно не находится в диапазоне от -2 до +6. С другой стороны, если O равно -2, то N должно быть равно +3, что находится в пределах допустимого диапазона. Таким образом, эти (0 = -2, N = +3) верны. 5. Вы можете увидеть эти степени окисления в LDS N2O3. Каждый O получил 2 e-. Каждый N потерял 3e-, оставив только два электрона из первоначальных пяти.
Пример: N2O3 a. N представляет собой +, O представляет собой b. N, скорее всего, +5, O, скорее всего, будет -2 c. Степени окисления в сумме составляют 2 (+5) + 3 (-2) = +4. Но молекула нейтральна. 4. Одна из степеней окисления атома будет наиболее вероятной, другая будет находиться в допустимых пределах. Если N равно +5, то O должно быть -31/3, чтобы сумма равнялась 0. Но O не может быть -31/3, потому что оно не находится в диапазоне от -2 до +6. С другой стороны, если O равно -2, то N должно быть равно +3, что находится в пределах допустимого диапазона. Таким образом, эти (0 = -2, N = +3) верны. 5. Вы можете увидеть эти степени окисления в LDS N2O3. Каждый O получил 2 e-. Каждый N потерял 3e-, оставив только два электрона из первоначальных пяти.
.
Некоторые полезные советы · Если присутствует элемент группы «В», атомы группы «А», как правило, будут иметь свои наиболее вероятные степени окисления. Электроны во внешних оболочках атомов группы «В» не так далеко друг от друга по энергии.
· Отдельные атомы или атомы в гомоядерных молекулах имеют степень окисления 0. Вы понимаете, почему? Вам следует.
· В молекуле с несколькими атомами начните с атомов с наибольшей и наименьшей электроотрицательностью.
· Степени окисления могут использоваться для определения наиболее вероятных формул бинарных соединений, поскольку известны наиболее вероятные степени окисления, и их сумма должна равняться нулю. Присвоение степени окисления Определение степени окисления (или степени окисления) химических соединений можно выполнить, следуя нескольким простым правилам.
1. Сумма степеней окисления атома или атомов в нейтральной молекуле должна равняться нулю.
2. Если атом или молекула являются ионными, их степень окисления должна равняться их общему заряду. 3. Атомы щелочных металлов (группа I) имеют в соединениях степень окисления, равную +1. 4. 5. 6.
7.
Атомы щелочноземельных металлов (Группа II) внутри соединений имеют степень окисления +2. Фтор всегда имеет степень окисления -1 в соединениях. Все галогены (кроме фтора) в соединениях имеют степень окисления -1, за исключением случаев с кислородом или другими галогенами, где их степени окисления могут быть положительными. Водороду всегда присваивается степень окисления +1 в соединениях, за исключением гидридов металлов (например, LiH), где применяются предыдущие правила. В случае LiH литию присваивается заряд +2 (правило C), оставляя водород для нейтрализации соединения с зарядом -2. Кислороду присваивается степень окисления -2 в соединениях, за двумя исключениями… 1
Фтор всегда имеет степень окисления -1 в соединениях. Все галогены (кроме фтора) в соединениях имеют степень окисления -1, за исключением случаев с кислородом или другими галогенами, где их степени окисления могут быть положительными. Водороду всегда присваивается степень окисления +1 в соединениях, за исключением гидридов металлов (например, LiH), где применяются предыдущие правила. В случае LiH литию присваивается заряд +2 (правило C), оставляя водород для нейтрализации соединения с зарядом -2. Кислороду присваивается степень окисления -2 в соединениях, за двумя исключениями… 1
Степень окисления фтора всегда имеет приоритет.
2
Кислород-кислород Связи с кислородом следуют предыдущим правилам, что означает, что сначала выполняются другие назначения, оставляя кислород для нейтрализации заряда.
2(a) Кислород имеет степень окисления -1 в перекисных соединениях Примеры: (Синие цвета обозначают положительную степень окисления, красные цвета — отрицательную степень окисления, относящуюся к атомам под ними. ) +1 — 2
) +1 — 2
+1 -1
+1 -1
+1 -½
0
+6 -2
N2O
LIH
H3O2
KO2
O2
SO42-
СПОСКОЛЬНЫЙ НОМЕР. следующие молекулы и используйте таблицу электроотрицательностей для определения степеней окисления. Ch5, Nh4, Ch4Ch3Ch4,
Ch4CHClCBr2F
2. Используя периодическую таблицу и не рисуя точечные структуры Льюиса, определите степени окисления атомов в: Ch5, CO2, N2O5, Li4C, SO3, Na2O, Cl- 1 , ПО4-3
3. Определите эти степени окисления, не рисуя точечные структуры Льюиса. N2O3 , NO , P2O4 , NO2 , Nh5+1, NO3-1 , OF2 , h3O2 , Na2O2
4. Определите эти степени окисления (см. Некоторые полезные советы) N , N2 ,
N-3 ,
Be+2 ,
F2 ,
Mg
5. Определите степени окисления этих многоатомных молекул. KNO3, Nh5NO3, h3CO3, K3PO4, Al(NO3)3, (Nh5) 2SO4
6. Определить степени окисления (см. Некоторые полезные советы) K2Cr2O7 , KMnO4 , Fe2O3 , FeO , UO2F2 , VO , MnO2
7. Определите степени окисления: B, N-3, K2O, Ch4Ch3Ch4, CO3-2, KClO4, MnO4-1, Al2(SO4)3, F2
Определите степени окисления: B, N-3, K2O, Ch4Ch3Ch4, CO3-2, KClO4, MnO4-1, Al2(SO4)3, F2
Числа окисления Рабочий лист-2 1. Используйте степени окисления для определения заряд на следующих радикалах. (Обратите внимание, что это работает только с наиболее стабильными радикалами, например, NO3-1, а не NO2-1.) SO4, CO3, HCO3, PO4, Nh5, ClO4, NO3, OH 2. Используйте степени окисления, чтобы определить наиболее вероятную формулу молекулы. состоит из: Al и N, Al и Se, N и O, S и O, C и Se 3. Используйте степени окисления, чтобы определить наиболее вероятный заряд радикала, а затем формулу молекулы: Mg и радикала CO3, Радикал Al и CO3, радикал Nh5 и радикал SO4 4. Используйте степени окисления, чтобы определить формулы продуктов, затем сбалансируйте уравнения. h3 + O2 N2 + h3 HCl + KOH NaOH + h3SO4 Nh5OH + h4PO4 P2 + O2 Al(OH)3 + h3CO3 Mg + O2
Уравновешивание окислительно-восстановительных уравнений методом полуреакции
Что такое окислительно-восстановительная реакция? реакция переноса одного или нескольких электронов Что такое полуреакция? две части окислительно-восстановительной реакции, одна представляет собой окисление, а другая восстановление
Этапы решения
1. Разделите реакцию на две полуреакции. Сбалансируйте все атомы, кроме H и O. Сбалансируйте O, добавив h3O. Сбалансируйте H, добавив H+. Уравновешивайте заряды, добавляя электроны к наиболее положительной стороне. Сбалансируйте другую половину, используя шаги 2-5. Баланс приобретённых и потерянных электронов. Сложите две половины вместе и отмените.
Разделите реакцию на две полуреакции. Сбалансируйте все атомы, кроме H и O. Сбалансируйте O, добавив h3O. Сбалансируйте H, добавив H+. Уравновешивайте заряды, добавляя электроны к наиболее положительной стороне. Сбалансируйте другую половину, используя шаги 2-5. Баланс приобретённых и потерянных электронов. Сложите две половины вместе и отмените.
Пример решения методом полуреакции Cr2O7-2 +Cl-1 Cr+3 + Cl2 1. Разделить Rxn на две полуреакции Cr2O7-2 Cr+3 Cl-1 Cl2 2. Уравновесить все не-H и атомы O
Cr2O7-2 2Cr+3 2Cl-1 Cl2 3. Уравновесить O добавлением воды Cr2O7-2 2Cr+3 +7h3O 4. Уравновесить H добавлением H+ 14H+ + Cr2O7-2 2Cr+3 + 7h3O 5. Уравновесить заряд, добавив электроны к более положительной стороне 6e- + 14H+ + Cr2O7-2 2Cr+3 +7h3O 2Cl-1 Cl2 + 2e6. Сбалансируйте другую сторону, применяя правила 2-5. Мы практиковали оба одновременно. 7. Сложите обе половины и сократите 6e- + 14H+ + Cr2O7-2 2Cr+3 +7h3O 3.(2Cl-1 Cl2 + 2e-) = 6Cl-1 3Cl2 + 6e6e- + 14H+ + Cr2O7-2 + 6Cl-1 2Cr+3+7h3O+3Cl2 +6e14H+ + Cr2O7-2 +6Cl-1 2Cr+3 +7h3O +3Cl2
Шаг Разделить пополам реакции. 1: Этап В каждой половине реакции сбалансируйте все элементы, кроме O и H.
1: Этап В каждой половине реакции сбалансируйте все элементы, кроме O и H.
2: Этап 3: Этап 4: Этап 5: Этап 6: Этап 7: Этап 8:
Уравновесьте O, добавив воду. Сбалансируйте H, добавив H+. Сбалансируйте расходы, добавив e-. Умножьте все коэффициенты в 1 или обеих полуреакциях на целое число, чтобы количество e- в двух полуреакциях было равным. Сложите 2 полуреакции вместе и отмените любые виды, которые появляются по обе стороны от чистой реакции. Убедитесь, что заряды и атомы уравновешены.
http://www.wfu.edu/~ylwong/redox/balance-redox-rxn/tutorial/acid/balance-redox-rxnacid-tut.html Сбалансируйте каждую полуреакцию, причем реакция проводится в кислом растворе. 1) Re —> ReO2 2) Cl2 —> HClO 3) NO3¯ —> HNO2 4) h3GeO3 —> Ge 5) h3SeO3 —> SeO42¯ 6) Au —> Au (OH)3 (это немного странно!) 7) h4AsO4 —> Ash4 8) h3MoO4 —> Mo 9) NO —> NO3¯
I. Сбалансируйте уравнение как в кислоте раствор
Стадия Разделить пополам реакции. 1: Шаг В каждой половине реакции сбалансируйте все элементы, кроме O и H. 2: Шаг Сбалансируйте O, добавив h3O. 3: Сбалансируйте H, добавив H+. 4: Шаг баланса взимается путем добавления e-. 5: Шаг Умножьте все коэффициенты в 1 или обеих половинных реакциях на целое число, чтобы количество e- в двух половинных реакциях было равным. 6: Шаг. Сложите 2 полуреакции вместе и исключите все виды, которые появляются по обе стороны от чистой реакции. 7: II. Сбалансируйте уравнение с основанием Шаг Определите количество протонов (H+) в кислотном ответе. Добавьте одинаковое количество ионов ОН- к ОБЕИМ частям уравнения. 8: Шаг Если H+ и OH- появляются на одной стороне уравнения, они будут реагировать в соотношении 1:1 с образованием h3O. 9: Шаг Отмените молекулы воды, которые появляются с обеих сторон уравнения. 10: Шаг Убедитесь, что заряды и атомы уравновешены. 11: http://www.wfu.edu/~ylwong/redox/balance-redox-rxn/tutorial/base/balance-redox-rxnbase-tut.html Сбалансируйте каждую полуреакцию, причем реакция проходит в основном растворе. 1) NiO2 —> Ni(OH)2 2) BrO4¯ —> Br¯ 3) SbO3¯ —> SbO2¯ 4) Cu2O —> Cu 5) S2O32¯ —> SO32¯ 6) Tl+ —> Tl2O3
2: Шаг Сбалансируйте O, добавив h3O. 3: Сбалансируйте H, добавив H+. 4: Шаг баланса взимается путем добавления e-. 5: Шаг Умножьте все коэффициенты в 1 или обеих половинных реакциях на целое число, чтобы количество e- в двух половинных реакциях было равным. 6: Шаг. Сложите 2 полуреакции вместе и исключите все виды, которые появляются по обе стороны от чистой реакции. 7: II. Сбалансируйте уравнение с основанием Шаг Определите количество протонов (H+) в кислотном ответе. Добавьте одинаковое количество ионов ОН- к ОБЕИМ частям уравнения. 8: Шаг Если H+ и OH- появляются на одной стороне уравнения, они будут реагировать в соотношении 1:1 с образованием h3O. 9: Шаг Отмените молекулы воды, которые появляются с обеих сторон уравнения. 10: Шаг Убедитесь, что заряды и атомы уравновешены. 11: http://www.wfu.edu/~ylwong/redox/balance-redox-rxn/tutorial/base/balance-redox-rxnbase-tut.html Сбалансируйте каждую полуреакцию, причем реакция проходит в основном растворе. 1) NiO2 —> Ni(OH)2 2) BrO4¯ —> Br¯ 3) SbO3¯ —> SbO2¯ 4) Cu2O —> Cu 5) S2O32¯ —> SO32¯ 6) Tl+ —> Tl2O3
7) Al —> AlO2¯ 8) Sn —> HSnO2¯ 9) CrO42¯ —> Cr(OH)3
PRACTICE—1
Mg + HCl MgCl2 + h3
2
Fe + V2O3 Fe2O3 + VO
3
KMnO4 + KNO2 + h3SO4 MnSO4 + h3O + KNO3 + K2SO4
4
K2CR2O7 + SNCL2 + HCL ϩ CRCL3 + SNCL4 + KCL + H3O
5
KMNO4 + NACL + H3SO4 ϩ CL2 + K2SO4 + MNSO4 + H3O + NA2SO4
6
K2SC2 + H3O + SO2SO4
70003K2CR2O7 + H3OSO4
70003K2SC2 + H3O + H3O + H3O4SO4
6K2SO7 + H3O + H3O + H3O4SO4
6K2SO
7
KClO3 + C12h32O11 → KCl + h3O + CO2
8
H3C2O4 + K2MNO4 ϩ CO2 + K2O + MN2O3 + H3O
9
MN (NO3) 2 + NABIO3 + HNO3 ϩ HMNO4 + BI (NO3) 3 + NANO3 + H3O
10
H3C2O4 + KM2O4 + KM2O4 + KM2O4 + KM2O4 + KM2O4 + KM2O4 + KM2O4 + KM2 + H3O
10 0002
H3O4 + KM2 + H3O
10 0003
H3O4 + KM2 + H3O
10 0003
H3O4 + KM2 + H3O
10
H (NO3). + Mn2O3 + h3O
+ Mn2O3 + h3O
1. 2. 3. 4. 5. 6. 7.
Fe+2 + MnO4-1 Fe+3 + Mn+2 MnO4-1 +SO3-2 SO4-2 + Mn +2 Ce+4 + Sn+2 Ce+3 + Sn+4 BrO3-1 + Br-1 Br2 Cr2O7-2 + I-1 I2 + Cr+3 Ce+4 + h4AsO3 Ce+3 +h4AsO4 Ce+4 + Fe+2 Ce+3 + Fe+3
8. Ce+3 + I-1 Ce+3 + I2 Практика — Оба — (Запишите на бумаге)
http://www.wfu.edu/~ylwong/redox/balance-redox-rxn/practice/index.html
Оксиды азота — химия, класс 12, элементы p-блока
Вы здесь: Главная / Класс 12 / Химия / Элементы p-блока / Оксиды азота
Опубликовано на от MRS Shilpi Nagpal
Оксиды азота-элементы P-блока-класс 12
Содержание
- 1 Оксиды азота
- 331 (1) nitroly).
- 1.2 (2) Nitric Oxide (NO)
- 2 Dinitrogen Trioxide (N2O3)
- 2.1 Properties of Dinitrogen Trioxide
- 3 Dinitrogen Pentoxide (N2O5)
Азот соединяется с кислородом при различных условиях с образованием ряда бинарных оксидов, различающихся степенью окисления атома азота. Они варьируются от N 2 O (степень окисления N +1) через NO (+2), N 2 O 3 (+3), N 2 O 4 (+4) до N 2 O 5 (5). Склонность к образованию кратных связей pπ-pπ диктует структуру оксидов.
Они варьируются от N 2 O (степень окисления N +1) через NO (+2), N 2 O 3 (+3), N 2 O 4 (+4) до N 2 O 5 (5). Склонность к образованию кратных связей pπ-pπ диктует структуру оксидов.
(a) Получают нагреванием нитрата аммония.
NH 4 NO 3 —–> N 2 O + 2H 2 0
(b) Это бесцветный нереакционноспособный газ со слабым приятным запахом. Он также известен как веселящий газ , потому что вызывает истерический смех при вдыхании в незначительных количествах.
(c) Это нейтральный оксид, который реагирует с амидом натрия с образованием азида натрия.
N 2 O + 2NANH 2 — -> NAN 3 + NH 3 + NAOH
Содиной аусид. для мелких операций.
(e) Разлагается на азот и кислород при 873 K. .
.
(2) Оксид азота (NO)
(a) Получают каталитическим окислением аммиака при 1100 К в присутствии платины.
4NH 3 + 5O 2 ——->4NO + 6H 2 O
(b) Он также может быть получен реакцией азотной кислоты на медь как:
(c) Его также можно получить восстановлением нитрита натрия сульфатом железа в присутствии серной кислоты.
2NaNO 2 +2FeSO 4 +3H 2 SO 4 ——-> Fe 2 (SO 4 ) 3 + 2NaHSO 4 + 2H 2 O + 2NO
(d) Нейтральный оксид
(e) Бесцветный газ. У него нечетное число электронов (11 валентных электронов), поэтому в газообразном состоянии он является парамагнетиком . Однако в жидком и твердом состояниях он образует рыхлый димер таким образом, что магнитные эффекты двух неспаренных электронов компенсируются. Молекула диамагнитна.
Молекула диамагнитна.
(f) Оксид азота легко реагирует с кислородом с образованием коричневых паров диоксида азота.
2NO (г) + O 2 (г) ——–> 2NO 2 (г)
(ж) Оксид азота легко образует комплексы с переходными металлами.
Например: Fe 2+ соединяется с NO с образованием комплекса [Fe(H 2 O) 5 NO] 2+ , который отвечает за тест по коричневому кольцу на нитраты.
(з) Термодинамически неустойчив и разлагается на элементы при высоких температурах (1373 К 1473 К)
Триоксид динитрогена (N 2 O 3 )
(1). Он готовясь к охлаждению эквимолярных количеств азового оксида и нитриогена. + NO2(г) ⇔ N 2 O 3
(2) It can also be prepared by reacting nitric oxide and dinitrogen tetraoxide at 250 K.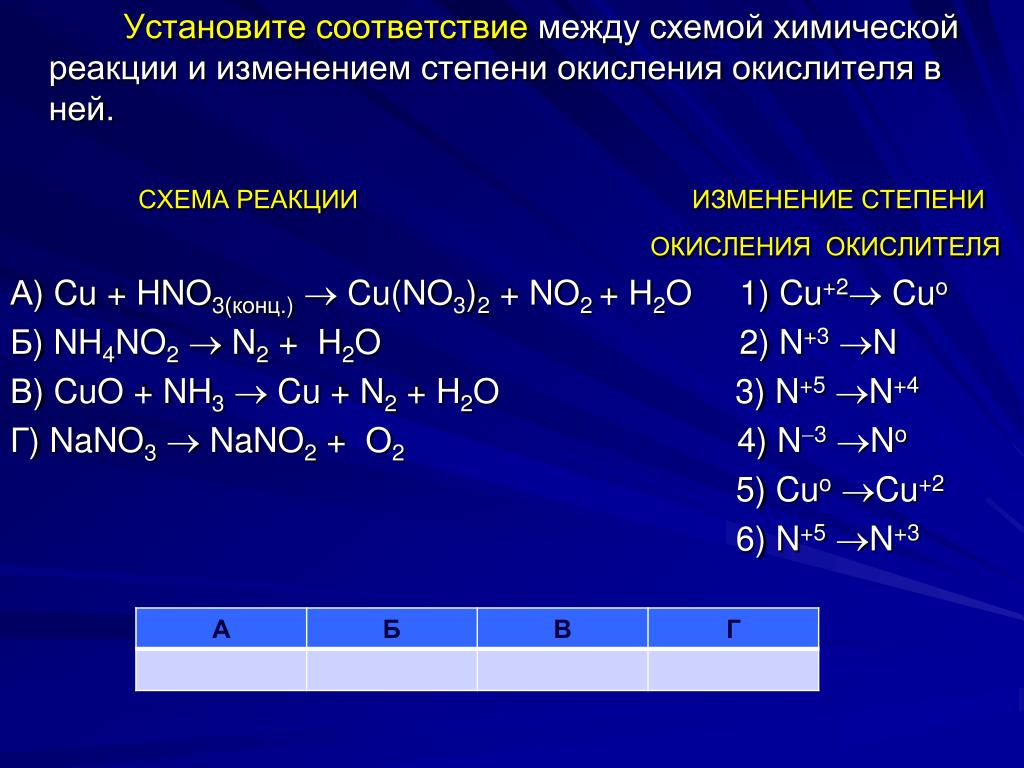
2NO + N 2 O 4 ——> 2N 2 O 3
Properties of Триоксид диазота
(1) Это твердое вещество голубого цвета, имеющее кислую природу. Это ангидрид азотистой кислоты (HNO 2 ).
N 2 O 3 + H 2 O —> 2HNO 2
(2) Существует в чистом виде только в твердом состоянии при очень низких температурах. Выше температуры плавления (273 K) диссоциирует на NO и NO 2 .
N 2 O 3 —> NO + NO 2
Диоксид азота (№ 2 )
. Он приготовлена нагреванием.
2PB (№ 3 ) 2 —> 2PBO + 4NO 2 + O 2
Это также нечетная электронная молекуля и в газовой фазе, IT Exibliv in Exibliv in Exibliv in Exiblium in Exiblium in Exiblium in Exiblium in Exiblium in Exiblium in Exiblium in Exiblium in Exibliv in Exibliv in Exibliv in Exibliv in Exibliv in exible exible exible exible exitib Н 2 О 4 AS:
N 2 O 4 ⇔ 2 NO 2
Выше 415 K он содержит в основном № 2 и на 250 K, он содержит основной N 2 2 и на 250 K, он содержит основной N 2 2 21. 4
4
2 NO 2 ⇔ N 2 O 4
Dinitrogen Pentoxide (N 2 O 5 )
(1) It получают обезвоживанием концентрированной азотной кислоты пятиокисью фосфора.
4HNO 3 + P 4 O 10 —–> 2N 2 O 5 + HPO 3
(2) N 2 O 5 exists as бесцветное твердое вещество ниже 273К. При повышении температуры цвет меняется на желтый из-за частичного разложения бесцветного N 2 O 5 до коричневого NO 2 .
2 Н 2 О 5 ——–> 4НО 2 + О 2
(3) При 303 К кристаллы плавятся с образованием желтой жидкости, которая при 313 К разлагается с образованием NO 2 .
(4) N 2 O 5 действует в качестве сильного окисляющего агента и окисляет йод до I 2 O 5
NO и 2 . кислотные и нитратные удобрения Жидкость N 2 O 4 также используется в качестве окислителя для ракетного топлива в ракетах и космических аппаратах.
(5) NO вызывает проблемы загрязнения атмосферы из-за своей ядовитой природы. Его пары выбрасываются в атмосферу при сжигании нефти и угля.
Рубрика: Химия, класс 12, Элементы p-блока
О г-же Шилпи Нагпал
Г-жа Шилпи Нагпал является аспирантом по химии и опытным преподавателем, который обучает студентов с 2007 года. Она специализируется на репетиторстве по естественным наукам для учащихся 6-12 классов. Миссис Нагпал имеет подтвержденный послужной список успеха, и ее ученики постоянно получают более высокие оценки и улучшают результаты тестов. Она четко формулирует свои мысли, хорошо осведомлена, и ее страсть к преподаванию проявляется в ее работе со студентами.
Взаимодействие с читателем
Исследования комплексов железа(ii) и железа(iii) с донорными лигандами fac-N2O, цис-N2O2 и N2O3: модели 2-His 1-карбоксилатного мотива негемовых монооксигеназ железа
Исследования комплексов железа(ii) и железа(iii) с
fac -N 2 O, цис -N 2 O 2 и N 2 O 3 : модели лигандов 2-His 1-карбоксилатный мотив монооксигеназ негемового железа† Патрик Дж.
Каппилино, и Джон Р.
Мечниковский, б Лори А.
Тайлер, c Пол С.
Тарвес, и Джошуа С.
МакНалли, и 906:00
Уэйн
Ло, д Бала Сундари Т.
Касибхатла, и Мэтью Д. Крзяняк, и Джон
Маккракен, и Фэн
Ван, и Уильям Х.
Армстронг д а также
Джон П.
Карадонна* и
Крзяняк, и Джон
Маккракен, и Фэн
Ван, и Уильям Х.
Армстронг д а также
Джон П.
Карадонна* и
Принадлежности автора
* Соответствующие авторы
и Кафедра химии, Бостонский университет, Бостон, Массачусетс 02215, США
Электронная почта: caradonn@bu. edu
edu
Тел.: +(617) 353-1692
б Факультет химии, Университет Фэрфилда, Фэрфилд, Коннектикут 06824, США
в Кафедра химии, Юнион-колледж, Скенектади, штат Нью-Йорк, 12308, США
д Кафедра химии, Бостонский колледж, Честнат-Хилл, Массачусетс, 02467, США
и Химический факультет Мичиганского государственного университета, Ист-Лансинг, Мичиган, 48824, США
Аннотация
rsc.org/schema/rscart38″> г. Ферменты класса активирующих кислород мононуклеарных негемовых железооксигеназ (MNO) содержат высококонсервативный центр железа, фасциально лигированный двумя атомами гистидинового азота и одним карбоксилатным атомом кислорода, которые оставляют одну сторону металлического центра (три сайта связывания) открытой для координация с кофактором, субстратом и/или дикислородом. Сравнительное семейство [Fe II/III (N 2 O n )(L) 4− n 0 n1791 )] ± x , n = 1–3, L = растворитель или Cl Ядро N , O , которое затем модифицируют, чтобы оно содержало одно или два дополнительных карбоксилатных хелатных плеча, было структурно и спектроскопически охарактеризовано. Исследования ЭПР показывают, что высокоспиновые d 5 Fe III g = 4. 3 signal becomes more symmetrical as the number of carboxylate ligands decreases across the series Fe(N 2 O 3 ), Fe(N 2 O 2 ) и Fe(N 2 O 1 ), что отражает увеличение напряжения E / D этих комплексов по мере увеличения числа координационных центров растворителя, параллельно расширенному распределению электронных структур, которые вносят вклад в форму спектральной линии. Наблюдаемые систематические вариации Fe II –Fe III окислительно-восстановительные потенциалы иллюстрируют фундаментальное влияние дифференциального карбоксилатного лигирования. The trend towards lower reduction potential for the iron center across the [Fe III (N 2 O 1 )Cl 3 ] − , [Fe III (N 2 O 2 )Cl 2 ] — и [FE III (N 2 O 3 O 3 ).
3 signal becomes more symmetrical as the number of carboxylate ligands decreases across the series Fe(N 2 O 3 ), Fe(N 2 O 2 ) и Fe(N 2 O 1 ), что отражает увеличение напряжения E / D этих комплексов по мере увеличения числа координационных центров растворителя, параллельно расширенному распределению электронных структур, которые вносят вклад в форму спектральной линии. Наблюдаемые систематические вариации Fe II –Fe III окислительно-восстановительные потенциалы иллюстрируют фундаментальное влияние дифференциального карбоксилатного лигирования. The trend towards lower reduction potential for the iron center across the [Fe III (N 2 O 1 )Cl 3 ] − , [Fe III (N 2 O 2 )Cl 2 ] — и [FE III (N 2 O 3 O 3 ). более сильно отдающие анионные O-донорные карбоксилатные лиганды, которые, как ожидается, стабилизируют окисленное состояние трехвалентного железа. Эта электрохимическая тенденция параллельна наблюдаемой чувствительности к кислороду трех комплексов железа (Fe II (N 2 O 1 ) < Fe II (N 2 O 2 ) < Fe II (N 2 O 3 )), которые образуют соединения трехвалентного железа с μ-оксомостиком при воздействии молекул воздуха или донора атомов кислорода (OAD). Наблюдаемая чувствительность к кислороду особенно интересна и обсуждается в контексте α-кетоглутарат-зависимых ферментных механизмов MNO.
более сильно отдающие анионные O-донорные карбоксилатные лиганды, которые, как ожидается, стабилизируют окисленное состояние трехвалентного железа. Эта электрохимическая тенденция параллельна наблюдаемой чувствительности к кислороду трех комплексов железа (Fe II (N 2 O 1 ) < Fe II (N 2 O 2 ) < Fe II (N 2 O 3 )), которые образуют соединения трехвалентного железа с μ-оксомостиком при воздействии молекул воздуха или донора атомов кислорода (OAD). Наблюдаемая чувствительность к кислороду особенно интересна и обсуждается в контексте α-кетоглутарат-зависимых ферментных механизмов MNO.Химия азота и фосфора
Химия Азот и фосфор
| Химия азота | Синтез Аммиак | Синтез Азотная кислота |
| Промежуточный уровень Номера окисления | Отрицательное окисление Числа азота кроме -3 | Положительное окисление Цифры для азота: галогениды азота 90 128 |
| Положительный Числа окисления азота: оксиды азота | Химия Фосфор | Эффект Различия в силе одинарной и тройной связи |
| Эффект Различия в силе двойных связей P=X и N=X | Эффект Различия в электроотрицательности фосфора и Азот | Эффект Различия в способностях фосфора и азота расширить их валентную оболочку |
Химия азота
В химии азота преобладает легкость, с которой
атомы азота образуют двойные и тройные связи. Нейтральный азот
атом содержит пять валентных электронов: 2 s 2 2 p 3 .
Таким образом, атом азота может достичь октета валентности.
электроны, разделяя три пары электронов с другим
атом азота.
Нейтральный азот
атом содержит пять валентных электронов: 2 s 2 2 p 3 .
Таким образом, атом азота может достичь октета валентности.
электроны, разделяя три пары электронов с другим
атом азота.
Поскольку ковалентный радиус атома азота относительно маленькие (всего 0,070 нм), атомы азота достаточно близко подходят друг к другу образовывать очень прочные связи. Энтальпия диссоциации связи для тройная связь азот-азот равна 946 кДж/моль, почти вдвое больше больше, чем у двойной связи O=O.
Прочность тройной связи азот-азот делает N 2 молекула очень нереакционноспособна. N 2 настолько инертен, что литий является одним из немногих элементов, с которыми он реагирует в помещении температура.
| 6 Ли( с ) | + | Н 2 ( г ) | 2 Ли 3 Н( с ) |
Несмотря на то, что молекула N 2 нереакционноспособные соединения, содержащие азот, существуют практически
все элементы периодической таблицы, кроме элементов группы VIIIA
(Хе, Не, Ар и так далее). Это можно объяснить двумя способами.
Во-первых, N 2 становится значительно более реактивным по мере
температура повышается. При высоких температурах азот реагирует с
водорода с образованием аммиака и с кислородом с образованием оксида азота.
Это можно объяснить двумя способами.
Во-первых, N 2 становится значительно более реактивным по мере
температура повышается. При высоких температурах азот реагирует с
водорода с образованием аммиака и с кислородом с образованием оксида азота.
| Н 2 ( г ) | + | 3 H 2 ( г ) | 2 NH 3 ( г ) | |
| Н 2 ( г ) | + | О 2 ( г ) | 2 НЕТ( г ) |
Во-вторых, ряд природных катализаторов преодолевают инертность N 2 при низкой температуре.
Синтез Аммиак
Трудно представить себе живую систему, в которой не
содержат азот, который является важным компонентом
белки, нуклеиновые кислоты, витамины и гормоны, из которых состоит жизнь
возможный. Животные получают необходимый им азот из растений.
или другие животные в их рационе. Растения должны подобрать свое
азот из почвы или поглощать его в виде N 2 от
атмосфера. Концентрация азота в почве довольно высока.
небольшой, поэтому процесс, с помощью которого растения восстанавливают N 2 до NH 3 или
«fix» N 2 чрезвычайно важен.
Животные получают необходимый им азот из растений.
или другие животные в их рационе. Растения должны подобрать свое
азот из почвы или поглощать его в виде N 2 от
атмосфера. Концентрация азота в почве довольно высока.
небольшой, поэтому процесс, с помощью которого растения восстанавливают N 2 до NH 3 или
«fix» N 2 чрезвычайно важен.
Хотя 200 миллионов тонн NH 3 производится фиксации азота каждый год, растения сами по себе не могут уменьшить N 2 до NH 3 . Эту реакцию осуществляет сине-зеленые водоросли и бактерии, связанные с определенными растения. Наиболее понятный пример фиксации азота включает ризобиальные бактерии, обнаруженные в корневых клубеньках бобовых, таких как клевер, горох и фасоль. Эти бактерии содержат нитрогеназу фермент, способный на замечательный подвиг восстановления N 2 из атмосферы в NH 3 при комнатной температуре.
Аммиак производится в промышленных масштабах с помощью процесса, сначала
Разработан между 1909 и 1913 годами Фрицем Габером. В Хабер
процесс , смесь N 2 и H 2 газ при 200-300 атм и 400-600 o С пропускают
катализатор из мелкодисперсного металлического железа.
В Хабер
процесс , смесь N 2 и H 2 газ при 200-300 атм и 400-600 o С пропускают
катализатор из мелкодисперсного металлического железа.
| Fe | |||||
| Н 2 ( г ) | + | 3 H 2 ( г ) | 2 NH 3 ( г ) |
Почти 20 миллионов тонн NH 3 производится в
Соединенные Штаты каждый год этим процессом. Около 80% его стоит
более 2 миллиардов долларов США, используется для производства удобрений для растений, которые
не может исправить азот из атмосферы. Исходя из веса,
аммиак является вторым по важности промышленным химическим веществом в
Соединенные Штаты. (Только серная кислота производится в более крупных
количество.)
Исходя из веса,
аммиак является вторым по важности промышленным химическим веществом в
Соединенные Штаты. (Только серная кислота производится в более крупных
количество.)
Две трети аммиака, используемого для удобрений, преобразуется в твердые вещества, такие как нитрат аммония, NH 4 NO 3 ; фосфат аммония, (NH 4 ) 3 PO 4 ; сульфат аммония, (NH 4 ) 2 SO 4 ; а также мочевина, H 2 NCONH 2 . Применяется другая треть непосредственно в почву как безводный (буквально, «без воды») аммиак. Аммиак это газ в помещении температура. С ним можно обращаться как с жидкостью при растворении в воды с образованием водного раствора. Альтернативно, это может быть охлаждается до температуры ниже -33 o C, в этом случае газ конденсируется с образованием безводной жидкости NH 3 ( l ).
Синтез Азотная кислота
NH 3 , полученный по способу Габера, который не
используется в качестве удобрения, сжигается в кислороде для получения азота
окись.
| 4 NH 3 ( г ) | + | 5 O 2 ( г ) | 4 НО( г ) | + | 6 H 2 O( г ) |
Оксид азота, или оксид азота, как его когда-то называли, представляет собой бесцветный газ, быстро реагирующий с кислородом с образованием азота диоксид, темно-коричневый газ.
| 2 НР( г ) | + | О 2 ( г ) | 2 НЕТ 2 ( г ) |
Двуокись азота растворяется в воде с образованием азотной кислоты и НЕТ, которые можно захватить и переработать.
| 3 № 2 ( г ) | + | Н 2 О( л ) | 2 HNO 3 ( водный ) | + | НЕТ( г ) |
Таким образом, с помощью трехэтапного процесса, разработанного Фридрихом Оствальдом
в 1908 г. аммиак можно превратить в азотную кислоту.
аммиак можно превратить в азотную кислоту.
| 4 NH 3 ( г ) | + | 5 О 2 ( г ) | 4 НО( г ) | + | 6 H 2 O( г ) | |
| 2 НО( г ) | + | O 2 ( г ) | 2 НЕТ 2 ( г ) | |||
| 3 № 2 ( г ) | + | Н 2 О( л ) | 2 HNO 3 ( водный ) | + | НЕТ( г ) |
Процесс Габера для синтеза аммиака в сочетании с
процесс Оствальда для преобразования
превращение аммиака в азотную кислоту произвело революцию в производстве взрывчатых веществ. Нитраты были важными взрывчатыми веществами со времен брата Роже.
Бекон смешал серу, селитру и порошкообразный уголь, чтобы сделать
пороха в 1245 г.
Нитраты были важными взрывчатыми веществами со времен брата Роже.
Бекон смешал серу, селитру и порошкообразный уголь, чтобы сделать
пороха в 1245 г.
| 16 КНО 3 ( с ) | + | С 8 ( с ) | + | 24 С( с ) | 8 К 2 С( с ) | + | 24 CO 2 ( г ) | + | 8 Н 2 ( г ) | H o = -571,9 кДж/моль N 2 |
До разработки процесса Оствальда единственным источником
нитраты для использования во взрывчатых веществах были природными минералами
например селитра, представляющая собой смесь NaNO 3 и KNO 3 .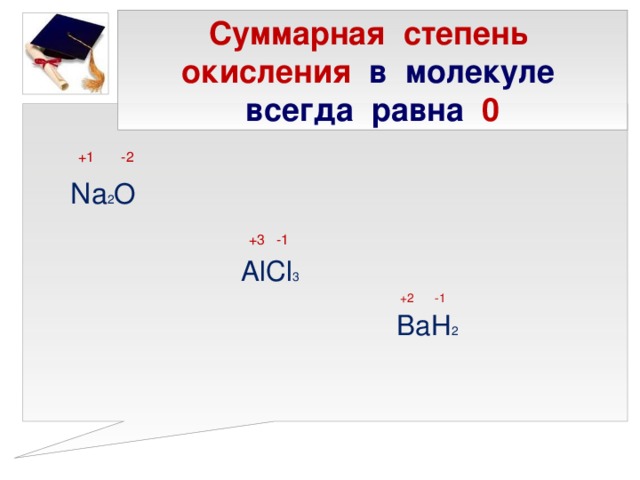 Как только появились надежные поставки азотной кислоты из
Процесс Оствальда позволяет получать ряд нитратов для использования в качестве
взрывчатые вещества. Объединение NH 3 из процесса Габера с
HNO 3 из процесса Оствальда, например, дает
аммиачной селитры, которая является одновременно прекрасным удобрением и
дешевое надежное взрывчатое вещество, обычно используемое в качестве взрывчатого вещества.
Как только появились надежные поставки азотной кислоты из
Процесс Оствальда позволяет получать ряд нитратов для использования в качестве
взрывчатые вещества. Объединение NH 3 из процесса Габера с
HNO 3 из процесса Оствальда, например, дает
аммиачной селитры, которая является одновременно прекрасным удобрением и
дешевое надежное взрывчатое вещество, обычно используемое в качестве взрывчатого вещества.
| 2 NH 4 НЕТ 3 ( с ) | 2 Н 2 ( г ) | + | О 2 ( г ) | + | 4 H 2 O( г ) |
Разрушительная сила аммиачной селитры
видно на фотографиях Федерального здания Альфреда П. Мурра.
в Оклахома-Сити, который был разрушен бомбой, сделанной из
аммиачной селитры от 19 апреля 1995 г.
Промежуточный Числа окисления
Азотная кислота (HNO 3 ) и аммиак (NH 3 ) представляют максимальную (+5) и минимальную (-3) степени окисления для азот. Азот также образует соединения при каждом окислении. число между этими крайними значениями (см. таблицу ниже).
Общие числа окисления азота
| Окисление Номер | Примеры | |
| -3 | НХ 3 , НХ 4 + , НХ 2 — , Мг 3 Н 2 | |
| -2 | Н 2 В 4 | |
| -1 | НХ 2 ОХ | |
| -1/3 | НаН 3 , ХН 3 | |
| 0 | Н 2 | |
| +1 | Н 2 О | |
| +2 | НО, Н 2 О 2 | |
| +3 | ХНО 2 , НО 2 — , Н 2 О 3 , № + | |
| +4 | НЕТ 2 , Н 2 О 4 | |
| +5 | HNO 3 , NO 3 — , N 2 O 5 |
Отрицательный Число окисления азота кроме -3
Примерно в то время, когда Габер разработал процесс получения
аммиак и Оствальд разработали процесс преобразования аммиака
в азотную кислоту, Рашиг разработал процесс, в котором использовалась
ион гипохлорита (OCl –) для окисления аммиака с получением
гидразин, N 2 H 4 .
| 2 NH 3 ( водный ) | + | OCl — ( водный ) | N 2 H 4 ( aq ) | + | Класс — ( водный ) | + | Н 2 О( л ) |
Эту реакцию можно понять, отметив, что OCl — ион является двухэлектронным окислителем. Потеря пары электронов и пары ионов H + соседними NH 3 молекулы произвели бы пару высокореактивных NH 2 молекулы, которые, объединившись, образуют молекулу гидразина. показано на рисунке ниже.
Гидразин — бесцветная жидкость со слабым запахом аммиака
которые можно собрать при нагревании этого раствора до N 2 H 4 перегоняется из реакционной колбы. Многие из физических
свойства гидразина аналогичны свойствам воды.
Многие из физических
свойства гидразина аналогичны свойствам воды.
| Н 2 О | С 2 Н 4 | |||
| Плотность | 1000 г/см 3 | 1,008 г/см 3 | ||
| Точка плавления | 0,00 или С | 1,54 или С | ||
| Точка кипения | 100 или С | 113,8 или С |
Между химическими
Однако свойства этих соединений. Гидразин горит, когда
воспламеняется на воздухе с образованием газообразного азота, водяного пара и больших
количества энергии.
| Н 2 В 4 ( л ) | + | О 2 ( г ) | Н 2 ( г ) | + | 2 H 2 O( г ) | H o = -534,3 кДж/моль N 2 H 4 |
В основном гидразин используется в качестве ракетного топлива. это
уступает только жидкому водороду по количеству
килограмм тяги на килограмм сожженного топлива.
Гидразин имеет ряд преимуществ перед жидким Н9.0230 2 ,
Однако. Его можно хранить при комнатной температуре, тогда как жидкий
водород необходимо хранить при температуре ниже -253 o С.
Гидразин также более плотный, чем жидкий H 2 и
поэтому требует меньше места для хранения.
Чистый гидразин редко используется в качестве ракетного топлива, поскольку он замерзает при температурах верхних слоев атмосферы. Гидразин смешивают с N,N -диметилгидразином, (CH 3 ) 2 ННХ 2 , с образованием раствора, который остается жидким при низких температурах. Смеси гидразина и N,N -диметилгидразина были использовался для заправки ракет Titan II, которые несли проект Gemini. космических аппаратов и реакция между производными гидразина и N 2 O 4 до сих пор используется в качестве топлива для небольших ракетных двигателей, которые позволяют космический шаттл для маневрирования в космосе.
Продукт сгорания гидразина необычен. Когда
соединения углерода горят, углерод окисляется до СО или СО 2 .
При горении соединений серы образуется SO 2 . Когда
гидразин сжигают, продукт реакции N 2 из-за необычайно прочной тройной связи азот-азот в
молекула N 2 .
| Н 2 В 4 ( л ) | + | О 2 ( г ) | Н 2 ( г ) | + | 2 H 2 O( г ) |
Гидразин реагирует с азотистой кислотой (HNO 2 ) с образованием азид водорода, HN 3 , в котором атом азота формально имеет степень окисления — 1 / 3 .
| Н 2 Н 4 ( водный ) | + | HNO 2 ( водный ) | ХН 3 ( водный ) | + | 2 Н 2 О( л ) |
Чистый азид водорода является чрезвычайно опасным веществом. Даже
с разбавленными растворами следует обращаться осторожно из-за риска
взрывов. Азид водорода лучше всего описывается как резонанс
гибрид структур Льюиса, показанных на рисунке ниже.
соответствующий азид-ион, N 3 — , является линейным
молекула, представляющая собой резонансный гибрид трех структур Льюиса.
Даже
с разбавленными растворами следует обращаться осторожно из-за риска
взрывов. Азид водорода лучше всего описывается как резонанс
гибрид структур Льюиса, показанных на рисунке ниже.
соответствующий азид-ион, N 3 — , является линейным
молекула, представляющая собой резонансный гибрид трех структур Льюиса.
| HN 3 | |
| Н 3 — |
Положительный Числа окисления азота: галогениды азота
Фтор, кислород и хлор — единственные элементы, которые больше электроотрицательнее азота. В результате положительное окисление количества азота находятся в соединениях, содержащих один или больше этих элементов.
Теоретически N 2 может реагировать с F 2 , чтобы
образуют соединение с формулой NF 3 . На практике N 2 слишком инертен, чтобы вступать в эту реакцию при комнатной температуре. НФ 3 получают реакцией аммиака с F 2 в присутствии
катализатор на основе меди.
На практике N 2 слишком инертен, чтобы вступать в эту реакцию при комнатной температуре. НФ 3 получают реакцией аммиака с F 2 в присутствии
катализатор на основе меди.
| Медь | ||||||
| NH 3 ( г ) | + | 3 F 2 ( г ) | NF 3 ( г ) | + | 3 HF( г ) |
HF, полученный в результате этой реакции, соединяется с аммиаком с образованием фторид аммония. Общая стехиометрия реакции равна поэтому написано так.
| Медь | ||||||
| 4 NH 3 ( г ) | + | 3 F 2 ( г ) | NF 3 ( г ) | + | 3 NH 4 F( с ) |
Структура Льюиса NF 3 аналогична
Структура Льюиса NH 3 , и две молекулы имеют
подобные формы.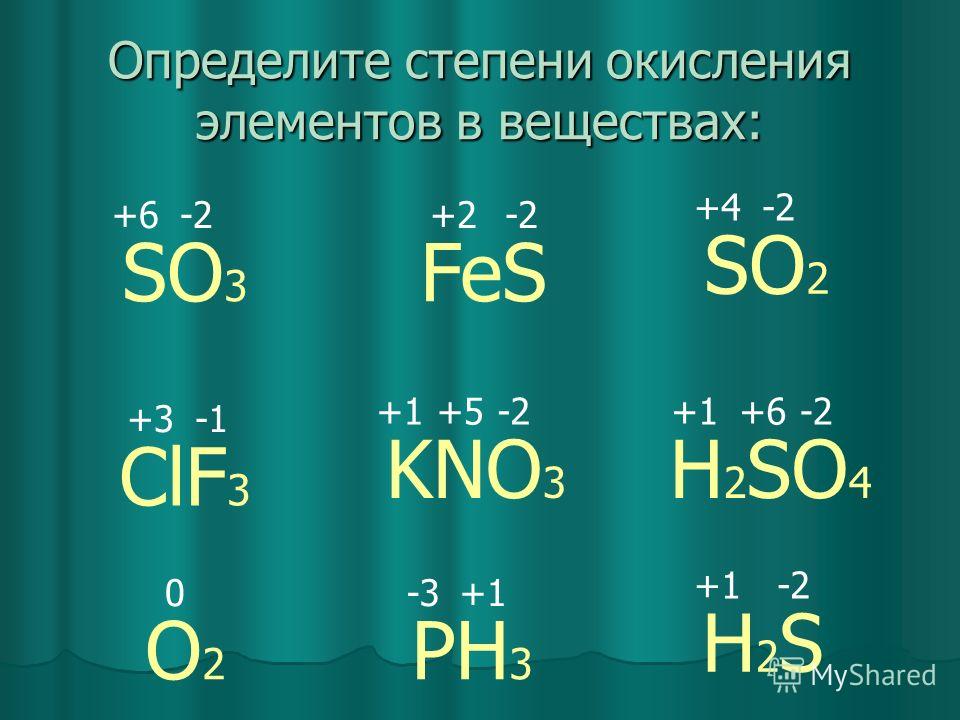
Аммиак реагирует с хлором с образованием NCl 3 , который на первый взгляд кажется тесно связанным с NF 3 . Но между этими составами есть существенная разница. НФ 3 практически инертен при комнатной температуре, тогда как NCl 3 представляет собой чувствительную к ударам взрывоопасную жидкость, которая разлагается до форма N 2 и Cl 2 .
| 2 NCl 3 ( л ) | Н 2 ( г ) | + | 3 Кл 2 ( г ) |
Аммиак реагирует с йодом с образованием твердого вещества, представляющего собой комплекс
между NI 3 и NH 3 . Этот материал является
предметом популярной, но опасной демонстрации, в которой
заливают свежеприготовленные образцы NI 3 в аммиаке
на фильтровальную бумагу, которой дают высохнуть на кольцевом штативе. После
аммиак испаряется, NH 3 /NI 3 к кристаллам прикасаются пером, прикрепленным к метровой палочке,
что приводит к детонации этого чувствительного к ударам твердого вещества, которое
разлагается с образованием смеси N 2 и я 2 .
После
аммиак испаряется, NH 3 /NI 3 к кристаллам прикасаются пером, прикрепленным к метровой палочке,
что приводит к детонации этого чувствительного к ударам твердого вещества, которое
разлагается с образованием смеси N 2 и я 2 .
| 2 NI 3 ( с ) | Н 2 ( г ) | + | 3 I 2 ( г ) |
Положительный Числа окисления азота: оксиды азота
Структуры Льюиса для семи оксидов азота с окислением номера в диапазоне от +1 до +5 приведены в Таблица ниже.
Все эти соединения имеют две общие черты: они содержат
Двойные связи N=O, и они менее стабильны, чем их элементы в
газовой фазе, о чем свидетельствуют данные по энтальпии образования в
Таблица ниже.
Данные по энтальпии образования оксидов азота
| Соединение | H или f (кДж/моль) | |
| Н 2 О( г ) | 82.05 | |
| НЕТ( г ) | 90,25 | |
| № 2 ( г ) | 33,18 | |
| Н 2 О 3 ( г ) | 83,72 | |
| Н 2 О 4 ( г ) | 9,16 | |
| Н 2 О 5 ( г ) | 11.35 |
Закись азота, N 2 O, известная также как
закись азота можно получить путем тщательного разложения аммония
нитрат.
| от 170 до 200 или С | ||||
| NH 4 НЕТ 3 ( с ) | Н 2 О( г ) | + | 2 Н 2 О( г ) |
Закись азота — это бесцветный газ со сладким запахом, наиболее известный
нехимиков как «веселящий газ». Уже в 1800 г.
Хамфри Дэви отметил, что N 2 O при вдыхании относительно
в небольших количествах, часто вызывает состояние явного опьянения
сопровождается либо судорожным смехом, либо плачем. Когда взято
в больших дозах закись азота обеспечивает быстрое и эффективное облегчение
от боли. Поэтому N 2 O был использован в качестве первого
анестетик. Поскольку для анестезии необходимы большие дозы,
и длительное воздействие газа может привести к летальному исходу, N 2 О есть
используется сегодня только для относительно коротких операций.
Поскольку для анестезии необходимы большие дозы,
и длительное воздействие газа может привести к летальному исходу, N 2 О есть
используется сегодня только для относительно коротких операций.
Закись азота обладает рядом других интересных свойств. Первый, хорошо растворяется в сливках; по этой причине он используется в качестве пропеллент в дозаторах для взбитых сливок. Во-вторых, хотя и делает не горят сами по себе, лучше воздуха поддерживают возгорание других предметов. Это можно объяснить, заметив, что N 2 O может разлагаться с образованием атмосферы, одна треть O 2 по объему, тогда как обычный воздух составляет всего 21% кислорода по объему.
| 2 Н 2 О( г ) | 2 Н 2 ( г ) | + | О 2 ( г ) |
На протяжении многих лет окончания — ous и — ic использовались для различения самого низкого и самого высокого в паре
степени окисления. № 2 O представляет собой закись азота, поскольку
степень окисления азота +1. NO это оксид азота
потому что степень окисления азота +2.
№ 2 O представляет собой закись азота, поскольку
степень окисления азота +1. NO это оксид азота
потому что степень окисления азота +2.
Огромные количества оксида азота или оксида азота генерируется каждый год в результате реакции между N 2 и O 2 в атмосфере, катализируемый ударом молния, проходящая через атмосферу или раскаленными стенками двигатель внутреннего сгорания.
| Н 2 ( г ) | + | О 2 ( г ) | 2 НО( г ) |
Одна из причин снижения степени сжатия автомобильных двигателей в последние годы заключается в снижении температуры реакции горения, тем самым уменьшая количество NO выбрасывается в атмосферу.
NO можно получить в лаборатории путем реакции с металлической медью
с разбавленной азотной кислотой.
| 3 Cu( с ) | + | 8 HNO 3 ( aq ) | 3 Cu(NO 3 ) 2 ( водный ) | + | 2 НО( г ) | + | 4 Н 2 О( л ) |
Молекула NO содержит нечетное число валентных электронов. В результате невозможно написать структуру Льюиса для этого молекула, в которой все электроны спарены (см. таблицу оксидов азота). Когда НЕТ газа при охлаждении пары молекул NO соединяются в обратимой реакции образуют димер (от греческого «два частей»), по формуле N 2 О 2 , в в котором все валентные электроны спарены, как показано в таблице оксидов азота.
NO быстро реагирует с O 2 с образованием диоксида азота
(когда-то известный как перекись азота), который представляет собой темно-коричневый газ при
комнатная температура.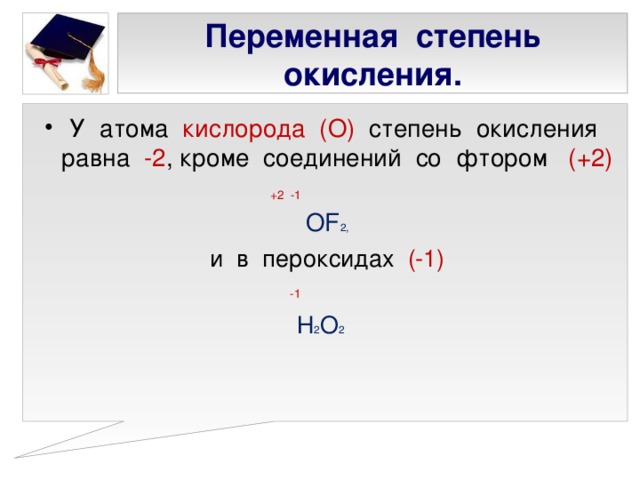
| 2 НО( г ) | + | О 2 ( г ) | 2 НЕТ 2 ( г ) |
NO 2 можно приготовить в лаборатории нагреванием нитраты некоторых металлов до их разложения.
| 2 Pb(NO 3 ) 2 ( с ) | 2 PbO( с ) | + | 4 НЕТ 2 ( г ) | + | О 2 ( г ) |
Его также можно получить путем взаимодействия металлической меди с концентрированным . азотная кислота,
азотная кислота,
| Cu( с ) | + | 4 HNO 3 ( aq ) | Cu(NO 3 ) 2 ( водный ) | + | 2 НЕТ 2 ( г ) | + | 2 Н 2 О( л ) |
NO 2 также имеет нечетное число электронов и поэтому содержит по крайней мере один неспаренный электрон в своем льюисовском структуры. № 2 димеризуется при низких температурах с образованием N 2 O 4 молекулы, в которых все электроны парные, как показано в таблице оксидов азот.
Смеси NO и NO 2 объединяются при охлаждении с образованием
триоксид диазота, N 2 O 3 , который представляет собой синий
жидкость. Образование голубой жидкости при воздействии NO или NO 2 охлаждается, поэтому подразумевает наличие хотя бы небольшого
часть другого оксида, поскольку N 2 О 2 и
N 2 O 4 оба бесцветны.
Образование голубой жидкости при воздействии NO или NO 2 охлаждается, поэтому подразумевает наличие хотя бы небольшого
часть другого оксида, поскольку N 2 О 2 и
N 2 O 4 оба бесцветны.
Осторожно удаляя воду из концентрированной азотной кислоты при при низких температурах с дегидратирующим агентом мы можем образовать диазот пятиокись.
| 4 HNO 3 ( aq ) | + | П 4 О 10 ( с ) | 2 Н 2 О 5 ( с ) | + | 4 ВПО 3 ( с ) |
N 2 O 5 представляет собой бесцветное твердое вещество,
разлагается на свету или при нагревании до комнатной температуры. Как мог бы
можно ожидать, N 2 O 5 растворяется в воде до
образуют азотную кислоту.
Как мог бы
можно ожидать, N 2 O 5 растворяется в воде до
образуют азотную кислоту.
| Н 2 О 5 ( с ) | + | Н 2 О( л ) | 2 HNO 3 ( водный ) |
Химия Фосфор
Фосфор — первый элемент, открытие которого можно проследить
одному физическому лицу. В 1669 г., при поиске способа
превращая серебро в золото, Хенниг Бранд получил белую восковую
твердое тело, светящееся в темноте и самопроизвольно воспламеняющееся
при контакте с воздухом. Бранд сделал это вещество путем выпаривания
воду из мочи и позволяя черному остатку разлагаться в течение
несколько месяцев. Затем он смешал этот остаток с песком, нагрел это
смеси в присутствии минимума воздуха и собирают под
водой летучие продукты, которые перегоняются из реакции
колба.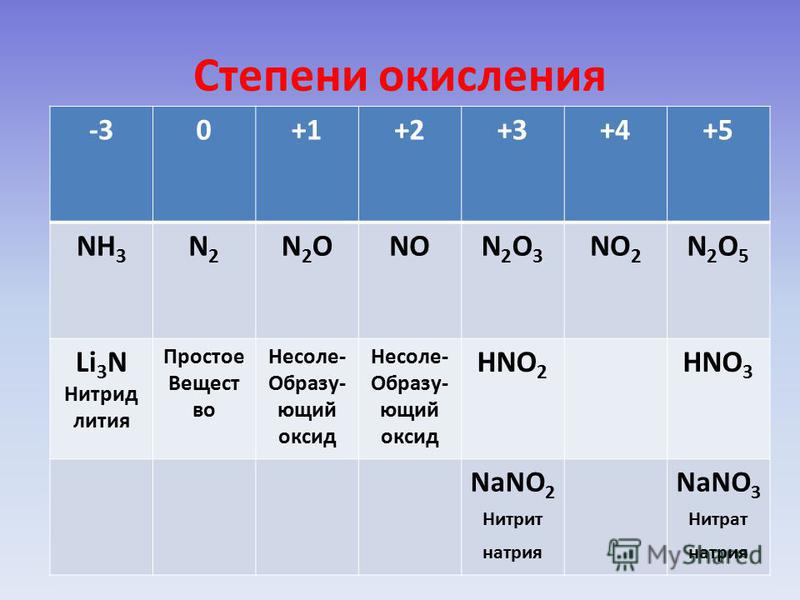
Фосфор образует ряд соединений, являющихся прямыми аналогами азотсодержащих соединений. Однако тот факт, что элементарный азот практически инертен при комнатной температуре, тогда как элементарный фосфор может самопроизвольно воспламениться при воздействии на воздух показывает, что существуют различия между эти элементы тоже. Фосфор часто образует соединения с те же степени окисления, что и аналогичные соединения азота, но с различными формулами, как показано в таблице ниже.
Соединения азота и фосфора с Одинаковые числа окисления, но разные формулы
| Номер окисления | Соединение азота | Соединение фосфора | ||
| 0 | Н 2 | П 4 | ||
| +3 | HNO 2 (азотистая кислота) | H 3 PO 3 (фосфористая кислота) | ||
| +3 | Н 2 О 3 | П 4 О 6 | ||
| +5 | HNO 3 (азотная кислота) | H 3 PO 4 (фосфорная кислота) | ||
| +5 | NaNO 3 (нитрат натрия) | Na 3 PO 4 (фосфат натрия) | ||
| +5 | Н 2 О 5 | П 4 О 10 |
Те же факторы, которые объясняют различия между серой
и кислород могут быть использованы для объяснения различий между
фосфор и азот.
1. Тройные связи азот-азот намного прочнее, чем фосфор-фосфорные тройные связи.
2. Одинарные связи PP прочнее, чем одинарные связи N-N.
3. Фосфор ( EN = 2.19) намного меньше электроотрицательнее азота ( EN = 3,04).
4. Фосфор может расширять свою валентную оболочку, чтобы удерживать более восемь электронов, а азот не может.
Влияние Различия в силе одинарной и тройной связи
Отношение радиусов атомов фосфора и азота такое же, как отношение радиусов атомов серы и кислорода, в пределах экспериментальная ошибка.
В результате тройные связи фосфор-фосфор значительно
слабее, чем тройные связи азот-азот, по той же причине
что двойные связи S=S слабее, чем двойные связи O=O фосфор
атомы слишком велики, чтобы сблизиться достаточно близко друг к другу, чтобы образовать прочные
облигации.
Каждый атом в молекуле N 2 завершает свой октет валентные электроны, разделяя три пары электронов с один соседний атом. Поскольку фосфор не образует прочных множественными связями сам с собой, элементарный фосфор состоит из тетраэдрический P 4 молекулы, в которых каждый атом образует одинарные связи с тремя соседними атомами, как показано на рисунке ниже.
Фосфор представляет собой белое твердое вещество воскообразного вида, которое плавится при 44,1 o C и кипит при 287 o C. Это получают восстановлением фосфата кальция углеродом в присутствии кремнезем (песок) при очень высоких температурах.
| 2 Ca 3 (PO 4 ) 2 ( с ) | + | 6 SiO 2 ( с ) | + | 10 С( с ) | 6 CaSiO 3 ( с ) | + | П 4 ( с ) | + | 10 CO( г ) |
Белый фосфор хранится под водой, потому что элемент
самопроизвольно воспламеняется в присутствии кислорода при
температуры лишь немного выше комнатной. Несмотря на то что
фосфор нерастворим в воде, хорошо растворим в углероде
дисульфид. Растворы P 4 в CS 2 в
достаточно стабильно. Как только CS 2 испарится,
однако фосфор воспламеняется.
Несмотря на то что
фосфор нерастворим в воде, хорошо растворим в углероде
дисульфид. Растворы P 4 в CS 2 в
достаточно стабильно. Как только CS 2 испарится,
однако фосфор воспламеняется.
Валентный угол P-P-P в тетраэдрической молекуле P 4 всего 60 o . Этот очень маленький угол создает
значительное напряжение в молекуле P 4 ,
который можно снять, разорвав одну из Р-Р-связей.
Следовательно, фосфор образует другие аллотропы, открывая P 4 тетраэдр. При нагревании белого фосфора до 300 o С,
одна связь внутри каждого тетраэдра P 4 разрывается, и
P 4 молекулы соединяются вместе, образуя полимер (от греческого pol , «много», и meros ,
«parts») со структурой, показанной на рисунке ниже.
Этот аллотроп фосфора темно-красный, и его присутствие в
небольшие следы часто придают белому фосфору светло-желтую окраску.
Красный фосфор более плотный (2,16 г/см 3 ), чем белый
фосфора (1,82 г/см 3 ) и гораздо менее реакционноспособен при
нормальные температуры.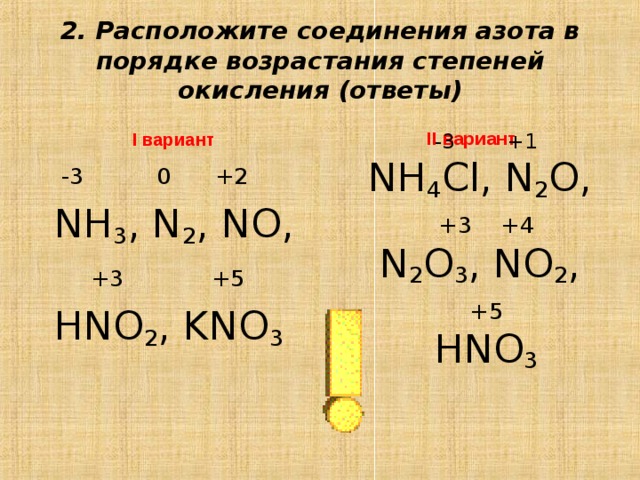
Влияние Различия в прочности двойных связей P=X и N=X
Размер атома фосфора также влияет на его способность образовывать двойные связи с другими элементами, такими как кислород, азот, и сера. В результате фосфор имеет тенденцию образовывать соединения, которые содержат две одинарные связи PO, где азот образует N = O двойная связь. Азот образует нитрат, NO 3 — , ион, например, в котором он имеет степень окисления +5. Когда фосфор образует ион с той же степенью окисления, фосфат, PO 4 3-, ион, как показано на рисунок ниже.
Аналогичным образом азот образует азотную кислоту HNO 3 , которая
содержит двойную связь N=O, тогда как фосфор образует фосфорную
кислота, H 3 PO 4 , которая содержит одиночный PO
облигации, как показано на рисунке ниже.
Влияние Различия электроотрицательностей фосфора и азота
Разница электроотрицательностей фосфора и азота ( EN = 0,85) такая же, как разница между электроотрицательностью серы и кислорода ( EN = 0,86), в пределах погрешности эксперимента. Потому что меньше электроотрицательны, фосфор более склонен, чем азот, проявляют положительные степени окисления. Самое важное окисление. числа для фосфора -3, +3 и +5 (см. Таблицу ниже).
Общие числа окисления фосфора
| Окисление Номер | Примеры | |
| -3 | Ca 3 P 2 , РН 3 | |
| +3 | ПФ 3 , П 4 О 10 , Н 3 ПО 3 | |
| +5 | ПФ 5 , П 4 О 10 , Н 3 ПО 4 , Заказ на поставку 4 3- |
Поскольку он более электроотрицательный, чем большинство металлов,
фосфор реагирует с металлами при повышенных температурах с образованием
фосфиды, в которых он имеет степень окисления -3.
| 6 Ca( с ) | П 4 ( с ) | 2 Ca 3 P 2 ( с ) |
Эти фосфиды металлов реагируют с водой с образованием ядовитый, очень реактивный, бесцветный газ, известный как фосфин (PH 3 ), который имеет самый неприятный запах, с которым сталкивались авторы.
| Ca 3 P 2 ( с ) | + | 6 Н 2 О( л ) | 2 РН 3 ( г ) | + | 3 Ca 2+ ( водный ) | + | 6 ОН — ( водный ) |
Образцы РН 3 , фосфорсодержащего аналога аммиака,
часто загрязнены следами P 2 H 4 ,
фосфорный аналог гидразина. Как будто токсичность и запах
РН 3 было недостаточно, смеси РН 3 и
P 2 H 4 самопроизвольно воспламенился в
наличие кислорода.
Как будто токсичность и запах
РН 3 было недостаточно, смеси РН 3 и
P 2 H 4 самопроизвольно воспламенился в
наличие кислорода.
Соединения (такие как Ca 3 P 2 и PH 3 ) в которых фосфор имеет отрицательную степень окисления, далеки превосходят соединения, в которых степень окисления фосфор положительный. Фосфор горит в O 2 по производят P 4 O 10 в реакции, которая дает необычайное количество энергии в виде тепла и света.
| П 4 ( с ) | + | 5 O 2 ( г ) | П 4 О 10 ( с ) | H o = -2985 кДж/моль P 4 |
При горении фосфора в присутствии ограниченного количества O 2 ,
P 4 O 6 производится.
| П 4 ( с ) | + | 3 O 2 ( г ) | П 4 О 6 ( с ) | H o = -1640 кДж/моль P 4 |
P 4 O 6 состоит из тетраэдра, в котором атом кислорода вставлен в каждую связь PP в P 4 молекула (см. рисунок ниже). P 4 O 10 имеет аналогичная структура с дополнительным атомом кислорода, связанным с каждым из четырех атомов фосфора.
Р 4 О 6 и Р 4 О 10 реагирует с водой с образованием фосфористой кислоты, H 3 PO 3 , и фосфорная кислота, H 3 PO 4 соответственно.
| П 4 О 6 ( с ) | + | 6 Н 2 О( л ) | 4 Ч 3 Заказ на поставку 3 ( aq ) | |
| П 4 О 10 ( с ) | + | 6 Н 2 О( л ) | 4 H 3 Заказ на покупку 4 ( aq ) |
P 4 O 10 обладает таким высоким сродством к воде
что он обычно используется в качестве обезвоживающего агента. Фосфор
кислота, Н 3 PO 3 и фосфорная кислота, H 3 PO 4 ,
являются примерами большого класса оксикислот фосфора. Льюис
структуры некоторых из этих оксикислот и родственных им оксианионов
приведены в таблице ниже.
Фосфор
кислота, Н 3 PO 3 и фосфорная кислота, H 3 PO 4 ,
являются примерами большого класса оксикислот фосфора. Льюис
структуры некоторых из этих оксикислот и родственных им оксианионов
приведены в таблице ниже.
| ОКСИАКИД | ОКСИАНИЙ |
Влияние Различия в способностях фосфора и азота к расширению Их валентность Shell
Реакция между аммиаком и фтором останавливается на NF 3 потому что азот использует 2 с , 2 р x , 2 р г и 2 p z орбиталей для удержания валентных электронов.

 Окисляет металлы, водород, сернистый газ и прочее. Растворяясь в воде, образует азотную кислоту. В результате таких реакций образуется свободная форма азота.
Окисляет металлы, водород, сернистый газ и прочее. Растворяясь в воде, образует азотную кислоту. В результате таких реакций образуется свободная форма азота.

 17
17 728
728 0115
0115 Спектр
Спектр К., Фин О. Создание базы данных экспонатов крови с использованием комплексного анализа текста и подхода к объединению баз данных. Перспектива охраны окружающей среды. 2019Сен;127(9):97008. дои: 10.1289/EHP4713. Epub 2019 Sep 26. [PubMed:31557052 ]
К., Фин О. Создание базы данных экспонатов крови с использованием комплексного анализа текста и подхода к объединению баз данных. Перспектива охраны окружающей среды. 2019Сен;127(9):97008. дои: 10.1289/EHP4713. Epub 2019 Sep 26. [PubMed:31557052 ]