что, как сбалансировать и часто задаваемые вопросы —
By Кавита Сингхал
Иодистый водород (HI) обычно представляет собой бесцветный газ, который при растворении в воде превращается в сильную кислоту. Посмотрим на реакцию HI с Na.2S через эту статью.
Сульфид натрия (Na2S) представляет собой соль, которая может существовать как в безводной, так и в водной форме. Это очень реактивная щелочь, поэтому она быстро реагирует с кислотой с образованием сероводорода. Когда На2S подвергается воздействию влаги, через его гидриды выделяются токсичные пары сероводорода.
В этой статье мы обсудим важные факты и часто задаваемые вопросы о HI + Na.2S химические реакции, такие как энтальпия реакции, необходимое тепло, образующийся продукт, тип реакции, тип межмолекулярных сил между их соединениями и т. д.
Что является произведением HI и Na
2S?Иодистый водород (HI) реагирует с сульфидом натрия (Na2S) для производства сероводорода (H2S) и йодид натрия (NaI). Химическое уравнение реакции выглядит следующим образом:
Химическое уравнение реакции выглядит следующим образом:
2HI + Na2С = Н2S + 2NaI
Какой тип реакции HI + Na
2S?HI + Na2S представляет собой реакцию двойного замещения, но также следует за кислотно-щелочной реакцией, поскольку Na2S принимает протон от HI, а неподеленные электронные пары, присутствующие на сере, притягивают протон, а не остаются связанными с ионом натрия. Таким образом, HI действуют как кислота Бренстедаи На2S действуют как база Бронстеда.
Как сбалансировать HI + Na
2S?Общее сбалансированное молекулярное уравнение для HI + Na2S это,
2HI + Na2С = Н2S + 2NaI
Сбалансированное уравнение для HI + Na2S можно получить, используя следующий метод:
- Несбалансированное химическое уравнение для HI + Na2S,
Привет + Na2С = Н2S + NaI - Количество всех атомов в левой и правой частях химической реакции должно быть одинаковым.

- Если все атомы не равны по количеству, перед несбалансированной молекулой следует поставить некоторый коэффициент, чтобы увеличить количество этого конкретного несбалансированного атома.
- Здесь мы видим, что количество атомов водорода и натрия неодинаково по обе стороны реакции.
- Поэтому, чтобы сбалансировать их, HI на левой стороне и NaI на правой стороне умножаются на коэффициент 2.
- Следовательно, сбалансированное химическое уравнение:
- 2HI + Na2С = Н2S + 2NaI
Привет + Na
2S титрованиеКоличественный анализ HI не может быть оценен путем выполнения титрование HI против Na2S, потому что HI — сильная кислота, а Na2S действует как соль. Поэтому титрование этой реакции невозможно.
Привет + Na
2S чистое ионное уравнениеОбщее сбалансированное молекулярное уравнение HI + Na2S выглядит следующим образом:
2HI + Na2С = Н2S + 2NaI
Чистое ионное уравнение для этого химического уравнения можно получить, выполнив следующие шаги:
- Напишите уравнение растворимости для HI + Na2S
- Обозначьте состояние или фазу (s, l, g или aq) каждого вещества в сбалансированном молекулярном уравнении HI + Na.
 2S,
2S,
2HI (водн.) + Na2S (водн.) = H2S(т) + 2NaI(водн.) - Разбейте все водорастворимые ионные вещества на соответствующие им ионы, чтобы получить полное ионное уравнение.,
2H+(водн.) +2I–(водн.) + 2Na+ (водн.) + S2- (водн.) = h3S (тв.) + 2Na+ (водн.) + 2I–(водн.) - Чтобы получить чистое ионное уравнение, удалите зрительские ионы (I– и Na+) из левой и правой частей полного ионного уравнения.
- Таким образом, результирующее ионное уравнение для HI + Na2S является,
2H+(водн.) + S2- (водн.) = H2SS)
Сопряженная кислота или основание в 2HI + Na2С = Н2S + 2NaI:
- HI (кислота) + H2О = Н3O+ + Я— (Сопряженная база)
- Na2S не содержит сопряженных пар, потому что это соль.

- H2S (кислота) + h3O = H+ + HS- (сопряженное основание)
- NaI не содержит сопряженных пар, потому что это соль.
привет и Na
2S межмолекулярные силыКаждое соединение в HI + Na2С = Н2S + 2NaI содержат следующие межмолекулярные силы:
- HI является полярной молекулой, поэтому она содержит ионное взаимодействие, диполь-дипольное взаимодействие и водородные связи между своими молекулами.
- Na2S является ионным соединением, поэтому в его молекулах присутствует электростатическое притяжение. Положительный заряд иона натрия одной молекулы связывается с отрицательно заряженным сульфид-ионом другой молекулы.
- Связь в атомах молекулы h3S сильно полярна из-за большой разницы электроотрицательностей между атомами водорода и серы. Благодаря этому h3S демонстрирует сильное диполь-дипольное взаимодействие и лондоновскую дисперсионную силу.

- NaI — ионная молекула, поэтому ее ионы удерживаются друг с другом за счет электростатической и кулоновской сил.
Привет + Na
2S энтальпия реакцииПривет + Na2Энтальпия реакции S составляет 237.21 кДж/моль. Стандартная энтальпия образования реагентов и продуктов следующая:
| Соединение | Стандартная энтальпия пласта (ΔfH°(кДж/моль) ) |
| HI | 26.46 |
| Na2S | -369.0 |
| H2S | -20.27 |
| NaI | -266.51 |
& delta; Hf = Сумма энтальпий образования (продуктов) – Сумма энтальпий образования (реагентов)
& delta; Hf = [2*(26. 46) – 369.0) – (-20.27 – 2*(266.51))]
46) – 369.0) – (-20.27 – 2*(266.51))]
& delta; Hf = [-316.08- (-553.29)]
& delta; Hf = 237.21 кДж/моль
HI + Na
2S буферный раствор?Привет + Na2С не является буферный раствор потому что водный раствор этой смеси не дает соответствующей кислоты или основания.
HI + Na
2S полная реакция?Привет + Na2S является полной реакцией, так как в этой реакции все молекулы HI и Na2S потребляются и успешно превращаются в конечный продукт.
HI + Na
2S экзотермическая или эндотермическая реакция?An эндотермическая реакция происходит, когда два моля HI реагируют с одним молем Na2S.
- Энтальпия реакции оказалась положительной (т.
 е. ΔHf>0) из приведенных выше расчетов.
е. ΔHf>0) из приведенных выше расчетов. - Реагенты поглощают 237.21 кДж / моль тепла во время реакции, что снижает энергию окружающей среды и охлаждает реакционную систему.
HI+ Na
2S окислительно-восстановительная реакция?Привет + Na2С не является окислительно-восстановительная реакция потому что степени окисления элементов не меняются в ходе реакции.
HI + Na
2S реакция осаждения?HI+ Na2S-реакция – это осадки реакция bпотому что Х2S образуется в твердой фазе после завершения реакции.
HI + Na
2Обратимая или необратимая реакция?Привет + Na2S – необратимая реакция. Поскольку это происходит только в прямом направлении и производит H2S но вернуться невозможно Na2S при обычной температуре реакции, давлении и реакционной среде.
HI + Na
2S реакция смещения?Привет + Na2Это реакция двойного смещения, потому что в этой реакции, ион йода (I–) и расширение Ион серы (S2-) меняются местами друг с другом, образуя новые продукты H2С и NaI.
ЗаключениеВ статье говорится, что На2S реагирует с сильной кислотой HI и успешно образует NaI и слабую кислоту ( H2С). ЧАС2S получают в твердом состоянии, поэтому он осаждается в реакционной системе и легко отделяется. Эта реакция является эндотермической, поскольку чистая энергия реагентов выше, чем у конечных продуктов.
Сульфид натрия: применение, взаимодействие, механизм действия В ближайшее время планируется его аннотирование.
- Общее название
- Сульфид натрия
- Регистрационный номер в DrugBank
- DB11159
- История вопроса
Сульфид натрия представляет собой химическое соединение с химической формулой Na2S.
 Сульфид натрия используется в целлюлозно-бумажной промышленности, при очистке воды, в текстильной промышленности и в различных химических производственных процессах, включая производство резиновых химикатов, сернистых красителей и нефтедобычи. Вместе с гидратной формой сульфид натрия выделяет сероводород (h3S) при контакте с влажным воздухом. h3S является эндогенным газообразным медиатором, обладающим противовоспалительными и антиапоптотическими свойствами. Наряду с другими сульфидами противовоспалительное и тканезащитное действие сульфида натрия исследовано на моделях воспаления и окислительного стресса. Интересно, что сульфид натрия, как было показано, играет некоторую кардиозащитную роль против сердечной ишемии или реперфузионного повреждения, а также защищает легкие от повреждения легких, вызванного вентилятором
Сульфид натрия используется в целлюлозно-бумажной промышленности, при очистке воды, в текстильной промышленности и в различных химических производственных процессах, включая производство резиновых химикатов, сернистых красителей и нефтедобычи. Вместе с гидратной формой сульфид натрия выделяет сероводород (h3S) при контакте с влажным воздухом. h3S является эндогенным газообразным медиатором, обладающим противовоспалительными и антиапоптотическими свойствами. Наряду с другими сульфидами противовоспалительное и тканезащитное действие сульфида натрия исследовано на моделях воспаления и окислительного стресса. Интересно, что сульфид натрия, как было показано, играет некоторую кардиозащитную роль против сердечной ишемии или реперфузионного повреждения, а также защищает легкие от повреждения легких, вызванного вентилятором - Type
- Small Molecule
- Groups
- Approved
- Structure
- Weight
- Average: 78.
 04
04
Monoisotopic: 77.95160973 - Chemical Formula
- Na 2 S
- Synonyms
- Not Available
- Индикация
Недоступно
Сокращение количества отказов при разработке лекарств
Создание, обучение и проверка моделей машинного обучения
с использованием доказательных и структурированных наборов данных.Узнайте, как
Создавайте, обучайте и проверяйте прогнозные модели машинного обучения со структурированными наборами данных.
Узнайте, как
- Противопоказания и предупреждения Blackbox
Избегайте опасных для жизни нежелательных явлений, связанных с приемом лекарств
Улучшите поддержку принятия клинических решений с помощью информации о противопоказаниях и предупреждениях черного ящика, ограничениях населения, вредных рисках и многом другом.

Узнать больше
Предотвратите опасные для жизни побочные эффекты лекарств и улучшите поддержку принятия клинических решений.
Подробнее
- Фармакодинамика
Нет в наличии
- Механизм действия
- Нет в наличии
- Абсорбция
Недоступно
- Объем распределения
Недоступно
- Связывание белка
Недоступно
- Метаболизм
- .
Недоступно
- Разрешение
Недоступно
- Побочные эффекты
Улучшение поддержки принятия решений и результатов исследований
Со структурированными данными о побочных эффектах, включая: предупреждения черного ящика, побочные реакции, предупреждения и меры предосторожности, а также показатели заболеваемости.
Узнать больше
Улучшите поддержку принятия решений и результаты исследований с помощью наших структурированных данных о побочных эффектах.

Узнать больше
- Токсичность
Недоступно
- Пути введения
- Недоступно
- Фармакогеномные эффекты/НЛР
- Недоступно
- Лекарственные взаимодействия
Эту информацию не следует интерпретировать без помощи поставщика медицинских услуг. Если вы считаете, что испытываете взаимодействие, немедленно обратитесь к поставщику медицинских услуг. Отсутствие взаимодействия не обязательно означает отсутствие взаимодействия.
Недоступно- Взаимодействия с пищей
- Взаимодействий не обнаружено.
Информация о лекарственных препаратах из более чем 10 регионов мира
Наши наборы данных содержат утвержденную информацию о продукте, включая: дозировку, форму, маркировщик, способ введения и период реализации.
Доступ сейчас
Доступ к информации о лекарственных препаратах из более чем 10 регионов мира.

Access Now
- За счет счетчиков
Имя Дозировка Сила Маршрут Labeller Маркетин.0212 Регион Изображение Обезболивающее средство от вросших ногтей на ногах Dr. Scholls Гель 10 мг/1 г 2003-05-07 2021-02-28 US Scholls Wellness Company LLC Ingrown Toenail Gel 1 g/10g Topical Scapa Tapes North America, LLC 01.01.2021 Неприменимо US Scholls Wellness Company LLC Ingrown Toenail Gel 1 g/10g Topical Scholls Wellness Company LLC 2021-01-01 Not applicable US Sodium Sufide Gel 0.  085 g/8.5g
085 g/8.5gTopical CVS Health 2017-05-22 2017-10-02 US Sodium Sufide Gel 0.085 g/8.5g Topical Walgreens 2018-03-01 Not applicable US
- Drug Categories
- Anions
- Электролиты
- Сероводород
- Ионы
- Соединения серы
- Химическая таксономия Предоставлено Classyfire
- Описание
- Это соединение принадлежит к классу неорганических соединений, известных как сульфиды щелочных металлов. Это неорганические соединения, содержащие атом серы со степенью окисления -2, в которых самый тяжелый атом, связанный с кислородом, представляет собой щелочной металл.
- Королевство
- Неорганические соединения
- Super Class
- Смешанные металлические/неметальные соединения
- класс
- Организации из щелочных металлов
- Sub Class
- Sulfide Sulfides
- Direct
- ALKALLIDISLIDIDIDIDE
- 07 Direct
- 99999
- SLKALI SULFIDES
- Прямой родитель 9000
- .

- Неорганические сульфиды / Неорганические соли натрия
- Заместители
- Сульфид щелочного металла / Неорганическая соль / Неорганическая натриевая соль / Неорганический сульфид
- Молекулярная рамка
- Недоступно
- Внешние дескрипторы
- неорганическая натриевая соль, сульфидная соль (Chebi: 76208)
- Потронутые Организма 9007
- 9999977777777777777777777777777777777777. -82-2
- Ключ ИнЧИ
- ГРВФОГОЕДУУМБП-УХФФФАОЙСА-Н
- ИнЧИ
ИнЧИ=1S/2Na.S/q2*+1;-2
- 908AC Наименование
DISODIUM SULFANEDIIDE
- Улыбки
[NA+]. [NA+]. [S—]
- Общие ссылки
- Francis RC, Vaporidi K, Bloch kd, ichinosesose-f, ZapiNosese F, ZapiNosesoses. F, ZapiNosesoses. F, ZapiNosesoses. F, ZapiNoses. и вредное воздействие сульфида натрия и сероводорода на повреждение легких у мышей, вызванное вентилятором.
 Анестезиология. 2011 ноябрь; 115(5):1012-21. doi: 10.1097/ALN.0b013e31823306cf. [Статья]
Анестезиология. 2011 ноябрь; 115(5):1012-21. doi: 10.1097/ALN.0b013e31823306cf. [Статья]
- Francis RC, Vaporidi K, Bloch kd, ichinosesose-f, ZapiNosese F, ZapiNosesoses. F, ZapiNosesoses. F, ZapiNosesoses. F, ZapiNoses. и вредное воздействие сульфида натрия и сероводорода на повреждение легких у мышей, вызванное вентилятором.
- Внешние ссылки
- PubChem Compound
- 14804
- PubChem Substance
- 347827927
- ChemSpider
- 14120
- RxNav
- 1293719
- ChEBI
- 76208
- ChEMBL
- CHEMBL2107611
- Wikipedia
- Sodium_sulfide
- Clinical Trials
Фаза Статус Назначение Условия Количество 2 Withdrawn Treatment ST Segment Elevation Myocardial Infarction (STEMI) 1 1 Terminated Treatment Impaired Renal Function 1 - Manufacturers
Нет в наличии
- Упаковщики
Нет в наличии
- Лекарственные формы
Форма Route Strength Gel Topical 10 mg/1g Gel Topical 1 g/10g Gel Topical 0.  085 g/8.5 г
085 g/8.5 г- Цены
- Нет в наличии
- Патенты
- Нет в наличии
- Состояние 9 Нет в наличии
- 0 Свойства 800700009 Not Available
- Predicted Properties
Property Value Source logP -0.77 Chemaxon pKa (Strongest Acidic) 3.09 Chemaxon Физиологический заряд 1 Хемаксон Подсчет акцепторов водорода 0 Хемаксон Hydrogen Donor Count 0 Chemaxon Polar Surface Area 0 Å 2 Chemaxon Rotatable Bond Count 0 Chemaxon Refractivity 0 m 3 ·mol -1 Chemaxon Polarizability 1.  78 Å 3
78 Å 3 Chemaxon Number of Rings 0 Chemaxon Bioavailability 1 Chemaxon Rule of Five Yes Chemaxon Ghose Filter No Chemaxon Veber’s Rule Да Chemaxon Правило, подобное MDDR Нет Chemaxon - Прогнозируемые функции ADMET
- недоступен
- Mass Spec (NIST)
- Недоступно
- Spectra
- Недоступно
Препарат, созданный в декабре 03, 2015 16:51 / Обновлен по адресу 12, 2020 16:53
00 Оценка механических свойств сульфидных стеклянных электролитов Na2S–P2S5
Масаси Нос, и Ацутака Като, и Ацуши Сакуда, б Акитоши Хаяши* и и Масахиро Тацумисаго и
Принадлежности автора
* Соответствующие авторы
и Кафедра прикладной химии, Высшая инженерная школа, Университет префектуры Осака, 1-1 Гакуэнчо, Нака-ку, Сакаи, Осака 599-8531, Япония
Электронная почта: hayashi@chem. osakafu-u.ac.jp
osakafu-u.ac.jp
Факс: +81-72-2549910
Тел.: +81-72-2549334
б Департамент энергетики и окружающей среды, Научно-исследовательский институт электрохимической энергии, Национальный институт передовых промышленных наук и технологий (AIST), 1-8-31 Мидоригаока, Икеда, Осака 563-8577, Япония
Аннотация
Механические свойства, такие как формуемость и модули упругости твердых электролитов, важны для изготовления полностью твердотельных аккумуляторов и сохранения их зарядно-разрядной емкости. В этой статье x NA 2 S · (100 — x ) P 2 S 5 (MOL%) SULFIDE ELECTROLITES (.


 2S,
2S,

 е. ΔHf>0) из приведенных выше расчетов.
е. ΔHf>0) из приведенных выше расчетов. Сульфид натрия используется в целлюлозно-бумажной промышленности, при очистке воды, в текстильной промышленности и в различных химических производственных процессах, включая производство резиновых химикатов, сернистых красителей и нефтедобычи. Вместе с гидратной формой сульфид натрия выделяет сероводород (h3S) при контакте с влажным воздухом. h3S является эндогенным газообразным медиатором, обладающим противовоспалительными и антиапоптотическими свойствами. Наряду с другими сульфидами противовоспалительное и тканезащитное действие сульфида натрия исследовано на моделях воспаления и окислительного стресса. Интересно, что сульфид натрия, как было показано, играет некоторую кардиозащитную роль против сердечной ишемии или реперфузионного повреждения, а также защищает легкие от повреждения легких, вызванного вентилятором
Сульфид натрия используется в целлюлозно-бумажной промышленности, при очистке воды, в текстильной промышленности и в различных химических производственных процессах, включая производство резиновых химикатов, сернистых красителей и нефтедобычи. Вместе с гидратной формой сульфид натрия выделяет сероводород (h3S) при контакте с влажным воздухом. h3S является эндогенным газообразным медиатором, обладающим противовоспалительными и антиапоптотическими свойствами. Наряду с другими сульфидами противовоспалительное и тканезащитное действие сульфида натрия исследовано на моделях воспаления и окислительного стресса. Интересно, что сульфид натрия, как было показано, играет некоторую кардиозащитную роль против сердечной ишемии или реперфузионного повреждения, а также защищает легкие от повреждения легких, вызванного вентилятором  04
04 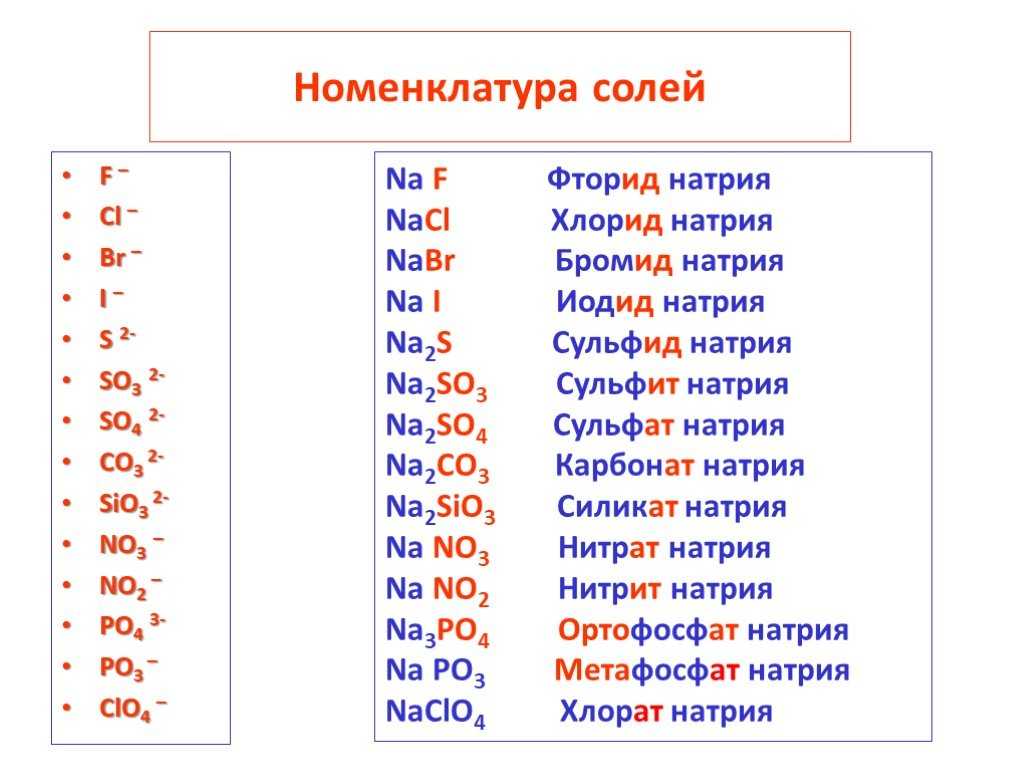


 085 g/8.5g
085 g/8.5g
 Анестезиология. 2011 ноябрь; 115(5):1012-21. doi: 10.1097/ALN.0b013e31823306cf. [Статья]
Анестезиология. 2011 ноябрь; 115(5):1012-21. doi: 10.1097/ALN.0b013e31823306cf. [Статья] 085 g/8.5 г
085 g/8.5 г 78 Å 3
78 Å 3