Лабораторная работа №1 «Сравнение количеств теплоты при смешивании воды разной температуры» (9 слайдов)
Слайд 1
Лабораторная работа №1 Сравнение количеств теплоты при смешивании воды разной температуры.
Слайд 2
Цель работы: определить количество теплоты, отданное горячей водой и полученное холодной при теплообмене, и объяснить полученный результат.
Оборудование: калориметр, мензурка, термометр, стакан.
Примечание Калориметр — прибор, применяемый во многих опытах при тепловых явлениях. Калориметр состоит из двух сосудов, разделенных воздушным промежутком. Дно внутреннего сосуда отделено от внешнего пластмассовой подставкой. Такое устройство позволяет уменьшать теплообмен содержимого внутреннего сосуда с внешней средой.
Слайд 3
Правила охраны труда и техники безопасности
Будьте осторожны при работе с горячей водой. Не разливайте воду – возможны ожоги.
Будьте осторожны при работе со стеклянной посудой (термометр, стакан, мензурка). Помните, стекло – хрупкий материал, легко трескается при ударах и резкой перемене температуры.
Снимайте данные, не вынимая термометр из жидкости!
На столе не должно быть никаких посторонних предметов.
Помните, стекло – хрупкий материал, легко трескается при ударах и резкой перемене температуры.
Снимайте данные, не вынимая термометр из жидкости!
На столе не должно быть никаких посторонних предметов.
Слайд 4
ХОД РАБОТЫ:
Налейте в стакан холодную воду массой 100 г (отмерить мерным стаканом). Измерьте температуру холодной воды. Результаты измерения запишите в таблицу.
Налейте в калориметр горячую воду массой 100 г. Измерьте температуру горячей воды. Результаты измерения запишите в таблицу.
Не вынимая термометра из горячей воды, вылейте холодную воду из стакана в калориметр. Измерьте температуру смеси. Результат измерения запишите в таблицу.
Рассчитайте количество теплоты Qг, отданное горячей водой при остывании до температуры смеси, и количество теплоты Qх полученное холодной водой при нагревании до той же температуры. Используйте формулы Qг = cmг (t2 — tг1) и Qх = cmх (t2 — tх1). Результаты вычислений запишите в таблицу.
Сравните количество теплоты, отданное горячей водой, с количеством теплоты, полученным холодной водой (по модулю). Сделайте вывод.
Сделайте вывод.
Слайд 5
Заполните таблицу
Масса холодной воды
mх кг Температура холодной воды
tх1 °С Количество теплоты, полученное холодной водой Qх Дж Температура смеси
t2 °С Масса горячей воды
mг, кг Температура горячей воды
tг1°С Количество теплоты, отданное горячей водой Qг Дж
0,1 19
34
0,1 53
Слайд 6
Сравните количества теплоты Qг и Qх.
Сделайте соответствующий вывод.
ВЫВОД: _____________________________________________________________________ ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Слайд 7
Ответьте на вопросы:
Каким прибором вы пользовались для определения температуры воды?
Какова цена деления этого прибора?
Какую минимальную температуру можно измерить этим прибором?
Какую максимальную температуру можно измерить этим прибором?
Как определить абсолютную погрешность измерения?
Чему равна абсолютная погрешность измерения?
Слайд 8
Контрольные вопросы:
1. Как определялась в эксперименте масса воды?
2. Почему калориметр имеет двойные стенки?
3. Почему холодную воду надо брать комнатной температуры?
4. Будут ли равными изменения температуры и количество отданной и принятой теплоты, если использовать неравные массы теплой и холодной воды?
Суперзадание: объясните, как влияет на полученные результаты участие в теплообмене калориметра. Всегда ли можно этим влиянием пренебречь?
Как определялась в эксперименте масса воды?
2. Почему калориметр имеет двойные стенки?
3. Почему холодную воду надо брать комнатной температуры?
4. Будут ли равными изменения температуры и количество отданной и принятой теплоты, если использовать неравные массы теплой и холодной воды?
Суперзадание: объясните, как влияет на полученные результаты участие в теплообмене калориметра. Всегда ли можно этим влиянием пренебречь?
Слайд 9
Контрольные вопросы:
1) Как определялась в эксперименте масса воды?
Через плотность по формуле m=pV, т.е. косвенно, без использования весов. Так как плотность воды 1 г/см3, то масса 100 мл = 100 см3 будет 100г = 0,1 кг
2) Почему калориметр имеет двойные стенки?
Чтобы меньше терялась теплота в окружающую среду
3) Почему холодную воду надо брать комнатной температуры?
Чтобы её температура не изменялась из-за влияния воздуха в кабинете, т.к. она же не в калориметре
4) Будут ли равными изменения температуры и количество отданной и принятой теплоты, если использовать неравные массы теплой и холодной воды?
Изменения температуры не будут одинаковыми, а количество отданной и принятой теплоты будут равны
Суперзадание: объясните, как влияет на полученные результаты участие в теплообмене калориметра. Всегда ли можно этим влиянием пренебречь?
Ответ: Уравнение теплового баланса строго выполняется только в том случае, если система теплоизолирована. Хотя калориметр снижает потери энергии, связанные с теплопередачей в окружающую среду, тем не менее они остаются. Кроме того, есть потери за счёт теплообмена между водой и калориметром. Поэтому количество теплоты, отданное теплой водой, будет всегда больше, чем количество теплоты, полученное холодной водой. Если тёплую воду вливать в холодную, то различие между Qотд и Qпол будет больше, чем в случае, когда холодную воду добавляют в тёплую. Это обусловлено тем, что в первом случае потери энергии в окружающую среду будут частично скомпенсированы за счёт количества теплоты, которое холодной воде передают калориметр и термометр.
Таким образом, как это ни кажется странным, проверяемое положение о равенстве отданного и принятого количества теплоты выполнения работы будет подтверждено точнее, если в калориметр наливать сначала холодную воду, а затем доливать горячую (как и указано в работе).
Всегда ли можно этим влиянием пренебречь?
Ответ: Уравнение теплового баланса строго выполняется только в том случае, если система теплоизолирована. Хотя калориметр снижает потери энергии, связанные с теплопередачей в окружающую среду, тем не менее они остаются. Кроме того, есть потери за счёт теплообмена между водой и калориметром. Поэтому количество теплоты, отданное теплой водой, будет всегда больше, чем количество теплоты, полученное холодной водой. Если тёплую воду вливать в холодную, то различие между Qотд и Qпол будет больше, чем в случае, когда холодную воду добавляют в тёплую. Это обусловлено тем, что в первом случае потери энергии в окружающую среду будут частично скомпенсированы за счёт количества теплоты, которое холодной воде передают калориметр и термометр.
Таким образом, как это ни кажется странным, проверяемое положение о равенстве отданного и принятого количества теплоты выполнения работы будет подтверждено точнее, если в калориметр наливать сначала холодную воду, а затем доливать горячую (как и указано в работе). Что касается второй части вопросы, всегда ли можно влиянием калориметра пренебречь? Нет, не всегда. Можно пренебречь тогда, когда удельная теплоёмкость и масса внутреннего стакана калориметра мала по сравнению с массой воды (жидкости) находящейся в калориметре.
Что касается второй части вопросы, всегда ли можно влиянием калориметра пренебречь? Нет, не всегда. Можно пренебречь тогда, когда удельная теплоёмкость и масса внутреннего стакана калориметра мала по сравнению с массой воды (жидкости) находящейся в калориметре.
Лабораторная работа №1. Сравнение количеств теплоты при смешивании воды разной температуры.
Сравнение количеств теплоты при смешивании воды разной температуры.
Цель работы: определить количество теплоты, отданное горячей водой и полученное холодной при теплообмене. Объяснить полученный результат.
Из учебника мы знаем, что при теплопередаче происходит переход энергии от одних тел к другим путем теплопроводности, излучения или конвекции. Энергия, которую получает или отдает тело при теплопередаче, называется количеством теплоты. Мы знаем также, что количество теплоты, необходимое для нагревания тела (или выделяемое им при остывании), зависит от рода вещества, из которого оно состоит, от массы этого тела и от изменения его температуры.
Итак, понятно, что в процессе теплопередачи между двумя телами их температуры стремятся уравняться. Тело с более высокой температурой отдает некоторое количество теплоты, а тело с более низкой температурой получает это количество теплоты. Причем в идеальных условиях, когда два этих тела абсолютно изолированы от всего на свете, переданное количество теплоты должно быть равно полученному согласно закону сохранения энергии.
Однако, условия проводимого нами эксперимента безусловно далеки от идеальных. От горячей воды тепло передается не только холодной воде, но и калориметру, термометру, окружающему воздуху. Тем не менее, хотя мы и не получим входе эксперимента полного соответствия отданного количества теплоты полученному, эти показатели, если эксперимент выполнен аккуратно, должны быть близки. Ход работы описан в учебнике.
Пример выполнения работы.
Вычисления:
Количество теплоты, отданное горячей водой — 12600Дж.
Количество теплоты, полученное холодной водой — 10920Дж.
Вывод: Количество теплоты, полученное холодной водой близко к количеству теплоты, отданному горячей водой, что, с учетом далеких от идеальных условий эксперимента, можно считать равенством.
1) Как определялась в эксперименте масса воды?
Через плотность по формуле m=pV, т.е. косвенно, без использования весов. Так как плотность воды 1 г/см3, то масса 100 мл = 100 см3 будет 100г = 0,1 кг
2) Почему калориметр имеет двойные стенки?
Чтобы меньше терялась теплота в окружающую среду
3) Почему холодную воду надо брать комнатной температуры?
Чтобы её температура не изменялась из-за влияния воздуха в кабинете, т.к. она же не в калориметре
4) Будут ли равными изменения температуры и количество отданной и принятой теплоты, если использовать неравные массы теплой и холодной воды?
Изменения температуры не будут одинаковыми, а количество отданной и принятой теплоты будут равны
Суперзадание: объясните, как влияет на полученные результаты участие в теплообмене калориметра. Всегда ли можно этим влиянием пренебречь?
Всегда ли можно этим влиянием пренебречь?
Ответ: Уравнение теплового баланса строго выполняется только в том случае, если система теплоизолирована. Хотя калориметр снижает потери энергии, связанные с теплопередачей в окружающую среду, тем не менее они остаются. Кроме того, есть потери за счёт теплообмена между водой и калориметром. Поэтому количество теплоты, одданное теплой водой, будет всегда больше, чем количество теплоты, полученное холодной водой. Если тёплую воду вливать в холодную, то различие между Qотд и Qпол будет больше, чем в случае, когда холодную воду добавляют в тёплую. Это обусловлено тем, что в первом случае потери энергии в окружающую среду будут частично скомпенсированы за счёт количества теплоты, которое холодной воде передают калориметр и термометр.
Таким образом, как это ни кажется странным, проверяемое положение о равенстве отданного и принятого количества теплоты выполнения работы будет подтверждено точнее, если в калориметр наливать сначала холодную воду, а затем доливать горячую (как и указано в работе).
Что касается второй части вопросы, всегда ли можно влиянием калориметра пренебречь? Нет, не в сегда. Можно пренебречь тогда, когда удельная теплоёмкость и масса внутреннего стакана калориметра мала по сравнению с массой воды (жидкости) находящейся в калориметре.
Источник:
Решебник
по
физике
за 8 класс (А.В.Перышкин, Н.А.Родина, 1998 год),
задача №1
к главе «Лабораторные работы
Все задачи
← Введение
Лабораторная работа №2. Измерение удельной теплоемкости твердого тела. →
Лаборатория 4 – Калориметрия
Цель
Определить, обеспечивает ли чашечный калориметр из пенополистирола достаточную изоляцию для измерения теплопередачи, идентифицировать неизвестный металл с помощью его теплоемкости и определить теплоту нейтрализации и теплоту растворения.
Цели
1
Проводить простые калориметрические эксперименты.2
Использовать результаты калориметрии для расчета удельной теплоемкости неизвестного металла.3
Определить теплоту реакции (ΔH) по калориметрическим измерениям.
Введение
Теплота и работа — два наиболее распространенных способа обмена энергией с окружающей средой. Работа в реакциях, в которых не участвуют газы, равна нулю, поэтому все изменение энергии приводит к теплу. Количество тепла, поступающего в окружающую среду или выходящего из нее, определяется с помощью метода, называемого калориметрией (измерение тепла). Калориметр состоит из изолированного контейнера, термометра, массы воды и исследуемой системы. Использование изолированного контейнера (в данном эксперименте – пенопластового стакана) позволяет предположить, что через стенки калориметра тепло не передается.
( 1 )
q sys = -q sur
Напомним, что q > 0 означает, что тепло поступает в систему, а q
( 2 )
q sur = q вода
Тепло, которое обменивается с водой, вызывает изменение температуры ΔT воды в воде, как показано в уравнении 3.
( 3 )
q вода = C вода · ΔT вода
где С вода – теплоемкость воды, количество теплоты, необходимое для повышения температуры воды на 1°С. Единицами C являются Дж/°C.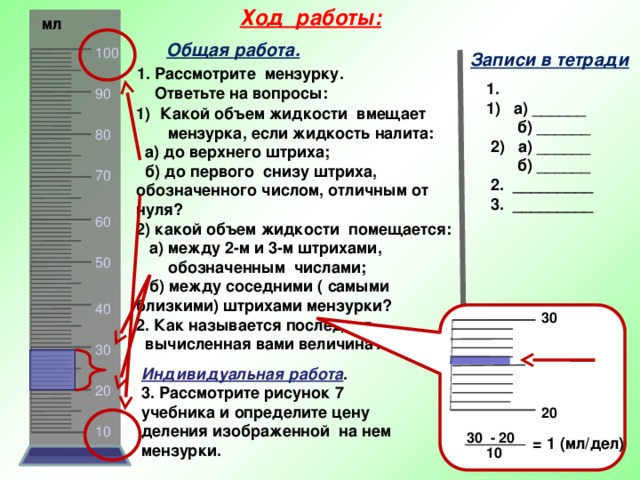 ΔT представляет собой изменение температуры, определяемое как ΔT = T конечное — T начальное . Теплоемкость зависит от массы образца, поэтому вместо нее часто используется удельная теплоемкость, количество тепла, необходимое для повышения температуры одного грамма вещества на 1°C. Символ удельной теплоемкости — s. Удельная теплоемкость воды 4,18 Дж/г·°С. Теплоемкость воды равна произведению массы воды на удельную теплоемкость воды, т. е. C
ΔT представляет собой изменение температуры, определяемое как ΔT = T конечное — T начальное . Теплоемкость зависит от массы образца, поэтому вместо нее часто используется удельная теплоемкость, количество тепла, необходимое для повышения температуры одного грамма вещества на 1°C. Символ удельной теплоемкости — s. Удельная теплоемкость воды 4,18 Дж/г·°С. Теплоемкость воды равна произведению массы воды на удельную теплоемкость воды, т. е. C
( 4 )
q вода = м вода · с вода · ΔT вода
Наконец, уравнения 1, 2 и 3 можно объединить в уравнение калориметрии:
( 5 )
q sys = -m вода ·s вода ·ΔT вода = -m вода ·(4,18 Дж/г·°C)·ΔT вода
В предыдущем обсуждении мы предположили, что вся теплопередача связана с водой в калориметре и что калориметрический прибор (стакан из пенопласта, воздух внутри, термометр и т.
( 6 )
m теплая вода ·s теплая вода ·ΔT теплая вода = -m холодная вода ·s холодная вода ·ΔT 4 0 холодная вода Будет измерено изменение массы и температуры как теплой, так и холодной воды. Если наше предположение, что калориметрический аппарат не участвует в передаче тепла, верно, то обе части уравнения должны быть равны. Степень, в которой они отличаются от равенства, даст оценку справедливости предположения. В части B этой лабораторной работы система представляет собой неизвестный металл, и мы можем написать:
( 7 )
m металл ·s металл ·ΔT металл = -m вода ·s вода ·ΔT вода 5  По этим значениям можно рассчитать удельную теплоемкость металла. В этот эксперимент включена таблица удельных теплоемкостей металлов, чтобы вы могли идентифицировать металл. В реакциях, проводимых при постоянном давлении, теплота, которая поглощается или выделяется, называется теплотой или энтальпией реакции (ΔH). Энтальпия реакции является результатом разности потенциальных энергий реагентов и продуктов. Знак ΔH указывает направление теплового потока. Если ΔH 0 (потенциальная энергия реагентов меньше, чем у продуктов), тепло поглощается и реакция эндотермическая. В части C лаборатории система представляет собой кислотно-щелочную реакцию «нейтрализации».
По этим значениям можно рассчитать удельную теплоемкость металла. В этот эксперимент включена таблица удельных теплоемкостей металлов, чтобы вы могли идентифицировать металл. В реакциях, проводимых при постоянном давлении, теплота, которая поглощается или выделяется, называется теплотой или энтальпией реакции (ΔH). Энтальпия реакции является результатом разности потенциальных энергий реагентов и продуктов. Знак ΔH указывает направление теплового потока. Если ΔH 0 (потенциальная энергия реагентов меньше, чем у продуктов), тепло поглощается и реакция эндотермическая. В части C лаборатории система представляет собой кислотно-щелочную реакцию «нейтрализации».
(8)
NH 3 (AQ) + H 3 PO 4 (AQ) NH 4 + (AQ) + H 2 PO 4 — 2 PO 4 — 2 PO 4 — 2 PO 4 — 2 PO 4 — 2 PO 4 — 2 . )
)
В части D лаборатории система представляет собой растворение соли.
(9)
NH 4 H 2 PO 4 (S) NH 4 + (AQ) + H 2 PO 4 —8 (AQ) 4
Поскольку эти системы являются реакциями,
( 10 )
ΔH = -m вода ·с вода ·ΔT вода
ΔH, полученное для реакции 8, называется «теплотой нейтрализации», а значение, определенное для реакции 9, называется «теплотой растворения». Технически эта кислотно-щелочная реакция не является нейтрализацией, так как продукты представляют собой не соль и воду, а скорее слабую кислоту и слабое основание. Обратите внимание, что термины «энтальпия» и «тепло» являются синонимами, и химики используют их взаимозаменяемо. Таким образом, «теплота реакции» и «энтальпия реакции» означают одно и то же. Изменения энтальпии реакций зависят от количества используемых реагентов — подумайте о разнице между взрывом динамитной шашки и динамитной шашки! Чтобы сравнить энергетику различных реакций, данные ΔH из калориметрии обычно преобразуют в «молярные энтальпии», ΔH, которые можно было бы измерить, если бы реакция проводилась в масштабе одного моля. Анализ единиц в приведенных выше уравнениях калориметрии показывает, что ΔH выражается в джоулях. Преобразование в молярную энтальпию требует определения количества молей соединения, которое прореагировало. Например, если при растворении 0,20 моля соединения выделяется 500 Дж тепла, то молярная энтальпия будет:
Обратите внимание, что термины «энтальпия» и «тепло» являются синонимами, и химики используют их взаимозаменяемо. Таким образом, «теплота реакции» и «энтальпия реакции» означают одно и то же. Изменения энтальпии реакций зависят от количества используемых реагентов — подумайте о разнице между взрывом динамитной шашки и динамитной шашки! Чтобы сравнить энергетику различных реакций, данные ΔH из калориметрии обычно преобразуют в «молярные энтальпии», ΔH, которые можно было бы измерить, если бы реакция проводилась в масштабе одного моля. Анализ единиц в приведенных выше уравнениях калориметрии показывает, что ΔH выражается в джоулях. Преобразование в молярную энтальпию требует определения количества молей соединения, которое прореагировало. Например, если при растворении 0,20 моля соединения выделяется 500 Дж тепла, то молярная энтальпия будет:
( 11 )
| 500 Дж |
| 0,20 моль |
5
45
45 В части А этого эксперимента вы проверите предположение, что калориметр с пенопластовой чашкой достаточно хорошо изолирует систему (исследуемая реакция) и окружающую среду (воду), чтобы можно было надежно измерить теплопередачу.
В Части B вы идентифицируете неизвестный металл, измерив его удельную теплоемкость и сравнив результат со значениями для металлов известной идентичности. В части C вы измерите теплоту нейтрализации реакции фосфорной кислоты и аммиака. В части D вы измерите теплоту раствора фосфата аммония. Оборудование
1
стакан 400 мл 2
Стаканы из пенопласта с крышкой 1
Пробирка 18 х 150 мм 1
держатель для пробирок 1
стакан 150 мл 1
стакан 250 мл 1
стакан 50 мл 2
Градуированные цилиндры на 100 мл 1
горячая тарелка 1
Интерфейс Микролаб 1
Инструкция по эксплуатации термистора MicroLab 1
термистор 1
бутылка с деионизированной водой
Реактивы
~20 г
металлические неизвестные ~50 мл
1,5 М NH 3 ~50 мл
1,5 М В 3 Заказ на покупку 4 ~10 г
NH 4 H 2 Заказ на покупку 4 - деионизированная вода
Безопасность
Фосфорная кислота вызывает коррозию. Он может поражать кожу, вызывать необратимое повреждение глаз и вызывать ожоги. При попадании на кожу или одежду пораженный участок следует немедленно промыть водой. Попросите вашего партнера по лаборатории уведомить инструктора о разливе. Аммиак раздражает дыхательные пути. Не вдыхайте пары. Если вы вдыхаете достаточно паров аммиака, чтобы вызвать дискомфорт, выйдите на свежий воздух. Попросите вашего партнера сообщить лаборанту о проблеме. Студенты будут иметь доступ к перчаткам из-за использования концентрированных растворов кислот и оснований во время лабораторного периода.
Он может поражать кожу, вызывать необратимое повреждение глаз и вызывать ожоги. При попадании на кожу или одежду пораженный участок следует немедленно промыть водой. Попросите вашего партнера по лаборатории уведомить инструктора о разливе. Аммиак раздражает дыхательные пути. Не вдыхайте пары. Если вы вдыхаете достаточно паров аммиака, чтобы вызвать дискомфорт, выйдите на свежий воздух. Попросите вашего партнера сообщить лаборанту о проблеме. Студенты будут иметь доступ к перчаткам из-за использования концентрированных растворов кислот и оснований во время лабораторного периода.
Удаление отходов
Все растворы можно смыть в раковину большим количеством воды. Не кладите металлические образцы в раковину. Верните их на боковую полку в соответствующих контейнерах.
До класса
Пожалуйста, просмотрите следующее видео:
- Безопасность
Пожалуйста, выполните предварительное лабораторное задание WebAssign. Проверьте сроки выполнения в своей учетной записи WebAssign. Учащиеся, не завершившие предварительную лабораторную работу WebAssign, должны принести и сдать лист предварительной лабораторной работы.
Проверьте сроки выполнения в своей учетной записи WebAssign. Учащиеся, не завершившие предварительную лабораторную работу WebAssign, должны принести и сдать лист предварительной лабораторной работы.
Лабораторная процедура
Пожалуйста, распечатайте рабочий лист для этой лабораторной работы. Этот лист понадобится вам для записи ваших данных.
Часть A. Проверка предположения об изоляции
1
Запустите интерфейс MicroLab и откалибруйте термистор, как описано в инструкциях MicroLab, представленных в лаборатории.
2
Установите приращение сбора MicroLab на 5 секунд, используя подробные инструкции, приведенные в лабораторной работе.
3
Отмерьте около 40 мл деионизированной воды с помощью мерного цилиндра, добавьте в химический стакан на 150 мл и нагрейте до температуры от 60 до 70°C. Работайте над шагами 4 и 5, пока вода нагревается.
Работайте над шагами 4 и 5, пока вода нагревается.
4
Взвесьте и запишите массу двух вложенных пенопластовых стаканов и крышки в таблицу данных А.
Таблица A: Проверка предположения об изоляции
5
Добавьте около 60 мл деионизированной воды с помощью мерного цилиндра, повторно взвесьте чашки, крышку и воду и запишите эту массу в таблицу данных А. Рассчитайте и запишите массу «холодной воды».
6
Настройте калориметр следующим образом: поместите вложенные чашки в химический стакан на 400 мл, чтобы содержимое не пролилось. Плотно закройте чашку крышкой.
7
Когда температура теплой воды составляет от 60 до 70°C, вы готовы к измерению температуры. Вставьте термистор в теплую воду; начать сбор данных MicroLab. Измерьте температуру теплой воды и запишите ее в таблицу данных А.
8
Измерьте температуру воды в калориметре (холодная вода), вставив термистор через отверстие в крышке чашки. Когда крышка находится на чашке, термистор не должен касаться стенок или дна чашки. Держите чашку плотно закрытой крышкой во время измерений, чтобы весь теплообмен происходил внутри чашки. Запишите эту температуру в таблицу данных А.
9
Откройте калориметр и быстро налейте в него теплую воду. Будьте осторожны, чтобы вода не разбрызгивалась из чашки, иначе вы потеряете точность. Замените крышку калориметра. Осторожно взболтайте воду, чтобы не расплескать и не пролить воду. Запишите температуру смеси в Таблицу данных А, как только она станет стабильной, примерно через 30 секунд после смешивания.
10
Повторно взвесьте сборку и запишите массу в Таблицу данных А. Рассчитайте и запишите массу добавленной теплой воды.
Вопрос 1: Когда смешиваются холодная и теплая вода, как вы ожидаете, ΔT холодной воды и ΔT теплой воды будут иметь одинаковое значение или разные значения? Как насчет q для холодной воды и q для теплой воды ?
Вопрос 2: Рассчитайте ΔT холодной воды , ΔT теплой воды , q холодной воды и q теплой воды . Показать свою работу.
Показать свою работу.
Часть B: Идентификация неизвестного металла по удельной теплоемкости
1
Сделать кипящую водяную баню с 100-150 мл воды в стакане на 250 мл на плите. Пока он нагревается, выполните следующие действия.
2
Запишите номер неизвестного металла, который вы используете, в Таблицу данных B.
3
Взвесьте и запишите массу неизвестного металла в Таблицу данных В.
4
Поместите металл в пробирку и поместите пробирку в стакан на 250 мл с кипящей водой.
5
Опустошите и высушите калориметр из Части А, затем добавьте в калориметр примерно 40 мл воды.
6
Взвесьте и запишите массу чашек, крышки и воды в Таблицу данных B. Рассчитайте и запишите массу воды.
7
Пока металл продолжает нагреваться, ответьте на следующие вопросы.
Вопрос 3: Посоветуйтесь с партнером по лаборатории и инструктором. В этом эксперименте, что такое система и что такое окружение?
Вопрос 4: Когда смешаны металл и вода, как вы ожидаете, ΔT металла и ΔT воды будут одинаковыми или разными?
Вопрос 5: Когда металл и вода смешаны, вы ожидаете, что q металл и q вода будут одинаковыми или разными?
8
Измерьте температуру воды в калориметре и запишите ее в таблицу данных В.
9
После того, как металл находился в кипящей воде в течение 5-6 минут, можно с уверенностью предположить, что металл имеет температуру воды. Измерьте эту температуру и запишите ее в таблицу данных B.
Измерьте эту температуру и запишите ее в таблицу данных B.
10
Используя держатель для пробирок, чтобы не обжечься, выньте пробирку и осторожно, но быстро залейте металл в калориметр. Быстро заменить крышку. Будьте осторожны, чтобы вода не разбрызгивалась из чашки. Аккуратно взболтайте воду.
11
Считайте температуру смеси, как только она станет стабильной, и запишите ее в Таблицу данных В.
Таблица B: Идентификация неизвестного металла по удельной теплоемкости
Вопрос 6: Рассчитайте удельную теплоемкость металла. Показать свою работу.
Вопрос 7: Что такое металл? См. таблицу ниже.
Часть C: Теплота нейтрализации
1
Опорожните и высушите калориметр из Части B.
2
Мерным цилиндром отмерьте точно 50,0 мл 1,50 М NH 3 и добавьте раствор в пустой сухой калориметр.
3
Отмерьте ровно 50,0 мл 1,50 М H 3 PO 4 в другой мерный цилиндр.
4
Накройте калориметр и вставьте термистор. Измерьте начальную температуру и запишите это значение в Таблицу данных C. Раствор NH 3 должен иметь ту же температуру, что и раствор
H 3 PO 4
, таким образом, одно показание будет служить начальным значением. температура у обоих.
5
Поднимите крышку калориметра, добавьте кислоту и быстро закройте крышку. Мягко вращайте. Когда температура перестанет изменяться (вскоре после смешивания), запишите эту температуру как температуру смешанного раствора в таблице данных C.
6
Взвесьте и запишите массу чашек, крышки и раствора в Таблицу данных C. Рассчитайте массу смешанного раствора и раствора фосфорной кислоты.
Таблица C: Теплота нейтрализации
Вопрос 8: Что такое ΔH для этой реакции? Показать свою работу.
Вопрос 9a: Используя объем и концентрацию, сколько молей
NH 3
и H 3 PO 4 смешали вместе?
Вопрос 9b: Каково молярное значение ΔH для этой реакции? Показать свою работу.
Вопрос 10 Рассчитайте количество NH 4 H 2 PO 4 , полученное в Части C, в граммах.
Часть D: Тепло растворения
1
После тщательного ополаскивания и сушки калориметра отмерьте 100,0 мл деионизированной воды в чистом градуированном цилиндре и добавьте его в калориметр.
2
Запишите массу прибора и воды в Таблицу данных D. Рассчитайте массу воды в калориметре.
Таблица D: Теплота раствора
3
Тарируйте чистую, сухую мензурку на 50 мл. Взвесьте количество NH 4 H 2 PO 4 , которое вы рассчитали в вопросе 10, в химический стакан на 50 мл и запишите точную массу, которую вы получили, в таблице данных D.
4
Закройте калориметр, вставьте термистор и запишите начальную температуру воды в Таблицу данных D.
5
Поднимите крышку, выгрузите твердое вещество в калориметр и быстро закройте крышку. Мягко вращайте. Для растворения твердого вещества может потребоваться минута или две. Продолжайте вращать до тех пор, пока температура не перестанет меняться. Запишите эту температуру как температуру раствора в таблице данных D.
Мягко вращайте. Для растворения твердого вещества может потребоваться минута или две. Продолжайте вращать до тех пор, пока температура не перестанет меняться. Запишите эту температуру как температуру раствора в таблице данных D.
6
После последнего измерения выберите на экране стоп и закройте программу MicroLab. Слейте раствор в канализацию с большим количеством воды. Промойте всю стеклянную посуду и калориметр водой, высушите их и верните на место установки, где вы их нашли.
Вопрос 11: Посоветуйтесь с партнером по лаборатории и инструктором. В этом эксперименте, что такое система и что такое окружение?
Вопрос 12: Как, по вашему мнению, молярное изменение энтальпии (ΔH) этой реакции будет сравниваться с теплотой нейтрализации в части C? (Если вы хотите проверить, рассчитайте его сейчас. Вам будет предложено ввести значение в постлабораторном упражнении WebAssign.)
Вам будет предложено ввести значение в постлабораторном упражнении WebAssign.)
7
Перед отъездом введите свои результаты в лабораторном задании. Если все результаты признаны правильными, выйдите из системы. Если не все результаты верны, попробуйте найти ошибку или проконсультируйтесь с лаборантом. Если все результаты правильные, запишите их и выйдите из WebAssign. Лабораторное задание должно быть выполнено к концу лабораторного периода. Если требуется дополнительное время, проконсультируйтесь с преподавателем лаборатории.
Плотность воды | Глава 3: Плотность
- Скачать
- Электронная почта
- Распечатать
- Добавить в закладки или поделиться
Тебе это нравится? Не нравится ? Пожалуйста, найдите время, чтобы поделиться с нами своими отзывами. Спасибо!
Урок 3.3
Основные понятия
- Жидкости, как и твердые тела, также имеют собственную плотность.

- Объем жидкости можно измерить непосредственно мерным цилиндром.
- Молекулы разных жидкостей имеют разный размер и массу.
- Масса и размер молекул жидкости, а также то, насколько плотно они упакованы вместе, определяют плотность жидкости.
- Как и твердое тело, плотность жидкости равна массе жидкости, деленной на ее объем; Д = м/об.
- Плотность воды 1 грамм на кубический сантиметр.
- Плотность вещества одинакова независимо от размера образца.
Резюме
Учащиеся измеряют объем и массу воды, чтобы определить ее плотность. Затем они измеряют массу различных объемов воды и обнаруживают, что плотность всегда одинакова. Учащиеся строят график зависимости объема и массы воды.
Цель
Учащиеся смогут измерить объем и массу воды и вычислить ее плотность. Учащиеся смогут объяснить, что, поскольку любой объем воды всегда имеет одинаковую плотность при данной температуре, эта плотность является характерным свойством воды.
Оценка
Загрузите лист с заданиями учащегося и раздайте по одному учащемуся, если это указано в задании. Рабочий лист будет служить компонентом «Оценить» каждого плана урока 5-E.
Безопасность
Убедитесь, что вы и ваши ученики носите подходящие защитные очки.
Материалы для каждой группы
- Градуированный цилиндр, 100 мл
- Вода
- Весы в граммах (могут измерять более 100 г)
- Пипетка
Демонстрационные материалы
- Вода
- Два одинаковых ведра или больших контейнера
Проведите демонстрацию, чтобы представить идею плотности воды.
Материалы
- Вода
- Два одинаковых ведра или больших контейнера
Подготовка учителя
Наполните одно ведро наполовину, а в другое добавьте примерно 1 стакан воды.
Процедура
- Выберите ученика, который поднимет оба ведра с водой.

- Спросите у студента-добровольца, какое ведро имеет большую массу.
Ожидаемые результаты
Ведро, в котором больше воды, имеет большую массу.
Спросите студентов:
- В уроках 3.1 — Что такое плотность? и 3.2 — Метод вытеснения воды, вы нашли плотность твердых тел, измерив их массу и объем. Как вы думаете, может ли жидкость, например вода, иметь плотность?
- Учащиеся должны понять, что вода имеет объем и массу. Поскольку D=m/v, вода также должна иметь плотность.
- Как, по-вашему, можно найти плотность такой жидкости, как вода?
- Не ожидается, что учащиеся смогут полностью ответить на этот вопрос на данном этапе. Он задуман как повод к расследованию. Но учащиеся могут понять, что сначала им нужно каким-то образом найти массу и объем воды.
- Могут ли маленькое и большое количество воды, поднятые вашим одноклассником, иметь одинаковую плотность?
- Учащиеся могут указать, что ведро с большим количеством воды имеет большую массу, но больший объем.
 Ведро с меньшей массой имеет меньший объем. Поэтому возможно, что разное количество воды может иметь одинаковую плотность.
Ведро с меньшей массой имеет меньший объем. Поэтому возможно, что разное количество воды может иметь одинаковую плотность.
Раздайте каждому учащемуся лист с заданиями.
Учащиеся записывают свои наблюдения и отвечают на вопросы о задании в листе задания. Разделы «Объясните это с помощью атомов и молекул» и «Воспримите это» в листе с заданиями будут выполняться в классе, в группах или индивидуально в зависимости от ваших инструкций. Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Обсудите с учащимися, как найти объем и массу воды.
Скажите учащимся, что они попытаются определить плотность воды.
Спросите студентов:
- Какие две вещи нужно знать, чтобы найти плотность воды?
- Учащиеся должны понимать, что им нужны как объем, так и масса образца воды, чтобы найти ее плотность. 907:50
- Как можно измерить объем воды?
- Предложите учащимся использовать мерный цилиндр для измерения объема в миллилитрах.
 Напомните учащимся, что каждый миллилитр равен 1 см 3 .
Напомните учащимся, что каждый миллилитр равен 1 см 3 . - Как можно измерить массу воды?
- Предложите учащимся использовать весы для измерения массы в граммах. Скажите учащимся, что они могут найти массу, взвесив воду. Однако, поскольку вода является жидкостью, она должна находиться в каком-то контейнере. Таким образом, чтобы взвесить воду, они также должны взвесить контейнер. Объясните учащимся, что им придется вычесть массу пустого мерного цилиндра из массы цилиндра и воды, чтобы получить массу только воды. 907:50
Предложите учащимся найти массу различных объемов воды, чтобы показать, что плотность воды не зависит от размера образца.
Вопрос для расследования
Имеют ли разное количество воды одинаковую плотность?
Материалы для каждой группы
- Градуированный цилиндр, 100 мл
- Вода
- Весы в граммах (могут измерять более 100 г)
- Пипетка
Процедура
- Найдите массу пустого мерного цилиндра.
 Запишите массу в граммах в таблице на рабочем листе.
Запишите массу в граммах в таблице на рабочем листе. Налейте 100 мл воды в мерный цилиндр. Постарайтесь быть максимально точным, убедившись, что мениск находится прямо на отметке 100 мл. Используйте пипетку, чтобы добавить или удалить небольшое количество воды.
- Взвесьте мерный цилиндр с водой. Запишите массу в граммах.
- Найдите массу только воды, вычитая массу пустого градуированного цилиндра. Запишите массу 100 мл воды в таблицу.
- Используйте массу и объем воды для расчета плотности. Запишите плотность в г/см 3 в таблицу.
- Сливайте воду, пока в мерном цилиндре не будет 50 мл воды. Если вы случайно вылили слишком много, добавляйте воду, пока не дойдете до 50 мл.
Найдите массу 50 мл воды. Запишите массу в лист активности. Рассчитайте и запишите плотность.
- Затем слейте воду, пока в мерном цилиндре не будет 25 мл воды. Найдите массу 25 мл воды и запишите ее в таблицу. Рассчитайте и запишите плотность.

Таблица 1. Нахождение плотности различных объемов воды. Объем воды 100 миллилитров 50 миллилитров 25 миллилитров Масса мерного цилиндра + вода (г) Масса пустого мерного цилиндра (г) Масса воды (г) Плотность воды (г/см 3 )
Ожидаемые результаты
Плотность воды должна быть близка к 1 г/см 3 . Это верно для 100, 50 или 25 мл.
Спросите студентов:
- Посмотрите на свои значения плотности на диаграмме.
 Одинакова ли плотность различных объемов воды?
Одинакова ли плотность различных объемов воды? - Помогите учащимся увидеть, что большинство различных значений плотности близки к 1 г/см 3 . Они могут задаться вопросом, почему не все их значения точно равны 1 г/см 3 . Одной из причин может быть неточность измерения. Другая причина заключается в том, что плотность воды меняется в зависимости от температуры. Вода имеет наибольшую плотность при 4 °C и при этой температуре имеет плотность 1 г/см 3 . При комнатной температуре, около 20–25 °C, плотность составляет около 0,99 г/см 3 .
- Какова плотность воды в г/см3?
- Ответы учащихся могут различаться, но в основном их значения должны быть около 1 г/см 3 .
Предложите учащимся начертить свои результаты.
Помогите учащимся построить график данных на листе с заданиями. По оси x должен быть объем, а по оси y масса.
Когда учащиеся наносят свои данные на график, должна быть прямая линия, показывающая, что при увеличении объема масса увеличивается на ту же величину.
Обсудите наблюдения учащихся, данные и графики.
Спросите студентов:
- Используйте свой график, чтобы найти массу 40 мл воды. Какова плотность этого объема воды?
- Масса 40 мл воды равна 40 граммам. Поскольку D = m/v и mL = см 3 , плотность воды составляет 1 г/см 3 .
- Выберите объем от 1 до 100 мл. Используйте свой график, чтобы найти массу. Какова плотность этого объема воды?
- Независимо от того, весят ли студенты 100, 50, 25 мл или любое другое количество, плотность воды всегда будет равна 1 г/см 3 .
Скажите учащимся, что плотность – это характерное свойство вещества. Это означает, что плотность вещества одинакова независимо от размера образца.
Спросите студентов:
- Является ли плотность характерным свойством воды? Откуда вы знаете?
- Плотность является характеристическим свойством воды, поскольку плотность любой пробы воды (при одной и той же температуре) всегда одинакова.
 Плотность 1 г/см 3 .
Плотность 1 г/см 3 .
Объясните, почему плотность пробы воды любого размера всегда одинакова.
Спроецируйте изображение Плотность воды.
Молекулы воды имеют одинаковую массу и размер. Молекулы воды также упакованы довольно близко друг к другу. Они упакованы одинаково во всей пробе воды. Итак, если объем воды имеет определенную массу, удвоенный объем будет иметь удвоенную массу, трехкратный объем будет иметь трехкратную массу и т. д. Независимо от того, какой размер пробы воды вы измеряете, соотношение между массой и объемом всегда будет одинаковым. Поскольку D=m/v, плотность одинакова для любого количества воды.
Проект анимации «Жидкая вода».
Молекулы воды всегда в движении. Но в среднем они упакованы везде одинаково. Следовательно, соотношение между массой и объемом одинаково, что делает плотность одинаковой. Это верно независимо от размера выборки или места, откуда вы ее выбираете.
Предложите учащимся подумать, равна ли плотность большого куска твердого вещества плотности меньшего куска.

Дайте учащимся время рассчитать плотность каждого из трех образцов, нарисованных на листе с заданиями, и ответить на соответствующие вопросы.
Спросите студентов:
- Плотность жидкости не зависит от размера образца. Может ли это быть верно и для твердых тел? Рассчитайте плотность каждого из трех образцов, чтобы выяснить это.
- Да. Плотность твердого вещества одинакова независимо от размера образца. 907:50
- Образец А имеет массу 200 г. Какова плотность образца А?
- Д = м/об
- D = 200 г/100 см 3
- D = 2 г/см 3
- Если вы разрежете образец A пополам и осмотрите только одну половину, вы получите образец B. Какова плотность образца B?
- Если учащиеся не знают, что такое масса, скажите им, что это половина массы образца A. Поскольку образец A весит 200 г, образец B составляет половину объема и, следовательно, половину массы (100 г). 907:50
- Д = м/об
- D = 100 г/50 см 3
- D = 2 г/см 3
- Если вы разрежете образец B пополам, вы получите образец C.

1
стакан 400 мл2
Стаканы из пенопласта с крышкой1
Пробирка 18 х 150 мм1
держатель для пробирок1
стакан 150 мл1
стакан 250 мл1
стакан 50 мл2
Градуированные цилиндры на 100 мл1
горячая тарелка1
Интерфейс Микролаб1
Инструкция по эксплуатации термистора MicroLab1
термистор1
бутылка с деионизированной водой~20 г
металлические неизвестные~50 мл
1,5 М NH 3~50 мл
1,5 М В 3 Заказ на покупку 4~10 г
NH 4 H 2 Заказ на покупку 4 Он может поражать кожу, вызывать необратимое повреждение глаз и вызывать ожоги. При попадании на кожу или одежду пораженный участок следует немедленно промыть водой. Попросите вашего партнера по лаборатории уведомить инструктора о разливе. Аммиак раздражает дыхательные пути. Не вдыхайте пары. Если вы вдыхаете достаточно паров аммиака, чтобы вызвать дискомфорт, выйдите на свежий воздух. Попросите вашего партнера сообщить лаборанту о проблеме. Студенты будут иметь доступ к перчаткам из-за использования концентрированных растворов кислот и оснований во время лабораторного периода.
Он может поражать кожу, вызывать необратимое повреждение глаз и вызывать ожоги. При попадании на кожу или одежду пораженный участок следует немедленно промыть водой. Попросите вашего партнера по лаборатории уведомить инструктора о разливе. Аммиак раздражает дыхательные пути. Не вдыхайте пары. Если вы вдыхаете достаточно паров аммиака, чтобы вызвать дискомфорт, выйдите на свежий воздух. Попросите вашего партнера сообщить лаборанту о проблеме. Студенты будут иметь доступ к перчаткам из-за использования концентрированных растворов кислот и оснований во время лабораторного периода. Проверьте сроки выполнения в своей учетной записи WebAssign. Учащиеся, не завершившие предварительную лабораторную работу WebAssign, должны принести и сдать лист предварительной лабораторной работы.
Проверьте сроки выполнения в своей учетной записи WebAssign. Учащиеся, не завершившие предварительную лабораторную работу WebAssign, должны принести и сдать лист предварительной лабораторной работы. Работайте над шагами 4 и 5, пока вода нагревается.
Работайте над шагами 4 и 5, пока вода нагревается.
 Показать свою работу.
Показать свою работу.
 Измерьте эту температуру и запишите ее в таблицу данных B.
Измерьте эту температуру и запишите ее в таблицу данных B.


 Мягко вращайте. Для растворения твердого вещества может потребоваться минута или две. Продолжайте вращать до тех пор, пока температура не перестанет меняться. Запишите эту температуру как температуру раствора в таблице данных D.
Мягко вращайте. Для растворения твердого вещества может потребоваться минута или две. Продолжайте вращать до тех пор, пока температура не перестанет меняться. Запишите эту температуру как температуру раствора в таблице данных D. Вам будет предложено ввести значение в постлабораторном упражнении WebAssign.)
Вам будет предложено ввести значение в постлабораторном упражнении WebAssign.)

Проведите демонстрацию, чтобы представить идею плотности воды.
Материалы
- Вода
- Два одинаковых ведра или больших контейнера
Подготовка учителя
Наполните одно ведро наполовину, а в другое добавьте примерно 1 стакан воды.
Процедура
- Выберите ученика, который поднимет оба ведра с водой.

- Спросите у студента-добровольца, какое ведро имеет большую массу.
Ожидаемые результаты
Ведро, в котором больше воды, имеет большую массу.
Спросите студентов:
- В уроках 3.1 — Что такое плотность? и 3.2 — Метод вытеснения воды, вы нашли плотность твердых тел, измерив их массу и объем. Как вы думаете, может ли жидкость, например вода, иметь плотность?
- Учащиеся должны понять, что вода имеет объем и массу. Поскольку D=m/v, вода также должна иметь плотность.
- Как, по-вашему, можно найти плотность такой жидкости, как вода?
- Не ожидается, что учащиеся смогут полностью ответить на этот вопрос на данном этапе. Он задуман как повод к расследованию. Но учащиеся могут понять, что сначала им нужно каким-то образом найти массу и объем воды.
- Могут ли маленькое и большое количество воды, поднятые вашим одноклассником, иметь одинаковую плотность?
- Учащиеся могут указать, что ведро с большим количеством воды имеет большую массу, но больший объем.
 Ведро с меньшей массой имеет меньший объем. Поэтому возможно, что разное количество воды может иметь одинаковую плотность.
Ведро с меньшей массой имеет меньший объем. Поэтому возможно, что разное количество воды может иметь одинаковую плотность.
Раздайте каждому учащемуся лист с заданиями.
Учащиеся записывают свои наблюдения и отвечают на вопросы о задании в листе задания. Разделы «Объясните это с помощью атомов и молекул» и «Воспримите это» в листе с заданиями будут выполняться в классе, в группах или индивидуально в зависимости от ваших инструкций. Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Обсудите с учащимися, как найти объем и массу воды.
Скажите учащимся, что они попытаются определить плотность воды.
Спросите студентов:
- Какие две вещи нужно знать, чтобы найти плотность воды?
- Учащиеся должны понимать, что им нужны как объем, так и масса образца воды, чтобы найти ее плотность. 907:50
- Как можно измерить объем воды?
- Предложите учащимся использовать мерный цилиндр для измерения объема в миллилитрах.
 Напомните учащимся, что каждый миллилитр равен 1 см 3 .
Напомните учащимся, что каждый миллилитр равен 1 см 3 . - Как можно измерить массу воды?
- Предложите учащимся использовать весы для измерения массы в граммах. Скажите учащимся, что они могут найти массу, взвесив воду. Однако, поскольку вода является жидкостью, она должна находиться в каком-то контейнере. Таким образом, чтобы взвесить воду, они также должны взвесить контейнер. Объясните учащимся, что им придется вычесть массу пустого мерного цилиндра из массы цилиндра и воды, чтобы получить массу только воды. 907:50
Предложите учащимся найти массу различных объемов воды, чтобы показать, что плотность воды не зависит от размера образца.
Вопрос для расследования
Имеют ли разное количество воды одинаковую плотность?
Материалы для каждой группы
- Градуированный цилиндр, 100 мл
- Вода
- Весы в граммах (могут измерять более 100 г)
- Пипетка
Процедура
- Найдите массу пустого мерного цилиндра.
 Запишите массу в граммах в таблице на рабочем листе.
Запишите массу в граммах в таблице на рабочем листе. Налейте 100 мл воды в мерный цилиндр. Постарайтесь быть максимально точным, убедившись, что мениск находится прямо на отметке 100 мл. Используйте пипетку, чтобы добавить или удалить небольшое количество воды.
- Взвесьте мерный цилиндр с водой. Запишите массу в граммах.
- Найдите массу только воды, вычитая массу пустого градуированного цилиндра. Запишите массу 100 мл воды в таблицу.
- Используйте массу и объем воды для расчета плотности. Запишите плотность в г/см 3 в таблицу.
- Сливайте воду, пока в мерном цилиндре не будет 50 мл воды. Если вы случайно вылили слишком много, добавляйте воду, пока не дойдете до 50 мл.
Найдите массу 50 мл воды. Запишите массу в лист активности. Рассчитайте и запишите плотность.
- Затем слейте воду, пока в мерном цилиндре не будет 25 мл воды. Найдите массу 25 мл воды и запишите ее в таблицу. Рассчитайте и запишите плотность.

| Объем воды | 100 миллилитров | 50 миллилитров | 25 миллилитров |
|---|---|---|---|
| Масса мерного цилиндра + вода (г) | |||
| Масса пустого мерного цилиндра (г) | |||
| Масса воды (г) | |||
| Плотность воды (г/см 3 ) |
Ожидаемые результаты
Плотность воды должна быть близка к 1 г/см 3 . Это верно для 100, 50 или 25 мл.
Спросите студентов:
- Посмотрите на свои значения плотности на диаграмме.
 Одинакова ли плотность различных объемов воды?
Одинакова ли плотность различных объемов воды? - Помогите учащимся увидеть, что большинство различных значений плотности близки к 1 г/см 3 . Они могут задаться вопросом, почему не все их значения точно равны 1 г/см 3 . Одной из причин может быть неточность измерения. Другая причина заключается в том, что плотность воды меняется в зависимости от температуры. Вода имеет наибольшую плотность при 4 °C и при этой температуре имеет плотность 1 г/см 3 . При комнатной температуре, около 20–25 °C, плотность составляет около 0,99 г/см 3 .
- Какова плотность воды в г/см3?
- Ответы учащихся могут различаться, но в основном их значения должны быть около 1 г/см 3 .
Предложите учащимся начертить свои результаты.
Помогите учащимся построить график данных на листе с заданиями. По оси x должен быть объем, а по оси y масса.
Когда учащиеся наносят свои данные на график, должна быть прямая линия, показывающая, что при увеличении объема масса увеличивается на ту же величину.
Обсудите наблюдения учащихся, данные и графики.
Спросите студентов:
- Используйте свой график, чтобы найти массу 40 мл воды. Какова плотность этого объема воды?
- Масса 40 мл воды равна 40 граммам. Поскольку D = m/v и mL = см 3 , плотность воды составляет 1 г/см 3 .
- Выберите объем от 1 до 100 мл. Используйте свой график, чтобы найти массу. Какова плотность этого объема воды?
- Независимо от того, весят ли студенты 100, 50, 25 мл или любое другое количество, плотность воды всегда будет равна 1 г/см 3 .
Скажите учащимся, что плотность – это характерное свойство вещества. Это означает, что плотность вещества одинакова независимо от размера образца.
Спросите студентов:
- Является ли плотность характерным свойством воды? Откуда вы знаете?
- Плотность является характеристическим свойством воды, поскольку плотность любой пробы воды (при одной и той же температуре) всегда одинакова.
 Плотность 1 г/см 3 .
Плотность 1 г/см 3 .
Объясните, почему плотность пробы воды любого размера всегда одинакова.
Спроецируйте изображение Плотность воды.
Молекулы воды имеют одинаковую массу и размер. Молекулы воды также упакованы довольно близко друг к другу. Они упакованы одинаково во всей пробе воды. Итак, если объем воды имеет определенную массу, удвоенный объем будет иметь удвоенную массу, трехкратный объем будет иметь трехкратную массу и т. д. Независимо от того, какой размер пробы воды вы измеряете, соотношение между массой и объемом всегда будет одинаковым. Поскольку D=m/v, плотность одинакова для любого количества воды.
Проект анимации «Жидкая вода».
Молекулы воды всегда в движении. Но в среднем они упакованы везде одинаково. Следовательно, соотношение между массой и объемом одинаково, что делает плотность одинаковой. Это верно независимо от размера выборки или места, откуда вы ее выбираете.
Предложите учащимся подумать, равна ли плотность большого куска твердого вещества плотности меньшего куска.

Дайте учащимся время рассчитать плотность каждого из трех образцов, нарисованных на листе с заданиями, и ответить на соответствующие вопросы.
Спросите студентов:
- Плотность жидкости не зависит от размера образца. Может ли это быть верно и для твердых тел? Рассчитайте плотность каждого из трех образцов, чтобы выяснить это.
- Да. Плотность твердого вещества одинакова независимо от размера образца. 907:50
- Образец А имеет массу 200 г. Какова плотность образца А?
- Д = м/об
- D = 200 г/100 см 3
- D = 2 г/см 3
- Если вы разрежете образец A пополам и осмотрите только одну половину, вы получите образец B. Какова плотность образца B?
- Если учащиеся не знают, что такое масса, скажите им, что это половина массы образца A. Поскольку образец A весит 200 г, образец B составляет половину объема и, следовательно, половину массы (100 г). 907:50
- Д = м/об
- D = 100 г/50 см 3
- D = 2 г/см 3
- Если вы разрежете образец B пополам, вы получите образец C.




 Ведро с меньшей массой имеет меньший объем. Поэтому возможно, что разное количество воды может иметь одинаковую плотность.
Ведро с меньшей массой имеет меньший объем. Поэтому возможно, что разное количество воды может иметь одинаковую плотность. Напомните учащимся, что каждый миллилитр равен 1 см 3 .
Напомните учащимся, что каждый миллилитр равен 1 см 3 . Запишите массу в граммах в таблице на рабочем листе.
Запишите массу в граммах в таблице на рабочем листе.
 Одинакова ли плотность различных объемов воды?
Одинакова ли плотность различных объемов воды? Плотность 1 г/см 3 .
Плотность 1 г/см 3 .