Молярный объем газообразных веществ
Цель урока: сформировать понятие о молярном, миллимолярном и киломолярном объемах газов и единицах их измерения.
Задачи урока:
- Обучающие – закрепить ранее изученные формулы и найти связь между объемом и массой, количеством вещества и числом молекул, закрепить и систематизировать знания учащихся.
- Развивающие – развивать умения и навыки решать задачи, способности к логическому мышлению, расширять кругозор учащихся, их творческие способности, умения работать с дополнительной литературой, долговременную память, интерес к предмету.
- Воспитательные – воспитывать личности с высоким уровнем культуры, формировать потребность в познавательной деятельности.
Тип урока: Комбинированный урок.
Оборудование и реактивы: Таблица «Молярный объем газов», портрет Авогадро, мензурка, вода, мерные стаканы с серой, оксидом кальция, глюкозы количеством вещества 1 моль.
План урока:
- Организационный момент (1 мин.)
- Проверка знаний в виде фронтального опроса (10 мин.)
- Заполнение таблицы (5 мин.)
- Объяснение нового материала (10 мин.)
- Закрепление (10 мин.)
- Подведение итогов (3 мин.)
- Домашнее задание (1 мин.)
1. Организационный момент.
2. Фронтальная беседа по вопросам.
Как называется масса 1 моля вещества?
Как связать молярную массу и количество вещества?
Чему равно число Авогадро?
Как связано число Авогадро и количество вещества?
А как связать массу и число молекул вещества?
3. А теперь заполните таблицу, решив задачи – это групповая работа.
| Формула, вещества | Масса, г | Молярная масса, г/моль | Количество вещества, моль | Число молекул | Число Авогадро, молекул/моль |
| ZnO | ? | 81 г/моль | ? моль | 18•1023 молекул | 6•1023 |
| MgS | 5,6г | 56 г/моль | ? моль | ? | 6•1023 |
| BaCl2 | ? | ? г/моль | 0,5 моль | 3•1023 молекул |
4.
 Изучение нового материала.
Изучение нового материала.«…Мы хотим не только знать, как устроена природа (и как происходят природные явления), но и по возможности достичь цели, может быть, утопической и дерзкой на вид, – узнать, почему природа является именно такой, а не другой. В этом ученые находят наивысшее удовлетворение.»
Альберт Эйнштейн
Итак, наша цель найти наивысшее удовлетворение, как настоящие ученые.
А как называется объем 1 моля вещества?
От чего зависит молярный объем?
Чему будет равен молярный объем воды, если ее Mr = 18, а ρ = 1 г/мл?
(Конечно 18 мл).
Для определения объема вы пользовались формулой известной из физики ρ = m / V (г/мл, г/см3, кг/м3)
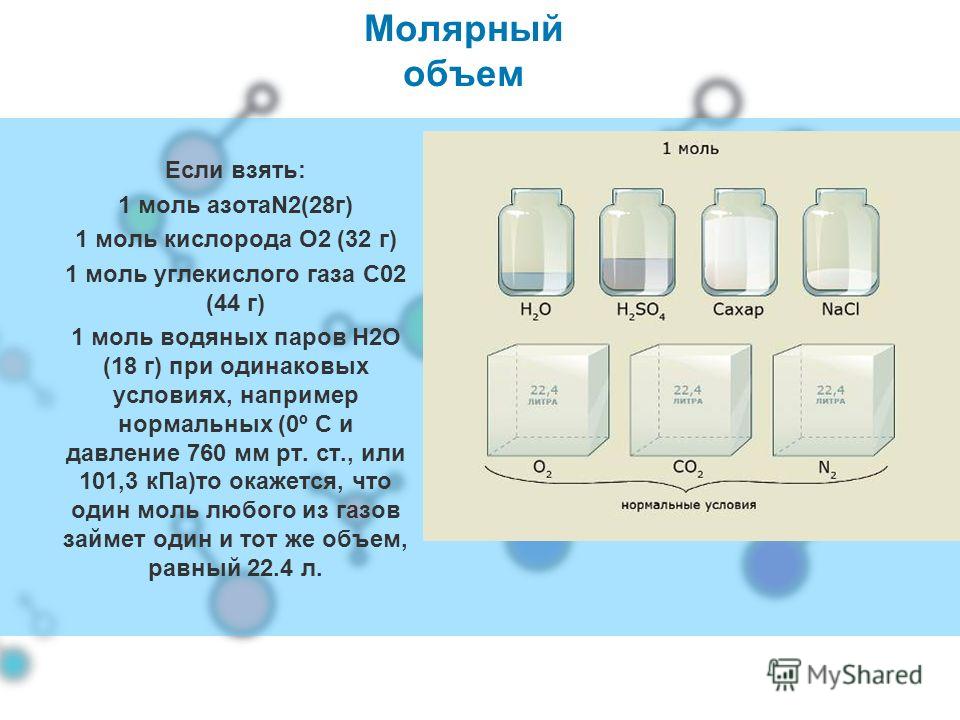
Отмерим этот объем мерной посудой. Отмерим молярные объемы спирта, серы, железа, сахара. Они разные, т.к. плотность разная, (таблица различных плотностей).
А как обстоит дело у газов? Оказывается, 1 моль любого газа при н.
Откуда взялось это число?
Оно вытекает из закона Авогадро. Следствие из закона Авогадро: 1 моль любого газа при н.у. занимает объем 22,4 л/моль.
Немного о жизни итальянского ученого мы сейчас услышим. (сообщение о жизни Авогадро)
А теперь посмотрим зависимость величин от разных показателей:
| Формула вещества | Агрегатное состояние (при н.у.) | Масса, г | Плотность, г/мл |
Объем порций в 1 моль, л | Количество вещества, моль | Зависимость между объемом и количеством вещества |
| NaCl | Твердое | 58,5 | 2160 | 0,027 | 1 | 0,027 |
| H2O | Жидкое | 18 | 1000 | 0,018 | 1 | 0,18 |
| O2 | Газ | 32 | 1,43 | 22,4 | 1 | 22,4 |
| H2 | Газ | 2 | 0,09 | 22,4 | 1 | 22,4 |
| CO2 | Газ | 44 | 1,96 | 22,4 | 1 | 22,4 |
| SO2 | газ | 64 | 2,86 | 22,4 | 1 | 22,4 |
Из сравнения полученных данных сделайте вывод (зависимость между объемом и количеством вещества для всех газообразных веществ (при н.
Обозначается Vm и измеряется л/моль и т.д. Выведем формулу для нахождения молярного объема
Vm = V/v, отсюда можно найти количество вещества и объем газа. А теперь вспомним ранее изученные формулы, можно ли их объединить? Можно получить универсальные формулы для расчетов.
m/M = V/Vm;
V/Vm = N/Na
5. А теперь закрепим полученные знания с помощью устного счета, чтобы знания через умения стали применятся автоматически, то есть превратились в навыки.
За правильный ответ вы будите получать балл, по количеству баллов получите оценку.
- Назовите формулу водорода?
- Какова его относительная молекулярная масса?
- Какова его молярная масса?
- Сколько молекул водорода будет в каждом случае?
- Какой объем займут при н.
 у. 3 г H2?
у. 3 г H2? - Сколько будут весить 12•1023 молекул водорода?
- Какой объем займут эти молекулы в каждом случае?
А теперь решим задачи по группам.
Задача №1
Образец: Какой объем занимает 0,2 моль N2 при н.у.?
| Дано: н.у. Vm = 22, 4 л/моль ν (N2) = 0,2 моль |
Решение: ν (N2) = V(N2) / Vm , следовательно V (N2) = ν (N2) · Vm = 0,2 моль · 22,4 л / моль = 4,48 л |
| Найти: V – ? |
Задачи для самостоятельного решения
Решите задачи по приведённому образцу:
- Какой объем занимают 5 моль O2 при н.
 у.?
у.? - Какой объем занимают 2,5 моль H2 при н.у.?
Задача №2
Образец: Какое количество вещества содержит водород объемом 33,6 л при н.у.?
| Дано: н.у. Vm = 22, 4 л/моль V (H2) = 33,6 л |
Решение: ν (H2) = V(N2 ) / Vm = 33,6 л / 22,4 л/моль = 1,5 моль Ответ: ν (H2) = 1,5 моль |
| Найти: ν — ? |
Задачи для самостоятельного решения
Решите задачи по приведённому образцу:
- Какое количество вещества содержит кислород объемом 0,224 л при н.у.?
- Какое количество вещества содержит углекислый газ объемом 4,48 л при н.у.?
Задача №3
Образец: Какой объем займут 56 г. газа СО при н.у.?
газа СО при н.у.?
| Дано: н.у. Vm = 22, 4 л/моль m (CO) = 56 г |
Решение: ν (CO) = V(CO) / Vm , следовательно V (CO) = ν (CO) · Vm Неизвестное количество вещества найдём по формуле: M(CO) = Ar(C) + Ar(O) = 12 + 16 = 28 г/моль ν (СО) = m/M = 56 г / 28 г/моль = 2 моль V (CO) = ν (CO) · Vm = 2 моль · 22,4 л/моль = 44,8 л Ответ: V (CO) = 44,8 л |
| Найти: V – ? |
Задачи для самостоятельного решения
Решите задачи по приведённому образцу:
- Какой объем займут 8 г. газа O2 при н.у.?
- Какой объем займут 64 г. газа SO2 при н.
 у.?
у.?
Задача №4
Образец: В каком объеме содержится 3·1023 молекул водорода H2 при н.у.?
| Дано: н.у. Vm = 22, 4 л/моль N = 3·1023 молекул Na = 6,02 ·1023 моль-1 |
Решение: ν (H2) = V(H2) / Vm, следовательно V (H2) = ν (H2) · Vm Неизвестное количество вещества найдём по формуле: ν = N / Na = 3·1023 / 6,02 ·1023 моль-1 = 0,48 моль V (H2) = ν (H2) · Vm = 0,48 моль · 22,4 л/моль = 10,752 л Ответ: V (H2) = 10,752 л |
| Найти: V – ? |
Задачи для самостоятельного решения
Решите задачи по приведённому образцу:
- В каком объеме содержится 12,04 ·1023 молекул водорода СO2 при н.
 у.?
у.? - В каком объеме содержится 3,01·1023 молекул водорода O2 при н.у.?
Понятие относительной плотности газов следует дать на основании их знаний о плотности тела: D = ρ1/ρ2, где ρ1 – плотность первого газа, ρ2 – плотность второго газа. Вы знаете формулу ρ = m/V. Заменив в этой формуле m на М, а V на Vm, получим ρ = М/Vm. Тогда относительную плотность можно выразить, используя правую часть последней формулы:
D = ρ1/ρ2= М1/М2.
Вывод: относительная плотность газов – число, показывающее, во сколько раз молярная масса одного газа больше молярной массы другого газа.
Например, определите относительную плотность кислорода по воздуху, по водороду.
6. Подведение итогов.
Решите задачи для закрепления:
Найдите массу (н.у.): а) 6 л. О3; б) 14 л. газа H2S?
газа H2S?
Какой объём водорода при н.у. образуется при взаимодействии 0,23 г натрия с водой?
Какова молярная масса газа, если 1 л. его имеет массу 3,17 г.? (Подсказка! m = ρ·V)
7. Домашняя работа.
§16, 1-4 стр.85 (писм.)
Презентация.
Объем при нормальных условиях формула. Объем одного моля газа при нормальных условиях. Моль. Закон Авогадро. Молярный объем газа. Тема: Молярный объем газов
Урок 1.
Тема: Количество вещества. Моль
Химия – это наука о веществах. А как измерять вещества? В каких единицах? В молекулах, из которых состоят вещества, но сделать это очень сложно. В граммах, килограммах или миллиграммах, но так измеряют массу. А что если объединить массу, которую измеряют на весах и число молекул вещества, возможно ли это?
а) H-водород
А н = 1а.е.м.
1а.е.м = 1,66*10 -24 г
Возьмем 1г водорода и подсчитаем количество атомов водорода в этой массе (предложите это сделать ученикам с помощью калькулятора).
N н = 1г / (1,66*10 -24) г = 6,02*10 23
б) O-кислород
А о = 16а.е.м = 16*1.67* 10 -24 г
N o = 16г / (16 *1.66 * 10 -24) г =6,02 * 10 23
в) C-углерод
А с = 12а.е.м = 12*1.67*10 -24 г
N c = 12г / (12* 1.66*10 -24) г = 6,02*10 23
Сделаем вывод: если мы возьмем такую массу вещества, которая равна атомной массе по величине, но взята в граммах, то там будет всегда (для любого вещества) 6.02 *10 23 атомов этого вещества.
H 2 O — вода
18г / (18* 1.66*10 -24) г =6,02*10 23 молекул воды и т.д.
N а = 6,02*10 23 — число или постоянная Авогадро .
Моль — количество вещества, в котором содержится 6,02 *10 23 молекул, атомов или ионов, т.е. структурных единиц.
Бывает моль молекул, моль атомов, моль ионов.
n – число молей,(число молей часто обозначают- ню),
N — число атомов или молекул,
N а = постоянная Авогадро.
Кмоль = 10 3 моль, ммоль = 10 -3 моль.
Показать портрет Амедео Авогадро на мультимедийной установке и кратко рассказать о нем, или поручить ученику подготовить небольшой доклад о жизни учёного.
Урок 2.
Тема « Молярная масса вещества»
Чему же равна масса 1 моля вещества? (Вывод учащиеся часто могут сделать сами.)
Масса одного моля вещества равна его молекулярной массе, но выражена в граммах. Масса одного моля вещества называется молярной массой и обозначается – M.
Формулы:
М — молярная масса,
n — число молей,
m — масса вещества.
Масса моля измеряется в г/моль, масса кмоля измеряется в кг/кмоль, масса ммоля измеряется в мг/моль.
Заполнить таблицу (таблицы раздаются).
Вещество | Число молекул | Молярная масса | Число молей | Масса вещества |
5моль | ||||
Н 2 SO 4 | ||||
12 ,0 4*10 26 |
Урок 3.
Тема: Молярный объем газов
Решим задачу. Определите объем воды, масса которой при нормальных условиях 180 г.
Дано:
Т.е. объем жидких и твердых тел считаем через плотность.
Но, при расчёте объёма газов не обязательно знать плотность. Почему?
Итальянский ученый Авогадро определил, что в равных объемах различных газов при одинаковых условиях (давлении, температуре) содержится одинаковое число молекул — это утверждение называется законом Авогадро.
Т.е. если при равных условиях V(H 2) =V(O 2) , то n(H 2) =n(O 2), и наоборот если при равных условиях n(H 2) =n(O 2) то и объемы этих газов будут одинаковы. А моль вещества всегда содержит одно и тоже число молекул 6,02 *10 23 .
Делаем вывод – при одинаковых условиях моли газов должны занимать один и тот же объем.
При нормальных условиях (t=0, P=101,3 кПа. или 760 мм рт. ст.) моли любых газов занимают одинаковый объем. Этот объем называется молярным.
V m =22,4 л/моль
1кмоль занимает объём -22,4 м 3 /кмоль, 1ммоль занимает объем -22,4 мл/ммоль.
Пример 1. (Решается на доске):
Пример 2. (Можно предложить решить ученикам):
| Дано: | Решение: |
m(H 2)=20г |
Предложить учащимся заполнить таблицу.
Вещество | Число молекул | Масса вещества | Число молей | Молярная масса | Объем |
Количество вещества. Молярная масса. Молярный объем газа. Закон Авогадро
Молярная масса. Молярный объем газа. Закон Авогадро
Из курса физики мы знаем о таких физических величинах, как масса, объём и плотность. При помощи этих величин легко характеризовать вещества. Например, мы идём в магазин и покупаем 1 кг сахара или литровую бутылку минеральной воды. Но оказывается, что этих величин недостаточно, если необходимо рассмотреть вещество с точки зрения числа частиц. Сколько молекул сахара содержится в 1 кг сахара? А сколько молекул воды в литровой бутылке? А в одной капле? Ответ на этот вопрос можно получить, если знать ещё об одной физической величине, которая называется количество вещества. Точное число молекул посчитать сложно, но если считать не штуками, а порциями, то задача упрощается. Например, мы никогда не покупаем в магазине спички поштучно, но купив одну порцию спичек – коробок, знаем, что там 100 штук. И салфетки мы тоже поштучно не покупаем, но купив пачку салфеток, то есть порцию, мы точно будем знать, сколько штук салфеток мы купили.
Количество вещества – это порция вещества с определённым числом структурных частиц. Количество вещества принято обозначать греческой буквой ν [ню]. В системе СИ единица измерения количества вещества называется моль. Один моль вещества содержит столько же структурных частиц, сколько атомов содержится в 12 г углерода, а именно 6*1023 частиц. Это количество является постоянной величиной и называется «постоянная Авогадро». Количество вещества можно определить как отношение числа структурных частиц к числу частиц в одном моле вещества.
Количество вещества принято обозначать греческой буквой ν [ню]. В системе СИ единица измерения количества вещества называется моль. Один моль вещества содержит столько же структурных частиц, сколько атомов содержится в 12 г углерода, а именно 6*1023 частиц. Это количество является постоянной величиной и называется «постоянная Авогадро». Количество вещества можно определить как отношение числа структурных частиц к числу частиц в одном моле вещества.
Например, количество вещества, которое соответствует 3*1023 атомов железа можно легко рассчитать по этой формуле.
Преобразовав исходную формулу легко определить число структурных частиц по известному количеству вещества: N = v * NA
Своё имя эта постоянная получила в честь Амедео Авогадро, который в 1811 году сделал предположение, которое затем подтвердилось экспериментально и теперь носит имя Закона Авогадро. Закон Авогадро: «в равных объёмах различных газов при одинаковых условиях (температура и давление) содержится одинаковое количество молекул».
Из закона Авогадро следует, что при одинаковых условиях массы газов, содержащие одинаковое число структурных частиц, будут занимать одинаковый объём. При давлении 1 атмосфера и температуре 0 градусов Цельсия 1 моль любого газа занимает объём равный 22, 4 л. Этот объём называется молярный объём. А условия – нормальные условия. Молярный объём обозначается Vm, показывает объём газа количеством 1 моль. При нормальных условиях является постоянной величиной.
При нормальных условиях количество вещества это отношение объёма к молярному объему.
По этой формуле можно определить объём вещества, если известно его количество: V = ν * Vm
Массу вещества количеством 1 моль называют молярной массой, обозначают буквой M. Молярная масса численно равна относительной молекулярной массе. Единица измерения молярной массы г/моль.
Зная массу вещества, легко определить количество вещества.
Найдём количество вещества 5,6 г железа.
Чтобы найти массу вещества по известному количеству преобразуем формулу: m = ν * M
Справочный материал
Количество вещества ν [ню] – это физическая величина, характеризующая количество однотипных структурных единиц (любые частицы, из которых состоит вещество – атомы, молекулы, ионы и т. д), содержащихся в веществе. Единица измерения количества вещества в Международной системе единиц (СИ) – моль.
д), содержащихся в веществе. Единица измерения количества вещества в Международной системе единиц (СИ) – моль.
Моль – это единица измерения количества вещества. Один моль вещества содержит столько же структурных частиц, сколько атомов содержится в 12 г углерода.
Молярная масса (M) – масса вещества количеством один моль. Единица измерения г/моль.
Нормальные условия (н.у.) – физические условия, определяемые давлением 101325 Па (нормальная атмосфера) и температурой 273,15 К (0 °С).
Молярный объём (Vm) – объём вещества количеством один моль. Единица измерения л/моль; при н.у. Vm = 22,4 л/моль
Закон Авогадро – в равных объёмах различных газов при одинаковых условиях (температура и давление) содержится одинаковое количество молекул.
Постоянная Авогадро (NA) показывает число структурных частиц в веществе количеством один моль.
При изучении химических веществ важными понятиями являются такие величины, как молярная масса, плотность вещества, молярный объем. Так, что же такое молярный объем, и в чем его отличие для веществ в разном агрегатном состоянии?
Молярный объем: общая информация
Чтобы вычислить молярный объем химического вещества необходимо молярную массу этого вещества разделить на его плотность. Таким образом, молярный объем вычисляется по формуле:
Таким образом, молярный объем вычисляется по формуле:
где Vm – молярный объем вещества, М – молярная масса, p – плотность. В Международной системе СИ эта величина измеряется в кубический метр на моль (м 3 /моль).
Рис. 1. Молярный объем формула.
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа.
Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм 3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм 3 /м.
Молярный объем при нормальных условиях можно вывести, используя уравнение состояния для идеального газа, которое называется уравнением Клайперона-Менделеева:
где R – универсальная газовая постоянная, R=8. 314 Дж/моль*К=0,0821 л*атм/моль К
314 Дж/моль*К=0,0821 л*атм/моль К
Объем одного моля газа V=RT/P=8.314*273.15/101.325=22.413 л/моль, где Т и Р – значение температуры (К) и давления при нормальных условиях.
Рис. 2. Таблица молярных объемов.
Закон Авогадро
В 1811 году А. Авогадро выдвинул гипотезу, что в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковой число молекул. Позже гипотеза подтвердилась и стала законом, носящим имя великого итальянского ученого.
Рис. 3. Амедео Авогадро.
Закон становится понятен, если вспомнить, что в газообразном виде расстояние между частицами несопоставимо больше, чем размеры самих частиц.
Таким образом, из закона Авогадро можно сделать следующие выводы:
- В равных объёмах любых газов, взятых при одной и той же температуре и при одном и том же давлении, содержится одно и то же число молекул.
- 1 моль совершенно различных газов при одинаковых условиях занимает одинаковый объем.

- Один моль любого газа при нормальных условиях занимает объем 22,41 л.
Следствие из закона Авогадро и понятие молярного объема основаны на том, что моль любого вещества содержит одинаковое число частиц (для газов – молекул), равное постоянной Авогадро.
Чтобы узнать число молей растворенного вещества содержится в одном литре раствора, необходимо определить молярную концентрацию вещества по формуле c=n/V, где n – количество растворенного вещества, выражаемое в молях, V – объем раствора, выражаемый в литрах С – молярность.
Что мы узнали?
В школьной программе по химии 8 класса изучается тема «Молярный объем». В одном моле газа всегда содержится одинаковый объем, равный 22,41 кубический метр/моль. Этот объем называется молярным объемом газа.
Тест по теме
Оценка доклада
Средняя оценка: 4.2 . Всего получено оценок: 64.
Названия
кислот образуются
от русского названия центрального атома
кислоты с добавлением суффиксов и
окончаний. Если степень окисления
центрального атома кислоты соответствует
номеру группы Периодической системы,
то название образуется с помощью
простейшего прилагательного от названия
элемента: H 2 SO 4
– серная кислота, HMnO 4
– марганцовая кислота. Если кислотообразующие
элементы имеют две степени окисления,
то промежуточная степень окисления
обозначается суффиксом –ист-: H 2 SO 3
– сернистая кислота, HNO 2
– азотистая кислота. Для названий кислот
галогенов, имеющих много степеней
окисления, применяются различные
суффиксы: типичные примеры – HClO 4
– хлорн ая
кислота, HClO 3
– хлорноват ая
кислота, HClO 2
– хлорист ая
кислота, HClO
– хлорноватист ая
кислота (бескислородная
кислота HCl
называется хлороводородной кислотой
– обычно соляной кислотой).
Кислоты могут различаться числом молекул
воды, гидратирующей оксид. Кислоты,
содержащие наибольшее число атомов
водорода,
называются ортокислотами: H 4 SiO 4
– ортокремниевая кислота, H 3 PO 4
– ортофосфорная кислота.
Если степень окисления
центрального атома кислоты соответствует
номеру группы Периодической системы,
то название образуется с помощью
простейшего прилагательного от названия
элемента: H 2 SO 4
– серная кислота, HMnO 4
– марганцовая кислота. Если кислотообразующие
элементы имеют две степени окисления,
то промежуточная степень окисления
обозначается суффиксом –ист-: H 2 SO 3
– сернистая кислота, HNO 2
– азотистая кислота. Для названий кислот
галогенов, имеющих много степеней
окисления, применяются различные
суффиксы: типичные примеры – HClO 4
– хлорн ая
кислота, HClO 3
– хлорноват ая
кислота, HClO 2
– хлорист ая
кислота, HClO
– хлорноватист ая
кислота (бескислородная
кислота HCl
называется хлороводородной кислотой
– обычно соляной кислотой).
Кислоты могут различаться числом молекул
воды, гидратирующей оксид. Кислоты,
содержащие наибольшее число атомов
водорода,
называются ортокислотами: H 4 SiO 4
– ортокремниевая кислота, H 3 PO 4
– ортофосфорная кислота. Кислоты,
содержащие 1 или 2 атома водорода,
называются метакислотами: H 2 SiO 3
– метакремниевая кислота, HPO 3
– метафосфорная кислота. Кислоты,
содержащие два центральных атома,
называются ди кислотами:
H 2 S 2 O 7
– дисерная кислота, H 4 P 2 O 7
– дифосфорная кислота.
Кислоты,
содержащие 1 или 2 атома водорода,
называются метакислотами: H 2 SiO 3
– метакремниевая кислота, HPO 3
– метафосфорная кислота. Кислоты,
содержащие два центральных атома,
называются ди кислотами:
H 2 S 2 O 7
– дисерная кислота, H 4 P 2 O 7
– дифосфорная кислота.
Названия комплексных соединенийобразуются так же, как названия солей , но комплексному катиону или аниону дается систематическое название, то есть оно читается справа налево: K 3 – гексафтороферрат(III) калия, SO 4 – сульфат тетраамминмеди(II).
Названия оксидов образуются с помощью слова «оксид» и родительного падежа русского названия центрального атома оксида с указанием, в случае необходимости, степени окисления элемента:Al 2 O 3 – оксид алюминия,Fe 2 O 3 – оксид железа(III).
Названия
оснований образуются
с помощью слова «гидроксид»
и родительного падежа русского названия
центрального атома гидроксида с
указанием, в случае необходимости,
степени окисления элемента: Al(OH) 3
– гидроксид алюминия, Fe(OH) 3
– гидроксид железа(III).
Названия соединений с водородом образуются в зависимости от кислотно-основных свойств этих соединений. Для газообразных кислотообразующих соединений с водородом применяются названия:H 2 S– сульфан (сероводород),H 2 Se– селан (селеноводород),HI– иодоводород; их растворы в воде называются соответственно сероводородной, селеноводородной и иодоводородной кислотами. Для некоторых соединений с водородом применяются специальные названия:NH 3 – аммиак,N 2 H 4 – гидразин,PH 3 – фосфин. Соединения с водородом, имеющим степень окисления –1, называются гидридами:NaH– гидрид натрия,CaH 2 –гидрид кальция.
Названия
солей образуются
от латинского названия центрального
атома кислотного остатка с добавлением
префиксов и суффиксов. Названия бинарных
(двухэлементных) солей образуются с
помощью суффикса –ид :
NaCl
– хлорид натрия, Na 2 S
– сульфид натрия. Если центральный атом
кислородсодержащего кислотного остатка
имеет две положительные степени
окисления, то высшая степень окисления
обозначается суффиксом –ат :
Na 2 SO 4
– сульфат натрия, KNO 3
– нитрат калия, а низшая степень окисления –
суффиксом –ит :
Na 2 SO 3
– сульфит натрия, KNO 2
– нитрит калия. Для названия кислородсодержащих
солей галогенов пользуются префиксами
и суффиксами: KClO 4
– пер хлорат калия, Mg(ClO 3) 2
– хлорат магния, KClO 2
– хлорит калия, KClO
– гипо хлорит калия.
Для названия кислородсодержащих
солей галогенов пользуются префиксами
и суффиксами: KClO 4
– пер хлорат калия, Mg(ClO 3) 2
– хлорат магния, KClO 2
– хлорит калия, KClO
– гипо хлорит калия.
Насыщаемость ковалентн ых связ ей – проявляется в том, что в соединениях s- и p-элементов нет неспаренных электронов, то есть все неспаренные электроны атомов образуют связывающие электронные пары (исключения составляют NO, NO 2 , ClO 2 и ClO 3).
Неподеленные электронные пары (НЭП) –электроны, которые занимают атомные орбитали парами. Наличие НЭП обусловливает способность анионов или молекул, образовывать донорно-акцепторные связи в качестве доноров электронных пар.
Неспаренные электроны–
электроны атома, содержащиеся по одному
в орбитали. Для s-
и p-элементов
число неспаренных электронов определяет,
сколько связывающих электронных пар
может образовать данный атом с другими
атомами по обменному механизму. В методе
валентных связей исходят из того, что
число неспаренных электронов может
быть увеличено за счет неподеленных
электронных пар, если в пределах
валентного электронного уровня есть
вакантные орбитали. В большинстве
соединенийs- иp-элементов
неспаренных электронов нет, так как все
неспаренные электроны атомов образуют
связи. Однако молекулы с неспаренными
электронами существуют, например, NO,
NO 2 ,
они обладают повышенной реакционной
способностью и имеют тенденцию
образовывать димеры типа N 2 O 4
за счет неспаренных электронов.
В методе
валентных связей исходят из того, что
число неспаренных электронов может
быть увеличено за счет неподеленных
электронных пар, если в пределах
валентного электронного уровня есть
вакантные орбитали. В большинстве
соединенийs- иp-элементов
неспаренных электронов нет, так как все
неспаренные электроны атомов образуют
связи. Однако молекулы с неспаренными
электронами существуют, например, NO,
NO 2 ,
они обладают повышенной реакционной
способностью и имеют тенденцию
образовывать димеры типа N 2 O 4
за счет неспаренных электронов.
Нормальная концентрация – это число молей эквивалентов в 1 л раствора.
Нормальные условия — температура 273K (0 o C), давление 101,3 кПа (1 атм).
Обменный
и донорно-акцепторный механизмы
образования химической связи .
Образование ковалентных связей между
атомами может происходить двояко. Если
образование связывающей электронной
пары происходит за счет неспаренных
электронов обоих связанных атомов, то
такой способ образования связывающей
электронной пары носит название обменного
механизма – атомы обмениваются
электронами, притом связывающие электроны
принадлежат обоим связанным атомам. Если же связывающая электронная пара
образуется за счет неподеленной
электронной пары одного атома и вакантной
орбитали другого атома, то такое
образование связывающей электронной
пары является донорно-акцепторным
механизмом (см. метод
валентных связей).
Если же связывающая электронная пара
образуется за счет неподеленной
электронной пары одного атома и вакантной
орбитали другого атома, то такое
образование связывающей электронной
пары является донорно-акцепторным
механизмом (см. метод
валентных связей).
Обратимые
ионные реакции – это
такие реакции, в которых образуются
продукты, способные образовывать
исходные вещества (если иметь ввиду
написанное уравнение, то про обратимые
реакции можно сказать, что они могут
протекать в ту и другую стороны с
образованием слабых электролитов или
малорастворимых соединений). Обратимые
ионные реакции часто характеризуются
неполнотой превращения; так как в течение
обратимой ионной реакции образуются
молекулы или ионы, которые вызывают
смещение в сторону исходных продуктов
реакции, то есть как бы «тормозят»
реакцию. Обратимые ионные реакции
описываются с помощью знака ⇄,
а необратимые – знака →. Примером
обратимой ионной реакции может служить
реакция H 2 S
+ Fe 2+
⇄
FeS
+ 2H + ,
а примером
необратимой
– S 2-
+ Fe 2+
→ FeS.
Окислители – вещества, у которых при окислительно-восстановительных реакциях степени окисления некоторых элементов уменьшаются.
Окислительно-восстановительная двойственность – способность веществ выступать в окислительно-восстановительных реакциях в качестве окислителя или восстановителя в зависимости от партнера (например, H 2 O 2 , NaNO 2).
Окислительно-восстановительные реакции (ОВР) – это химические реакции, в течение которых изменяются степени окисления элементов реагирующих веществ.
Окислительно-восстановительный потенциал – величина, характеризующая окислительно-восстановительную способность (силу) и окислителя, и восстановителя, составляющих соответствующую полуреакцию. Так, окислительно-восстановительный потенциал пары Cl 2 /Cl — , равный 1,36 В, характеризует молекулярный хлор как окислитель и хлорид-ион как восстановитель.
Оксиды
– соединения
элементов с кислородом, в которых
кислород имеет степень окисления, равную
–2.
Ориентационные взаимодействия – межмолекулярные взаимодействия полярных молекул.
Осмос – явление переноса молекул растворителя на полупроницаемой (проницаемой только для растворителя) мембране в сторону меньшей концентрации растворителя.
Осмотическое давление – физико-химическое свойство растворов, обусловленное способностью мембран пропускать только молекулы растворителя. Осмотическое давление со стороны менее концентрированного раствора уравнивает скорости проникновения молекул растворителя в обе стороны мембраны. Осмотическое давление раствора равно давлению газа, в котором концентрация молекул такая же, как концентрация частиц в растворе.
Основания по Аррениусу – вещества, которые в процессе электролитической диссоциации отщепляют гидроксид-ионы.
Основания по Бренстеду – соединения (молекулы или ионы типа S 2- , HS -), которые могут присоединять ионы водорода.
Основания по
Льюису (льюисовы основания ) – соединения
(молекулы или ионы), с неподеленными
электронными парами, способными
образовывать донорно-акцепторные связи. Самым обычным льюисовым основанием
являются молекулы воды, которые обладают
сильными донорными свойствами.
Самым обычным льюисовым основанием
являются молекулы воды, которые обладают
сильными донорными свойствами.
Молярный объем газа
Это «Единица 12», раздел 12.1 из книги Общие Химия (v. 1.0).
Помогла ли вам эта книга? Рассмотрите возможность передачи:
Помощь Creative Commons
Creative Commons поддерживает свободную культуру от музыки до образования. Их лицензии помогли сделать эту книгу доступной для вас.
Помогите государственной школе
DonorsChoose.org помогает таким людям, как вы, помогать учителям финансировать их класс проекты, от предметов искусства до книг и калькуляторов.
12.1 Закон Авогадро и молярный объем газа
Цель обучения
- Понять взаимосвязь между давлением, температурой, объемом и количеством газа.
Связь между количеством и объемом
Мы можем продемонстрировать связь между объемом и количеством газа, наполнив воздушный шар; по мере того, как мы добавляем больше газа, воздушный шар становится больше. Конкретное количественное соотношение было обнаружено итальянским химиком Амедео Авогадро, признавшим важность работы Гей-Люссака по объединению объемов газов. В 1811 г. Авогадро постулировал, что при одинаковых температуре и давлении равные объемы газов содержат одинаковое количество газообразных частиц (рис. 12.1, а). Логическое следствие, иногда называемое законом Авогадро. Закон, утверждающий, что при постоянной температуре и давлении объем образца газа прямо пропорционален количеству молей газа в образце, описывает зависимость между объемом и количеством газ: При постоянной температуре и давлении объем образца газа прямо пропорционален количеству молей газа в образце. заявлено математически,
Конкретное количественное соотношение было обнаружено итальянским химиком Амедео Авогадро, признавшим важность работы Гей-Люссака по объединению объемов газов. В 1811 г. Авогадро постулировал, что при одинаковых температуре и давлении равные объемы газов содержат одинаковое количество газообразных частиц (рис. 12.1, а). Логическое следствие, иногда называемое законом Авогадро. Закон, утверждающий, что при постоянной температуре и давлении объем образца газа прямо пропорционален количеству молей газа в образце, описывает зависимость между объемом и количеством газ: При постоянной температуре и давлении объем образца газа прямо пропорционален количеству молей газа в образце. заявлено математически,
Уравнение 12,1 (уравнение)
V (в постоянной T и P ) = K N
Рисунок 12.1 (A) Avgadro’s Gypetes
es. газы при одинаковых температуре и давлении содержат одинаковое количество газообразных частиц. Поскольку молярная масса каждого газа различна, масса каждой пробы газа отличается, хотя все они содержат 1 моль газа.
Молярный объем газа
По закону Авогадро объем прямо пропорционален количеству молей. Важно помнить, что n могут быть молями любого газа, поскольку один моль всегда содержит 6,02 × 10 23 молекул, а одна молекула любого газа при одной и той же температуре будет иметь одинаковую кинетическую энергию.
На основании этого принципа установлено, что один моль любого газа, помещенный в сосуд объемом 22,4 л при температуре 0 °С (273 К), будет оказывать давление в один атм (760 мм рт. ст.). Таким образом, 22,4 литра называют молярным объемом (объемом одного моля) любого газа при стандартной температуре и давлении (СТД). Имейте в виду, что мы должны указать температуру и давление, иначе утверждение бессмысленно.
Другими словами, мы можем сказать, что для данного количества молекул газа при любой данной температуре, чтобы оказать определенное давление, объем должен быть одним и тем же, независимо от того, какие молекулы газа присутствуют. Например, если мы поместим 1 моль газообразного водорода в сосуд объемом 22,4 литра при 0°С, давление будет равно 1 атм. Если у нас есть 1 моль газообразного кислорода в том же объеме при той же температуре, давление все равно будет 1 атм. Точно так же, если мы поместим 1 моль любого газа в сосуд объемом 22,4 л и создадим давление в 1 атм, мы обнаружим, что температура должна быть 0°С (273 К).
Если у нас есть 1 моль газообразного кислорода в том же объеме при той же температуре, давление все равно будет 1 атм. Точно так же, если мы поместим 1 моль любого газа в сосуд объемом 22,4 л и создадим давление в 1 атм, мы обнаружим, что температура должна быть 0°С (273 К).
Это молярный объем является очень полезным соотношением, поскольку оно позволяет нам рассчитать объем данного количества любого газа (в граммах, молях или других эквивалентных единицах) или рассчитать количество газа в данном объеме. Мы также можем использовать это соотношение для расчета плотности газов при заданной температуре и давлении, а также для выполнения стехиометрических расчетов, включая газы. Важно помнить, что при работе с газами необходимо указывать температуру и давление. Для жидкостей и твердых тел в этом нет необходимости, так как изменения температуры и давления существенно не влияют на объем вещества в жидком или твердом состоянии.
Рассмотрим следующие примеры расчетов, которые можно выполнить, используя этот молярный объем газа (22,4 литра на моль при нормальных условиях).
Пример 12.1-1
Рассчитайте объем в л при нормальных условиях, занимаемый 2,8 г газа CO 2 .
Дано: массы газа.
Запрашиваемый: объем газа на СТП.
Стратегия:
Измените массу на число молей. Затем используйте молярный объем газа при нормальных условиях.
Решение:
(2,8г)(1моль44г)(22,4л1моль)=1,4л
Пример 12.1-2
Рассчитайте плотность (в г/л) газа NO 2 при нормальных условиях.
Дано: формула газа.
Запрашиваемый: плотность газа на СТП.
Стратегия:
Рассчитайте молярную массу газа и разделите ее на молярный объем при нормальных условиях.
Решение:
Сложение масс из периодической таблицы дает 1 моль NO 2 = 46,0 г.
Мы знаем, что при нормальных условиях 1 моль NO 2 = 22,4 л
(46 г22,4 л)=2,1 г/л
Упражнение
Рассчитайте плотность хлора в г/л при нормальных условиях.
Ответ: 3,17 г/л
Пример 12.1-3
Рассчитайте массу в кг 485 мл газообразного кислорода при нормальных условиях.
Дано: объем газа.
Запрашиваемый: масса газа на СТП.
Стратегия:
Преобразуйте мл в л, затем используйте 22,4 л/моль, чтобы преобразовать в моли, затем используйте формулу веса кислорода, чтобы преобразовать моли в граммы, затем переведите граммы в килограммы.
Решение:
(485мл)(1л1000мл)(1моль22,4л)(32,0г1моль)(1кг1000г)=6,93×10-4кг
Ответ: 2,5 г
Пример 12.
 1-4
1-4Для реакции
N 2 (г) + 3H 2 (г) → 2NH 3 (г)
Сколько литров NH 3 , на STP, может быть произведено из 1,3 г H 2 ?
Дано: масса реактива.
Запрашиваемый: объем газообразного продукта на СТП.
Стратегия:
Используйте стехиометрию для расчета количества молей аммиака, которое может быть получено. Затем переведите моли в л, используя молярный объем газа при нормальных условиях.
Решение:
(1,3 г3)(1мольч32,0г)(2мольNч43мольч3)(22,4л1моль)=9,7 л
Упражнение
Рассчитайте количество литров газообразного кислорода при СТП, которое может прореагировать с 28,2 г натрия с образованием оксида натрия.
Ответ: 6,87 л
Резюме
Авогадро постулировал, что объем газа прямо пропорционален количеству присутствующих молей газа ( закон Авогадро ). 1 моль любого газа при 1 атм и 0°C занимает 22,4 л. Этот молярный объем можно использовать в расчетах плотности или стехиометрии.
Численные задачи
Каков объем 17,88 моль Ar при нормальных условиях?
Сколько молей содержится в 334 л H 2 при STP?
Сколько литров при СТП CO 2 получается из 100,0 г C 8 H 18 , приблизительная формула бензина?
2С 8 H 18 (л) + 25O 2 (г) → 16CO 2 (г) + 18H 2 O(л)
Сколько литров O 2 требуется при нормальных условиях для сжигания 3,77 г бутана из одноразовой зажигалки?
2C 4 H 10 (ж) + 13O 2 (ж) → 8CO 2 (ж) + 10H 2 O(ж)
Какова плотность каждого газа при нормальных условиях?
- Он
- Не
- Ар
- Кр
Какова плотность каждого газа при нормальных условиях?
- В 2
- О 2
- Н 2
Если 3,45 × 10 22 атомов Ar имеют объем 1,55 л при определенной температуре и давлении, то какой объем имеют 6,00 × 10 23 атомов Ar при той же температуре и давлении?
Если 5,55 × 10 22 атомов Не занимают объем 2,06 л при 0°С и давлении 1,00 атм, то какой объем занимают 2,08 × 10 23 атома He занимают при тех же условиях?
Используйте закон Авогадро для определения конечного объема газа, начальный объем которого равен 6,72 л, начальное количество равно 3,88 моль, а конечное количество равно 6,10 моль.
 Предположим, что давление и температура поддерживаются постоянными.
Предположим, что давление и температура поддерживаются постоянными.Используйте закон Авогадро для определения конечного количества газа, начальный объем которого составляет 885 мл, начальное количество составляет 0,552 моль, а конечный объем составляет 1477 мл. Предположим, что давление и температура поддерживаются постоянными.
Сбалансируйте каждое химическое уравнение, а затем определите объем указанного реагента при нормальных условиях, необходимый для завершения реакции. В предположении полной реакции, каков объем продуктов?
- SO 2 (г) + O 2 (г) → SO 3 (г) с учетом 2,4 моль O 2
- H 2 (г) + Cl 2 (г) → HCl (г) с учетом 0,78 г H 2
- C 2 H 6 (г) + O 2 (г) → CO 2 (г) + H 2 O(г) с учетом 1,91 моль O 2
Во время выплавки железа углерод реагирует с кислородом с образованием монооксида углерода, который затем реагирует с оксидом железа (III) с образованием металлического железа и диоксида углерода.
 Если производится 1,82 л CO 2 на СТП,
Если производится 1,82 л CO 2 на СТП,- какая масса СО расходуется?
- какой объем СО на СТП расходуется?
- сколько O 2 (в литрах) используется при STP?
- какая масса углерода потребляется?
- сколько производится металлического железа (в граммах)?
При полном разложении образца хлората калия образовалось 1,34 г хлорида калия и газообразный кислород.
- Какова масса KClO 3 в исходном образце?
- Какая масса кислорода образуется?
- Какой объем кислорода производится на СТП?
Ответить
401 л
157 л
- 0,179 г/л
- 0,901 г/л
- 1,78 г/л
- 3,74 г/л
27,0 л
10,6 л
- 2,20 г KClO 3
- 0,863 г О 2
- 604 мл О 2
ChemTeam: молярный объем
ChemTeam: молярный объемМолярный объем
Вернуться в меню KMT & Gas Laws
Молярный объем – это объем, занимаемый одним молем идеального газа при нормальных условиях. Его значение:
Его значение:
22,414 л моль¯ 1
На самом деле известно еще на несколько знаков после запятой, но приведенного выше числа должно оказаться достаточно. Это значение известно уже около 200 лет, и оно не является константой природы, как, скажем, заряд электрона. Если бы мы выбрали другую стандартную температуру, то молярный объем был бы другим.
Используя PV = nRT, вы можете рассчитать значение молярного объема. V — неизвестное значение, а n = 1,00 мол. Установите P и T на их стандартные значения и используйте R = 0,08206.
(1,00 атм) (V) = (1,00 моль) (0,08206 л атм моль¯ 1 K¯ 1 ) (273 K)В = 22,4 л
Молярный объем не так часто встречается в задачах. Как следствие, учителям иногда нравится использовать молярный объем в тесте, чтобы сбить ребенка с толку!! Давайте сделаем несколько примеров.
Кстати, задачи ниже можно решить и с помощью PV = nRT. Имейте в виду, что использование молярного объема (как в задачах ниже) работает только в STP.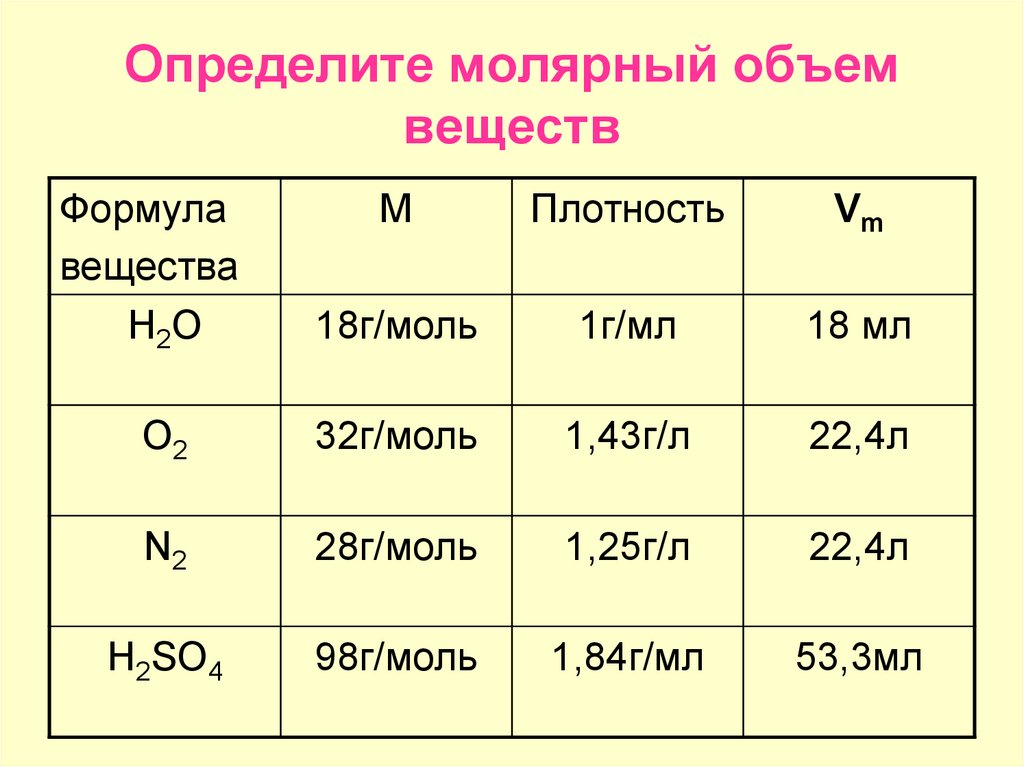 Если у вас нестандартные условия, вы ДОЛЖНЫ использовать PV = nRT.
Если у вас нестандартные условия, вы ДОЛЖНЫ использовать PV = nRT.
Пример #1: у вас есть 2,00 моль сухого H 2 при нормальных условиях. Сколько это литров?
Решение:
(2,00 моль) (22 414 л/моль) = 44,8 л (до трех знаков инжира)
Пример #2: 0,250 моль HCl сколько литров займет при нормальных условиях?
Решение:
х 22,414 л ––––––– = ––––––– 0,250 моль моль x = (0,250 моль) (22,414 л моль¯ 1 )
x = 5,60 л (до трех цифр)
Пример №3: Чему равен молярный объем при 576 К?
Решение:
Строго говоря, это не более чем проблема объема-температуры (закон Чарльза), но по какой-то причине добавление в задачу «молярного объема» приводит людей в замешательство.

 у. 3 г H2?
у. 3 г H2? у.?
у.? у.?
у.? у.?
у.?
 Предположим, что давление и температура поддерживаются постоянными.
Предположим, что давление и температура поддерживаются постоянными. Если производится 1,82 л CO 2 на СТП,
Если производится 1,82 л CO 2 на СТП,