Степень окисления — ГДЗ Габриелян Сладков 8 класс рабочая тетрадь
ЧАСТЬ 1
1. Степень окисления (с. о.) — это условный заряд атомов химического элемента в сложном веществе, вычисленный на основе предположения, что оно состоит из простых ионов.
Следует знать!
1) В соединениях с. о. водорода = +1, кроме гидридов .
2) В соединениях с. о. кислорода = -2, кроме пероксидов  и фторидов 
3) Степень окисления металлов всегда положительна.
Для металлов главных подгрупп первых трёх групп с. о. постоянна:
металлы IA группы — с. о. = +1,
металлы IIA группы — с. о. = +2,
металлы IIIA группы — с. о. = +3.
4
У свободных атомов и простых веществ с. о. = 0. 5
Суммарная с. о. всех элементов в соединении = 0.
2. Способ образования названий двухэлементных (бинарных) соединений.
3.
4. Дополните таблицу «Названия и формулы бинарных соединений».
5. Определите степень окисления выделенного шрифтом элемента сложного соединения.
ЧАСТЬ 2
1. Определите степени окисления химических элементов в соединениях по их формулам. Запишите названия этих веществ.
2. Разделите вещества FeO, Fe2O3, CaCl2, AlBr3, CuO, K2O, BaCl2, SO3 на две группы. Запишите названия веществ, указав степени окисления.
3. Установите соответствие между названием и степенью окисления атома химического элемента и формулой соединения.
4. Составьте формулы веществ по названию.
5. Сколько молекул содержится в 48 г оксида серы (IV)?
6. С помощью Интернета и других источников информации подготовьте сообщение о применении какого-либо бинарного соединения по следующему плану:
1) формула;
2) название;
3) свойства;
4) применение.
h3O вода, оксид водорода. Вода при обычных условиях жидкость, без цвета, запаха, в толстом слое – голубая. Температура кипения около 100⁰С. Является хорошим растворителем. Состоит молекула воды из двух атомов водорода и одного атома кислорода, это его качественный и количественный состав. Это сложное вещество, для него характерны следующие химические свойства: взаимодействие со щелочными металлами, щелочноземельными металлами.
Реакции обмена с водой называются гидролизом. Эти реакции имеют большое значение в химии.
7. Степень окисления марганца в соединении К2МnO4 равна: 3) +6
8. Наименьшую степень окисления хром имеет в соединении, формула которого: 1) Сг2O3
9. Максимальную степень окисления хлор проявляет в соединении, формула которого: 3) Сl2O7
Разбор и решение задания №14 ОГЭ по химии
В 14 задании нам потребуются знания об окислении и восстановлении, понятия окислитель и восстановитель, окислительно-восстановительная реакция.
Теория к заданию №14 ОГЭ по химии
Степень окисления — условная величина, показывающая заряд атома в молекуле.
Степень окисления никогда не показывает реальный заряд атома — это условная величина, принимаемая нами для удобства рассчетов химических реакций.
Чтобы определить степень окисления атома в молекуле, следует пользоваться следующими правилами:
- степень окисления водорода всегда +1 (исключение — гидриды металлов)
- степень окисления кислорода всегда -2 (исключения — пероксиды и фториды)
- степень окисления металлов первой группы +1, второй +2, алюминия +3
Окислитель — это атом или ион в молекуле, который забирает электроны.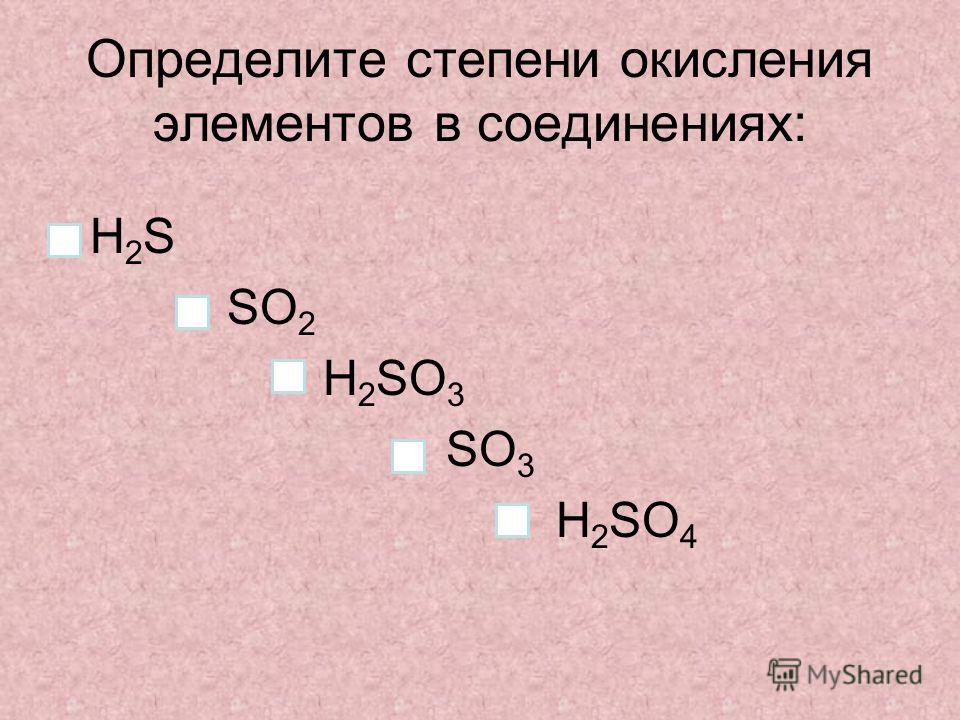
Восстановитель — это атом или ион в молекуле, который отдает электроны.
Окислитель в ходе реакции восстанавливается, а восстановитель наоборот — окисляется!
Наиболее часто встречающимися окислителями являются кислоты, соли и оксиды с максимально положительной степенью окисления входящего в них элемента.
- кислоты: HNO3, h3SO4, HClO4, h3Cr2O7
- соли: KСlO4, KClO3, KNO3, KMnO4, K2Cr2O7
- оксиды: PbO2, Mn2O7, CrO3, N2O5
- активные неметаллы – фтор, хлор, кислород, озон
Наиболее часто встречающиеся восстановители:
- металлы
- вещества с минимально возможной (отрицательной) степенью окисления неметалла
— водородные соединения: NН3, HI, HBr, h3S
— соли: KI, NaBr, K2S
Составление окислительно-восстановительной реакции (ОВР)
Основное правило, которым мы должны руководствоваться при составлении ОВР:
Количество электронов, отданное восстановителем, равно количеству электронов, принятых окислителем.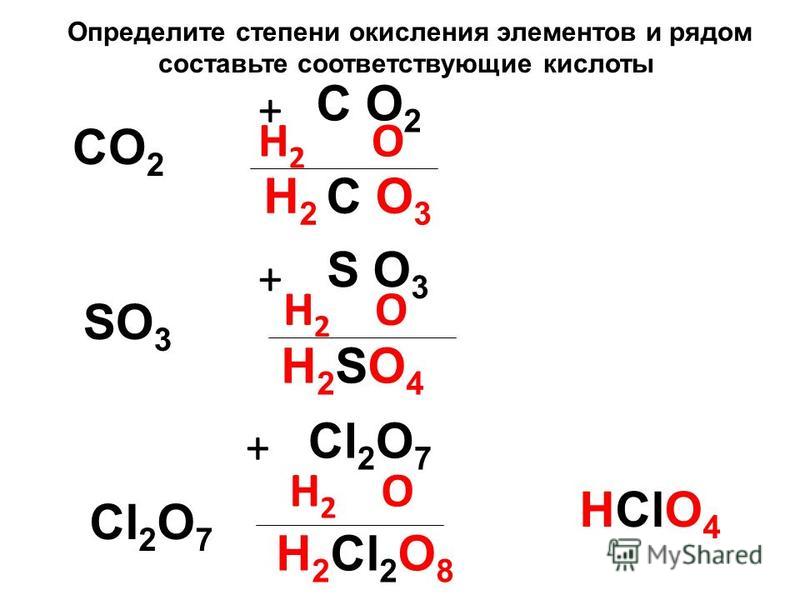
Именно этот факт позволяет уравнять химическую реакцию.
Разбор типовых вариантов задания №14 ОГЭ по химии
Первый вариант задания
Сера является окислителем в реакции:
- h3S + I2 = S + 2HI
- 3S + 2Al = Al2S3
- 2SO2 + О2 = 2SO3
- S + 3NO2 = SO3 + 3NO
Распишем первое уравнение:
h3S + I2 = S + 2HI
Исходные вещества:
- степень окисления серы в молекуле сероводорода равен -2, так как водород всегда +1
- степень окисления йода 0, так как это простое вещество
Продукты реакции:
- степень окисления серы 0, простое вещество
- степень окисления йода -1, так как водород +1
Анализируем:
- сера поменяла степень окисления с -2 до 0, значит отдала электроны (целых два на один атом :-)) — значит она восстановитель (но сама сера окислилась!)
- йод поменял степень окисления с 0 до -1, значит он принял электроны — окислитель (но сам по себе йод восстановился!)
Перейдем ко второй реакции:
3S + 2Al = Al2S3
Исходные вещества:
- степень окисления серы 0, простое вещество
- степень окисления алюминия 0, так как это тоже простое вещество
Поскольку реагирует металл и неметалл, то можно сразу понять, что металл восстановитель, а неметалл — окислитель и это верный ответ, но мы продолжим разбор 😉
Продукты реакции:
- степень окисления алюминия (из моих правил вверху) +3
- степень окисления серы -2
Анализируем:
- сера из нулевой степени окисления стала -2, значит забрала электроны и восстановилась, но сама сера — окислитель
- алюминий отдал электроны и окислился — он восстановитель
Третья реакция:
2SO2 + О2 = 2SO3
Исходные вещества:
- степень окисления серы +4, так как у кислорода заряд -2, и их два атома
- степень окисления кислорода 0, так как это простое вещество
Поскольку реагирует кислород и образуется оксид, можно догадаться, что сера здесь выступает восстановителем и окисляется, докажем это:
Продукты реакции:
- степень окисления серы +6
- степень окисления кислорода -2
Анализируем:
- сера отдала последние два электрона и окислилась, являясь восстановителем
- кислород забрал электроны и восстановился, являясь окислителем
Последняя реакция:
S + 3NO2 = SO3 + 3NO
Исходные вещества:
- степень окисления серы 0, так как это простое вещество
- степень окисления азота +4, так как у кислорода -2, и их два атома
Продукты реакции:
- степень окисления серы +6, так как у кислорода степень окисления -2, и их три атома в молекуле
- степень окисления азота +2, так как у кислорода -2
Анализируем:
- сера отдала 6 электронов и окислилась, являясь восстановителем
- азот забрал электроны (+4 -> +2) и восстановился, являясь окислителем
Ответ: 2
Присвойте степени окисления каждому элементу следующих ионов.
 …
…Recent Channels
- General Chemistry
Chemistry
- General Chemistry
- Organic Chemistry
- Analytical Chemistry
- GOB Chemistry
- Biochemistry
Biology
- General Biology
- Microbiology
- Анатомия и физиология
- Генетика
- Клеточная биология
Math
- College Algebra
- Trigonometry
- Precalculus
Physics
- Physics
Business
- Microeconomics
- Macroeconomics
- Financial Accounting
Social Sciences
- Psychology
Начните вводить текст, затем используйте стрелки вверх и вниз, чтобы выбрать вариант из списка.
Общая химия6. Химические количества и водные реакцииРасчет степеней окисления
6:23
минуты
Задача 110d
Вопрос из учебника
Проверенное решение
Наши преподаватели рекомендовали это видео-решение как полезное для решения описанной выше задачи.
71просмотр
Было ли это полезно?
Смотреть дальше
Master Расчет числа окисления с небольшим видео-объяснением от Жюля Бруно
Начать обучение
Похожие видео
Связанные практики
Расчет степени окисления
Leah5sci MCAT
218views
Как рассчитать степень окисления или степень окисления? Easy Trick
Najam Academy
344views
Вычисление степени окисления
Не думайте слишком много! с Praxis Academic
167 просмотров
Расчет степеней окисления
Jules Bruno
453 просмотров
Как рассчитать степень окисления переходных металлов в координационных соединениях
Полное руководство ко всему
147Views
Как вычислять номера окисления — Базовое введение — DR K
Хемсимплифицированные
128Views
Оценки окисления — Учеб по химии
. Практические задачи
Практические задачи
Тайлер ДеВитт
218 просмотров
Как найти числа окисления (правила и примеры)
Уэйн Бреслин
165views
Рассчитайте номера окисления. Пример 1
Жюль Бруно
294Views
Рассчитайте номера окисления
jules
251views
Расчеты. Jules Bruno
301views
Расчет степеней окисления Пример 3
Jules Bruno
185views
Расчет степеней окисления
Jules Bruno
157views
Расчет степени окисления Пример 4
Jules Bruno
221views
Какова степень окисления $S{O_3}$?
Последняя обновленная дата: 09 -й апреля 2023
•
Общее представление: 201k
•
Просмотры сегодня: 2,74K
Ответ
Проверено
201K+ Просмот степень окисления и степень окисления это разные вещи. Степень окисления говорит нам, сколько электронов добавляется или удаляется из вида.
Полный ответ:
Теперь узнаем, что нам говорит степень окисления? Число окисления простыми словами можно назвать числом, которое определяется для элементов в химической комбинации. Степень окисления — это в основном количество электронов, которые атомы в молекуле могут разделить, потерять или получить, образуя химические связи с другими атомами другого элемента.
В триоксиде серы три атома кислорода и один атом серы. Атом кислорода несет заряд $-2$. Так как у нас три атома кислорода, то суммарный заряд кислорода составил $-6$. Теперь мы знаем, что триоксид серы является нейтральным соединением, он не несет никакого заряда, поэтому мы суммируем значения зарядов с нулем, чтобы найти степень окисления серы в триоксиде серы.
Пусть степень окисления серы равна x, таким образом,
$x = 6$
Таким образом, степень окисления серы в триоксиде серы равна $6$ .

