Аортальный стеноз лечение: протезирование аортального клапана, операция по замене аортального клапана сердца
При патологии аортального клапана частота осложнения в виде инфекционного эндокардита выше, чем при патологии митрального клапана. Двустворчатый аортальный клапан – самый частый врожденный порок сердца (распространенность — 2%). При обнаружении данной аномалии в детском возрасте пациенты должны в течение всей жизни находиться под наблюдением кардиолога, а при появлении клинической симптоматики аортального стеноза — так же и кардиохирурга.
Этиология:
- Воспалительные поражения: ревматизм, системная склеродермия, аортоартериит.
- Дегенеративные процессы: миксоматозная дегенерация.
- Атеросклероз.
- Инфекционные процессы: инфекционный эндокардит.
- Врожденная патология: двустворчатый аортальный клапан.
Отмечается тенденция к увеличению частоты инволюционных (дегенеративно-атеросклеротических) причин аортального стеноза, что привело к увеличению возрастных пациентов старше 60-65 лет, нуждающихся в хирургической коррекции аортального порока.
При врожденном или ревматическом поражении клапана отмечается длительный латентный период без клинических проявлений. Летальность и риск осложнений существенно увеличиваются с появлением симптомов заболевания. При стенокардии, обмороках и проявлениях сердечной недостаточности, обусловленной систолической дисфункцией левого желудочка средняя продолжительность жизни 5, 3 и 2года соответственно. При бессимптомном течении риск внезапной смерти невелик (даже при тяжелом аортальном стенозе), тогда как при наличии симптомов 15 – 20% больных умирают внезапно.
Скорость прогрессирования поражения аортального клапана:
- легкий аортальный стеноз (площадь отверстия аортального клапана -1.2 – 2 см2) становится тяжелым, требующим протезирования аортального клапана, за 10 лет – у 10% больных, за 25 лет – у 38%;
- при умеренном бессимптомном аортальном стенозе (площадь отверстия аортального клапана – 0.75 – 1.2 см2) протезирование аортального клапана через 10 лет требуется в 25% случаев;
- бессимптомный тяжелый аортальный стеноз (площадь отверстия аортального клапана < 0,75 см2) обычно прогрессирует быстрее; у 30 – 40% больных в течение 2-х лет появляются симптомы и возникает потребность в протезировании аортального клапана.

Мерцательная аритмия, аортальная недостаточность (спонтанная или вызванная инфекционным эндокардитом), митральная недостаточность и острый инфаркт миокарда ускоряют декомпенсацию.
При неосложненном течении аортального стеноза характерная аускультативная картина: систолический шум в точке Боткина и на основании сердца справа, проводится на сосуды шеи, ослабление 2-го тона за счет аортального компонента. Интенсивность систолического шума может уменьшаться при развитии систолической дисфункции левого желудочка и не является критерием тяжести порока. Часто течение аортального стеноза осложняется патологией митрального клапана («митрализация»).
Диагностика аортального стеноза
- ЭКГ;
- Рентгенография грудной клетки;
- Коронароангиография — проводится при показаниях к хирургическому лечению или подозрении на коронарный атеросклероз;
- МСКТ восходящей аорты с контрастированием – показано при постстенотическом расширении корня аорты;
- ЭхоКГ.
 ЭХОКГ позволяет определить: структуру клапана (двустворчатый клапан, утолщение створок, фиброз, кальциноз, вегетации), характер его движения (подвижность створок, степень открытия) и площадь отверстия; изменения корня аорты (постстенотическая дилатация), объем левого желудочка, выраженность гипертрофии левого желудочка, нарушения локальной сократимости левого желудочка (указывающие на ИБС), ФВ, объем левого предсердия, состояние других клапанов. Доплеровское исследование позволяет с высокой точностью определить градиент давления между аортой и левым желудочком.
ЭХОКГ позволяет определить: структуру клапана (двустворчатый клапан, утолщение створок, фиброз, кальциноз, вегетации), характер его движения (подвижность створок, степень открытия) и площадь отверстия; изменения корня аорты (постстенотическая дилатация), объем левого желудочка, выраженность гипертрофии левого желудочка, нарушения локальной сократимости левого желудочка (указывающие на ИБС), ФВ, объем левого предсердия, состояние других клапанов. Доплеровское исследование позволяет с высокой точностью определить градиент давления между аортой и левым желудочком.
Эхокардиографические критерии тяжести аортального стеноза с учетом площади аортального клапана (в норме площадь составляет 3 – 4 см2
):- умеренный стеноз 1 – 1.4см2
- тяжелый стеноз < 1 см2
- критический стеноз < 0,75 см2
Средний систолический градиент между аортой и ЛЖ на уровне аортального клапана менее 50 мм рт. ст. – гемодинамически малозначимый аортальный стеноз, 50 – 80 мм рт.ст. – умеренный аортальный стеноз, более 80 мм рт.ст. – резкий аортальный стеноз.
ст. – гемодинамически малозначимый аортальный стеноз, 50 – 80 мм рт.ст. – умеренный аортальный стеноз, более 80 мм рт.ст. – резкий аортальный стеноз.
Показания к хирургическому лечению (протезированию) аортального стеноза
(Американская Ассоциация сердца, Американская коллегия кардиологов)
Классификация рекомендаций и уровни достоверности в формате АКК/ААС:
- Класс I: Состояния, при которых есть доказательства и/или общее согласие, что процедура или метод лечения является благоприятным, полезным и эффективным.
- Класс II: Состояния, при которых есть противоречивые доказательства и/или расхождение во мнениях о полезности/эффективности процедуры или метода лечения.
- Класс IIА: Вес достоверность/мнение в пользу полезности/эффективности.
- Класс IIБ: Польза/эффективность менее хорошо установлены достоверностью/мнением.

- Класс III: Состояния, при которых есть доказательства и/или общее мнение, что процедура/метод лечения не полезны, не эффективны, а в некоторых случаях могут быть вредны.
Кроме того, уровни достоверности в поддержку рекомендаций изложены следующим образом:
- Уровень достоверности А: Данные получены из многочисленных рандомизированных клинических испытаний.
- Уровень достоверности В: Данные получены из единичных рандомизированных исследований или нерандомизированных испытаний.
- Уровень достоверности С: Только единодушное согласие экспертов, отдельные исследования случаев и стандарты лечения.
КЛАСС I
-
1. Протезирование аортального клапана показано симптомным пациентам с тяжелым аортальным стенозом (Уровень достоверности: B).
-
2. Протезирование аортального клапана показано пациентам с тяжелым аортальным стенозом, при операции аорто-коронарного шунтирования (АКШ).
 (Уровень достоверности: С).
(Уровень достоверности: С).
-
3. Протезирование аортального клапана показано пациентам с тяжелым аортальным стенозом, при операции на аорте или других клапанах сердца. (Уровень достоверности: C).
-
4. Протезирование аортального клапана показано пациентам с тяжелым аортальным стенозом и систолической дисфункцией ЛЖ (ФВ менее 50%). (Уровень достоверности: C).
КЛАСС IIА
Протезирование аортального клапана показано пациентам с умеренным аортальным стенозом, при операции АКШ, операции на аорте или других клапанах сердца. (Уровень достоверности: B).
КЛАСС IIБ
-
1. Протезирование аортального клапана показано асимптомным пациентам с тяжелым аортальным стенозом и патологическим ответом на нагрузку (например, развитие симптомов гипотензии). (Уровень достоверности: C).
-
2.
 Протезирование аортального клапана показано возрастным пациентам с тяжелым асимптомным аортальным стенозом, если существует высокая вероятность быстрого прогрессирования (возраст, кальциноз). (Уровень достоверности: C).
Протезирование аортального клапана показано возрастным пациентам с тяжелым асимптомным аортальным стенозом, если существует высокая вероятность быстрого прогрессирования (возраст, кальциноз). (Уровень достоверности: C).
-
3. Протезирование аортального клапана показано пациентам с легким аортальным стенозом, при операции АКШ, когда есть признаки умеренной — тяжелой кальцинации клапана, способной привести к быстрому прогрессированию. (Уровень достоверности: C).
-
4. Протезирование аортального клапана показано асимптомным пациентам с крайне тяжелым аортальным стенозом (площадь аортального клапана менее 0.6 cм2, средний градиент более 60 мм рт.ст. и скорость потока более 5.0 м/с), когда ожидаемая операционная летальность пациентов составляет менее 1.0%. (Уровень достоверности: C).
КЛАСС III
-
1. Протезирование аортального клапана не показано для предупреждения внезапной смерти у асимптомных пациентов с аортальным стенозом у кого нет ни одного показателя из списка рекомендаций Классов IIА/IIБ.

-
2. У возрастных пациентов с тяжелым, симптомным, кальцинированным аортальным стенозом протезирование аортального клапана является единственным эффективным методом лечения.
-
3. Молодые пациенты с врожденным или ревматическим аортальным стенозом могут быть кандидатами на вальвулотомию. Хотя нет единого мнения относительно оптимального срока проведения операции у асимптомных пациентов, для большинства пациентов можно разработать рациональные рекомендации.
Протезирование аортального клапана
За последние годы в хирургическом лечении клапанов сердца наблюдался значительный прогресс. Усовершенствование техники (в т.ч. аппаратов искусственного кровообращения), разработка единых стандартов и протоколов как предоперационного обследования, так и хода операции позволили снизить риски периоперационных осложнений, сделав саму операцию на клапанном аппарате сердца более безопасной, чем отказ от операции и попытка жить с дисфункцией клапана.
Виды хирургического лечения: операции по замене клапана сердца
Принципиально существует два вида операции на клапанах сердца: протезирование искусственным или биологическим протезом и пластика собственного клапана. Вполне естественно, что собственный клапан человека после удачной реконструкции функционирует лучше, чем искусственный протез. Но в случае невозможности сохранения собственного клапана единственный выход – замена его на протез.
Виды клапанов, используемых при протезировании
- Биологические клапаны. Могут быть выполнены из тканей животного или человека (гетеротрансплантаты, гомотрансплантаты, аутотрансплантаты). Биологические клапаны могут содержать некоторые искусственные компоненты для обеспечения поддержки клапана и его размещения. Основное преимущество такого клапана в отсутствии необходимости в пожизненной антикоагулянтной терапии (постоянном строгом приеме препаратов, значительно разжижающих кровь и требующем постоянной сдачи анализов крови), а основной минус – ограниченный срок службы (15 – 20 лет).

- Механические клапаны. Состоят целиком из механических элементов (титана и пиролитического углерода) и разработаны таким образом, чтобы заменять пациенту функции его собственного клапана. Механический клапан очень надёжен и долговечен, предназначен для многолетней полноценной работы, что является основным преимуществом, однако требует от пациента постоянного приема антикоагулянтов.
При протезировании аортального клапана доступ к клапану осуществляется посредством рассечения аорты в восходящем отделе (поперечная аортотомия). После иссечения створок аортального клапана и тщательной декальцинации фиброзного кольца последнее прошивается П-образными швами. С целью предотвращения прорезывания фиброзного кольца швы укрепляют тефлоновыми прокладками. Для выбора размера имплантируемого протеза диаметр фиброзного кольца измеряют специальными калибраторами. Выбранный протез имплантируют в аортальную позицию путем прошивания его оплетки. После фиксации протеза оценивают подвижность запирательных элементов механического протеза или коаптацию створок биологического клапана. При отсутствии ограничений их подвижности рассеченную аорту герметизируют двумя рядами швов.
При отсутствии ограничений их подвижности рассеченную аорту герметизируют двумя рядами швов.
Современные подходы к диагностике аортального стеноза | Синьков А.В.
В обзоре представлены современные данные по эпидемиологии, этиологии и диагностике аортального стеноза, классификации степени кальциноза аортального клапана и количественной оценке тяжести аортального стеноза, приведены показания к интервенционному лечению аортального стеноза.
Введение
В 2017 г. вышли в свет два основополагающих руководства для врачей, посвященные проблеме диагностики аортального стеноза (АС), подготовленные ведущими экспертами в этой области: совместное руководство Европейского общества кардиологии (ESC) и Европейской ассоциации торакальной хирургии (EACTS) по диагностике и лечению болезней сердечных клапанов (2017 ESC/EACTS Guidelines for the management of valvular heart disease [1]) и 2-е издание руководства по эхокардиографии Европейской ассоциации сердечно-сосудистой визуализации (The EACVI Textbook of Echocardiography, 2 ed. [2]). Содержащиеся в этих руководствах алгоритмы диагностики АС отражают согласованное мнение ведущих мировых экспертных групп, включают сумму имеющихся на настоящий момент научных доказательств, основаны на результатах многоцентровых
[2]). Содержащиеся в этих руководствах алгоритмы диагностики АС отражают согласованное мнение ведущих мировых экспертных групп, включают сумму имеющихся на настоящий момент научных доказательств, основаны на результатах многоцентровых
рандомизированных контролируемых исследований и призваны оптимизировать принятие диагностических решений в повседневной врачебной практике.
Представляется обоснованным знакомство практикующих врачей с содержащимися в этих руководствах современными подходами к диагностике АС.
Эпидемиология аортального стеноза
АС является самым распространенным заболеванием сердечных клапанов в развитых странах. Распространенность АС составляет около 2% населения в возрасте 70–80 лет и увеличивается до 3–9% в возрасте старше 80 лет. Среди населения старших возрастных групп АС представлен в основном в виде «кальцинированного АС» (2–7% населения старше 65 лет). У молодых лиц ведущей причиной АС является врожденная патология. Случаи ревматического АС в развитых странах в настоящее время достаточно редки [2].
Случаи ревматического АС в развитых странах в настоящее время достаточно редки [2].
Диагностика аортального стеноза
В последние годы для диагностики АС был предложен ряд современных неинвазивных методов: трансторакальная и чреспищеводная эхокардиография (ЭхоКГ), стресс-ЭхоКГ, магнитно-резонансная томография (МРТ), мультиспиральная компьютерная томография (МСКТ). Следует отметить, что по своим диагностическим возможностям неинвазивные методы сопоставимы, а в ряде случаев и превышают возможности классических инвазивных методов (ангиография, катетеризация сердца), позволяют не только диагностировать АС, но и определить его этиологию, тяжесть, оценить прогноз и показания к оперативному лечению [1].
Наиболее распространенной неинвазивной диагностической методикой в настоящее время является ЭхоКГ, позволяющая получить всестороннюю оценку АС. Именно данные ЭхоКГ служат основой для определения показаний к интервенционному лечению.
Этиология аортального стеноза
Выделяют 3 формы обструкции выносящего тракта левого желудочка (ЛЖ): клапанную, надклапанную и подклапанную.
При подклапанной форме уровень обструкции локализуется ниже кольца АК. Причиной фиксированной подклапанной обструкции является наличие тонкой фиброзной мембраны или фиброзно-мышечного сужения выносящего тракта ЛЖ. Динамическая подклапанная обструкция чаще всего обусловлена гипертрофической кардиомиопатией [2].
Надклапанный АС является редким врожденным заболеванием, причина которого — гипоплазия восходящей аорты (синдром Вильямса — Бойрена).
Наиболее частой формой АС является клапанная форма. Во взрослом возрасте основная причина АС — дистрофическая кальцификация АК, характеризующаяся фиброзным утолщением и ограничением подвижности створок клапана. Отложение кальция происходит в основном в теле створки со стороны аорты и в минимальной степени затрагивает комиссуры. Кальцификации подвержены как двух-, так и трехстворчатый АК. 60% больных с кальцифицированным АС имеют двухстворчатый АК [2].
Кальцификации подвержены как двух-, так и трехстворчатый АК. 60% больных с кальцифицированным АС имеют двухстворчатый АК [2].
Ревматическое ремоделирование АК характеризуется фиброзным утолщением и расширенной васкуляризацией створок. Наиболее характерной чертой данной патологии являются спайки комиссур клапана, ограничивающие раскрытие створок и уменьшающие эффективную площадь отверстия клапана [2].
Причинами врожденного клапанного АС являются сращение двух или более створок, гипоплазия клапанного кольца, утолщение, деформация и ригидность створок. Наиболее частая причина врожденного АС — двухстворчатый АК, встречающийся у 0,5–2% населения, но необходимо помнить о возможности одно- и четырехстворчатого АК как причины АС [2].
Эхокардиографическая оценка морфологии аортального клапана и сопутствующих изменений
Морфологическую оценку АК лучше всего проводить в парастернальной проекции по короткой оси. Полезную информацию можно получить и при исследовании в парастернальной проекции по длинной оси, апикальной трехкамерной проекции и апикальной пятикамерной проекции. Чреспищеводная ЭхоКГ является более предпочтительной для оценки АК по сравнению с трансторакальной ЭхоКГ.
Полезную информацию можно получить и при исследовании в парастернальной проекции по длинной оси, апикальной трехкамерной проекции и апикальной пятикамерной проекции. Чреспищеводная ЭхоКГ является более предпочтительной для оценки АК по сравнению с трансторакальной ЭхоКГ.
При ЭхоКГ зоны кальцификации выглядят как выраженные гиперэхогенные образования с акустической тенью. Тем не менее дифференциация между кальцификацией и высокой степенью фиброза при ЭхоКГ может быть затруднительной, для точной диагностики необходимо использовать другие диагностические методики (например, МСКТ).
Кальцификация АК ранее рассматривалась как дегенеративные изменения, поскольку предполагалось, что она связана с общими дегенеративными процессами в организме. Однако последние данные свидетельствуют, что кальцификация представляет собой активный процесс, по патогенезу напоминающий атеросклероз. Поэтому термин «кальцифицированный» (кальцинированный) АК является более точным, чем термин «дегенеративно измененный». Кальцификация двухстворчатого АК встречается чаще и развивается раньше, чем трехстворчатого АК.
Кальцификация двухстворчатого АК встречается чаще и развивается раньше, чем трехстворчатого АК.
Современная классификация выраженности кальцификации АК предполагает деление на 3 степени:
незначительная (mild): изолированные, единичные, мелкие кальцинаты;
умеренная (moderate): множественные кальцинаты, по размеру больше, чем при незначительной степени;
выраженная (severe): распространенная кальцификация и утолщение всех створок.
Было показано, что данная классификация имеет прогностическое значение при долговременном наблюдении. При МСКТ кальцификация определяется как выявление 4 и более смежных пикселей с плотностью >130 единиц Хаунсфилда.
Наиболее частыми ассоциированными с АС изменениями являются гипертрофия миокарда ЛЖ и дилатация восходящей аорты. Концентрическая гипертрофия ЛЖ — естественный компенсаторный механизм миокарда в ответ на длительную нагрузку давлением. Степень гипертрофии зависит от фенотипа и может варьировать от выраженной до незначительной и даже находиться в пределах нормальных значений. Случаи выраженной гипертрофии необходимо дифференцировать с гипертрофической кардиомиопатией и инфильтративными болезнями миокарда. Для оценки степени гипертрофии рекомендуется определять массу миокарда ЛЖ. Дилатация восходящей аорты диагностируется при ее увеличении больше 2,1 см/м2 [2].
Случаи выраженной гипертрофии необходимо дифференцировать с гипертрофической кардиомиопатией и инфильтративными болезнями миокарда. Для оценки степени гипертрофии рекомендуется определять массу миокарда ЛЖ. Дилатация восходящей аорты диагностируется при ее увеличении больше 2,1 см/м2 [2].
При ревматическом поражении АК стеноз часто сочетается с аортальной недостаточностью и сопутствующим вовлечением митрального клапана. Недостаточность АК приводит к увеличению трансаортального объемного кровотока и повышению показателя градиента давления, в то время как клинически значимая митральная недостаточность (умеренная и тяжелая степень), наоборот, снижает трансаортальный кровоток и связанные с ним гемодинамические показатели. В обоих случаях для оценки АС рекомендуется использовать площадь клапана, являющуюся независимым от объема кровотока показателем.
Двухстворчатый АК обычно сочетается с коарктацией аорты и другими врожденными пороками сердца. Преобладающим вариантом двухстворчатого АК является сращение левой и правой коронарных створок (~80%) (передне-задний тип), реже наблюдается сращение правой коронарной и некоронарной створок (~19%) (право-левый тип), крайне редким вариантом является сращение левой коронарной и некоронарной створок (~1%). Для постановки диагноза важна хорошая визуализация АК в парастернальной позиции по короткой оси, где АК имеет характерный вид «рыбьего рта». Симптомами, подтверждающими наличие двухстворчатого АК, являются куполообразный вид створок в парастернальной позиции по длинной оси и эксцентрическая линия смыкания створок в диастолу в М-режиме. Гиперэхогенная линия шва в месте сращения створок может создавать впечатление трехстворчатого АК при трансторакальной ЭхоКГ. Для постановки точного диагноза нередко требуется проведение чреспищеводной ЭхоКГ [2].
Для постановки диагноза важна хорошая визуализация АК в парастернальной позиции по короткой оси, где АК имеет характерный вид «рыбьего рта». Симптомами, подтверждающими наличие двухстворчатого АК, являются куполообразный вид створок в парастернальной позиции по длинной оси и эксцентрическая линия смыкания створок в диастолу в М-режиме. Гиперэхогенная линия шва в месте сращения створок может создавать впечатление трехстворчатого АК при трансторакальной ЭхоКГ. Для постановки точного диагноза нередко требуется проведение чреспищеводной ЭхоКГ [2].
Количественная оценка выраженности аортального стеноза
В норме площадь АК составляет 3–4 см2, поток через клапан имеет ламинарное течение, пиковая скорость потока — обычно меньше 2 м/с. При сужении АК скорость чресклапанного потока увеличивается пропорционально степени сужения.
Оценка скорости потока и градиента давления
При ЭхоКГ измерение скорости чресклапанного потока осуществляется в режиме постоянно-волнового допплера. При уменьшении площади клапана отмечается позднее, чем в норме, появление пика допплеровского сигнала в систолу. Для оценки степени стеноза используют как пиковые (максимальные) чресклапанные градиенты давления, вычисляемые на основе упрощенного уравнения Бернулли, так и средние чресклапанные градиенты давления, получаемые путем усреднения всех одномоментных градиентов давления в течение систолы. Средние чресклапанные градиенты по своей величине и физиологической составляющей в большей степени сопоставимы с градиентами, получаемыми при инвазивной катетеризации сердца, и являются более предпочтительными для оценки степени стеноза.
При уменьшении площади клапана отмечается позднее, чем в норме, появление пика допплеровского сигнала в систолу. Для оценки степени стеноза используют как пиковые (максимальные) чресклапанные градиенты давления, вычисляемые на основе упрощенного уравнения Бернулли, так и средние чресклапанные градиенты давления, получаемые путем усреднения всех одномоментных градиентов давления в течение систолы. Средние чресклапанные градиенты по своей величине и физиологической составляющей в большей степени сопоставимы с градиентами, получаемыми при инвазивной катетеризации сердца, и являются более предпочтительными для оценки степени стеноза.
В то же время следует учитывать, что допплеровское измерение скорости потока и градиента давления может подвергаться влиянию ряда систематических и случайных ошибок, приводящих к гипер- или гиподиагностике степени АС. Основными ошибками являются: несовпадение ультразвукового луча с направлением потока, игнорирование высокой скорости в проксимальном отделе выносящего тракта ЛЖ при его обструкции, наложение на чресклапанный аортальный поток сигналов митральной или трикуспидальной регургитации, отсутствие усреднения нескольких комплексов при сердечной аритмии, игнорирование зависимости чресклапанной скорости и градиента от увеличенного сердечного выброса при выраженной аортальной регургитации, анемии, тиреотоксикозе и наличии внутрисердечных шунтов.
Определение эффективной площади отверстия АК методом постоянства потока
Вычисляется на основе равенства потоков в выносящем тракте ЛЖ и на уровне АК. Измерив площадь, среднюю скорость потока в выносящем тракте ЛЖ и среднюю скорость потока через АК, можно определить эффективную площадь отверстия АК. Скорость в выносящем тракте ЛЖ определяется в импульсно-волновом допплеровском режиме, а скорость через АК — в постоянно-волновом режиме. Скорость и площадь в выносящем тракте ЛЖ должны определяться на одном уровне — примерно на 0,5–1 см проксимальнее АК. Данный алгоритм встроен во все современные ультразвуковые аппараты. Ограничения точности измерений и необходимые допущения для упрощения расчетов при этом методе могут служить источником ошибок измерения эффективной площади отверстия АК, в основном в сторону меньшей величины площади. Более точное определение площади АК может быть получено при использовании чреспищеводной, трехмерной ЭхоКГ и МРТ [2].
Планиметрия АК
Точное очерчивание отверстия АК в двухмерном режиме затруднено у большинства пациентов из-за сложной формы стеноза и сопутствующего кальциноза. Этот метод не рекомендуется как рутинное измерение площади АК, но может быть полезен у определенных групп пациентов в дополнение к другим методам. Следует также отметить, что расстояние между створками АК в М-режиме в настоящее время не является показателем для оценки степени АС [2].
Классификация тяжести аортального стеноза
Классификация тяжести АС включает последовательность степеней увеличения выраженности стеноза, определяемой на основе пиковой скорости аортальной струи, среднего чресклапанного градиента давления и площади АК (табл. 1). Следует отметить, что градация степеней тяжести АС основана на прогностической информации, полученной в клинических исследованиях, а не на физических или гемодинамических критериях. Как показали клинические исследования, пиковая скорость, средний градиент и площадь клапана (вычисляемая методом постоянства потока) полностью коррелируют между собой. Прогностическое значение пиковой скорости аортальной струи отмечается во всем спектре градаций АС, даже за пределами пороговых значений тяжелого АС, в то время как определение площади клапана подвержено значительной вариабельности [2].
Как показали клинические исследования, пиковая скорость, средний градиент и площадь клапана (вычисляемая методом постоянства потока) полностью коррелируют между собой. Прогностическое значение пиковой скорости аортальной струи отмечается во всем спектре градаций АС, даже за пределами пороговых значений тяжелого АС, в то время как определение площади клапана подвержено значительной вариабельности [2].
Аортальный склероз определяется как наличие кальцификации АК без гемодинамической обструкции кровотока, легкий стеноз характеризует начальные явления стеноза с незначительной обструкцией кровотока, умеренный стеноз — существенную, клинически значимую обструкцию кровотока, тяжелый стеноз — крайнюю степень, требующую оперативного лечения.
Поскольку скорость и чресклапанный градиент АК существенно зависят от объема кровотока, представленные в таблице 1 пороговые значения применимы только при нормальных значениях сердечного выброса (индекс сердечного выброса >35 мл/м2). У лиц с чрезмерно большой или, наоборот, маленькой площадью поверхности тела рекомендуется индексировать площадь клапана к площади поверхности тела (пороговое значение ≤0,6 см2/м2 для тяжелого АС) [2].
У лиц с чрезмерно большой или, наоборот, маленькой площадью поверхности тела рекомендуется индексировать площадь клапана к площади поверхности тела (пороговое значение ≤0,6 см2/м2 для тяжелого АС) [2].
При однонаправленных изменениях скорости, градиента и площади клапана классификация тяжести АС не представляет проблем, но разнонаправленные изменения показателей могут вызывать затруднения. Площадь АК может быть >1 см2, несмотря на скорость >4 м/с и средний градиент >40 мм рт. ст., при повышенном объемном чресклапанном кровотоке в случае выраженной аортальной регургитации, при наличии внутрисердечных шунтов и при состояниях с высоким сердечным выбросом (гипертермия, анемия, тиреотоксикоз). Причиной расхождения значений площади и гемодинамических показателей могут быть также ошибки измерения диаметра выносящего тракта ЛЖ, занижающие величину площади (<1 см2) при скорости <4 м/с и среднем градиенте <40 мм рт. ст. [2].
Причиной расхождения показателей площади клапана (<1 см2), скорости (<4 м/с) и среднего градиента (<40 мм рт. ст.) может являться систолическая дисфункция ЛЖ (снижение фракции выброса (ФВ) <50% и индекса сердечного выброса <35 мл/м2) — так называемый АС с низким кровотоком — низким градиентом при уменьшенной ФВ. Таким больным рекомендуется проведение стресс-ЭхоКГ с добутамином. При наличии контрактильного резерва (увеличение ударного объема на 20% и более) об истинно тяжелом АС будет свидетельствовать сохраняющийся низкий показатель площади клапана (<1–1,2 см2) при значительном увеличении среднего чресклапанного градиента (>40 мм рт. ст.), при псевдотяжелом АС (первичное поражение миокарда) средний чресклапанный градиент остается низким (<30–40 мм рт. ст.), но площадь клапана увеличивается (>1–1,2 см2) [2].
ст.) может являться систолическая дисфункция ЛЖ (снижение фракции выброса (ФВ) <50% и индекса сердечного выброса <35 мл/м2) — так называемый АС с низким кровотоком — низким градиентом при уменьшенной ФВ. Таким больным рекомендуется проведение стресс-ЭхоКГ с добутамином. При наличии контрактильного резерва (увеличение ударного объема на 20% и более) об истинно тяжелом АС будет свидетельствовать сохраняющийся низкий показатель площади клапана (<1–1,2 см2) при значительном увеличении среднего чресклапанного градиента (>40 мм рт. ст.), при псевдотяжелом АС (первичное поражение миокарда) средний чресклапанный градиент остается низким (<30–40 мм рт. ст.), но площадь клапана увеличивается (>1–1,2 см2) [2].
Наибольшие диагностические сложности определения тяжести АС могут возникать в случае снижения площади клапана <1 см2 при скорости <4 м/с, среднем градиенте <40 мм рт. ст. и нормальной ФВ, это так называемый тяжелый АС с парадоксально низким кровотоком — низким градиентом при сохранной ФВ. Данный синдром может встречаться у пациентов (чаще пожилых, с длительным анамнезом артериальной гипертензии), с выраженной гипертрофией и уменьшенным объемом ЛЖ, приводящими к снижению чресклапанного кровотока (индекс сердечного выброса <35 мл/м2), несмотря на сохранность нормальной ФВ. Для дифференциального диагноза тяжелого и псевдотяжелого АС рекомендуется использовать шкалу кальцификации клапана при неконтрастной МСКТ (табл. 2). При степени кальцификации АК >1600 для женщин и >3000 для мужчин тяжелый АС высоковероятен, при степени кальцификации >1200 для женщин и >2000 для мужчин тяжелый АС вероятен, при степени кальцификации <800 для женщин и <1600 для мужчин тяжелый АС маловероятен [1].
Данный синдром может встречаться у пациентов (чаще пожилых, с длительным анамнезом артериальной гипертензии), с выраженной гипертрофией и уменьшенным объемом ЛЖ, приводящими к снижению чресклапанного кровотока (индекс сердечного выброса <35 мл/м2), несмотря на сохранность нормальной ФВ. Для дифференциального диагноза тяжелого и псевдотяжелого АС рекомендуется использовать шкалу кальцификации клапана при неконтрастной МСКТ (табл. 2). При степени кальцификации АК >1600 для женщин и >3000 для мужчин тяжелый АС высоковероятен, при степени кальцификации >1200 для женщин и >2000 для мужчин тяжелый АС вероятен, при степени кальцификации <800 для женщин и <1600 для мужчин тяжелый АС маловероятен [1].
Встречающиеся в клинической практике случаи уменьшения площади клапана <1 см2 при среднем градиенте <40 мм рт. ст. и нормальном ударном объеме чаще всего являются следствием ошибок измерения площади клапана и в действительности соответствуют умеренному АС [2].
Важнейшим этапом менеджмента АС являются оценка его прогрессирования и определение показаний к интервенционному лечению (табл. 3). Рекомендуемая кратность ЭхоКГ-исследований составляет 6–12 мес. Наиболее чувствительным показателем прогрессирования АС является скорость чресклапанного потока, в то время как площадь клапана менее чувствительна для выявления небольших изменений. Для оценки прогрессирования стеноза очень важно проводить исследование скорости потока в условиях одинаковых эхо-окна и функции ЛЖ. Следует отметить, что ведущим показанием к интервенционному лечению АС является наличие у больного клинических симптомов АС в покое или при нагрузке.
Ниже представлены требования к стандартному отчету ЭхоКГ при оценке больных АС:
этиология АС;
морфология и степень кальцификации АК;
количественная оценка тяжести стеноза:
пиковая скорость струи через АК;
средний градиент через АК;
площадь АК методом постоянства потока;
характеристика эхо-окна;
индекс ударного объема;
размер и функция ЛЖ;
толщина миокарда ЛЖ;
сопутствующие поражения;
давление в легочной артерии.
Заключение
Унификация подходов к диагностике, оценке тяжести и определению показаний к интервенционному лечению являются важнейшими составляющими успешного ведения больных АС на всех этапах оказания медицинской помощи — от районной поликлиники до кардиохирургического центра. Представленные в настоящем обзоре данные призваны оптимизировать принятие диагностических решений в повседневной врачебной практике с целью улучшения клинических исходов АС.
Антарктическая озоновая дыра занимает 13-е место в истории наблюдений и, как ожидается, сохранится до ноября
Основные направления:
Исследования
Климат
Темы:
озоновая дыра
>
Лейтенант Тимоти Холланд, корпус NOAA, выходит из станции сборки аэростатов с озонозондом, прикрепленным к метеозонду, прежде чем запустить его над Южным полюсом. (Изображение предоставлено Джозайей Хорнеман, помощником врача станции, Контракт на поддержку Антарктики)
(Изображение предоставлено Джозайей Хорнеман, помощником врача станции, Контракт на поддержку Антарктики)
Антарктическая озоновая дыра 2021 года достигла максимальной площади 7 октября и занимает 13-е место по величине с 1979 года, сообщили сегодня ученые из NOAA и НАСА. В этом году озоновая дыра образовалась так же, как и в прошлом году: более холодная, чем обычно, зима в Южном полушарии привела к образованию глубокой и большей, чем в среднем, дыры, которая, вероятно, сохранится до ноября или начала декабря.
«Это большая озоновая дыра из-за более холодных, чем в среднем, стратосферных условий 2021 года, и без внешней связи Монреальского протокола она была бы намного больше», — сказал Пол Ньюман, главный научный сотрудник отдела наук о Земле в Центре космических полетов имени Годдарда НАСА. .
То, что мы называем озоновой дырой, представляет собой истончение защитного озонового слоя в стратосфере (верхний слой атмосферы Земли) над Антарктидой, которое начинается каждый сентябрь. Хлор и бром, полученные из соединений, произведенных человеком, высвобождаются в результате реакций на высокогорных полярных облаках. Затем химические реакции начинают разрушать озоновый слой, когда в Антарктиде восходит солнце в конце зимы.
Хлор и бром, полученные из соединений, произведенных человеком, высвобождаются в результате реакций на высокогорных полярных облаках. Затем химические реакции начинают разрушать озоновый слой, когда в Антарктиде восходит солнце в конце зимы.
Загрузить изображение
Размер имеет значение. Но как измерить дыру в атмосфере?
Исследователи NOAA и NASA обнаруживают и измеряют рост и разрушение озоновой дыры с помощью спутниковых инструментов на борту спутников Aura, Suomi-NPP и NOAA-20.
В этом году спутниковые наблюдения НАСА определили, что озоновая дыра достигла максимальной площади 9,6 миллиона квадратных миль (24,8 миллиона квадратных километров) — примерно столько же, сколько площадь Северной Америки, — прежде чем в середине октября она начала уменьшаться. Более низкие, чем в среднем, температуры и сильные ветры в стратосфере вокруг Антарктиды способствовали размеру дыры.
Более низкие, чем в среднем, температуры и сильные ветры в стратосфере вокруг Антарктиды способствовали размеру дыры.
Ученые NOAA на станции Южного полюса регистрируют толщину озонового слоя, выпуская метеозонды с приборами для измерения озона, называемыми озонозондами, которые измеряют различные концентрации озона по мере того, как шар поднимается в стратосферу.
Когда восходит полярное солнце, ученые NOAA также проводят измерения с помощью спектроферометра Добсона, оптического прибора, который регистрирует общее количество озона между поверхностью и краем космоса, известное как общее содержание озона в столбе. В этом году ученые зафиксировали самое низкое значение общего содержания озона в 102 единицы Добсона 7 октября, что является 8-м самым низким значением с 19 октября.86. На высотах от 8 до 13 миль (от 14 до 21 километра) озон почти полностью отсутствовал во время максимального размера озоновой дыры.
На этой диаграмме показана средняя протяженность антарктической озоновой дыры в пик сезона истощения озонового слоя с 1979 года по настоящее время. Ученые заявили, что озоновая дыра 2021 года была бы на 1,5 миллиона квадратных миль больше, если бы уровень хлора в атмосфере сегодня был таким же высоким, как в начале 2000-х годов. (НАСА)
Ученые заявили, что озоновая дыра 2021 года была бы на 1,5 миллиона квадратных миль больше, если бы уровень хлора в атмосфере сегодня был таким же высоким, как в начале 2000-х годов. (НАСА)Загрузить изображение
Хорошие новости
Хотя антарктическая озоновая дыра 2021 года больше среднего, она значительно меньше озоновых дыр, измеренных в конце 1990-х и начале 2000-х годов.
Озоновая дыра восстанавливается благодаря Монреальскому протоколу и последующим поправкам, запрещающим выброс вредных озоноразрушающих химических веществ, называемых хлорфторуглеродами или ХФУ. Если бы уровень содержания хлора в атмосфере от фреонов сегодня был таким же высоким, как в начале 2000-х годов, озоновая дыра в этом году, вероятно, была бы больше примерно на 1,5 миллиона квадратных миль (около четырех миллионов квадратных километров) при тех же погодных условиях.
Узнайте больше об исследованиях антарктического озона NOAA.
НаверхИнформация о районе Джексон Хоул
Все типы недвижимостиДомаКондоминиумы
All Jackson HoleTown of JacksonTeton VillageTeton PinesThe Aspens
Поиск
Тип аренды
Все типы
Дома
Кондоминиумы
Площадь
Все Джексон Хоул
Город Джексон
Teton Village
Teton Pines
The Aspens
Прибытие
Спальни Любой123456 или более
Отправление
Ванные комнаты Any12345 или более
Гости
Рейтинг качества AnyLuxurySuperiorModerateEconomy
Индекс недвижимости
Джексон-Хоул — долина, окруженная горами.
Где Джексон Хоул?
Долина имеет длину 48 миль и ширину от 8 до 15 миль, а дно долины наклонено от 6 779 футов над уровнем моря на севере до примерно 6 069 футов на южном конце. Река Снейк, берущая начало в высокогорной местности Йеллоустон, извивается по долине, питаясь ручьями и реками, такими как река Грос-Вантр и Флэт-Крик. Несколько озер лежат вдоль течения Змеи; среди них большое озеро Джексон. Вдоль западной стороны долины в небо возвышаются знаменитые горы Тетон, резкий подъем скалы без преамбулы предгорий, отделяющий массивные горы от дна долины. Гранд-Титон, самая высокая гора в этом хребте, возвышается на 13 772 фута над уровнем моря и возвышается над озером Дженни у своего подножия. В долине на востоке горы Гро-Вантр (Большой Живот) немного плавнее поднимаются со дна долины. В отличие от впечатляющих Тетонов, самой высокой горой в хребте Грос-Вантр является пик Даблтоп на высоте 11 682 фута, примерно в двадцати милях по прямой, к юго-востоку от Джексон-Хоул.
Национальный парк Гранд-Титон занимает большую часть долины Джексон-Хоул, сохраняя высокие вершины гор долины Тетон и красивые ледниковые озера. Местная дикая природа включает лосей, оленей-мул, вилорогих антилоп, лосей, гризли и черных медведей, бизонов и лебедей-трубачей. К радости посетителей парка, многие из крупных животных беспрепятственно бродят по дну долины, а многочисленные тропы ведут в горы, чтобы удовлетворить пытливые умы. Сегодня парк включает в себя 485 квадратных миль или 310 000 акров.
Город Джексон расположен в южной части долины, между горным хребтом Хобак, который соединяет гору Снежный Король с южной границей долины, и Восточным холмом Грос-Вентр. Холм — один из нескольких, которые перемежают долину, варьируя равнину реки Снейк с каменистыми горбами древних форм рельефа.
Джексон является административным центром округа Тетон, который был создан в 1921 году, более чем через тридцать лет после того, как Вайоминг стал штатом в 189 году. 0. По состоянию на 2000 год в округе Тетон проживало около 18 251 человек, а в Джексоне — 8 647 человек. Количество временных жителей увеличивает численность населения в туристические сезоны — в летние месяцы на 52 000 человек и на 5 000 в зимние месяцы. Графство имеет большую площадь земли — 2 697 000 акров или 4 214 квадратных миль. Почти 97% территории округа — это общественная земля, а это значит, что она принадлежит вам и мне, а не отдельным или частным владельцам.
0. По состоянию на 2000 год в округе Тетон проживало около 18 251 человек, а в Джексоне — 8 647 человек. Количество временных жителей увеличивает численность населения в туристические сезоны — в летние месяцы на 52 000 человек и на 5 000 в зимние месяцы. Графство имеет большую площадь земли — 2 697 000 акров или 4 214 квадратных миль. Почти 97% территории округа — это общественная земля, а это значит, что она принадлежит вам и мне, а не отдельным или частным владельцам.
Благодаря обширным общественным землям, включая два национальных парка, туризм является наиболее важной отраслью в этом районе. Национальный парк Гранд-Титон находится в самом сердце Джексон-Хоул, а Йеллоустонский национальный парк находится всего в нескольких милях к северу. Город Джексон служит воротами для обоих. В 1999, национальный парк Гранд-Титон посетило 4 160 303 человека. Сумма указывает на популярность района и здоровье отрасли. Несколько ранчо в долине все еще действуют, напоминая жителям о первоначальной экономической базе этого района.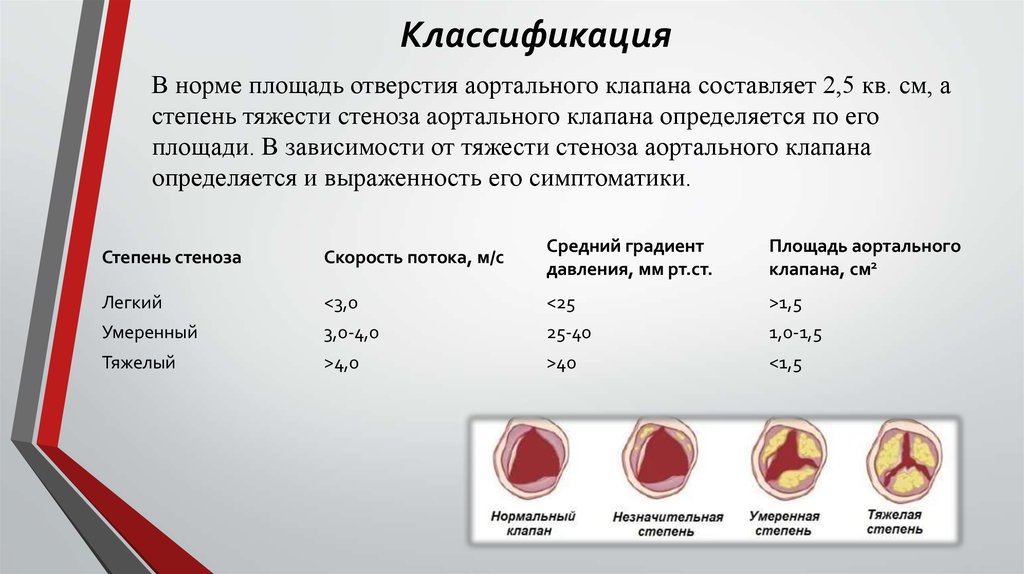


 ЭХОКГ позволяет определить: структуру клапана (двустворчатый клапан, утолщение створок, фиброз, кальциноз, вегетации), характер его движения (подвижность створок, степень открытия) и площадь отверстия; изменения корня аорты (постстенотическая дилатация), объем левого желудочка, выраженность гипертрофии левого желудочка, нарушения локальной сократимости левого желудочка (указывающие на ИБС), ФВ, объем левого предсердия, состояние других клапанов. Доплеровское исследование позволяет с высокой точностью определить градиент давления между аортой и левым желудочком.
ЭХОКГ позволяет определить: структуру клапана (двустворчатый клапан, утолщение створок, фиброз, кальциноз, вегетации), характер его движения (подвижность створок, степень открытия) и площадь отверстия; изменения корня аорты (постстенотическая дилатация), объем левого желудочка, выраженность гипертрофии левого желудочка, нарушения локальной сократимости левого желудочка (указывающие на ИБС), ФВ, объем левого предсердия, состояние других клапанов. Доплеровское исследование позволяет с высокой точностью определить градиент давления между аортой и левым желудочком. 
 (Уровень достоверности: С).
(Уровень достоверности: С).
 Протезирование аортального клапана показано возрастным пациентам с тяжелым асимптомным аортальным стенозом, если существует высокая вероятность быстрого прогрессирования (возраст, кальциноз). (Уровень достоверности: C).
Протезирование аортального клапана показано возрастным пациентам с тяжелым асимптомным аортальным стенозом, если существует высокая вероятность быстрого прогрессирования (возраст, кальциноз). (Уровень достоверности: C).