Хроматографический анализ трансформаторного масла
Объект: электрооборудование 110 кВ и выше
Результат: отчет с оценкой ХАРГ в масле и рекомендациями по дальнейшей эксплуатации электрооборудования
_______________________________________________________________________________________________________________________
ХАРГ это эффективный метод выявления дефектов оборудования на ранней стадии развития, не обнаруживаемых традиционными способами.
Хроматографический анализ газов растворенных в масле, является специальным методом, служащим для обнаружения повреждений и дефектов конструктивных узлов электрооборудования, но практически не информирующем о качестве и состоянии самого масла. Хроматографический анализ (ХАРГ) позволяет:
- отслеживать развитие процессов в оборудовании,
- выявлять дефекты на ранней стадии их развития, не обнаруживаемые традиционными способами,
- определять предполагаемый характер дефекта и степень имеющегося повреждения
- ориентироваться при определении места повреждения.

Для оценки состояния маслонаполненного оборудования используются газы: водород (Н2), метан (Ch5), этан (C2H6), этилен (C2h5), ацетилен (С2Н2), угарный газ (CO), углекислый газ (CO2). Кроме этого, всегда присутствуют кислород и азот, а их концентрация изменяется в зависимости от герметичности корпуса трансформатора и могут выделяться такие газы как пропан, бутан, бутен и другие, но их исследование в диагностических целях не получило широкого распространения.
Состояние оборудования оценивается сопоставлением полученных при анализе количественных данных с граничными значениями концентрации газов и по скорости роста концентрации газов в масле. Важно различать нормальные и чрезмерные объемы газа. Нормальное старение или газовая генерация изменяется в зависимости от конструкции трансформатора, нагрузки и типа изоляционных материалов.
Взаимосвязь основных газов и наиболее характерных видов дефектов.
| Водород (Н2) | Дефекты электрического характера: частичные разряды, искровые и дуговые разряды |
| Метан (Ch5) |
Дефекты термического характера: нагрев масла и бумажно-масляной изоляции в диапазоне температур (400-600)°С или нагрев масла и бумажно-масляной изоляции, сопровождающийся разрядами; |
| Этан (C2H6) | Дефекты термического характера: нагрев масла и бумажно-масляной изоляции в диапазоне температур (300-400)°С; |
| Этилен (C2h5) | Дефекты термического характера: нагрев масла и бумажно-масляной изоляции выше 600°С |
| Ацетилен (С2Н2) | Дефекты электрического характера: электрическая дуга, искрение |
| Угарный газ (CO) | Дефекты термического характера: старение и увлажнение масла и/или твердой изоляции; |
| Углекислый газ (CO2) |
Дефекты термического характера: старение и увлажнение масла и/или твердой изоляции; нагрев твердой изоляции |
Дефекты трансформаторов, определяемые с помощью хроматографического анализа:
|
Наименование дефектов |
Основные газы | Характерные газы |
| Перегревы токоведущих соединений |
С2Н4 — в случае нагрева масла |
Н2, СН4 и С2Н6 |
|
— нагрев и выгорание контактов переключающих устройств; — ослабление и нагрев места крепления электростатического экрана; — обрыв электростатического экрана; |
||
|
— ослабление винтов компенсаторов отводов НН; — ослабление и нагрев контактных соединений отвода НН и шпильки проходного изолятора; |
С2Н2 — в случае перегрева масла, |
|
| Перегревы элементов конструкции остова. | ||
|
— неудовлетворительная изоляция листов электротехнической стали; — нарушение изоляции стяжных шпилек или накладок, ярмовых балок с образованием короткозамкнутого контура; — общий нагрев и недопустимый местный нагрев от магнитных полей рассеяния в ярмовых балках, бандажах, рессующих кольцах и винтах; — неправильное заземление магнитопровода; — нарушение изоляции амортизаторов и шипов поддона реактора, домкратов и прессующих колец при распрессовке и др. |
||
| Частичные разряды | Н2 |
СН4 и С2Н2 с малым содержанием |
| Искровые и дуговые разряды | Н2 или С2Н2 |
СН4 и С2Н2 с любым содержанием |
| Ускоренное старении и/или увлажнение твердой изоляции | СО и СO2 | |
|
Перегрев твердой изоляции |
СO2 |
Для получения объективных результатов хроматографического анализа трансформаторного масла необходимо квалифицированно произвести отбор проб из маслонаполненного оборудования. Более подробные требования по отбору проб трансформаторного масла представлены в разделе Отбор проб масла
Более подробные требования по отбору проб трансформаторного масла представлены в разделе Отбор проб масла
Периодичность проведения ХАРГ трансформаторного масла
| Наименование оборудования | Периодичность |
| для трансформаторов 110 кВ и выше | не реже 1 раза в 6 месяцев |
|
для герметичных вводов, имеющих удовлетворительные результаты регламентных испытаний — для вводов 110-220 кВ — для вводов 330-750 кВ |
1 раз в 4 года 1 раз в 2 года |
Преимущество этого метода состоит в том, что образцы масла можно отобрать в любое время без вывода оборудования из работы.
Детальную информацию по проведению и использованию хроматографического анализа трансформаторного масла вы можете получить из руководящих документов:
- РД 153-34.
 0-46.302-00 «Методические указания по диагностике развивающихся дефектов трансформаторного оборудования по результатам хроматографического анализа газов, растворенных в масле»
0-46.302-00 «Методические указания по диагностике развивающихся дефектов трансформаторного оборудования по результатам хроматографического анализа газов, растворенных в масле» - РД 34.46.303-98 «Методические указания по подготовке и проведению хроматографического анализа газов, растворенных в масле силовых трансформаторов»
Если Вы хотите получить более подробную информацию, техническую консультацию, обсудить оптимальный вариант решения стоящей перед вами задачи, вы можете:
ПОЗВОНИТЬ: +7 (495) 315-68-02, +7 (495) 542-88-48 НАПИСАТЬ ПИСЬМО: diagnost@ntc-retec.ru ЗАПОЛНИТЬ на сайте ЗАЯВКУ
1) Что такое объемный процент конкретных продуктов, в частности двуокиси углерода (CO 2 ) и углерод монооксид (СО)?
2) Что такое роса точка водяного пара в продуктах сгорания? Это требует оценка парциального давления паровой составляющей водяного пара продукты.

3) Имеются экспериментальные методы объемного анализ продуктов сгорания, как правило, делается на Сухой Основа , что дает объемный процент всех компонентов, кроме водяного пара. Это позволяет простой метод определения фактического соотношения воздух-топливо и избытка используемого воздуха в процессе горения.
Вещество
Формула
hfo [кДж/кмоль]
Углекислый газ
СО 2 (г)
-393 520
Водяной пар
Н 2 О(г)
-241 820
Вода
Н 2 О(л)
-285 820
Метан
CH 4 (г)
-74 850
- Доступ к более чем 100 миллионам учебных ресурсов по конкретным курсам
- Круглосуточная помощь опытных наставников по более чем 140 предметам
- Полный доступ к более чем 1 миллиону решений для учебников
Глава 11: Горение (обновлено 31.05.10)
Глава 11: Горение (обновлено 31.05.10) Глава 11: Возгорание
(Спасибо
до Дэвид
Bayless за помощь в написании
этот раздел)
Введение — До этого
точка теплоты Q во всех задачах и примерах была либо заданной
значение или было получено из отношения первого закона. Однако в различных
тепловые двигатели, газовые турбины и паровые электростанции
полученный в результате процессов сжигания с использованием либо твердого топлива (например,
уголь или дрова). жидкое топливо (например, бензин, керосин или дизельное топливо),
или газообразное топливо (например, природный газ или пропан).
Однако в различных
тепловые двигатели, газовые турбины и паровые электростанции
полученный в результате процессов сжигания с использованием либо твердого топлива (например,
уголь или дрова). жидкое топливо (например, бензин, керосин или дизельное топливо),
или газообразное топливо (например, природный газ или пропан).
В этой главе мы познакомимся с химией и термодинамика горения родовых углеводородных топлив — (C x H y ), в котором окислителем является кислород, содержащийся в атмосферном воздухе. Обратите внимание, что мы не будем рассматривать сжигание твердого топлива или сложные смеси и смеси углеводородов, входящие в состав бензин, керосин или дизельное топливо.
Атмосферный воздух содержит
примерно 21% кислорода (O 2 )
по объему. остальные 79% «других газов» в основном
азот (N 2 ), т.е.
будем считать, что воздух состоит из 21 % кислорода и 79 % азота.
объем. Таким образом, каждый моль кислорода, необходимый для окисления углеводорода,
сопровождается 79/21 = 3,76 моль азота.
Процесс горения — Основной процесс горения можно описать топливом (т. углеводород) плюс окислитель (воздух или кислород), называемый Реактивы , которые подвергаются химическому процессу с выделением тепла с образованием Товары сгорания так, чтобы масса сохранялась. в простейший процесс горения, известный как стехиометрический Сгорание , весь углерод в топливе образует двуокись углерода (CO 2 ) и весь водород образует воду (H 2 O) в продуктах, поэтому химическую реакцию можно записать так:
где z известен как стехиометрический коэффициент для окислителя (воздуха)
Обратите внимание, что эта реакция дает пять неизвестных: z, a,
b, c, d, поэтому нам нужно решить пять уравнений. стехиометрический
сжигание предполагает, что в продуктах нет избыточного кислорода, поэтому
d = 0. Остальные четыре уравнения получаем из балансировки числа
атомов каждого элемента в реагентах (углерод, водород, кислород
и азот) с количеством атомов этих элементов в
продукты. Это означает, что ни один атом не разрушается и не теряется в
реакция горения.
Остальные четыре уравнения получаем из балансировки числа
атомов каждого элемента в реагентах (углерод, водород, кислород
и азот) с количеством атомов этих элементов в
продукты. Это означает, что ни один атом не разрушается и не теряется в
реакция горения.
Элемент | Сумма в реагентах | = | Сумма в продуктах | Сокращенное уравнение |
Углерод (C) | х |
| а | а = х |
Водород (H) | и |
| 2б | б = у/2 |
Кислород (O) | 2z |
| 2а+б | z = а + b/2 |
Азот (N) | 2(3,76)z |
| 2с | c = 3,76z |
Обратите внимание, что образовавшаяся вода может находиться в виде пара или
жидкой фазы в зависимости от температуры и давления
продукты горения.![]()
В качестве примера рассмотрим стехиометрическое горение метана (СН 4 ) в атмосферном воздухе. Приравнивание моляра коэффициенты реагентов и продуктов получаем:
Теоретическое соотношение воздух-топливо и воздух-топливо -The минимальное количество воздуха, обеспечивающее полное сгорание топлива называется Теоретическая Air (также называемый Стехиометрический воздух ). В этом случае продукты не содержат кислорода. Если мы поставляем меньше, чем теоретический воздух, тогда продукты могут содержать углерод монооксида (CO), поэтому нормальная практика заключается в подаче более теоретический воздух, чтобы предотвратить это явление. это Превышение Air приведет к появлению кислорода в продукты.
Стандартная мера количества воздуха, используемого в процесс сгорания Air-Fuel Соотношение (AF), определяемое следующим образом:
Таким образом, рассматривая только реагенты метана сгорания с теоретическим воздухом, представленным выше, получаем:
Решенная проблема 11. 1 — В
этой задачи мы хотим разработать уравнение горения и определить
соотношение воздух-топливо для полного сгорания н-бутана (C 4 Н 10 )
с а) теоретическим воздухом и б) 50% избытком воздуха.
1 — В
этой задачи мы хотим разработать уравнение горения и определить
соотношение воздух-топливо для полного сгорания н-бутана (C 4 Н 10 )
с а) теоретическим воздухом и б) 50% избытком воздуха.
Анализ продуктов сгорания — Горение всегда происходит при повышенных температурах и будем считать, что все продукты сгорания (включая воду пар) ведут себя как идеальные газы. Так как газ у них разный. постоянных, удобно использовать уравнение состояния идеального газа в через универсальную газовую постоянную следующим образом:
При анализе продуктов сгорания имеется интересны несколько пунктов:
Для идеальных газов мы находим, что мольная доля y i i-го компонента в смеси газов при удельном давлении P
а температура T равна объемной доле этого компонента.
Так как из молярного отношения идеального газа: P.V = N.R у .Т,
у нас есть:
Кроме того, поскольку сумма объемов компонентов V i должны равняться общему объему V, имеем:
Используя аналогичный подход, мы определяем частичную давление компонента с использованием закона парциальных давлений Дальтона:
Проблема решена 11. 2 — В
эта проблема Пропан (C 3 H 8 )
сжигается с 61% избыточного воздуха, который поступает в камеру сгорания при
25°С. Предполагая полное сгорание и полное давление 1 атм.
(101,32 кПа), определите а) соотношение воздух-топливо [кг воздуха/кг топлива], б)
объемный процент двуокиси углерода в продуктах, и c)
температура точки росы продуктов.
2 — В
эта проблема Пропан (C 3 H 8 )
сжигается с 61% избыточного воздуха, который поступает в камеру сгорания при
25°С. Предполагая полное сгорание и полное давление 1 атм.
(101,32 кПа), определите а) соотношение воздух-топливо [кг воздуха/кг топлива], б)
объемный процент двуокиси углерода в продуктах, и c)
температура точки росы продуктов.
Проблема решена 11.3 — В эта проблема Этан (C 2 H 6 ) сжигается атмосферным воздухом, а объемный анализ сухие продукты сгорания дают следующее: 10% CO 2 , 1% CO, 3% O 2 и 86% N 2 . Развивать уравнение горения, и определить а) процент избытка воздух, б) соотношение воздух-топливо, и в) точка росы сгорания продукты.
Первый закон анализа горения — Основной целью горения является получение тепла за счет изменения энтальпии от реагентов к продуктам. Из первого закона уравнение в контрольном объеме без учета кинетической и потенциальной энергии изменения и при условии, что работа не выполняется, мы имеем:
, где суммирование проводится по всем продукты (p) и реагенты (r).N относится к количеству молей каждого компонента, а h [кДж/кмоль] относится к молярной энтальпии каждый компонент.
Поскольку существует ряд различных веществ нам необходимо установить общее эталонное состояние для оценки энтальпии, обычно выбирают 25 ° C и 1 атм, что обычно обозначается верхним индексом о. Проф. С. Бхаттачарджи из Государственный университет Сан-Диего разработал экспертную веб-систему в < www.thermofluids.net > называется ТЕСТ ( Т он E Эксперт S система для T (гермодинамика) в который он включил набор таблиц свойств идеального газа, основанных на на энтальпии h или = 0 по этой общей ссылке. Мы адаптировали некоторые из этих таблиц специально для этого раздела, и их можно найти в по следующей ссылке:
Горение Таблицы молярной энтальпии
В качестве примера снова рассмотрим полное сгорание метана (CH 4 ) с теоретическим воздухом:
Обратите внимание, что в реагентах и продуктах
В приведенном выше примере у нас есть основные элементы O 2 и N 2 как
а также соединения CH 4 ,
CO 2 и H 2 O. Когда соединение образуется, изменение энтальпии называется Энтальпия
пласта , обозначаемый h f o ,
и для нашего примера:
Когда соединение образуется, изменение энтальпии называется Энтальпия
пласта , обозначаемый h f o ,
и для нашего примера:
где (g) относится к газу и (l) относится к жидкость.
Знак минус означает, что процесс Экзотермический , т. е. при образовании соединения выделяется тепло. Обратите внимание, что энтальпия образования основных элементов O 2 и N 2 составляет нуль.
Сначала рассмотрим случай, когда имеется достаточно теплообмен таким образом, что и реагенты, и продукты находятся в 25°C и давление 1 атм, и что водный продукт является жидким. С заметного изменения энтальпии нет, уравнение энергии принимает вид:
Это тепло (Qcv) называется энтальпией . Горения или Нагрева Стоимость топлива. Если продукты содержат жидкую воду, то это Высшее Теплота сгорания (как в нашем примере), однако, если продукт содержит водяной пар, то это Нижний Теплотворная способность топлива. энтальпия сгорания – это наибольшее количество тепла, которое может быть выделяется данным топливом.
Адиабатическая температура пламени —
Противоположная крайность приведенного выше примера, в котором мы оценивали
энтальпией сгорания является случай адиабатического процесса, в котором
тепло не выделяется. Это приводит к значительной температуре
увеличение продуктов сгорания (обозначается Адиабатическая
Температура пламени ), которая может быть
уменьшается за счет увеличения соотношения воздух-топливо.
Это приводит к значительной температуре
увеличение продуктов сгорания (обозначается Адиабатическая
Температура пламени ), которая может быть
уменьшается за счет увеличения соотношения воздух-топливо.
Решенная проблема 11.4 — Определить адиабатическая температура пламени для полного сгорания Метан ( CH 4 ) с 250% теоретического воздуха в адиабатическом контрольном объеме.
Это уравнение может быть решено только итеративным
метод проб и ошибок с использованием таблиц Sensible
Энтальпия против температуры для всех четырех
составные части продукции — СО 2 ,
Н 2 О, О 2 ,
и N 2 . Быстрый
приближение к адиабатической температуре пламени может быть получено с помощью
при условии, что продукты полностью состоят из воздуха. Этот подход был
представил нас Поттер и Somerton в их Schaum’s
Краткое изложение термодинамики для инженеров ,
в котором они предполагали, что все продукты будут N 2 . Мы находим более удобным использовать воздух, предполагая репрезентативное значение
из конкретных
Теплоемкость воздуха : С р, 1000К = 1,142 [кДж/кг.К].
Мы находим более удобным использовать воздух, предполагая репрезентативное значение
из конкретных
Теплоемкость воздуха : С р, 1000К = 1,142 [кДж/кг.К].
Таким образом, суммируя все моли продуктов, мы имеем:
Использование таблиц Sensible Энтальпия против температуры мы оценили энтальпии всех четырех продуктов при температуре 1280К. Этот в результате общая энтальпия составила 802 410 [кДж/кмоль топлива], что составляет очень близко к требуемому значению, что оправдывает такой подход.
Проблема 11.5 — — Определить адиабатическую температуру пламени. полное сгорание пропана ( C 3 H 8 ) с 250% теоретического воздуха в адиабатическом контрольном объеме [T = 1300К].
__________________________________________________________________________________________
Инженерная термодинамика Израиля
Уриэли находится под лицензией Creative
Commons Attribution-Noncommercial-Share Alike 3. 0 США
Лицензия
0 США
Лицензия
[Решено] При сгорании этана (C2H6) образуются углекислый газ и вода:…
Получите больше от подписки*
*Вы можете изменить, приостановить или отменить в любое время
Вопрос от freemankellie
При сгорании этана (C2H6) образуется углекислый газ и вода: 2C2H6)g0+7O2(g)>4CO2(g)6h3O(l). Сколько литров углекислого газа получится при сжигании 179 литров этана? (Один моль любого газа занимает 22,4 л при определенных условиях температуры и давления. Примите эти условия для этого вопроса.) A) 179 л B) 313 л C) 358 л D) 538 л.
Химия Наука Органическая химия ХИМИЧЕСКОЕ РАЗНОЕ
Ответ и объяснение
Решено проверенным экспертом
Рейтинг Полезно
Ответил fimijohn127
ec facilisis. Пелле крот
о. Донец Аликет. Lorem ipsum dolor sit amet, consectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrices ac magna. Fusce dui lectus, congue vel laoreet ac, dictum vitae odio
Получите полный доступ к Course Hero
Изучите более 16 миллионов пошаговых ответов из нашей библиотеки
Подпишитесь, чтобы посмотреть ответ
Пошаговое объяснение
congue vel laoreet ac, dictum vitae odio. Донец Аликет. Lorem ipsum dolor sit amet, consectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie c
Донец Аликет. Lorem ipsum dolor sit amet, consectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie c
1 Приложение
jpg
Отзывы учащихся
100% (1 оценка)
Другой ответ
Ответил bhargavchem999
или nec facilisis. Pellentesque dapibus efficitur laoreet. N
s ante, dapibus a molestie consequat, ultrices ac magna. Fusce dui lectus, congue vel laoreet ac, dict
fficitur laoreet. Nam risus ante, dapibus a molestie conequat, ultrices ac ma
llentesque dapibus efficitur laoreet. Nam risus ante, dapibus
исц.элит. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus eff
Получите полный доступ к Course Hero
Изучите более 16 миллионов пошаговых ответов из нашей библиотеки
Подпишитесь, чтобы посмотреть ответ
Пошаговое объяснение
эк аликет.



 0-46.302-00 «Методические указания по диагностике развивающихся дефектов трансформаторного оборудования по результатам хроматографического анализа газов, растворенных в масле»
0-46.302-00 «Методические указания по диагностике развивающихся дефектов трансформаторного оборудования по результатам хроматографического анализа газов, растворенных в масле»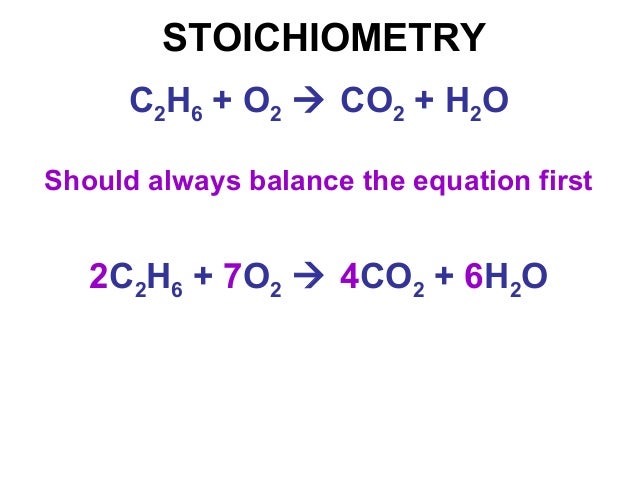
 N относится к количеству молей
каждого компонента, а h [кДж/кмоль] относится к молярной энтальпии
каждый компонент.
N относится к количеству молей
каждого компонента, а h [кДж/кмоль] относится к молярной энтальпии
каждый компонент.