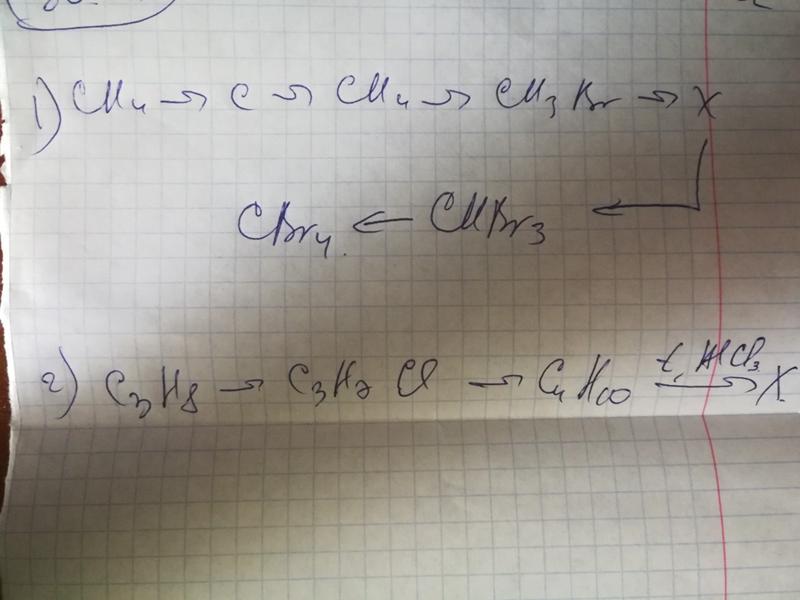Алканы
Главная \ Подготовка к ЕГЭ \ Химия \ Алканы
Алканы
Общая характеристика
Алканы — предельные углеводороды. Это значит, что все связи одинарные (предельные).
Напишем гомологический ряд алканов (формулы в нем соответствуют общей формуле алканов Cnh3n+2, таким образом, зная количество атомов углерода в молекуле можно посчитать количество атомов водорода).
Метан — СН4
Этан — С2Н6
Пропан — С3Н8
Бутан — С4Н10
Пентан — С5Н12
Гексан — С6Н14
Гептан — С7Н16
Октан — С8Н18
Нонан — С9Н20
Декан — С10Н22
Здесь нужно обратить внимание на окончание -ан (оно, как и в названии класса, обозначает предельность). Каждому алкану соответствует радикал:
Метил — СН3-
Этил — С2Н5-
Пропил — С3Н7-
Бутил — С4Н9-
Пентил — С5Н11-
Гексил — С6Н13-
Гептил — С7Н15-
Октил — С8Н17-
Нонил — С9Н19-
Декил — С10Н21-
Получение алканов
Получение метана
1. Из простых веществ
Из простых веществ
С + 2Н2 →(t, kat) Ch5
2. Из карбида алюминия
Al4C3 + h3O → Al(OH)3↓ + Ch5↑
3. В лаборатории из безводного гидроксида натрия с ледяной уксусной кислотой
2NaOH + Ch4COOH →(t) Na2CO3 + h3O + Ch5↑
4. Сплавление ацетата натрия с гидроксидом натрия
Ch4COONa + NaOH → Ch5↑ + Na2CO3
Получение гомологов метана
1. Реакция Вюрца
Ch5 + Cl2 →(hν) Ch4Cl + HCl
2Ch4Cl + 2Na → 2NaCl + Ch4-Ch4
При помощи этой реакции лучше не получать углеводороды с нечетным количеством атомов углерода, так как в этом случае получается смесь продуктов.
Пример: 3Ch4Cl + 3C2H5Cl + 6Na → Ch4-Ch4 + C2H5-Ch4 + C2H5-C2H5 + 6NaCl
2. Каталитическое гидрирование галоген-алканов
Ch4Ch3Cl + h3 →(Pd) Ch4Ch4 + HCl
3. Восстановление йодалканов при нагревании с йодоводородной кислотой:
Ch4Ch3I + HI →(t) Ch4Ch4 + I2↓
4. При восстановлении спиртов
Ch4OH →(LiAlh5) Ch4Ch4 + h3O
5. Реакция Кижнера-Вольфа
Реакция Кижнера-Вольфа
Ch3 — C(O) — Ch4 + N2h5(изб) →(присутствие KOH) Ch4-Ch3-Ch4 + N2↑ + h3O
6. Гидрирование непредельных углеводородов
С2Н4 + Н2 → С2Н6
С2Н2 + 2Н2 → С2Н6
7. Синтез Фишера-Тропша
nCO + (2n+1)h3 → Cnh3n+2 + nh3O
8. Синтез Кольбе
2RCOO‾ → 2CO2 + R-R + 2e
Реакцию проводят в водных, этанольных или метанольных электролитах на гладких анодах из платины или анодах из непористого угля при температуре 20-50С.
Химические свойства алканов
1. Галогенирование
Ch5 + Cl2 →(hν) Ch4Cl + HCl
Ch4Cl + Cl2 →(hv) Ch3Cl2 + HCl
Ch3Cl2 + Cl2 →(hv) CHCl3 + HCl
CHCl3 + Cl2 →(hv) CCl4 + HCl
Механизм реакции
1. Инициация цепи
Cl2 →(hv) 2Cl°
2. Рост цепи
Cl° + Ch5 → HCl + Ch4°
Ch4° + Cl2 → Ch4Cl + Cl°
Эти реакции идут пока не произойдет обрыв цепи.
3. Обрыв цепи
Cl° + Cl° → Cl2
Ch4° + Ch4° → C2H6
Ch4° + Cl° → Ch4Cl
Суммарное уравнение: Ch5 + Cl2 →(hv) Ch4Cl + HCl
2. Реакция нитрования (реакция Коновалова)
Реакция нитрования (реакция Коновалова)
Ch5 + HNO3 →(140C, p) Ch4 — NO2 + h3O
3. Реакция изомеризации
Ch4Ch3Ch3Ch4 →(AlCl3, 100C) Ch4CH(Ch4)Ch4
4. Крекинг алканов
C10h32 →(t, kat) C5h22 + C5h20
2Ch5 →(t, kat) C2h3 + 3h3
C2H6 →(t, kat) C2h3 + 2h3
5. Сульфохлорирование (реакция Рида)
Ch5 →(SO2, Cl2, hv) Ch4 — SO2Cl + HCl
6. Окисление
а) Кислородом воздуха
Ch5 + 2O2 → CO2 + 2h3O
б) Каталитическое окисление
2Ch5 + O2 → 2Ch4OH
Ch5 + O2 → HCHO + h3O
2Ch5 + 3O2 → 2HCOOH + 2h3O
7. Термическое разложение алканов
Ch5 →(t) C + 2h3
C2H6 →(t) 2C + 3h3
8. Дегидрирование
Ch4-Ch4 → Ch3=Ch3 + h3
Ch4-Ch3-Ch3-Ch4 → Ch3=CH-CH=Ch3 + 2h3
Ch4-Ch3-Ch3-Ch4 → Ch3=C-CH-Ch4 + 2h3
9. Конверсия метана
Ch5 + h3O →(Ni) CO + 3h3 (CO+h3 — синтез-газ)
Пара-хлортолуол, структурная формула, химические свойства
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
МНОГОКРАТНОЕ ЗАМЕЩЕНИЕ В РЕАКЦИИ МЕТАНА И ХЛОРА | |||||||||||||||
Внимание! Мы вот-вот изрядно замутим воду! Не продолжайте, пока не будете уверены, что понимаете механизм производства хлорметана — и уверены, что сможете записать его на экзамене. Если вы не уверены в этом, вернитесь к этой реакции и посмотрите на нее еще раз. Было бы целесообразно проверить ваш учебный план и прошлые экзаменационные работы, чтобы узнать, нужно ли вам знать об этих дальнейших реакциях замещения. | |||||||||||||||
| Факты Когда смесь метана и хлора подвергается воздействию ультрафиолетового света (обычно солнечного света), происходит реакция замещения, и органическим продуктом является хлорметан.
Однако на этом реакция не останавливается, и весь водород в метане, в свою очередь, может быть заменен атомами хлора.
Вы можете подумать, что можете контролировать, какой продукт вы получите, используя пропорции метана и хлора, но это не так просто. Если вы используете достаточное количество хлора, вы в конечном итоге получите CCl 4 , но любые другие пропорции всегда приведут к смешению продуктов. Механизмы Образование множественных продуктов замещения, таких как ди-, три- и тетрахлорметан, можно объяснить точно так же, как и образование исходного хлорметана. Производство дихлорметана Вы помните, что общее уравнение первой стадии реакции равно .
По ходу реакции метан расходуется и его место занимает хлорметан. Это означает, что аргумент о том, с чем может столкнуться радикал хлора, меняется в ходе реакции. Со временем возрастает вероятность того, что он столкнется с молекулой хлорметана, а не с молекулой метана. Когда это происходит, радикал хлора может забирать водород из хлорметана точно так же, как из метана. В этом новом случае:
| |||||||||||||||
Примечание: Точка, представляющая электрон, была перемещена против углерода, который представляет собой атом с неспаренным электроном.  Было бы потенциально запутанно оставить его рядом с хлором. Было бы потенциально запутанно оставить его рядом с хлором. | |||||||||||||||
Образовавшийся хлорметильный радикал может затем взаимодействовать с молекулой хлора на новой стадии распространения. . .
. . . так образуется дихлорметан и регенерируется радикал хлора. Эти этапы распространения продолжаются до тех пор, пока цепь не обрывается любыми двумя радикалами, столкнувшимися и объединившимися вместе. Производство три- и тетрахлорметана Очевидно, что с течением времени возрастает вероятность того, что дихлорметан подвергнется воздействию радикала хлора, что приведет к следующим стадиям распространения, дающим трихлорметан:
| |||||||||||||||
Осторожно! Не пропускайте легко эти уравнения.  Внимательно посмотрите на каждый из них, чтобы понять, что происходит, и связать это с тем, что было раньше. Проговорите уравнения с самим собой. Внимательно посмотрите на каждый из них, чтобы понять, что происходит, и связать это с тем, что было раньше. Проговорите уравнения с самим собой.Например: «Радикал хлора сталкивается с молекулой дихлорметана и крадет водород. В результате остается новый радикал (я не знаю, как он называется, но это не имеет особого значения, пока я могу вычислить его формулу, если Я должен!), который затем натыкается на молекулу хлора — и т. д., и т. д.» Это поможет вам правильно сосредоточиться на уравнениях. Если вы просто прочитаете их быстро, вы снова забудете о них через 15 секунд! | |||||||||||||||
По мере увеличения количества трихлорметана вы получите следующие шаги, дающие тетрахлорметан:
Вот почему вы всегда получите смесь продуктов независимо от соотношения метана и хлора, которое вы используете. Попытки производить в основном один продукт Если вам нужен тетрахлорметан, вы, конечно, можете получить его, используя большой избыток хлора, так что в конечном итоге все атомы водорода будут заменены. Если вам нужен в основном хлорметан, вы можете добиться этого, используя огромный избыток метана, чтобы всегда было больше шансов, что радикал хлора поразит метан, а не что-либо еще, но даже в этом случае вы все равно получите некоторую смесь продуктов. Не существует очевидного способа получения в основном дихлорметана или трихлорметана.
© Джим Кларк 2000 | |||||||||||||||
Хлорирование метана — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3758
- Джим Кларк
- Школа Труро в Корнуолле
Если смесь метана и хлора подвергнуть воздействию пламени, она взорвется с образованием углерода и хлороводорода. Это не очень полезная реакция! Реакция, которую мы собираемся исследовать, является более мягкой реакцией между метаном и хлором в присутствии ультрафиолетового света — обычно солнечного света. Это хороший пример фотохимической реакции — реакции, вызванной светом.
Это хороший пример фотохимической реакции — реакции, вызванной светом.
\[ \ce{Ch5 + Cl_2 -> CH_3Cl + HCl} \номер\]
Органический продукт – хлорметан. Один из атомов водорода в метане заменен атомом хлора, так что это реакция замещения. Однако на этом реакция не останавливается, и весь водород в метане, в свою очередь, может быть заменен атомами хлора. Множественная замена рассматривается на отдельной странице, и вы найдете ссылку на нее внизу этой страницы.
Механизм включает цепную реакцию. Во время цепной реакции для каждого реактивного вида, с которым вы начинаете, в конце создается новый — и это поддерживает процесс. Общий процесс известен как свободнорадикальное замещение или как свободнорадикальная цепная реакция .
- Инициирование цепи : Цепь инициируется (запускается) ультрафиолетовым светом, расщепляющим молекулу хлора на свободные радикалы.
Cl 2 \(\rightarrow\) 2Cl
- Реакции распространения цепи : Это реакции, которые поддерживают движение цепи.


 Это означает, что вы можете получить любой из хлорметана, дихлорметана, трихлорметана или тетрахлорметана.
Это означает, что вы можете получить любой из хлорметана, дихлорметана, трихлорметана или тетрахлорметана. Вам просто нужно смотреть на вероятные столкновения по мере развития реакции.
Вам просто нужно смотреть на вероятные столкновения по мере развития реакции. Весь процесс управляется случайностью. Произведя некоторое количество хлорметана, вы никак не сможете предотвратить его воздействие радикалами хлора, а также для дихлорметана и трихлорметана.
Весь процесс управляется случайностью. Произведя некоторое количество хлорметана, вы никак не сможете предотвратить его воздействие радикалами хлора, а также для дихлорметана и трихлорметана. . .
. .