Бор, свойства атома, химические и физические свойства
Бор, свойства атома, химические и физические свойства.
Поделиться в:
B 5 Бор
10,806-10,821* 1s2 2s2 2p1
Бор — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 5. Расположен в 13-й группе (по старой классификации — главной подгруппе третьей группы), втором периоде периодической системы.
Атом и молекула бора. Формула бора. Строение атома бора
Изотопы и модификации бора
Свойства бора (таблица): температура, плотность, давление и пр.
Физические свойства бора
Химические свойства бора. Взаимодействие бора. Реакции с бором
Получение бора
Применение бора
Таблица химических элементов Д.И. Менделеева
Атом и молекула бора. Формула бора. Строение атома бора:
Бор (лат. Borum, от арабского слова бурак (بورق) или персидского бурах (بوره), которые использовались для обозначения буры) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением B и атомным номером 5. Расположен в 13-й группе (по старой классификации — главной подгруппе третьей группы), втором периоде периодической системы.
И. Менделеева с обозначением B и атомным номером 5. Расположен в 13-й группе (по старой классификации — главной подгруппе третьей группы), втором периоде периодической системы.
Бор – неметалл. Химически довольно инертен.
Бор обозначается символом B.
Как простое вещество бор при нормальных условиях представляет собой бесцветные, тёмно-серые, тёмно-коричневые, тёмно-красные или бурые кристаллы либо тёмно-серое или чёрное аморфное вещество.
Молекула бора одноатомна.
Химическая формула бора B.
Электронная конфигурация атома бора 1s2 2s2 2p1. Потенциал ионизации (первый электрон) атома бора равен 800,64 кДж/моль (8,298019(3) эВ).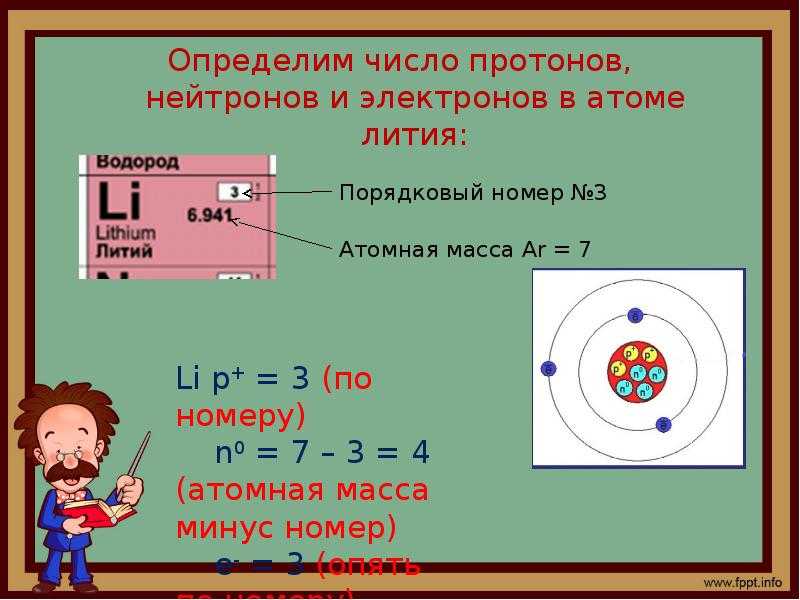
Строение атома бора. Атом бора состоит из положительно заряженного ядра (+5), вокруг которого по двум атомным оболочкам движутся 5 электронов. При этом 2 электрона находятся на внутреннем уровне, а 3 электрона – на внешнем. Поскольку бор расположен во втором периоде, оболочки всего две. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома бора находятся два спаренных – на s-орбитали и один неспаренный – на p-орбитали электроны. В свою очередь ядро атома бора состоит из 5 протонов и 6 нейтронов. Бор относится к элементам p-семейства.
Радиус атома бора (вычисленный) составляет 84 пм.
Атомная масса атома бора составляет 10,806-10,821 а. е. м.
Бор, свойства атома, химические и физические свойства
Изотопы и модификации бора:
Свойства бора (таблица): температура, плотность, давление и пр.
 :
:Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения* | |
| Название | Бор | |
| 102 | Прежнее название | |
| 103 | Латинское название | Borum |
| 104 | Английское название | Boron |
| 105 | Символ | B |
| 106 | Атомный номер (номер в таблице) | 5 |
| 107 | Тип | Неметалл |
| 108 | Группа | |
| 109 | Открыт | Жозеф Луи Гей-Люссак и Луи Жак Тенар, Франция, 30 июня 1808 г., Гемфри Дэви, Великобритания, 9 июля 1808 г. |
| 110 | Год открытия | 1808 г. |
| 111 | Внешний вид и пр. | Бесцветные, тёмно-серые, тёмно-коричневые, тёмно-красные или бурые кристаллы.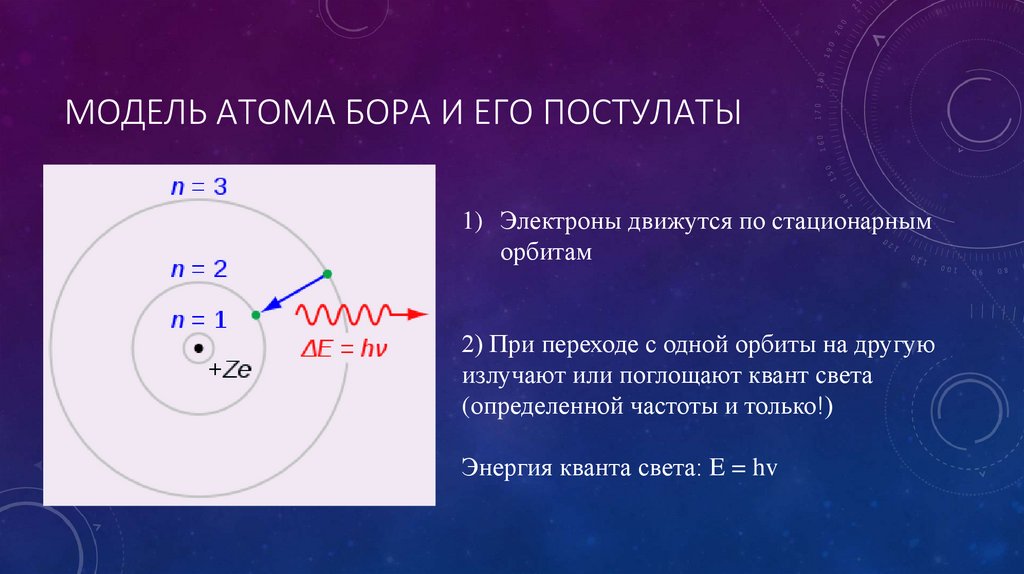 Либо тёмно-серое или чёрное аморфное вещество Либо тёмно-серое или чёрное аморфное вещество |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | Более 10 аллотропных модификаций бора, в т.ч.: – α-R-бор (B12) с ромбоэдрической (тригональной) кристаллической решёткой и 12 атомами в элементарной ячейке, – β-R-бор с ромбоэдрической (тригональной) кристаллической решёткой и ~105 атомами в элементарной ячейке, – α-T-бор ((B12)4B2) с тетрагональной кристаллической решёткой и 50 атомами в элементарной ячейке, – β-T-бор с тетрагональной кристаллической решёткой, – γ-бор с орторомбической кристаллической решёткой и 28 атомами в элементарной ячейке, – сверхпроводящий бор с неизвестной кристаллической решёткой. Большинство аллотропных модификаций бора основаны на икосаэдрических мотивах B12 |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | Борофен |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,00086 % |
| 120 | Содержание в морях и океанах (по массе) | 0,00044 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 1,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | 2,0·10-7 % |
| 123 | Содержание в метеоритах (по массе) | 0,00016 % |
| 124 | Содержание в организме человека (по массе) | 0,00007 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса)* | 10,806-10,821 а. е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p1 |
| 203 | Электронная оболочка | K2 L3 M0 N0 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 84 пм |
| 205 | Эмпирический радиус атома* | 85 пм |
| 206 | Ковалентный радиус* | 82 пм |
| 207 | Радиус иона (кристаллический) | B3+ 25 (4) пм, 41 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 192 пм |
| 209 | Электроны, Протоны, Нейтроны | 5 электронов, 5 протонов, 6 нейтронов |
| 210 | элемент p-семейства | |
| 211 | Период в периодической таблице | 2 |
| 212 | Группа в периодической таблице | 13-ая группа (по старой классификации – главная подгруппа 3-ей группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -1, 0, +1, +2, +3 |
| 302 | Валентность | III |
| 303 | Электроотрицательность | 2,04 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 800,64 кДж/моль (8,298019(3) эВ) |
| 305 | Электродный потенциал | |
| 306 | Энергия сродства атома к электрону | 26,989(3) кДж/моль (0,279723(25) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность | 2,34 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело), 2,46 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело) – α-R-бор, 2,35 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело) – β-R-бор, 2,36 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело) – β-Т-бор, 2,52 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело) – γ-бор, 2,08 г/см3 (при температуре плавления 2076 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 2076 °C (2349 K, 3769 °F) |
| 403 | Температура кипения* | 3927 °C (4200 K, 7101 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 50,2 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 508 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 1,28 Дж/г·K (при 0-100 °C) |
| 410 | Молярная теплоёмкость* | 11,087 Дж/(K·моль) |
| 411 | Молярный объём | 4,3947 см³/моль |
| 412 | Теплопроводность | 27,4 Вт/(м·К) (при стандартных условиях), 27,4 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-R-бор |
| 512 | Структура решётки | Ромбоэдрическая (тригональная)
|
| 513 | Параметры решётки | a = 10,92 Å, α = 23,81° |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 1250 K |
| 516 | Название пространственной группы симметрии | R_ 3m |
| 517 | Номер пространственной группы симметрии | 166 |
| 521 | Кристаллическая решётка #2 | β-R-бор |
| 522 | Структура решётки | Ромбоэдрическая (тригональная)
|
| 523 | Параметры решётки | a = 10,17 Å, α = 65,18° |
| 524 | Отношение c/a | |
| 525 | Температура Дебая | |
| 526 | Название пространственной группы симметрии | R_ 3m |
| 527 | Номер пространственной группы симметрии | 166 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-42-8 |
Примечание:
100* Данные в таблице приводятся применительно к кристаллическому бору.
201* Указан диапазон значений атомной массы в связи с различной распространённостью изотопов данного элемента в природе.
205* Эмпирический радиус атом бора [1] и [3] составляет 90 пм и 98 пм соответственно.
206* Ковалентный радиус бора согласно [1] составляет 84±3 пм.
402* Температура плавления бора согласно [3] составляет 2075 °C (2 348 K, 3767°F).
403* Температура кипения бора согласно [3] составляет 3865 °C (4 138 K, 6989 °F).
407* Удельная теплота плавления (энтальпия плавления ΔHпл) бора согласно [3] и [4] составляет 23,60 кДж/моль и 23 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) бора согласно [3] и [4] составляет 504,5 кДж/моль и 530 кДж/моль соответственно.
410* Молярная теплоемкость бора согласно [3] составляет 11,09 Дж/(K·моль).
Физические свойства бора:
Химические свойства бора. Взаимодействие бора. Реакции с бором:
Получение бора:
Применение бора:
Таблица химических элементов Д. И. Менделеева
И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34.
 Селен
Селен - 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67.
 Гольмий
Гольмий - 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100.
 Фермий
Фермий - 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Boron
- https://de.wikipedia.org/wiki/Bor
- https://ru.wikipedia.org/wiki/Бор_(элемент)
- http://chemister.ru/Database/properties.php?dbid=1&id=215
- https://chemicalstudy.ru/bor-svoystva-atoma-himicheskie-i-fizicheskie-svoystva
Примечание: © Фото https://www. pexels.com, https://pixabay.com
pexels.com, https://pixabay.com
бор атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле бора
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 4 657
Атом Бора • Джеймс Трефил, энциклопедия «Двести законов мироздания»
Когда Джон Дальтон впервые в истории современной науки предложил атомную теорию строения вещества, атомы представлялись ему неделимыми, наподобие микроскопических бильярдных шаров.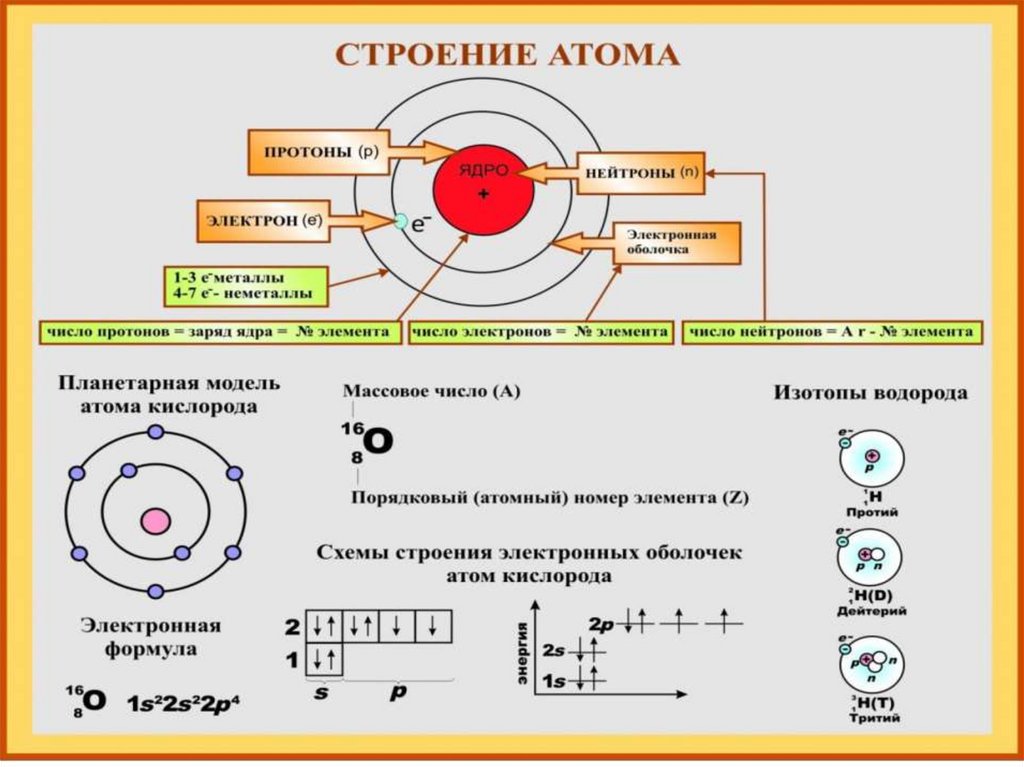 Однако на протяжении всего XIX столетия становилось всё очевиднее, что такая модель неприемлема. Поворотной точкой стало открытие электрона Дж. Дж. Томсоном в 1897 году, из которого следовало, что атом состоит из отдельных частиц — прямое свидетельство против его неделимости. Последним гвоздем в крышку гроба неделимого атома стало открытие в 1911 году атомного ядра (см. Опыт Резерфорда). После этих открытий стало ясно, что атом не просто делим, но что он еще и обладает дискретной структурой: состоит из массивного, положительно заряженного центрального ядра и движущихся по орбитам вокруг него легких, отрицательно заряженных электронов.
Однако на протяжении всего XIX столетия становилось всё очевиднее, что такая модель неприемлема. Поворотной точкой стало открытие электрона Дж. Дж. Томсоном в 1897 году, из которого следовало, что атом состоит из отдельных частиц — прямое свидетельство против его неделимости. Последним гвоздем в крышку гроба неделимого атома стало открытие в 1911 году атомного ядра (см. Опыт Резерфорда). После этих открытий стало ясно, что атом не просто делим, но что он еще и обладает дискретной структурой: состоит из массивного, положительно заряженного центрального ядра и движущихся по орбитам вокруг него легких, отрицательно заряженных электронов.
Но с этой простой планетарной моделью атома тут же возникли проблемы. Прежде всего, согласно физическим законам того времени, такой атом не мог бы просуществовать дольше доли мгновения — на наше счастье, мы имеем все основания утверждать, что этот факт опытом не подтверждается. Аргументация была такова: в соответствии с законами механики Ньютона, электрон, находящийся на орбите, движется с ускорением. Следовательно, согласно уравнениям Максвелла, он должен излучать электромагнитные волны и, как следствие, терять энергию (в силу закона сохранения энергии; см. Уравнение состояния идеального газа) и вскоре сойти с орбиты и упасть на ядро. Это стандартная задачка по физике для студентов-первокурсников, и любой из них легко докажет путем таких рассуждений, что планетарный атом не просуществует и секунды. Очевидно, что-то было не так в этой простой модели строения атома, раз реальные атомы, окружающие нас, просуществовали миллиарды лет.
Следовательно, согласно уравнениям Максвелла, он должен излучать электромагнитные волны и, как следствие, терять энергию (в силу закона сохранения энергии; см. Уравнение состояния идеального газа) и вскоре сойти с орбиты и упасть на ядро. Это стандартная задачка по физике для студентов-первокурсников, и любой из них легко докажет путем таких рассуждений, что планетарный атом не просуществует и секунды. Очевидно, что-то было не так в этой простой модели строения атома, раз реальные атомы, окружающие нас, просуществовали миллиарды лет.
Разрешить эту проблему и направить физиков по верному пути понимания атомной структуры удалось молодому датскому теоретику Нильсу Бору, недавно прибывшему на стажировку в Англию после защиты докторской диссертации у себя на родине. За отправную точку Бор принял новые постулаты квантовой механики, согласно которым на субатомном уровне энергия испускается исключительно порциями, которые получили название «кванты». Немецкий физик Макс Планк воспользовался положением о том, что атомы излучают свет отдельными частицами (позже Альберт Эйнштейн назвал их «фотоны»), для разрешения застарелой проблемы излучения черного тела. Используя концепцию фотонов, Альберт Эйнштейн теоретически объяснил фотоэлектрический эффект. За свои работы и Планк, и Эйнштейн получили по Нобелевской премии.
Используя концепцию фотонов, Альберт Эйнштейн теоретически объяснил фотоэлектрический эффект. За свои работы и Планк, и Эйнштейн получили по Нобелевской премии.
Бор развил квантовую теорию еще на шаг и применил ее к состоянию электронов на атомных орбитах. Говоря научным языком, он предположил, что угловой момент электрона (см. Опыт Штерна—Герлаха) квантуется. Далее он показал, что в этом случае электрон не может находиться на произвольном удалении от атомного ядра, а может быть лишь на ряде фиксированных орбит, получивших название «разрешенные орбиты». Электроны, находящиеся на таких орбитах, не могут излучать электромагнитные волны произвольной интенсивности и частоты, иначе им, скорее всего, пришлось бы перейти на более низкую, неразрешенную орбиту. Поэтому они и удерживаются на своей более высокой орбите, подобно самолету в аэропорту отправления, когда аэропорт назначения закрыт по причине нелетной погоды.
Однако электроны могут переходить на другую разрешенную орбиту. Как и большинство явлений в мире квантовой механики, этот процесс не так просто представить наглядно. Электрон просто исчезает с одной орбиты и материализуется на другой, не пересекая пространства между ними. Этот эффект назвали «квантовым прыжком», или «квантовым скачком». Позже этот термин обрел широкую популярность и вошел в наш лексикон со значением «внезапное, стремительное улучшение» («Настоящий квантовый скачок в технологии производства наручных часов!»). Если электрон перескакивает на более низкую орбиту, он теряет энергию и, соответственно, испускает квант света — фотон фиксированной энергии с фиксированной длиной волны. На глаз мы различаем фотоны разных энергий по цвету — раскаленная на огне медная проволока светится синим, а натриевая лампа уличного освещения — желтым. Для перехода на более высокую орбиту электрон должен, соответственно, поглотить фотон.
Как и большинство явлений в мире квантовой механики, этот процесс не так просто представить наглядно. Электрон просто исчезает с одной орбиты и материализуется на другой, не пересекая пространства между ними. Этот эффект назвали «квантовым прыжком», или «квантовым скачком». Позже этот термин обрел широкую популярность и вошел в наш лексикон со значением «внезапное, стремительное улучшение» («Настоящий квантовый скачок в технологии производства наручных часов!»). Если электрон перескакивает на более низкую орбиту, он теряет энергию и, соответственно, испускает квант света — фотон фиксированной энергии с фиксированной длиной волны. На глаз мы различаем фотоны разных энергий по цвету — раскаленная на огне медная проволока светится синим, а натриевая лампа уличного освещения — желтым. Для перехода на более высокую орбиту электрон должен, соответственно, поглотить фотон.
В картине атома по Бору, таким образом, электроны переходят вниз и вверх по орбитам дискретными скачками — с одной разрешенной орбиты на другую, подобно тому, как мы поднимаемся и спускаемся по ступеням лестницы. Каждый скачок обязательно сопровождается испусканием или поглощением кванта энергии электромагнитного излучения, который мы называем фотоном.
Каждый скачок обязательно сопровождается испусканием или поглощением кванта энергии электромагнитного излучения, который мы называем фотоном.
Со временем интуитивная гипотеза Бора уступила место строгой систематической формулировке в рамках законов квантовой механики и, в частности, концепции двойственной природы элементарных частиц — корпускулярно-волновой (см. Принцип дополнительности). Сегодня электроны представляются нам не микроскопическими планетами, обращающимися вокруг атомного ядра, а волнами вероятности, плещущимися внутри своих орбит — подобно приливам и отливам в тороидальном бассейне — и подчиняющимися уравнению Шрёдингера. Современные физики, как само собой разумеющееся, рассчитывают характеристики этих волн для самых сложных по структуре атомов и используют их для объяснения свойств и поведения этих атомов. Однако основополагающую картину всей современной квантовой механики нарисовал в своем великом прозрении Нильс Бор — в далеком теперь 1913 году.
Сколько электронов у бора?
Последняя обновленная дата: 01 -й февраля 2023
•
Общее представление: 235,8K
•
Просмотры сегодня: 5,28K
Ответ
Проверено
235,8K+ виды
Hint:
20202 235,8K+
Hint: 202020202 электронов, присутствующих в любом атоме, сначала мы должны знать атомный номер $\left( {\text{Z}} \right)$ или атомную массу $\left( {\text{A}} \right)$ этот атом, потому что атомный номер атома всегда равен количеству протонов, присутствующих внутри ядра, или количеству электронов, присутствующих на орбиталях вне ядра. 9{{\text{10}}}{\text{B}}$, где верхняя величина показывает атомную массу $\left( {\text{A}} \right)$, а нижняя величина показывает атомный номер $\left ( {\text{Z}} \right)$ атома бора.
9{{\text{10}}}{\text{B}}$, где верхняя величина показывает атомную массу $\left( {\text{A}} \right)$, а нижняя величина показывает атомный номер $\left ( {\text{Z}} \right)$ атома бора.
— Итак, атомная масса бора равна 10, а атомный номер — 5.
— Из соотношения между атомным номером и числом электронов видно, что в атоме бора присутствует пять электронов, так как атомный номер равен ни одному. . электронов или протонов.
Следовательно, в атоме Бора всего пять электронов. 91}$. Бор является металлоидом, что означает, что он имеет промежуточные свойства как металлов, так и неметаллов, и относится к категории элементов р-блока. Он присутствует в твердом состоянии и выглядит блестящим и ломким. Он является хорошим проводником тепла, а также электричества при высоких температурах.
Примечание: Количество электронов всегда равно атомному номеру атома только в нейтральном состоянии, но когда атом присутствует в форме иона, тогда число электронов отличается от атомного номера.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал Химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main
Какой элемент обладает наибольшим радиусом атомов Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций класса 12 по химии JEE_Main
В Индии по случаю бракосочетания фейерверков класс 12 по химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть отнесены к классу 12 по химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из перечисленного является истинным пероксидом A rmSrmOrm2 12 класса химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А класса 11 химии JEE_Main
Фосфин получают из следующей руды A Кальций класса 12 химический JEE_Main
Тенденции сомнения
Химия бора (Z=5) — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 551
Бор — пятый элемент периодической таблицы (Z = 5), расположенный в группе 13. Он классифицируется как металлоид благодаря своим свойствам, отражающим сочетание металлов и неметаллов.
Он классифицируется как металлоид благодаря своим свойствам, отражающим сочетание металлов и неметаллов.
Введение
Название бор происходит от арабского и персидского слов, обозначающих буру, основную руду. Хотя соединения бора были известны еще в древние времена, впервые он был выделен в 1808 году Гей-Люссаком и Тенаром и независимо сэром Хамфри Дэви (на счету которого много элементов!).
Бор присутствует в земной коре только в количестве около 10 частей на миллион (примерно столько же, сколько свинец). Чистый элемент блестящий и черный. Он очень твердый и в чистом виде почти такой же твердый, как алмаз, но слишком хрупкий для практического использования. При высоких температурах он является хорошим проводником, но при комнатной температуре и ниже является изолятором. Это поведение, а также многие другие его свойства позволили ему классифицироваться как металлоид. В дополнение к кристаллической форме бора существует также аморфный порошок темно-коричневого цвета (как показано выше).
Элемент можно получить восстановлением буры (\(Na_2B_4O_7\)) углеродом. Бор высокой чистоты можно получить электролизом расплавленного фторбората калия. Общие соединения бора включают буру и борную кислоту (\(H_3BO_3\)).
| Атомная масса | 10,811 г/моль |
| Электронная конфигурация | [He]2s 2 2p 1 |
| Точка плавления | 2349К |
| Точка кипения | 4200 К |
| Теплота плавления | 50,2 кДж/моль |
| Теплота парообразования | 480 кДж/моль |
| Удельная теплоемкость | 11,087 Дж/моль·К |
| Степени окисления | +4, +3, +2, +1 |
| Магнитный заказ | диамагнетик |
| Электроотрицательность | 2,04 |
| Атомный радиус | 90 вечера |
| Стабильные изотопы | 10 Б, 11 Б |
Бор — единственный элемент группы 3, который не является металлом. Он обладает свойствами, лежащими между металлами и неметаллами (полуметаллами). Например, бор является полупроводником, в отличие от остальных элементов группы 13. Химически он ближе к алюминию, чем любой другой элемент 13 группы.
Он обладает свойствами, лежащими между металлами и неметаллами (полуметаллами). Например, бор является полупроводником, в отличие от остальных элементов группы 13. Химически он ближе к алюминию, чем любой другой элемент 13 группы.
История
Бор был впервые обнаружен Жозефом-Луи Гей-Люссаком и Луи-Жаком Тенаром, а также Гемфри Дэви в 1808 году. Эти химики выделили бор, объединив борную кислоту с калием. Сегодня существует множество способов получения бора, но наиболее распространенным является нагревание буры (соединение натрия и бора) с кальцием.
Бор и его соединения
Многие соединения бора являются электронодефицитными, что означает отсутствие октета электронов вокруг центрального атома бора. Этот недостаток объясняет, почему бор является сильной кислотой Льюиса, поскольку он может принимать протоны (H 9ионов 0118 + ) в растворе. Бороводородные соединения называются гидридами бора или боранами.
Бораны
В молекуле BH 3 каждый из 3 атомов водорода связан с центральным атомом бора.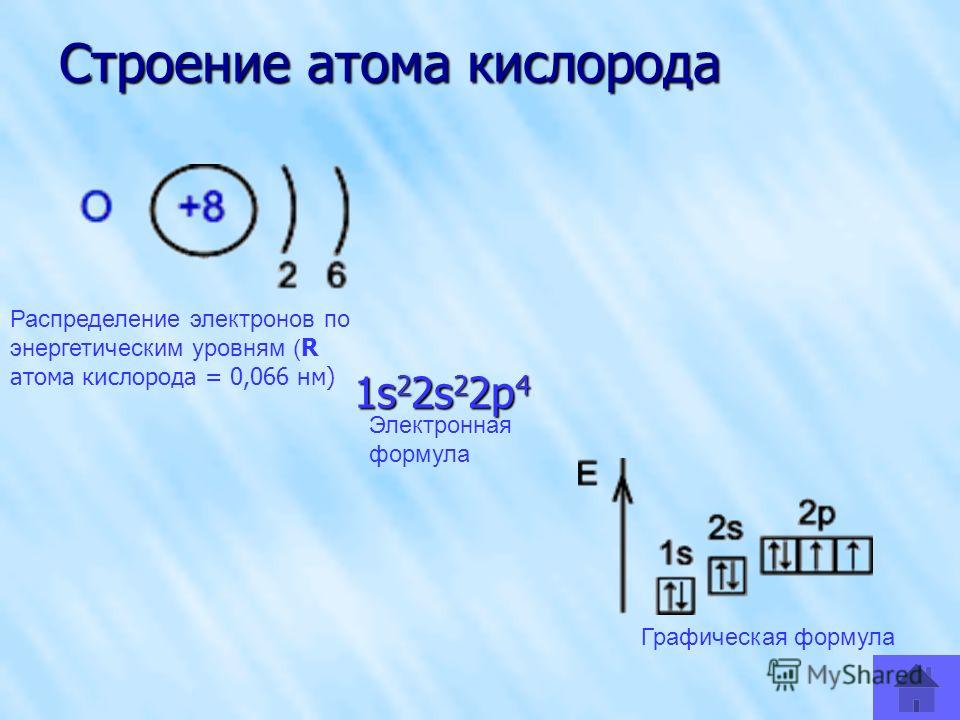 Атом бора имеет только шесть электронов на внешней оболочке, что приводит к дефициту электронов.
Атом бора имеет только шесть электронов на внешней оболочке, что приводит к дефициту электронов.
Диборан:
H H
I I
H — B ? В — Н
I I
H H
Эта молекула имеет 12 электронов валентной оболочки; по 3 из атомов B и по 1 из шести атомов H. Чтобы эта структура соответствовала правилам, необходимым для рисования любой модели структуры Льюиса, она должна иметь 14 электронов валентной оболочки; однако это не так. Согласно этому рисунку два атома В и четыре атома Н лежат в одной плоскости (sp 3 — перпендикулярно плоскости страницы). В этих четырех связях участвует 8 электронов. Четыре электрона связывают оставшиеся атомы H с двумя атомами B и атомами B вместе. Это делается, когда два атома H одновременно связываются с двумя атомами B. Это создает то, что называется атомным «мостом», потому что два электрона являются общими для трех атомов. Эти связи также называют трехцентровыми двухэлектронными связями. Связь между атомами H и B можно объяснить с помощью теории молекулярных орбиталей.
Другие соединения бора
Хотя соединения бора широко распространены в земной коре, несколько концентрированных руд находятся в Италии, России, Тибете, Турции и Калифорнии. Бура является наиболее распространенной рудой, и ее можно превратить в различные соединения бора. При кристаллизации раствора буры и перекиси водорода образуется перборат натрия (NaBO 3 * 4 H 2 O). Перборат натрия используется в отбеливателях, безопасных для цвета. Ключом к отбеливающей способности этого соединения является наличие в нем двух пероксогрупп, соединяющих атомы бора вместе. Другое соединение, из которого могут быть синтезированы другие соединения бора, — это борная кислота (B(OH) 3 ). При смешивании с водой слабокислотная и электронодефицитная борная кислота принимает ион OH- из воды и образует комплексный ион [B(OH) 4 ]-.
Боратные соли производят основные растворы, которые используются в чистящих средствах. Борная кислота также используется в качестве инсектицида для уничтожения тараканов и в качестве антисептика в растворах для промывания глаз. Другие соединения бора используются во множестве вещей, например, в клеях, цементе, дезинфицирующих средствах, удобрениях, антипиренах, стекле, гербицидах, металлургических флюсах, текстильных отбеливателях и красителях.
Другие соединения бора используются во множестве вещей, например, в клеях, цементе, дезинфицирующих средствах, удобрениях, антипиренах, стекле, гербицидах, металлургических флюсах, текстильных отбеливателях и красителях.
Ссылки
- Адэр, Рик, изд. Бор. The Rosen Group Inc., 2007. Печать.
- Хасан, Хизер. Элементы бора: бор, алюминий, галлий, индий, таллий. Группа Розен, 2009. Печать.
Проблемы
- Какова электронная конфигурация бора?
- Чем объясняется образование гидридов бора?
- Каковы некоторые области применения соединений бора?
- Ничья B 4 H 10 .
- Что такое теория молекулярных орбиталей и как она используется для объяснения связей в гидридах бора?
Ответы
- [He]2s 2 2p 1
- Бор очень электроотрицателен и хочет образовывать соединения с атомами водорода.
- Клеи, цемент, дезинфицирующие средства, удобрения и т.


 Селен
Селен Гольмий
Гольмий Фермий
Фермий