Железо: качественные реакции на его ионы
Физические и химические свойства железа
Твитнуть
Отправить
[Deposit Photos]Химический элемент железо известен людям еще с древности: старинные предметы быта, выполненные из этого материала, ученые приписывают к IV тысячелетию до нашей эры.
Жизнь человека невозможно представить без железа. Считается, что железо используется для промышленных нужд чаще, чем другие металлы. Из него изготавливают важнейшие конструкции. Также железо в небольших количествах содержится в крови. Именно содержание двадцать шестого элемента окрашивает кровь в красный цвет.
Физические свойства железа
Железо — металл бело-серого цвета с серебристым блеском.
Чистое золото [Wikimedia]
У железа ярко выраженные магнитные свойства. Температура плавления металла равняется 1539 градусам Цельсия, а закипает вещество при 2862 градусах.
Химические свойства железа
Наиболее характерные степени окисления железа — +2 и +3, но также получено железо со степенью окисления +6. Железо +3 имеет слабые окислительные свойства.
При температуре до 200 °С железо покрывается плотной оксидной пленкой, которая мешает дальнейшему окислению. В присутствии влаги металл сильно окисляется, покрываясь ржавчиной.
[Deposit Photos]Железо хорошо реагирует с соляной и разбавленной серной кислотами:
Fe + 2HCl = FeCl₂ + H₂;
Fe + H₂SO₄(разб.) = FeSO₄ + H₂.
В кислороде железо горит, образуя оксид:
3Fe + 2O₂ = Fe₃O₄.
При нагревании железо может реагировать с неметаллами:
Fe + S = FeS.
Также при температуре 700—900 °С вступает в реакцию с водяным паром:
3Fe + 4H₂O = Fe₃O₄ + 4H₂.
Соединения железа
Как известно, у оксидов железа есть ионы с двумя степенями окисления: +2 и + 3. Знать это крайне важно, ведь для разных элементов будут проводиться совершенно разные качественные реакции.
Качественные реакции на железо
Качественная реакция нужна для того, чтобы без труда можно было определить присутствие ионов одного вещества в растворах или примесях другого. Рассмотрим качественные реакции двухвалентного и трехвалентного железа.
Качественные реакции на железо (III)
Определить содержание ионов трехвалентного железа в растворе можно с помощью щелочи. При положительном результате образуется основание — гидроксид железа (III) Fe(OH)₃.
Гидроксид железа (III) Fe(OH)₃ [Wikimedia]FeCl₃ + 3NaOH = Fe(OH)₃↓+ 3NaCl.
Также определить ионы Fe(III) можно с помощью желтой кровяной соли K₃[Fe(CN)₆].
Раствор хлорида железа смешивают с желтоватым раствором кровяной соли. В результате можно увидеть красивый синеватый осадок, который и будет свидетельствовать о том, что в растворе присутствуют ионы трехвалентного железа. Здесь вы найдете зрелищные опыты на изучение свойств железа.
Качественные реакции на железо (II)
Ионы Fe²⁺ вступают в реакцию с красной кровяной солью K₄[Fe(CN)₆]. Если при добавлении соли образуется синеватый осадок, то эти ионы присутствуют в растворе.
[Flickr] ТвитнутьОтправить
Больше статей о химии:
- Эксперимент «Фиолетовое облако» Как получить фиолетовый искрящийся дым из алюминия и йода
- Эксперимент «Клеточка Траубе» Как вырастить искусственную клетку в ходе химической реакции
Делайте эксперименты дома!
Оловянное дерево
Узнать больше
Переходные металлы 11 класс онлайн-подготовка на Ростелеком Лицей
Общие свойства переходных металлов
Переходные элементы располагаются в побочных подгруппах Периодической системы Д. И. Менделеева. Их подразделяют на d-элементы и f-элементы. f-элементы – это лантаноиды и актиноиды.
И. Менделеева. Их подразделяют на d-элементы и f-элементы. f-элементы – это лантаноиды и актиноиды.
При образовании соединений атомы металлов могут использовать не только валентные s- и p-электроны, но и d-электроны. Поэтому для d-элементов гораздо более характерна переменная валентность, чем для элементов главных подгрупп. Благодаря этому свойству переходные металлы часто образуют комплексные соединения.
Переходные элементы – это металлы. Поэтому в своих соединениях они проявляют положительные степени окисления. Очень сильно видно различие в свойствах у элементов IV–VIII подгрупп периодической системы. Элементы побочных подгрупп – это металлы, а главных подгрупп – неметаллы. Однако, когда элементы главных и побочных подгрупп находятся в высших степенях окисления, их соединения проявляют заметное сходство.
Например, оксид CrO3 близок по свойствам SO3. Оба эти вещества в обычных условиях находятся в твердом состоянии и образуют при взаимодействии с водой кислоты состава H2ЭO4. Точно также – оксиды марганца и хлора. Соответствующие им высшие оксиды – Mn2O7 и Cl2O7. Им соответствуют кислоты состава HЭО4. Подобная близость свойств объясняется тем, что часто элементы главных и побочных подгрупп в высших степенях окисления приобретают сходное электронное строение. Что касается химических свойств d-элементов, то обращает на себя внимание тот факт, что в пределах одной декады переходных элементов число стабильных степеней окисления сначала увеличивается, а потом уменьшается (cм. Табл. 1). Химические свойства переходных элементов довольно сложны.
Точно также – оксиды марганца и хлора. Соответствующие им высшие оксиды – Mn2O7 и Cl2O7. Им соответствуют кислоты состава HЭО4. Подобная близость свойств объясняется тем, что часто элементы главных и побочных подгрупп в высших степенях окисления приобретают сходное электронное строение. Что касается химических свойств d-элементов, то обращает на себя внимание тот факт, что в пределах одной декады переходных элементов число стабильных степеней окисления сначала увеличивается, а потом уменьшается (cм. Табл. 1). Химические свойства переходных элементов довольно сложны.
Табл. 1
Значение переходных металлов для организма и жизнедеятельности
Без переходных металлов наш организм существовать не может. Железо – это действующее начало гемоглобина. Цинк участвует в выработке инсулина. Кобальт – центр витамина В-12. Медь, марганец и молибден, а также некоторые другие металлы входят в состав ферментов.
Многие переходные металлы и их соединения используются в качестве катализаторов. Например, реакция гидрирования алкенов на платиновом или палладиевом катализаторе. Полимеризация этилена проводится с помощью титансодержащих катализаторов.
Рис. 1
Большое использование сплавов переходных металлов: сталь, чугун, бронза, латунь, победит (рис. 1). При исследовании сплавов прослеживается уникальное значение железа для человека. Сплавы даже разделяют на черные и цветные по содержанию в них железа.
Химические свойства железа
Химические свойства железа и его соединений
Железо – это химический элемент №26, который находится в побочной подгруппе VIII группы, в четвертом периоде. Электронная конфигурация атома железа – 1s22s22p63s23p63d64s2.
Рис. 2
Распределение валентных электронов на орбиталях представлено на рис. 2.
Степени окисления железа: 0, +2, +3. Соединения железа (III) проявляют слабые окислительные свойства, образуемые оксиды и гидроксиды Fe2O3 и Fe(OH)3 проявляют амфотерные свойства, хотя основные свойства у этих соединений значительно преобладают.
Соединения железа (III) проявляют слабые окислительные свойства, образуемые оксиды и гидроксиды Fe2O3 и Fe(OH)3 проявляют амфотерные свойства, хотя основные свойства у этих соединений значительно преобладают.
1. Взаимодействие с неметаллами
При нагревании железо, особенно порошкообразное, способно взаимодействовать практически со всеми неметаллами. Хлор и фтор окисляют железо до Fe+3. Бром может окислить и до Fe+2, и до Fe+3 в зависимости от количества, а йод окисляет только до степени окисления +2Fe+2. При реакции с серой сначала образуется сульфид железа, а затем дисульфид железа.
Fe + S FeS
FeS + S FeS2 — природный минерал такого состава называется пирит (рис. 3).
Он используется для получения серной кислоты, а также железа и соединений железа.
Рис. 3
2. Взаимодействие железа с кислородом
При взаимодействии железа с кислородом, в зависимости от его количества, могут образовываться разные оксиды. В том числе и смешанный оксид Fe3O4.
В том числе и смешанный оксид Fe3O4.
2Fe + О2 2FeО
4Fe + 3О2 2Fe2О3
3Fe + 2О2 Fe3О4
3. Взаимодействие железа с водой
При сильном нагревании металлическое железо взаимодействует с водой.
3Fe + 4Н2О Fe3О4 + 4Н2↑
Во влажном воздухе при обычных условиях железо реагирует с парами воды и кислородом, с образованием ржавчины. Она состоит из смешенных оксидов, гидроксидов и соединений кислорода. Это не индивидуальное вещество.
Примерная схема ржавления железа:
4Fe + 6Н2О + 3О2 → 4Fe(ОН)3
4. Взаимодействие железа с кислотами
Как и другие типичные металлы, железо взаимодействует с кислотами-неокислителями с выделением водорода.
Fe + 2НCl → FeCl2 + Н2↑
С кислотами-окислителями железо не реагирует из-за пассивации. Но с разбавленными кислотами реакция происходит.
Но с разбавленными кислотами реакция происходит.
Fe + 4НNO3 → Fe(NO3)3 + NO↑ + 2Н2O
5. С растворами солей
Металлическое железо вытесняет менее активные металлы из растворов их солей.
Fe + CuSO4 → Cu + FeSO4
Амфотерные свойства железа
Железо и некоторые его соединения способны проявлять амфотерные свойства.
Fe + 2NaOH + 2H2O → Na2[Fe(OH)4] + H2↑ В горячем концентрированном растворе щелочи образуется комплексное соединение, и выделяется водород.
Соединения железа (II) и железа (III)
Соединения железа (II)
Соли железа (II) можно получить при взаимодействии металлического железа с кислотами-неокислителями или восстановлением железа (III).
2FeCl3 + Fe → 3FeCl2
Соединения железа (II) обладают восстановительными свойствами.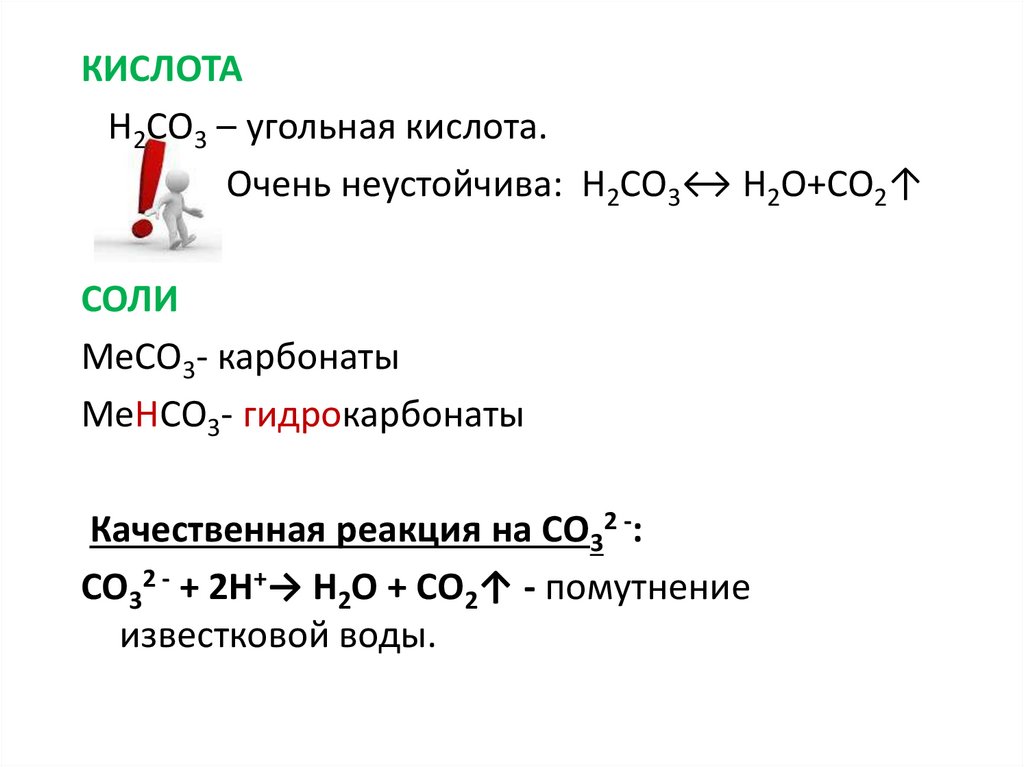
FeCl2 + 2NaOH → Fe(OH)2↓ + 2NaCl. На воздухе Fe(OH)2↓ окисляется кислородом.
4Fe(OH)2↓ + 2H2O + O2 → 4Fe(OH)3↓
Соединения железа (III)
Соли железа (III) получают либо окислением железа галогенами, либо при его взаимодействии с разбавленными кислотами-окислителями. Соли железа (III) могут проявлять слабые окислительные свойства.
2FeCl3 +2KI → 2FeCl2 + I2↓ + 2KCl. На этой реакции основан йодометрический способ определения солей железа.
Качественная реакция на соли железа (III)
FeCl3 + 6NaSCN → Na3[Fe(SCN)6] + 3NaCl. При взаимодействии с роданидами образуются ярко-красные, похожие на кровь комплексы различного состава.
Взаимодействие со щелочью.
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
Fe(OH)3↓ как и Fe(OH)2↓ амфотерен, с преобладанием основных свойств.
Fe(OH)3↓ + 3HCl → FeCl3 + 3H2O
Fe(OH)3 + NaOH → NaFeO2 + 2H2O
Железная кислота и её соли
При окислении Fe(OH)3↓ или при электролизе раствора щелочи на железном аноде образуются соли, содержащие железо в составе аниона:
2Fe(OH)3 + 3Cl2 + 10NaOH → 2Na2FeO4 + 6NaCl + 8H2O
Fe + 2KOH + 2H2O → K2FeO4 + 3H2↑
Железо имеет степень окисления +6. Такие соли называются ферраты: Na
Подведение итога урока
В ходе урока вы изучили тему «Переходные металлы». Вы узнали о некоторых общих свойствах переходных металлов, о химических свойствах железа как наиболее важного переходного металла. Мы подчеркнули важность и необходимость для организма человека наличия именно переходных металлов. Рассмотрели некоторые примеры сплавов переходных металлов, исследовали амфотерные свойства железа и его соединений с различными степенями окисления. Немного узнали о железной кислоте и ее солях – ферратах.
Мы подчеркнули важность и необходимость для организма человека наличия именно переходных металлов. Рассмотрели некоторые примеры сплавов переходных металлов, исследовали амфотерные свойства железа и его соединений с различными степенями окисления. Немного узнали о железной кислоте и ее солях – ферратах.
Список литературы
- Рудзитис Г. Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
- Попель П. П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П. П. Попель, Л. С. Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
- Габриелян О. С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа, 2007. – 220 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Интернет-портал «internerurok.ru» (Источник)
- Интернет-портал «hemi.
 nsu.ru» (Источник)
nsu.ru» (Источник) - Интернет-портал «chemport.ru» (Источник)
- Интернет-портал «Химик.ру» (Источник)
Домашнее задание
- №№ 1, 5-б, в (с. 173) Габриелян О. С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа, 2007. – 220 с.
- Что такое металлотермия? Приведите примеры.
- Какие свойства характерны для соединений железа (III)?
Железо
ЖелезоЖелезо, Fe 3+
Наиболее распространенное окисление штаты : +2, +3
М.П. 1535 или
Б.П. 2750 или
Плотность 7,87 г/см 3
Характеристики : Серый, умеренно активный металл.
Характерные реакции Фе 2+ и Fe 3+ :
[Fe(H 2 O) 6 ] 3+ ион бесцветный (или бледно-розовый), но многие растворы, содержащие его
ионы имеют желтый или янтарный цвет из-за гидролиза.
Водный аммиак:
Водный аммиак реагирует с Fe(II) ионы для получения белого желеобразного Fe(OH) 2 , который окисляется с образованием красно-коричневого Fe(OH) 3 :
Водный аммиак реагирует с Fe(III) ионы с образованием красно-коричневого Fe(OH) 3 :
Оба осадка нерастворимы в избыток водного аммиака. Гидроксид железа(II) быстро окисляется до Fe(OH) 3 в присутствии воздуха или других окислителей агенты.
Гидроксид натрия также производит
Fe(OH) 2 и Fe(OH) 3 из соответствующих степеней окисления железа в водной
решение.
Нет осадка гидроксида растворяется в избытке гидроксида натрия.
Ферроцианид калия:
Ферроцианид калия вступает в реакцию с раствором Fe 3+ для получения темно-синего осадка называется берлинская лазурь:
С Fe 2+
раствора образуется белый осадок, который превращается до синего из-за окисления кислородом воздуха: Примечание. Многие ионы металлов образуют
ферроцианид выпадает в осадок, поэтому ферроцианид калия не является хорошим
реагент для разделения ионов металлов. Чаще используется в качестве
подтверждающий тест.
Многие ионы металлов образуют
ферроцианид выпадает в осадок, поэтому ферроцианид калия не является хорошим
реагент для разделения ионов металлов. Чаще используется в качестве
подтверждающий тест.
Феррицианид калия:
Феррицианид калия даст коричневая окраска, но без осадка с Fe 3+ . С Fe 2+ образуется темно-синий осадок. Несмотря на то что этот осадок известен как синий Тернбулла, он идентичен берлинская лазурь.
Калий Тиоцианат:
KSCN дает темно-красную окраску. к растворам, содержащим Fe 3+ :
Нет реакции:
Класс — , SO 4 2-
Перейти к катионное меню
| 1 | Найдите число нейтронов | Х | ||
| 2 | Найдите массу 1 моля | Н_2О | ||
| 3 | Весы | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | ||
| 4 | Найдите массу 1 моля | Х | ||
| 5 | Найдите число нейтронов | Фе | ||
| 6 | Найдите число нейтронов | ТК | ||
| 7 | Найдите электронную конфигурацию | Х | ||
| 8 | Найдите число нейтронов | Са | ||
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | ||
| 10 | Найдите число нейтронов | С | ||
| 11 | Найдите число протонов | Х | ||
| 12 | Найдите количество нейтронов | О | ||
| 13 | Найдите массу 1 моля | СО_2 | ||
| 14 | Весы | C_8H_18+O_2→CO_2+H_2O | ||
| 15 | Найдите атомную массу | Х | ||
| 16 | Определите, растворимо ли соединение в воде | Н_2О | ||
| 17 | Найдите электронную конфигурацию | На | ||
| 18 | Найдите массу отдельного атома | Х | ||
| 19 | Найдите число нейтронов | № | ||
| 20 | Найдите число нейтронов | Золото | ||
| 21 | Найдите число нейтронов | Мн | ||
| 22 | Найдите количество нейтронов | Ру | ||
| 23 | Найдите электронную конфигурацию | О | ||
| 24 | Найдите массовые проценты | Н_2О | ||
| 25 | Определите, растворимо ли соединение в воде | NaCl | ||
| 26 | Найдите эмпирическую/самую простую формулу | Н_2О | ||
| 27 | Найдите числа окисления | Н_2О | ||
| 28 | Найдите электронную конфигурацию | К | ||
| 29 | Найдите электронную конфигурацию | мг | ||
| 30 | Найдите электронную конфигурацию | Са | ||
| 31 | Найдите число нейтронов | Rh | ||
| 32 | Найдите число нейтронов | На | ||
| 33 | Найдите число нейтронов | Пт | ||
| 34 | Найдите число нейтронов | Быть | Быть | |
| 35 | Найдите число нейтронов | Кр | ||
| 36 | Найдите массу 1 моля | Н_2SO_4 | ||
| 37 | Найдите массу 1 моля | HCl | ||
| 38 | Найдите массу 1 моля | Фе | ||
| 39 | Найдите массу 1 моля | С | ||
| 40 | Найдите число нейтронов | Медь | ||
| 41 | Найдите число нейтронов | С | ||
| 42 | Найдите числа окисления | Х | ||
| 43 | Весы | CH_4+O_2→CO_2+H_2O | ||
| 44 | Найдите атомную массу | О | ||
| 45 | Найдите атомный номер | Х | ||
| 46 | Найдите число нейтронов | Пн | ||
| 47 | Найдите число нейтронов | ОС | ||
| 48 | Найдите массу 1 моля | NaOH | ||
| 49 | Найдите массу 1 моля | О | ||
| 50 | Найдите электронную конфигурацию | Фе | ||
| 51 | Найдите электронную конфигурацию | С | ||
| 52 | Найдите массовые проценты | NaCl | ||
| 53 | Найдите массу 1 моля | К | ||
| 54 | Найдите массу отдельного атома | На | ||
| 55 | Найдите число нейтронов | Н | ||
| 56 | Найдите число нейтронов | Ли | ||
| 57 | Найдите число нейтронов | В | 92О | |
| 60 | Упростить | ч*2р | ||
| 61 | Определите, растворимо ли соединение в воде | Х | ||
| 62 | Определение плотности на STP | Н_2О | ||
| 63 | Найдите числа окисления | NaCl | ||
| 64 | Найдите атомную массу | Он | Он | |
| 65 | Найдите атомную массу | мг | ||
| 66 | Найдите число электронов | Х | ||
| 67 | Найдите число электронов | О | ||
| 68 | Найдите число электронов | С | ||
| 69 | Найдите количество нейтронов | ПД | ||
| 70 | Найдите число нейтронов | рт. |

 nsu.ru» (Источник)
nsu.ru» (Источник)