Азот — степени окисления, свойства и реакции
Поможем понять и полюбить химию
Начать учиться
В этой статье мы рассмотрим характеристики азота в химии, узнаем, какие степени окисления может иметь азот и поговорим о важнейших соединениях, в состав которых входит этот химический элемент.
Азот (N2) — первый представитель V группы главной подгруппы и 2 периода периодической системы химических элементов Д. И. Менделеева. Если рассматривать местоположение азота в длиннопериодной таблице Менделеева, то там он занимает лидирующее место в 15 группе. Для представителей этой группы было предложено название пниктогены (от греческого корня πνῑ́γω — удушливый, плохо пахнущий). Явно это относится к водородным соединениям представителей данной группы.
Электронное строение азота
Рассмотрим строение атома и электронную конфигурацию азота, а затем сделаем некоторые заключения.
Атомный или порядковый номер азота равен 7, что соответствует количеству электронов и протонов в ядре. Молярная масса равна 14,00728 г/моль, а количество нейтронов в атоме этого изотопа равно семи.
Теперь перейдем к электронному строению. В основном состоянии электронная формула азота: 1s2 2s2 2p3, в сокращенном виде — [He]2s2 2p3. На внешнем энергетическом уровне 5 валентных электронов, среди которых 3 неспаренных p-электрона.
Исходя из такой конфигурации, азот может образовывать только 3 связи по обменному механизму и еще одну по донорно-акцепторному механизму. Это связано с тем, что на втором подуровне у азота больше нет вакантных орбиталей, куда могли бы распариться электроны с 2s-подуровня. Отсюда вытекает максимальная валентность азота IV.
Важно
Валентности азота V нет!
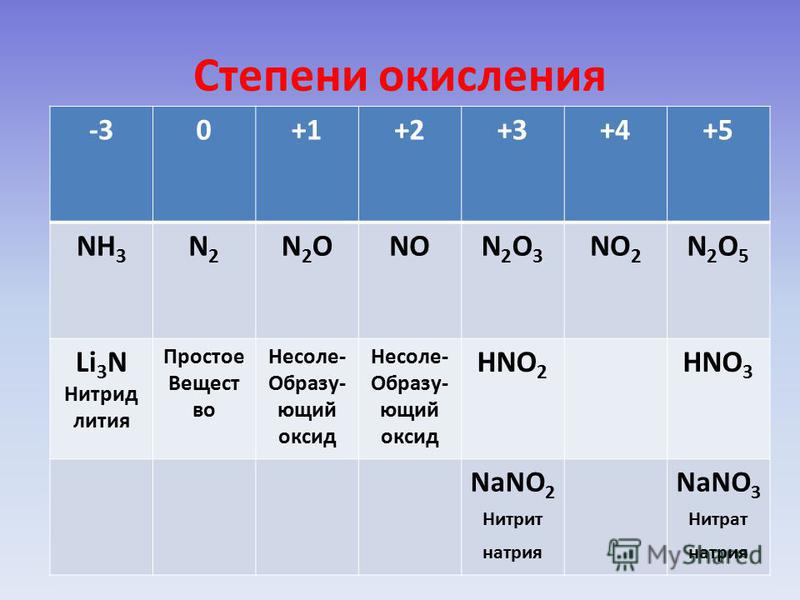
Для азота характерен весь спектр возможных степеней окисления от −3 до +5.
Давайте рассмотрим шкалу, где отражены соединения азота в различных веществах.
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Строение молекулы азота
Азот — двухатомная молекула, атомы которой связаны между собой прочной тройной связью. Длина связи — 0,110 нм.
Почему именно тройная связь и из чего она состоит?
Напомним, что у каждого атома в молекуле азота 3 неспаренных электрона, которые и образуют впоследствии тройную связь, которая, в свою очередь, состоит из одной сигма-связи и двух пи-связей.
Физические свойства азота
Азот как простое вещество — бесцветный газ, который не имеет запаха и плохо растворяется в воде. По своей молярной массе азот легче, чем воздух. Благодаря наличию тройной неполярной связи и относительно маленьким радиусам атомов азот имеет низкие температуры кипения и плавления: tпл = −210 °С и tкип = −196 °С.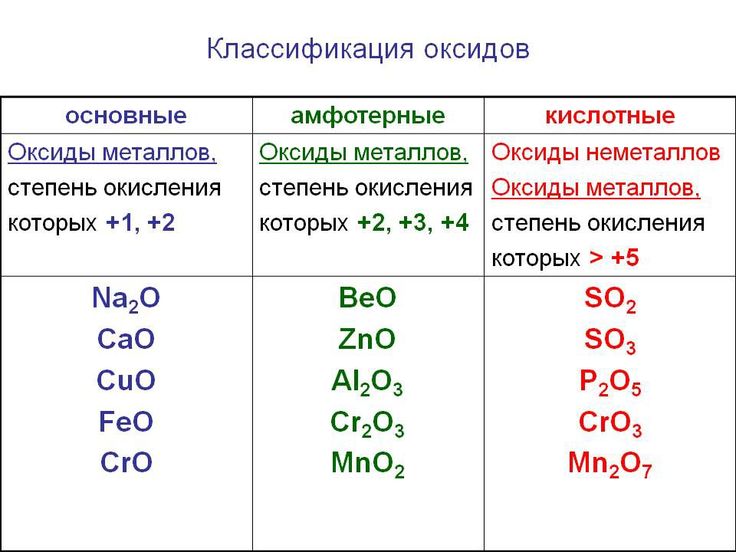 Аллотропных модификаций азот не имеет. Несмотря на то, что основное состояние азота — газообразное, он бывает еще и жидким. Например, 1 литр жидкого азота при нагревании до 20 °С превращается в 700 литров газообразного азота. Более подробную информацию можно узнать в нашем видео:
Аллотропных модификаций азот не имеет. Несмотря на то, что основное состояние азота — газообразное, он бывает еще и жидким. Например, 1 литр жидкого азота при нагревании до 20 °С превращается в 700 литров газообразного азота. Более подробную информацию можно узнать в нашем видео:
Химические свойства азота
Азот химически малоактивен из-за наличия все той же тройной связи. Она же обуславливает малую термическую устойчивость соединений азота при нагревании. В химических реакциях азот может проявлять себя и как окислитель, и как восстановитель благодаря широкому спектру возможных степеней окисления.
Как восстановитель азот реагирует:
с фтором
N2 + F2 = 2NF3с кислородом
N2 + O2 = 2NO
Эти реакции проходят при температуре выше 1000 градусов Цельсия либо в электрическом заряде.
Как окислитель азот реагирует:
с металлами
N2 + 6Li = 2Li3азот реагирует при обычных условиях только с литием, а с щелочноземельными металлами — только при нагревании;
с водородом
N2 +3H2 = 2NH3реакция протекает обратимо в присутствии металлического железа в качестве катализатора.
Рассмотрим способы получения азота. В промышленности его получают фракционной перегонкой жидкого воздуха, а вот в лаборатории азот получают иначе. Вот лишь некоторые способы:
реакция взаимодействия хлорида аммония и нитрита натрия
NaNO2 + NH4Cl = N2 + NaCl + 2H2Oразложение некоторых солей аммония (на примере нитрита аммония)
NH4NO2 = N2 + 2H2O
Азот — основной компонент любого белка в организме человека.
Важнейшие соединения азота
Аммиак
В первую очередь поговорим о водородном соединении азота — аммиаке. Аммиак — бесцветный газ с характерным резким запахом. Давайте рассмотрим строение молекулы аммиака:
Аммиак имеет форму тригональной пирамиды. Этот газ очень ядовит и способен вызывать химический ожог глаз, а пары сильно раздражают слизистые оболочки органов дыхания. В то же время аммиак обладает достаточно высокой растворимостью в воде из-за образования водородных связей с молекулами воды. Вас когда-нибудь приводили в чувства после потери сознания ваткой, смоченной чем-то гадко пахнущим? Поздравляю, это было ваше первое знакомство с раствором аммиака в воде.
В отличие от самого азота, аммиак является крайне реакционноспособным соединением. Так как азот находится в аммиаке в своей низшей степени окисления (−3), то аммиак проявляет только восстановительные свойства.
Так как азот находится в аммиаке в своей низшей степени окисления (−3), то аммиак проявляет только восстановительные свойства.
Например, аммиак реагирует с кислородом (при нагревании):
Как видно из уравнений, аммиак вступает в реакции окисления, а продукты его окисления напрямую зависят от силы окислителя и условий проведения реакций.
Со сложными веществами — окислителями аммиак реагирует следующим образом:
6NH3 + 8KClO3 + 6NaOH = 6NaNO3 + 8KCl + 12H2O
10NH3 + 6KMnO 4 + 9H2SO4 = 5N2 + 6MnSO4 + 3K2SO4 + 24H2O
С кислотами аммиак реагирует благодаря своим оснóвным свойствам, что приводит к образованию различных солей:
А теперь рассмотрим получение аммиака. Различают два типа способов: промышленный и лабораторный.
Различают два типа способов: промышленный и лабораторный.
Промышленный способ — синтез из простых веществ:
Лабораторный способ:
В данном способе аммиак собирают в перевернутую вверх дном колбу, так как аммиак легче воздуха.
Азотная кислота
Азотная кислота — одна из важнейших неорганических кислот. Это летучая бесцветная жидкость с резким запахом, которая способна смешиваться с водой в любых пропорциях.
Получают ее в промышленности в несколько этапов. Рассмотрим подробнее каждый из них:
Окисление аммиака кислородом воздуха на платиновом катализаторе
4NH3 + 5O2 = 4NO + 6H2OОкисление оксида азота (II)
2NO + O2 = 2NO2Поглощение образующегося оксида азота (IV) водой в избытке воздуха
4NO2 + O2 + 2H2O = 4HNO3
Для азотной кислоты характерны особые химические свойства исходя из ее концентрации.
Например, с металлами данная кислота никогда не будет реагировать с выделением газообразного водорода. Рассмотрим таблицу с примерами металлов с различными концентрациями азотной кислоты:
Также азотная кислота как сильный окислитель способна окислять некоторые неметаллы до их кислот. Давайте рассмотрим примеры:
Азотная кислота в соотношении 1:3 с соляной кислотой образуют смесь под названием царская водка. Это желтовато-оранжевая дымящаяся жидкость, которая получила свое название от алхимиков благодаря способности растворять «царские» металлы — золото и платину.
Оксиды азота
В отличие от других химических элементов, азот образует большое число оксидов: N2O, NO, N2O3, NO2, N2O4 и N2O5, каждый из которых является кислотным. В таблице показали, какой оксид какой кислоте соответствует:
 Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде. У этого оксида есть и другие названия, самое распространенное из них — закись азота. Оксид азота (I) применяли в медицине в качестве наркоза более 200 лет назад. При вдыхании этого газа человека охватывает радость и безудержный смех, отчего оксид получил еще одно название — веселящий газ.
Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде. У этого оксида есть и другие названия, самое распространенное из них — закись азота. Оксид азота (I) применяли в медицине в качестве наркоза более 200 лет назад. При вдыхании этого газа человека охватывает радость и безудержный смех, отчего оксид получил еще одно название — веселящий газ.
Оксид азота (II) NO. Несолеобразующий оксид, который при нормальный условиях является бесцветным газом, плохо растворяется в воде и в больших концентрациях ядовит для человека.
Оксид азота (III) N2O3. Соединение очень неустойчивое и существует только при низких температурах. В твердом и жидком состоянии оксид азота (III) окрашен в ярко-синий цвет. При температуре выше 0 градусов разлагается до оксида азота (II) и оксида азота (IV).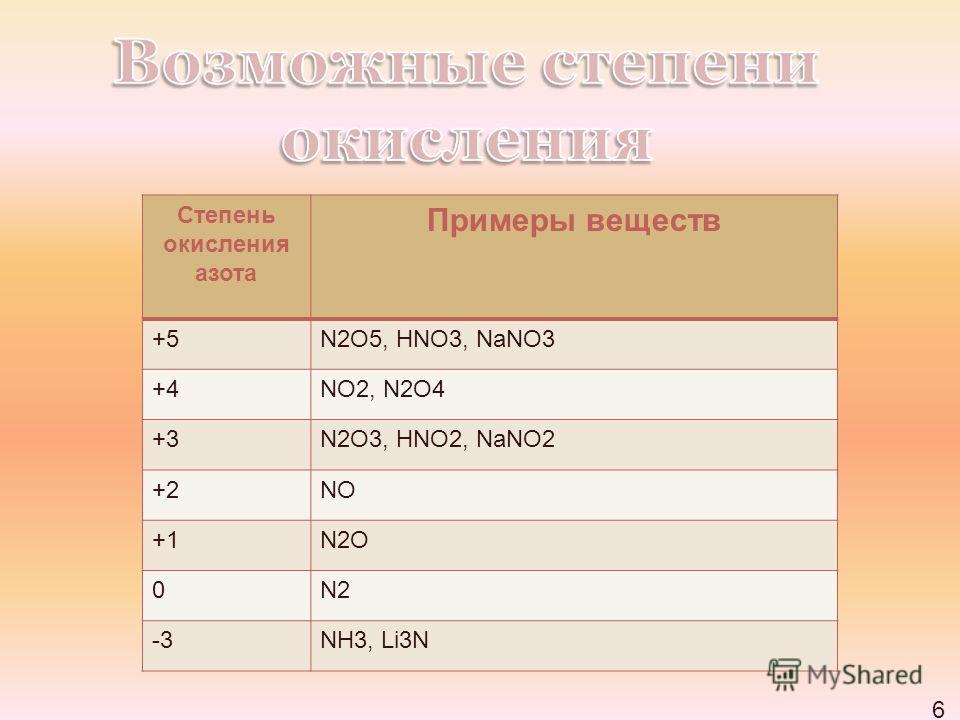
Оксиды азота (IV) NO2 и N2O4. Твердый оксид азота (IV) бесцветный, так как состоит из молекул N2O4. При нагревании появляется коричневая окраска, которая усиливается с повышением температуры по мере увеличения NO2 в смеси. Эти оксиды хорошо растворимы в воде и взаимодействуют с ней.
Оксид азота (V) N2O5. Азотный ангидрид, который образуется в виде летучих бесцветных гигроскопичных кристаллов. Это крайне неустойчивое вещество, которое распадается в течение нескольких часов. При нагревании распадается со взрывом на оксид азота (IV) и газообразный кислород.
Вопросы для самопроверки
Какую связь образуют между собой атомы азота?
Одинарную.
Двойную.

Тройную.
Выберите высшую и низшую степени окисления азота:
−3 и +5,
−5 и +3,
0 и +4,
−3 и +3.
Максимальная валентность азота равна:
V,
III,
-
IV,
II.
В каком качестве выступает аммиак в окислительно-восстановительных реакциях?
Только окислитель.
Только восстановитель.
И окислитель, и восстановитель.

Не участвует в реакциях с изменением степеней окисления.
Выберите формулу веселящего газа:
NO,
N2O3,
N2O,
N2
Ответы
c
a
c
b
c
Ксения Боброва
К предыдущей статье
Теория электролитической диссоциации
К следующей статье
Электролиз расплавов и растворов
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
Гидролиз NA3PO4
Mg h3SO4 ->MgSO4 S h3O
электронный баланс Nh4+O2=NO+h3O
идет ли гидролиз у Bi(NO3)3. ..
..
Пользуйтесь нашим приложением
Закись азота — структура, свойства, применение и эффекты
•
Просмотров сегодня: 2.34k
Закись азота — это неорганическая молекула, состоящая из двух элементов азота и одного элемента кислорода. Закись азота является одним из переменных оксидов, связанных с азотом. Однако он не относится к газам NOₓ, ответственным за загрязнение воздуха. Этот газ был первоначально обнаружен химиком по имени Джозеф Пристли.
Химическое название и формула закиси азота
Химическое название закиси азота называется оксидом азота (I) или монооксидом азота. Химическая формула закиси азота: N 2 O, и эта формула представляет собой один атом кислорода и два атома азота. Это нереакционноспособный газ, а степень окисления азота в закиси азота равна +1.
Структура закиси азота
Закись азота представляет собой линейную неорганическую молекулу. Пи-связь, присутствующая внутри молекулы, проявляет резонанс. Комплексная структура закиси азота имеет длину связи 119пикометров связей N-O и 113 пикометров связей N-N.
Пи-связь, присутствующая внутри молекулы, проявляет резонанс. Комплексная структура закиси азота имеет длину связи 119пикометров связей N-O и 113 пикометров связей N-N.
Свойства закиси азота
Физические свойства закиси азота следующие.
Закись азота существует в газообразном состоянии.
По своей природе бесцветен.
Имеет нейтральную молекулу.
Имеет сладкий вкус и приятный запах.
Молекулярная масса закиси азота составляет 44 г/моль.
Хорошо растворим в воде.
Закись азота негорючая по своей природе, и ее пары значительно плотнее воздуха.

Химические свойства закиси азота следующие.
Закись азота является одним из газов, вызывающих глобальное потепление.
Закись азота бурно разлагается при воздействии высоких температур.
Закись азота в небольших количествах действует как анестетик, используемый при небольших хирургических вмешательствах.
Разлагается на кислород и азот при 873 К. Поэтому поддерживает реакцию горения в присутствии источника кислорода.
Степень окисления азота +1 в закиси азота.
Использование закиси азота
Закись азота используется в качестве ветеринарного и человеческого анестезирующего вещества.

Закись азота используется для производства химикатов, используемых в ракетном топливе.
Также используется в качестве пенообразователя.
Используется как окислитель, а также в стоматологии.
Закись азота используется в хирургии в качестве анестезирующего средства, а также в качестве средства от аэрозолей.
Воздействие закиси азота
Закись азота вызывает психические расстройства и мутации, повреждая ДНК.
Он также вызывает кислородное голодание, а хроническое воздействие закиси азота приводит к дефициту витамина B₁₂.
Закись азота оказывает анксиолитическое действие.

Также проявляет эйфорический эффект.
Чтобы узнать больше об этом газе и укрепить свои концептуальные основы, войдите в Веданту и найдите лучший учебный материал. Узнайте, что говорят эксперты об этом газе. Найдите более глубокую и концептуальную информацию и соответствующим образом подготовьте свои заметки к экзаменам.
Получение закиси азота
Закись азота получают реакцией нагревания. Нитрат аммония нагревается при высокой температуре, и в качестве продукта образуется закись азота, а в качестве побочного продукта — молекула воды. Нитрат аммония представляет собой термически нестабильную молекулу. Поэтому он разлагается при высоких температурах.
\[NH_{4}NO_{3} \rightarrow N_{2}O + 2H_{2}O\]
Азот соединяется с кислородом при различных условиях с образованием ряда бинарных оксидов, различающихся по степени окисления атома азота. Они варьируются от закиси азота (степень окисления азота +1) до оксида азота (степень окисления азота +2), триоксида азота (степень окисления азота +3), тетраоксида азота (степень окисления азота +4). до пентаоксида азота (степень окисления азота +5). Формула оксида азота представляет собой количество атомов азота и атомов кислорода в молекуле.
Они варьируются от закиси азота (степень окисления азота +1) до оксида азота (степень окисления азота +2), триоксида азота (степень окисления азота +3), тетраоксида азота (степень окисления азота +4). до пентаоксида азота (степень окисления азота +5). Формула оксида азота представляет собой количество атомов азота и атомов кислорода в молекуле.
Формула оксида азота
Формула оксида азота | 901 | Внешний вид, Кислотный или нейтральный характер | Свойства |
Монооксид азота (N 2 O) | +1 | Бесцветный газ и нейтральный | Инертный газ |
Оксид азота (NO) | +2 | Бесцветный и нейтральный газ 16 9001 16 9001 Парамагнитные, реактивные и термодинамически неустойчивые | |
Триоксид азота ( N 2 O 3 ) | +3 | Бледно-голубое твердое и кислое | Неустойчиво в газовой фазе |
Тетраоксид диазота (N 2 O 4 ) | +4 | 9001ic Бесцветная жидкость | Находится в равновесии с NO 2 как в газовой фазе и жидкая фаза |
Двуокись азота (NO 2 ) | +4 | Коричневая кислота 1Реактивные и парамагнитные | |
Пятиокись азота | +5 | Бесцветное твердое или газообразное и кислотное 2 ) + (№ 3 ) — |
Недавно обновленные страницы
Использование вискозы — значение, свойства, источники и часто задаваемые вопросы
Разница между атомом и молекулой
Реверберационная печь — история, конструкция, работа, преимущества и недостатки
Химические реакции — описание, понятия, типы, примеры и часто задаваемые вопросы
Отжиг — объяснение, типы, моделирование и часто задаваемые вопросы
Классификация лекарств на основе фармакологического эффекта, действие препарата
Использование искусственного шелка — значение, свойства, источники и часто задаваемые вопросы
Разница между атомом и молекулой
Отражательная печь — история, конструкция, эксплуатация, преимущества и недостатки
Актуальные темы
неорганическая химия — степень окисления азота в N2010 90 90 Задавать вопрос
спросил
Изменено 2 года, 2 месяца назад
Просмотрено 3к раз
$\begingroup$
Если мы попытаемся рассчитать степень окисления азота в $\ce{N2O}$, используя знакомый алгебраический метод, мы получим степень окисления $+1$ для обоих атомов азота, и это то, что я нашел, когда искал его на Интернет.
Я пытался сделать это со структурой и тут запутался:
$$\ce{\overset{-}{N}=\overset{+}{N}=O}$$
Связь $\ce{N=N}$ является координационной связью, поэтому она должна давать степень окисления $-1$ для левой $\ce{N}$ и $+1$ для средней. Поскольку средний имеет двойную связь с кислородом, он получает дополнительные $+2$, что в сумме составляет $+3.$
Но если учесть эту резонансную структуру:
$$\ce{N#\overset{+ }{N}-\overset{-}{O}}$$
Левый $\ce{N}$ получает степень окисления $0$, а средний получает $+2.$ Так что я запутался, поскольку к тому, что на самом деле правильно.
Могут ли атомы существовать в суперпозициях степеней окисления? Или, может быть, я упускаю из виду какую-то основную концепцию?
- неорганическая химия
- резонанс
- степень окисления
- структура Льюиса
- пниктоген
$\endgroup$
3
$\begingroup$
Если мы попытаемся рассчитать степень окисления азота в $\ce{N2O}$, используя знакомый алгебраический метод, мы получим степень окисления $+1$ для обоих атомов азота, что я и нашел, когда искал в Интернете.
.
Ну… вы получаете среднюю степень окисления . Этот расчет, возможно, неявно предполагает, что все атомы азота эквивалентны. В некоторых случаях (например, гидразин) это так, и результат, который вы получаете алгебраически, такой, как вы ожидаете от изображения Льюиса. В других случаях (например, здесь) это не так, поскольку азоты не эквивалентны (только один из них связан с кислородом). Таким образом, очевидно, что простой алгебраический подход не работает.
А как же «настоящий» результат? А как насчет резонансных структур? Ну, тут все становится действительно сложно. По сути, у вас есть две π-системы, ортогональные друг другу, каждая из которых занята четырьмя электронами, которые могут проявляться как неподеленная пара на любом конце и множественная связь с другим атомом. Если вы действительно хотите поиграть в эту игру, вы можете включить другую резонансную структуру, как показано ниже, где все π неподеленные пары сосредоточены на концевом атоме азота:0011
$$\ce{N#\overset{+}{N}-\overset{-}{O} <-> \overset{-}{N}=\overset{+}{N}=O <- > \overset{2-}{N}-\overset{+}{N}#\overset{+}{O}}$$
(Ясно, что эта третья резонансная структура дает наименьший вклад в общую картину, поскольку она имеет большее разделение зарядов, и заряды разделены противоположно тому, что предсказывает электроотрицательность. )
)
Экспериментальная структура показывает, что расстояние $\ce{N-N}$ немного короче, чем расстояние $\ce{N-O}$, которое можно было бы использовать предположить, что связь $\ce{N-N}$ имеет несколько больший порядок связи, чем связь $\ce{N-O}$. Но в конечном счете, они по-прежнему очень похожи (разница всего лишь в $\pu{4pm}$), так что одинаковые порядки облигаций также могут быть вариантом. Короче говоря: если не считать электронного распределения (то есть решения уравнения Шредингера), вы не сможете прийти к однозначному ответу для «настоящих» степеней окисления.
Так что можно сделать на бумаге? Сравнивая резонансные структуры, самая левая, как я их упорядочил, немного лучше, чем центральная, поскольку формальные заряды распределены в соответствии с различной электроотрицательностью. Таким образом, я был бы склонен придать ему немного больший вес и — в условиях классной комнаты — использовать его для определения степеней окисления. Тем не менее, это слишком двусмысленный пример, чтобы его можно было серьезно использовать в каком-либо экзамене, если только его цель не состоит в том, чтобы разработать цепочку аргументов, которые сформировали этот ответ.



 12.14
12.14

 .
.