Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
youtube.com/embed/4sKc0lcxi7g» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/g4ioDc7sLwU» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/zW5JhiZ4140″ frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
Na2HPO4+KCl= как будет реакция… -reshimne.ru
Новые вопросы
Ответы
=Na2K+H+ClPO4
Это то что после равно!
Na2HPO4+HCI=NaCI+Kh3PO4
Похожие вопросы
Напишите реакцию присоединения пропана и Br2 (Бром 2). ..
..
Определите степень окисления атомов галогенов и фосфора в соединениях : P2O3. ; KBr; HF; Ca2(PO4)2…
Что выпадает при сливании растворов хлорида бария и соды? Напишите уравнения реакций в молекулярном и ионных видах.
Заранее спасибо!…
Какие частицы называются катионами ?Почему?Приведите примеры…
Число протонов и нейтронов в ядрах атомов химических элементов с номерами 13 и 53…
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Химия
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мир
ГеографияУкраїнська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
Право
Французский язык
Немецкий язык
МХК
ОБЖ
Психология
4.
 2. Фосфор
2. ФосфорФосфор представлен в природе одним изотопом — 31Р, кларк фосфора равен 0,05 мол.%. Встречается в виде фосфатных минералов: Ca3(PO4)2 — фосфорит, Ca5(PO4)3X (X = F,Cl,OH) — апатиты. Входит в состав костей и зубов животных и человека, а также в состав нуклеиновых кислот (ДНК и РНК) и аденозинфосфорных кислот (АТФ, АДФ и АМФ).
Получают фосфор восстановлением фосфорита коксом в присутствии диоксида кремния.
t
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO
Простое
вещество — фосфор — образует несколько
аллотропных модификаций, из которых
основными являются белый, красный и
черный фосфор. Белый фосфор образуется
при конденсации паров фосфора и
представляет собой белое воскоподобное
вещество (т.пл.
Напряженность связей (валентный угол P-P-P составляет всего 60 ) обусловливает высокую реакционную способность и токсичность белого фосфора (смертельная доза около 0,1 г). Поскольку белый фосфор хорошо растворим в жирах, в качестве антидота при отравлении нельзя применять молоко. На воздухе белый фосфор самопроизвольно воспламеняется, поэтому хранят его в герметически упакованной химической посуде под слоем воды.
Красный фосфор имеет полимерное строение. Получается при нагревании белого фосфора или облучении его светом. В отличие от белого фосфора малореакционноспособен и нетоксичен. Однако остаточные количества белого фосфора могут придавать красному фосфору токсичность!
Черный
фосфор получается при нагревании белого
фосфора под давлением 120 тыс. атм. Имеет
полимерное строение, обладает
полупроводниковыми свойствами, химически
устойчив и нетоксичен.
атм. Имеет
полимерное строение, обладает
полупроводниковыми свойствами, химически
устойчив и нетоксичен.
Химические свойства. Белый фосфор самопроизвольно окисляется кислородом воздуха при комнатной температуре (окисление красного и черного фосфора идет при нагревании). Реакция протекает в два этапа и сопровождается свечением (хемилюминесценция).
t t
2P + 3O2 = 2P2O3; P2O3 + O2 = P2O5
Ступенчато происходит также взаимодействие фосфора с серой и галогенами.
t t
2P + 3Cl2 = 2PCl3; PCl3 + Cl2 = PCl5
При
взаимодействии с активными металлами
фосфор выступает в роли окислителя,
образуя фосфиды — соединения фосфора в
степени окисления -3.
t
3Ca + 2P = Ca3P2
Кислотами-окислителями (азотная и концентрированная серная кислоты) фосфор окисляется до фосфорной кислоты.
P + 5HNO3(конц) = H3PO4 + 5NO2 + H2O
При кипячении с растворами щелочей белый фосфор диспропорционирует:
4P0 + 3KOH + 3H2O = P-3H3 + 3KH2P+1O2
фосфин гипофосфит калия
Соединения со степенью окисления –3. Фосфиды s-элементов представляют соединения с ионно-ковалентным типом связи, они солеподобны, легко разлагаются водой:
Mg3P2 + 6H2O = 3Mg(OH)2 + 2PH3
Фосфиды
d-металлов являются соединениями
переменного состава (бертолидами),
обычно тугоплавки, имеют металлический
блеск, электропроводны и химически
малоактивны.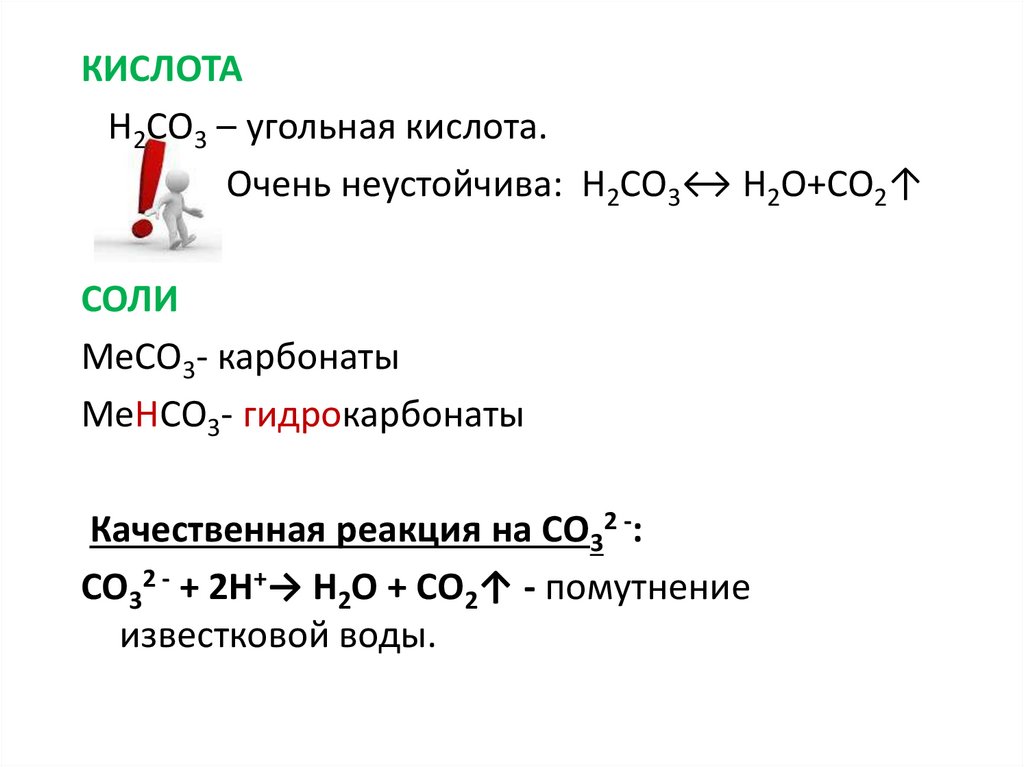
Ковалентным фосфином является PH3 — фосфин — бесцветный газ, с характерным неприятным запахом чеснока, очень токсичен. На воздухе самопроизвольно воспламеняется, в воде малорастворим. В отличие от аммиака образует соли только с очень сильными кислотами.
PH3 + О2 = Р2O5 + H2O; PH3 + HI = РH4I
иодид фосфония
Образуется фосфин при диспропорционировании белого фосфора в щелочных растворах. Лабораторным методом получения является гидролиз фосфидов:
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3
Соединения
со степенью окисления +1. Наиболее важными соединениями фосфора
в степени окисления +1 являются
фосфорноватистая кислота и ее соли —
гипофосфиты. Фосфорноватистая кислота
— H[H2PO2]
— бесцветное кристаллическое вещество,
хорошо растворимое в воде, сильная
одноосновная кислота (Ka = 810-2).
Фосфорноватистая кислота
— H[H2PO2]
— бесцветное кристаллическое вещество,
хорошо растворимое в воде, сильная
одноосновная кислота (Ka = 810-2).
Фосфорноватистая кислота и гипофосфиты — сильные восстановители. При нагревании фосфорноватистая кислота диспропорционирует:
3H[H2P+1O2] = P-3H3 + 2H2[HP+3O2]
фосфористая кислота
Соединения со степенью окисления +3. Степень окисления +3 фосфор имеет в галогенидах, оксиде, фосфористой кислоте — H[H2PO3] — и ее солях — фосфитах. PF3 — газ, PCl3 и PBr3 – жидкости, дымящиеся на воздухе вследствие гидролиза.
PCl3 + 3H2O = H[H2PO3] + 3HCl
Молекула
тригалогенида фосфора имеет геометрию
тригональной пирамиды с атомом фосфора
в вершине.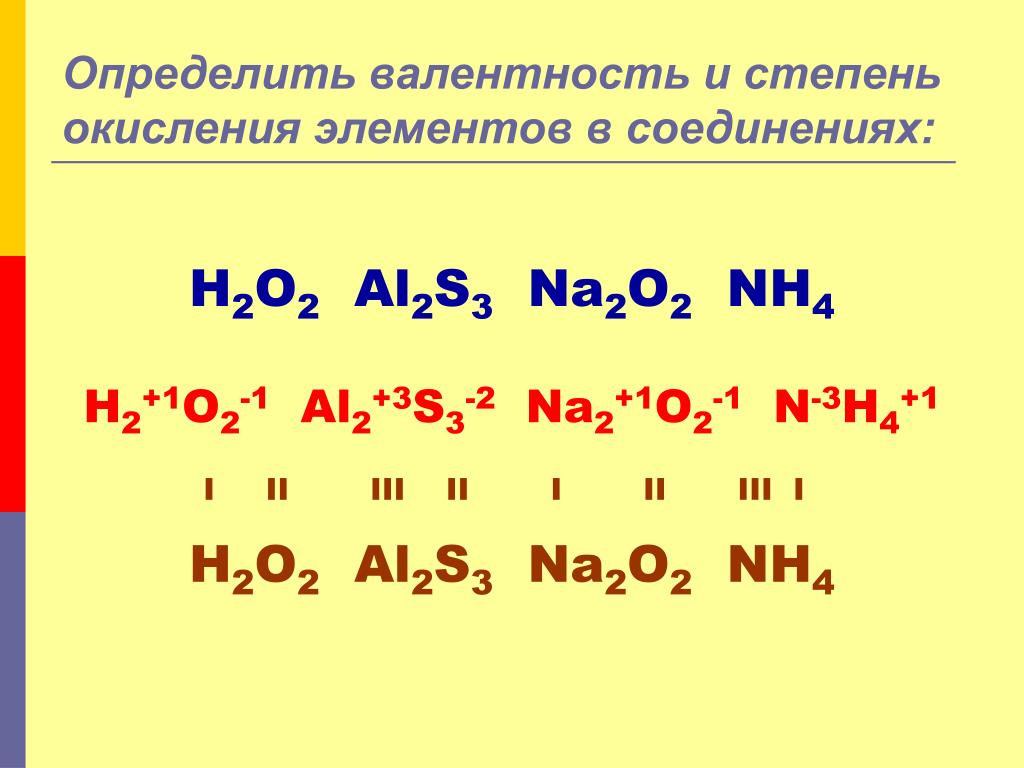 В образовании связей принимают
участие sp3-гибридные
орбитали, валентный угол составляет
приблизительно 100.
В образовании связей принимают
участие sp3-гибридные
орбитали, валентный угол составляет
приблизительно 100.
Оксид фосфора(III) — P2O3 – существует в нескольких модификациях, построенных из пирамидальных структурных единиц — PO3. Обычная форма имеет молекулярную решетку, образованную молекулами – P4O6 – бесцветное кристаллическое вещество следующего строения:
По химическим свойствам типичный кислотный оксид — ангидрид фосфористой кислоты.
P2O3 + 3H2O = 2H2[HPO3]; P2O3 + 4NaOH = 2Na2[HPO3] + H2O
Фосфористая
кислота — H2[HPO3]
— бесцветные гигроскопичные кристаллы,
хорошо растворимые в воде. H2[HPO3]
является сильной двухосновной кислотой
(K1 = 210-2,
K2 = 610-7).
Соли фосфористой кислоты — фосфиты — сильные восстановители.
Hg+2Cl2 + H2[HP+3O3] + H2O = H3P+5O4 + Hg0 + 2HCl
Соединения со степенью окисления +5. Основные соединения фосфора в степени окисления +5: PHal5, POHal3 (Hal = F, Cl, Br), P2O5, H3PO4 и ее соли.
Фторид фосфора(V) — газообразное вещество, молекула которого имеет геометрию тригональной бипирамиды:
Аналогичное
строение имеют другие галогениды
фосфора(V) в газообразном состоянии. В
кристаллах их строение соответствует
следующим формулам: [PCl4]+[PCl6]—,
[PBr4]+Br—.
Галогениды фосфора — реакционноспособные
и гидролитически неустойчивые соединения.
PF5 + HF = H[PF6]; PCl5 + 4H2O = H3PO4 + 5HCl
Оксогалогениды фосфора(V) также гидролитически неустойчивы, например:
POCl3 + 3H2O = H3PO4 + HCl
Широко применяются в органической химии для получения хлорсодержащих и фосфорорганических соединений.
Оксид фосфора(V) — P2O5, точнее P4O10 — бесцветное снегоподобное вещество.
Типичный кислотный оксид, реакция с водой идет ступенчато и приводит в конечном итоге к образованию ортофосфорной кислоты:
t
P2O5 + H2O = 2HPO3; HPO3 + H2O = H3PO4
метафосфорная кислота ортофосфорная кислота
Повышенное сродство к воде позволяет использовать оксид фосфора(V) для осушки газов и органических растворителей, а также в качестве водоотнимающего средства, например:
P2O5 + 2HClO4 = 2HPO3 + Cl2O7
Ортофосфорная
кислота — H3PO4 — бесцветные гигроскопичные кристаллы
(т. пл. 42 С)
неограниченно растворимые в воде.
пл. 42 С)
неограниченно растворимые в воде.
Кислота
средней силы при диссоциации по первой
ступени (K1 = 810-3),
слабая — при диссоциации по второй и
третьей ступеням (K2 = 610-8,
K3 = 110-12).
Образует три ряда солей, например,
NaH2PO4 — дигидрофосфат натрия; Na2HPO4 — гидрофосфат натрия; Na3PO4 — фосфат
(ортофосфат) натрия. Фосфаты щелочных
металлов и аммония хорошо растворимы
в воде. Фосфаты остальных металлов
малорастворимы. Переход к кислым солям
сопровождается заметным повышением
растворимости. Фосфаты щелочноземельных
металлов и аммония применяются в качестве
фосфорных удобрений: Ca3(PO4)2 — фосфоритная мука; CaHPO42H2O
— преципитат; Ca(H2PO4)2H2O
— двойной суперфосфат; Ca(H2PO4)2H2O
+ 2CaSO4 — суперфосфат; NH4H2PO4 + (NH4)2HPO4 — аммофос. Широко применяются комбинированные
удобрения, содержащие несколько
питательных элементов: аммофос + KNO3 — азофоска;
(NH4)2HPO4 + NH4NO3 + KCl — нитрофоска.
Широко применяются комбинированные
удобрения, содержащие несколько
питательных элементов: аммофос + KNO3 — азофоска;
(NH4)2HPO4 + NH4NO3 + KCl — нитрофоска.
Присоединение фосфорного ангидрида к фосфорной кислоте приводит к образованию ряда полифосфорных кислот, простейшей из которых является дифосфорная (пирофосфорная) кислота — H4P2O7.
Полифосфорные
кислоты образуют ряд солей с открытой
цепью из 2 – 10 атомов фосфора –полифосфаты
– или циклического строения – метафосфаты.
Полифосфаты представляют собой соли
аниона общей формулы – [PnO3n+1](n+2)-.
Например, Na4P2O7 – диполифосфат (пирофосфат), Na5P3O10 — триполифосфат. К метафосфатам относятся
соли аниона общей формулы – [PnO3n]n-.
Например, Na3P3O9 – триметафосфат, Na4P4O12 — тетраметафосфат. Структура диполифосфат-
и триметафосфат-анионов:
Структура диполифосфат-
и триметафосфат-анионов:
БУФЕРЫ
БУФЕРЫ
Качество фиксации зависит от рН и типа присутствующих ионов.
Выбор буфера на основе:
1. буферная способность в желаемом диапазоне рН с возможностью поддержания постоянный рН во время фиксации.
2. побочные эффекты, зависящие от типа ткани:
а. подходящее осмолярность, чтобы клетки и органеллы не набухали и не сжимались во время фиксация.
б. подходящее ионная концентрация, чтобы материалы не экстрагировались и не осаждались во время фиксации.
в. в токсичность буфера.
Критерии хорошего буфера :
1. pKa: обычно от 6 до 8 для биологических образцов.
2. Максимум растворимость в воде и минимальная растворимость во всех других растворителях.
3. Уменьшенный ионные эффекты.
4. Диссоциация
буфера меньше всего зависит от концентрации буфера, температуры и ионной
сочинение.
5. Сопротивление к окислению (стабильный).
6. Недорого и легко приготовить.
7. Нет реакция с фиксацией.
Общие буферы
I. Фосфат Буфер (буфер Соренсона) pH 5,8-8
Преимущества :
1. Большинство физиологические общие буферы. Имитирует определенные компоненты внеклеточного жидкости.
2. Нетоксичный к клеткам.
3. рН мало меняется с температурой.
4. Стабильный в течение нескольких недель при 4°С. чаще возникает во время фиксации. Склонен к образованию осадка в присутствии ионов кальция. Выпадает в осадок уранилацетат и имеет тенденцию реагировать со свинцом. соли.
2. Становится медленно контаминированные микроорганизмами
Приготовление буфера
Основные растворы :
2
23
3
фосфат 1 литр
Na 2 HPO 4 *2H 2 0 (ММ
= 178,05) 35,61 г
или
Na 2 HPO 4 *7H 2 0 (MW
= 268,07) 53,65 г
или
Na 2 HPO 4 *12H 2 0 (МВт
= 358,14) 71,64 г
+ ddH 2 от 0 до
сделать 1
литр
0,2 М одноосновного натрия
фосфат 1 литр
NaH 2 PO 4 *H 2 0 (ММ
= 138,01) 27,6 г
или
NaH 2 PO 4 *2H 2 0 (MW
= 156,03) 31,21 г
+ ddH 2 0 сделать 1
литр
Рабочий буфер: 0,1 М 100 мл
Смесь X мл
0,2 М двухосновного фосфата натрия с Y мл одноосновного фосфата натрия. Разбавить
до 100 мл с ddH 2 0 или разбавить фиксатором 1:1.
Разбавить
до 100 мл с ddH 2 0 или разбавить фиксатором 1:1.
pH (25°C) X
ML Y ML
5,8 4,0 46,0
6,0 6,15 43,75
6,2 9,25 40,75
6,4 13,25 36,75
6,6 18,75 31,25
6.8 24,5,5,5 9000 26,75 31,25
6.8 24,5,5 9000 9000 2.6 18,75 31,25
9000 26,8 24,5,5 9000 7,0 30,5 19,5
7,2 36,0 14,0
7,4 40,5 9,5
7,6 43,5 6,5
7,8 45,75 4,25
8,0 47,35 2,65
Осмалярный
регулируется изменением молярности фосфатов или добавлением
сахароза, глюкоза или хлорид натрия.
при рН 7,2:
0,10 м = 226 МО (миллиологи)
0,05M = 118 МОС
0,075 = 180 МОС
0,15 м = 350 МОС
975 = 180 МОС 0,15 м = 350 МОС
9.
II. Какодилатный буфер (арсенатный буфер) pH 5-7,4
Преимущества :
1. Простота
подготовить.
2. Стабильный
при длительном хранении.
3. Есть ли
не поддерживают рост микроорганизмов.
4. Осадки
обычно не возникают. Осадки не образуются при низких концентрациях
кальций.
Недостатки :
1. Токсично.
Содержит мышьяк.
2. Неприятный
запах.
Preparation of Buffer :
Stock solutions :
0.2M sodium cacodylate 1 liter
Na(CH 3 ) 2 As0 2 * 3H 2 0 (МВт
= 195,92) 42,8 г
+ ddH 2 от 0 до
сделать 1
литр
0,2 М НС1
Конц. НС1 (36-38%) 10
мл
ddH 2 0 603
мл
Рабочий буфер : 0,1 М 100
мл
Отрегулировать
50 мл 0,2 М какодилата натрия до желаемого pH с 0,2 М HCl. Разбавить до 100 мл
с ddH 2 0 или разбавьте фиксатором 1:1.
рН 0,2 М
НС1 (мл)
6,4 18,3
6,6 13,3
6,8
9.3
7,0
6.3
7.2
4.2
7.4
2.7
Также можно сделать буфер
с какодиловой кислотой.
На складе
растворы :
0,2 м
какодиловая кислота 1
литр
(CH 3 ) 2 AsO 2 H (МВт
= 138,0) 27,6 г
+ ddH 2 от 0 до
сделать 1
литр
0,2 М NaOH 100 мл
NaOH (молекулярная масса
= 40) 0,8 г
+ ddH 2 от 0 до
сделать 100
мл
Рабочий буфер : 0,1 М
Настройка
50 мл 0,2 М какодиловой кислоты до желаемого pH с 0,2 М NaOH. Разбавить до 100 мл
с ddH 2 или разбавьте фиксатором 1:1.
III. Veronal-ацетатный буфер (Michaelis
буфер)
Преимущества :
Полезно
для окрашивания блока уранилацетатом, так как осадки не образуются.
Недостатки :
1. Реагирует
с альдегидами.
2. Плохо
буфер с физиологическим pH.
3. Опоры
рост микроорганизмов.
4. Содержит
барбитураты.
Подготовка
Буфер :
Запас
раствор : 0,28 М 100
мл
Натрий
веронал (барбитон натрия)
C 8 H 11 0 3 N 2 Na (ММ
= 206,18) 2,89 г
Ацетат натрия
(безводный)
CH 3 C00Na (молекулярная масса
= 82,03) 1,15 г
или
Ацетат натрия
(гидратированный)
CH 3 C00Na*3H 2 0 (ММ
= 136,09) 1,90 г
+ ddH 2 H 2 0
сделать 100
мл
Раствор стабилен и
может храниться в течение нескольких месяцев при 4 C.
Рабочий
буфер :
Веронал ацетатный бульон
раствор 5 мл
ddH 2 0 15
мл
Добавляйте 0,1 НС1 постепенно до
желаемый рН.
Решение не может быть
хранится.
Поддерживает рост
бактерии и плесень даже при 4°С.
Кристаллизуется в отсутствие
четырехокиси осмия.
IV. Коллидиновый буфер pH
7,25-7,74
Преимущества :
1. Максимум
буферная емкость около 7,4.
2. Стабильный
неограниченно долго при комнатной температуре.
3. Полезно
для фиксации больших блоков тканей. Способствует проникновению фиксатора за счет
экстрактивные эффекты (см. недостаток 1).
Недостатки :
1. Нет
подходит в качестве буфера при первичной фиксации четырехокисью осмия из-за
значительная экстракция тканевых компонентов.
2. Использование
приводит к лизису цитоплазматического матрикса и обширной деструкции мембран при
используется с параформальдегидными фиксаторами.
3. Использование
дает худшие результаты с глутаровым альдегидом, чем с фосфатом или какодилатом
буфер.
Приготовление буфера :
Исходный раствор : 0,4 М 100
мл
Чистый s-коллидин 5,34
гм
2,4,6(СН 3 ) 3 (C 2 H 5 N) (МВт
= 121,18)
+ ddH 2 от 0 до
сделать 100
мл
Рабочий буфер : 0,2 М 100
мл
Отрегулировать 50 мл s-коллидина
исходный раствор до желаемого pH с помощью 1 н. HCl. Разбавить до 100 мл с помощью ddH 2 0.
pH 1N
НС1, мл0003
7,59 14
7,67 12
7,74 10
В. Трис Буфер
Преимущества :
1. Хороший
буферная способность при более высоком рН, необходимая для некоторых тканей и некоторых цитохимических
процедуры.
2. «Подробнее
или меньше» физиологически инертен.
Недостатки :
1. pH
меняется с температурой. Должен измеряться при желаемой температуре.
Должен измеряться при желаемой температуре.
2. рН
необходимо измерять электродом определенного типа.
Приготовление буфера :
А. Трис
Буфер pH 7,1–8,9
Основной раствор 0,2 М 1
литр
Трис(гидроксиметил)аминометан 24,2
gm
H 2 NC(CH 2 0H) 3 (MW
= 121,13)
+ ddH 2 0 до
сделать 1
литр
Рабочий
буфер : 0.1M 100
мл
Отрегулировать
рН 50 мл исходного раствора с 0,1 М NaOH. Разбавить до 100 мл с помощью ddH 2 0.
B. Трис-малеат
Буфер pH 5,8–8,2
Исходный раствор : 0,2 М л
Трис(гидроксиметил)аминометан 24,2
г
Малеиновая кислота 23,2
gm
HO 2 CCH:CHCO 2 ч (МВт
= 116,07)
+ ddH 2 от 0 до
сделать 1
литр
или
Тризима-малеат (ММ
= 237,2) 47,4 г
+ ddH 2 от 0 до
сделать 1
литр
Рабочий буфер : 0,2 М 100
мл
Отрегулировать
50 мл маточного раствора до желаемого pH с помощью 0,1M NaOH. Разбавить до 100 мл с помощью ddH 2 0.
Разбавить до 100 мл с помощью ddH 2 0.
VI. Специальные буферы, используемые для
Цитохимические реакции .
А. Ацетат
Буфер (буфер ацетат натрия-уксусная кислота) рН 4-5,6
Ацетат натрия 0,2 М
= 27,2 г/л
CH 3 CO 2 Na*3H 2 0 (молекулярная масса
— 136.09)
Уксусная кислота 0,2M
CH 3 COOH (молекулярная масса
= 60)
Добавить ацетат натрия в
уксусной кислоты для получения желаемого pH. Разбавьте ddH 2 0 до желаемой молярности.
Б. Борат
Буфер pH 7,4–9,2
Бура (тетраборат натрия) 0,2 М
= 76,2 г/мл
Na 2 B 4 0 7 *120H 2 0 (ММ
= 381,37)
Борная кислота 0,2М
= 12,37 г/1
H 3 BO 3 (МВт
= 61,83)
Добавить борную кислоту к буре
раствора до тех пор, пока не будет достигнут желаемый рН. Разбавить до нужной молярности с помощью ddH 2 0,
Разбавить до нужной молярности с помощью ddH 2 0,
C. Цитрат
Буфер (буфер цитрат натрия-лимонная кислота) рН 3-6,2
Цитрат натрия 0,2 М
= 58,8 г/1
Na 3 C 6 H 5 0 7 *H 2 0 (MW
= 294,12)
Лимонная кислота 0,2М
= 42,02 г/1
C 6 H 8 0 7 *H 2 0 (молекулярная масса
= 210,14)
Смешать лимонную кислоту и
цитрат натрия для получения желаемого pH. Разбавить ddH 2 0 до желаемой молярности.
D. Диметилглутарат
Буфер рН 3,2-7,6
Диметилглутаровая кислота 0,1М
= 16,02 г/1
C 7 H 12 0 4 (MW = 160,2)
Добавьте 0,2 н. NaOH, чтобы получить
желаемый рН. Разбавьте ddH 2 0 до желаемой молярности.
E. Сукцинат
Буфер рН 3,8-6
Янтарная кислота 0,2 М
= 23/62 г/1
C 4 H 6 0 2 (МВт
= 118,09)
Добавьте 0,2 М NaOH до желаемого
рН. Разбавьте ddH 2 0 до желаемой молярности.
Разбавьте ddH 2 0 до желаемой молярности.
F. Малеат
Буфер (натрий гидромалеатный буфер) pH 5,2-6,8
121.14) 23,2 г
+ ddH 2 от 0 до
сделать 1
литр
Отрегулируйте pH с помощью 0,1M NaOH.
Разбавить ddH 2 0 до желаемой молярности.
G. Имидазол
Буфер рН 6,2-7,8
Имидазол 0,2М
= 13,62/1
C 3 H 4 N 2 (МВт
= 68,08)
Довести 0,2 н. НС1 до имидазола
раствора до тех пор, пока не будет достигнут желаемый рН. Разбавить до желаемой молярности с помощью ddH 2 0,
H. AMPd
Буфер рН 7,8-9,7
2-аминометил-1,3-пропандиол 0,2М
= 21,03 г/1
C 4 H 11 НЕТ 2 (МВт
= 105,14)
Добавьте 0,2 М НС1 до
желаемый рН достигается. Разбавьте ddH 2 0 до желаемой молярности.
Фосфат натрия (тринатрийфосфат (TSP)): молекулярная геометрия — гибридизация — молекулярная масса — молекулярная формула — пары связей — неподеленные пары
Свойства фосфата натрия Название молекулы
Фосфат натрия
Молекулярная геометрия
Тетраэдрический
Гибридизация
сп3
Молекулярная формула
Na3PO4
Молекулярный вес
163,94 г/моль
Пары облигаций
5
Одиночные пары
11
Структура Льюиса
в инфографике
Infographic
Download ↓↓
pdf
файл | 3,4 МБ — высокое разрешение
JPG
файл | Размер: 309 КБ
Фото:
1500×1500 высокое разрешение
Определения Молекулярная геометрия: Молекулы имеют сбалансированную геометрическую форму, связи имеют определенную
длина и угол, а это определяют законы квантовой механики. химическое уравнение и структурное уравнение молекулы являются двумя наиболее
важные факторы, определяющие его свойства, особенно его активность.
структура молекулы также играет важную роль в определении полярности,
состояние вещества, цвет, магнетизм, вкус и многие другие свойства.
химическое уравнение и структурное уравнение молекулы являются двумя наиболее
важные факторы, определяющие его свойства, особенно его активность.
структура молекулы также играет важную роль в определении полярности,
состояние вещества, цвет, магнетизм, вкус и многие другие свойства.
Гибридизация : Гибридизация в химии
процесс смешивания, слияния или объединения двух или более различных орбиталей
электронов в одном и том же атоме. И они близки по энергии для получения нового гибрида
орбитали одинаковой длины и энергии. Гибридизация происходит в одном и том же
атома и образует орбитали, эквивалентные по форме, длине и энергии.
атом должен быть возбужден. Орбитали должны быть близки по энергии, например 2s с 2p
или 4s с 3d. Число гибридных орбиталей равно числу чистых
орбиталей, участвующих в гибридизации. Гибридные орбитали более заметны.
наружу, чтобы их способность перекрываться была сильнее, чем у обычных
орбитали.
Молекулярная формула: Химическая формула — это краткий путь
выражения числа и типа атомов, из которых состоит конкретный химический
сложный. Он выражает каждый элемент его химическим символом и пишет
непосредственно рядом с ним число атомов в молекуле этого соединения. Если
в молекуле более одного атома одного и того же элемента, количество
атомов записывается в правом нижнем углу элемента. Для немолекулярного
веществ, нижняя цифра представляет собой описательную формулу. Химическое
формула, которая используется для ряда соединений, которые отличаются друг от друга
фиксированных единиц называется «общей формулой». Эта серия называется
однородный ряд, а его номер называется символом однородности.
Он выражает каждый элемент его химическим символом и пишет
непосредственно рядом с ним число атомов в молекуле этого соединения. Если
в молекуле более одного атома одного и того же элемента, количество
атомов записывается в правом нижнем углу элемента. Для немолекулярного
веществ, нижняя цифра представляет собой описательную формулу. Химическое
формула, которая используется для ряда соединений, которые отличаются друг от друга
фиксированных единиц называется «общей формулой». Эта серия называется
однородный ряд, а его номер называется символом однородности.
Молекулярный вес : в химии вещества
(иногда ее называют молекулярной массой вещества) – это масса
молекулы этого вещества относительно единицы атомной массы (u, равной
1/12 массы атома n-углерода-12) (просто: молекулярная масса есть сумма
массы атомов в молекуле). Молекулярную массу можно рассчитать как сумму
атомных весов атомов в любой молекуле. Молекулярная масса также может быть
измеряют непосредственно масс-спектрометром. В масс-спектрометрии молекулярный
масса малых молекул (менее примерно 200 атомов данного элемента) равна
минута, то есть сумма наиболее распространенных изотопов этого элемента. Для большего
молекул, она является средней или рассчитывается с использованием молекулярной массы
элемент или с помощью таблицы Менделеева, где есть статистика для
распределение атомов представлено изотопами молекулы.
В масс-спектрометрии молекулярный
масса малых молекул (менее примерно 200 атомов данного элемента) равна
минута, то есть сумма наиболее распространенных изотопов этого элемента. Для большего
молекул, она является средней или рассчитывается с использованием молекулярной массы
элемент или с помощью таблицы Менделеева, где есть статистика для
распределение атомов представлено изотопами молекулы.
Пары связей : Пара связей — это пара электронов, присутствующих в химической связи. Как мы
знаете, одна связь всегда состоит из двух электронов, спаренных вместе. Вместе эти
два электрона называются парой связи. Пары связей можно увидеть в ковалентных
соединения и координационные соединения.
Одиночные пары : Несвязывающая или одиночная пара — это пара электронов в атоме без
связывание или совместное использование с другим атомом. Он часто имеет отрицательную полярность из-за
его высокая плотность заряда. Эта пара используется для образования координационных связей. За
например, при производстве гидроксония ионы h4O+ присутствуют, когда кислоты
растворяются в воде, а атом кислорода дает неподеленную пару атому водорода
ион.
Эта пара используется для образования координационных связей. За
например, при производстве гидроксония ионы h4O+ присутствуют, когда кислоты
растворяются в воде, а атом кислорода дает неподеленную пару атому водорода
ион.
Структура Льюиса : Структура Льюиса или представление Льюиса (также известная как электронная
растровая диаграмма, растровая формула Льюиса, точечная структура Льюиса или точечный электрон
структура) представляет собой двухмерную диаграмму, используемую в химии, чтобы показать связь
между атомами молекулы и неподеленными электронными парами, которые могут присутствовать в
эта молекула. Он в основном используется для отображения относительного положения
различные атомы по отношению друг к другу и образования валентности
связи, которые соединяют различные атомы соединения, а также
положение электронов относительно атомов молекулы. Льюис
Структуру можно построить для любой молекулы, которая содержит ковалентную связь в
дополнение к комплексам.
НАТРИЯ ФОСФАТ ДВУХОСНОВНЫЙ, ГЕПТАГИДРАТ | 7782-85-6
ФОСФАТ НАТРИЯ, ДВУХОСНОВНЫЙ, ГЕПТАГИДРАТ Свойства
Температура плавления 48°С Плотность 1,68 г/мл при 25 °C (лит.) плотность пара 4,9 (против воздуха) температура хранения Хранить при температуре от +5°С до +30°С.
растворимость 154 г/л форма Твердый цвет Белый Удельный вес 1,7 Диапазон рН 8,7 — 9,3 РН 8,7-9,3 (25 ℃, 5% в растворе) Растворимость воды Растворим в воде и нерастворим в этаноле.
Мерк 14 8659 Справочник по базе данных CAS 7782-85-6 (Ссылка на базу данных CAS) Непрямые добавки, используемые в веществах, контактирующих с пищевыми продуктами НАТРИЯ ФОСФАТ, ДВУХОСНОВЫЙ, ГЕПТАГИДРАТ FDA UNII 70WT22SF4B Система регистрации веществ EPA Гептагидрат фосфата натрия (7782-85-6)
НАТРИЯ ФОСФАТ ДВУХОСНОВЫЙ, ГЕПТАГИДРАТ цена
Больше Цена(42)
Производитель Номер продукта Описание продукта Номер CAS Упаковка Цена Обновлено Купить Сигма-Олдрич 8210-ОП OmniPur Фосфат натрия, двухосновный, гептагидрат — CAS 7782-85-6 — Calbiochem 7782-85-6 500 г 65,2 $ 15. 05.2022
05.2022 Купить Сигма-Олдрич 431478 Натрий фосфат двухосновный гептагидрат ≥99,99% микроэлементов на основе 7782-85-6 50 г 75,4 $ 15.05.2022 Купить Сигма-Олдрич 431478 Натрий фосфат двухосновный гептагидрат ≥99,99% микроэлементов на основе 7782-85-6 250 г 202 долл. США
США 15.05.2022 Купить Сигма-Олдрич 1.06574 Гептагидрат гидрофосфата натрия EMPROVE? ESSENTIAL, DAC, USP 7782-85-6 1 кг 118 долларов 15.05.2022 Купить Сигма-Олдрич 1. 06575
06575 Гептагидрат гидрофосфата натрия для анализа EMSURE? АКС 7782-85-6 1 кг 139 долларов 15.05.2022 Купить
Номер продукта Упаковка Цена Купить 8210-ОП 500 г 65,2 $ Купить 431478 50 г 75,4 $ Купить 431478 250 г 202 долл. США
США Купить 1.06574 1 кг 118 долларов Купить 1.06575 1 кг 139 долларов Купить
ФОСФАТ НАТРИЯ, ДВУХОСНОВЫЙ, ГЕПТАГИДРАТ Химические свойства, использование, производство
Химические свойства
В USP 32 указано, что двухосновный фосфат натрия высушивают или
содержит 1, 2, 7 или 12 молекул гидратной воды. Безводный двухосновный фосфат натрия представляет собой белый порошок.
Дигидрат представляет собой белые или почти белые кристаллы без запаха.
Безводный двухосновный фосфат натрия представляет собой белый порошок.
Дигидрат представляет собой белые или почти белые кристаллы без запаха.
Гептагидрат представляет собой бесцветные кристаллы или белые гранулы.
или затвердевшая соль, которая выцветает на теплом сухом воздухе. додекагидрат
встречается в виде сильно выцветших, бесцветных или прозрачных кристаллов.
Химические свойства
Белый порошок
Использование
Двухосновный гептагидрат фосфата натрия использовался для приготовления натрий-фосфатного буфера и фосфатно-солевого буфера (PBS).[44}
Использование
Двухосновный гептагидрат фосфата натрия используется в качестве прекурсора при приготовлении молекулярного катализатора на основе кобальта для окисления воды.
Использование
Буферный агент.
Методы производства
Либо костный фосфат (костная зола), полученный нагреванием костей до
белизны, или минерал фосфорит используется как источник трехосновного
фосфат кальция, который является исходным сырьем в промышленности
Производство двухосновного фосфата натрия.
Трехосновный фосфат кальция тонко измельчают и вываривают с
серная кислота. Затем эту смесь выщелачивают горячей водой и
нейтрализуют карбонатом натрия и двухосновным фосфатом натрия
кристаллизуют из фильтрата.
Фармацевтические приложения
Двухосновный фосфат натрия используется в самых разных фармацевтических
составы в качестве буферного агента и в качестве секвестрирующего агента.
В терапевтических целях двухосновный фосфат натрия используется как мягкое слабительное.
и при лечении гипофосфатемии.
Двухосновный фосфат натрия также используется в пищевых продуктах; за
Например, в качестве эмульгатора в плавленых сырах.
Безопасность
Двухосновный фосфат натрия широко используется в качестве наполнителя в
парентеральные, пероральные и местные фармацевтические препараты.
Фосфаты широко распространены в организме и участвуют в
многие физиологические процессы, поскольку он является основным анионом
внутриклеточная жидкость. Большинство пищевых продуктов содержат достаточное количество
фосфатов, вызывая гипофосфатемию (дефицит фосфатов)
практически неизвестен, за исключением некоторых болезненных состояний или у пациентов
получают полное парентеральное питание. Лечение обычно пероральное
введение до 100 ммоль фосфата в сутки.
Приблизительно две трети проглоченного фосфата всасывается.
из желудочно-кишечного тракта, практически весь выводится с мочой.
с мочой, а остальное выводится с калом.
Чрезмерное введение фосфатов, особенно внутривенно,
ректально или у пациентов с почечной недостаточностью может вызвать
гиперфосфатемия, которая может привести к гипокальциемии или другим тяжелым
электролитный дисбаланс. Побочные эффекты возникают реже
после перорального приема, хотя фосфаты действуют как мягкий солевой раствор
слабительные при приеме внутрь или ректально. Следовательно,
желудочно-кишечные расстройства, включая диарею, тошноту и
рвота может возникнуть после использования двухосновного фосфата натрия
в качестве вспомогательного вещества в пероральных препаратах. Однако уровень двухосновных
фосфат натрия, используемый в качестве вспомогательного вещества в фармацевтических
формулировка обычно не связана с побочными эффектами.
Побочные эффекты возникают реже
после перорального приема, хотя фосфаты действуют как мягкий солевой раствор
слабительные при приеме внутрь или ректально. Следовательно,
желудочно-кишечные расстройства, включая диарею, тошноту и
рвота может возникнуть после использования двухосновного фосфата натрия
в качестве вспомогательного вещества в пероральных препаратах. Однако уровень двухосновных
фосфат натрия, используемый в качестве вспомогательного вещества в фармацевтических
формулировка обычно не связана с побочными эффектами.
LD50 (крыса, перорально): 17 г/кг
хранение
Безводная форма двухосновного фосфата натрия гигроскопична.
При нагревании до 40 ℃ додекагидрат плавится; при 100℃ теряет свой
кристаллизационная вода; а при тускло-красном кале (около 240℃) это
превращается в пирофосфат Na4P2O7. Водные растворы
двухосновный фосфат натрия стабилен и может быть стерилизован
автоклавирование.
Сыпучий материал следует хранить в герметичном контейнере, в
прохладное, сухое место.
Несовместимости
Двухосновный фосфат натрия несовместим с алкалоидами, антипирином,
хлоралгидрат, ацетат свинца, пирогаллол, резорцин и
глюконат кальция и ципрофлоксацин. Взаимодействие между кальцием и фосфатом, приводящее к образованию нерастворимых
выпадает кальций-фосфатный осадок, возможен в парентеральных смесях.
Регуляторный статус
внесен в список GRAS. Разрешен в Европе для использования в качестве пищевой добавки.
Включен в базу данных неактивных ингредиентов FDA (инъекции;
настои; назальные, офтальмологические, оральные, ушные, местные и вагинальные
препараты). Входит в состав непарентеральных и парентеральных лекарственных средств.
лицензирован в Великобритании. Включен в Канадский список допустимых
Нелекарственные ингредиенты.
НАТРИЯ ФОСФАТ ДВУХОСНОВЫЙ, ГЕПТАГИДРАТ Продукты приготовления и сырье
Сырье
Продукты подготовки
Фосфорная кислота, динатриевая соль, гептагидрат
Гептагидрат моногидрофосфата натрия (2:1:1:7)
ФОСФАТ НАТРИЯ МОНОВОДОРОДНЫЙ
SEC-НАТРИЯ ФОСФАТ ГЕПТАГИДРАТ
ВТОРИЧНЫЙ ФОСФАТ НАТРИЯ
ВТОРИЧНЫЙ ФОСФАТ НАТРИЯ ГЕПТАГИДРАТ
НАТРИЯ ОДНОВОДОРОДНЫЙ ФОСФАТ ГЕПТАГИДРАТ
НАТРИЯ ФОСФАТ, ДВУХОСНОВЫЙ, ГЕПТАГИДРАТ
НАТРИЯ ФОСФАТ ГЕПТАГИДРАТ
НАТРИЯ ФОСФАТ ГЕПТАГИДРАТ, ДВУХОСНОВНОЙ
НАТРИЯ ФОСФАТ ДВУХОСНОВНЫЙ
НАТРИЯ ФОСФАТ, ДВУХОСНОВНОЙ, 7-ГИДРАТ
НАТРИЯ ФОСФАТ 7х3О, ДВУХОСНОВНОЙ
НАТРИЙ ВОДОРОД ФОСФАТ ГЕПТАГИДРАТ
НАТРИЯ ДВУХОСНОВНЫЙ ФОСФАТ ГЕПТАГИДРАТ
ДИ-НАТРИЙ ВОДОРОД ФОСФАТ-7-ГИДРАТ
ДИНАТРИЙ ВОДОРОД ФОСФАТ ГЕПТАГИДРАТ
ФОСФАТ ДИНАТРИЯ ВОДОРОДА
ДИНАТРИЙ ФОСФАТ
ДИНАТРИЯ ФОСФАТ ГЕПТАГИДРАТ
DSP
ДСП ГЕПТАГИДРАТ
Фосфат натрия, двухосновный, гептагидрат
ГЕПТАГИДРАТ НАТРИЯ ВОДОРОДНОФОСФАТНЫЙ, РЕАГЕНТ ПЛЮС, 99,99+%
ДИ-НАТРИЙ ВОДОРОД ФОСФОРНЫЙ ГЕПТАГИДРАТ E, ACS
НАТРИЯ ФОСФАТ, ДВУХОСНОВНОЙ ГЕПТАГИДРАТ, 98+%, A. C.S. РЕАГЕНТ
ДИ-НАТРИЯ ВОДОРОД ФОСФАТ-7-ГИДРАТ R . Г., РАГ. СКУД
Гептагидрат гидрогенфосфата натрия, ACS, 98,0-102,0%
НАТРИЯ ФОСФАТ ДВУХОСНОВНОЙ 7 ч3O
Фосфат натрия, двухосновный гептагидрат, для анализа ACS, 98+%
гептагидрат гидрофосфата натрия, ас
Двуосновный натрийфосфат, гептагидрат, кристалл, USP
НАТРИЙФОСФАТ, ДВУХОСНОВЫЙ, ГЕПТАГИДРАТ, КРИСТАЛЛ, РЕАГЕНТ, ACS
НАТРИЙФОСФАТ, ДВУХОСНОВЫЙ, ГЕПТАГИДРАТ, ГРАНУЛИРОВАННЫЙ, РЕАГЕНТ, ACS
НАТРИЙФОСФАТОДВОСНОВНЫЙ,ГЕПТАГИДРАТ,ГРАНУЛИРОВАННЫЙ,БИОТЕХНОЛОГИЧЕСКИЙ
НАТРИЙФОСФАТОДВОСНОВНЫЙ,ГЕПТАГИДРАТ,ТЕХНИЧЕСКИЙ
НАТРИЯ ФОСФАТ ДВУХОСНОВНОЙ ГЕПТАГИДРАТ ГРАНУЛИРОВАННЫЙ
Фосфат натрия, двухосновный, сухой порошок
динатрия гидрофосфат гептагидрат, динатрия фосфат
Двухосновный фосфат натрия, гептагидрат, кристалл
Фосфат натрия, двухосновный, гептагидрат, кристалл, реагент
Фосфат натрия, двухосновный, гептагидрат, гранулированный, реагент
Фосфат натрия, двухосновный гептагидрат, для анализа, 99+%
НАТРИЯ ФОСФАТ, ДВУХОСНОВНОЙ ГЕПТАГИДРАТ, РЕАГЕНТ (ACS)
Фосфат натрия, трехосновный, додекагидрат, кристалл, реагент
Фосфат натрия, двухосновный гептагидрат, 99+%, для анализа
Фосфат натрия, двухосновный гептагидрат, для анализа
Фосфат натрия, двухосновный гептагидрат, для анализа ACS
Фосфат натрия, двухосновный гептагидрат,98+%, для анализа ОКС
НАТРИЯ ФОСФАТ, ДИ
SS Натрий фосфат двухосновный гептагидрат
Фосфат натрия, двухосновный гептагидрат, для анализа АЦС, 98+% 500ГР
Фосфат натрия, двухосновный гептагидрат, для анализа, 99+% 500гр
ДИ-НАТРИЙ ВОДОРОД ФОСФ.
C.S. РЕАГЕНТ
ДИ-НАТРИЯ ВОДОРОД ФОСФАТ-7-ГИДРАТ R . Г., РАГ. СКУД
Гептагидрат гидрогенфосфата натрия, ACS, 98,0-102,0%
НАТРИЯ ФОСФАТ ДВУХОСНОВНОЙ 7 ч3O
Фосфат натрия, двухосновный гептагидрат, для анализа ACS, 98+%
гептагидрат гидрофосфата натрия, ас
Двуосновный натрийфосфат, гептагидрат, кристалл, USP
НАТРИЙФОСФАТ, ДВУХОСНОВЫЙ, ГЕПТАГИДРАТ, КРИСТАЛЛ, РЕАГЕНТ, ACS
НАТРИЙФОСФАТ, ДВУХОСНОВЫЙ, ГЕПТАГИДРАТ, ГРАНУЛИРОВАННЫЙ, РЕАГЕНТ, ACS
НАТРИЙФОСФАТОДВОСНОВНЫЙ,ГЕПТАГИДРАТ,ГРАНУЛИРОВАННЫЙ,БИОТЕХНОЛОГИЧЕСКИЙ
НАТРИЙФОСФАТОДВОСНОВНЫЙ,ГЕПТАГИДРАТ,ТЕХНИЧЕСКИЙ
НАТРИЯ ФОСФАТ ДВУХОСНОВНОЙ ГЕПТАГИДРАТ ГРАНУЛИРОВАННЫЙ
Фосфат натрия, двухосновный, сухой порошок
динатрия гидрофосфат гептагидрат, динатрия фосфат
Двухосновный фосфат натрия, гептагидрат, кристалл
Фосфат натрия, двухосновный, гептагидрат, кристалл, реагент
Фосфат натрия, двухосновный, гептагидрат, гранулированный, реагент
Фосфат натрия, двухосновный гептагидрат, для анализа, 99+%
НАТРИЯ ФОСФАТ, ДВУХОСНОВНОЙ ГЕПТАГИДРАТ, РЕАГЕНТ (ACS)
Фосфат натрия, трехосновный, додекагидрат, кристалл, реагент
Фосфат натрия, двухосновный гептагидрат, 99+%, для анализа
Фосфат натрия, двухосновный гептагидрат, для анализа
Фосфат натрия, двухосновный гептагидрат, для анализа ACS
Фосфат натрия, двухосновный гептагидрат,98+%, для анализа ОКС
НАТРИЯ ФОСФАТ, ДИ
SS Натрий фосфат двухосновный гептагидрат
Фосфат натрия, двухосновный гептагидрат, для анализа АЦС, 98+% 500ГР
Фосфат натрия, двухосновный гептагидрат, для анализа, 99+% 500гр
ДИ-НАТРИЙ ВОДОРОД ФОСФ.
Na 2 HPO 4 *2H 2 0 (ММ = 178,05) 35,61 г
или
Na 2 HPO 4 *7H 2 0 (MW = 268,07) 53,65 г
или
Na 2 HPO 4 *12H 2 0 (МВт = 358,14) 71,64 г
+ ddH 2 от 0 до сделать 1 литр
0,2 М одноосновного натрия фосфат 1 литр
NaH 2 PO 4 *H 2 0 (ММ = 138,01) 27,6 г
или
NaH 2 PO 4 *2H 2 0 (MW = 156,03) 31,21 г
+ ddH 2 0 сделать 1 литр
Рабочий буфер: 0,1 М 100 мл
Смесь X мл
0,2 М двухосновного фосфата натрия с Y мл одноосновного фосфата натрия. Разбавить
до 100 мл с ddH 2 0 или разбавить фиксатором 1:1.
Разбавить
до 100 мл с ddH 2 0 или разбавить фиксатором 1:1.
pH (25°C) X ML Y ML
5,8 4,0 46,0
6,0 6,15 43,75
6,2 9,25 40,75
6,4 13,25 36,75
6,6 18,75 31,25
6.8 24,5,5,5 9000 26,75 31,25
6.8 24,5,5 9000 9000 2.6 18,75 31,25
9000 26,8 24,5,5 90007,0 30,5 19,5
7,2 36,0 14,0
7,4 40,5 9,5
7,6 43,5 6,5
7,8 45,75 4,25
8,0 47,35 2,65
Осмалярный регулируется изменением молярности фосфатов или добавлением сахароза, глюкоза или хлорид натрия.
при рН 7,2:
0,10 м = 226 МО (миллиологи)
0,05M = 118 МОС
0,075 = 180 МОС
0,15 м = 350 МОС
975 = 180 МОС0,15 м = 350 МОС
9.II. Какодилатный буфер (арсенатный буфер) pH 5-7,4
Преимущества :
1. Простота
подготовить.
2. Стабильный при длительном хранении.
3. Есть ли не поддерживают рост микроорганизмов.
4. Осадки обычно не возникают. Осадки не образуются при низких концентрациях кальций.
Недостатки :
1. Токсично. Содержит мышьяк.
2. Неприятный запах.
Preparation of Buffer :
Stock solutions :
0.2M sodium cacodylate 1 liter
Na(CH 3 ) 2 As0 2 * 3H 2 0 (МВт = 195,92) 42,8 г
+ ddH 2 от 0 до сделать 1 литр
0,2 М НС1
Конц. НС1 (36-38%) 10 мл
ddH 2 0 603 мл
Рабочий буфер : 0,1 М 100 мл
Отрегулировать
50 мл 0,2 М какодилата натрия до желаемого pH с 0,2 М HCl. Разбавить до 100 мл
с ddH 2 0 или разбавьте фиксатором 1:1.
рН 0,2 М НС1 (мл)
6,4 18,3
6,6 13,3
6,8 9.3
7,0 6.3
7.2 4.2
7.4 2.7
Также можно сделать буфер с какодиловой кислотой.
На складе растворы :
0,2 м какодиловая кислота 1 литр
(CH 3 ) 2 AsO 2 H (МВт = 138,0) 27,6 г
+ ddH 2 от 0 до сделать 1 литр
0,2 М NaOH 100 мл
NaOH (молекулярная масса = 40) 0,8 г
+ ddH 2 от 0 до сделать 100 мл
Рабочий буфер : 0,1 М
Настройка 50 мл 0,2 М какодиловой кислоты до желаемого pH с 0,2 М NaOH. Разбавить до 100 мл с ddH 2 или разбавьте фиксатором 1:1.
III. Veronal-ацетатный буфер (Michaelis буфер)
Преимущества :
Полезно
для окрашивания блока уранилацетатом, так как осадки не образуются.
Недостатки :
1. Реагирует с альдегидами.
2. Плохо буфер с физиологическим pH.
3. Опоры рост микроорганизмов.
4. Содержит барбитураты.
Подготовка Буфер :
Запас раствор : 0,28 М 100 мл
Натрий веронал (барбитон натрия)
C 8 H 11 0 3 N 2 Na (ММ = 206,18) 2,89 г
Ацетат натрия (безводный)
CH 3 C00Na (молекулярная масса = 82,03) 1,15 г
или
Ацетат натрия (гидратированный)
CH 3 C00Na*3H 2 0 (ММ = 136,09) 1,90 г
+ ddH 2 H 2 0 сделать 100 мл
Раствор стабилен и может храниться в течение нескольких месяцев при 4 C.
Рабочий буфер :
Веронал ацетатный бульон раствор 5 мл
ddH 2 0 15 мл
Добавляйте 0,1 НС1 постепенно до
желаемый рН.
Решение не может быть хранится.
Поддерживает рост бактерии и плесень даже при 4°С.
Кристаллизуется в отсутствие четырехокиси осмия.
IV. Коллидиновый буфер pH 7,25-7,74
Преимущества :
1. Максимум буферная емкость около 7,4.
2. Стабильный неограниченно долго при комнатной температуре.
3. Полезно для фиксации больших блоков тканей. Способствует проникновению фиксатора за счет экстрактивные эффекты (см. недостаток 1).
Недостатки :
1. Нет подходит в качестве буфера при первичной фиксации четырехокисью осмия из-за значительная экстракция тканевых компонентов.
2. Использование приводит к лизису цитоплазматического матрикса и обширной деструкции мембран при используется с параформальдегидными фиксаторами.
3. Использование
дает худшие результаты с глутаровым альдегидом, чем с фосфатом или какодилатом
буфер.
Приготовление буфера :
Исходный раствор : 0,4 М 100 мл
Чистый s-коллидин 5,34 гм
2,4,6(СН 3 ) 3 (C 2 H 5 N) (МВт = 121,18)
+ ddH 2 от 0 до сделать 100 мл
Рабочий буфер : 0,2 М 100 мл
Отрегулировать 50 мл s-коллидина исходный раствор до желаемого pH с помощью 1 н. HCl. Разбавить до 100 мл с помощью ddH 2 0.
pH 1N НС1, мл0003
7,59 14
7,67 12
7,74 10
В. Трис Буфер
Преимущества :
1. Хороший буферная способность при более высоком рН, необходимая для некоторых тканей и некоторых цитохимических процедуры.
2. «Подробнее или меньше» физиологически инертен.
Недостатки :
1. pH
меняется с температурой.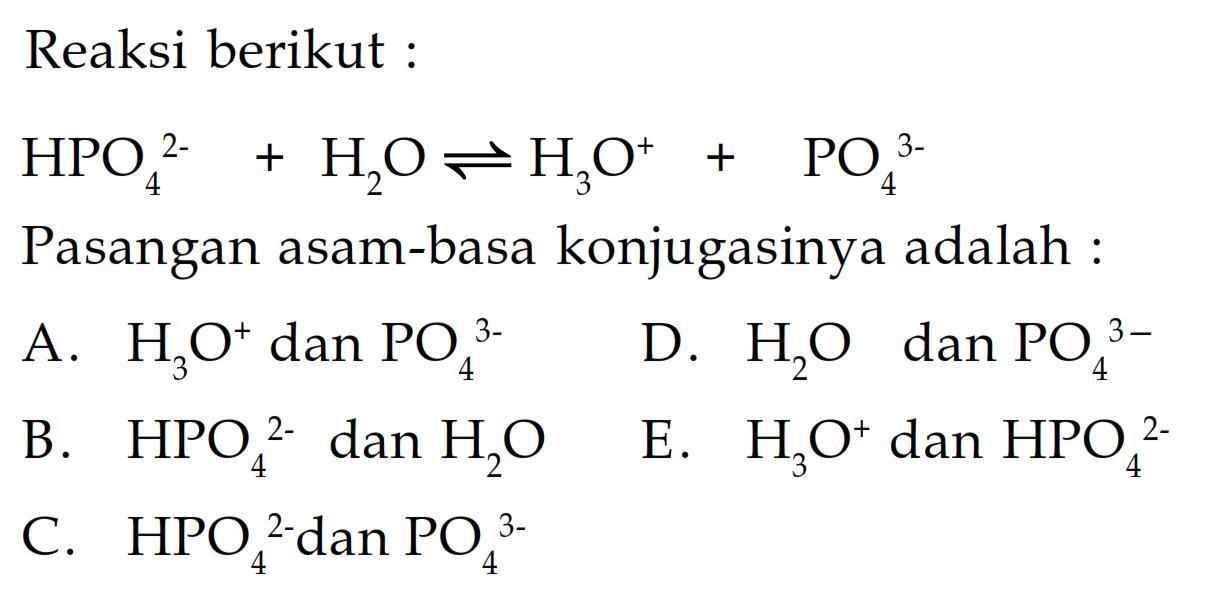 Должен измеряться при желаемой температуре.
Должен измеряться при желаемой температуре.
2. рН необходимо измерять электродом определенного типа.
Приготовление буфера :
А. Трис Буфер pH 7,1–8,9
Основной раствор 0,2 М 1 литр
Трис(гидроксиметил)аминометан 24,2 gm
H 2 NC(CH 2 0H) 3 (MW = 121,13)
+ ddH 2 0 до сделать 1 литр
Рабочий буфер : 0.1M 100 мл
Отрегулировать рН 50 мл исходного раствора с 0,1 М NaOH. Разбавить до 100 мл с помощью ddH 2 0.
B. Трис-малеат Буфер pH 5,8–8,2
Исходный раствор : 0,2 М л
Трис(гидроксиметил)аминометан 24,2 г
Малеиновая кислота 23,2 gm
HO 2 CCH:CHCO 2 ч (МВт = 116,07)
+ ddH 2 от 0 до сделать 1 литр
или
Тризима-малеат (ММ = 237,2) 47,4 г
+ ddH 2 от 0 до сделать 1 литр
Рабочий буфер : 0,2 М 100 мл
Отрегулировать
50 мл маточного раствора до желаемого pH с помощью 0,1M NaOH.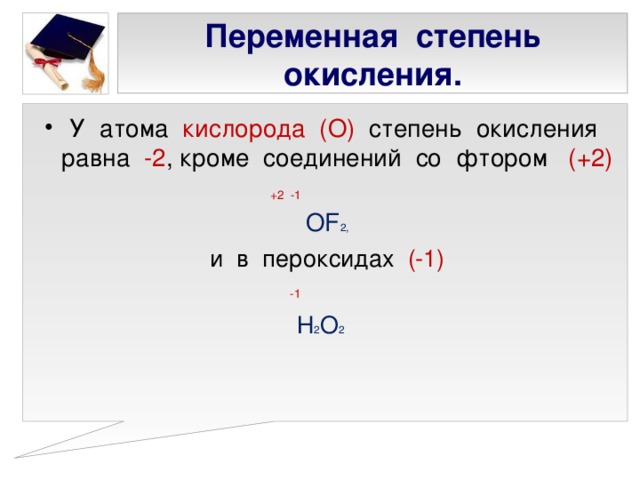 Разбавить до 100 мл с помощью ddH 2 0.
Разбавить до 100 мл с помощью ddH 2 0.
VI. Специальные буферы, используемые для Цитохимические реакции .
А. Ацетат Буфер (буфер ацетат натрия-уксусная кислота) рН 4-5,6
Ацетат натрия 0,2 М = 27,2 г/л
CH 3 CO 2 Na*3H 2 0 (молекулярная масса — 136.09)
Уксусная кислота 0,2M
CH 3 COOH (молекулярная масса = 60)
Добавить ацетат натрия в уксусной кислоты для получения желаемого pH. Разбавьте ddH 2 0 до желаемой молярности.
Б. Борат Буфер pH 7,4–9,2
Бура (тетраборат натрия) 0,2 М = 76,2 г/мл
Na 2 B 4 0 7 *120H 2 0 (ММ = 381,37)
Борная кислота 0,2М = 12,37 г/1
H 3 BO 3 (МВт = 61,83)
Добавить борную кислоту к буре
раствора до тех пор, пока не будет достигнут желаемый рН.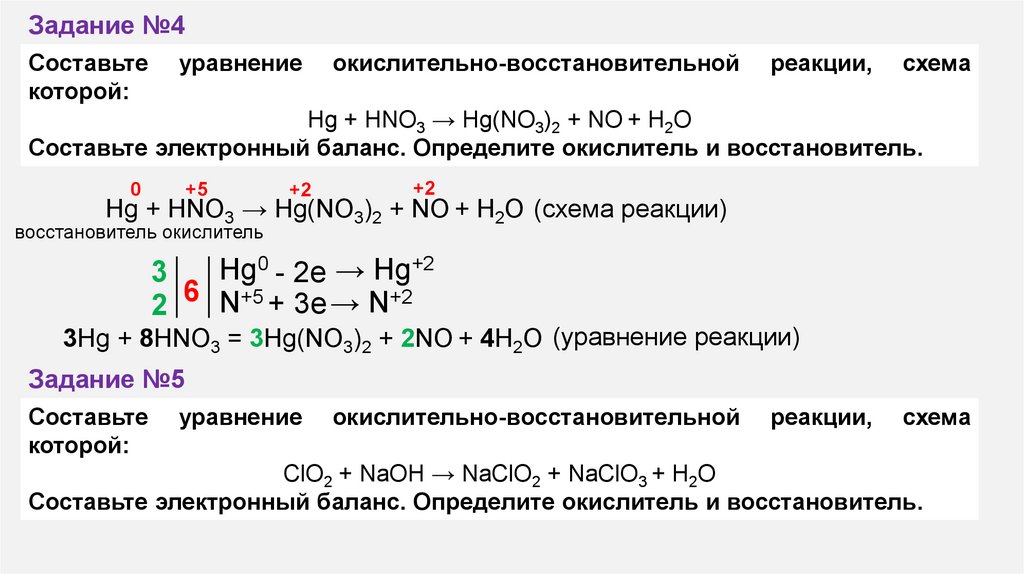 Разбавить до нужной молярности с помощью ddH 2 0,
Разбавить до нужной молярности с помощью ddH 2 0,
C. Цитрат Буфер (буфер цитрат натрия-лимонная кислота) рН 3-6,2
Цитрат натрия 0,2 М = 58,8 г/1
Na 3 C 6 H 5 0 7 *H 2 0 (MW = 294,12)
Лимонная кислота 0,2М = 42,02 г/1
C 6 H 8 0 7 *H 2 0 (молекулярная масса = 210,14)
Смешать лимонную кислоту и цитрат натрия для получения желаемого pH. Разбавить ddH 2 0 до желаемой молярности.
D. Диметилглутарат Буфер рН 3,2-7,6
Диметилглутаровая кислота 0,1М = 16,02 г/1
C 7 H 12 0 4 (MW = 160,2)
Добавьте 0,2 н. NaOH, чтобы получить желаемый рН. Разбавьте ddH 2 0 до желаемой молярности.
E. Сукцинат Буфер рН 3,8-6
Янтарная кислота 0,2 М = 23/62 г/1
C 4 H 6 0 2 (МВт = 118,09)
Добавьте 0,2 М NaOH до желаемого
рН. Разбавьте ddH 2 0 до желаемой молярности.
Разбавьте ddH 2 0 до желаемой молярности.
F. Малеат Буфер (натрий гидромалеатный буфер) pH 5,2-6,8 121.14) 23,2 г
+ ddH 2 от 0 до сделать 1 литр
Отрегулируйте pH с помощью 0,1M NaOH. Разбавить ddH 2 0 до желаемой молярности.
G. Имидазол Буфер рН 6,2-7,8
Имидазол 0,2М = 13,62/1
C 3 H 4 N 2 (МВт = 68,08)
Довести 0,2 н. НС1 до имидазола раствора до тех пор, пока не будет достигнут желаемый рН. Разбавить до желаемой молярности с помощью ddH 2 0,
H. AMPd Буфер рН 7,8-9,7
2-аминометил-1,3-пропандиол 0,2М = 21,03 г/1
C 4 H 11 НЕТ 2 (МВт = 105,14)
Добавьте 0,2 М НС1 до желаемый рН достигается. Разбавьте ddH 2 0 до желаемой молярности.
Фосфат натрия (тринатрийфосфат (TSP)): молекулярная геометрия — гибридизация — молекулярная масса — молекулярная формула — пары связей — неподеленные пары
Свойства фосфата натрияНазвание молекулы | Фосфат натрия |
Молекулярная геометрия | Тетраэдрический |
Гибридизация | сп3 |
Молекулярная формула | Na3PO4 |
Молекулярный вес | 163,94 г/моль |
Пары облигаций | 5 |
Одиночные пары | 11 |
Структура Льюиса | в инфографике |
Infographic
Download ↓↓
pdf файл | 3,4 МБ — высокое разрешение
JPG файл | Размер: 309 КБ
Фото: 1500×1500 высокое разрешение
Определения
Молекулярная геометрия: Молекулы имеют сбалансированную геометрическую форму, связи имеют определенную
длина и угол, а это определяют законы квантовой механики. химическое уравнение и структурное уравнение молекулы являются двумя наиболее
важные факторы, определяющие его свойства, особенно его активность.
структура молекулы также играет важную роль в определении полярности,
состояние вещества, цвет, магнетизм, вкус и многие другие свойства.
химическое уравнение и структурное уравнение молекулы являются двумя наиболее
важные факторы, определяющие его свойства, особенно его активность.
структура молекулы также играет важную роль в определении полярности,
состояние вещества, цвет, магнетизм, вкус и многие другие свойства.
Гибридизация : Гибридизация в химии процесс смешивания, слияния или объединения двух или более различных орбиталей электронов в одном и том же атоме. И они близки по энергии для получения нового гибрида орбитали одинаковой длины и энергии. Гибридизация происходит в одном и том же атома и образует орбитали, эквивалентные по форме, длине и энергии. атом должен быть возбужден. Орбитали должны быть близки по энергии, например 2s с 2p или 4s с 3d. Число гибридных орбиталей равно числу чистых орбиталей, участвующих в гибридизации. Гибридные орбитали более заметны. наружу, чтобы их способность перекрываться была сильнее, чем у обычных орбитали.
Молекулярная формула: Химическая формула — это краткий путь
выражения числа и типа атомов, из которых состоит конкретный химический
сложный. Он выражает каждый элемент его химическим символом и пишет
непосредственно рядом с ним число атомов в молекуле этого соединения. Если
в молекуле более одного атома одного и того же элемента, количество
атомов записывается в правом нижнем углу элемента. Для немолекулярного
веществ, нижняя цифра представляет собой описательную формулу. Химическое
формула, которая используется для ряда соединений, которые отличаются друг от друга
фиксированных единиц называется «общей формулой». Эта серия называется
однородный ряд, а его номер называется символом однородности.
Он выражает каждый элемент его химическим символом и пишет
непосредственно рядом с ним число атомов в молекуле этого соединения. Если
в молекуле более одного атома одного и того же элемента, количество
атомов записывается в правом нижнем углу элемента. Для немолекулярного
веществ, нижняя цифра представляет собой описательную формулу. Химическое
формула, которая используется для ряда соединений, которые отличаются друг от друга
фиксированных единиц называется «общей формулой». Эта серия называется
однородный ряд, а его номер называется символом однородности.
Молекулярный вес : в химии вещества
(иногда ее называют молекулярной массой вещества) – это масса
молекулы этого вещества относительно единицы атомной массы (u, равной
1/12 массы атома n-углерода-12) (просто: молекулярная масса есть сумма
массы атомов в молекуле). Молекулярную массу можно рассчитать как сумму
атомных весов атомов в любой молекуле. Молекулярная масса также может быть
измеряют непосредственно масс-спектрометром. В масс-спектрометрии молекулярный
масса малых молекул (менее примерно 200 атомов данного элемента) равна
минута, то есть сумма наиболее распространенных изотопов этого элемента. Для большего
молекул, она является средней или рассчитывается с использованием молекулярной массы
элемент или с помощью таблицы Менделеева, где есть статистика для
распределение атомов представлено изотопами молекулы.
В масс-спектрометрии молекулярный
масса малых молекул (менее примерно 200 атомов данного элемента) равна
минута, то есть сумма наиболее распространенных изотопов этого элемента. Для большего
молекул, она является средней или рассчитывается с использованием молекулярной массы
элемент или с помощью таблицы Менделеева, где есть статистика для
распределение атомов представлено изотопами молекулы.
Пары связей : Пара связей — это пара электронов, присутствующих в химической связи. Как мы знаете, одна связь всегда состоит из двух электронов, спаренных вместе. Вместе эти два электрона называются парой связи. Пары связей можно увидеть в ковалентных соединения и координационные соединения.
Одиночные пары : Несвязывающая или одиночная пара — это пара электронов в атоме без
связывание или совместное использование с другим атомом. Он часто имеет отрицательную полярность из-за
его высокая плотность заряда. Эта пара используется для образования координационных связей. За
например, при производстве гидроксония ионы h4O+ присутствуют, когда кислоты
растворяются в воде, а атом кислорода дает неподеленную пару атому водорода
ион.
Эта пара используется для образования координационных связей. За
например, при производстве гидроксония ионы h4O+ присутствуют, когда кислоты
растворяются в воде, а атом кислорода дает неподеленную пару атому водорода
ион.
Структура Льюиса : Структура Льюиса или представление Льюиса (также известная как электронная
растровая диаграмма, растровая формула Льюиса, точечная структура Льюиса или точечный электрон
структура) представляет собой двухмерную диаграмму, используемую в химии, чтобы показать связь
между атомами молекулы и неподеленными электронными парами, которые могут присутствовать в
эта молекула. Он в основном используется для отображения относительного положения
различные атомы по отношению друг к другу и образования валентности
связи, которые соединяют различные атомы соединения, а также
положение электронов относительно атомов молекулы. Льюис
Структуру можно построить для любой молекулы, которая содержит ковалентную связь в
дополнение к комплексам.
НАТРИЯ ФОСФАТ ДВУХОСНОВНЫЙ, ГЕПТАГИДРАТ | 7782-85-6
ФОСФАТ НАТРИЯ, ДВУХОСНОВНЫЙ, ГЕПТАГИДРАТ Свойства
| Температура плавления | 48°С |
|---|---|
| Плотность | 1,68 г/мл при 25 °C (лит.) |
| плотность пара | 4,9 (против воздуха) |
| температура хранения | Хранить при температуре от +5°С до +30°С. |
| растворимость | 154 г/л |
| форма | Твердый |
| цвет | Белый |
| Удельный вес | 1,7 |
| Диапазон рН | 8,7 — 9,3 |
| РН | 8,7-9,3 (25 ℃, 5% в растворе) |
| Растворимость воды | Растворим в воде и нерастворим в этаноле. |
| Мерк | 14 8659 |
| Справочник по базе данных CAS | 7782-85-6 (Ссылка на базу данных CAS) |
| Непрямые добавки, используемые в веществах, контактирующих с пищевыми продуктами | НАТРИЯ ФОСФАТ, ДВУХОСНОВЫЙ, ГЕПТАГИДРАТ |
| FDA UNII | 70WT22SF4B |
| Система регистрации веществ EPA | Гептагидрат фосфата натрия (7782-85-6) |
НАТРИЯ ФОСФАТ ДВУХОСНОВЫЙ, ГЕПТАГИДРАТ цена Больше Цена(42)
| Производитель | Номер продукта | Описание продукта | Номер CAS | Упаковка | Цена | Обновлено | Купить |
|---|---|---|---|---|---|---|---|
| Сигма-Олдрич | 8210-ОП | OmniPur Фосфат натрия, двухосновный, гептагидрат — CAS 7782-85-6 — Calbiochem | 7782-85-6 | 500 г | 65,2 $ | 15. 05.2022 05.2022 | Купить |
| Сигма-Олдрич | 431478 | Натрий фосфат двухосновный гептагидрат ≥99,99% микроэлементов на основе | 7782-85-6 | 50 г | 75,4 $ | 15.05.2022 | Купить |
| Сигма-Олдрич | 431478 | Натрий фосфат двухосновный гептагидрат ≥99,99% микроэлементов на основе | 7782-85-6 | 250 г | 202 долл. США США | 15.05.2022 | Купить |
| Сигма-Олдрич | 1.06574 | Гептагидрат гидрофосфата натрия EMPROVE? ESSENTIAL, DAC, USP | 7782-85-6 | 1 кг | 118 долларов | 15.05.2022 | Купить |
| Сигма-Олдрич | 1. 06575 06575 | Гептагидрат гидрофосфата натрия для анализа EMSURE? АКС | 7782-85-6 | 1 кг | 139 долларов | 15.05.2022 | Купить |
| Номер продукта | Упаковка | Цена | Купить |
|---|---|---|---|
| 8210-ОП | 500 г | 65,2 $ | Купить |
| 431478 | 50 г | 75,4 $ | Купить |
| 431478 | 250 г | 202 долл. США США | Купить |
| 1.06574 | 1 кг | 118 долларов | Купить |
| 1.06575 | 1 кг | 139 долларов | Купить |
ФОСФАТ НАТРИЯ, ДВУХОСНОВЫЙ, ГЕПТАГИДРАТ Химические свойства, использование, производство
Химические свойства
В USP 32 указано, что двухосновный фосфат натрия высушивают или
содержит 1, 2, 7 или 12 молекул гидратной воды. Безводный двухосновный фосфат натрия представляет собой белый порошок.
Дигидрат представляет собой белые или почти белые кристаллы без запаха.
Безводный двухосновный фосфат натрия представляет собой белый порошок.
Дигидрат представляет собой белые или почти белые кристаллы без запаха.
Гептагидрат представляет собой бесцветные кристаллы или белые гранулы.
или затвердевшая соль, которая выцветает на теплом сухом воздухе. додекагидрат
встречается в виде сильно выцветших, бесцветных или прозрачных кристаллов.
Химические свойства
Белый порошок
Использование
Двухосновный гептагидрат фосфата натрия использовался для приготовления натрий-фосфатного буфера и фосфатно-солевого буфера (PBS).[44}
Использование
Двухосновный гептагидрат фосфата натрияиспользуется в качестве прекурсора при приготовлении молекулярного катализатора на основе кобальта для окисления воды.
Использование
Буферный агент.
Методы производства
Либо костный фосфат (костная зола), полученный нагреванием костей до
белизны, или минерал фосфорит используется как источник трехосновного
фосфат кальция, который является исходным сырьем в промышленности
Производство двухосновного фосфата натрия.
Трехосновный фосфат кальция тонко измельчают и вываривают с
серная кислота. Затем эту смесь выщелачивают горячей водой и
нейтрализуют карбонатом натрия и двухосновным фосфатом натрия
кристаллизуют из фильтрата.
Фармацевтические приложения
Двухосновный фосфат натрия используется в самых разных фармацевтических
составы в качестве буферного агента и в качестве секвестрирующего агента.
В терапевтических целях двухосновный фосфат натрия используется как мягкое слабительное.
и при лечении гипофосфатемии.
Двухосновный фосфат натрия также используется в пищевых продуктах; за
Например, в качестве эмульгатора в плавленых сырах.
Безопасность
Двухосновный фосфат натрия широко используется в качестве наполнителя в
парентеральные, пероральные и местные фармацевтические препараты.
Фосфаты широко распространены в организме и участвуют в
многие физиологические процессы, поскольку он является основным анионом
внутриклеточная жидкость. Большинство пищевых продуктов содержат достаточное количество
фосфатов, вызывая гипофосфатемию (дефицит фосфатов)
практически неизвестен, за исключением некоторых болезненных состояний или у пациентов
получают полное парентеральное питание. Лечение обычно пероральное
введение до 100 ммоль фосфата в сутки.
Приблизительно две трети проглоченного фосфата всасывается.
из желудочно-кишечного тракта, практически весь выводится с мочой.
с мочой, а остальное выводится с калом.
Чрезмерное введение фосфатов, особенно внутривенно,
ректально или у пациентов с почечной недостаточностью может вызвать
гиперфосфатемия, которая может привести к гипокальциемии или другим тяжелым
электролитный дисбаланс. Побочные эффекты возникают реже
после перорального приема, хотя фосфаты действуют как мягкий солевой раствор
слабительные при приеме внутрь или ректально. Следовательно,
желудочно-кишечные расстройства, включая диарею, тошноту и
рвота может возникнуть после использования двухосновного фосфата натрия
в качестве вспомогательного вещества в пероральных препаратах. Однако уровень двухосновных
фосфат натрия, используемый в качестве вспомогательного вещества в фармацевтических
формулировка обычно не связана с побочными эффектами.
Побочные эффекты возникают реже
после перорального приема, хотя фосфаты действуют как мягкий солевой раствор
слабительные при приеме внутрь или ректально. Следовательно,
желудочно-кишечные расстройства, включая диарею, тошноту и
рвота может возникнуть после использования двухосновного фосфата натрия
в качестве вспомогательного вещества в пероральных препаратах. Однако уровень двухосновных
фосфат натрия, используемый в качестве вспомогательного вещества в фармацевтических
формулировка обычно не связана с побочными эффектами.
LD50 (крыса, перорально): 17 г/кг
хранение
Безводная форма двухосновного фосфата натрия гигроскопична.
При нагревании до 40 ℃ додекагидрат плавится; при 100℃ теряет свой
кристаллизационная вода; а при тускло-красном кале (около 240℃) это
превращается в пирофосфат Na4P2O7. Водные растворы
двухосновный фосфат натрия стабилен и может быть стерилизован
автоклавирование.
Сыпучий материал следует хранить в герметичном контейнере, в
прохладное, сухое место.
Несовместимости
Двухосновный фосфат натрия несовместим с алкалоидами, антипирином, хлоралгидрат, ацетат свинца, пирогаллол, резорцин и глюконат кальция и ципрофлоксацин. Взаимодействие между кальцием и фосфатом, приводящее к образованию нерастворимых выпадает кальций-фосфатный осадок, возможен в парентеральных смесях.
Регуляторный статус
внесен в список GRAS. Разрешен в Европе для использования в качестве пищевой добавки. Включен в базу данных неактивных ингредиентов FDA (инъекции; настои; назальные, офтальмологические, оральные, ушные, местные и вагинальные препараты). Входит в состав непарентеральных и парентеральных лекарственных средств. лицензирован в Великобритании. Включен в Канадский список допустимых Нелекарственные ингредиенты.
НАТРИЯ ФОСФАТ ДВУХОСНОВЫЙ, ГЕПТАГИДРАТ Продукты приготовления и сырье
Сырье
Продукты подготовки
Фосфорная кислота, динатриевая соль, гептагидрат
Гептагидрат моногидрофосфата натрия (2:1:1:7)
ФОСФАТ НАТРИЯ МОНОВОДОРОДНЫЙ
SEC-НАТРИЯ ФОСФАТ ГЕПТАГИДРАТ
ВТОРИЧНЫЙ ФОСФАТ НАТРИЯ
ВТОРИЧНЫЙ ФОСФАТ НАТРИЯ ГЕПТАГИДРАТ
НАТРИЯ ОДНОВОДОРОДНЫЙ ФОСФАТ ГЕПТАГИДРАТ
НАТРИЯ ФОСФАТ, ДВУХОСНОВЫЙ, ГЕПТАГИДРАТ
НАТРИЯ ФОСФАТ ГЕПТАГИДРАТ
НАТРИЯ ФОСФАТ ГЕПТАГИДРАТ, ДВУХОСНОВНОЙ
НАТРИЯ ФОСФАТ ДВУХОСНОВНЫЙ
НАТРИЯ ФОСФАТ, ДВУХОСНОВНОЙ, 7-ГИДРАТ
НАТРИЯ ФОСФАТ 7х3О, ДВУХОСНОВНОЙ
НАТРИЙ ВОДОРОД ФОСФАТ ГЕПТАГИДРАТ
НАТРИЯ ДВУХОСНОВНЫЙ ФОСФАТ ГЕПТАГИДРАТ
ДИ-НАТРИЙ ВОДОРОД ФОСФАТ-7-ГИДРАТ
ДИНАТРИЙ ВОДОРОД ФОСФАТ ГЕПТАГИДРАТ
ФОСФАТ ДИНАТРИЯ ВОДОРОДА
ДИНАТРИЙ ФОСФАТ
ДИНАТРИЯ ФОСФАТ ГЕПТАГИДРАТ
DSP
ДСП ГЕПТАГИДРАТ
Фосфат натрия, двухосновный, гептагидрат
ГЕПТАГИДРАТ НАТРИЯ ВОДОРОДНОФОСФАТНЫЙ, РЕАГЕНТ ПЛЮС, 99,99+%
ДИ-НАТРИЙ ВОДОРОД ФОСФОРНЫЙ ГЕПТАГИДРАТ E, ACS
НАТРИЯ ФОСФАТ, ДВУХОСНОВНОЙ ГЕПТАГИДРАТ, 98+%, A. C.S. РЕАГЕНТ
ДИ-НАТРИЯ ВОДОРОД ФОСФАТ-7-ГИДРАТ R . Г., РАГ. СКУД
Гептагидрат гидрогенфосфата натрия, ACS, 98,0-102,0%
НАТРИЯ ФОСФАТ ДВУХОСНОВНОЙ 7 ч3O
Фосфат натрия, двухосновный гептагидрат, для анализа ACS, 98+%
гептагидрат гидрофосфата натрия, ас
Двуосновный натрийфосфат, гептагидрат, кристалл, USP
НАТРИЙФОСФАТ, ДВУХОСНОВЫЙ, ГЕПТАГИДРАТ, КРИСТАЛЛ, РЕАГЕНТ, ACS
НАТРИЙФОСФАТ, ДВУХОСНОВЫЙ, ГЕПТАГИДРАТ, ГРАНУЛИРОВАННЫЙ, РЕАГЕНТ, ACS
НАТРИЙФОСФАТОДВОСНОВНЫЙ,ГЕПТАГИДРАТ,ГРАНУЛИРОВАННЫЙ,БИОТЕХНОЛОГИЧЕСКИЙ
НАТРИЙФОСФАТОДВОСНОВНЫЙ,ГЕПТАГИДРАТ,ТЕХНИЧЕСКИЙ
НАТРИЯ ФОСФАТ ДВУХОСНОВНОЙ ГЕПТАГИДРАТ ГРАНУЛИРОВАННЫЙ
Фосфат натрия, двухосновный, сухой порошок
динатрия гидрофосфат гептагидрат, динатрия фосфат
Двухосновный фосфат натрия, гептагидрат, кристалл
Фосфат натрия, двухосновный, гептагидрат, кристалл, реагент
Фосфат натрия, двухосновный, гептагидрат, гранулированный, реагент
Фосфат натрия, двухосновный гептагидрат, для анализа, 99+%
НАТРИЯ ФОСФАТ, ДВУХОСНОВНОЙ ГЕПТАГИДРАТ, РЕАГЕНТ (ACS)
Фосфат натрия, трехосновный, додекагидрат, кристалл, реагент
Фосфат натрия, двухосновный гептагидрат, 99+%, для анализа
Фосфат натрия, двухосновный гептагидрат, для анализа
Фосфат натрия, двухосновный гептагидрат, для анализа ACS
Фосфат натрия, двухосновный гептагидрат,98+%, для анализа ОКС
НАТРИЯ ФОСФАТ, ДИ
SS Натрий фосфат двухосновный гептагидрат
Фосфат натрия, двухосновный гептагидрат, для анализа АЦС, 98+% 500ГР
Фосфат натрия, двухосновный гептагидрат, для анализа, 99+% 500гр
ДИ-НАТРИЙ ВОДОРОД ФОСФ.
C.S. РЕАГЕНТ
ДИ-НАТРИЯ ВОДОРОД ФОСФАТ-7-ГИДРАТ R . Г., РАГ. СКУД
Гептагидрат гидрогенфосфата натрия, ACS, 98,0-102,0%
НАТРИЯ ФОСФАТ ДВУХОСНОВНОЙ 7 ч3O
Фосфат натрия, двухосновный гептагидрат, для анализа ACS, 98+%
гептагидрат гидрофосфата натрия, ас
Двуосновный натрийфосфат, гептагидрат, кристалл, USP
НАТРИЙФОСФАТ, ДВУХОСНОВЫЙ, ГЕПТАГИДРАТ, КРИСТАЛЛ, РЕАГЕНТ, ACS
НАТРИЙФОСФАТ, ДВУХОСНОВЫЙ, ГЕПТАГИДРАТ, ГРАНУЛИРОВАННЫЙ, РЕАГЕНТ, ACS
НАТРИЙФОСФАТОДВОСНОВНЫЙ,ГЕПТАГИДРАТ,ГРАНУЛИРОВАННЫЙ,БИОТЕХНОЛОГИЧЕСКИЙ
НАТРИЙФОСФАТОДВОСНОВНЫЙ,ГЕПТАГИДРАТ,ТЕХНИЧЕСКИЙ
НАТРИЯ ФОСФАТ ДВУХОСНОВНОЙ ГЕПТАГИДРАТ ГРАНУЛИРОВАННЫЙ
Фосфат натрия, двухосновный, сухой порошок
динатрия гидрофосфат гептагидрат, динатрия фосфат
Двухосновный фосфат натрия, гептагидрат, кристалл
Фосфат натрия, двухосновный, гептагидрат, кристалл, реагент
Фосфат натрия, двухосновный, гептагидрат, гранулированный, реагент
Фосфат натрия, двухосновный гептагидрат, для анализа, 99+%
НАТРИЯ ФОСФАТ, ДВУХОСНОВНОЙ ГЕПТАГИДРАТ, РЕАГЕНТ (ACS)
Фосфат натрия, трехосновный, додекагидрат, кристалл, реагент
Фосфат натрия, двухосновный гептагидрат, 99+%, для анализа
Фосфат натрия, двухосновный гептагидрат, для анализа
Фосфат натрия, двухосновный гептагидрат, для анализа ACS
Фосфат натрия, двухосновный гептагидрат,98+%, для анализа ОКС
НАТРИЯ ФОСФАТ, ДИ
SS Натрий фосфат двухосновный гептагидрат
Фосфат натрия, двухосновный гептагидрат, для анализа АЦС, 98+% 500ГР
Фосфат натрия, двухосновный гептагидрат, для анализа, 99+% 500гр
ДИ-НАТРИЙ ВОДОРОД ФОСФ.
