Окислительно-восстановительные реакции
Окислительно-восстановительные
реакции часто довольно громоздки и,
тем не менее, их нужно уметь
уравнивать. Для этой цели используют
предельно простую модель молекулы.
Прежде всего вводят понятие о
степени окисления атома в молекуле.
Начнем с конкретных примеров.
Степень окисления атомов в молекулах
простых веществ (h3, F2, O2, O3,
графит, алмаз, металлы) принимается
равной нулю. Атомы щелочных
металлов во всех соединениях с
неметаллами имеют степень окисления
равную +1 (если вспомнить о ионном
характере связи в этих молекулах, то
это действительно так). Атомы фтора
(самого активного из всех неметаллов)
во всех соединениях имеют степень
окисления равную -1. В соединениях с
металлами, где имеется ионный тип
связи, это действительно так.
Атомы кислорода во всех соединениях (кроме O2, O3, h3O2 и ее производных, F2O) имеют степень окисления равную -2.
Дальше начинается элементарный
подсчет. Любая молекула в целом
электронейтральна: сумманое число
положительных степеней окисления в
молекуле равно суммарному числу
отрицательных степеней окисления.
Так как степень окисления атомов кислорода равна -2, то степень окисления атомов азота можно легко подсчитать (они приведены под формулами оксидов).
Водород в соединениях с металлами (в молекулах гидридов металлов) имеет степень окисления равную -1. Водород в соединениях с неметаллами (как самый слабый из неметаллов) имеет степень окисления равную +1.
Итак, степень окисления атома в молекуле равна тому заряду, который был бы на данном атоме, если бы все ковалентные полярные связи стали ионными.
В качестве примера уравнивания окислительно- восстановительной реакции рассмотрим реакцию горения угля:
C + O2 = CO2,
Подытожим все сказанное.
Химические реакции, в которых атомы
одного или нескольких элементов
изменяют свою степень окисления,
называются окислительно-
восстановительными.
Окислители — это вещества, которые в результате химической реакции присоединяют к себе электроны (в разобранной реакции это и кислород, и молекулы кислорода, и атомы кислорода — можно использовать любое название).
Восстановители — это вещества, которые в результате химической реакции отдают электроны (в разобранной реакции это углерод или атом углерода).
Восстановители в результате окислительно-восстановительной реакции окисляются (у атомов восстановителя отбираются электроны).
Окислители в результате окислительно-восстановительной реакции восстанавливаются (атомы окислителя присоединяют к себе электроны).
В сульфате меди степень окисления атома меди равна +2 (Cu+2), атома кислорода -2 (О-2). При электролитической диссоциации в растворе появляются реальные ионы:
CuSO4 = Cu2+ + SO42-.
Чтобы подчеркнуть, что это реальные ионы, числа пишут перед знаком заряда (а в степенях окисления атомов — наоборот).
Кроме метода электронного баланса при уравнивании окислительно- восстановительных реакций часто используется метод электронно- ионного баланса. Он иногда имеет определенные преимущества.
Окислители
Из простых веществ наиболее сильными
окислителями являются неметаллы.
Прежде всего это фтор и галогены.
Активным окислителем является
кислород (стоит на втором месте по
окислительной способности после
фтора). Из кислот наиболее сильными
окислителями являются
концентрированная азотная и
концентрированная серная, из солей,
особенно в кислой среде, —
перманганаты и бихроматы, из оксидов
— высшие оксиды неметаллов: SO3,
Cl2O7 и металлов: CrO3, MnO2, Mn2O7,
PbO2.
Восстановители
Из простых веществ наиболее сильными восстановительными свойствами обладают щелочные и щелочноземельные металлы. Все прочие металлы обычно располагают в электрохимический ряд напряжений:
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Sn, Pb, H, Cu, Hg, Ag, Au
При высоких температурах сильными восстановительными способностями обладают углерод, окись углерода, водород.
другие статьи:
- Агрегатные состояние вещества
- Строение атома — развитие моделей
- Квантовая механика и строение атома водорода
- Электронные конфигурации атомов и периодический закон
- Ядра атомов. Радиоактивность и изотопы
- Строение молекул. Типы химической связи
- Квантовая механика молекул и теория химической связи.
 Метод молекулярных орбиталей. Теория спин-валентности
Метод молекулярных орбиталей. Теория спин-валентности - Окислительно-восстановительные реакции
- Химическая термодинамика
- Химическая кинетика и катализ
- Химическое равновесие. Обратимые и необратимые реакции
- Электрохимия. Свойства электролитов. Электролиз
Опыт изучения понятия степень окисления в помощь молодому учителю
16 Марта 2012
Изучение понятия «степень окисления» мы проводим после ознакомления учащихся с электроотрицательностью (ЭО). При изучении этих понятий в традиционной последовательности возникает ряд методических затруднений.
Без знания электроотрицательности обучающиеся не могут понять причину поляризации связей, а, следовательно, правильно объяснить, почему образуются положительные и отрицательные заряды у атомов элементов. По рекомендациям учебника, положительный знак заряда следует приписывать тому атому элемента, который отдает электроны. Но это правило можно применить лишь к соединениям, образованным металлами и неметаллами. В таких соединениях неметалл всегда имеет отрицательный заряд. Судить же о степени окисления в соединениях из двух неметаллов можно на основании учета одновременно двух свойств атома: насколько легко он отдает и принимает электроны. Именно оба эти свойства, как известно, определяют ЭО элемента. Если учитывать лишь одно свойство, то можно неправильно определить, степени окисления. Например, в соединении NC13, NBr3 и NI3. отрицательный заряд сосредоточен на атоме азота, а не на атомах галогенов, как, можно было бы предположить на основе сравнения одного свойства атомов азота и галогенов присоединять недостающие электроны. Такие же ошибки могут быть допущены и в других случаях, когда определяют степени окисления в кислородных соединениях хлора, брома и йода, в сульфиде йода и др. При расстановке зарядов в формулах ковалентных соединений нужно знать не то, насколько атом легко отдает или присоединяет электроны, а именно его электроотрицательность.
По рекомендациям учебника, положительный знак заряда следует приписывать тому атому элемента, который отдает электроны. Но это правило можно применить лишь к соединениям, образованным металлами и неметаллами. В таких соединениях неметалл всегда имеет отрицательный заряд. Судить же о степени окисления в соединениях из двух неметаллов можно на основании учета одновременно двух свойств атома: насколько легко он отдает и принимает электроны. Именно оба эти свойства, как известно, определяют ЭО элемента. Если учитывать лишь одно свойство, то можно неправильно определить, степени окисления. Например, в соединении NC13, NBr3 и NI3. отрицательный заряд сосредоточен на атоме азота, а не на атомах галогенов, как, можно было бы предположить на основе сравнения одного свойства атомов азота и галогенов присоединять недостающие электроны. Такие же ошибки могут быть допущены и в других случаях, когда определяют степени окисления в кислородных соединениях хлора, брома и йода, в сульфиде йода и др. При расстановке зарядов в формулах ковалентных соединений нужно знать не то, насколько атом легко отдает или присоединяет электроны, а именно его электроотрицательность.
Ознакомление обучающихся с понятием степени окисления мы начинаем с его определения. Сообщаем, что под степенью окисления понимают заряд, который, возникает вследствие полного (действительного или условного) перехода электронов от одного атома к другому. Например, в соединениях
Fe+3Br3-, S+6O3-2, Zn+2O-2, h3+ S-2
заряды расставлены, исходя из предположения, что любое из, веществ, независимо от характера связей в нем, состоит из ионов.
Научиться правильно расставлять степени окисления означает овладеть двумя умениями: безошибочно приписывать каждому атому элемента сложного вещества знаки + или — и определять величины зарядов.
Практика показывает, что одновременное формирование двух отмеченных умений идет, медленно. Успешнее оно проходит в том случае, если обучающиеся овладеют вначале умением расставлять знаки зарядов. С этой целью мы составляем ряд заданий, направленных на закрепление знаний об ЭО металлов и неметаллов.
Na+Сl-, Ba+2S-2, Al2+3O3-2
и др.? Почему? Выполнением этого задания стремимся закрепить в памяти обучающихся, что металлы во всех соединениях имеют положительный заряд.
Следующее задание включает вопросы, направленные на применение знаний о различной ЭО двух неметаллов, находящихся в одной группе или в одном периоде таблицы Менделеева. Например: какой из двух элементов более электроотрицателен: азот или фосфор, бром или фтор, кислород или фтор?
После того как все обучающиеся станут правильно отвечать на подобные вопросы, мы переходим к рассмотрению более сложного задания, предлагая сравнить элементы, принадлежащие к различным группам и периодам. Ответы на вторую группу вопросов обучающиеся смогут дать, пользуясь рядом ЭО, приведенным в учебнике. Вопросы мы формулируем по-разному, акцентируя внимание то на более электроотрицательном элементе, то на менее электроотрицательном.
Выяснение знаний об ЭО неметаллов, а следовательно, подготовленность обучающихся к расстановке зарядов проводится по результатам выполнения следующего задания: подчеркните знаки тех элементов, на которых сосредоточен отрицательный заряд в соединениях: Рh4, PC15, SF6, СO2, С12О7. Второй вариант выполняет подобное задание, подчеркивая электроположительный элемент в соединениях: SO2, HF, NC13, OF2, Р2О5.
В конце занятия изученное обобщаем в виде следующих положений:
- Любой неметалл более электроотрицателен, чем металл. Поэтому металлам в формулах соединений с другими элементами всегда приписывают положительный знак заряда.
-
Фтор — наиболее электроотрицательный неметалл. Поэтому во всех соединениях на нем сосредоточивается только отрицательный заряд.

- За исключением фтора, все неметаллы могут иметь как отрицательный, так и положительный заряд, что зависит от ЭО соединенных с ними элементов.
Умение определять величины степеней окисления относится к сложным умениям. Складывается оно из знаний о строении атомов и их свойствах, а также из умения применять математические действия.
Для определения степеней окисления, обучающиеся должны знать следующие положения. Величина степени окисления атома простого вещества равна нулю, например:
Na°, C°, Cl2°, P4°, Fe°, S8°, O2°.
Атомы простого вещества не отличаются между собой ЭО. Величина положительной степени окисления металла равна количеству валентных электронов, которые атом отдает на образование ионов или ковалентных, связей:
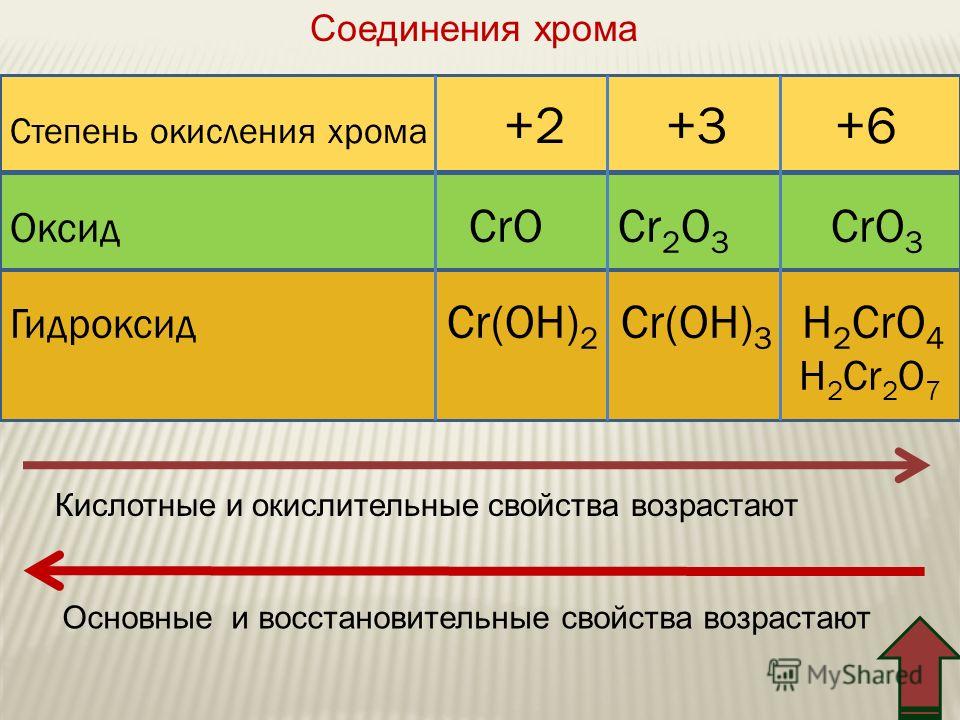
Na+С1, Mg+2(NO3)2, Al+3Br3, Сг+603, Мn2+7О7,
Все неметаллы, за исключением наиболее электроотрицательного фтора, характеризуются несколькими значениями положительных и отрицательных степеней окисления. Низшая (отрицательная) степень окисления неметалла равна количеству неспаренных электронов в атоме, например
Низшая (отрицательная) степень окисления неметалла равна количеству неспаренных электронов в атоме, например
HCl-, h3S-2, K3P-3, А14С3-4
Высшая (положительная) степень окисления неметалла равна количеству валентных электронов в атоме:
Р+5С15, S+6O3, Br2+7О7.
Фтор и кислород составляют исключение. Фтор не имеет положительных степеней окисления, а у кислорода в соединениях с фтором она не превышает +2. Все неметаллы имеют степени окисления, величина которых выражается промежуточными числами между высшими и низшими степенями окисления. Например, атом кислорода может иметь степени окисления -2, -1, 0, +1, +2.
Изложенные сведения заносим в таблицу.|
Неметаллы |
Количество валентных электронов в атоме |
Количество неспаренных электронов в атоме |
Низшая степень окисления |
Высшая степень окисления |
|
F |
7 |
1 |
-1 |
0 |
|
O |
6 |
2 |
-2 |
+2 |
|
Cl, Br, I |
7 |
1 |
-1 |
+7 |
|
S |
6 |
2 |
-2 |
+6 |
|
N, P |
5 |
3 |
-3 |
+5 |
|
C, Si |
4 |
4 |
-4 |
+4 |
|
H |
1 |
1 |
-1 |
+1 |
Чтобы правильно судить о том, какая степень окисления из всех возможных будет у элемента в конкретном случае, обучающиеся должны знать, с чего начинается определение степеней окисления, какие математические действия следует произвести, как проверить правильность выполненного задания и др. Эти знания они получают в процессе рассмотрения конкретных примеров и разъяснений.
Эти знания они получают в процессе рассмотрения конкретных примеров и разъяснений.
Обучающиеся анализируют формулу (состав) вещества и устанавливают, на каких элементах сосредоточены положительные и отрицательные заряды. В случае ВаS, FeI3, h3O2 электроотрицательный элемент расположен на втором месте. В первую очередь приписывают величину степени окисления тому элементу, у которого самый малый диапазон (количество) степеней окисления данного знака. Например, в формуле ВаS, лучше начинать с бария, так как он имеет только одну положительную степень окисления +2. В соединении FeI3 таким элементом является йод, а в Н2О2 — водород (кислород имеет две отрицательные степени окисления -2, -1). Если в формуле нет индексов, то величина степени окисления определяемого элемента совпадает с величиной степени окисления рассмотренного элемента, например: Вa+2S-2. При наличии индексов в формуле поступают следующим образом:
-
умножают индекс элемента на величину его степени окисления.
 Полученное произведение запоминают или записывают над чертой, проведенной выше степени окисления:
Полученное произведение запоминают или записывают над чертой, проведенной выше степени окисления:
—3 +2____
Fe I3- h3+O2
поскольку общий заряд вещества равен нулю, второму элементу приписывают такое же количество зарядов с противоположным знаком:
+3—3 +2 —2
Fe I3- h3+ O2
величину степени окисления второго, определяемого элемента находят делением общего количества зарядов на индекс:
+3—3 +2 —2
Fe+3 I3- h3+O2-
Правильность вычисленных степеней окисления проверяют следующим образом. Знак и величина степени окисления должны быть проверены с учетом ЭО и строения атомов. Для неметаллов диапазон степеней окисления находится в приведенной выше справочной таблице. Произведение индекса на степень окисления элемента с одним знаком заряда должно быть равно подобному произведению другого элемента с противоположным знаком заряда.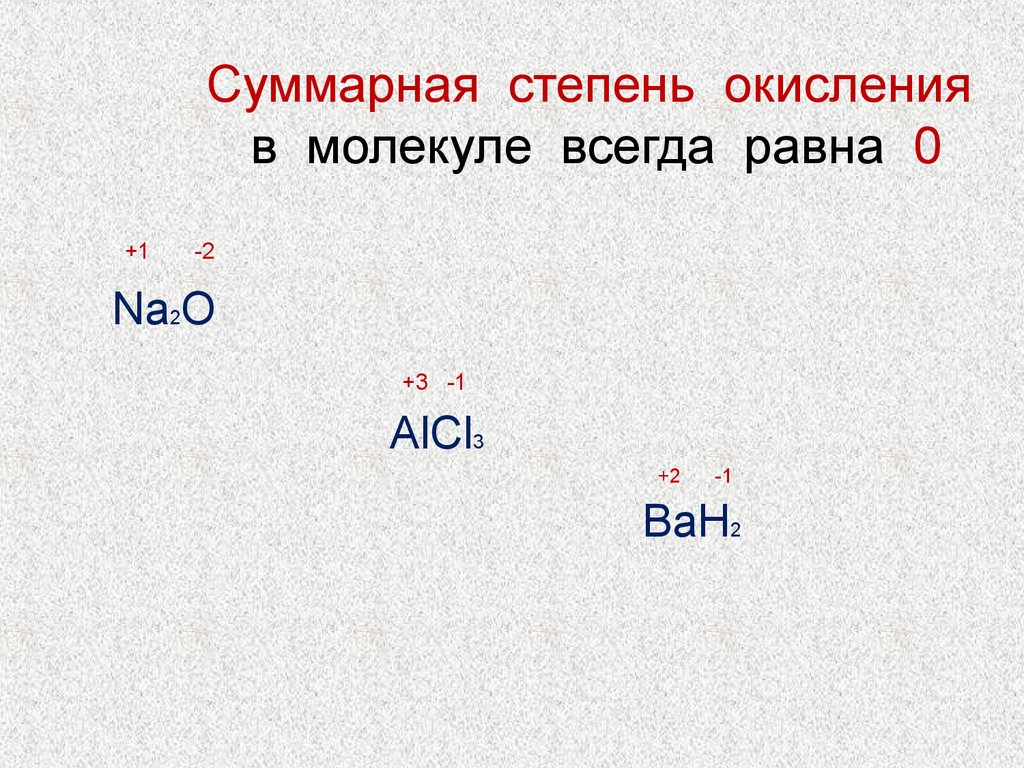 Только при условии равенства отмеченных произведений общий заряд вещества будет равен нулю. Если вычисленная степень окисления превышает крайние значения, определяемые строением атома, то вычисление следует начинать с другого элемента данного соединения.
Только при условии равенства отмеченных произведений общий заряд вещества будет равен нулю. Если вычисленная степень окисления превышает крайние значения, определяемые строением атома, то вычисление следует начинать с другого элемента данного соединения.
В примере —4
h3+?O2-2
неправильно начато определение степеней окисления.
Для водорода она оказалась равной +2, т.е. несуществующей с точки зрения строения его атома.
Закрепление умения определять степени окисления мы проводим на формулах разнообразных бинарных соединений (Zn3N2, PBr3, C1F3, SO2, P2O3, O2F2, N2h5 и др.), в которых величина степени окисления выражается целыми числами.
Вычислять степень окисления по формулам веществ, состоящих из трех элементов, мы начинаем при изучении классов кислот, оснований и солей. После записи формул h3SO4 и Na2СO3 предлагаем обучающимся сравнить ЭО элементов каждого соединения.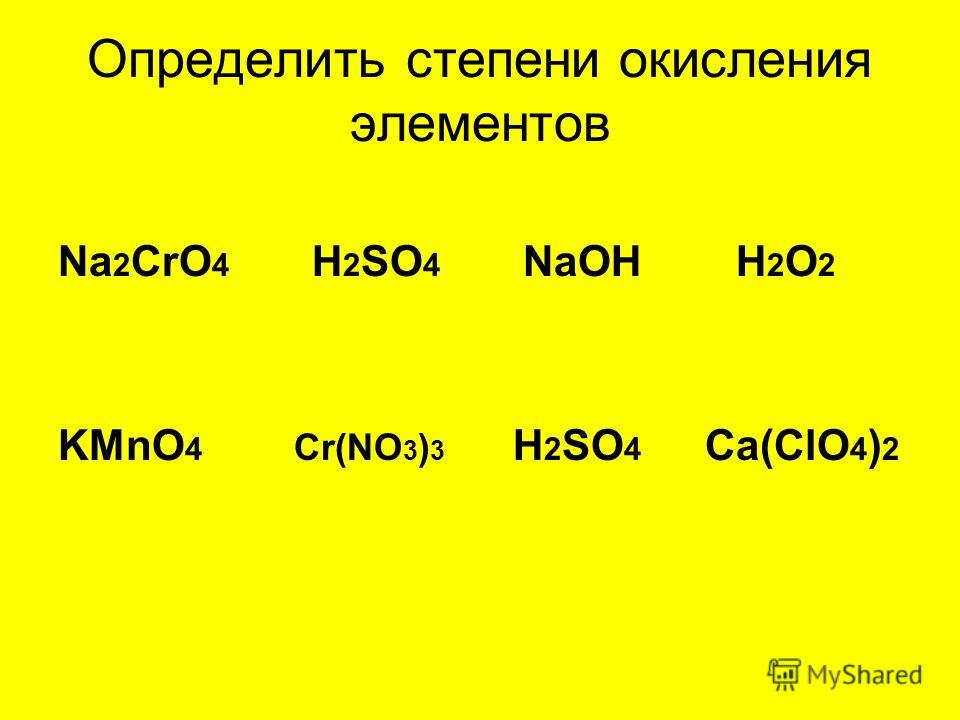 Наиболее электроотрицательным элементом в этих соединениях является кислород, а наименее электроотрицательными — водород и натрий. На основании этого названным элементам приписываем степени окисления и умножением их на индексы находим произведения:
Наиболее электроотрицательным элементом в этих соединениях является кислород, а наименее электроотрицательными — водород и натрий. На основании этого названным элементам приписываем степени окисления и умножением их на индексы находим произведения:
+2 —8
h3+ S ?O4-
+2 —6
Na2+ C ?O3-2
Величину степени окисления атома серы находим, исходя из знакомого правила: сумма зарядов всех элементов данного вещества равна нулю. Сравнением величин положительных и отрицательных зарядов (+2, и -8) устанавливается знак и величина степени окисления атома серы в серной кислоте. Она равна +6. По аналогии находим степень окисления атома углерода в карбонате натрия. Она равна +4. Умение вычислять степени окисления в сложных веществах, состоящих из трех элементов, обучающиеся отрабатывают на примерах CuSO4, h3SO3, LiNO3, CaCO3, Al2(SO4)3, KMnO4 и др.
Автор материала: Мухамедзянова Светлана Дмитриевна
Поделиться с друзьями
Азбука народной мудрости на уроках русского языкаПрофессиональная адаптация молодого педагога
16.
 3: Степени окисления — электронный учет
3: Степени окисления — электронный учет- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 47578
Окислительно-восстановительные реакции связаны с переносом электронов от одного вещества к другому, поэтому полезно иметь систему для отслеживания того, какие электроны получают, а какие теряют, и сколько электронов задействовано. Система учета окислительно-восстановительных реакций называется Числа окисления. Вы также можете помнить что-то под названием электроотрицательность из предыдущих уроков химии.
Электроотрицательность
Способность связанного атома притягивать к себе общие электроны.
Когда два атома разных элементов связаны друг с другом ковалентной связью (общие электроны), электроны, как правило, распределяются между двумя атомами неравномерно из-за различий в их электроотрицательности. Думайте об этом как о перетягивании каната для электронов. Иногда оба атома с одинаковой силой притягивают общие электроны; в других случаях явно есть более сильный игрок, который будет притягивать электроны ближе к себе.
Рассмотрим связь между атомом водорода (с одним валентным электроном) и атомом кислорода (с его шестью валентными электронами):
Поскольку кислород имеет более высокую электроотрицательность, чем водород, общие электроны находятся ближе к атому кислорода, чем к атому водорода. Это не полный перенос электронов, который создал бы ион, но частичные заряды действительно формируются. Водородный конец связи частично положительный (+1), потому что он частично потерял один электрон, а кислородный конец H – O частично отрицательный (-1), потому что он частично получил один электрон от водорода:
Однако наша молекула неполная, потому что вокруг кислорода есть одинокий электрон. Добавим еще один водород, чтобы завершить нашу молекулу воды:
Добавим еще один водород, чтобы завершить нашу молекулу воды:
Мы видим, что каждый из двух атомов водорода «отдал» один электрон кислороду. Кислород «приобрел» два электрона — по одному от каждого водорода. Опять же, это не настоящие ионы, но полезно думать о них таким же образом.
Заряды, сообщаемые таким образом атомам в молекуле, называются степенями окисления . Мы можем использовать степени окисления, чтобы отслеживать, где находятся электроны в молекуле и как они перемещаются во время реакции. В нашем примере с водой водороду присвоена степень окисления +1, потому что каждый отдельный водород «потерял» один электрон. Кислород имеет степень окисления +2, потому что один атом кислорода «приобрел» всего два электрона, по одному от каждого водорода.
Вот еще одна молекула, включающая водород и кислород — перекись водорода, H 2 O 2 :
В перекиси водорода каждый водород по-прежнему имеет степень окисления +1, потому что каждый водород «отдает» один электрон кислороду. Кислород, однако, теперь имеет степень окисления -1, потому что каждый кислород получает только один электрон от соседнего водорода. Электроны между двумя одинаковыми атомами кислорода распределяются поровну, поэтому в результате этой связи нет частичного заряда.
Кислород, однако, теперь имеет степень окисления -1, потому что каждый кислород получает только один электрон от соседнего водорода. Электроны между двумя одинаковыми атомами кислорода распределяются поровну, поэтому в результате этой связи нет частичного заряда.
Число окисления
Положительное или отрицательное число, присвоенное атому в молекуле или ионе, которое отражает частичное приобретение или потерю электронов.
Знание степени окисления каждого отдельного элемента в молекуле будет ключевым шагом в нашем понимании окислительно-восстановительных реакций. К счастью, это обычно не связано с рисованием электронных точечных диаграмм. Вместо этого существует ряд правил, которые мы можем использовать для определения степени окисления. Вот основные правила:
| 1. | Степень окисления чистого элемента (самого по себе, а не иона) равна нулю. |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ElementIonicCompoundCompoundCompound+14 total2 Mn atomsCompound+122Compound»> 2. | Степень окисления одноатомного иона (само по себе или в составе ионного соединения) равна его заряду. Щелочные металлы — элементы в первом столбце периодической таблицы — всегда будут иметь степень окисления +1; Щелочноземельные металлы (столбец 2) почти всегда +2. |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ElementIonicCompoundCompoundCompound+14 total2 Mn atomsCompound+122Compound»> 3. | Степень окисления водорода почти всегда равна +1, когда он находится в соединении. |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ElementIonicCompoundCompoundCompound+14 total2 Mn atomsCompound+122Compound»> 4. | Степень окисления кислорода почти всегда равна -2, когда он находится в соединении. Исключения:
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ElementIonicCompoundCompoundCompound+14 total2 Mn atomsCompound+122Compound» valign=»top»> 5. | Сумма степеней окисления в соединении равна нулю. Чтобы определить степень окисления Mn в Mn 2 O 7 , мы должны работать в обратном порядке:
-2 × 7 атомов = -14 всего Поскольку сумма степеней окисления должна быть равна нулю, общая степень окисления Mn должна быть +14, чтобы нейтрализовать -14 кислорода, но поскольку имеется 2 атома Mn, каждый отдельных атома будет иметь степень окисления +7:
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ElementIonicCompoundCompoundCompound+14 total2 Mn atomsCompound+122Compound»> | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6. | Сумма степеней окисления многоатомного иона равна заряду этого иона. Снова действуйте в обратном порядке, чтобы определить степень окисления любого атома, отличного от кислорода или водорода. Для определения степени окисления Cr в Cr 2 O 7 2 — :
-2 × 7 = -14
+12 + (-14) = -2
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Важно отметить, что степень окисления всегда относится к каждый отдельный атом в соединении, а не в сумме для этого элемента.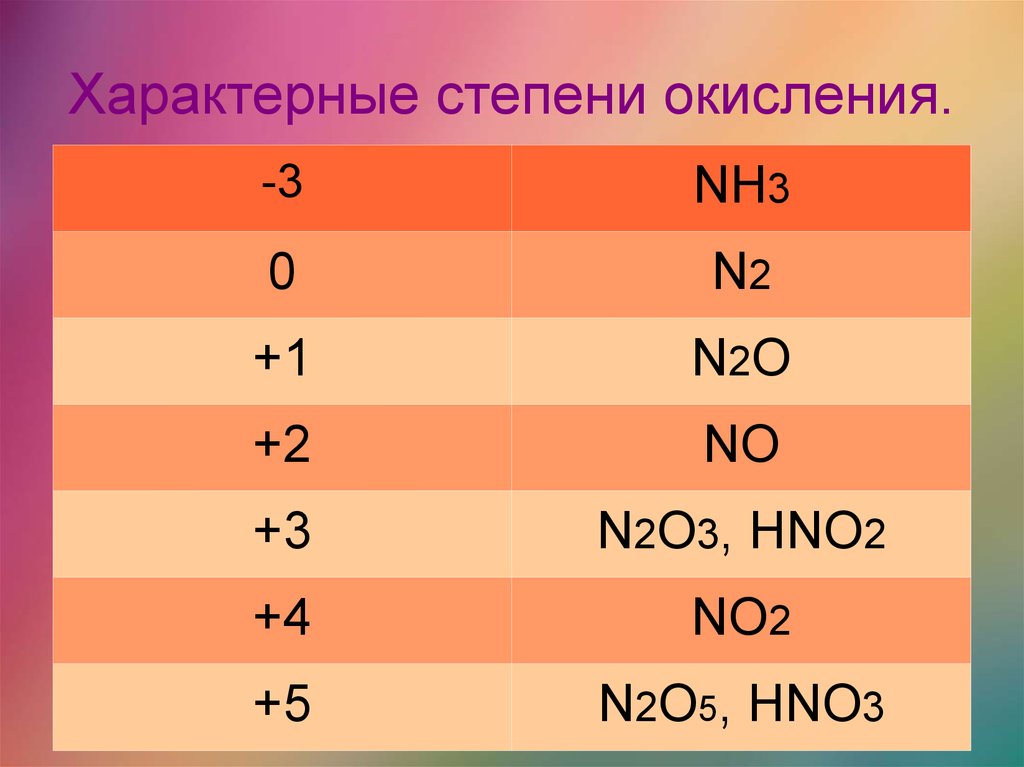
Например, в H 2 O общий положительный «заряд» обоих атомов водорода будет +2 (что уравновешивается -2 от кислорода), но каждый водород имеет степень окисления +1.
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- СК-12
- Показать страницу TOC
- № на стр.
- Теги
- автор@Генри Агнью
- автор@Мариса Альвиар-Агнью
- источник@https://www.
 ck12.org/c/chemistry/
ck12.org/c/chemistry/
Какова степень окисления кислорода в оксиде, пероксиде и супероксиде.
Last updated date: 14th Feb 2023
•
Total views: 263.1k
•
Views today: 4.52k
Answer
Verified
263.1k+ views
Hint: To find the answer на этот вопрос правильно напишите формулы ионов оксида, пероксида и супероксида. Здесь все три из них имеют атомы одного и того же элемента, поэтому, чтобы найти степень окисления, вы можете разделить заряд иона на количество атомов, присутствующих в атоме.
Полный пошаговый ответ:
Прежде чем найти степень окисления кислорода в данных оксидах, мы обсудим несколько общих правил, которые мы должны помнить, пытаясь найти степени окисления различных элементов.
— Мы должны знать, что степень окисления свободного элемента равна 0.
— Если у нас есть одноатомный ион, то его степень окисления равна заряду на нем. Оно может быть положительным, отрицательным или нейтральным.
— Степень окисления кислорода обычно равна -2, но в некоторых случаях может быть -1 или $\left(-\dfrac{1}{2} \right)$. Сумма степеней окисления всех атомов в нейтральном соединении равна 0. Если соединение имеет общий заряд, сумма всех степеней окисления будет равна этому заряду. Степень окисления водорода в большинстве случаев равна +1, но у менее электроотрицательных элементов она может быть и -1. 9{1-}$ .
Здесь у нас есть 2 атома кислорода и заряд -1, который равномерно распределен между двумя атомами.
Следовательно, степень окисления каждого атома будет $-\dfrac{1}{2}$ .
Из приведенного выше обсуждения видно, что кислородное число кислорода в оксиде равно -2, в пероксиде равно -1 и в супероксиде равно $-\dfrac{1}{2}$ , таким образом, это правильный ответ.
Примечание: Степень окисления – это степень окисления, т.

 Метод молекулярных орбиталей. Теория спин-валентности
Метод молекулярных орбиталей. Теория спин-валентности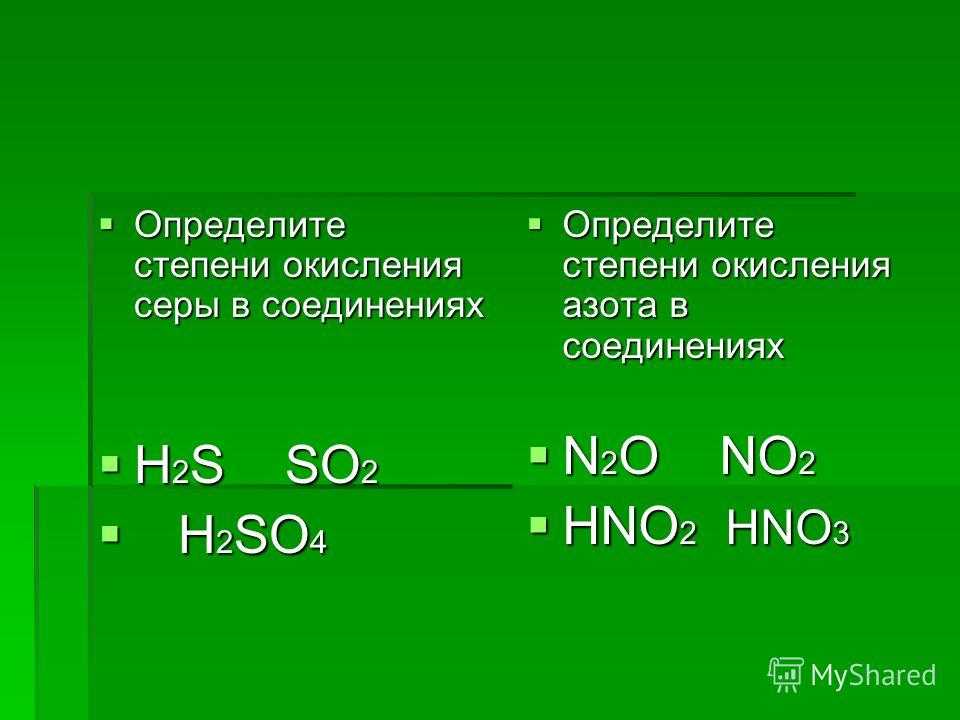
 Полученное произведение запоминают или записывают над чертой, проведенной выше степени окисления:
Полученное произведение запоминают или записывают над чертой, проведенной выше степени окисления: 
 ck12.org/c/chemistry/
ck12.org/c/chemistry/