О серной кислоте
Что такое серное кислота ?
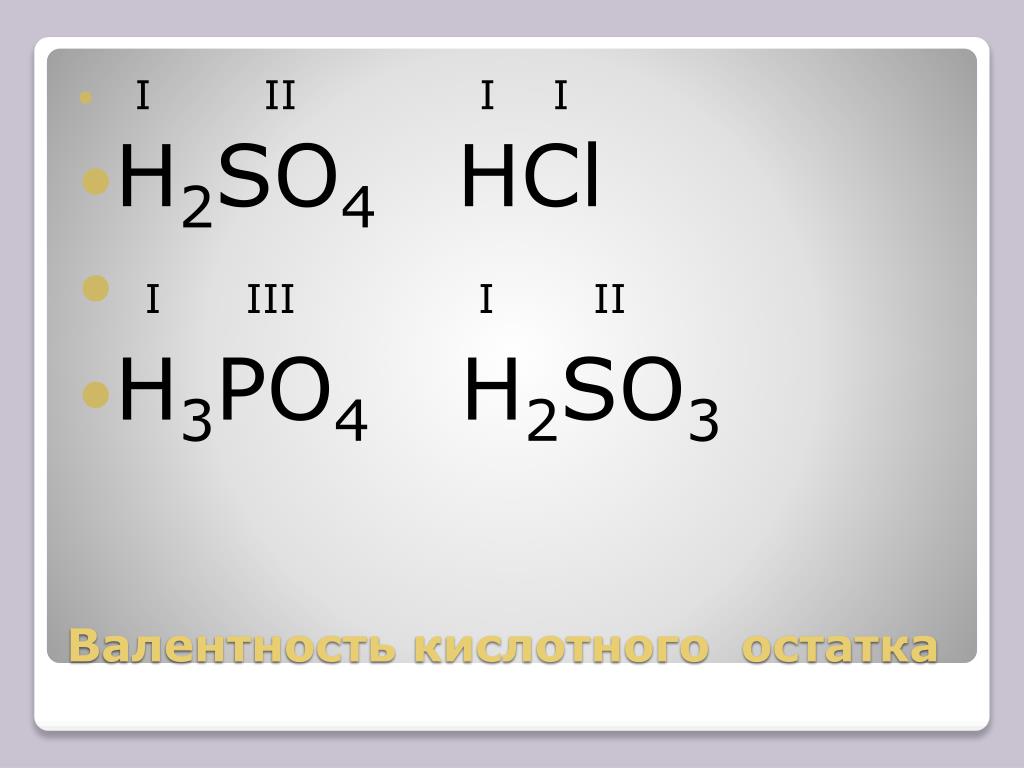
Серная кислота является одним из самых известных и распространённых химических соединений. Объясняется это в первую очередь её ярко выраженными свойствами. Её формула — h3SO4. Это двухосновная кислота, обладающая высшей степенью окисления серы +6. При обычных условиях серная кислота представляет собой жидкость без запаха и цвета, обладающую маслянистыми свойствами. Она получила достаточно широкое распространение в технике и различных отраслях производства. На данный момент это вещество является одним из важнейших и наиболее распространённых продуктов химической промышленности. В природе залежи самородной серы попадаются не так часто, как правило, она встречается только в соединениях с другими веществами. Сейчас развивается добыча серы из различных соединений, в том числе из разнообразных промышленных отходов. В некоторых случаях даже газы цветной металлургии могут быть приспособлены для получения серы и различных соединений с ней.
Свойства серной кислоты
Серная кислота пагубным образом влияет на любые органические соединения. Она забирает из них воду очень быстро, так что ткани и различные соединения начинают обугливаться. 100%-ная кислота является одной из самых сильных, при этом соединение не дымит и не разрушает чёрные металлы. Разбавленная серная кислота реагирует с любыми металлами кроме свинца. В концентрированном виде начинает окислять многие элементы.
Использование серной кислоты
Главным образом серная кислота применяется в химической промышленности, где на её основе производят азотные и фосфорные удобрения, в том числе и суперфосфат, который на данный момент считается одним из наиболее распространённых удобрений. Ежегодно производят до нескольких миллионов тонн этого вещества. В металлругии h3SO4 применяется для проверки качества получаемых изделий. При прокате стали могут возникать микротрещины, для того чтобы их обнаружить, деталь помещают в свинцовую ванну и травят 25%-м раствором кислоты. После этого даже мельчайшие трещины можно увидеть невооружённым взглядом. Перед нанесением гальванопокрытий на металл необходимо его предварительно подготовить — зачистить и обезжирить. Так как серная кислота реагирует с металлами, она растворяет тончайший слой, а вместе с ним удаляются любые следы загрязнения. Кроме того, поверхность металла становится более шершавой, что лучше подходит для нанесения никелевого, хромового или медного покрытия. Серная кислота применяется при обработке некоторых руд, также значительное её количество требуется в нефтяной промышленности, где её применяют главным образом для очистки различных продуктов. Она часто используется в химической промышленности, которая постоянно развивается. В результате обнаруживаются дополнительные возможности и способы применения. Это вещество может использоваться для производства свинцово-кислотных источников тока — различных аккумуляторов.
После этого даже мельчайшие трещины можно увидеть невооружённым взглядом. Перед нанесением гальванопокрытий на металл необходимо его предварительно подготовить — зачистить и обезжирить. Так как серная кислота реагирует с металлами, она растворяет тончайший слой, а вместе с ним удаляются любые следы загрязнения. Кроме того, поверхность металла становится более шершавой, что лучше подходит для нанесения никелевого, хромового или медного покрытия. Серная кислота применяется при обработке некоторых руд, также значительное её количество требуется в нефтяной промышленности, где её применяют главным образом для очистки различных продуктов. Она часто используется в химической промышленности, которая постоянно развивается. В результате обнаруживаются дополнительные возможности и способы применения. Это вещество может использоваться для производства свинцово-кислотных источников тока — различных аккумуляторов.
Получение серной кислоты
Главным сырьём для получения кислоты служат сера и различные соединения на её основе. Кроме того, как уже было сказано, сейчас развивается использование промышленных отходов для получения серы. При окислительном обжиге сульфидных руд отходящие газы содержат SO2. Его приспосабливают для получения серной кислоты. Хотя в России по-прежнему лидирующие позиции занимают производства на основе переработки серного колчедана, который сжигают в печах. При продувании воздуха через горящий колчедан образуются пары с высоким содержанием SO2. Для очистки от других примесей и опасных паров применяют электрофильтры. Сейчас в производстве активно используются разные способы получения кислоты, и многие из них связаны с переработкой отходов, хотя высока доля традиционных производств.
Кроме того, как уже было сказано, сейчас развивается использование промышленных отходов для получения серы. При окислительном обжиге сульфидных руд отходящие газы содержат SO2. Его приспосабливают для получения серной кислоты. Хотя в России по-прежнему лидирующие позиции занимают производства на основе переработки серного колчедана, который сжигают в печах. При продувании воздуха через горящий колчедан образуются пары с высоким содержанием SO2. Для очистки от других примесей и опасных паров применяют электрофильтры. Сейчас в производстве активно используются разные способы получения кислоты, и многие из них связаны с переработкой отходов, хотя высока доля традиционных производств.
Отравление серной кислотой и первая помощь
При отравлении парами серной кислоты возникает раздражение и ожог глаз, слизистых оболочек носоглотки, гортани, носовые кровотечения, боль в горле, охриплость голоса из-за спазма голосовой щели. При этом особенно опасны отеки гортани и легких. Первая помощь состоит в обеспечении пострадавшему свежего воздуха. Необходимо промыть рот и зев раствором соды (20 грамм питьевой соды на 1 литр воды).
Необходимо промыть рот и зев раствором соды (20 грамм питьевой соды на 1 литр воды).
При попадании серной кислоты на кожу возникают химические ожоги, глубина и тяжесть которых определяются концентрацией кислоты и площадью ожога. Пораженное место необходимо обильно промыть водой.
При поступлении серной кислоты внутрь немедленно после приема появляются резкие боли в области рта и всего пищеварительного тракта, сильная рвота с примесью сначала алой крови, а затем бурыми массами. Одновременно с рвотой начинается сильный кашель. Развивается резкий отек гортани и голосовых связок, вызывающий резкие затруднения дыхания. Кожа лица принимает темно-синий цвет, зрачки расширяются. Отмечается падение и ослабление сердечной деятельности. Смертельная доза серной кислоты при поступлении внутрь – 5 миллиграммов.
Первая помощь при отравлении — осторожное промывание желудка. Затем больной должен принимать жженую магнезию или известковую воду каждые 5 минут по 1 столовой ложке. Полезно обильное питье воды со льдом, молоко, сырой яичный белок, жиро- и маслосодержащие продукты, слизистые отвары.
Полезно обильное питье воды со льдом, молоко, сырой яичный белок, жиро- и маслосодержащие продукты, слизистые отвары.
Степень — окисление — сера
Cтраница 3
Наряду с описанным рядом превращений ( сульфиды — h3S — — S — h3S04 — сульфаты), наблюдаемых в природе и ведущих к повышению степени окисления серы, происходят восстановительные процессы, приводящие снова к образованию сероводорода. [31]
Наряду с описанным рядом превращений ( сульфиды — — Ш5 — S — — НгЗСЧ — сульфаты), наблюдаемых в природе и ведущих к повышению степени окисления серы, происходят восстановительные процессы, приводящие снова к образованию сероводорода. [32]
Наряду с описанным рядом превращений ( сульфиды — h3S — — — S — h3SO4 — — сульфаты), наблюдаемых в природе и ведущих к повышению степени окисления серы, происходят восстановительные процессы, приводящие снова к образованию сероводорода. [33]
Большая часть образовавшихся сульфатов уносилась водами рек в моря, при усыхании которых образовались пласты минералов ( главным оС: азом, гипса CaSO4 — 2h3O), Наряду с описанным рядом превращений ( сульфиды — h3S — — S — — — h3SO4 — сульфаты), наблюдаемых в природе и ведущих к повышению [34]
[34]
Степени окисления серы — 1 и 5 встречаются и в других соединениях [ например, в (1.138) и (1.144) ], для которых неполярность связи S — S достаточно очевидна. [35]
Как изменяется степень окисления серы и ртути. [36]
Как и оксид серы ( IV), сернистая кислота и ее соли являются сильными восстановителями. При этом степень окисления серы возрастает. [37]
Как и двуокись серы, сернистая кислота и ее соли являются сильными восстановителями. При этом степень окисления серы возрастает. [38]
Сульфид меди CuS реагирует с горячей азотной кислотой с образованием газообразного NO и элементарной серы. Изменяются только степени окисления серы S и азота N. [39]
Если на ТИКОСе степень окисления меркаптидной серы за 90 мин. КС-2 уже за 72 мин. Содержание меркаптановой серы в отдуве на КС-2 не превышает 0 8 % мае. [40]
Достоверно установлено существование только одной ее соли CoSO2 — сульфокси-лата кобальта. Формально такой же степенью окисления серы 2 характеризуются атомы серы в тиосерной кислоте Н28гОз и ее солях — тиосульфатах.
[41]
Формально такой же степенью окисления серы 2 характеризуются атомы серы в тиосерной кислоте Н28гОз и ее солях — тиосульфатах.
[41]
Достоверно установлено существование только одной ее соли CoSO2 — сульфоксилата кобальта. Формально такой же Степенью окисления серы 2 характеризуются атомы серы в тиосернои кислоте h3S2O3 и ее солях — тиосульфатах. [42]
Достоверно установлено существование только одной ее соли CoS02 — сульфокси-лата кобальта. Формально такой же
У этих соединений более ярко выражена восстановительная функция. Продуктами окисления S являются устойчивые соединения со степенью окисления серы 6: серная кислота или ее соли. [44]
При проведении этого опыта иногда на — стенках средней части пробирки появляется желтый налет. Это продукт параллельно протекающей окислительно-восстановительной реакции, в результате которой степень окисления серы достигает лишь нулевого, а не самого низкого значения. [45]
[45]
Страницы: 1 2 3
Олово: его степени окисления и реакции с ним
Похоже, вы зашли на наш сайт из Германия . Пожалуйста, перейдите на наш региональный сайт для получения более актуальных цен, сведений о продуктах и специальных предложениях.
Выбрать другую страну
Химические свойства олова
[Депозитные фотографии] Олово — легкий металл, расположенный в 14-й группе таблицы Менделеева, с атомным номером 50. Этот элемент известен человечеству с древних времен и считался одним из самых редких и ценных металлов, поэтому предметы, изготовленные из олова могли себе позволить только самые богатые жители Римской империи и Древней Греции. Из олова делали специальную бронзу, которая использовалась еще в 3-м тысячелетии до нашей эры. Бронза стала самым прочным и популярным сплавом, а олово использовалось в качестве одного из ее компонентов и использовалось более 2000 лет.
Бронза стала самым прочным и популярным сплавом, а олово использовалось в качестве одного из ее компонентов и использовалось более 2000 лет.
На латыни этот металл назывался «stannum», что означает прочность и выносливость, но ранее это название давали сплаву свинца и серебра. Только в IV веке это слово было присвоено самому олову .
Этот металл редко встречается в природе, он является лишь 47-м по распространенности элементом в земной коре и добывается из касситерита, так называемого оловянного камня, в котором содержится около 80 % этого металла.
Касситерит [Депозитные фотографии]Использование в промышленности
Поскольку олово является нетоксичным и очень прочным металлом, оно используется в сплавах с другими металлами, но в основном используется для производства жести, которая используется для банок, припоев в электронике и для производства бронзы. .
.
Физические свойства олова
Металл белого цвета с серебристым блеском
Слева: белая жесть; справа: серая жесть [Викимедиа]При нагревании олово трескается из-за трения кристаллов друг о друга. Этот характерный треск слышен, если кусок жести просто согнуть.
Олово очень ковкое и пластичное. В классических условиях этот элемент существует в виде «белого олова», которое может видоизменяться в зависимости от температуры, например, если белое олово находится на морозе, оно превращается в серое олово, имеющее структуру, подобную алмазу. Между прочим, серое олово очень хрупкое и превращается в порошок прямо на глазах. По этой причине в истории существует термин «оловянная чума».
via GIPHY
Люди не знали об этом свойстве олова, поэтому из него делали пуговицы и кружки для солдат, а также другие полезные предметы, которые после пребывания на морозе превращались в порошок. Это ставило армии в невыгодное положение. Например, некоторые историки считают, что это свойство олова снижало боеспособность армии Наполеона.
Это ставило армии в невыгодное положение. Например, некоторые историки считают, что это свойство олова снижало боеспособность армии Наполеона.
Получение олова
Основным методом получения олова является восстановление металла из руды, содержащей оксид олова(IV), углем, алюминием или цинком.
SnO₂ + C = Sn + CO₂.
Олово особо чистое получают электрохимическим рафинированием или методом зонной плавки.
Химические свойства олова
При комнатной температуре олово достаточно устойчиво к воздействию воздуха или воды, так как на поверхности металла образуется тонкая оксидная пленка. На воздухе олово начинает окисляться при температуре выше 150°С:
Sn + O₂ → SnO₂.
Волокна SnO₂ (оптический микроскоп) [Викимедиа] Если олово нагреть, элемент будет реагировать с большинством неметаллов, образуя соединения со степенью окисления +4, что более характерно для этого элемента.
Sn + 2Cl₂ → SnCl₄
Взаимодействие олова и концентрированной соляной кислоты происходит достаточно медленно:
Sn + 4HCl → H₂[SnCl₄] + H₂ вообще не вступают в реакцию с разбавленной серной кислотой.
Очень интересна реакция олова с азотной кислотой, которая зависит от концентрации раствора. Реакция протекает с образованием оловянной кислоты H₂SnO₃, которая представляет собой белый аморфный порошок.
3Sn + 4HNO₃ + nH₂O = 3H₂SnO₃·nH₂O + 4NO
Если олово смешать с разбавленной азотной кислотой, элемент проявит металлические свойства с образованием нитрата олова.
4Sn + 10HNO₃ = 4Sn(NO3)₂ + NH4NO₃ + 3H₂O
Если олово нагреть, оно может реагировать со щелочами с выделением водорода.
Sn + 2KOH + 4H₂O = K₂[Sn(OH)₆] + 2H₂
Здесь вы найдете удивительные и безопасные эксперименты с оловом
Степени окисления олова – обычная степень окисления олова нуль.
Sn также может иметь степень окисления +2: оксид олова (II) SnO, хлорид олова (II) SnCl₂, гидроксид олова (II) Sn(OH)₂.
Степень окисления +4 наиболее характерна для этого элемента в оксиде олова(IV) SnO₂ и галогенидах(IV), например SnCl4, сульфиде олова(IV) SnS₂ и нитриде олова(IV) Sn₃N₄.
У нас есть для вас еще статьи по химии:
- Гироскоп-спиннер Почему спиннер не хочет падать?
- Взрывное серебро Как сделать взрыв из серебра
Вы можете провести десятки химических опытов дома!
Трансмутация
Учить больше
Попытайся
типов-химических-реакций-рабочий-документ — Googlesuche
AlleBilderVideosBücherMapsNewsShopping
suchoptionen
[DOC] Types of Chemical Reaction Worksheet — LPS
› Химические веб-сайты › Reaction web. lps.org
lps.org
Укажите, какой тип химической реакции (синтез, разложение, однократное замещение, двойное замещение или горение) представлен цифрами от 7 до 20.
[DOC] Таблица типов химических реакций
mpcs.instructure.com › курсы › файлы › скачать
Таблица типов химических реакций. Сбалансируйте реакции от 1 до 6 и укажите, какой тип химической реакции (синтез, разложение, …
[DOC] Пять типов химических реакций. Ответы на рабочий лист
nanchang2.weebly.com › uploads › worksheet_1_types_of_chem
Five Types рабочего листа химической реакции. Сбалансируйте следующие реакции и укажите, какой из шести типов химических реакций представлен:
[PDF] Рабочий лист «Типы химических реакций» — SCHOOLinSITES
content.schoolinsites.com › API › документы
Типы химических реакций. Сбалансируйте каждую из следующих реакций и определите каждый тип реакции: 1. ____ NaBr + ____ Ca(OH)2 → ___ CaBr2 + ____ . ..
..
[DOC] Типы химических реакций Рабочий лист Написание формул
www. npsd.k12.nj.us › cms › lib › Centricity › Domain › Types of Ch…
Types of Chemical Reactions Worksheet. Написание формул. Чтобы завершить химические реакции, вы должны уметь писать формулы для ионных соединений.
[DOC] ГЛАВА 5 — ХИМИЧЕСКИЕ РЕАКЦИИ — Berkeley City College
www.berkeleycitycollege.edu › somar › files › 2013/02 › Chapter5_…
Составление и балансировка химических уравнений; Типы реакций -. окислительно-восстановительные реакции; комбинированные реакции; реакции разложения; Одиночная замена …
[DOC] Глава 8 Рабочий лист №1
www.lcps.org › lib4 › Домен › Рабочий лист реакций 41415KEY
Рабочий лист реакций №4. Пишите сбалансированные продукты или «Нет RXN», если реакции не будет. … Тип реакции: ОДИНОЧНОЕ ЗАМЕЩЕНИЕ, ОКИСЛЕНИЕ.
[DOC] Шесть типов химических реакций. Рабочий лист
www.