Кислородосодержащие соединения серы 9 класс онлайн-подготовка на Ростелеком Лицей
Соединения со степенью окисления серы +4
Степень окисления +4 сера проявляет в диоксиде серы SO2, в соответствующей ему сернистой кислоте Н2SO3 и в ее солях – сульфитах.
Оксид серы (IV) SO2 (диоксид серы) представляет собой газообразное вещество с резким запахом. Диоксид серы способен обесцвечивать некоторые красители, поэтому используется для отбеливания бумаги. Диоксид серы является кислотным оксидом. Он способен реагировать со щелочами. В результате образуются соли – сульфиты. Например, раствор гидроксида калия поглощает диоксид серы:
SO2 + 2KOH = K2SO3 + Н2О
Диоксид серы может быть окислен до триоксида серы SO3. Эта обратимая экзотермическая реакция ускоряется катализатором на основе пентаоксида ванадия V2O5.
2SO2 + O2 = 2SO3 + Q
Раствор диоксида серы в воде часто называют сернистой кислотой, хотя вещества состава H2SO3 не обнаружено. Оксид серы (IV) обратимо взаимодействует с водой:
Оксид серы (IV) обратимо взаимодействует с водой:
SO2 + H2O ↔ H+ + HSO3—
Диссоциация по второй ступени протекает в меньшей степени:
HSO3— ↔ H+ + SO32-
Сульфиты реагируют с кислотами с образованием диоксида серы:
K2SO3 + 2НСl = SO2↑ + 2KCl + Н2О
Эта реакция ионного обмена протекает до конца вследствие того, что образуется диоксид серы, который уходит из сферы реакции.
Соединения со степенью окисления серы +6
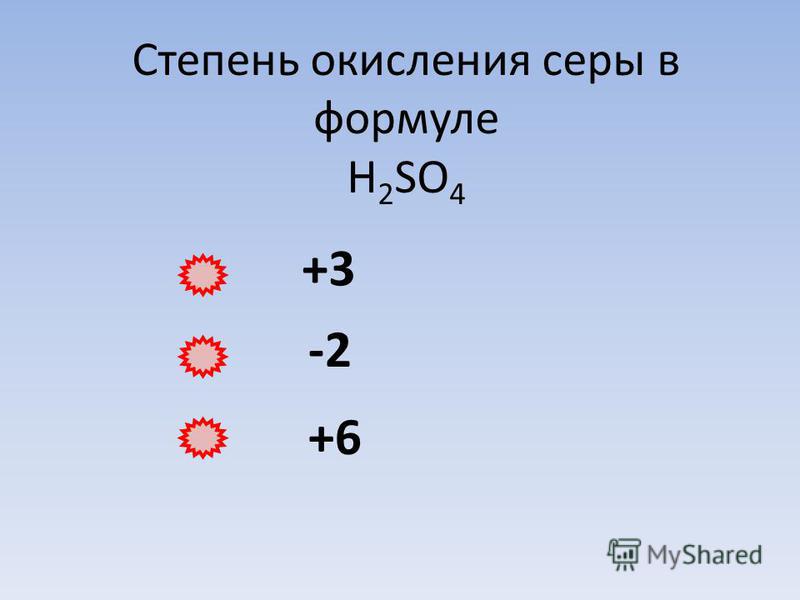
Сера проявляет высшую степень окисления +6 в оксиде серы (VI) SO3, серной кислоте – H2SO4, и в ее солях – сульфатах.
Оксид серы (VI) SO3 представляет собой бесцветное кристаллическое вещество, которое плавится уже при комнатной температуре и кипит при температуре +45 °С.
Оксид серы (VI) реагирует с водой. При этом образуется серная кислота:
При этом образуется серная кислота:
SO3 + H2O = H2SO4 + Q
В связи с этим оксид серы еще называется серный ангидрид.
Как типичный кислотный оксид, он реагирует со щелочами, например с гидроксидом натрия:
SO3 + 2NaOH = Na2SO4 + H2O
Для разбавленной серной кислоты характерны все общие свойства кислот. Она изменяет цвет индикаторов, реагирует с металлами, стоящими в ряду активности левее водорода, с основными оксидами и основаниями.
Концентрированная серная кислота – тяжелая бесцветная маслянистая жидкость, имеющая несколько особых химических свойств. Концентрированная серная кислота – сильный окислитель за счет серы, содержащейся в кислотном остатке. Например, она способна реагировать с медью:
Cu + 2H2SO4 = CuSO4 + SO2↑ + 2H2O
Концентрированная серная кислота при обычной температуре не реагирует с железом, алюминием и некоторыми другими металлами. Дело в том, что алюминий и железо покрыты прочными оксидными пленками, которые препятствуют их взаимодействию с кислотой. Это явление называется пассивация.
Дело в том, что алюминий и железо покрыты прочными оксидными пленками, которые препятствуют их взаимодействию с кислотой. Это явление называется пассивация.
Концентрированная серная кислота обугливает сахар и древесину, а также способна окислять и неметаллы, например, при нагревании она реагирует с углем:
2H2SO4 + C = 2SO
2 + CO2 + 2H2OРаспознавание серной кислоты и ее солей – сульфатов, можно провести с помощью реакции с хлоридом бария (рис. 1).
Рис. 1. Серная кислота и ее соли образуют с хлоридом бария белый осадок
Серная кислота и ее растворимые в воде соли реагируют с растворимыми солями бария, образуя белый осадок сульфата бария:
Ba2+ + SO42- = BaSO4↓
Список литературы
- Оржековский П. А. Сборник задач и упражнений по химии: 9 кл.: к учебнику П. А. Оржековского и др. «Химия. 9 класс» / П. А. Оржековский, Н.
 А. Титов, Ф. Ф. Гегеле. – М.: АСТ: Астрель, 2007.
А. Титов, Ф. Ф. Гегеле. – М.: АСТ: Астрель, 2007. - Оржековский П. А. Химия: 9 класс: учеб. для общеобраз. учрежд. / П. А. Оржековский, Л. М. Мещерякова, Л. С. Понтак. – М.: АСТ: Астрель, 2007 (§35).
- Оржековский П. А. Химия: 9 класс: учеб для общеобр. учрежд. / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013 (§22).
- Рудзитис Г. Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009.
- Хомченко И. Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008.
- Энциклопедия для детей. Том 17. Химия / Глав. ред. В. А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Единая коллекция цифровых образовательных ресурсов (видеоопыты по теме) (Источник)
- Электронная версия журнала «Химия и жизнь» (Источник)
Домашнее задание
с.
Лучший ответ по мнению автора
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
При действии избытка раствора щелочи на 122,5 г смеси Al, CuO, Fe2O3 Выделилось 33,6 л газа (н.
как смыть краску с денежных купюр
Решено
FeSO4+KClO3+h3SO4=Fe2(SO4)3+KCl+h3O
закон сохранения массы веществ,превращения энергии при химических реакциях,закон постоянства состава.
Решено
задача по физ.химии
Пользуйтесь нашим приложением
Цисплатин 3. Окислительно-восстановительная химия — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 2900
- ChemCases
- Государственный университет Кеннесо
Перенос электронов от одного вида к другому называется окислительно-восстановительной химией или окислительно-восстановительной химией. Окисление относится к потере электронов, тогда как восстановление относится к приобретению электронов. При обсуждении окислительно-восстановительной химии полезно присваивать степени окисления элементам, подвергающимся переносу электронов. Использование степеней окисления — это метод бухгалтерского учета, который химики используют для отслеживания электронов. Степень окисления определяется так, что окисление соответствует увеличению степени окисления, а восстановление соответствует уменьшению степени окисления. Другой способ думать о окислительно-восстановительной химии и степенях окисления состоит в том, что в окислительно-восстановительной химии мы преувеличиваем ионный характер связей; другими словами, окислительно-восстановительная химия основана на представлении, в котором атомы изображаются как ионы. Присвоение степеней окисления требует соблюдения трех правил: 9{2-}\) равно -2.)
Окисление относится к потере электронов, тогда как восстановление относится к приобретению электронов. При обсуждении окислительно-восстановительной химии полезно присваивать степени окисления элементам, подвергающимся переносу электронов. Использование степеней окисления — это метод бухгалтерского учета, который химики используют для отслеживания электронов. Степень окисления определяется так, что окисление соответствует увеличению степени окисления, а восстановление соответствует уменьшению степени окисления. Другой способ думать о окислительно-восстановительной химии и степенях окисления состоит в том, что в окислительно-восстановительной химии мы преувеличиваем ионный характер связей; другими словами, окислительно-восстановительная химия основана на представлении, в котором атомы изображаются как ионы. Присвоение степеней окисления требует соблюдения трех правил: 9{2-}\) равно -2.)
Кроме того, есть несколько элементов, которые имеют определенные значения степени окисления:
- Степень окисления водорода +1 при соединении с неметаллом и -1 при соединении с металлом.
 Причина этого в том, что водород менее электроотрицателен, чем неметаллы. Когда мы рассматриваем связь водород-неметалл как ионную связь , водород отдает свой электрон неметаллу, что приводит к степени окисления +1 для H. Например, в молекуле воды два атома водорода связаны с атомом кислорода. атом (неметалл, равный более электроотрицательнее, чем водород). H имеет степень окисления +1, а O имеет степень окисления -2. (Вновь сформулируем правило № 3 выше: сумма степеней окисления в нейтральной молекуле равна 0.) Степень окисления атомов водорода в связях металл-водород также можно объяснить разницей в электроотрицательности между H и M. Водород более электроотрицательный. чем металлы. Следовательно, при ионной обработке связи металл-водород атом металла отдает электрон атому водорода, что приводит к степени окисления -1 для H. Например, в гидриде натрия (NaH) натрий имеет степень окисления +1, тогда как водород имеет степень окисления -1.
Причина этого в том, что водород менее электроотрицателен, чем неметаллы. Когда мы рассматриваем связь водород-неметалл как ионную связь , водород отдает свой электрон неметаллу, что приводит к степени окисления +1 для H. Например, в молекуле воды два атома водорода связаны с атомом кислорода. атом (неметалл, равный более электроотрицательнее, чем водород). H имеет степень окисления +1, а O имеет степень окисления -2. (Вновь сформулируем правило № 3 выше: сумма степеней окисления в нейтральной молекуле равна 0.) Степень окисления атомов водорода в связях металл-водород также можно объяснить разницей в электроотрицательности между H и M. Водород более электроотрицательный. чем металлы. Следовательно, при ионной обработке связи металл-водород атом металла отдает электрон атому водорода, что приводит к степени окисления -1 для H. Например, в гидриде натрия (NaH) натрий имеет степень окисления +1, тогда как водород имеет степень окисления -1. - Степень окисления кислорода почти всегда равна -2.
 Это также можно объяснить на основе электроотрицательности. Кислород является вторым наиболее электроотрицательным элементом после фтора. Следовательно, при ионной обработке связи, содержащей кислород и другой элемент, за исключением фтора, кислород примет два электрона и примет степень окисления -2. Например, в сульфат-ионе (SO42-) каждый кислород имеет степень окисления -2, тогда как сера имеет степень окисления +6. (Опять же, см. правило № 3 выше: общий заряд иона = -2 = 4 x [число оксидов O] + [количество оксидов S].)
Это также можно объяснить на основе электроотрицательности. Кислород является вторым наиболее электроотрицательным элементом после фтора. Следовательно, при ионной обработке связи, содержащей кислород и другой элемент, за исключением фтора, кислород примет два электрона и примет степень окисления -2. Например, в сульфат-ионе (SO42-) каждый кислород имеет степень окисления -2, тогда как сера имеет степень окисления +6. (Опять же, см. правило № 3 выше: общий заряд иона = -2 = 4 x [число оксидов O] + [количество оксидов S].) - Степень окисления фтора всегда равна -1. Окисление других галогенов составляет -1, если только галоген не связан с кислородом или другим галогеном, стоящим выше в группе. Опять же, эти значения можно объяснить на основе различий в электроотрицательности. Фтор — самый электроотрицательный элемент из всех. Используя ионную модель, фтор всегда принимает электрон от атома, с которым он связан, что дает фтору как заряд -1, так и степень окисления -1.
 Другие атомы галогена также будут иметь степень окисления -1 , если только они не связаны с более электроотрицательным атомом, таким как кислород или другой галоген, находящийся выше в группе, такой как фтор. Например, в молекуле FI фтор имеет степень окисления -1, тогда как йод имеет степень окисления +1.
Другие атомы галогена также будут иметь степень окисления -1 , если только они не связаны с более электроотрицательным атомом, таким как кислород или другой галоген, находящийся выше в группе, такой как фтор. Например, в молекуле FI фтор имеет степень окисления -1, тогда как йод имеет степень окисления +1.
Вещество, вызывающее окисление, называется окислителем . Он делает это, принимая электроны от окисляемых частиц. Другими словами, окислитель восстанавливается. Согласно нашему бухгалтерскому методу расчета степеней окисления, окислитель содержит атом, который претерпевает понижение степени окисления. Точно так же вид, вызывающий сокращение, называется 9.0035 восстановитель . Восстановитель отдает электрон(ы) восстанавливаемым частицам. Следовательно, восстановитель сам окисляется и подвергается увеличению степени окисления. Например, в следующей окислительно-восстановительной реакции, которая происходит во время теста йодид калия-крахмал, описанного в модуле контрольных экспериментов, металл со степенью окисления +2 реагирует с ионом йодида. Предположим, что металлом является платина, и запишем степени окисления под каждым реагентом и продуктом: 90 + I_2 \номер \]
Предположим, что металлом является платина, и запишем степени окисления под каждым реагентом и продуктом: 90 + I_2 \номер \]
+2 2 х -1 0 0
В этом случае Pt 2 + (также называемый Pt(II)) реагирует с ионом йода с образованием Pt 0 (или Pt(0)) и йода. Используя наш метод учета степени окисления, мы видим, что степень окисления платины уменьшается на 2; следовательно, платина подвергается двухэлектронному восстановлению. Pt(II) действует как окислитель, окисляя йодид-ион до йода. Каждый из двух иодид-ионов подвергается одноэлектронному окислению с образованием одной молекулы I2, что в целом приводит к двухэлектронному окислению. Точно так же два йодид-иона действуют как восстановители, поскольку они восстанавливают Pt(II) до Pt(0). Как и во всех других химических реакциях, окислительно-восстановительные уравнения должны быть сбалансированы. При балансировке окислительно-восстановительных уравнений следует помнить два правила:
- Атомы должны уравновеситься.
 (В приведенном выше примере имеется один атом Pt и два атома I с каждой стороны реакции, поэтому атомы уравновешиваются.)
(В приведенном выше примере имеется один атом Pt и два атома I с каждой стороны реакции, поэтому атомы уравновешиваются.) - Суммарный заряд с каждой стороны должен сбалансироваться. (В приведенном выше примере заряд слева равен [+2 + 2(-1)] или вообще 0. Точно так же заряд справа равен [0 + 0] или вообще 0. Поэтому уравнение сбалансировано и по заряду.)
- Аткинс, П. В., Джонс, Л. Л. Химия: молекулы, материя и изменение; 3-е изд. WH Freeman and Company: Нью-Йорк, 19.97, глава 3: разделы с 3.12 по 3.15.
Эта страница под названием Cisplatin 3. Redox Chemistry распространяется под лицензией CC BY-NC-SA 4.0 и была создана, изменена и/или курирована ChemCases.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ChemCase
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- Чемодан
- Образец
- Петерсон
Видео с вопросами: Определение степени окисления серы в сульфат-ионе
Стенограмма видео
Что такое степень окисления сера в SO4 2-?
В этом вопросе нам нужно определить степень окисления элемента серы в сульфат-ионе.
Также указывается номер окисления
в качестве степени окисления. Степень окисления или окисление
состояние указывает количество электронов, потерянных или полученных атомом. Другими словами, это значение является
мера того, насколько окислен или восстановлен атом в химическом веществе. Отметим, что сульфат-анион
является многоатомным ионом, поскольку он имеет суммарный заряд. И он содержит несколько ковалентных
облигации. Это двухэлементная система. Он содержит элемент серы и
элемент кислород.
И он содержит несколько ковалентных
облигации. Это двухэлементная система. Он содержит элемент серы и
элемент кислород.
Мы можем разобраться с окислением число элементов, сначала глядя на их значения электроотрицательности. Электроотрицательность – это способность атом в связи, чтобы притягивать или притягивать связывающие электроны к себе. Сера имеет общепринятое значение электроотрицательности 2,58, а кислород имеет значение 3,44. Кислород очень электроноакцепторный и имеет одно из самых высоких чисел электроотрицательности среди всех химические элементы и, безусловно, выше, чем значение серы. Сера имеет гораздо более низкую число электроотрицательности. Теперь мы можем использовать значения электроотрицательности, чтобы начать присвоение степеней окисления.
Первый шаг в двухэлементной системе
например, мы присваиваем отрицательную степень окисления элементу с более высокой
электроотрицательность и положительную к элементу с меньшей электроотрицательностью. Итак, мы можем написать отрицательный знак
над атомом кислорода и положительный знак над атомом серы.
Итак, мы можем написать отрицательный знак
над атомом кислорода и положительный знак над атомом серы.
Шаг второй, к большему электроотрицательному элементу, присвойте его обычное значение изменения, которое он обычно образует как ион. Когда кислород заряжен, он обычно получает два электрона, поэтому мы пишем два рядом со знаком минус. Теперь нам нужно масштабировать с помощью индекс, который равен четырем. Это дает нам общий минус восемь для четырех атомов кислорода.
Шаг третий, используйте общий заряд
определить степень окисления менее электроотрицательного элемента, который в данном случае
дело сера. Общий заряд этого
многоатомный ион — два минус. Мы можем сделать окисление серы
число 𝑥 и найдите 𝑥, просуммировав степень окисления серы и четыре
атомов кислорода, чтобы получить общий заряд отрицательных двух.

 А. Титов, Ф. Ф. Гегеле. – М.: АСТ: Астрель, 2007.
А. Титов, Ф. Ф. Гегеле. – М.: АСТ: Астрель, 2007. Причина этого в том, что водород менее электроотрицателен, чем неметаллы. Когда мы рассматриваем связь водород-неметалл как ионную связь , водород отдает свой электрон неметаллу, что приводит к степени окисления +1 для H. Например, в молекуле воды два атома водорода связаны с атомом кислорода. атом (неметалл, равный более электроотрицательнее, чем водород). H имеет степень окисления +1, а O имеет степень окисления -2. (Вновь сформулируем правило № 3 выше: сумма степеней окисления в нейтральной молекуле равна 0.) Степень окисления атомов водорода в связях металл-водород также можно объяснить разницей в электроотрицательности между H и M. Водород более электроотрицательный. чем металлы. Следовательно, при ионной обработке связи металл-водород атом металла отдает электрон атому водорода, что приводит к степени окисления -1 для H. Например, в гидриде натрия (NaH) натрий имеет степень окисления +1, тогда как водород имеет степень окисления -1.
Причина этого в том, что водород менее электроотрицателен, чем неметаллы. Когда мы рассматриваем связь водород-неметалл как ионную связь , водород отдает свой электрон неметаллу, что приводит к степени окисления +1 для H. Например, в молекуле воды два атома водорода связаны с атомом кислорода. атом (неметалл, равный более электроотрицательнее, чем водород). H имеет степень окисления +1, а O имеет степень окисления -2. (Вновь сформулируем правило № 3 выше: сумма степеней окисления в нейтральной молекуле равна 0.) Степень окисления атомов водорода в связях металл-водород также можно объяснить разницей в электроотрицательности между H и M. Водород более электроотрицательный. чем металлы. Следовательно, при ионной обработке связи металл-водород атом металла отдает электрон атому водорода, что приводит к степени окисления -1 для H. Например, в гидриде натрия (NaH) натрий имеет степень окисления +1, тогда как водород имеет степень окисления -1. Это также можно объяснить на основе электроотрицательности. Кислород является вторым наиболее электроотрицательным элементом после фтора. Следовательно, при ионной обработке связи, содержащей кислород и другой элемент, за исключением фтора, кислород примет два электрона и примет степень окисления -2. Например, в сульфат-ионе (SO42-) каждый кислород имеет степень окисления -2, тогда как сера имеет степень окисления +6. (Опять же, см. правило № 3 выше: общий заряд иона = -2 = 4 x [число оксидов O] + [количество оксидов S].)
Это также можно объяснить на основе электроотрицательности. Кислород является вторым наиболее электроотрицательным элементом после фтора. Следовательно, при ионной обработке связи, содержащей кислород и другой элемент, за исключением фтора, кислород примет два электрона и примет степень окисления -2. Например, в сульфат-ионе (SO42-) каждый кислород имеет степень окисления -2, тогда как сера имеет степень окисления +6. (Опять же, см. правило № 3 выше: общий заряд иона = -2 = 4 x [число оксидов O] + [количество оксидов S].) Другие атомы галогена также будут иметь степень окисления -1 , если только они не связаны с более электроотрицательным атомом, таким как кислород или другой галоген, находящийся выше в группе, такой как фтор. Например, в молекуле FI фтор имеет степень окисления -1, тогда как йод имеет степень окисления +1.
Другие атомы галогена также будут иметь степень окисления -1 , если только они не связаны с более электроотрицательным атомом, таким как кислород или другой галоген, находящийся выше в группе, такой как фтор. Например, в молекуле FI фтор имеет степень окисления -1, тогда как йод имеет степень окисления +1. (В приведенном выше примере имеется один атом Pt и два атома I с каждой стороны реакции, поэтому атомы уравновешиваются.)
(В приведенном выше примере имеется один атом Pt и два атома I с каждой стороны реакции, поэтому атомы уравновешиваются.)