| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | ||
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | ||
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
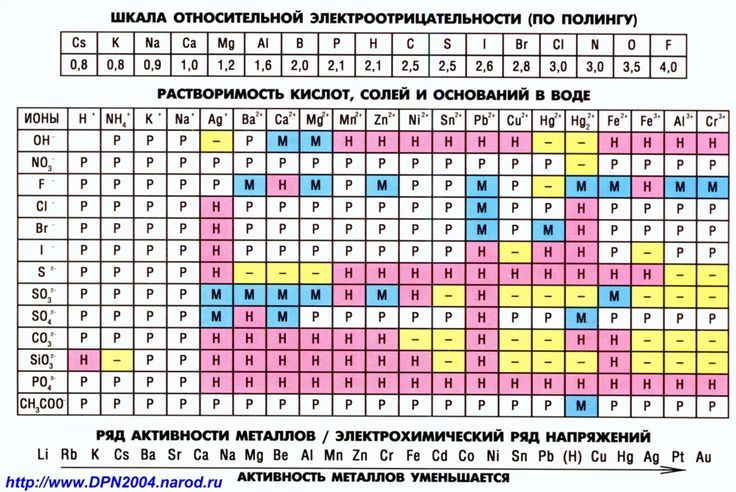
Определите степени окисления элементов в соединениях и проставьте их над их символами.
 I группа. Zn 2 Cl 2 — , К + 2 O -2 , H + 2 S -2 , С +4 Н 4 — , Н + 3 Р +5 O 4 -2 , Н + 2 С +4 O 3 -2
I группа. Zn 2 Cl 2 — , К + 2 O -2 , H + 2 S -2 , С +4 Н 4 — , Н + 3 Р +5 O 4 -2 , Н + 2 С +4 O 3 -2I группа. Zn 2 Cl 2 — , К + 2 O -2 , H + 2 S -2 , С +4 Н 4 — , Н + 3 Р +5 O 4 -2 , Н + 2 С +4 O 3 -2 ,
Ва 2 (ОН) 2 -1 .
Рассмотрим пример цинк хлорида Zn Cl 2 . Степень окисления цинка всегда 2: Zn 2 Cl 2 х из принципа электронейтральности вычисляем степень окисления хлора 1 • (2) 2 • х = 0, откуда х = 1.
Рассмотрим пример калий оксида К 2 O . Степень окисления калия всегда 1, а кислорода 2. В составе К+2O-2по принципу электронейтральности 2• (1) 1• (-2) = 0.
Рассмотрим пример соединения H 2 S . Степень окисления водорода в нейонних соединениях с неметаллами 1: H + 2 S х из принципа электронейтральности вычисляем степень окисления серы: 2 • (1) 1 • х = 0, откуда х = 2.
Рассмотрим пример соединения С Н 4 . Степень окисления водорода в ионных соединениях 1: С х Н 4 -1 Из принципа электронейтральности вычисляем степень окисления углерода: 1 • х + 4 • (-1) = 0, откуда х = + 4.
Рассмотрим пример ортофосфорная кислота Н 3 Р O 4 . Степень окисления водорода +1, а кислорода -2: Н + 3 Р х O 4 -2 Из принципа электронейтральности вычисляем степень окисления фосфора: 3 • (+1) +1 • х + 4 • (-2) = 0, откуда х = 8-3, х = + 5;
Рассмотрим пример угольной кислоты Н 2 С O 3 . Степень окисления водорода +1, а кислорода -2: Н + 2 С х O 3 -2 Из принципа электронейтральности вычисляем степень окисления углерода: 2 • (1) +1 • х + 3 • (-2) = 0, откуда х = 6-2, х = + 4.
Рассмотрим пример барий гидроксида Ва (ОН) 2 . Степень окисления бария в соединениях всегда 2, а гидроксильной группы ОН-1, поэтому Ва 2 (ОН) 2 -1 Принцип электронейтральности: 1 • (2) 2 (1) = 0.
II группа. Са 2 Н 2 — , Ba 2 Cl 2 — , Ca 2 3 N 2 -3 , H + N + 5 В 3 -2 , Zn 2 O -2 , H 1 2 S +6 В 4 — 2 , Mg + 2 2 C -4 .
Рассмотрим пример соединения Са Н 2 . Степень окисления кальция всегда 2, а водорода в ионных соединениях 1. В составе Са2Н2- по принципу электронейтральности 1 • (2) 2 • (-1) = 0 .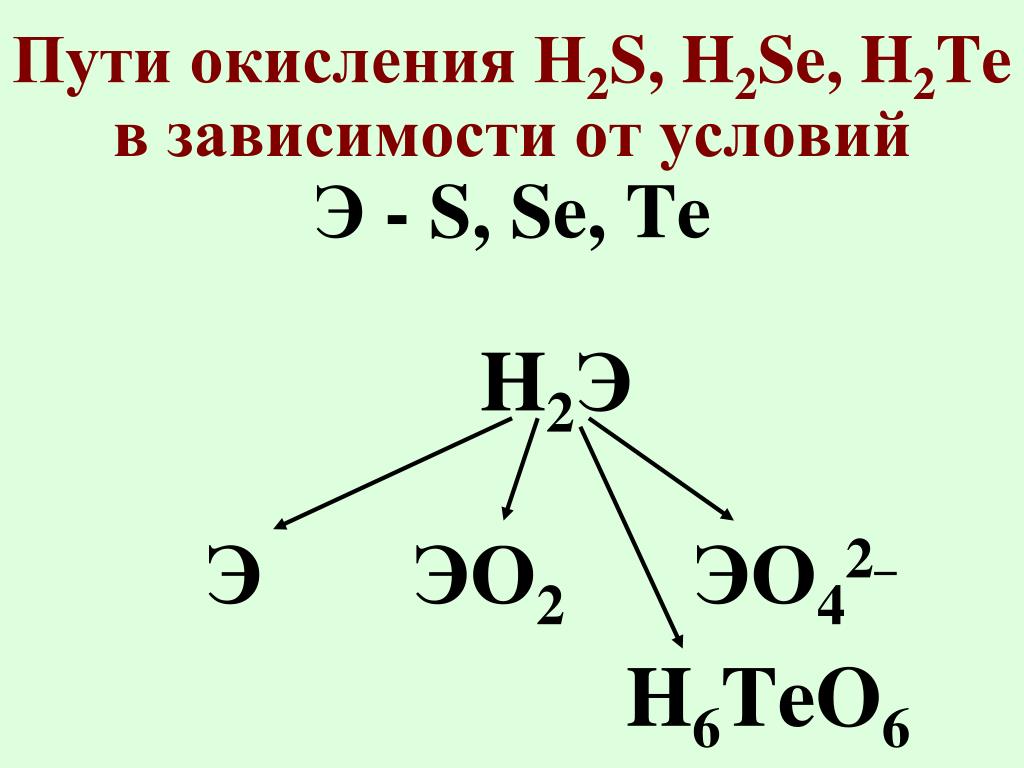
Рассмотрим пример барий хлорида Ba Cl 2 . Степень окисления бария всегда 2: Ba 2 Cl 2 х из принципа электронейтральности вычисляем степень окисления хлора 1 • (2) 2 • х = 0, откуда х = 1.
Рассмотрим пример кальций азота Ca 3 N 2 . Степень окисления кальция всегда 2: Ca 2 3 N 2 х из принципа электронейтральности вычисляем степень окисления азота: 3 • (2) 2 • х = 0, откуда х = -3.
Рассмотрим пример окиси цинка ZnO . Степень окисления цинка всегда 2, а кислорода 2. В составе Zn2O-2 по принципу электронейтральностии1•(2) 1• (-2) = 0.
Рассмотрим пример соединения Mg 2 C . Степень окисления магния всегда 2: Mg 2 2 C х из принципа электронейтральности вычисляем степень окисления углерода: 2 • (2) 1 • х = 0, откуда х = 4.
Рассмотрим пример азотной кислоты HNО 3. Степень окисления водорода +1, а кислорода -2: H + N х В 3 -2 Из принципа электронейтральности вычисляем степень окисления азота: 1 • (+1) +1 • х + 3 • (-2 ) = 0, откуда х = 6-1, х = + 5.
Рассмотрим пример серной кислоты H 2 SО 4 . Степень окисления водорода +1, а кислорода -2: H 1 2 S х В 4 -2 Из принципа электронейтральности вычисляем степень окисления серы: 2 • (1) +1 • х + 4 • (-2) = 0, откуда х = 8-2, х = + 6.
Степень окисления водорода +1, а кислорода -2: H 1 2 S х В 4 -2 Из принципа электронейтральности вычисляем степень окисления серы: 2 • (1) +1 • х + 4 • (-2) = 0, откуда х = 8-2, х = + 6.
III группы. Na + Cl — , Li + 2 O -2 , P +3 H 3 -1 , Mg 2 3 N 2 -3 , H 1 P +5 В 3 -2 , H + 2 Mn +6 В 4 -2 ,
Ca 2 (OH) 2 -1 .
Рассмотрим пример хлорида натрия Na Cl . Степень окисления натрия всегда +1: Na + Cl х из принципа электронейтральности вычисляем степень окисления хлора 1 • (+1) +1 • х = 0, откуда х = 1.
Рассмотрим пример литий оксида Li 2 O . Степень окисления лития всегда 1, а кислорода 2. В составе Li+2O-2 по принципу электронейтральности2• (1) 1• (-2) = 0.
Рассмотрим пример соединения P H 3 . Степень окисления водорода в ионных соединениях 1: P х H 3 -1 Из принципа электронейтральности вычисляем степень окисления фосфора: 1 • х + 3 • (-1) = 0, откуда х = +3.
Рассмотрим пример соединения Mg 3 N 2 . Степень окисления магния всегда 2: Mg 2 3 N 2 х из принципа электронейтральности вычисляем степень окисления азота: 3 • (2) 2 • х = 0, откуда х = -3.
Рассмотрим пример метафосфорная кислота HPО 3 . Степень окисления водорода +1, а кислорода -2: H 1 P х В 3 -2 Из принципа электронейтральности вычисляем степень окисления фосфора: 1 • (+1) +1 • х + 3 • (-2) = 0, откуда х = 6-1, х = + 5;
Рассмотрим пример соединения H 2 MnО 4 . Степень окисления водорода +1, а кислорода -2: H + 2 Mn х В 4 -2 Из принципа электронейтральности вычисляем степень окисления марганца: 2 • (1) +1 • х + 4 • (-2) = 0, откуда х = 8-2, х = + 6.
Рассмотрим пример кальций гидроксида С а (ОН) 2 . Степень окисления кальция в соединениях всегда 2, а гидроксильной группы ОН-1, поэтому С а 2 (ОН) 2 -1 Принцип электронейтральности: 1 • (2) 2 (1) = 0.
IV группа. Cu 2 H 2 — , Ba 2 Cl 2 -1 , Ca 2 3 P 2 -3 , H + N + 3 O 2 -2 , Ca 2 O -2 , H + 2 S +4 O 3 — 2 ,
Al +3 (OH) 3 -1 .
Рассмотрим пример соединения Cu 2 H 2 — . Степень окисления водорода в ионных соединениях 1: Cu х H 2 -1 Из принципа электронейтральности вычисляем степень окисления меди: 1 • х + 2 • (-1) = 0, откуда х = + 2.
Рассмотрим пример барий хлорида Ba Cl 2 . Степень окисления бария всегда 2: Ba 2 Cl 2 х из принципа электронейтральности вычисляем степень окисления хлора 1 • (2) 2 • х = 0, откуда х = 1.
Рассмотрим пример соединения Ca 3 P 2 . Степень окисления кальция всегда 2: Ca 2 3 P 2 х из принципа электронейтральности вычисляем степень окисления фосфора: 3 • (2) 2 • х = 0, откуда х = -3.
Рассмотрим пример кальций оксида CaO . Степень окисления кальция всегда 2, а кислорода 2. В составе Са 2 В -2 по принципу электронейтральности2• (1) 1• (-2) = 0.
Рассмотрим пример соединения HNO 2 . Степень окисления водорода +1, а кислорода -2: H + N х O 2 -2 Из принципа электронейтральности вычисляем степень окисления азота: 1 • (+1) +1 • х + 2 • (-2) = 0, откуда х = 4-1, х = + 3,
Рассмотрим пример сульфитной кислоты H 2 SO 3 . Степень окисления водорода +1, а кислорода -2: H + 2 S х O 3 -2 Из принципа электронейтральности вычисляем степень окисления серы: 2 • (1) +1 • х + 3 • (-2) = 0, откуда х = 6-2, х = + 4.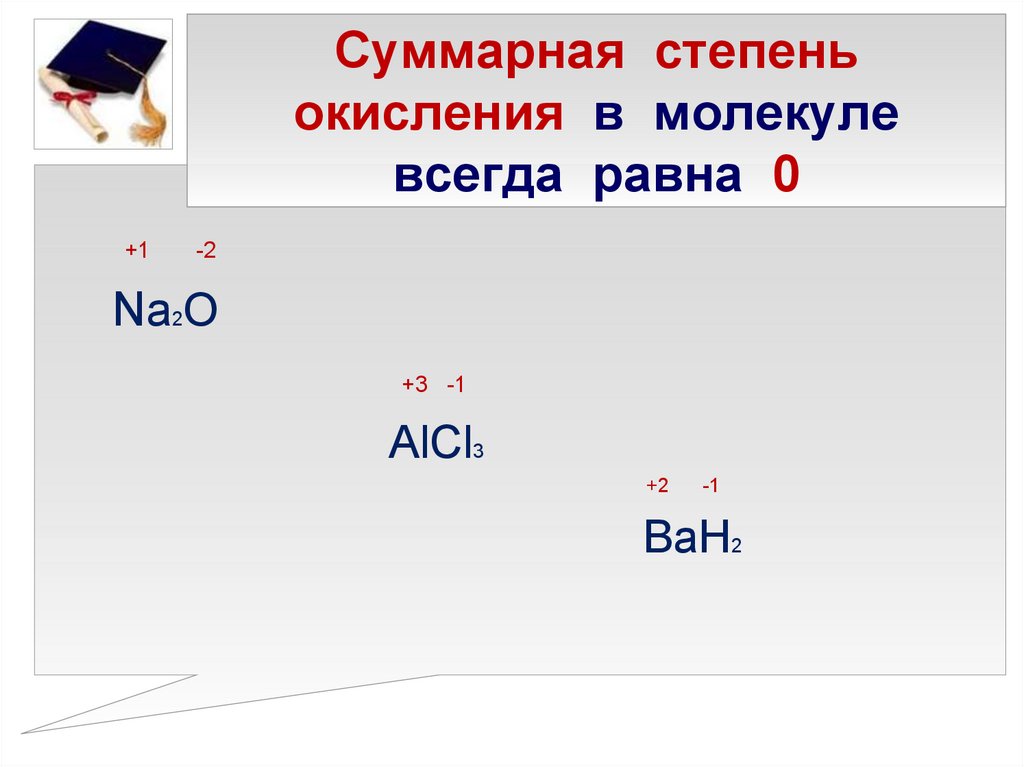
Рассмотрим пример алюминий гидроксида Al (OH) 3 . Степень окисления алюминия в соединениях всегда 3, а гидроксильной группы ОН-1, поэтому Al +3 (ОН) 3 -1 Принцип электронейтральности: 1 • (+3) +3 (1) = 0.
| 1 | Найдите количество нейтронов | Х | |
| 2 | Найдите массу 1 моля | Н_2О | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найдите массу 1 моля | Х | |
| 5 | Найдите количество нейтронов | Фе | |
| 6 | Найдите количество нейтронов | ТК | |
| 7 | Найдите электронную конфигурацию | Х | |
| 8 | Найдите количество нейтронов | Са | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найдите число нейтронов | С | |
| 11 | Найдите количество протонов | Х | |
| 12 | Найдите количество нейтронов | О | |
| 13 | Найдите массу 1 моля | СО_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найдите атомную массу | Х | |
| 16 | Определить, растворимо ли соединение в воде | Н_2О | |
| 17 | Найдите электронную конфигурацию | Нет | |
| 18 | Найдите массу отдельного атома | Х | |
| 19 | Найдите количество нейтронов | № | |
| 20 | Найдите количество нейтронов | Золото | |
| 21 | Найдите количество нейтронов | Мн | |
| 22 | Найдите количество нейтронов | Ру | |
| 23 | Найдите электронную конфигурацию | О | |
| 24 | Найдите массовые проценты | Н_2О | |
| 25 | Определить, растворимо ли соединение в воде | NaCl | |
| 26 | Найдите эмпирическую/простейшую формулу | Н_2О | |
| 27 | Найти степени окисления | Н_2О | |
| 28 | Найдите электронную конфигурацию | К | |
| 29 | Найдите электронную конфигурацию | Мг | |
| 30 | Найдите электронную конфигурацию | Са | |
| 31 | Найдите количество нейтронов | Рх | |
| 32 | Найдите количество нейтронов | Нет | |
| 33 | Найдите количество нейтронов | Пт | |
| 34 | Найдите количество нейтронов | Быть | Быть |
| 35 | Найдите количество нейтронов | Кр | |
| 36 | Найдите массу 1 моля | Н_2SO_4 | |
| 37 | Найдите массу 1 моля | HCl | |
| 38 | Найдите массу 1 моля | Фе | |
| 39 | Найдите массу 1 моля | С | |
| 40 | Найдите количество нейтронов | Медь | |
| 41 | Найдите количество нейтронов | С | |
| 42 | Найдите степени окисления | Х | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найдите атомную массу | О | |
| 45 | Найдите атомный номер | Х | |
| 46 | Найдите количество нейтронов | Пн | |
| 47 | Найдите количество нейтронов | ОС | |
| 48 | Найдите массу 1 моля | NaOH | |
| 49 | Найдите массу 1 моля | О | |
| 50 | Найдите электронную конфигурацию | Фе | |
| 51 | Найдите электронную конфигурацию | С | |
| 52 | Найдите массовые проценты | NaCl | |
| 53 | Найдите массу 1 моля | К | |
| 54 | Найдите массу отдельного атома | Нет | |
| 55 | Найдите число нейтронов | Н | |
| 56 | Найдите количество нейтронов | Ли | |
| 57 | Найдите количество нейтронов | В | |
| 58 | Найдите количество протонов | № 92О | |
| 60 | Упростить | ч*2р | |
| 61 | Определить, растворимо ли соединение в воде | Х | |
| 62 | Найдите плотность на STP | Н_2О | |
| 63 | Найти степени окисления | NaCl | |
| 64 | Найдите атомную массу | Он | Он |
| 65 | Найдите атомную массу | Мг | |
| 66 | Найдите количество электронов | Х | |
| 67 | Найдите число электронов | О | |
| 68 | Найдите число электронов | С | |
| 69 | Найдите число нейтронов | Пд | |
| 70 | Найдите количество нейтронов | рт.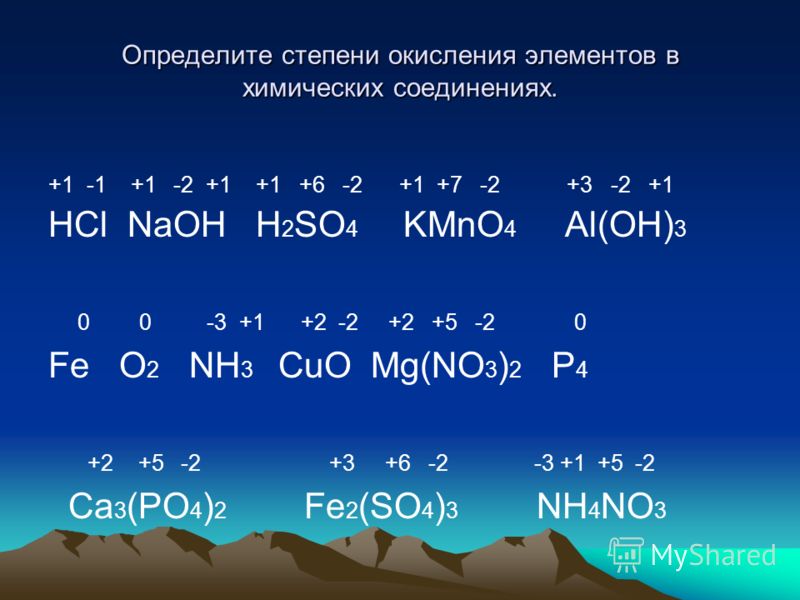 ст. ст. | |
| 71 | Найдите количество нейтронов | Б | |
| 72 | Найдите массу отдельного атома | Ли | |
| 73 | Найдите эмпирическую формулу | Н=12%, С=54%, N=20 | , , |
| 74 | Найдите количество протонов | Быть | Быть |
| 75 | Найдите массу 1 моля | На | |
| 76 | Найдите электронную конфигурацию | Со | |
| 77 | Найдите электронную конфигурацию | С | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | Н_2+О_2→Н_2О | |
| 80 | Найдите электронную конфигурацию | Р | |
| 81 | Найдите электронную конфигурацию | Пб | |
| 82 | Найдите электронную конфигурацию | Ал | |
| 83 | Найдите электронную конфигурацию | Ар | |
| 84 | Найдите массу 1 моля | О_2 | |
| 85 | Найдите массу 1 моля | Н_2 | |
| 86 | Найдите количество нейтронов | К | |
| 87 | Найдите количество нейтронов | Р | |
| 88 | Найдите число нейтронов | Мг | |
| 89 | Найдите количество нейтронов | Вт | |
| 90 | Найдите массу отдельного атома | С | |
| 91 | Упростить | н/д+кл | |
| 92 | Определить, растворимо ли соединение в воде | Н_2SO_4 | |
| 93 | Найдите плотность на STP | NaCl | |
| 94 | Найти степени окисления | C_6H_12O_6 | |
| 95 | Найти степени окисления | Нет | |
| 96 | Определить, растворимо ли соединение в воде | C_6H_12O_6 | |
| 97 | Найдите атомную массу | Кл | |
| 98 | Найдите атомную массу | Фе | |
| 99 | Найдите эмпирическую/самую простую формулу | СО_2 | |
| 100 | Найдите количество нейтронов | Мт |
Свойства оксида кальция (CaO) (25 фактов, которые вы должны знать)0002
Оксид кальция представляет собой белое или серовато-белое твердое соединение, также известное как известь или негашеная известь. Поясним свойства (физические и химические) оксида кальция.
Поясним свойства (физические и химические) оксида кальция.
Оксид кальция в основном получают термическим разложением (нагрев выше 825 0 C) карбоната кальция. Эта негашеная известь не является стабильной, потому что она далее реагирует с CO 2 с образованием CaCO 3 . CaO не является летучим соединением и имеет скорость расширения и сжатия от высокой до средней.
Давайте подробно разъясним название IUPAC, магнетизм, полярность, проводимость, температуру плавления и кипения, реакции и многие другие важные темы, касающиеся оксида кальция.
Оксид кальция Название IUPACIUPAC (Международный союз теоретической и прикладной химии) называет оксид кальция самим оксидом кальция. Кальций является атомом металла, а кислород находится в состоянии -2-окисления. Поэтому кислород записывается как оксид.
Химическая формула оксида кальция Оксид кальция имеет химическую формулу CaO.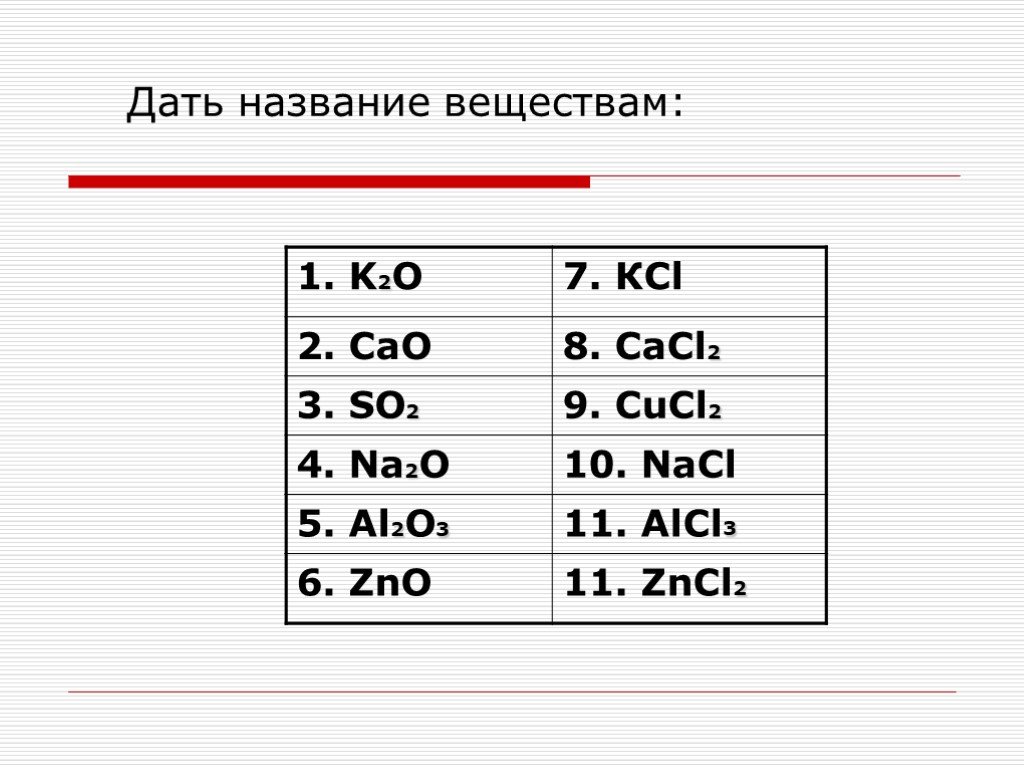 Существует ионное взаимодействие между ионами кальция (Ca 2+ ) и оксида (O 2- ).
Существует ионное взаимодействие между ионами кальция (Ca 2+ ) и оксида (O 2- ).
Оксид кальция имеет регистрационный номер CAS (подлинный цифровой идентификатор, который может содержать до 10 цифр) 1305-78-8.
Оксид кальция Паук IDSulfuric acid has the ChemSpider (ChemSpider is a free chemical structure database) ID 14095.
Calcium Oxide Chemical Classification- Calcium oxide can be chemically classified as inorganic crystal compound .
- Оксид кальция может быть химически классифицирован как щелочной или основной (основание Льюиса) .
- Оксид кальция может быть химически классифицирован как ионное соединение .

Молярная масса оксида кальция составляет 56,0774 г. Эта молярная масса получается суммированием молярных масс кальция и кислорода, которые составляют 40,078 г/моль и 15,999 г/моль соответственно.
Цвет оксида кальцияЧистый оксид кальция представляет собой белое или серовато-белое твердое кристаллическое или порошкообразное соединение. В противном случае он желтый или коричневатый из-за присутствия примесей, таких как железо, магнезия, кремнезем и оксид алюминия.
Вязкость оксида кальцияОксид кальция представляет собой соединение средней вязкости, более плотное, чем вода.
Молярная плотность оксида кальция. . Точка плавления оксида кальция Оксид кальция имеет температуру плавления 2613 0 C или 4735 0 F. Он показывает высокую температуру плавления, потому что молекулы CaO присоединены к кристаллу благодаря сильной ионной силе.
Он показывает высокую температуру плавления, потому что молекулы CaO присоединены к кристаллу благодаря сильной ионной силе.
The boiling point of calcium oxide is 2850 0 C or 5160 0 F.
Calcium Oxide state at Room TemperatureAt Оксид кальция при комнатной температуре представляет собой ионное кристаллическое твердое вещество из-за его высокой температуры кипения и плавления.
Оксид кальция Ионная/ковалентная связьСуществует ионная связь между атомами металла, ионами кальция (Ca 2+ ) и ионами оксида неметалла (O 2-
). Нейтральный ион кальция отдает два своих валентных электрона кислороду, и он становится Ca 2+ , а кислород становится O 2-. Ионное взаимодействие в оксиде кальция Оксид кальция Ионный/ковалентный радиус Радиус или межъядерное расстояние между Ca 2+ и O 2- составляет 240 пм. Это значение получено из ионного радиуса Ca 2+ и O 2-, которые составляют 114 пм и 146 пм соответственно.
Это значение получено из ионного радиуса Ca 2+ и O 2-, которые составляют 114 пм и 146 пм соответственно.
Электронная конфигурация представляет собой относительное расположение вращающихся электронов на различных орбиталях или оболочках. Объясним подробно.
Оксид кальция имеет электронную конфигурацию кальция и кислорода. Кальций является элементом s-блока, а кислород представляет собой элемент p-блока, имеющий электронную конфигурацию [Ar] 4s 2 и [He] 2s 2 2p 4 .
Оксид кальция Степень окисленияОксид кальция имеет нулевую степень окисления, поскольку он является нейтральным соединением. В CaO кальций находится в +2, а кислород в степени окисления -2, что делает CaO нейтральным соединением.
Оксид кальция Кислотно-щелочной Оксид кальция является основанием Льюиса, поскольку он может отдавать электронные пары атомам кислорода. Он имеет pk значение 12,8.
Он имеет pk значение 12,8.
Оксид кальция не имеет характерного запаха. Следовательно, это соединение без запаха.
Является ли оксид кальция парамагнитным?Парамагнитные соединения слабо притягиваются внешним магнитным полем из-за наличия неспаренных электронов. Проверим, является ли CaO парамагнитным или нет.
Оксид кальция не является парамагнитным соединением. Причина этого диамагнетизма заключается в том, что все электроны в Ca 2+ спарены ([Ar]), и из теории молекулярных орбиталей можно сделать вывод, что в O 2- также нет неспаренных электронов. Следовательно, это диамагнитное соединение.
Гидраты оксида кальция Реакция гидратации оксида кальция является примером экзотермического процесса, при котором выделяется тепло в окружающую среду. При контакте СаО с водой образуется кристаллический или аморфный белый гидроксид кальция. CaO(с) + H 2 O (ж) = Ca(OH) 2 (т).
При контакте СаО с водой образуется кристаллический или аморфный белый гидроксид кальция. CaO(с) + H 2 O (ж) = Ca(OH) 2 (т).
Твердый оксид кальция имеет кубическую кристаллическую структуру галита, каменной соли с пространственной группой cF8. В этом кристалле каждый ион Ca 2+ связан с шестью ионами O 2-, а каждый ион O 2- связан с шестью ионами Ca 2+ . Параметры решетки: a = b = c = 4,84 A 0 и α = β = γ = 90 0 .
Оксид кальция Полярность и проводимость- Оксид кальция не является ни полярным, ни неполярным соединением. Это ионное вещество. Но существует отчетливое разделение зарядов между электроположительными атомами кальция и электроотрицательными атомами кислорода.

- CaO имеет электрическую проводимость 19,50 Вт мК -1 , потому что это ионное соединение.
Оксид кальция представляет собой основание Льюиса. Поэтому он самопроизвольно реагирует с кислотой с образованием соли и воды, что известно как реакция нейтрализации.
- CaO + 2HCl = CaCl 2 + H 2 O
- CaO + 2HNO 3 = Ca(NO 3 ) 2 + H 2 O
- СаО + Н 2 SO 4 = CASO 4 +H 2 O
Оксид кальция не реагирует с металлом, поскольку ни один из металлов не может вытеснить кальций из оксида кальция.