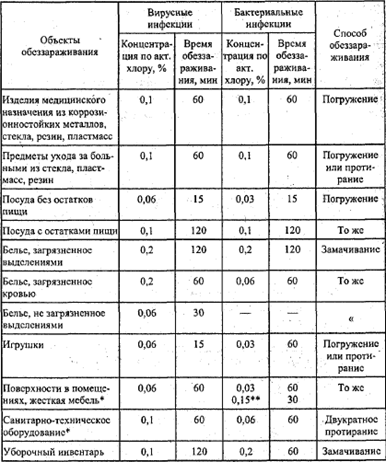
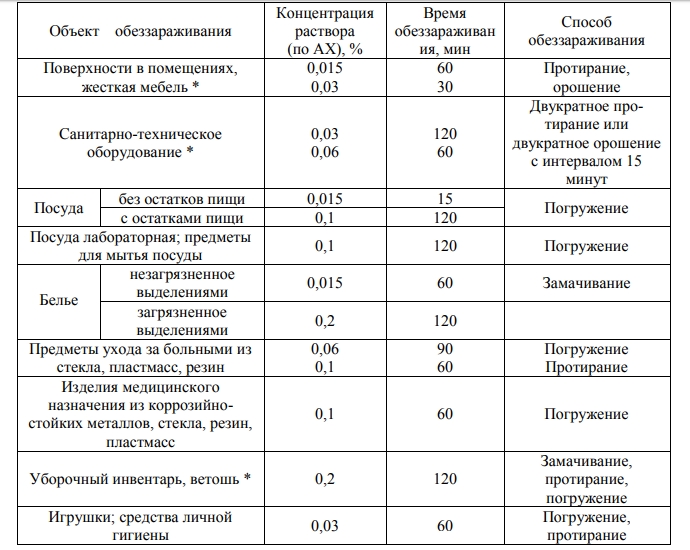
Раздел недели: Плоские фигуры. Свойства, стороны, углы, признаки, периметры, равенства, подобия, хорды, секторы, площади и т.д. | |||||||||
| Поиск на сайте DPVA Поставщики оборудования Полезные ссылки О проекте Обратная связь Ответы на вопросы. Оглавление Таблицы DPVA.ru — Инженерный Справочник | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация/ / Химический справочник / / Свойства растворов. Поделиться:
| ||||||||
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста. | |||||||||
Коды баннеров проекта DPVA.ru Консультации и техническая | Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса.
Free xml sitemap generator Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса.
Free xml sitemap generator | ||||||||
Новость не найдена
Нет товаров для сравнения С 28 декабря по 08 января — выходные дни26. 12.2022 12.2022С 28 декабря 2022 года по 08 января 2023 года компания не работает. Все заявки и заказы будут обработаны после праздников. С Новым Годом и Рождеством! Возможно увеличение сроков доставки15.12.2022 Предновогодний ажиотаж, пробки, снегопады — всё это влияет на сроки доставки. В данный момент транспортные компании испытывают повышенные нагрузки, в связи с этим стандартные сроки доставки могут быть увеличены. В текущих условиях мы не можем гарантировать быструю срочную доставку. Просьба с пониманием отнестись к данной информации и планировать заказы заранее. Химики синтезировали циклический полипорфирин с 24 звеньями19.10.2022 Британские химики с помощью темплатного синтеза получили полипорфириновый циклический олигомер, состоящий из 24 порфириновых звеньев и одной бутадииновой связки. Нобелевская премия по химии 202205.10.2022 Лауреатами Нобелевской премии по химии 2022 года стали Каролин Бертоцци (Carolyn R. Bertozzi), Мортен Мельдаль (Morten P. Meldal) и Барри Шарплесс (K. Barry Sharpless) — за развитие методов клик-химии и биоортогональной химии. | ||
Таблицы ICE — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1348
Таблица ICE ( I nitial, C hange, E quilibrium) представляет собой простой матричный формализм, который используется для упрощения расчетов в обратимых равновесных реакциях (например, слабые кислоты и слабые основания или образование сложных ионов).
Введение
Таблицы ICE состоят из концентраций молекул в растворе на разных стадиях реакции и обычно используются для расчета K или выражения константы равновесия реакции (в некоторых случаях может быть задано K, а одна или несколько концентраций в таблице будут неизвестными для решения). Таблицы ICE автоматически настраивают и организуют переменные и константы, необходимые при вычислении неизвестного.
ICE — это простая аббревиатура для заголовков первого столбца таблицы.
- I обозначает начальную концентрацию . Эта строка содержит начальные концентрации продуктов и реагентов.
- C означает изменение концентрации . Это изменение концентрации, необходимое для достижения равновесия реакции. Это разница между равновесным и исходным рядами. Концентрации в этой строке, в отличие от других строк, выражены либо соответствующим положительным (+), либо отрицательным (-) знаком и переменной; это потому, что эта строка представляет собой увеличение или уменьшение (или отсутствие изменений) концентрации.

- E для концентрации, когда реакция находится в состоянии равновесия . Это суммирование начального и итогового рядов. Как только эта строка заполнена, ее содержимое можно подставить в уравнение константы равновесия, чтобы найти \(K_c\).
Процедуру заполнения таблицы ICE лучше всего проиллюстрировать на примере.
Пример 1
Используйте таблицу ICE для определения \(K_c\) для следующей сбалансированной общей реакции:
\[ \ce{ 2X(г) <=> 3Y(г) + 4Z(г)} \номер\]
где заглавные буквы обозначают продукты и реагенты.
- Это уравнение будет размещено горизонтально над таблицей, где каждый продукт и реагент будут иметь отдельный столбец.
Образец, состоящий из 0,500 моль х, помещают в систему объемом 0,750 л.
- Это утверждение подразумевает, что начальных количеств Y и Z нет. Для строки I столбцов Y и Z будет введено 0,000 моль.
- Обратите внимание, что исходный состав указан в молях.
 Количества могут быть либо преобразованы в концентрации перед помещением их в таблицу ICE, либо после расчета равновесных количеств. В этом примере для таблицы ICE используются моли, а концентрации рассчитываются позже.
Количества могут быть либо преобразованы в концентрации перед помещением их в таблицу ICE, либо после расчета равновесных количеств. В этом примере для таблицы ICE используются моли, а концентрации рассчитываются позже.
Известно, что в равновесии количество образца x составляет 0,350 моль.
- Для строки равновесия X будет введено 0,350 моль.
Желаемый Неизвестный 92} \nonumber \]
Равновесные концентрации Y и Z неизвестны, но их можно рассчитать с помощью таблицы ICE.
ШАГ 1: Введите указанные суммы
| Реакция: | 2X | 3 года | 4З |
|---|---|---|---|
| Начальные суммы | 0,500 моль | 0,000 моль | 0,000 моль |
| Изменение суммы | ? | ? | ? |
| Равновесная сумма | 0,350 моль | ? | ? |
Это первый шаг в настройке таблицы ICE. Как упоминалось выше, мнемоника ICE является вертикальной, а уравнение возглавляет таблицу горизонтально, задавая строки и столбцы таблицы соответственно. Были даны численные суммы. Любая сумма, не указанная напрямую, неизвестна.
Как упоминалось выше, мнемоника ICE является вертикальной, а уравнение возглавляет таблицу горизонтально, задавая строки и столбцы таблицы соответственно. Были даны численные суммы. Любая сумма, не указанная напрямую, неизвестна.
ШАГ 2: Введите сумму изменения для каждого соединения
| Реакция | 2X | 3 года | 4З |
|---|---|---|---|
| Начальные суммы | 0,500 моль | 0,000 моль | 0,000 моль |
| Изменение суммы | -0,150 моль | +0,225 моль | +0,300 моль |
| Равновесные суммы | 0,350 моль | ? | ? |
Обратите внимание, что равновесие в этом уравнении смещено вправо, что означает удаление некоторого количества реагента и добавление некоторого количества продукта (для строки Изменение).
Изменение суммы (\(x\)) можно рассчитать с помощью алгебры:
\[ Равновесие \; Сумма = Начальная \; Сумма + Сдача \; в \; Сумма \номер\]
Решение для изменения суммы \(2x\) дает:
\[ 0,350 \; моль — 0,500\; моль = -0,150 \; моль \номер \]
Изменение реагентов и сбалансированное уравнение реакции известны, поэтому можно рассчитать изменение продуктов. Стехиометрические коэффициенты показывают, что на каждые 2 моля прореагировавшего x образуется 3 моля Y и 4 моля Z. Соотношение следующее:
\[ \begin{eqnarray} Изменить \; в \; Продукт &=& -\left(\dfrac{\text{Стехиометрический коэффициент продукта}}{\text{Стехиометрический коэффициент реагента}}\right)(\text{Изменение реагента}) \\ Изменение \; в \; Y &=& -\left(\dfrac{3}{2}\right)(-0,150 \; моль) \\ &= +0,225 \; mol \end{eqnarray} \nonumber \]
Попробуйте получить изменение Z этим методом (ответ уже есть в таблице ICE).
ШАГ 3: Найдите равновесные количества
| Реакция | 2X | 3 года | 4З |
|---|---|---|---|
| Начальные суммы | 0,500 моль | 0,000 моль | 0,000 моль |
| Изменение сумм | -0,150 моль | +0,225 моль | +0,300 моль |
| Равновесные суммы | 0,350 моль | 0,225 моль | 0,300 моль |
Если начальные количества Y и/или Z были отличны от нуля, то они должны быть добавлены вместе с изменением количества для определения равновесного количества. Однако, поскольку начального количества двух продуктов не было, равновесное количество просто равно изменению:
Однако, поскольку начального количества двух продуктов не было, равновесное количество просто равно изменению:
\[\begin{eqnarray} Равновесие \; Сумма &=& Исходная \; Сумма + Сдача \; в \; Сумма \\Равновесие\; Количество \; из \; Y &=& 0,000 \; моль\; + 0,225\; моль \&=&+0,225\; моль \end{eqnarray} \nonumber \]
Используйте тот же метод, чтобы найти равновесное количество Z. Преобразуйте равновесные количества в концентрации. Напомним, объем системы 0,750 л.
\[[Равновесие \; Концентрация \; из \; Вещество] = \dfrac{Количество \; из \; Вещество}{Объем \; из \; Система}\номер\] 9{-3} \end{eqnarray}\nonumber \]
Пример 2: Использование таблицы ICE с концентрациями
В этом примере таблица ICE используется для определения равновесной концентрации реагентов и продуктов. (Этот пример будет менее подробным, чем предыдущий, но применяются те же принципы.) Эти расчеты часто выполняются для титрования слабыми кислотами.
Найдите концентрацию A — для общей реакции диссоциации кислоты:
\[ \ce{HA(водн. {+} (водный)} \номер\] 9-\)) и протоны (Н 3 О + ). Обратите внимание, что вода является жидкостью, поэтому ее концентрация не имеет отношения к этим расчетам.
{+} (водный)} \номер\] 9-\)) и протоны (Н 3 О + ). Обратите внимание, что вода является жидкостью, поэтому ее концентрация не имеет отношения к этим расчетам.
ШАГ 1: Введите указанные концентрации
| Реакция: | ГА | А — | Н 3 О + |
|---|---|---|---|
| I | 0,150 М | 0,000 М | 0,000 М |
| С | ? | ? | ? |
| Е | ? | ? | ? |
- Содержимое крайнего левого столбца сокращено для удобства.

ЭТАП 2: Рассчитайте изменение концентрации с использованием переменной «x»
| Реакция: | ГА | А — | Н 3 О + |
|---|---|---|---|
| я | 0,150 М | 0,000 М | 0,000 М |
| С | -х М | +х М | +х М |
| Е | ? | ? | ? |
- Изменение концентрации неизвестно, поэтому для обозначения изменения используется переменная x.
 x одинаков как для продуктов, так и для реагентов, поскольку равные стехиометрические количества A — и H 3 O + образуются при диссоциации ГК в воде.
x одинаков как для продуктов, так и для реагентов, поскольку равные стехиометрические количества A — и H 3 O + образуются при диссоциации ГК в воде.
ЭТАП 3: Расчет концентраций при равновесии
| Реакция: | ГА | А — | Н 3 О + |
|---|---|---|---|
| я | 0,150 М | 0,000 М | 0,000 М |
| С | -х М | +х М | +х М |
| Е | 0,150 — х М | х М | х М |
- Чтобы найти равновесные суммы, складывают строки I и строки C.
 Используйте эти значения и K 92-4AC}}{2A}\nonumber \]
Используйте эти значения и K 92-4AC}}{2A}\nonumber \]Чтобы определить правильное решение, следует использовать интуицию. Если дать отрицательную концентрацию, ее можно устранить, потому что отрицательная концентрация нефизична.
Значение x можно использовать для расчета равновесных концентраций каждого продукта и реагента, подставив его в элементы в строке E ледяной таблицы.
[Решение: х = 0,0416, -0,0576. x = 0,0416 имеет химический смысл и, следовательно, является правильным ответом.]
Для некоторых задач, таких как пример 2, если x значительно меньше значения для K a , тогда x реагентов (в знаменателе) можно опустить, и концентрация для x не должна сильно повлиять. Это ускорит расчеты, избавив от необходимости использовать квадратную формулу.
Контрольный список для таблиц ICE
- Убедитесь, что обратимое уравнение сбалансировано в начале задачи; в противном случае в таблице будут использованы неправильные суммы.

- Приведенные данные должны быть в количествах, концентрациях, парциальных давлениях или каким-либо образом быть преобразованы в такие. Если это не так, то таблица ICE не поможет решить проблему.
- Если в таблице ICE есть равновесные количества , убедитесь, что равновесные значения преобразованы в концентрации перед подключением для решения \(K_c\).
- Если данные представлены в виде количеств или концентраций, используйте таблицу ICE, чтобы найти \(K_c\). Если данные находятся в 9{\Delta n_{gas}}\nonumber \] Проще использовать таблицу ICE с соответствующими данными и конвертировать в конце задачи.
- Введите в сначала известные данные , а затем вычислите неизвестные данные.
- Если в строках «начальная» или «равновесная» имеется отрицательное значение, перепроверьте расчет. Отрицательная концентрация, количество или парциальное давление физически невозможны.
 Очевидно, что строка «изменение» может содержать отрицательное значение.
Очевидно, что строка «изменение» может содержать отрицательное значение. - Обратите внимание на состояние каждого реагента и продукта. Если соединение является твердым или жидким, его концентрации не имеют отношения к расчетам. Используются только концентрации газообразных и водных соединений.
- В строке «изменение» значения обычно представляют собой переменную, обозначаемую как x . Прежде всего необходимо понять, в каком направлении уравнение придет к равновесию (слева направо или справа налево). Значение «изменения» в направлении «от» реакции будет противоположно 9.0582 x , а направление «к» будет положительным от x (добавляя концентрацию с одной стороны и убирая такое же количество с другой стороны).
- Знать направление реакции . Это знание повлияет на строку «изменение» таблицы ICE (в нашем примере мы знали, что реакция будет продолжаться, так как исходных продуктов не было). Направление реакции можно рассчитать, используя коэффициент реакции Q, который затем сравнивают с известным значением K.

- Проще всего использовать одни и те же единицы каждый раз, когда используется таблица ICE (обычно предпочтительна молярность). Это сведет к минимуму путаницу при расчете констант равновесия. Таблицы ICE обычно используются для слабокислотных или слабоосновных реакций из-за всей природы этих растворов. Количество кислоты или основания, которое диссоциирует, неизвестно (для сильных кислот и сильных оснований можно предположить, что диссоциирует вся кислота или основание, а это означает, что концентрация сильной кислоты или основания такая же, как и у ее диссоциированных частиц). .
Парциальные давления также могут быть заменены на концентрации в таблице ICE, если это необходимо (т.е., если концентрации не известны, требуется \(K_p\) вместо \(K_c\) и т. д.). «Количество» также допустимо (таблица ICE может быть выполнена в количествах до тех пор, пока не будут найдены равновесные количества, после чего они будут преобразованы в концентрации).
 Для простоты предположим, что слово «концентрация» можно заменить на «парциальное давление» или «количества» при составлении таблиц ICE. 9{-6}\)?
Для простоты предположим, что слово «концентрация» можно заменить на «парциальное давление» или «количества» при составлении таблиц ICE. 9{-6}\)?- Ответить
5,99×10 -4
Упражнение \(\PageIndex{2}\)
Если начальная концентрация NH 3 равна 0,350 М, а равновесная концентрация равна 0,325 М, чему равно \(K_c\) для этой реакции?
- Ответить
1,92×10 -3
Упражнение \(\PageIndex{3}\)
Как получается \(K_c\) из \(K_p\)? 9{\Delta n}\), затем найдите \(K_c\)
Упражнение \(\PageIndex{4}\)
Заполните эту таблицу ICE:
Реакция: [ГА] [А — ] [Н 3 О + ] я 0,650 моль ? ? С ? ? ? Е 0,250 моль ? ? - Ответить
Реакция: ГА А- Н 3 О + я 0,650 моль 0,000 моль 0,000 моль С -0,400 моль +0,400 моль +0,400 моль Е 0,250 моль 0,400 моль 0,400 моль
Авторы и ссылки
- Александр Шей (UCD), Эйлин Макдафф (UCD)
ICE Tables распространяется по лицензии CC BY, автор, ремикс и/или куратор LibreTexts.

- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- СС BY
- Показать страницу TOC
- № на стр.
- Теги
- Стол для льда
Плотность водных растворов органических кислот
Обратите внимание на единицы концентрации на рисунках:
% масс.: Масса растворенного вещества/общая масса раствора*100%
моль/кг: Моляльность = моли растворенного вещества/кг воды
моль/литр: Молярность = количество молей растворенного вещества/литр раствора
Значения приведены в таблице под рисунками.

См. также плотность водных растворов органических веществ, таких как сахара и спирты, неорганические хлориды, неорганические соли натрия, неорганические соли калия и некоторые другие неорганические вещества
Плотность водных растворов при 20°C, выраженная в г/смMass% Acetic acid Citric acid Formic acid D-Lactic acid Oxalic acid Trichloroacetic acid 1 0.9996 1.0022 1.0006 1.0002 1.0030 1.0034 5 1.0052 1.0189 1.0102 1.0086 1.0220 1,0230 10 1,0121 1,0402 1,0224 1,0199 3 9104 20 1.  0250
02501.0858 1.0467 1.0439 1.1035 30 1.0369 1.1346 40 1.0474 1.0935 1,0915 1,2188 50 1,0562 1,2803 3 60 1.1392 70 1.0673 1.1586 80 1.1848 100 1.0477 Плотность кислот, растворенных в воде при 20°C, выраженная в % масс. Для просмотра полной таблицы со щавелевой и трихлоруксусной кислотами — поверните экран!
666666.Mass% Acetic acid Citric acid Formic acid D-Lactic acid Oxalic acid Trichloroacetic acid 1 0,168 0,053 0,219 0.  112
1120.112 0.062 5 0.876 0.274 1.143 0.584 0.585 0.322 10 1.850 0.578 2.414 1.233 0.680 20 4.163 1.301 5.410 2.775 1.530 30 7.137 2.231 40 11.102 14.483 7.401 4.080 50 16.653 6.120 60 16.652 70 38.857 90.6973 90.69731047 80 44,405 моль/кг раствора при 20 ° C  раствора = молярность):
раствора = молярность):Для полной таблицы со щавелевой и трихлоруксусной кислотами — поверните экран!
Масс.% Уксусная кислота Citric acid Formic acid D-Lactic acid Oxalic acid Trichloroacetic acid 1 0.166 0.052 0.217 0.111 0.111 0.061 5 0.837 0.265 1.097 0.560 0.568 0.313 10 1.685 0.541 2.221 1.132 0.641 20 3.414 1.254 4.548 2. 
- Убедитесь, что обратимое уравнение сбалансировано в начале задачи; в противном случае в таблице будут использованы неправильные суммы.

 Константы диссоциации, кислотности, основности. Растворимость. Смеси. / / Растворы и концентрация. Приготовление процентных растворов. Растворы процентной концентрации. Растворы процентные (растворы процентной концентрации) весовые, объемно-весовые (условно процентные), и объемные.
Константы диссоциации, кислотности, основности. Растворимость. Смеси. / / Растворы и концентрация. Приготовление процентных растворов. Растворы процентной концентрации. Растворы процентные (растворы процентной концентрации) весовые, объемно-весовые (условно процентные), и объемные. П.П. Коростелев / 1962г / Издательство АН СССР
П.П. Коростелев / 1962г / Издательство АН СССР Ученые изучили способность полученного вещества поглощать излучение и флуоресцировать, а еще посмотрели на его молекулы под микроскопом.
Ученые изучили способность полученного вещества поглощать излучение и флуоресцировать, а еще посмотрели на его молекулы под микроскопом.
 Количества могут быть либо преобразованы в концентрации перед помещением их в таблицу ICE, либо после расчета равновесных количеств. В этом примере для таблицы ICE используются моли, а концентрации рассчитываются позже.
Количества могут быть либо преобразованы в концентрации перед помещением их в таблицу ICE, либо после расчета равновесных количеств. В этом примере для таблицы ICE используются моли, а концентрации рассчитываются позже.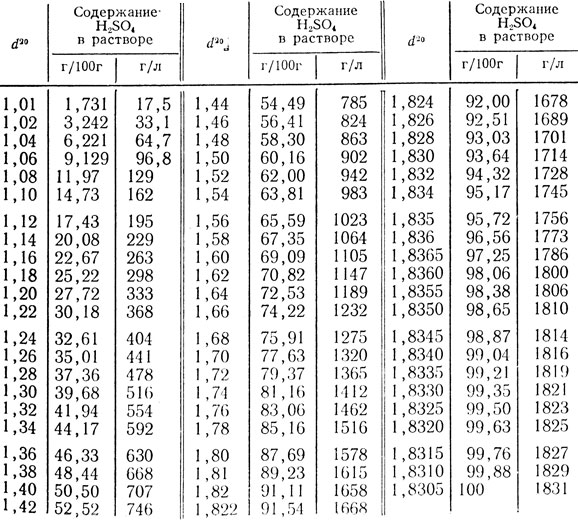
 x одинаков как для продуктов, так и для реагентов, поскольку равные стехиометрические количества A — и H 3 O + образуются при диссоциации ГК в воде.
x одинаков как для продуктов, так и для реагентов, поскольку равные стехиометрические количества A — и H 3 O + образуются при диссоциации ГК в воде. Используйте эти значения и K 92-4AC}}{2A}\nonumber \]
Используйте эти значения и K 92-4AC}}{2A}\nonumber \]
 Очевидно, что строка «изменение» может содержать отрицательное значение.
Очевидно, что строка «изменение» может содержать отрицательное значение.
 Для простоты предположим, что слово «концентрация» можно заменить на «парциальное давление» или «количества» при составлении таблиц ICE. 9{-6}\)?
Для простоты предположим, что слово «концентрация» можно заменить на «парциальное давление» или «количества» при составлении таблиц ICE. 9{-6}\)?

 0250
0250 112
112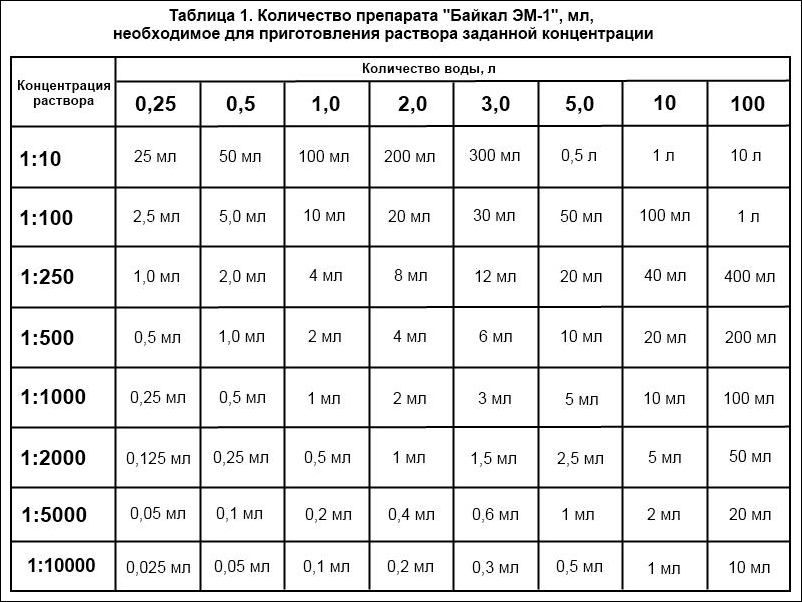 раствора = молярность):
раствора = молярность):