Число протонов нейтронов электронов в атоме элемента (Таблица)
Число протонов нейтронов и электронов в атоме химического элемента (изотопа) можно определить, зная порядковый номер элемента в периодической таблице Менделеева и его атомную массу:
— Число протонов = число электронов = порядковый номер элемента
— Число нейтронов = атомная масса – число протонов
Вычислим число нейтронов в атоме на примере кислорода 16O:
16 — 8 = 8 (в кислороде 8 нейтронов)
Таблица число протонов нейтронов электронов в атоме химического элемента
Справочная таблица содержит список элементов (изотопов) и их число протонов, нейтронов и электронов, а также атомную массу изотопа.
| Элемент, изотоп | Число протонов (= электронов) | Число нейтронов | Атомная масса изотопа |
| 1H | 1 | 0 | 1,0078 |
| 2H | 1 | 1 | 2,0141 |
| 3He | 2 | 1 | 3,0160 |
| 4He | 2 | 2 | 4,0026 |
| 6Li | 3 | 3 | 6,0151 |
| 7Li | 3 | 4 | 7,0160 |
| 9Be | 4 | 5 | 9,0122 |
| 10B | 5 | 5 | 10,0129 |
| 11B | 5 | 6 | 11,0093 |
| 12C | 6 | 6 | 12,0000 |
| 13C | 6 | 7 | 13,0034 |
| 14N | 7 | 7 | 14,0031 |
| 15N | 7 | 8 | 15,0001 |
| 16O | 8 | 8 | 15,9949 |
| 17O | 8 | 9 | 16,9991 |
| 18O | 8 | 10 | 17,9992 |
| 19F | 9 | 10 | 18,9984 |
| 20Ne | 10 | 10 | 19,9924 |
| 21Ne | 10 | 11 | 20,9938 |
| 22Ne | 10 | 12 | 21,9914 |
| 23Na | 11 | 12 | 22,9898 |
| 24Mg | 12 | 12 | 23,9850 |
| 25Mg | 12 | 13 | 24,9858 |
| 26Mg | 12 | 14 | 25,9826 |
| 27Al | 13 | 14 | 26,9815 |
| 28Si | 14 | 14 | 27,9769 |
| 29Si | 14 | 15 | 28,9765 |
| 30Si | 14 | 16 | 29,9738 |
| 31P | 16 | 30,9738 | |
| 32S | 16 | 16 | 31,9721 |
| 33S | 16 | 17 | 32,9715 |
| 34S | 16 | 18 | 33,9679 |
| 36S | 16 | 20 | 35,9671 |
| 35Cl | 17 | 18 | 34,9689 |
| 37Cl | 17 | 20 | 36,9659 |
| 36Ar | 18 | 18 | 35,9675 |
| 38Ar | 18 | 20 | 37,9627 |
| 40Ar | 18 | 22 | 39,9624 |
| 39K | 19 | 20 | 38,9637 |
| 40K* | 19 | 21 | 39,9640 |
| 41K | 19 | 22 | 40,9618 |
| 40Ca | 20 | 20 | 39,9626 |
| 42Ca | 20 | 22 | 41,9586 |
| 43Ca | 20 | 23 | 42,9588 |
| 44Ca | 20 | 24 | 43,9555 |
| 46Ca | 20 | 26 | 45,9537 |
| 48Ca* | 20 | 28 | 47,9525 |
| 45Sc | 21 | 24 | 44,9559 |
| 46Ti | 22 | 24 | 45,9526 |
| 47Ti | 22 | 25 | 46,9518 |
| 48Ti | 22 | 26 | 47,9479 |
| 49Ti | 22 | 27 | 48,9479 |
| 50Ti | 22 | 28 | 49,9448 |
| 50V* | 23 | 27 | 49,9472 |
| 51V | 23 | 28 | 50,9440 |
| 50Cr | 24 | 26 | 49,9460 |
| 52Cr | 24 | 28 | 51,9405 |
| 53Cr | 24 | 29 | 52,9406 |
| 54Cr | 24 | 30 | 53,9389 |
| 55Mn | 25 | 30 | 54,9380 |
| 54Fe | 26 | 28 | 53,9396 |
| 56Fe | 26 | 30 | 55,9349 |
| 57Fe | 26 | 31 | 56,9354 |
| 58Fe | 26 | 32 | 57,9333 |
| 59Co | 27 | 32 | 58,9332 |
| 58Ni | 28 | 30 | 57,9353 |
| 60Ni | 28 | 32 | 59,9308 |
| 61Ni | 28 | 33 | 60,9311 |
| 62Ni | 28 | 34 | 61,9283 |
| 64Ni | 28 | 36 | 63,9280 |
| 63Cu | 29 | 62,9296 | |
| 65Cu | 29 | 36 | 64,9278 |
| 64Zn | 30 | 34 | 63,9291 |
| 66Zn | 30 | 36 | 65,9260 |
| 67Zn | 30 | 37 | 66,9271 |
| 68Zn | 30 | 38 | 67,9248 |
| 70Zn | 30 | 40 | 69,9253 |
| 69Ga | 31 | 38 | 68,9256 |
| 71Ga | 31 | 40 | 70,9247 |
| 70Ge | 32 | 38 | 69,9242 |
| 72Ge | 32 | 40 | 71,9221 |
| 73Ge | 32 | 41 | 72,9235 |
| 74Ge | 32 | 42 | 73,9212 |
| 75As | 33 | 42 | 74,9216 |
| 74Se | 34 | 40 | 73,9225 |
| 76Se | 34 | 42 | 75,9192 |
| 77Se | 34 | 43 | 76,9199 |
| 78Se | 34 | 44 | 77,9173 |
| 80Se | 34 | 46 | 79,9165 |
| 82Se * | 34 | 48 | 81,9167 |
| 79Br | 35 | 44 | 78,9183 |
| 81Br | 35 | 80,9163 | |
| 78Kr * | 36 | 42 | 77,9204 |
| 80Kr | 36 | 44 | 79,9164 |
| 82Kr | 36 | 46 | 81,9135 |
| 83Kr | 36 | 47 | 82,9141 |
| 84Kr | 36 | 48 | 83,9115 |
| 86Kr | 36 | 50 | 85,9106 |
| 85Rb | 37 | 48 | 84,9118 |
| 87Rb* | 37 | 50 | 86,9092 |
| 84Sr | 38 | 46 | 83,9134 |
| 86Sr | 38 | 48 | 85,9093 |
| 87Sr | 38 | 49 | 86,9089 |
| 88Sr | 38 | 50 | 87,9056 |
| 89Y | 39 | 50 | 88,9058 |
| 90Zr | 40 | 50 | 89,9047 |
| 91Zr | 40 | 51 | 90,9056 |
| 92Zr | 40 | 52 | 91,9050 |
| 94Zr | 40 | 54 | 93,9063 |
| 93Nb | 41 | 52 | 92,9064 |
| 92Mo | 42 | 50 | 91,9068 |
| 94Mo | 42 | 52 | 93,9051 |
| 95Mo | 42 | 94,9058 | |
| 96Mo | 42 | 54 | 95,9047 |
| 97Mo | 42 | 55 | 96,9060 |
| 98Mo | 42 | 56 | 97,9054 |
| 100Mo* | 42 | 58 | 99,9075 |
| 96Ru | 44 | 52 | 95,9076 |
| 98Ru | 44 | 54 | 97,9053 |
| 99Ru | 44 | 55 | 98,9059 |
| 100Ru | 44 | 56 | 99,9042 |
| 101Ru | 44 | 57 | 100,9056 |
| 102Ru | 44 | 58 | 101,9043 |
| 104Ru | 44 | 60 | 103,9054 |
| 103Rh | 45 | 58 | 102,9055 |
| 102Pd | 46 | 56 | 101,9056 |
| 104Pd | 46 | 58 | 103,9040 |
| 105Pd | 46 | 59 | 104,9051 |
| 106Pd | 46 | 60 | 105,9035 |
| 108Pd | 46 | 62 | 107,9039 |
| 110Pd | 46 | 64 | 109,9052 |
| 107Ag | 47 | 60 | 106,9051 |
| 109Ag | 47 | 62 | 108,9048 |
| 106Cd | 48 | 58 | 105,9065 |
| 108Cd | 48 | 60 | 107,9042 |
| 110Cd | 48 | 62 | 109,9030 |
| 111Cd | 48 | 63 | 110,9042 |
| 112Cd | 48 | 64 | 111,9028 |
| 113Cd* | 48 | 65 | 112,9044 |
| 114Cd | 48 | 66 | 113,9034 |
| 116Cd* | 48 | 68 | 115,9048 |
| 113In | 49 | 64 | 112,9041 |
| 115In* | 49 | 66 | 114,9039 |
| 112Sn | 50 | 62 | 111,9048 |
| 114Sn | 50 | 64 | 113,9028 |
| 115Sn | 50 | 65 | 114,9033 |
| 116Sn | 50 | 66 | 115,9017 |
| 117Sn | 50 | 67 | 116,9030 |
| 118Sn | 50 | 68 | 117,9016 |
| 119Sn | 50 | 69 | 118,9033 |
| 120Sn | 50 | 70 | 119,9022 |
| 122Sn | 50 | 72 | 121,9034 |
| 124Sn | 50 | 74 | 123,9053 |
| 121Sb | 51 | 70 | 120,9038 |
| 123Sb | 51 | 72 | 122,9042 |
| 120Te | 52 | 68 | 119,9040 |
| 122Te | 52 | 70 | 121,9030 |
| 123Te | 52 | 71 | 122,9043 |
| 124Te | 52 | 72 | 123,9028 |
| 125Te | 52 | 73 | 124,9044 |
| 126Te | 52 | 74 | 125,9033 |
| 128Te* | 52 | 76 | 127,9045 |
| 130Te* | 52 | 78 | 129,9062 |
| 127I | 53 | 74 | 126,9045 |
| 124Xe* | 54 | 70 | 123,9059 |
| 126Xe | 54 | 72 | 125,9043 |
| 128Xe | 54 | 74 | 127,9035 |
| 129Xe | 54 | 75 | 128,9048 |
| 130Xe | 54 | 76 | 129,9035 |
| 131Xe | 54 | 77 | 130,9051 |
| 132Xe | 54 | 78 | 131,9042 |
| 134Xe | 54 | 80 | 133,9054 |
| 136Xe* | 54 | 82 | 135,9072 |
| 133Cs | 55 | 78 | 132,9055 |
| 130Ba* | 56 | 74 | 129,9063 |
| 132Ba | 56 | 76 | 131,9051 |
| 134Ba | 56 | 78 | 133,9045 |
| 135Ba | 56 | 79 | 134,9057 |
| 136Ba | 56 | 80 | 135,9046 |
| 137Ba | 56 | 81 | 136,9058 |
| 138Ba | 56 | 82 | 137,9052 |
| 138La* | 57 | 81 | 137,9071 |
| 139La | 57 | 82 | 138,9064 |
| 136Ce | 58 | 78 | 135,9072 |
| 138Ce | 58 | 80 | 137,9060 |
| 140Ce | 58 | 82 | 139,9054 |
| 142Ce | 58 | 84 | 141,9092 |
| 141Pr | 59 | 82 | 140,9077 |
| 142Nd | 60 | 82 | 141,9077 |
| 143Nd | 60 | 83 | 142,9098 |
| 144Nd* | 60 | 84 | 143,9101 |
| 145Nd | 60 | 85 | 144,9126 |
| 146Nd | 60 | 86 | 145,9131 |
| 148Nd | 60 | 88 | 147,9169 |
| 150Nd* | 60 | 90 | 149,9209 |
| 144Sm | 62 | 82 | 143,9120 |
| 147Sm* | 62 | 85 | 146,9149 |
| 148Sm* | 62 | 86 | 147,9148 |
| 149Sm | 62 | 87 | 148,9172 |
| 150Sm | 62 | 88 | 149,9173 |
| 152Sm | 62 | 90 | 151,9197 |
| 154Sm | 62 | 92 | 153,9222 |
| 151Eu* | 63 | 88 | 150,9199 |
| 153Eu | 63 | 90 | 152,9212 |
| 152Gd* | 64 | 88 | 151,9198 |
| 154Gd | 64 | 90 | 153,9209 |
| 155Gd | 64 | 91 | 154,9226 |
| 156Gd | 64 | 92 | 155,9221 |
| 157Gd | 64 | 93 | 156,9240 |
| 158Gd | 64 | 94 | 157,9241 |
| 160Gd | 64 | 96 | 159,9271 |
| 159Tb | 65 | 94 | 158,9253 |
| 156Dy | 66 | 90 | 155,9243 |
| 158Dy | 66 | 92 | 157,9244 |
| 160Dy | 66 | 94 | 159,9252 |
| 161Dy | 66 | 95 | 160,9269 |
| 162Dy | 66 | 96 | 161,9268 |
| 163Dy | 66 | 97 | 162,9287 |
| 164Dy | 66 | 98 | 163,9292 |
| 165Ho | 67 | 98 | 164,9303 |
| 162Er | 68 | 94 | 161,9288 |
| 164Er | 68 | 96 | 163,9292 |
| 166Er | 68 | 98 | 165,9303 |
| 167Er | 68 | 99 | 166,9320 |
| 168Er | 68 | 100 | 167,9324 |
| 170Er | 68 | 102 | 169,9355 |
| 169Tm | 69 | 100 | 168,9342 |
| 168Yb | 70 | 98 | 167,9339 |
| 170Yb | 70 | 100 | 169,9348 |
| 171Yb | 70 | 101 | 170,9363 |
| 172Yb | 70 | 102 | 171,9364 |
| 173Yb | 70 | 103 | 172,9382 |
| 174Yb | 70 | 104 | 173,9389 |
| 176Yb | 70 | 106 | 175,9426 |
| 175Lu | 71 | 104 | 174,9408 |
| 176Lu* | 71 | 105 | 175,9427 |
| 174Hf* | 72 | 102 | 173,9400 |
| 176Hf | 72 | 104 | 175,9414 |
| 177Hf | 72 | 105 | 176,9432 |
| 178Hf | 72 | 106 | 177,9437 |
| 179Hf | 72 | 107 | 178,9458 |
| 180Hf | 72 | 108 | 179,9466 |
| 181Ta | 73 | 108 | 180,9480 |
| 180W* | 74 | 106 | 179,9467 |
| 182W | 74 | 108 | 181,9482 |
| 183W | 74 | 109 | 182,9502 |
| 184W | 74 | 110 | 183,9509 |
| 186W | 74 | 112 | 185,9544 |
| 185Re | 75 | 110 | 184,9530 |
| 187Re* | 75 | 112 | 186,9558 |
| 184Os | 76 | 108 | 183,9525 |
| 186Os* | 76 | 110 | 185,9538 |
| 187Os | 76 | 111 | 186,9558 |
| 188Os | 76 | 112 | 187,9558 |
| 189Os | 76 | 113 | 188,9581 |
| 190Os | 76 | 114 | 188,9581 |
| 192Os | 76 | 116 | 191,9615 |
| 191Ir | 77 | 114 | 190,9606 |
| 193Ir | 77 | 116 | 191,9626 |
| 190Pt* | 78 | 112 | 189,9599 |
| 192Pt | 78 | 114 | 191,9610 |
| 194Pt | 78 | 116 | 193,9627 |
| 195Pt | 78 | 117 | 194,9648 |
| 196Pt | 78 | 118 | 195,9650 |
| 198Pt | 78 | 120 | 197,9679 |
| 197Au | 79 | 118 | 196,9666 |
| 196Hg | 80 | 116 | 195,9658 |
| 198Hg | 80 | 118 | 197,9668 |
| 199Hg | 80 | 119 | 198,9683 |
| 200Hg | 80 | 120 | 199,9683 |
| 201Hg | 80 | 121 | 200,9703 |
| 202Hg | 80 | 122 | 201,9706 |
| 204Hg | 80 | 124 | 203,9735 |
| 203Tl | 81 | 122 | 202,9723 |
| 205Tl | 81 | 124 | 204,9744 |
| 204Pb | 82 | 122 | 203,9730 |
| 206Pb | 82 | 124 | 205,9745 |
| 207Pb | 82 | 125 | 206,9759 |
| 208Pb | 82 | 126 | 207,9767 |
| 209Bi* | 83 | 126 | 208,9804 |
| 232Th* | 90 | 142 | 232,0381 |
| 235U* | 92 | 143 | 235,0439 |
* это нестабильные изотопы и с большим периодом полураспада, который равняется возрасту Вселенной.
Что у атома внутри
Валерия Сирота
«Квантик» №11, 2018
Слово «атом» по-гречески значит ‘неделимый’. Ещё древние греки придумали идею, что всё на свете, как из кирпичиков, сложено из крошечных «кусочков» — атомов. Но это было лишь одно из возможных предположений. Что это за кусочки и существуют ли они, никто не знал до XIX века, когда химики разобрались, что такое молекула, и составили список видов атомов — таблицу химических элементов1.
А в самом конце XIX века вдруг выяснилось, что атом вовсе не неделимый! Он состоит из крошечного тяжёлого ядра и очень лёгких электронов, крутящихся вокруг. Потом оказалось, что и ядро можно разделить на части (хотя и очень трудно!): оно состоит из двух очень похожих видов частиц — протонов и нейтронов. Их массы почти равны, а у электрона масса почти в 2000 раз меньше (соотношение примерно как между человеком и мышкой).
Главное различие между этими частицами в том, что протоны притягивают электроны (и сами к ним притягиваются).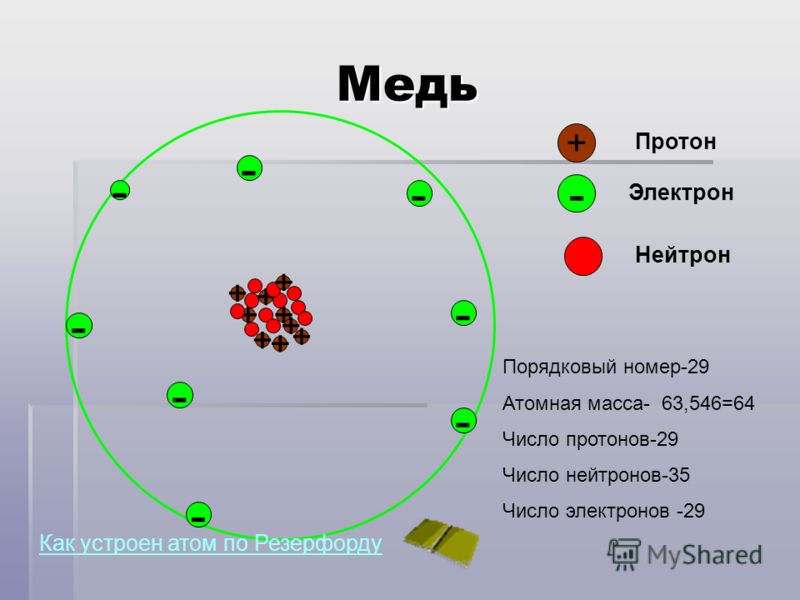 А два протона (или два электрона) отталкиваются друг от друга с такой же силой. Эти силы называются электрическими. Нейтроны же вовсе не притягивают электроны, да и между собой и с протонами хоть и взаимодействуют, но совсем по-другому (про это мы скажем чуть ниже): в электрическом взаимодействии они не участвуют.
А два протона (или два электрона) отталкиваются друг от друга с такой же силой. Эти силы называются электрическими. Нейтроны же вовсе не притягивают электроны, да и между собой и с протонами хоть и взаимодействуют, но совсем по-другому (про это мы скажем чуть ниже): в электрическом взаимодействии они не участвуют.
Договорились считать2, что у протонов положительный электрический заряд, у электронов — отрицательный. А у нейтронов электрический заряд — ноль. Получается правило: одинаковые по знаку заряды отталкиваются, заряды разного знака — притягиваются.
Не путайте электрическую силу с гравитационным притяжением! В самом деле, все тела, имеющие массу, притягивают друг друга. Но эта сила крошечная даже для таких «средне-тяжёлых» тел, как, например, мы с вами. Большая она только тогда, когда одно из тел очень тяжёлое — звезда, планета или хотя бы астероид. А сила гравитационного притяжения протонов (и тем более протона и электрона) ничтожна.
Электрическая сила, напротив, очень велика: если бы можно было закрепить в каком-то месте протон (и воздух, конечно, убрать), а в трёх сантиметрах над ним поместить другой протон, то второй протон не упал бы вниз, а полетел бы вверх — отталкивание одного протона сильнее гравитационного притяжения всей Земли!
Обычно вещи вокруг нас не имеют электрического заряда — в них столько же электронов, сколько и протонов. Но от некоторых атомов электроны довольно легко отрываются. И вот если отодрать от атомов одного предмета тысячу или миллион-другой электронов и «прицепить» к атомам другого предмета, эти два предмета окажутся заряжены: один — положительно (в нём протонов больше, чем электронов), а другой — отрицательно (в нём лишние электроны). А ведь тысяча протонов, если они рядом, притягивают каждый электрон в тысячу раз сильнее, чем один протон. И начнут эти два предмета притягиваться друг к другу… Случалось вам видеть что-нибудь похожее? Например, когда вы старательно причёсываетесь пластмассовой расчёской, а волосы сами собой поднимаются ей навстречу?
Но от некоторых атомов электроны довольно легко отрываются. И вот если отодрать от атомов одного предмета тысячу или миллион-другой электронов и «прицепить» к атомам другого предмета, эти два предмета окажутся заряжены: один — положительно (в нём протонов больше, чем электронов), а другой — отрицательно (в нём лишние электроны). А ведь тысяча протонов, если они рядом, притягивают каждый электрон в тысячу раз сильнее, чем один протон. И начнут эти два предмета притягиваться друг к другу… Случалось вам видеть что-нибудь похожее? Например, когда вы старательно причёсываетесь пластмассовой расчёской, а волосы сами собой поднимаются ей навстречу?
И ещё. В отличие от, например, животных одного вида, которые всё-таки немножко отличаются друг от друга, все протоны (или все нейтроны, или электроны) совершенно одинаковы. Так что, например, электрон, «потерявший» свой атом, уже не сможет найти его среди других таких же…
Электрическое притяжение к протонам и держит электроны в атоме, не даёт им улететь. Как мы вскоре убедимся, оно же скрепляет атомы в молекулы. Но не только! Оно же заставляет молекулы одних тел действовать на молекулы других. Если не считать силы гравитационного притяжения, с которой все мы знакомимся с детства (глядя, как падают на пол выпущенные из руки игрушки), все остальные наблюдаемые нами физические явления вызваны как раз электрической силой. Упругость пружины, трение, прилипание разных вещей друг к другу или, наоборот, их взаимное отталкивание — за всё это отвечает взаимодействие электронов одних атомов с ядрами и электронами других.
Как мы вскоре убедимся, оно же скрепляет атомы в молекулы. Но не только! Оно же заставляет молекулы одних тел действовать на молекулы других. Если не считать силы гравитационного притяжения, с которой все мы знакомимся с детства (глядя, как падают на пол выпущенные из руки игрушки), все остальные наблюдаемые нами физические явления вызваны как раз электрической силой. Упругость пружины, трение, прилипание разных вещей друг к другу или, наоборот, их взаимное отталкивание — за всё это отвечает взаимодействие электронов одних атомов с ядрами и электронами других.
Но вернёмся к нашим атомам. В нормальной ситуации атом электронейтрален, то есть не имеет заряда: у него электронов столько, сколько протонов в ядре. Если это не так (например, кто-то похитил у атома электрон или атом где-то захватил себе чужой), такой «калечный» атом называется ионом. Тогда он заряжен — положительно, если электронов не хватает, и отрицательно, если есть лишние.
Протоны притягивают к себе электроны и заставляют их вертеться вокруг ядра, не улетая далеко. А нейтроны в электрическом взаимодействии не участвуют. Зачем же они тогда нужны? Затем, чтобы «склеивать» протоны в ядре — ведь протоны отталкиваются друг от друга электрическими силами, и без нейтронов они бы разлетелись в разные стороны! Силы, которыми нейтроны удерживают протоны вместе, — уже не электрические. Они действуют только на очень маленьких расстояниях — внутри ядра3.
А нейтроны в электрическом взаимодействии не участвуют. Зачем же они тогда нужны? Затем, чтобы «склеивать» протоны в ядре — ведь протоны отталкиваются друг от друга электрическими силами, и без нейтронов они бы разлетелись в разные стороны! Силы, которыми нейтроны удерживают протоны вместе, — уже не электрические. Они действуют только на очень маленьких расстояниях — внутри ядра3.
Теперь можно догадаться, чем отличаются друг от друга разные сорта атомов: у них разное количество электронов. И, соответственно, протонов в ядре. Номер элемента в таблице Менделеева (число, написанное крупно в правом верхнем углу каждой клетки) — это число протонов в атомах этого элемента. А как узнать количество нейтронов? По массе атома, ведь массы протонов и нейтронов равны! Например, в атоме водорода — самом маленьком и самом лёгком — всего один протон. А в ядре атома гелия два протона, и при этом атом гелия в 4 раза тяжелее атома водорода. Электроны не в счёт — значит, в ядре гелия 2 нейтрона!
Масса атома — в единицах массы водорода — написана в каждой клетке внизу4. Легко убедиться, что у нетяжёлых атомов нейтронов примерно столько же, сколько протонов. А у тяжёлых — нейтронов больше: всё труднее становится удерживать всю эту громоздкую конструкцию.
Легко убедиться, что у нетяжёлых атомов нейтронов примерно столько же, сколько протонов. А у тяжёлых — нейтронов больше: всё труднее становится удерживать всю эту громоздкую конструкцию.
Но почему эта масса нецелая? Не может же, например, у хлора быть 18 с половиной нейтронов? Конечно, нет. Просто это значит, что в природе бывают атомы с 17 электронами, 17 протонами и 18 нейтронами, а бывают такие, у которых электронов и протонов столько же, а число нейтронов отличается. И те и другие — атомы хлора, ведь электронов и протонов столько же. Такие «подвиды» атомов одного вида называют изотопами. В таблице Менделеева написана средняя масса атомов каждого вида (с учётом распространённости их изотопов).
В большинстве клеток средняя масса близка к целому числу. Это значит, что, как правило, в природе больше всего какого-то одного изотопа атомов каждого вида, а атомы с другим количеством нейтронов встречаются не так уж часто. Почти всегда можно не обращать на них внимания и округлять массу до ближайшего целого числа. {3}_{1}\mathrm{H}\) — сверхтяжёлый водород, тритий.
{3}_{1}\mathrm{H}\) — сверхтяжёлый водород, тритий.
Ну-ка, проверим — всё ли понятно?
Художник Мария Усеинова
1 А разобрались ли вы? Для проверки и чтобы понять, как непросто было до всего этого догадаться, предлагаем вам решить «контрольную задачу» в конце статьи.
2 Вообще-то, когда договаривались, про электроны и протоны ещё ничего не знали — это было лет за 150 до их открытия. Тогда положительным назвали заряд, который получается на стекле, если его потереть шёлковой тряпочкой. Теперь мы знаем, что электроны со стекла «убегают» на шёлк.
3 Зато на этих маленьких расстояниях они очень большие — надо ведь «победить» электрическое отталкивание! Поэтому они так и называются — «сильные силы» (strong force), сильное взаимодействие.
4 Тут мы чуть-чуть обманываем читателя, но это не беда: дальше придётся обманывать ещё сильнее…
| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | O | |
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | K | |
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
Таблицу Менделеева хотят расширить до 173 элементов
01 июля 2021 17:21 Наталия Теряева
Президент РАН Александр Сергеев (в центре) и академик Юрий Оганесян (второй слева) на международном совещании «Сверхтяжелые элементы» в Дубне.
Фото Наталия Теряева/Вести.Ru
Известный на весь мир советский и российский учёный Юрий Цолакович Оганесян. Сейчас академику 88 лет.
Фото Объединённого института ядерных исследований.
Временная шкала показывает, когда открывались те или иные элементы. Перевод Вести.Ru.
Иллюстрация F-X Coudert, CNRS.
Период полураспада сверхтяжелых элементов исчисляется долями секунд. Перевод Вести.Ru.
Иллюстрация IAEA.
Последний химический элемент таблицы Менделеева сегодня имеет номер 118. Расчёты физиков и химиков показывают, что мы вполне можем создать 173 элемента. Как их получить, обсуждают в Дубне на международном совещании «Сверхтяжелые элементы».
Последний химический элемент таблицы Менделеева сегодня имеет номер 118. Речь об элементе под названием оганесон. Но расчёты физиков и химиков указывают на то, что мы вполне можем получить 173 элемента. Как это реализовать, ученые обсуждают в Дубне на международном совещании «Сверхтяжелые элементы». В дискуссии участвуют президент РАН Александр Сергеев и члены Совета РАН по физике тяжелых ионов.
Совещание проходит в Дубне, так как именно здесь, в Лаборатории ядерных реакций Объединенного института ядерных исследований, впервые в мире был синтезирован тот самый «конечный» 118-й элемент, а также пятерка других – со 113-го по 117-й.
Кстати, элемент под номером 118 назван оганесоном в честь академика Юрия Оганесяна, научного руководителя Лаборатории ядерных реакций.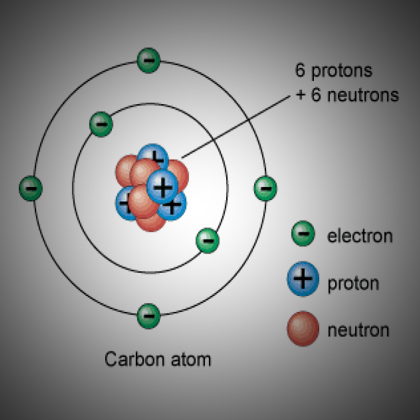 Его команда создала все шесть сверхтяжелых химических элементов от номера 113 до номера 118.
Его команда создала все шесть сверхтяжелых химических элементов от номера 113 до номера 118.
Известный на весь мир советский и российский учёный Юрий Цолакович Оганесян. Сейчас академику 88 лет.
Фото Объединённого института ядерных исследований.
Как дополнить Природу своими рукамиЧеловечество в лице великих ученых еще в начале ХХ века пришло к выводу, что химические элементы можно не только находить в природе, но и создавать искусственно.
Первым «искусственным» элементом стал технеций, стоящий в таблице Менделеева под номером 43. Его синтезировали в 1937 году, а впоследствии обнаружили в ничтожных количествах в природе.
Сверхтяжелых элементов с номерами от 95-го до 118-го в природе не существует. Да и в стенах лаборатории сверхтяжелые элементы живут доли секунды.
Жизнь таких элементов столь коротка из-за их супертяжелых ядер, в которых в невероятной тесноте обитают почти три сотни протонов и нейтронов.
Напомним, что из протонов и нейтронов состоят ядра всех химических элементов. Но, чем больше в ядре протонов и нейтронов, тем сильнее взаимодействия между ними – как в толпе вагона метро.
Подобно выскакивающим из набитого вагона пассажирам, из переполненного ядра всякого сверхтяжелого элемента с облегчением вылетает на волю компания из двух протонов и двух нейтронов – альфа-частица. Так сверхтяжелый элемент превращается в более легкий и «жизнеспособный». Этот процесс физики называют альфа-распадом.
Таким образом, все сверхтяжелые элементы радиоактивны. И это объясняет, почему сверхтяжелых элементов нет в природе. Даже если они и образуются где-то в естественных условиях, человечество их попросту не может «поймать».
Так что синтез сверхтяжелых элементов сравним с актом творения Природы. Это сверхзадача, которая удивительным образом оказалась под силу человеку – его мысли и его технологиям.
Временная шкала показывает, когда открывались те или иные элементы.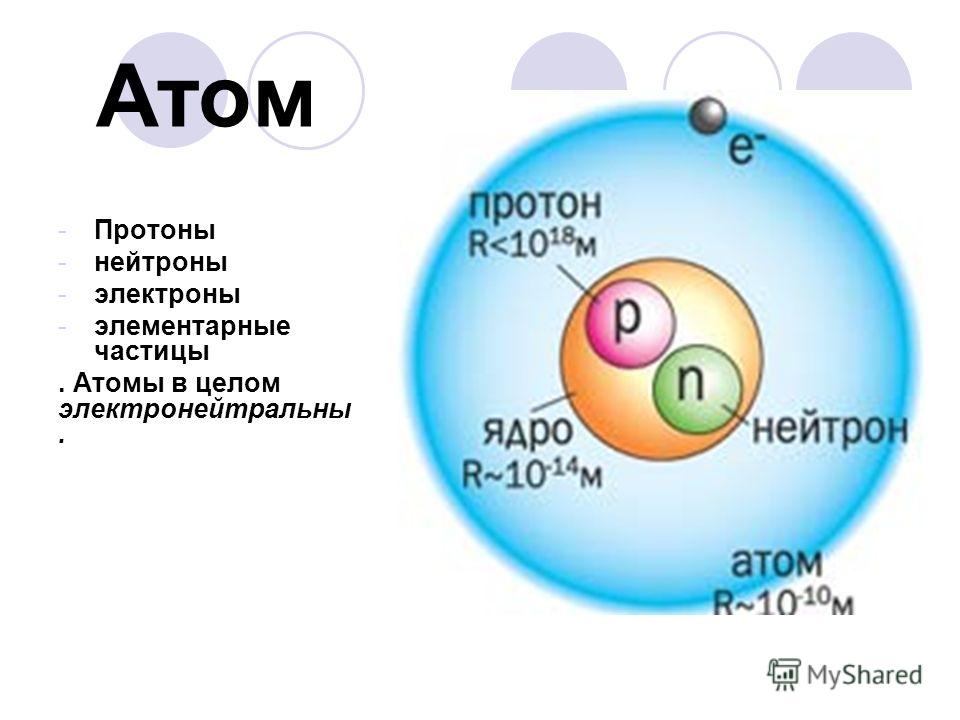 Перевод Вести.Ru.
Перевод Вести.Ru.
Иллюстрация F-X Coudert, CNRS.
Есть ли пределы у Природы?Создатели сверхтяжелых элементов, конечно, думали над вопросом, какое максимальное число протонов и нейтронов можно объединить в ядро и окружить облаком из электронов, чтобы такую конструкцию можно было назвать химическим элементом.
Четыре года назад группа новозеландских и американских физиков заявила: на оганесоне таблица Менделеева закончилась, и химическим элементам с номерами 119 и 120 уже не бывать.
Однако более поздние расчеты французских, шведских, польских, финских специалистов показали, что на оганесоне таблица Менделеева не закончится. Номер последнего элемента таблицы Менделеева – 173!
До него, конечно, еще нужно добраться, но дубненским физикам технология их создания уже понятна.
Для синтеза элементов выше 118-го в Объединенном институте ядерных исследований недавно построили «Фабрику сверхтяжелых элементов». Там собираются начать синтез химических элементов под номерами 119 и 120 осенью 2021 года.
Сверхтяжелые элементы могут стать волшебным инструментом получения частиц из пустоты, то есть из вакуума. Осуществить эту известную идею в Дубне на коллайдере NICA предложил 30 июня академик Юрий Оганесян. Коллайдер сейчас строится в Дубне и должен войти в строй через два года.
Согласно физической теории, сильное электрическое поле может рождать в вакууме пару двух частиц – электрон и позитрон. Позитрон – это античастица для электрона. Он всем похож на электрон, только заряжен положительно.
Еще никому в мире не удалось получить электрон-позитронную пару из вакуума с помощью электрического поля.
Но коллайдер NICA будет способен ускорять тяжелые ядра урана. В ядре урана 92 протона. При сближении двух тяжелых ядер урана возникает очень сильное электрическое поле. Его создают заряды обоих ядер. Это сильное поле должно рождать в вакууме пару двух элементарных частиц – электрон и позитрон.
Что при этом будет происходить? Один протон из ядра урана будет забирать рожденный из вакуума электрон и превращаться вместе с ним в нейтрон. После этого в ядре урана останется 91 протон, а нейтронов станет на один больше.
После этого в ядре урана останется 91 протон, а нейтронов станет на один больше.
Позитрон же улетит восвояси. Его «увидит» детектор, после чего физики сообщат миру о фундаментальном событии – рождении электрон-позитронной пары из вакуума с помощью электрического поля. Такое вот волшебство.
Второй вариант вынашивания и рождения электрон-позитронной пары из вакуума: создание сильного электрического поля с помощью мощного лазера.
Период полураспада сверхтяжелых элементов исчисляется долями секунд. Перевод Вести.Ru.
Иллюстрация IAEA.
Президент РАН Александр Сергеев в ходе своего доклада перед участниками совещания дополнил перечень новых физических явлений, которые можно будет получить на российских установках с помощью такого лазера. Также академик озвучил необходимые параметры такого инструмента.
К примеру, для рождения электрон-позитронной пары понадобится петаваттный лазер, то есть лазер мощностью 10-100 петаватт. Один петаватт равен 1015 Вт.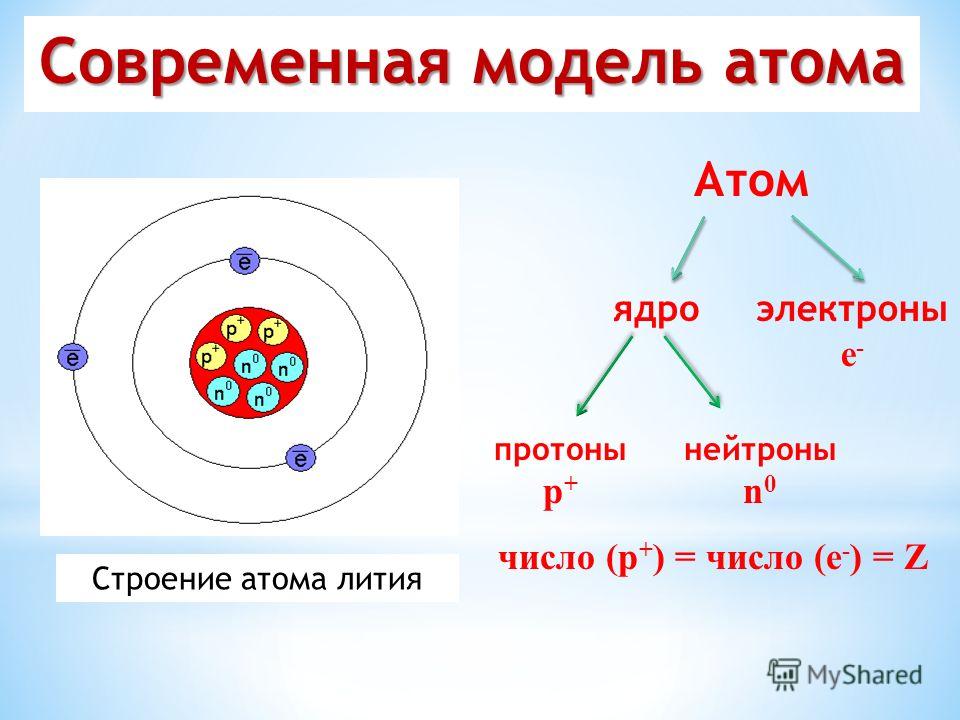
Лазерный центр такой выдающейся мощности для ядерно-физических исследований академик Сергеев предложил построить в Дубне. Его созданием инженеры займутся после завершения строительства коллайдера NICA.
Ранее мы сообщали о создании физиками новой периодической системы химических элементов, отражающей законы ядерной физики, а не химии.
Больше новостей из мира науки вы найдёте в разделе «Наука» на медиаплатформе «Смотрим».
наука лазер периодическая таблица Менделеева Объединенный институт ядерных исследований Александр Сергеев РАН Юрий Оганесян новости
Нахождение числа нейтронов, протонов и электронов в атоме
Репетитор
по физике
916 478 1032
П
Р
О
Г
Р
А
М
М
И
Р
О
В
А
Н
И
Е
Репетитор
916 478 1032
Репетитор
по физике
916 478 1032
Репетитор
по алгебре
916 478 1032
Репетитор
по физике
916 478 1032
Атом состоит из ядра и вращающихся вокруг ядра электронов.
Ядро состоит из протонов и нейтронов
Протон- положительно заряженная частица
масса протона равна единице, заряд протона равен единице
Нейтрон-нейтральная частица
масса нейтрона равна единице, заряд нейтрона равен нулю
Электрон- отрицательно заряженная частица
Заряд электрона равен -1, а масса электрона равна нулю
Порядковый номер элемента в таблице Менделеева указывает на число электронов в атоме
Количество протонов в атоме равно количеству электронов , так как атом электрически нейтрален
Масса атома складывается из числа протонов и числа нейтронов, масса электрона не учитывается
Рассмотрим фрагмент таблицы Менделеева и найдем количество протонов, нейтронов и электронов
в атоме водорода
После чего начертим модель атома водорода
Порядковый номер атома водорода равен единице, значит атом имеет:
1 электрон
1 протон
Для нахождения количества нейтронов нужно из массы вычесть число протонов
Масса атома водорода равна единице
Количество нейтронов=1-1=0
В атоме водорода нет нейтронов
Модель атома водорода:
Рассмотрим фрагмент таблицы Менделеева и найдем количество протонов, нейтронов и электронов
в атоме гелия
После чего начертим модель атома гелия
Порядковый номер атома гелия равен 2, значит атом имеет:
2 электрона
2 протона
Для нахождения количества нейтронов нужно из массы вычесть число протонов
Масса атома гелия равна 4
Количество нейтронов=4-2=2
В атоме гелия 2 нейтрона
Модель атома гелия:
Задача 1.
С помощью фрагмента таблицы Менделеева найти количество протонов, нейтронов и электронов в атоме лития
Массу атома округлить до 7.
Показать ответ Показать решение Видеорешение
Ответ: 3 протона 3 электрона 4 нейтрона
Дано:
M=7
Z=3
Протонов 3
электронов 3
Нейтронов=M-Z=7-3=4
Ответ: 3 протона 3 электрона 4 нейтрона
Задача 2.
С помощью фрагмента таблицы Менделеева найти количество протонов, нейтронов и электронов в атоме углерода.
Показать ответ Показать решение Видеорешение
Ответ: 6 протонов 6 электронов 6 нейтронов
Дано:
M=12
Z=6
Протонов 6
электронов 6
Нейтронов=M-Z=12-6=6
Ответ: 6 протонов 6 электронов 6 нейтронов
Задача 3.
С помощью фрагмента таблицы Менделеева найти количество протонов, нейтронов и электронов в атоме азота.
Показать ответ Показать решение Видеорешение
Ответ: 7 протонов 7 электронов 7 нейтронов
Дано:
M=14
Z=7
Протонов 7
электронов 7
Нейтронов=M-Z=14-7=7
Ответ: 7 протонов 7 электронов 7 нейтронов
Задача 4.
С помощью фрагмента таблицы Менделеева найти количество протонов, нейтронов и электронов в атоме кислорода.
Атомную массу округлить до 16.
Показать ответ Показать решение Видеорешение
Ответ: 8 протонов 8 электронов 8 нейтронов
Дано:
M=16
Z=8
Протонов 8
электронов 8
Нейтронов=M-Z=16-8=8
Ответ: 8 протонов 8 электронов 8 нейтронов
Как мы видим в таблице Менделеева выше стоит порядковый номер, то есть заряд, который равен числу протонов
и электронов , а под ним расположена атомная масса.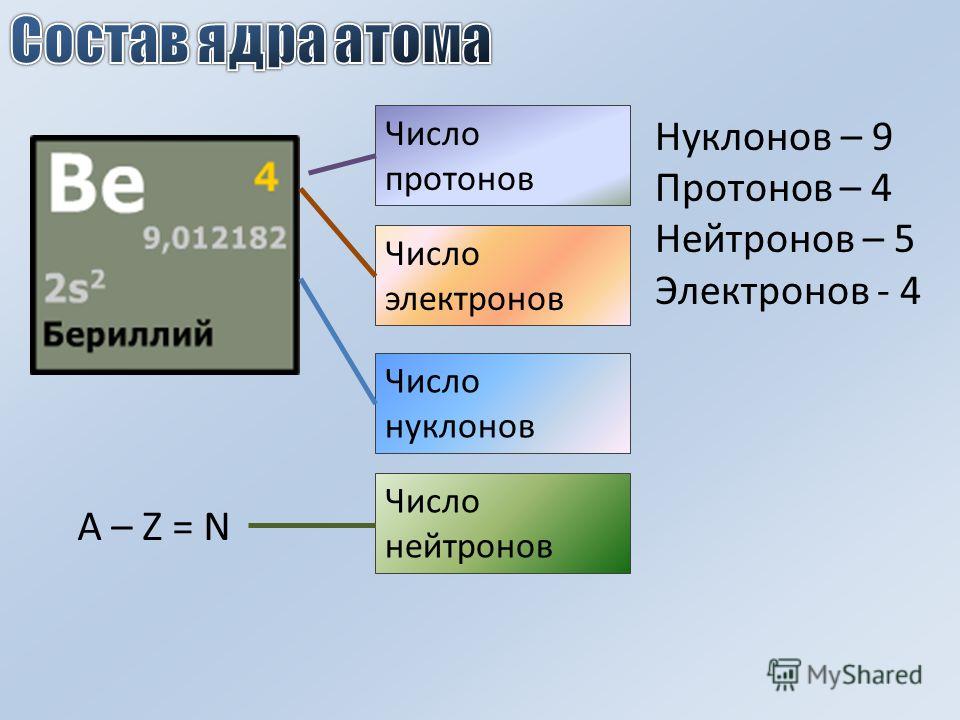 {18}\textrm{O} \)
{18}\textrm{O} \)
В погоне за призраками Российские ученые получили 117-й элемент таблицы Менделеева: Наука и техника: Lenta.ru
Российские физики вместе с коллегами из США синтезировали 117-й элемент таблицы Менделеева. Такие заголовки появились в среду, 7 апреля, в самых различных изданиях, а сюжеты об этом событии прошли по основным телеканалам. Насколько важно получение новых элементов и есть ли в них какой-то практический смысл?
Все мы со школы помним таблицу Менделеева. В ней собраны элементы, из которых состоит окружающий нас мир. Учителя химии обычно заставляют запоминать, какие элементы представлены в самом начале таблицы, — редко они спрашивают, что находится дальше второй строки (напомним, ее завершает аргон — элемент с номером 18). Всего на сегодняшний день таблица Менделеева официально включает 112 элементов, и последний из них — коперниций.
У непосвященного человека возникает вопрос, откуда берутся новые элементы, которые ученые добавляют в таблицу, и сколько всего этих элементов. Для начала разберемся со вторым вопросом.
Для начала разберемся со вторым вопросом.
Почти не существуют
Правильного ответа на него никто не знает. Исследователи могут утверждать, что тот или иной элемент существует, только после того, как обнаружат его. Однако далеко не все элементы в принципе возможно обнаружить. Дело в том, что многие из них являются нестабильными — то есть спустя некоторое время после образования они распадаются на части. О скорости этого процесса судят по длительности периода полураспада — времени, за которое половина ядер того или иного элемента распадется на части. В очень грубом приближении период полураспада элемента приблизительно на 30 процентов короче его среднего времени жизни.
Живущие на Земле ученые могут найти только те элементы, время жизни которых больше возраста Земли (около 4,5 миллиарда лет). Все остальные элементы к моменту появления на планете исследователей уже распались на части — на изотопы более легких элементов. Некоторые из известных специалистам элементов с относительно небольшим периодом полураспада в наши дни «доживают» свой век — их еще можно обнаружить, но в очень небольшом количестве.
Ученые довольно быстро смогли заполнить первые несколько десятков ячеек таблицы Менделеева, но чем больше становился атомный номер (а значит, и вес) элемента, тем труднее было его обнаружить. Это наблюдение наводило на мысль о том, что чем тяжелее элемент, тем меньше у него период полураспада. По мере развития наук, названия которых начинаются со слов «ядерная» или «атомная», стало ясно, что это предположение правомерно. Нашлась и причина, по которой тяжелые элементы стремятся развалиться на части.
Изотопами называют разновидности атомов (и ядер) одного химического элемента, отличающиеся количеством нейтронов в ядре.
Ядра всех элементов, за исключением водорода, состоят из протонов и нейтронов. Массы этих элементарных частиц приблизительно равны, но протон обладает положительным зарядом, а нейтрон электрически нейтрален. По мере увеличения атомного номера элемента в его ядре растет число протонов и нейтронов, причем количество протонов возрастает только на одну единицу, а вот число нейтронов может изменяться.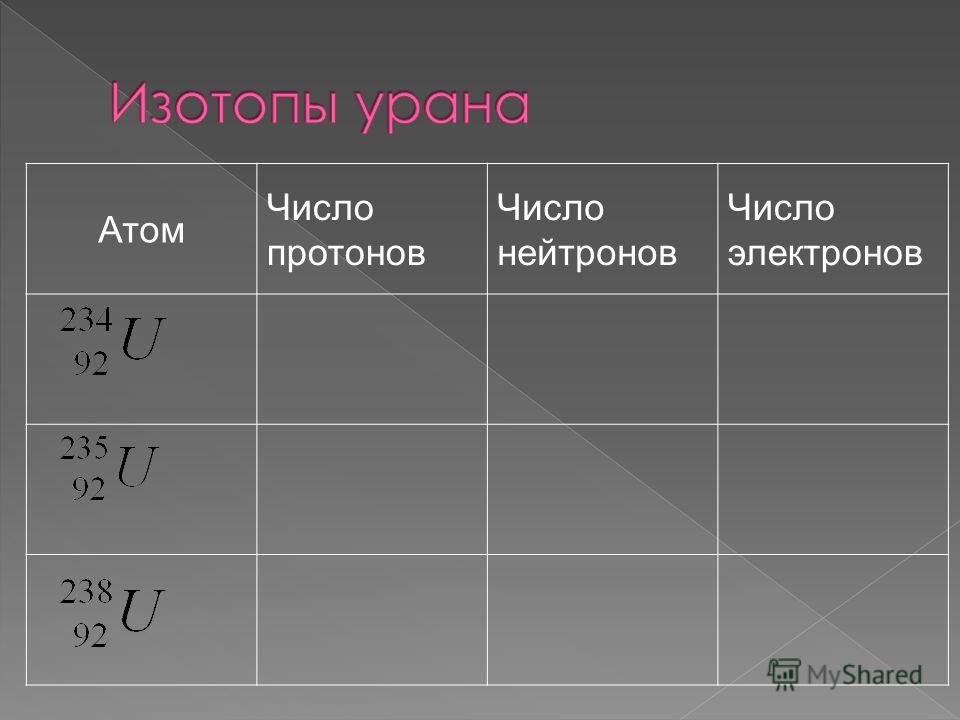 Физики (а исследование свойств ядра является их прерогативой) выяснили, что ядра могут расти только до определенных пределов — если поместить в них слишком много протонов и нейтронов, возникающие внутри ядер силы в буквальном смысле разрывают их изнутри.
Физики (а исследование свойств ядра является их прерогативой) выяснили, что ядра могут расти только до определенных пределов — если поместить в них слишком много протонов и нейтронов, возникающие внутри ядер силы в буквальном смысле разрывают их изнутри.
Максимально возможное для одного ядра число нейтронов и протонов содержится в ядре урана (атомный номер 92) — хотя и этот элемент уже не очень устойчив. Все элементы, в ядрах которых протонов больше, чем в ядре урана, нестабильны. Такие элементы объединяют в общую группу трансурановых элементов, и ученые находят их не в природе, а в своих лабораториях. На этом месте мы подошли к ответу на второй вопрос, поставленный в начале статьи.
Как их получают
В середине XX века физики научились получать элементы, которые не встречаются в природе, искусственно. Основная идея всех подобных экспериментов проста: надо взять какой-нибудь из стабильных элементов и добавить в него лишних протонов и нейтронов. В итоге ядро элемента-мишени превратится в ядро более тяжелого элемента (точнее, в ядро одного из многочисленных изотопов этого более тяжелого элемента). Сложности начинаются на этапе экспериментального воплощения данной идеи.
Сложности начинаются на этапе экспериментального воплощения данной идеи.
Для того чтобы протоны и нейтроны проникли внутрь ядра элемента-мишени, необходимо втолкнуть их туда с огромной силой. Чтобы обеспечить достаточно мощный толчок, ученые сначала разгоняют частицы-снаряды до огромной скорости и затем «впечатывают» их в мишень. «Беговой дорожкой» для снарядов служат особые приборы — ускорители.
Многочисленные эксперименты показали, что даже в ускорителях новые элементы рождаются далеко не всегда — очень важно правильно подобрать мишень и снаряды. При «неправильных» комбинациях утяжеленное ядро элемента-мишени моментально распадается на уже известные физикам элементы, а появления нового элемента не происходит.
Период полураспада изотопа берклия-249 составляет всего 320 дней, поэтому ученые жестко ограничены во времени при проведении своих экспериментов. Этот изотоп российским физикам передали их коллеги из Окриджской национальной лаборатории. Он был получен на самом мощном из существующих в мире атомном реакторе HIFR.
Создатели 117-го элемента, работающие в Лаборатории ядерных реакций имени Флерова Объединенного института ядерных исследований (ОИЯИ) в Дубне, занимаются подбором условий для синтеза новых элементов с 60-х годов прошлого века. В свое время в этой лаборатории были получены новые элементы с атомными номерами со 104 по 108. Кроме того, сотрудники ОИЯИ получили различные изотопы коперниция — 112-го элемента, впервые синтезированного в Институте тяжелых ионов в немецком городе Дармштадт.
Также ученые ОИЯИ опубликовали статьи, в которых декларировалось получение элементов с атомными номерами со 113 по 116, а также 118-го элемента. Для того чтобы эти результаты были приняты научной общественностью, их должны повторить в других лабораториях. Пока независимо был подтвержден лишь синтез 114-го элемента.
Получение 117-го элемента заняло у сотрудников Лаборатории ядерных реакций имени Флерова около года — эксперимент был начат 27 июля 2009 года. Физики обстреливали мишень из берклия-249 ионами кальция-48 на ускорителе У-400.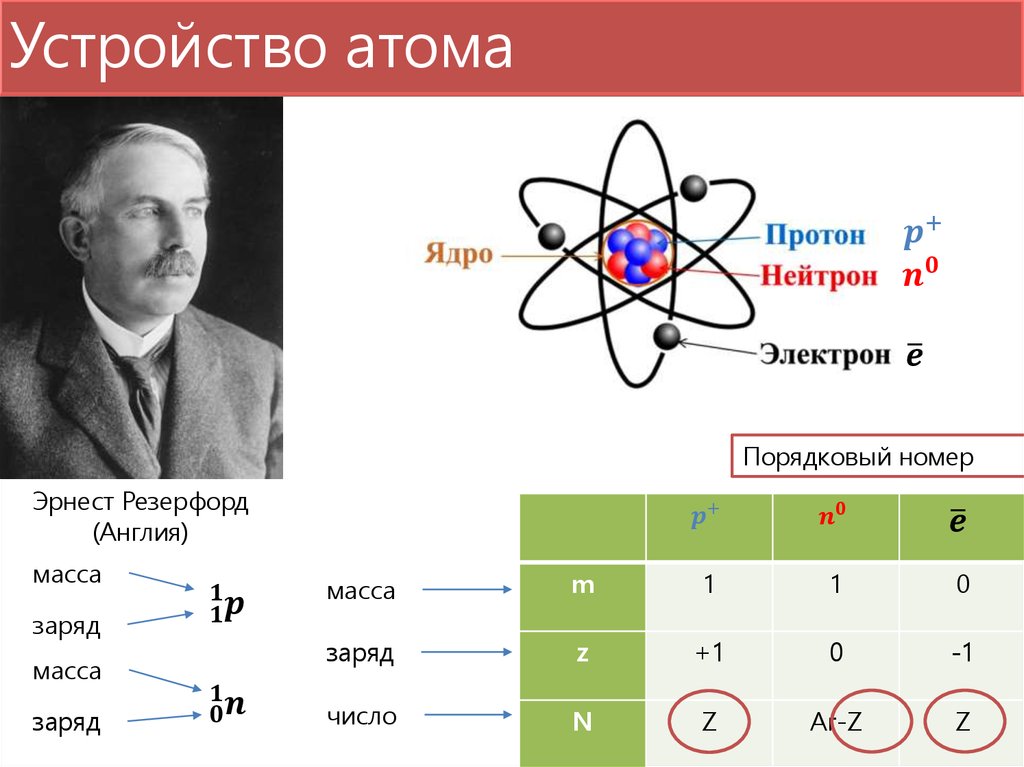 В общей сложности было зафиксировано шесть событий рождения ядер 117-го элемента. Время его полураспада, как и положено трансурановому элементу, очень мало. Однако время полураспада некоторых продуктов разрушения 117-го элемента указывает, что более тяжелые элементы могут оказаться значительно более стабильными.
В общей сложности было зафиксировано шесть событий рождения ядер 117-го элемента. Время его полураспада, как и положено трансурановому элементу, очень мало. Однако время полураспада некоторых продуктов разрушения 117-го элемента указывает, что более тяжелые элементы могут оказаться значительно более стабильными.
Существование где-то за 118-м элементом «островка стабильности» постулируется одной из гипотез, объясняющих фундаментальные принципы устройства атомных ядер. Физики собираются начать поиски этого островка уже в начале 2012 года. Два года потребуется ученым для модернизации ускорителя — без этого синтезировать 119-й и 120-й элементы не получится.
Остается только один вопрос: зачем физики получают все новые и новые трансурановые элементы? Практического применения для большинства сверхтяжелых элементов не существует — их синтез чрезвычайно затратен, а время полураспада в лучшем случае (как для 111, 113 и 115 элементов) измеряется секундами. Ответ донельзя прост: они необходимы ученым исключительно для того, чтобы лучше понять, как устроена природа. Что не так уж и мало.
Что не так уж и мало.
1.8: Субатомные частицы — протоны, нейтроны и электроны
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 25458
Цели обучения
- Знать значение изотопов и атомных масс.
На сегодняшний день открыто около 118 различных элементов; по определению каждый из них химически уникален. Чтобы понять, почему они уникальны, нужно понять строение атома (фундаментальной, отдельной частицы элемента) и характеристики его компонентов. Атомы состоят из электронов, протонов и нейтронов. Хотя это чрезмерное упрощение, игнорирующее другие открытые субатомные частицы, этого достаточно для обсуждения химических принципов. Некоторые свойства этих субатомных частиц приведены в таблице \(\PageIndex{1}\), которая иллюстрирует три важных момента:
Некоторые свойства этих субатомных частиц приведены в таблице \(\PageIndex{1}\), которая иллюстрирует три важных момента:
- Электроны и протоны имеют электрические заряды, одинаковые по величине, но противоположные по знаку. Относительные заряды -1 и +1 приписаны электрону и протону соответственно.
- Нейтроны имеют примерно ту же массу, что и протоны, но не имеют заряда. Они электрически нейтральны.
- Масса протона или нейтрона примерно в 1836 раз больше массы электрона. Протоны и нейтроны составляют основную массу атомов.
Открытие электрона и протона имело решающее значение для разработки современной модели атома и представляет собой отличный пример применения научного метода. Фактически, выяснение структуры атома — одна из величайших детективных историй в истории науки.
| Частица | Масса (г) | Атомная масса (а. е.м.) 9{-24}\) е.м.) 9{-24}\) | 1.008665 | 0 | 0 |
|---|
Почти вся масса атома содержится в маленьком (и поэтому очень плотном) ядре , которое несет положительный электрический заряд, и почти весь объем атома состоит из пустого пространства в где находятся электроны (рисунок \(\PageIndex{1}\)). Чрезвычайно малая масса электрона (1/1840 массы ядра водорода) заставляет его вести себя как квантовая частица, а это означает, что его местоположение в любой момент не может быть определено; лучшее, что мы можем сделать, — это описать его поведение в терминах вероятности его проявления в любой точке пространства. Принято (но несколько вводит в заблуждение) описывать объем пространства, в котором электроны атома имеют значительную вероятность быть обнаруженными, как электронное облако . Последний не имеет определенной внешней границы, как и атом. Радиус атома должен быть определен произвольно, например граница, в которой электрон может быть найден с вероятностью 95%. Атомные радиусы обычно составляют 30-300 пм.
Последний не имеет определенной внешней границы, как и атом. Радиус атома должен быть определен произвольно, например граница, в которой электрон может быть найден с вероятностью 95%. Атомные радиусы обычно составляют 30-300 пм.
Количество протонов определяет природу элементов
Количество протонов в ядре атома равно его атомный номер (\(Z\)). Это определяющая черта элемента: его значение определяет идентичность атома. Например, любой атом, содержащий шесть протонов, является элементом углерода и имеет атомный номер 6, независимо от того, сколько в нем нейтронов или электронов. Нейтральный атом должен содержать одинаковое количество положительных и отрицательных зарядов, поэтому количество протонов равно количеству электронов. Следовательно, атомный номер также указывает на количество электронов в атоме. Суммарное количество протонов и нейтронов в атоме называется его массовым числом (\(A\))). Таким образом, число нейтронов равно разнице между массовым числом и атомным номером:
Суммарное количество протонов и нейтронов в атоме называется его массовым числом (\(A\))). Таким образом, число нейтронов равно разнице между массовым числом и атомным номером:
\[\begin{align*}
\ce{атомный\: число\:(Z)\: &= \:число\: число\: протонов\\
масса\: число\:(A)\: &= \:число\: из\: протонов + число\: из\: нейтронов\\
A-Z\: &= \:число\: из\: нейтронов}
\end{align*}\]
Тождество элемента определяется \(Z\), числом протонов в ядре атома элемента, которое различно для каждого элемента. Известные элементы расположены в порядке возрастания Z в периодической таблице (рисунок \(\PageIndex{2}\)). Обоснование своеобразного формата периодической таблицы объясняется позже. Каждому элементу присваивается уникальный одно-, двух- или трехбуквенный символ. Названия элементов перечислены в периодической таблице вместе с их символами, атомными номерами и атомными массами. Химический состав каждого элемента определяется количеством в нем протонов и электронов.
Символы для нескольких распространенных элементов и их атомов перечислены в таблице \(\PageIndex{2}\). Некоторые символы получены из общего названия элемента; другие аббревиатуры названия на другом языке. Символы состоят из одной или двух букв, например, H для водорода и \(\ce{Cl}\) для хлора. Во избежание путаницы с другими обозначениями только первая буква символа пишется с большой буквы , Например, \(\ce{Co}\) — это символ кобальта, а \(\ce{CO}\) — это обозначение сложного монооксида углерода, который содержит атомы элементов углерода (\( \ce{C}\)) и кислород (\(\ce{O}\)).Все известные элементы и их символы есть в таблице Менделеева.
Традиционно первооткрыватель (или первооткрыватели) нового элемента дает ему имя. Однако до тех пор, пока название не будет признано Международным союзом теоретической и прикладной химии (IUPAC), рекомендуемое название нового элемента основано на латинском слове (словах) для его атомного номера. Например, элемент 106 назывался уннилгексий (Unh), элемент 107 — уннилсептий (Uns), а элемент 108 — уннилокций (Uno) в течение нескольких лет. Эти элементы теперь названы в честь ученых или мест; например, элемент 106 теперь известен как сиборгий (Sg) в честь Гленна Сиборга, лауреата Нобелевской премии, который принимал активное участие в открытии нескольких тяжелых элементов
Однако до тех пор, пока название не будет признано Международным союзом теоретической и прикладной химии (IUPAC), рекомендуемое название нового элемента основано на латинском слове (словах) для его атомного номера. Например, элемент 106 назывался уннилгексий (Unh), элемент 107 — уннилсептий (Uns), а элемент 108 — уннилокций (Uno) в течение нескольких лет. Эти элементы теперь названы в честь ученых или мест; например, элемент 106 теперь известен как сиборгий (Sg) в честь Гленна Сиборга, лауреата Нобелевской премии, который принимал активное участие в открытии нескольких тяжелых элементов
Изотопы: различающиеся числа нейтронов
Напомним, что ядра большинства атомов содержат нейтроны, а также протоны. В отличие от протонов, число нейтронов не является абсолютно фиксированным для большинства элементов. Атомы, имеющие одинаковое количество протонов и, следовательно, одинаковый атомный номер, но разное количество нейтронов, называются изотопами . Все изотопы элемента имеют одинаковое количество протонов и электронов, что означает, что они обладают одинаковым химическим составом. Изотопы элемента отличаются только своей атомной массой, которая определяется массовым числом (\(А\)), суммой чисел протонов и нейтронов. 9{14} С\) ( 14 С), с 8 нейтронами и 6 протонами. Однако ядро 14 C не является стабильным, а подвергается медленному радиоактивному распаду, который является основой метода датирования по углероду-14, используемого в археологии. Многие элементы, кроме углерода, имеют более одного стабильного изотопа; олово, например, имеет 10 изотопов. Информация о встречающихся в природе изотопах элементов с атомными номерами от 1 до 10 приведена в таблице \(\PageIndex{2}\). Обратите внимание, что в дополнение к стандартным названиям и символам изотопы водорода часто упоминаются с использованием общих имен и сопутствующих символов. Водород-2, символизируемый 2 H, также называемый дейтерием и иногда обозначаемый символом D.
Все изотопы элемента имеют одинаковое количество протонов и электронов, что означает, что они обладают одинаковым химическим составом. Изотопы элемента отличаются только своей атомной массой, которая определяется массовым числом (\(А\)), суммой чисел протонов и нейтронов. 9{14} С\) ( 14 С), с 8 нейтронами и 6 протонами. Однако ядро 14 C не является стабильным, а подвергается медленному радиоактивному распаду, который является основой метода датирования по углероду-14, используемого в археологии. Многие элементы, кроме углерода, имеют более одного стабильного изотопа; олово, например, имеет 10 изотопов. Информация о встречающихся в природе изотопах элементов с атомными номерами от 1 до 10 приведена в таблице \(\PageIndex{2}\). Обратите внимание, что в дополнение к стандартным названиям и символам изотопы водорода часто упоминаются с использованием общих имен и сопутствующих символов. Водород-2, символизируемый 2 H, также называемый дейтерием и иногда обозначаемый символом D. Водород-3, обозначаемый символом 3 H, также называемый тритием и иногда обозначаемый символом T.
Водород-3, обозначаемый символом 3 H, также называемый тритием и иногда обозначаемый символом T.
 89. Carbon left superscript 13, left subscript 6 has an atomic number of 6, 6 protons, 7 neutrons, a mass of 13.0033, and a natural abundance percentage of 1.11. Carbon left superscript 14, left subscript 6 has an atomic number of 6, 6 protons, 8 neutrons, and a mass of 14.0032. Its natural abundance percentage is not reported. Nitrogen left superscript 14, left subscript 7 has an atomic number of 7, 7 protons, 7 neutrons, a mass of 14.0031, and a natural abundance percentage of 99.63. Nitrogen left superscript 15, left subscript 7 has an atomic number of 7, 7 protons, 8 neutrons, a mass of 15.0001, and a natural abundance percentage of 0.37. Oxygen left superscript 16, left subscript 8 has an atomic number of 8, 8 protons, 8 neutrons, a mass of 15.9949, and a natural abundance percentage of 99.759. Oxygen left superscript 17, left subscript 8 has an atomic number of 8, 8 protons, 9 neutrons, a mass of 16.9991, and a natural abundance percentage of 0.037. Oxygen left superscript 18, left subscript 8 has an atomic number of 8, 8 protons, 10 neutrons, a mass of 17.
89. Carbon left superscript 13, left subscript 6 has an atomic number of 6, 6 protons, 7 neutrons, a mass of 13.0033, and a natural abundance percentage of 1.11. Carbon left superscript 14, left subscript 6 has an atomic number of 6, 6 protons, 8 neutrons, and a mass of 14.0032. Its natural abundance percentage is not reported. Nitrogen left superscript 14, left subscript 7 has an atomic number of 7, 7 protons, 7 neutrons, a mass of 14.0031, and a natural abundance percentage of 99.63. Nitrogen left superscript 15, left subscript 7 has an atomic number of 7, 7 protons, 8 neutrons, a mass of 15.0001, and a natural abundance percentage of 0.37. Oxygen left superscript 16, left subscript 8 has an atomic number of 8, 8 protons, 8 neutrons, a mass of 15.9949, and a natural abundance percentage of 99.759. Oxygen left superscript 17, left subscript 8 has an atomic number of 8, 8 protons, 9 neutrons, a mass of 16.9991, and a natural abundance percentage of 0.037. Oxygen left superscript 18, left subscript 8 has an atomic number of 8, 8 protons, 10 neutrons, a mass of 17. 9992, and a natural abundance percentage of 0.204. Fluorine left superscript 19, left subscript 9 has an atomic number of 9, 9 protons, 10 neutrons, a mass of 18.9984, and a natural abundance percentage of 100. Neon left superscript 20, left subscript 10 has an atomic number of 10, 10 protons, 10 neutrons, a mass of 19.9924, and a natural abundance percentage of 90.92. Neon left superscript 21, left subscript 10 has an atomic number of 10, 10 protons, 11 neutrons, a mass of 20.994, and a natural abundance percentage of 0.257. Neon left superscript 22, left subscript 10 has an atomic number of 10, 10 protons, 12 neutrons, a mass of 21.9914, and a natural abundance percentage of 8.82.»>
9992, and a natural abundance percentage of 0.204. Fluorine left superscript 19, left subscript 9 has an atomic number of 9, 9 protons, 10 neutrons, a mass of 18.9984, and a natural abundance percentage of 100. Neon left superscript 20, left subscript 10 has an atomic number of 10, 10 protons, 10 neutrons, a mass of 19.9924, and a natural abundance percentage of 90.92. Neon left superscript 21, left subscript 10 has an atomic number of 10, 10 protons, 11 neutrons, a mass of 20.994, and a natural abundance percentage of 0.257. Neon left superscript 22, left subscript 10 has an atomic number of 10, 10 protons, 12 neutrons, a mass of 21.9914, and a natural abundance percentage of 8.82.»>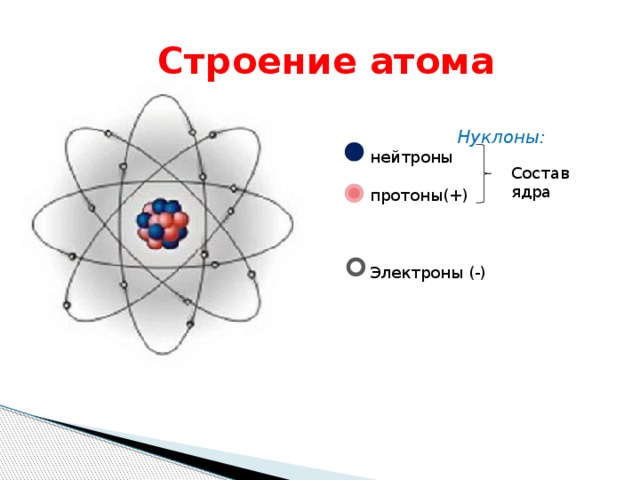 9914
9914Источники изотопных данных: G. Audi et al., Nuclear Physics A 729 (2003): 337–676; Дж. К. Коц и К. Ф. Перселл, Химия и химическая реактивность, 2-е изд., 1991 г.
Пример \(\PageIndex{1}\): Состав атома
Йод является важным микроэлементом в нашем рационе; он необходим для выработки гормона щитовидной железы. Недостаток йода в рационе может привести к развитию зоба, увеличению щитовидной железы. Добавление небольшого количества йода в поваренную соль (йодированную соль) практически устранило эту проблему со здоровьем в Соединенных Штатах, но до 40% населения мира по-прежнему подвержены риску дефицита йода. Атомы йода добавляются в виде анионов, каждый из которых имеет заряд 1- и массовое число 127. Определите количество протонов, нейтронов и электронов в одном из этих анионов йода.
Раствор
Атомный номер йода (53) говорит нам о том, что нейтральный атом йода содержит 53 протона в ядре и 53 электрона вне ядра. Поскольку сумма количества протонов и нейтронов равна массовому числу 127, количество нейтронов равно 74 (127 — 53 = 74). Поскольку йод добавляется в виде аниона 1–, число электронов равно 54 [53 – (1–) = 54].
Поскольку сумма количества протонов и нейтронов равна массовому числу 127, количество нейтронов равно 74 (127 — 53 = 74). Поскольку йод добавляется в виде аниона 1–, число электронов равно 54 [53 – (1–) = 54].
Упражнение \(\PageIndex{1}\)
Ион платины имеет массовое число 195 и содержит 74 электрона. Сколько протонов и нейтронов он содержит и каков его заряд?
- Ответить
78 протонов; 117 нейтронов; заряд 4+
Пример \(\PageIndex{2}\)
Элемент с тремя стабильными изотопами имеет 82 протона. Отдельные изотопы содержат 124, 125 и 126 нейтронов. Определите элемент и напишите символы для изотопов.
Дано : количество протонов и нейтронов
Запрос : элемент и символ атома
Стратегия :
- Обратитесь к периодической таблице и используйте количество протонов для идентификации элемента.
- Рассчитайте массовое число каждого изотопа, сложив числа протонов и нейтронов.

- Укажите символ каждого изотопа с массовым числом в верхнем индексе и числом протонов в нижнем индексе, оба написаны слева от символа элемента. 9{81}Бр}\).
Ионы: заряженные
Протоны и нейтроны в ядре атома очень крепко удерживаются сильными ядерными силами. Очень трудно либо отделить ядерные частицы, либо добавить дополнительные. Электроны, с другой стороны, удерживаются атомом за счет своего электростатического притяжения к положительно заряженным протонам в ядре. Эта сила сильна, но не настолько сильна, чтобы атом не мог терять или приобретать электроны. Атомы электрически нейтральны, если они содержат одинаковое количество положительно заряженных протонов и отрицательно заряженных электронов. Когда число этих субатомных частиц равно не равен , атом электрически заряжен и называется ионом. Заряд атома определяется следующим образом:
\[\text{Атомный заряд} = \text{количество протонов} − \text{количество электронов}\]
В главе атомы (и молекулы) обычно приобретают заряд, приобретая или теряя электроны.
 Атом, который получает один или несколько электронов, будет иметь отрицательный заряд и называется анионом. Положительно заряженные атомы, называемые катионами 9{-2}}\]
Атом, который получает один или несколько электронов, будет иметь отрицательный заряд и называется анионом. Положительно заряженные атомы, называемые катионами 9{-2}}\]Заряд вида сильно влияет на его свойства. Например, нейтральные атомы натрия нестабильны и бурно реагируют в сочетании с большинством веществ. Однако катионы натрия довольно инертны; на самом деле, мы едим их все время в составе хлорида натрия (поваренной соли). Как мы обсудим позже, катионы и анионы почти всегда встречаются вместе, чтобы обеспечить нейтральность вещества.
Резюме
Атом состоит из дискретных частиц, которые определяют его химическое и физическое поведение. Каждый атом элемента содержит одинаковое количество протонов, то есть атомный номер ( Z ). Нейтральные атомы имеют одинаковое количество электронов и протонов. Атомы элемента, содержащие разное количество нейтронов, называются изотопами . Каждый изотоп данного элемента имеет одинаковый атомный номер, но другое массовое число ( A ), которое представляет собой сумму числа протонов и нейтронов.
 Относительные массы атомов сообщаются с использованием атомной единицы массы ( а.е.м. ), которая определяется как одна двенадцатая массы одного атома углерода-12 с 6 протонами, 6 нейтронами и 6 электронами.
Относительные массы атомов сообщаются с использованием атомной единицы массы ( а.е.м. ), которая определяется как одна двенадцатая массы одного атома углерода-12 с 6 протонами, 6 нейтронами и 6 электронами.Авторы и ссылки
Пол Флауэрс (Университет Северной Каролины, Пембрук), Клаус Теопольд (Университет Делавэра) и Ричард Лэнгли (Государственный университет Стивена Ф. Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Загрузите бесплатно по адресу http://cnx.org/contents/85abf193-2bd…[email protected]).
Эд Витц (Университет Куцтауна), Джон В. Мур (UW-Мэдисон), Джастин Шорб (Колледж Хоуп), Ксавьер Прат-Ресина (Университет Миннесоты в Рочестере), Тим Вендорф и Адам Хан.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.

- Теги
- анион
- атомная единица массы (а.е.м.)
- атомный номер (Z)
- катион
- химический символ
- ион
- изотоп
- Массовый номер (А)
- природное изобилие
- периодическая таблица элементов
Протоны, нейтроны и электроны | Глава 4: Периодическая таблица и связь
Вам это нравится? Не нравится ? Пожалуйста, найдите время, чтобы поделиться с нами своими отзывами. Спасибо!
Урок 4.1
youtube.com/embed/raqHR4H_xFw» frameborder=»0″ allowfullscreen=»»>Ключевые понятия
- Атомы состоят из мельчайших частиц, называемых протонами, нейтронами и электронами.
- Протоны и нейтроны находятся в центре атома, составляя ядро.
- Электроны окружают ядро.
- Протоны имеют положительный заряд.
- Электроны имеют отрицательный заряд.
- Заряды протона и электрона точно такого же размера, но противоположны.
- Нейтроны не имеют заряда.
- Поскольку противоположные заряды притягиваются, протоны и электроны притягиваются друг к другу.
Резюме
Учащиеся накладывают статический заряд на пластиковую полоску, протягивая ее между пальцами. Они увидят, что пластик притягивает их пальцы. Студенты познакомятся с идеей о том, что трение полоски пальцами приводит к тому, что электроны перемещаются от их кожи к пластику, придавая пластику отрицательный заряд, а их коже — положительный заряд.
 Благодаря этим занятиям учащиеся познакомятся с некоторыми характеристиками электронов, протонов и нейтронов, из которых состоят атомы.
Благодаря этим занятиям учащиеся познакомятся с некоторыми характеристиками электронов, протонов и нейтронов, из которых состоят атомы.Цель
Учащиеся смогут объяснить, используя электроны и протоны, почему заряженный объект притягивается или отталкивается другим заряженным объектом. Они также смогут объяснить, почему заряженный объект может притягиваться даже к незаряженному объекту. Студенты также смогут объяснить, что притяжение между положительными протонами и отрицательными электронами удерживает атом вместе.
Оценка
Загрузите лист с заданиями учащегося и раздайте по одному учащемуся, если это указано в задании. Рабочий лист будет служить компонентом «Оценить» каждого плана урока 5-E.
Безопасность
Убедитесь, что вы и учащиеся носите подходящие защитные очки.
Материалы для каждой группы
- Пластиковый пакет для продуктов
- Ножницы
- Надутый воздушный шар
- Маленькие кусочки бумаги размером с конфетти
Демонстрационные материалы
- Раковина
- Воздушный шар
Покажите изображение острия карандаша и то, как атомы углерода выглядят на молекулярном уровне.

Проецирование изображения Карандашное масштабирование.
Учащиеся должны быть знакомы с частями атома из главы 3, но обзор основных моментов, вероятно, будет хорошей идеей.
Задайте учащимся вопросы, например, следующие:
- Из каких трех различных крошечных частиц состоит атом?
- Протоны, нейтроны и электроны.
- Что из этого находится в центре атома?
- Протоны и нейтроны находятся в центре (ядре) атома. Вы можете упомянуть, что водород — единственный атом, который обычно не имеет нейтронов. Ядро большинства атомов водорода состоит всего из 1 протона. Небольшой процент атомов водорода имеет 1 или даже 2 нейтрона. Атомы одного и того же элемента с разным числом нейтронов называются изотопами. Они будут обсуждаться в Уроке 2.
- Что вращается вокруг ядра атома?
- Электроны
- Какой из них имеет положительный заряд, отрицательный заряд и отсутствие заряда?
- Протон — положительный; электрон — отрицательный; нейтрон — без заряда.
 Заряды протона и электрона точно такого же размера, но противоположны. В нейтральном атоме одинаковое количество протонов и электронов точно компенсируют друг друга.
Заряды протона и электрона точно такого же размера, но противоположны. В нейтральном атоме одинаковое количество протонов и электронов точно компенсируют друг друга.
Примечание. На рисунке показана простая модель атома углерода. Он иллюстрирует некоторую основную информацию, такую как количество протонов и нейтронов в ядре. Это также показывает, что количество электронов равно количеству протонов. Эта модель также показывает, что некоторые электроны могут быть ближе к ядру, а другие дальше. Одна из проблем с этой моделью заключается в том, что она предполагает, что электроны вращаются вокруг ядра по идеальным кругам в одной плоскости, но это не так. Более широко принятая модель показывает электроны как более трехмерное «электронное облако», окружающее ядро. Учащиеся познакомятся с этими идеями более подробно на уроке 3. Но для большей части нашего изучения химии на уровне средней школы модель, показанная на иллюстрации, будет очень полезной. Кроме того, в большинстве случаев использования этой модели атома ядро будет отображаться в виде точки в центре атома.

Покажите анимацию и объясните, что протоны и электроны имеют противоположные заряды и притягиваются друг к другу.
Проецируйте анимацию «Протоны и электроны».
Объясните учащимся, что два протона отталкиваются друг от друга и что два электрона отталкиваются друг от друга. Но протон и электрон притягиваются друг к другу. Другими словами, одинаковые или «подобные» заряды отталкиваются друг от друга, а противоположные заряды притягиваются друг к другу.
Поскольку противоположные заряды притягиваются друг к другу, отрицательно заряженные электроны притягиваются к положительно заряженным протонам. Скажите учащимся, что именно это притяжение удерживает атом вместе.
Спроецируйте анимацию «Атом водорода».
Объясните учащимся, что в атоме водорода отрицательно заряженный электрон притягивается к положительно заряженному протону. Это притяжение и удерживает атом вместе.
Скажите учащимся, что водород — простейший атом.
 В нем всего 1 протон, 1 электрон и 0 нейтронов. Это единственный атом, в котором нет нейтронов. Объясните, что это простая модель, показывающая движение электрона вокруг ядра.
В нем всего 1 протон, 1 электрон и 0 нейтронов. Это единственный атом, в котором нет нейтронов. Объясните, что это простая модель, показывающая движение электрона вокруг ядра.Нажмите на кнопку «Показать облако» и объясните учащимся, что это другая модель. Он показывает электрон в пространстве, окружающем ядро, которое называется электронным облаком или энергетическим уровнем. Невозможно знать местонахождение электрона, а только область, где он, скорее всего, находится. Электронное облако или энергетический уровень показывает область вокруг ядра, где, скорее всего, находится электрон.
Примечание: любознательные студенты могут спросить, как положительно заряженные протоны могут находиться так близко друг к другу в ядре: почему они не отталкиваются друг от друга? Это большой вопрос. Ответ выходит далеко за рамки введения в химию для средней школы, но вы можете сказать одно: существует сила, называемая «сильной силой», которая удерживает вместе протоны и нейтроны в ядре атома.
 Эта сила намного сильнее силы отталкивания одного протона от другого.
Эта сила намного сильнее силы отталкивания одного протона от другого.Еще один хороший вопрос: почему электрон не врезается в протон? Если их притягивает друг к другу, почему бы им просто не столкнуться? Опять же, подробный ответ на этот вопрос выходит за рамки изучения химии в средней школе. Но упрощенный ответ связан с энергией или скоростью электрона. По мере приближения электрона к ядру его энергия и скорость увеличиваются. В конце концов он движется в области, окружающей ядро, со скоростью, достаточно большой, чтобы уравновесить притяжение, которое притягивает его, поэтому электрон не врезается в ядро.
Дайте каждому учащемуся лист с заданиями.
Предложите учащимся ответить на вопросы об иллюстрации на листе с заданиями. Учащиеся записывают свои наблюдения и отвечают на вопросы о деятельности в листе деятельности. Разделы «Объясните это с помощью атомов и молекул» и «Возьми это» Дальнейшие разделы рабочего листа будут выполняться в классе, в группах или индивидуально, в зависимости от ваших инструкций.

Выполните задание, чтобы показать, что электроны и протоны притягиваются друг к другу.
Учащиеся могут увидеть доказательства зарядов протонов и электронов, выполняя задание со статическим электричеством.
Примечание. Когда два материала трутся друг о друга в результате действия статического электричества, один материал имеет тенденцию терять электроны, а другой материал имеет тенденцию приобретать электроны. При этом человеческая кожа имеет тенденцию терять электроны, в то время как пластиковый пакет, сделанный из полиэтилена, имеет тенденцию приобретать электроны.
Вопрос для расследования
Что заставляет объекты притягиваться или отталкиваться друг от друга?
Материалы для каждой группы
- Пластиковый пакет для продуктов
- Ножницы
Процедура, часть 1
Заряженный пластик и заряженная кожа
- Вырежьте 2 полоски из пластикового пакета для продуктов так, чтобы каждая была шириной около 2–4 см и длиной около 20 см.

Крепко держите пластиковую полоску за один конец. Затем возьмитесь за пластиковую полоску между большим и указательным пальцами другой руки, как показано на рисунке.
- Быстро потяните верхнюю руку вверх так, чтобы пластиковая полоска прошла сквозь пальцы. Сделайте это три или четыре раза.
- Позвольте полоске свисать. Затем поднесите к нему другую руку.
- Напишите «притягивать» или «отталкивать» в таблице на листе с заданием, чтобы описать, что произошло.
- Вырежьте 2 полоски из пластикового пакета для продуктов так, чтобы каждая была шириной около 2–4 см и длиной около 20 см.
Ожидаемые результаты
Пластик будет притягиваться к вашей руке и двигаться к ней. Студенты могут заметить, что пластик также притягивает их руки и рукава. Сообщите учащимся, что позже в этом уроке они будут исследовать, почему пластиковая полоска также притягивается к незаряженным (нейтральным) поверхностям.
Примечание. Если учащиеся обнаруживают, что их пластиковая полоска не двигается к руке, значит, она недостаточно заряжена. Пусть они попробуют зарядить свою пластиковую полоску, удерживая ее на брюках или рубашке, а затем быстро потянув другой рукой.
 Затем они должны проверить, притягивается ли пластик к их одежде. Если нет, учащиеся должны снова попробовать зарядить пластик.
Затем они должны проверить, притягивается ли пластик к их одежде. Если нет, учащиеся должны снова попробовать зарядить пластик.Покажите учащимся модели, сравнивающие количество протонов и электронов в пластике и коже до и после их трения друг о друга.
Скажите учащимся, что пластиковая полоска и их кожа состоят из молекул, состоящих из атомов. Предложите учащимся предположить, что пластик и их кожа нейтральны — что у них такое же количество протонов, как и электронов.
Проецировать изображение Заряженный пластик и рука.
Укажите, что до того, как ученики протянули пластик между пальцами, количество протонов и электронов в каждом из них было одинаковым. Затем, когда студенты протягивали пластик сквозь пальцы, электроны с их кожи попадали на пластик. Поскольку в пластике больше электронов, чем протонов, он имеет отрицательный заряд. Поскольку их пальцы отдали часть электронов, их кожа теперь имеет больше протонов, чем электронов, поэтому она имеет положительный заряд.
 Положительная кожа и отрицательный пластик притягивают друг друга, потому что положительное и отрицательное притягиваются.
Положительная кожа и отрицательный пластик притягивают друг друга, потому что положительное и отрицательное притягиваются.Предложите учащимся исследовать, что происходит, когда натертую пластиковую полоску держат рядом со столом или стулом.
Процедура, часть 2
Заряженный пластик и нейтральный стол
- Зарядите одну пластиковую полоску так же, как и раньше.
На этот раз поднесите пластиковую полоску к столу или стулу.
- Напишите в таблице «притягивать» или «отталкивать».
Ожидаемые результаты
Пластик движется к столу.
Объясните учащимся, почему пластик притягивается к столу. Ответ занимает пару шагов, поэтому вы можете помочь учащимся, нарисовав или спроецировав увеличенную иллюстрацию пластика и стола.
После протягивания пластика между их пальцами пластик получает дополнительные электроны и отрицательный заряд. Стол имеет такое же количество протонов, как и электронов, и является нейтральным.
 Когда пластик приближается к столу, отрицательно заряженный пластик отталкивает электроны от поверхности стола. Это делает поверхность стола возле пластика слегка положительной. Отрицательно заряженный пластик притягивается к этой положительной области, поэтому пластик движется к ней.
Когда пластик приближается к столу, отрицательно заряженный пластик отталкивает электроны от поверхности стола. Это делает поверхность стола возле пластика слегка положительной. Отрицательно заряженный пластик притягивается к этой положительной области, поэтому пластик движется к ней.Предложите учащимся зарядить два кусочка пластика и подержать их рядом друг с другом, чтобы проверить, отталкиваются ли электроны друг от друга.
Попросите учащихся сделать прогноз:
- Как вы думаете, что произойдет, если вы зарядите две полоски пластика и поднесете их друг к другу?
Процедура, часть 3
2 шт. заряженного пластика
- Зарядите две пластиковые полоски
- Медленно поднесите две пластиковые полоски друг к другу.
- Напишите «притягивать» или «отталкивать» в таблице на рабочем листе.
Ожидаемые результаты
Полоски будут отдаляться или отталкиваться друг от друга.
 Поскольку на обеих полосках есть дополнительные электроны, каждая из них имеет дополнительный отрицательный заряд. Так как одинаковые заряды отталкиваются друг от друга, полоски удаляются друг от друга.
Поскольку на обеих полосках есть дополнительные электроны, каждая из них имеет дополнительный отрицательный заряд. Так как одинаковые заряды отталкиваются друг от друга, полоски удаляются друг от друга.Спросите студентов:
- Что произошло, когда вы поднесли два куска пластика друг к другу?
- Концы полос отошли друг от друга.
- Используйте свои знания об электронах и зарядах, чтобы объяснить, почему это происходит.
- Каждая полоска имеет дополнительные электроны, поэтому они обе заряжены отрицательно. Так как заряды отталкиваются, кусочки пластика отталкивались друг от друга.
Предложите учащимся применить свои знания о протонах и электронах, чтобы объяснить, что происходит, когда заряженный воздушный шар подносится к листу бумаги.
Материалы для каждой группы
- Надутый баллон
- Маленькие кусочки бумаги размером с конфетти
Процедура
- Потрите шарик о волосы или одежду.

- Медленно поднесите шарик к маленьким кусочкам бумаги.
Ожидаемые результаты
Кусочки бумаги подпрыгнут и прилипнут к воздушному шару.
Спросите студентов:
- Что вы наблюдали, когда подносили заряженный шар к бумажкам?
- Кусочки бумаги поднялись и застряли на воздушном шаре.
- Используйте свои знания об электронах, протонах и зарядах, чтобы объяснить, почему это происходит.
- Когда вы трёте шарик о волосы или одежду, он собирает дополнительные электроны, придавая шарику отрицательный заряд. Когда вы подносите воздушный шар к бумаге, электроны из воздушного шара отталкивают электроны в бумаге. Поскольку на поверхности бумаги находится больше протонов, это положительное изменение. Электроны все еще находятся на бумаге, просто не на поверхности, поэтому в целом бумага нейтральна. Противоположности притягиваются, поэтому бумага движется вверх к шарику.
Покажите симуляцию «Воздушные шары и статическое электричество» Университета Колорадо на сайте технологий физического образования в Боулдере.

В симуляции поставить галочки «показывать все заряды» и «Стена». Снимите все остальное.
В этой симуляции вы можете немного потереть воздушный шар о свитер и увидеть, что часть электронов из свитера переместится на воздушный шар. Это придает воздушному шару отрицательный заряд. Поскольку свитер потерял часть электронов, в нем больше протонов, чем электронов, поэтому он имеет положительный заряд. Если вы подвинете шарик к свитеру, он притянется. Это похоже на перемещение заряженной пластиковой полоски к ткани, о которую ее натирали.
Вы также можете переместить воздушный шар к стене. Избыточный отрицательный заряд на воздушном шаре отталкивает отрицательный заряд на поверхности стены. Это оставляет больше положительного заряда на поверхности стены. Отрицательно заряженный шарик притягивается к положительному участку стены. Это похоже на перемещение заряженной пластиковой полоски к пальцу.
Продемонстрируйте, как электроны могут притягивать поток воды.

Либо выполните следующую демонстрацию, либо покажите видеоролик «Воздушный шар и вода».
Материалы для демонстрации
- Раковина
- Воздушный шар
Процедура
- Потрите шарик о рубашку или штаны, чтобы придать ему статический заряд.
- Включите кран, чтобы была очень тонкая струя воды.
- Медленно поднесите заряженную часть шара к струе воды.
Ожидаемые результаты
Струя воды должна искривляться, притягиваясь к воздушному шару.
Спросите студентов:
- Что вы наблюдали, когда заряженный шар держали рядом с потоком воды?
- Струя воды наклонилась к воздушному шару.
- Используйте свои знания об электронах, протонах и зарядах, чтобы объяснить, почему это происходит.
- Когда вы трёте шарик о волосы или одежду, он собирает дополнительные электроны, придавая шарику отрицательный заряд. Когда вы подносите воздушный шар к потоку воды, электроны из воздушного шара отталкивают электроны в воде.
 Поскольку больше протонов находится на поверхности воды, это положительное изменение. Противоположности притягиваются, поэтому вода движется к шарику.
Поскольку больше протонов находится на поверхности воды, это положительное изменение. Противоположности притягиваются, поэтому вода движется к шарику.
Части периодической таблицы
Части периодической таблицыАтомные номера
1А 2А 3А 4А 5А 6А 7А 8А (1) (2) (13) (14) (15) (16) (17) (18) 3Б 4Б 5Б 6Б 7Б — 8Б — 1Б 2Б (3) (4) (5) (6) (7) (8) (9) (10) (11) (12) 1 1 2 2 3 4 5 6 7 8 9 10 3 11 12 13 14 15 16 17 18 4 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 5 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 6 55 56 57 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 7 87 88 89 104 105 106 107 108 109 110 111 112 — 114 — — — — 6 58 59 60 61 62 63 64 65 66 67 68 69 70 71 7 90 91 92 93 94 95 96 97 98 99 100 101 102 103 В современной периодической таблице элементы перечислены в порядке возрастания атомный номер .
 Атомный номер – это число протонов в
ядро атома. Количество протонов определяет идентичность
элемента (т. е. элемент с 6 протонами является атомом углерода, как бы
может присутствовать много нейтронов). Количество протонов определяет, как
много электронов окружает ядро, и это расположение этих
электроны, которые определяют большую часть химического поведения элемента.
Атомный номер – это число протонов в
ядро атома. Количество протонов определяет идентичность
элемента (т. е. элемент с 6 протонами является атомом углерода, как бы
может присутствовать много нейтронов). Количество протонов определяет, как
много электронов окружает ядро, и это расположение этих
электроны, которые определяют большую часть химического поведения элемента.В периодической таблице, расположенной в порядке возрастания атомного номера, элементы, имеющие сходные химические свойства, естественным образом выстраиваются в одну и ту же столбец (группа). Например, все элементы группы 1А относительно мягкие металлы, бурно реагируют с водой и образуют заряды 1+; все элементы группы 8А нереакционноспособны, одноатомные газы при комнатной температуре температура и т. д. Другими словами, существует периодических повторений г. о свойствах химических элементов при увеличении массы.
В оригинальной периодической таблице, опубликованной Дмитрием Менделеевым в 1869 году, элементы были расположены по возрастанию атомная масса — на тот момент, ядро еще не было открыто, и не было никакого понимания в всю внутреннюю структуру атома, поэтому атомная масса была единственной руководство по использованию.
 Как только структура ядра была понята,
стало ясно, что это атомный номер , который регулировал
свойства элементов.
Как только структура ядра была понята,
стало ясно, что это атомный номер , который регулировал
свойства элементов.Элементы, отсортированные по атомному номеру
Атомный номер
Символ Имя Атомная масса
(а.е.м., г/моль)1 Х Водород 1.00797 2 Он Гелий 4.00260 3 Ли Литий 6,941 4 Быть Бериллий 9.  01218
012185 Б Бор 10,81 6 С Углерод 12.011 7 Н Азот 14.0067 8 О Кислород 15,9994 9 Ф Фтор 18.998403 10 Не Неон 20.179 11 На Натрий 22.  98977
9897712 Мг Магний 24.305 13 Ал Алюминий 26.98154 14 Си Кремний 28.0855 15 Р Фосфор 30,97376 16 С Сера 32.06 17 Кл Хлор 35.453 18 Ар Аргон 39,948 19 К Калий 39.  0983
098320 Са Кальций 40.08 21 Sc Скандий 44.9559 22 Ти Титан 47,90 23 В Ванадий 50,9415 24 Кр Хром 51,996 25 Мн Марганец 54.9380 26 Фе Железо 55.  847
84727 Со Кобальт 58.9332 28 Ni Никель 58,70 29 Cu Медь 63,546 30 Цинк Цинк 65,38 31 Га Галлий 69,72 32 Ge Германий 72,59 33 Как Мышьяк 74.  9216
921634 Se Селен 78,96 35 Бр Бром 79.904 36 Кр Криптон 83,80 37 руб. руб.Рубидий 85.4678 38 Старший Стронций 87,62 39 Д Иттрий 88.9059 40 Зр Цирконий 91,22 41 № Ниобий 92.  9064
906442 Пн Молибден 95,94 43 ТК Технеций (98) 44 Ру Рутений 101.07 45 Rh Родий 102.9055 46 Pd Палладий 106,4 47 Аг Серебро 107,868 48 CD Кадмий 112,41 49 В Индий 114,82 50 Сн Олово 118,69 51 Сб Сурьма 121,75 52 Те Теллур 127,60 53 я Йод 126.  9045
904554 Хе Ксенон 131,30 55 CS Цезий 132.9054 56 Ба Барий 137,33 57 Ла Лантан 138.9055 58 Се Церий 140,12 59 Пр Празеодим 140,9077 60 Нд Неодим 144,24 61 вечер Прометий (145) 62 См Самарий 150,4 63 ЕС Европий 151,96 64 Гд Гадолиний 157,25 65 Тб Тербий 158,9254 66 Дай Диспрозий 162,50 67 Хо Гольмий 164.  9304
930468 Er Эрбий 167,26 69 тм Тулий 168,9342 70 Ыб Иттербий 173,04 71 Лу Лютеций 174,967 72 Хф Гафний 178,49 73 Та Тантал 180,9479 74 Вт Вольфрам 183,85 75 Re Рений 186,207 76 ОС Осмий 190,2 77 Ир Иридиум 192,22 78 Пт Платина 195,09 79 Au Золото 196,9665 80 рт.  ст.
ст.Меркурий 200,59 81 Тл Таллий 204,37 82 Пб Свинец 207,2 83 Би Висмут 208.9804 84 По Полоний (209) 85 В Астатин (210) 86 Р-н Радон (222) 87 Пт Франций (223) 88 Ра Радий 226.  0254
025489 Ак Актиний 227.0278 90 Т Торий 232.0381 91 Па Протактиний 231.0359 92 У Уран 238.029 93 № Нептуний 237.0482 94 Пу Плутоний (242) 95 Ам Америций (243) 96 см Кюриум (247) 97 Бк Берклиум (247) 98 См. 
Калифорния (251) 99 Эс Эйнштейний (252) 100 FM Фермиум (257) 101 Мд Менделевий (258) 102 № Нобелий (250) 103 Лр Лоуренсиум (260) 104 Рф Резерфордий (261) 105 Дб Дубниум (262) 106 Сг Сиборгиум (263) 107 Бх Борий (262) 108 Гс Хассиум (255) 109 Мт Мейтнерий (256) 110 Дс Дармштадтиум (269) 111 Рг Рентгений (272) 112 Ууб Унунбиум (277) 113 — —— ——— 114 Уук Унунквадиум 2.
 1 Электроны, протоны, нейтроны и атомы – физическая геология
1 Электроны, протоны, нейтроны и атомы – физическая геологияГлава 2 Минералы
Вся материя, включая минеральные кристаллы, состоит из атомов, а все атомы состоят из трех основных частиц: протонов , нейтронов, и электронов . Как показано в таблице 2.1, протоны заряжены положительно, нейтроны не заряжены, а электроны заряжены отрицательно. Отрицательный заряд одного электрона уравновешивает положительный заряд одного протона. И протоны, и нейтроны имеют массу 1, а электроны почти не имеют массы.
Таблица 2.1 Заряды и массы частиц внутри атомов Элементарная частица Зарядка Масса Протон +1 1 Нейтрон 0 1 Электрон −1 ~0 Элемент водорода состоит из простейших атомов, каждый из которых имеет только один протон и один электрон.
 Протон образует ядро, а электрон вращается вокруг него. Все остальные элементы имеют в своем ядре нейтроны, а также протоны, например, гелий, изображенный на рис. 2.2. Положительно заряженные протоны имеют тенденцию отталкиваться друг от друга, а нейтроны помогают удерживать ядро вместе. Количество протонов равно атомный номер , а количество протонов плюс нейтронов составляет атомная масса . Для водорода атомная масса равна 1, потому что есть один протон и нет нейтронов. Для гелия это 4: два протона и два нейтрона.
Протон образует ядро, а электрон вращается вокруг него. Все остальные элементы имеют в своем ядре нейтроны, а также протоны, например, гелий, изображенный на рис. 2.2. Положительно заряженные протоны имеют тенденцию отталкиваться друг от друга, а нейтроны помогают удерживать ядро вместе. Количество протонов равно атомный номер , а количество протонов плюс нейтронов составляет атомная масса . Для водорода атомная масса равна 1, потому что есть один протон и нет нейтронов. Для гелия это 4: два протона и два нейтрона.У большинства из 16 легчайших элементов (вплоть до кислорода) число нейтронов равно числу протонов. Для большинства оставшихся элементов нейтронов больше, чем протонов, потому что дополнительные нейтроны необходимы, чтобы удерживать ядро вместе, преодолевая взаимное отталкивание увеличивающегося числа протонов, сосредоточенных в очень маленьком пространстве. Например, кремний имеет 14 протонов и 14 нейтронов. Его атомный номер 14, а атомная масса 28.
Рис. 2.2. Изображение атома гелия. Наиболее распространенный изотоп урана имеет 92 протона и 146 нейтронов. Его атомный номер 92, а атомная масса 238 (92 + 146).
Наиболее распространенный изотоп урана имеет 92 протона и 146 нейтронов. Его атомный номер 92, а атомная масса 238 (92 + 146).Точка в середине — это ядро, а окружающее его облако показывает, где в любой момент могут находиться два электрона. Чем темнее оттенок, тем больше вероятность, что там будет электрон. Ангстрем (Å) равен 10 -10 м . Фемтометр (фм) равен 10 -15 м. Другими словами, электронное облако атома гелия примерно в 100 000 раз больше, чем его ядро.
Электроны, вращающиеся вокруг ядра атома, расположены в оболочках, также известных как «энергетические уровни». Первая оболочка может содержать только два электрона, а следующая оболочка может содержать до восьми электронов. Последующие оболочки могут содержать больше электронов, но самая внешняя оболочка любого атома содержит не более восьми электронов. Электроны на внешней оболочке играют важную роль в образовании связей между атомами. Элементы с полной внешней оболочкой являются инертными в том смысле, что они не реагируют с другими элементами с образованием соединений.
 Все они появляются в крайнем правом столбце периодической таблицы: гелий, неон, аргон и т. д. Для элементов, которые не имеют полной внешней оболочки, самые внешние электроны могут взаимодействовать с самыми внешними электронами соседних атомов, создавая химические связи. Конфигурации электронной оболочки для 29из первых 36 элементов перечислены в таблице 2.2.
Все они появляются в крайнем правом столбце периодической таблицы: гелий, неон, аргон и т. д. Для элементов, которые не имеют полной внешней оболочки, самые внешние электроны могут взаимодействовать с самыми внешними электронами соседних атомов, создавая химические связи. Конфигурации электронной оболочки для 29из первых 36 элементов перечислены в таблице 2.2.Таблица 2.2 Конфигурации электронных оболочек некоторых элементов до элемента 36. (Инертные элементы с заполненными внешними оболочками выделены жирным шрифтом.) Число электронов в каждой оболочке Элемент Символ Атомный номер Первый Второй Третий Четвертый Водород Х 1 1 Гелий Он 2 2 Литий Ли 3 2 1 Бериллий Be 4 2 2 Бор Б 5 2 3 Углерод С 6 2 4 Азот Н 7 2 5 Кислород О 8 2 6 Фтор Ф 9 2 7 Неон Не 10 2 8 Натрий На 11 2 8 1 Магний мг 12 2 8 2 Алюминий Ал 13 2 8 3 Кремний Си 14 2 8 4 Фосфор Р 15 2 8 5 Сера С 16 2 8 6 Хлор Кл 17 2 8 7 Аргон Ар 18 2 8 8 Калий К 19 2 8 8 1 Кальций Са 20 2 8 8 2 Скандий Sc 21 2 8 9 2 Титан Ти 22 2 8 10 2 Ванадий В 23 2 8 11 2 Хром Кр 24 2 8 13 1 Марганец Мн 25 2 8 13 2 Железо Фе 26 2 8 14 2 . 
. . . . . . Селен Se 34 2 8 18 6 Бром Бр 35 2 8 18 7 Криптон Кр 36 2 8 18 8 Атрибуции
Рисунок 2.2
Helium Atom от Yzmo находится под лицензией CC-BY-SA-3.0Структура атома
Структура атомаАтом и электромагнитное излучение
Основные Субатомные частицы Электромагнитный Радиация Свет и другие формы электромагнитного излучения Фундаментальный субатомный Частицы
Частица Символ Платный Масса электрон и — -1 0,0005486 а.  е.м.
е.м.протон р + +1 1,007276 а.е.м. нейтрон п о 0 1.008665 аму Количество протонов, нейтронов и электронов в атоме можно определить из набора простых правила.
- Число протонов в ядре атома равно равно атомному номеру ( Z ).
- Количество электронов в нейтральном атоме равно равно числу протонов.
- Массовое число атома ( M ) равно сумма числа протонов и нейтронов в ядро.
- Число нейтронов равно разности
между массовым числом атома ( М ) и
атомный номер ( Z ).

Примеры: Определим количество протонов, нейтронов, и электроны в следующих изотопах.
12 С 13 С 14 С 14 Н Различные изотопы элемента идентифицируют, записывая массовое число атома в верхний левый угол символа элемента. 12 С, 13 C и 14 C изотопы углерода ( Z = 6) и, следовательно, содержат шесть протонов. Если атомы нейтральны, они также должны содержать шесть электронов. Единственный разница между этими изотопами в количестве нейтронов в ядре.
12 C: 6 электронов, 6 протонов и 6 нейтронов
13 C: 6 электронов, 6 протонов и 7 нейтронов
14 С: 6 электронов, 6 протонов и 8 нейтронов
Электромагнитный Радиация
Многое из того, что известно о строении электронов в атоме было получено при изучении взаимодействия между материей и различными формами электромагнитный радиация .
 Электромагнитное излучение имеет некоторые
свойства частицы и волны.
Электромагнитное излучение имеет некоторые
свойства частицы и волны.Частицы имеют определенную массу и занимают пространство. Волны не имеют массы, но несут энергию как они путешествуют по космосу. Помимо их способности несут энергию, волны имеют четыре другие характеристики свойства: скорость, частота, длина волны и амплитуда. частота ( v ) количество волн (или циклов) на единицу время. Частота волны указывается в единицах циклов. в секунду (с -1 ) или герц (Гц).
Идеализированный рисунок волны на рисунке ниже иллюстрирует определения амплитуды и длины волны. Длина волны ( l ) — наименьшее расстояние между повторяющимися точками на волне. Амплитуда волна это расстояние между самой высокой (или самой низкой) точкой волны и центр тяжести волны.
Если мы измерим частоту ( v ) волны в циклах в секунду и длина волны ( l ) в метрах, Произведение этих двух чисел выражается в метрах на второй.
 Произведение частоты ( v ) на
длина волны ( l ) волны, следовательно, скорость ( с )
при котором волна распространяется в пространстве.
Произведение частоты ( v ) на
длина волны ( l ) волны, следовательно, скорость ( с )
при котором волна распространяется в пространстве.вл = с
Свет и прочее Формы электромагнитного излучения
Свет — это волна с электрическими и магнитными составные части. Следовательно, это форма электромагнитного поля . радиация .
Видимый свет содержит узкую полосу частот и длины волн в части электромагнитного спектра которые наши глаза могут обнаружить. Он включает в себя излучение с длины волн от 400 нм (фиолетовый) до 700 нм (красный). Поскольку это волна, свет преломляется, когда попадает в стекло. призма. Когда белый свет фокусируется на призме, световые лучи с разной длиной волны изгибаются на разную величину и свет превращается в спектр цветов.
 Начиная
со стороны спектра, где свет преломляется
наименьший угол, цвета красный, оранжевый, желтый, зеленый,
синий, и фиолетовый.
Начиная
со стороны спектра, где свет преломляется
наименьший угол, цвета красный, оранжевый, желтый, зеленый,
синий, и фиолетовый.Как видно из следующей диаграммы, энергия переносимый светом, увеличивается по мере того, как мы переходим от красного к синему через видимый спектр.
Поскольку длина волны электромагнитного излучения может быть до 40 м или до 10 -5 нм, видимый спектр составляет лишь малую часть всего диапазона электромагнитного излучения.
Электромагнитный спектр включает радио- и телеволны, микроволны, инфракрасное излучение, видимый свет, ультрафиолет, рентгеновские лучи, g-лучи и космические лучи, как показано на рисунке выше. Эти различные формы излучения движутся со скоростью света ( c ). Однако они различаются по своей частоте и длины волн. Произведение частоты на длина волны электромагнитного излучения всегда равна скорость света.

вл = с
В результате электромагнитное излучение то, что имеет большую длину волны, имеет низкую частоту, а излучение с высокой частотой имеет короткую длину волны.
вопросов и ответов — Как найти количество протонов, электронов и нейтронов в атоме элемента?
Предыдущий вопрос
(Не могли бы вы объяснить плотность?)
Вопросы и ответы
Основной индексСледующий вопрос
(Сколько протонов, нейтронов и электронов в атоме?)
Предыдущий вопрос
(Не могли бы вы объяснить плотность?)
Вопросы и ответы Основной индекс
Следующий вопрос
(Сколько протонов, нейтронов и электронов в атоме?)
Вопросы и ответы Основной индекс
Сколько протонов, электронов и нейтронов в атоме криптона, углерода, кислорода, неона, серебра, золота и т.д…?
Чтобы найти количество протонов, электронов и нейтронов в атоме, выполните следующие простые шаги:
Шаг 1.
 Сбор информации
Сбор информацииПервое, что вам нужно сделать, это найти некоторую информацию о вашем элементе. Перейдите в периодическую таблицу элементов и нажмите на свой элемент. Если это упрощает задачу, вы можете выбрать элемент из алфавитного списка.
Используйте Таблицу элементов, чтобы найти атомный номер и атомный вес вашего элемента. Атомный номер — это число, расположенное в верхнем левом углу, а атомный вес — это число, расположенное внизу, как в этом примере для криптона:
Шаг 2. Число протонов равно…
атомный номер — это количество протонов в атоме элемента. В нашем примере атомный номер криптона равен 36. Это говорит нам о том, что атом криптона имеет в ядре 36 протонов.
Интересно, что каждый атом криптона содержит 36 протонов. Если в атоме нет 36 протонов, он не может быть атомом криптона. Добавление или удаление протонов из ядра атома создает другой элемент. Например, удаление одного протона из атома криптона создает атом брома.

Шаг 3. Число электронов равно…
По определению атомы не имеют общего электрического заряда. Это означает, что должен существовать баланс между положительно заряженными протонами и отрицательно заряженными электронами. Атомов должно быть равное количество протонов и электронов. В нашем примере атом криптона должен содержать 36 электронов, поскольку он содержит 36 протонов.
Электроны особым образом расположены вокруг атомов. Если вам нужно знать, как электроны расположены вокруг атома, взгляните на статью «Как читать таблицу конфигурации электронов?» страница.
Атом может приобретать или терять электроны, становясь так называемым ионом . Ион — это не что иное, как электрически заряженный атом. Добавление или удаление электронов из атома не меняет того, какой это элемент, а только его суммарный заряд.
Например, удаление электрона из атома криптона образует ион криптона, который обычно записывается как Kr + . Знак плюс означает, что это положительно заряженный ион.
 Он заряжен положительно, потому что из атома был удален отрицательно заряженный электрон. Оставшихся 35 электронов было меньше, чем 36 положительно заряженных протонов, что привело к заряду +1.
Он заряжен положительно, потому что из атома был удален отрицательно заряженный электрон. Оставшихся 35 электронов было меньше, чем 36 положительно заряженных протонов, что привело к заряду +1.Шаг 4. Число нейтронов равно…
Атомный вес в основном является измерением общее число частиц в ядре атома . На самом деле, это не такой чистый срез. Атомный вес на самом деле представляет собой средневзвешенное значение всех встречающихся в природе изотопов элемента по отношению к массе углерода-12. Не понял? Не имеет значения. Все, что вам действительно нужно найти, это то, что называется массовым числом . К сожалению, массовое число не указано в таблице элементов. К счастью, чтобы найти массовое число, все, что вам нужно сделать, это округлить атомный вес до ближайшего целого числа 9.1278 . В нашем примере массовое число криптона равно 84, так как его атомный вес 83,80 округляется до 84.
Массовое число — это количество частиц в ядре атома.
 Помните, что ядро состоит из протонов и нейтронов. Итак, если мы хотим, мы можем написать:
Помните, что ядро состоит из протонов и нейтронов. Итак, если мы хотим, мы можем написать:Массовое число = (Количество протонов) + (Количество нейтронов)
Для криптона это уравнение принимает вид:
84 = (Количество протонов) + (Количество нейтронов)
Если бы мы только знали, сколько протонов у криптона, мы могли бы вычислить, сколько у него нейтронов. Подожди… Нам до знают, сколько протонов у криптона! Мы сделали это еще в Шаг 2 ! Атомный номер (36) — это количество протонов в криптоне. Подставляя это в уравнение, мы получаем:
84 = 36 + (Число нейтронов)
Какое число, прибавленное к 36, дает 84? Надеюсь, вы сказали 48. Это количество нейтронов в атоме криптона.
Интересно, что добавление или удаление нейтронов из атома не создает новый элемент. Скорее, он создает более тяжелую или более легкую версию этого элемента. Эти разные версии называются изотопами, и большинство элементов на самом деле представляют собой смесь разных изотопов.



 Атом, который получает один или несколько электронов, будет иметь отрицательный заряд и называется анионом. Положительно заряженные атомы, называемые катионами 9{-2}}\]
Атом, который получает один или несколько электронов, будет иметь отрицательный заряд и называется анионом. Положительно заряженные атомы, называемые катионами 9{-2}}\] Относительные массы атомов сообщаются с использованием атомной единицы массы ( а.е.м. ), которая определяется как одна двенадцатая массы одного атома углерода-12 с 6 протонами, 6 нейтронами и 6 электронами.
Относительные массы атомов сообщаются с использованием атомной единицы массы ( а.е.м. ), которая определяется как одна двенадцатая массы одного атома углерода-12 с 6 протонами, 6 нейтронами и 6 электронами.
 Благодаря этим занятиям учащиеся познакомятся с некоторыми характеристиками электронов, протонов и нейтронов, из которых состоят атомы.
Благодаря этим занятиям учащиеся познакомятся с некоторыми характеристиками электронов, протонов и нейтронов, из которых состоят атомы.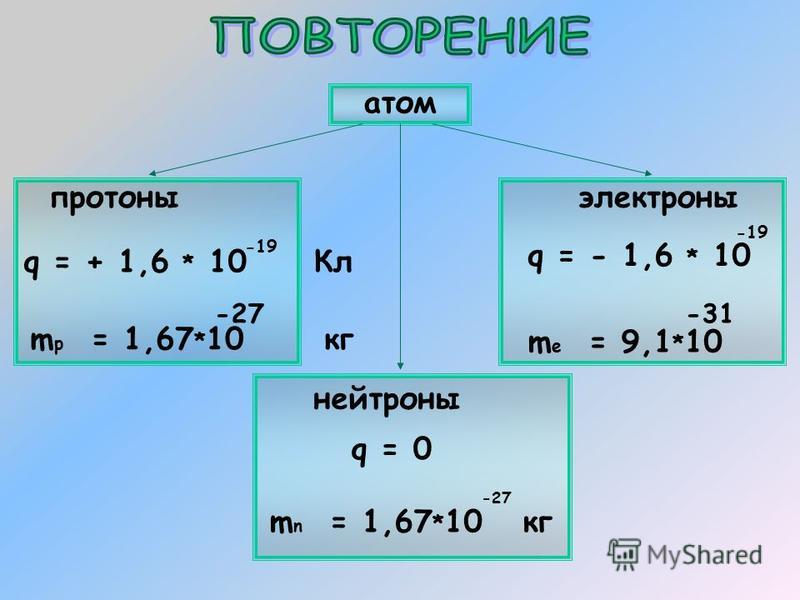
 Заряды протона и электрона точно такого же размера, но противоположны. В нейтральном атоме одинаковое количество протонов и электронов точно компенсируют друг друга.
Заряды протона и электрона точно такого же размера, но противоположны. В нейтральном атоме одинаковое количество протонов и электронов точно компенсируют друг друга.
 В нем всего 1 протон, 1 электрон и 0 нейтронов. Это единственный атом, в котором нет нейтронов. Объясните, что это простая модель, показывающая движение электрона вокруг ядра.
В нем всего 1 протон, 1 электрон и 0 нейтронов. Это единственный атом, в котором нет нейтронов. Объясните, что это простая модель, показывающая движение электрона вокруг ядра. Эта сила намного сильнее силы отталкивания одного протона от другого.
Эта сила намного сильнее силы отталкивания одного протона от другого.

 Затем они должны проверить, притягивается ли пластик к их одежде. Если нет, учащиеся должны снова попробовать зарядить пластик.
Затем они должны проверить, притягивается ли пластик к их одежде. Если нет, учащиеся должны снова попробовать зарядить пластик. Положительная кожа и отрицательный пластик притягивают друг друга, потому что положительное и отрицательное притягиваются.
Положительная кожа и отрицательный пластик притягивают друг друга, потому что положительное и отрицательное притягиваются. Когда пластик приближается к столу, отрицательно заряженный пластик отталкивает электроны от поверхности стола. Это делает поверхность стола возле пластика слегка положительной. Отрицательно заряженный пластик притягивается к этой положительной области, поэтому пластик движется к ней.
Когда пластик приближается к столу, отрицательно заряженный пластик отталкивает электроны от поверхности стола. Это делает поверхность стола возле пластика слегка положительной. Отрицательно заряженный пластик притягивается к этой положительной области, поэтому пластик движется к ней. Поскольку на обеих полосках есть дополнительные электроны, каждая из них имеет дополнительный отрицательный заряд. Так как одинаковые заряды отталкиваются друг от друга, полоски удаляются друг от друга.
Поскольку на обеих полосках есть дополнительные электроны, каждая из них имеет дополнительный отрицательный заряд. Так как одинаковые заряды отталкиваются друг от друга, полоски удаляются друг от друга.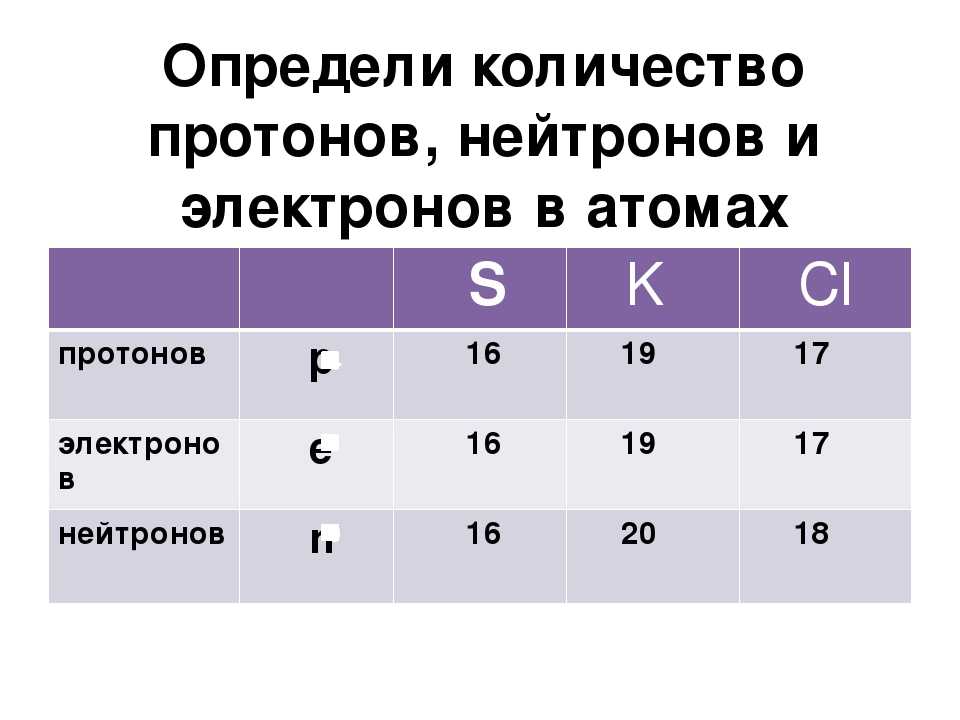
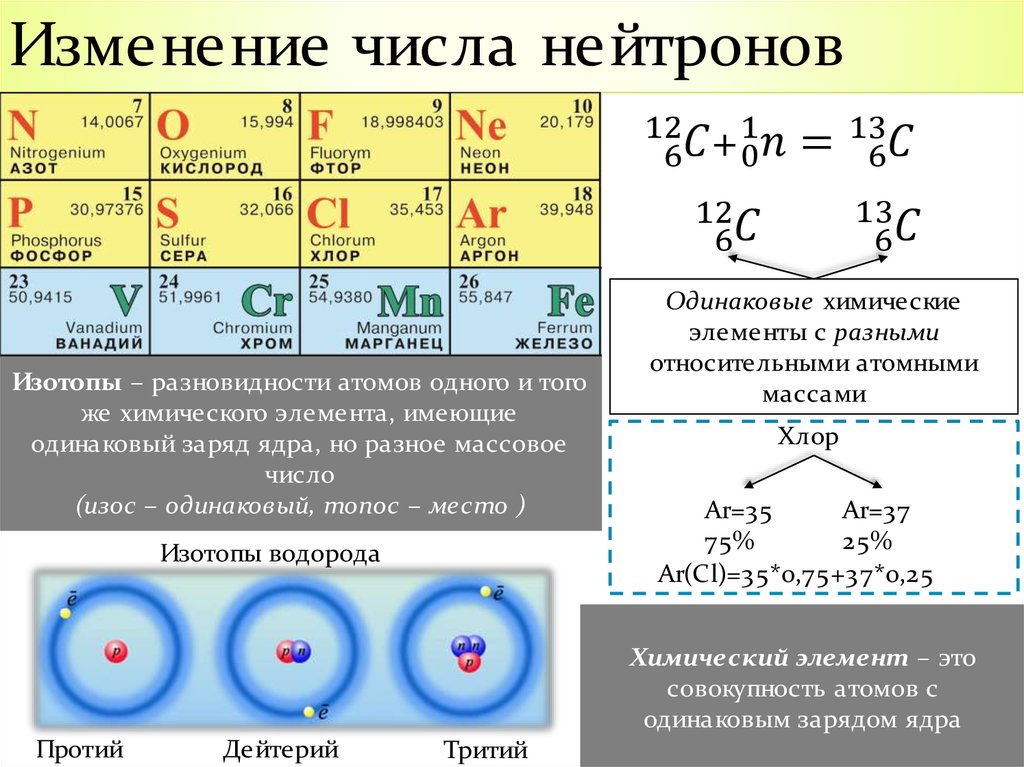
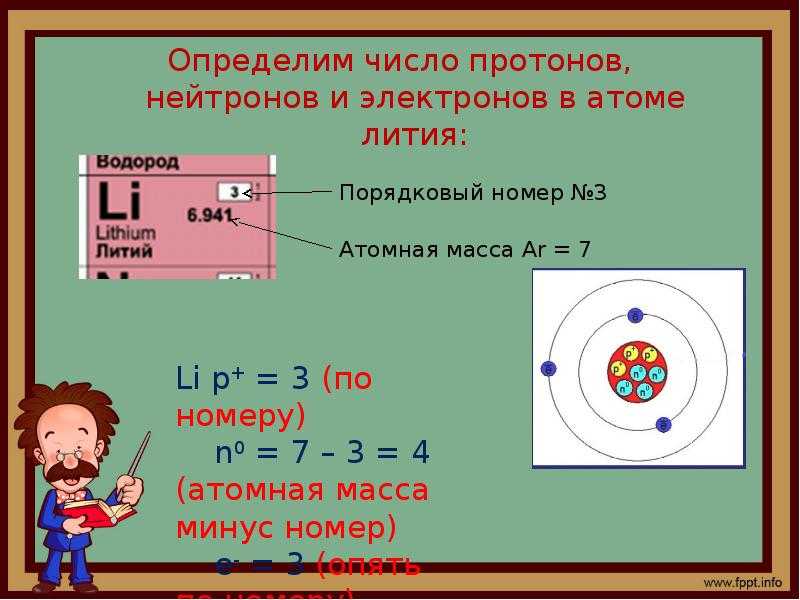
 Поскольку больше протонов находится на поверхности воды, это положительное изменение. Противоположности притягиваются, поэтому вода движется к шарику.
Поскольку больше протонов находится на поверхности воды, это положительное изменение. Противоположности притягиваются, поэтому вода движется к шарику. Атомный номер – это число протонов в
ядро атома. Количество протонов определяет идентичность
элемента (т. е. элемент с 6 протонами является атомом углерода, как бы
может присутствовать много нейтронов). Количество протонов определяет, как
много электронов окружает ядро, и это расположение этих
электроны, которые определяют большую часть химического поведения элемента.
Атомный номер – это число протонов в
ядро атома. Количество протонов определяет идентичность
элемента (т. е. элемент с 6 протонами является атомом углерода, как бы
может присутствовать много нейтронов). Количество протонов определяет, как
много электронов окружает ядро, и это расположение этих
электроны, которые определяют большую часть химического поведения элемента.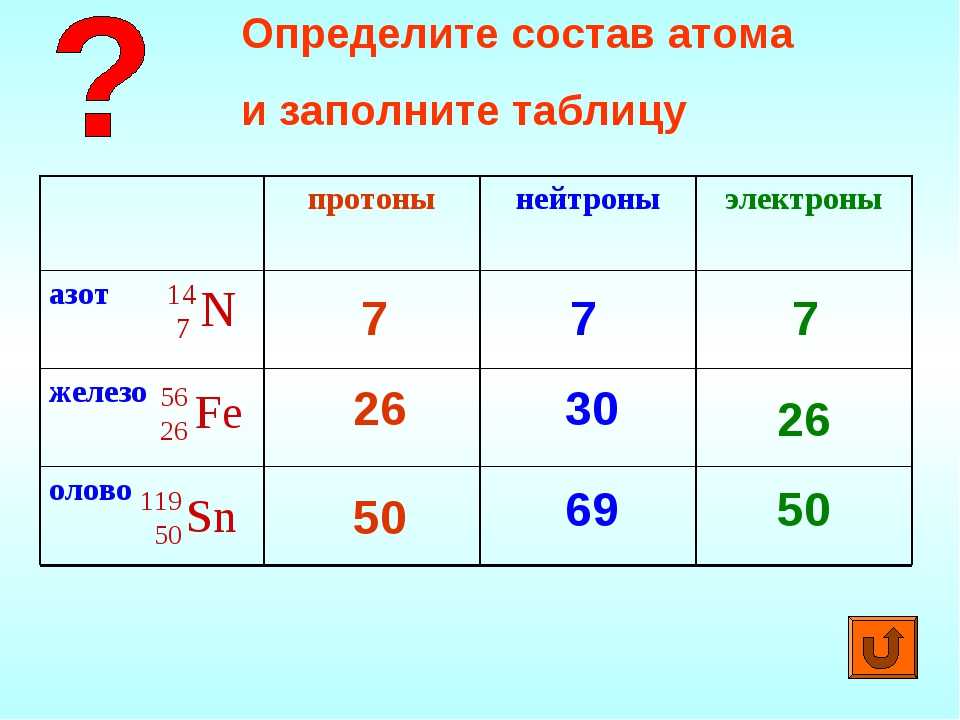 Как только структура ядра была понята,
стало ясно, что это атомный номер , который регулировал
свойства элементов.
Как только структура ядра была понята,
стало ясно, что это атомный номер , который регулировал
свойства элементов. 01218
01218 98977
98977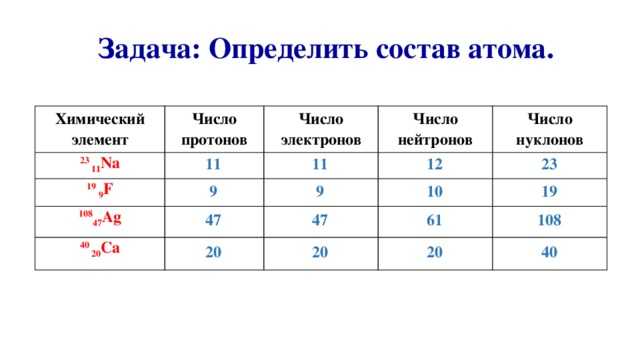 0983
0983 847
847 9216
9216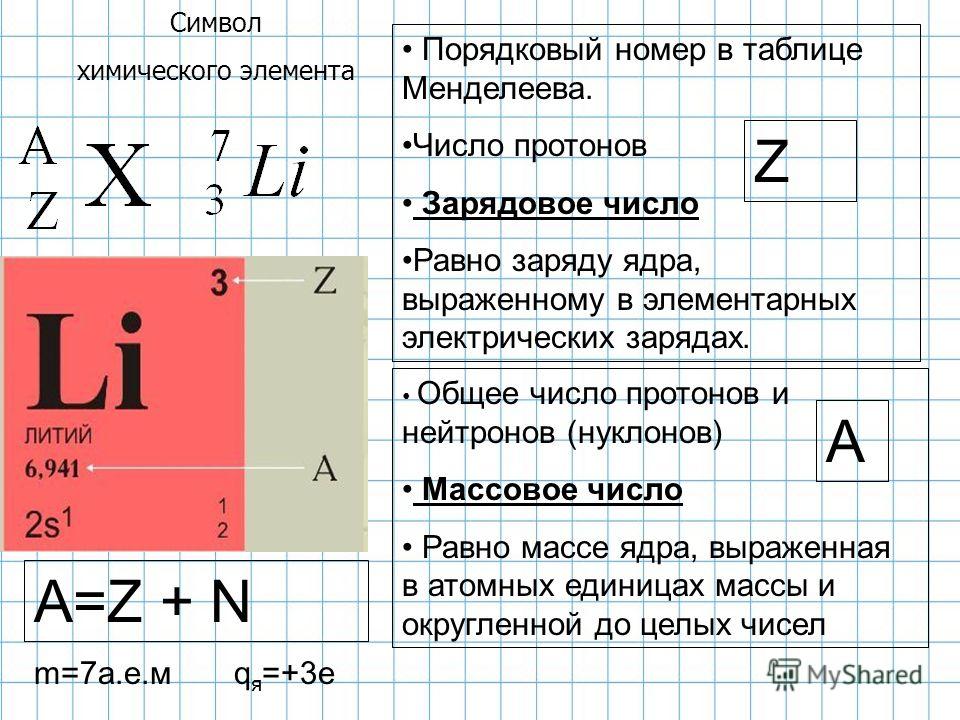 9064
9064 9045
9045 9304
9304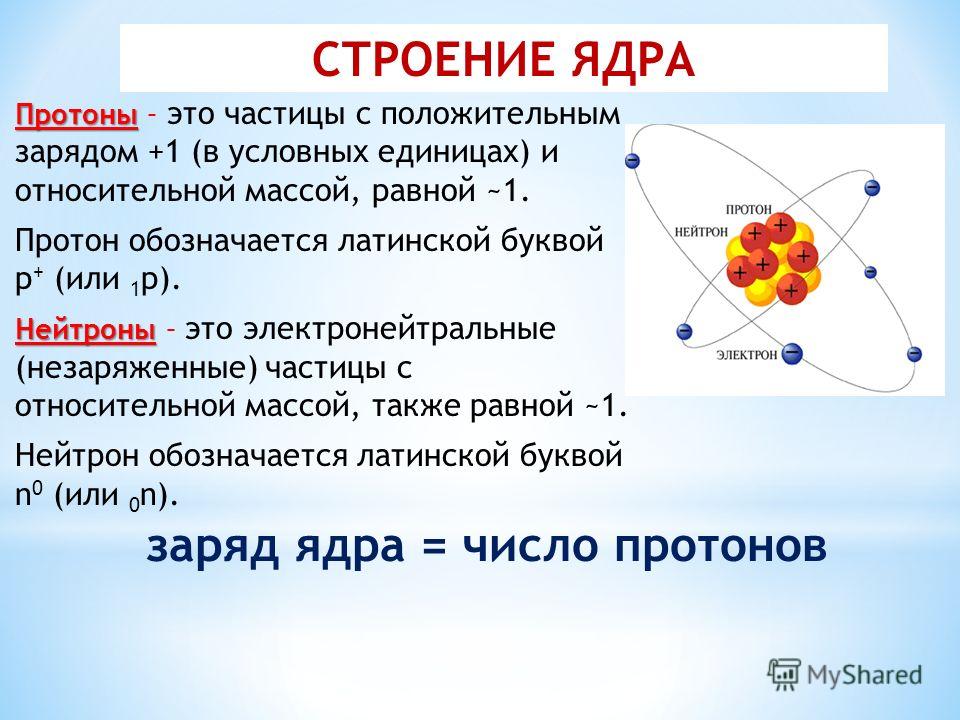 ст.
ст.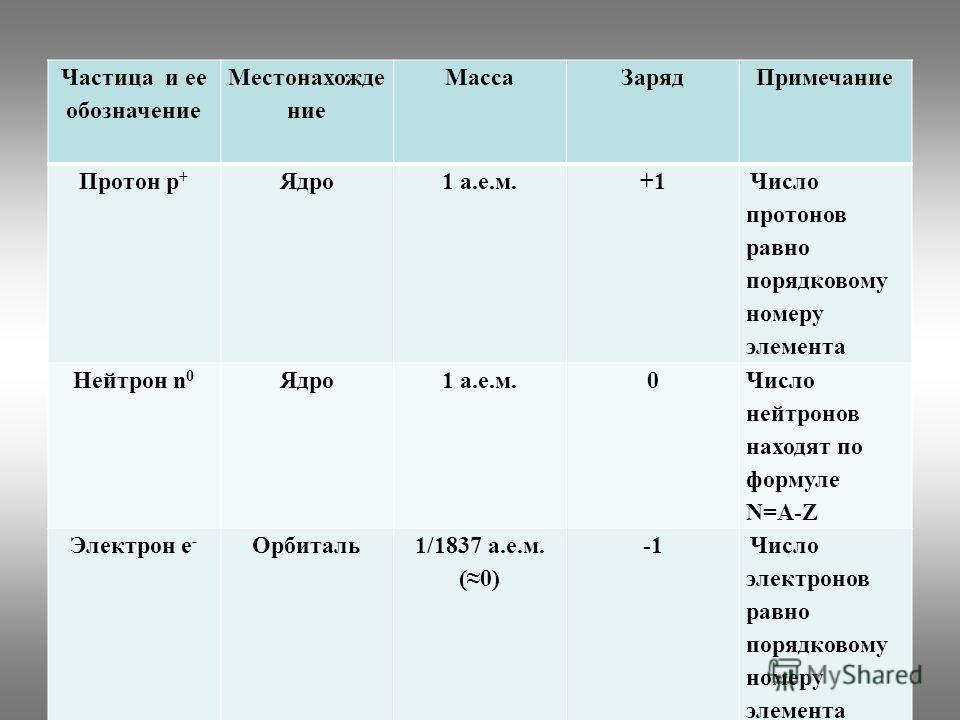 0254
0254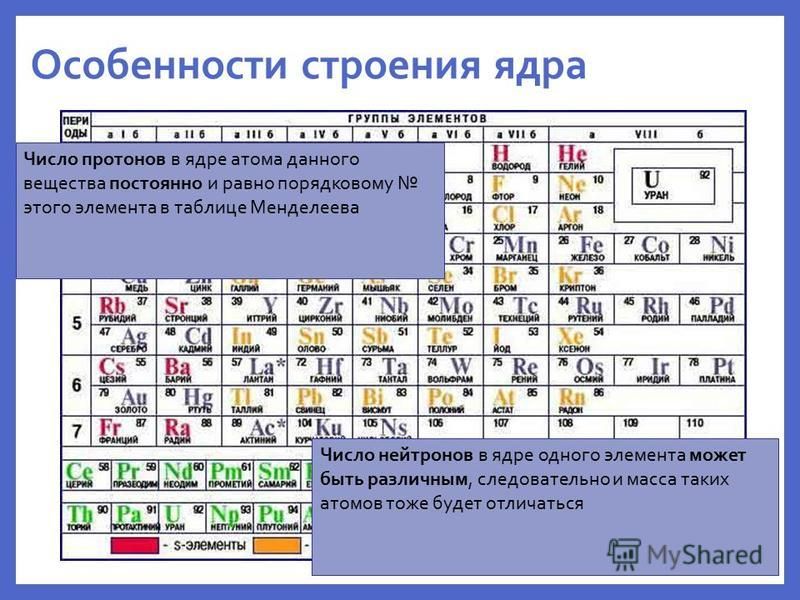
 1 Электроны, протоны, нейтроны и атомы – физическая геология
1 Электроны, протоны, нейтроны и атомы – физическая геология Протон образует ядро, а электрон вращается вокруг него. Все остальные элементы имеют в своем ядре нейтроны, а также протоны, например, гелий, изображенный на рис. 2.2. Положительно заряженные протоны имеют тенденцию отталкиваться друг от друга, а нейтроны помогают удерживать ядро вместе. Количество протонов равно атомный номер , а количество протонов плюс нейтронов составляет атомная масса . Для водорода атомная масса равна 1, потому что есть один протон и нет нейтронов. Для гелия это 4: два протона и два нейтрона.
Протон образует ядро, а электрон вращается вокруг него. Все остальные элементы имеют в своем ядре нейтроны, а также протоны, например, гелий, изображенный на рис. 2.2. Положительно заряженные протоны имеют тенденцию отталкиваться друг от друга, а нейтроны помогают удерживать ядро вместе. Количество протонов равно атомный номер , а количество протонов плюс нейтронов составляет атомная масса . Для водорода атомная масса равна 1, потому что есть один протон и нет нейтронов. Для гелия это 4: два протона и два нейтрона.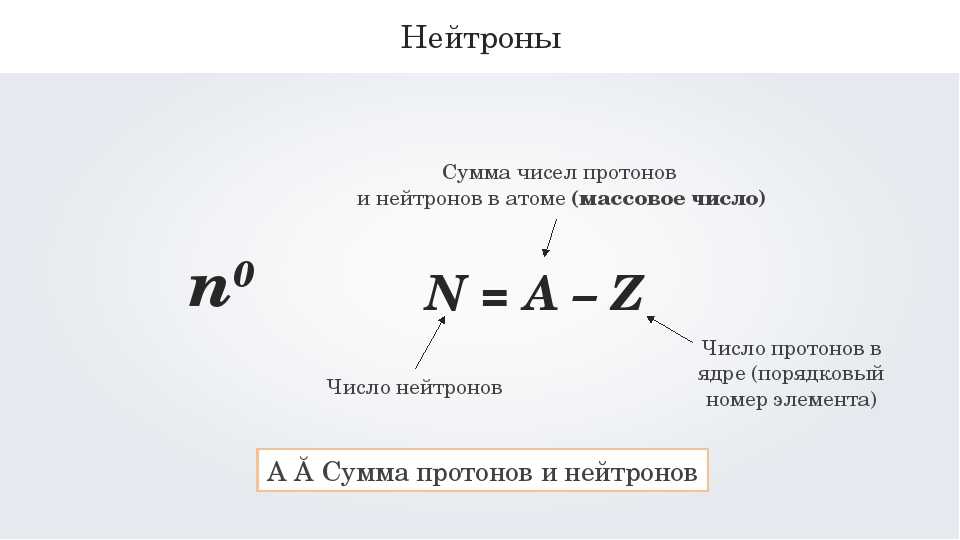 Наиболее распространенный изотоп урана имеет 92 протона и 146 нейтронов. Его атомный номер 92, а атомная масса 238 (92 + 146).
Наиболее распространенный изотоп урана имеет 92 протона и 146 нейтронов. Его атомный номер 92, а атомная масса 238 (92 + 146). Все они появляются в крайнем правом столбце периодической таблицы: гелий, неон, аргон и т. д. Для элементов, которые не имеют полной внешней оболочки, самые внешние электроны могут взаимодействовать с самыми внешними электронами соседних атомов, создавая химические связи. Конфигурации электронной оболочки для 29из первых 36 элементов перечислены в таблице 2.2.
Все они появляются в крайнем правом столбце периодической таблицы: гелий, неон, аргон и т. д. Для элементов, которые не имеют полной внешней оболочки, самые внешние электроны могут взаимодействовать с самыми внешними электронами соседних атомов, создавая химические связи. Конфигурации электронной оболочки для 29из первых 36 элементов перечислены в таблице 2.2.