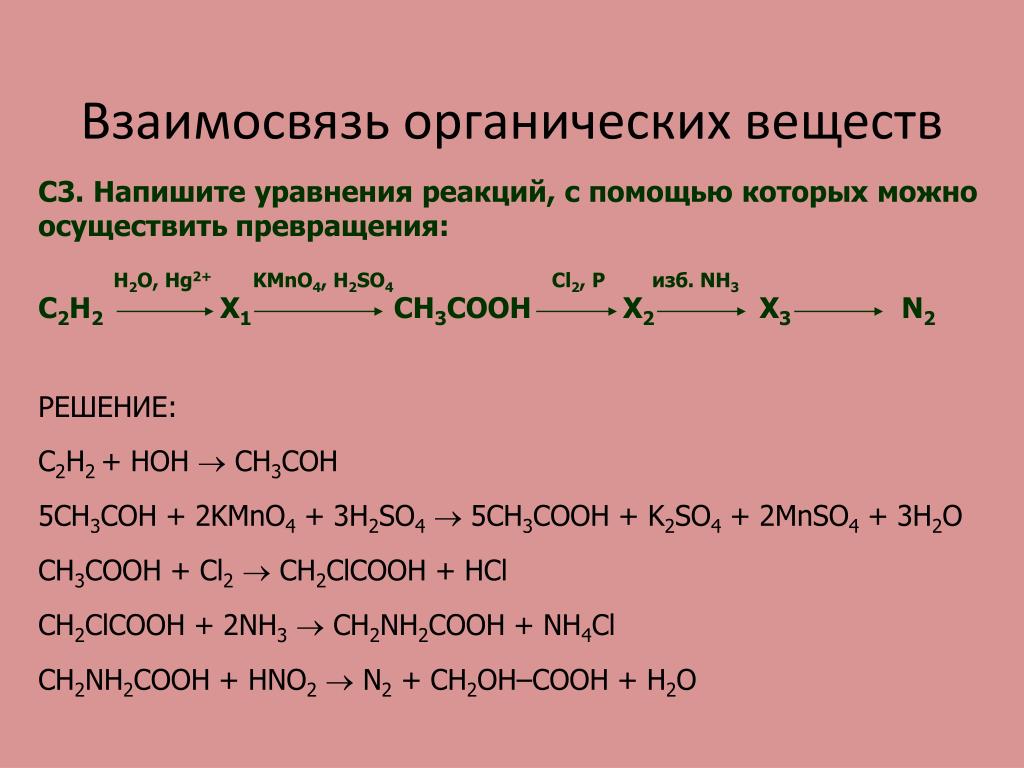
Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
Пользуйтесь нашим приложением
Химическая реакция.
 Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях – HIMI4KA
Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях – HIMI4KAОГЭ 2018 по химии › Подготовка к ОГЭ 2018
Химической реакцией называют взаимодействия, приводящие к изменению химической природы участвующих в них частиц. При этом происходит изменение их состава и (или) строения. В химических реакциях могут участвовать атомы, молекулы, ионы и радикалы.
В ходе химических реакций атомные ядра не затрагиваются и число атомов каждого химического элемента сохраняется.
Химические реакции протекают при определённых условиях (температура, давление, наличие или отсутствие растворителя, катализа, ультрафиолетовое излучение).
Признаками протекания химических реакций являются выделение или поглощение газа, образование или растворение осадка, изменение цвета, выделение или поглощение теплоты.
Описание качественных реакций, используемых для определения некоторых катионов и анионов, приводится в приложении в конце урока.
В таблице 5 представлены сведения о внешнем виде и свойствах некоторых распространённых веществ и соединений, используемых при описании внешних признаков протекания химической реакции.
Для описания химических реакций используют химические уравнения, в левой части которых указывают исходные вещества, а в правой — продукты реакции. Обе части химического уравнения соединяют стрелкой (в случае необратимых химических превращений), а если химическая реакция является обратимой, то это показывают с помощью прямой и обратной стрелок.
В неорганической химии, если количество атомов химических элементов в левой и правой частях уравнено с помощью стехиометрических коэффициентов, части уравнения часто соединяют знаком равенства.
Стехиометрией называют учение о количественных соотношениях между реагентами и продуктами реакции.
Коэффициенты стехиометрические — действительные натуральные (то есть положительные, как правило, целые) числа, стоящие перед формулой химического вещества в уравнении реакции. Коэффициенты показывают минимальное количество структурных единиц вещества (атомов, молекул, ионов, радикалов), участвующих в данной реакции.
Коэффициенты показывают минимальное количество структурных единиц вещества (атомов, молекул, ионов, радикалов), участвующих в данной реакции.
В вышеприведённой реакции два атома алюминия реагируют с тремя молекулами серной кислоты, в результате чего образуется одна молекула сульфата алюминия (коэффициент, равный одному, перед формулой не ставят) и три молекулы водорода.
В соответствии с законом сохранения массы (закон Ломоносова — Лавуазье) масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Этот закон подтверждает, что атомы являются неделимыми и в ходе химических реакций не изменяются. Молекулы при реакциях претерпевают изменения, но общее число атомов каждого вида не изменяется, и поэтому общая масса веществ в процессе реакции сохраняется.
Содержание
- Тренировочные задания
- Ответы
- Приложение
Тренировочные задания
1. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu(NO3)2 и NaOH
Б) Cu(NO3)2 и Na2S
В) Cu(NO3)2 и HNO3
ПРИЗНАКИ РЕАКЦИИ:
1) растворение осадка
2) выделение чёрного осадка
3) отсутствие внешних признаков
4) выделение синего осадка
2. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu(NO3)2 и NaOH
Б) HCl и Al(OH)3
В) AgNO3 и KI
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) растворение осадка
3) выделение белого осадка
4) выделение синего осадка
3. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и H3PO4
Б) Zn(OH)2 и HCl
В) MnO2 и HCl
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение жёлто-зелёного газа
3) выделение жёлтого осадка
4) растворение осадка
4. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) K2CrO4 и H2SO4
Б) Cu(OH)2 и HCl
В) HCl и NaOH
ПРИЗНАКИ РЕАКЦИИ:
1) появление оранжевой окраски
2) выделение газа с характерным запахом
3) растворение осадка
4) отсутствие внешних признаков
5. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaCl
Б) NaI и AgNO3
В) CuCl2 и Na2S
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) отсутствие внешних признаков
3) выделение белого осадка
4) выделение чёрного осадка
6. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Zn и KOH
В) HCl и FeS
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) выделение газа с характерным запахом
3) выделение бесцветного газа
4) выделение чёрного осадка
7.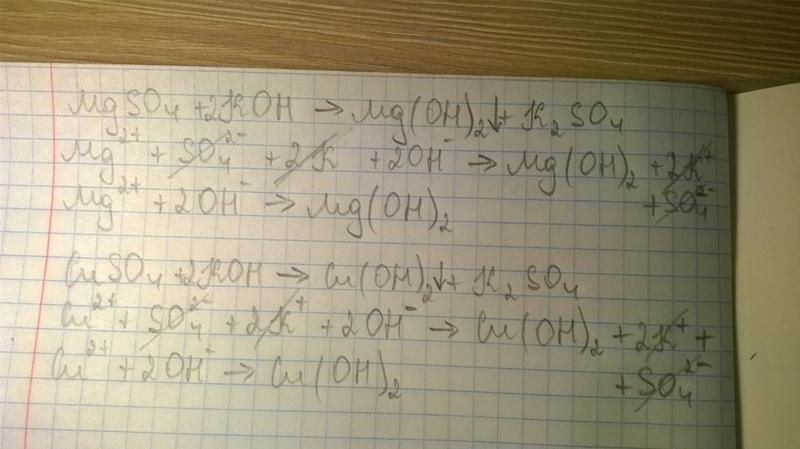 Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) K2S и H2SO4
Б) Fe(OH)2 и HCl
В) FeSO4 и Ba(NO3)2
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
8. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu(NO3)2 и KOH
Б) K2CO3 и BaCl2
В) Na2CO3 и HNO3
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
9. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) CaCl2 и AgNO3
Б) CuCl2 и Ba(OH)2
В) FeCl3 и Ba(OH)2
ПРИЗНАКИ РЕАКЦИИ:
1) выделение синего осадка
2) растворение осадка
3) выделение белого осадка
4) выделение бурого осадка
10. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Al и NaOH
В) HCl и K2SO3
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
11. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Al(NO3)3 и NaOH
Б) K2CO3 и HNO3
В) HBr и NaOH
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) отсутствие внешних признаков
12. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu и HNO3 (конц.)
Б) Cu и h3SO4 (конц.)
В) BaCO3 и HCl
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение бесцветного газа
13. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NH4Cl
Б) NH4Cl и Ca(OH)2
В) CuSO4 и KOH
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
14. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Fe(NO3)2 и NaOH
Б) KOH и CuCl2
В) ZnCl2 и Na2S
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого осадка
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
15.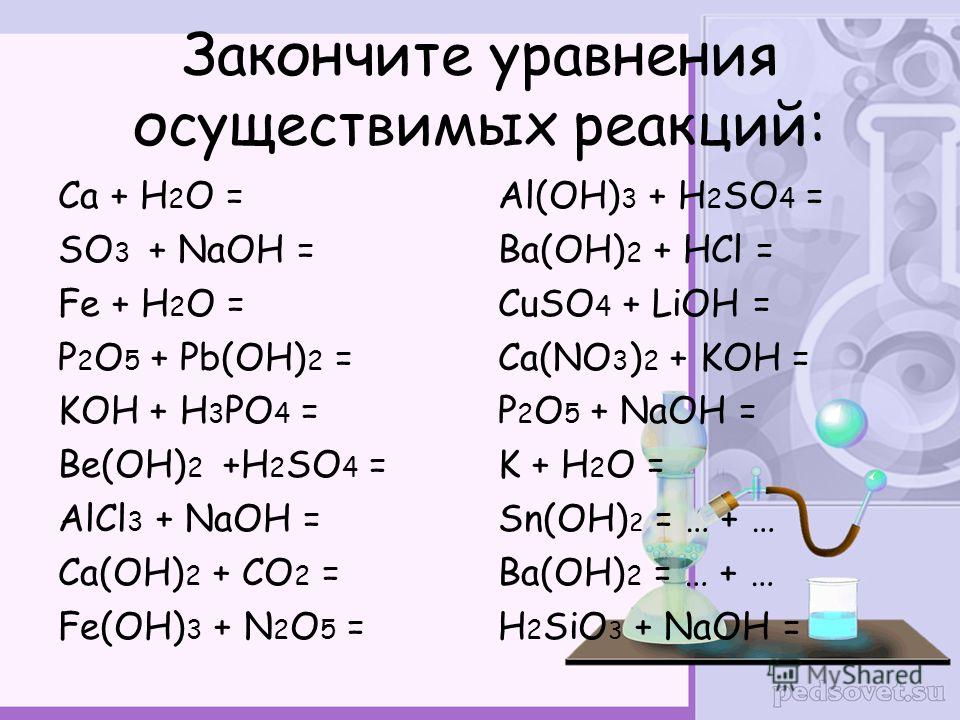 Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu и H2SO4(конц.)
Б) NaOH и NH4Cl
В) Na2CO3 и HI
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа
3) выделение белого осадка
4) выделение чёрного осадка
16. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) CuSO4 и BaCl2
Б) CuSO4 и NaOH
В) FeSO4 и NaOH
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
17. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) FeCl3 и AgNO3
Б) CaCl2 и Na2CO3
В) KOH и H3PO4
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение чёрного осадка
18. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) H2SO4 и Na2SO3
Б) HCl и Na2CO3
В) Cr(OH)3 и HCl
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
19. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) HNO3 и K2SiO3
Б) H2SO4 и BaCl2
В) Cu и H2SO4
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) выделение студенистого бесцветного осадка
20. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) BaI2 и AgNO3
Б) Ag и HNO3 (конц.)
В) Ag и H2SO4 (конц.)
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
Ответы
Приложение
Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению энергии →
← Атомы и молекулы. Химический элемент. Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических соединений
Вопрос по химии | Wyzant Спросите эксперта
Химия
Вопрос задан 22.05.19Если дать 75,0 г гидроксида калия прореагировать с 50 г соляной кислоты, сколько образуется хлорида калия?
Подписаться І 1
Подробнее
Отчет
1 ответ эксперта
Лучший Новейшие Самый старыйАвтор: Лучшие новыеСамые старые
Эрин М. ответил 22.05.19
ответил 22.05.19
Репетитор
5,0 (570)
Опытный и эффективный репетитор STEM
Смотрите таких репетиторов
Смотрите таких репетиторов
Здравствуйте!
Сначала нам нужно начать со сбалансированного уравнения:
Гидроксид калия — KOH
Соляная кислота — HCl
Это реакция двойного замещения/кислотно-основной реакции
1 KOH + 1 HCl → 1 H 2 O + 1 KCl
Теперь, когда у нас есть сбалансированное уравнение, нам нужно преобразовать граммы каждого вещества в моли этого вещества, а затем в моли KCl. Это называется проблемой предельных реагентов, потому что вам дана масса двух реагентов.
Мы знаем, что у нас есть 75 г КОН, так что давайте сначала конвертируем это в моли КОН, используя молярную массу, найденную из периодической таблицы.
K = 39,1 г/моль, O = 16 г/моль, H = 1,01 г/моль, поэтому молярная масса КОН равна их сумме:
39,1 + 16 + 1,01 = 56,11 г/моль
Чтобы перейти от граммов к молям, мы будем использовать некоторый размерный анализ/стехиометрию. Если есть какие-либо вопросы о том, делить или умножать, разделите или умножьте свои единицы и посмотрите, получите ли вы нужные единицы.
Если есть какие-либо вопросы о том, делить или умножать, разделите или умножьте свои единицы и посмотрите, получите ли вы нужные единицы.
75 г КОН x 1 моль КОН = 1,34 моль КОН
1 56,11 г KOH
Теперь мы можем использовать наше сбалансированное уравнение для преобразования молей KOH в моли KCl. Сбалансированное уравнение дает нам наши «молярные отношения», которые говорят вам, сколько молей реагентов необходимо для получения некоторого количества молей продукта. Итак, поскольку все ведущие коэффициенты в сбалансированном уравнении равны 1, мы можем сказать, что количество KOH является точным количеством KCl, которое будет произведено.
Следовательно,
1,34 моль KOH = 1,34 моль KCl
Теперь проделаем то же самое для 50 г HCl.
50 г HCl x 1 моль HCl = 1,37 моль HCl = 1,37 моль KCl
1 36,46 г HCl
Итак, теперь у нас есть два количества KCl. Однако, поскольку это проблема ограничивающего реагента, мы собираемся выбрать только наименьшее число, потому что это количество, которое будет произведено до того, как закончится предельный реагент.
Думайте об этом, как о расплавлении тунца. На каждый расплав тунца у вас есть два ломтика хлеба, одна банка тунца и один ломтик сыра. Если вы начнете с 50 кусков хлеба, банок тунца и ломтиков сыра, хлеб закончится первым, и максимальное количество бутербродов, которое вы можете сделать, равно 25, даже если у вас все еще остались сыр и тунец. То же самое и здесь: как только лимитирующий реагент закончится, вы больше не сможете производить продукт.
Итак, мы будем использовать 1,34 моля KCl, потому что это меньшее из двух чисел, а это означает, что KOH будет ограничивающим реагентом.
Таким образом, образуется 1,34 моль KCl, или, если перевести это в граммы,
1,34 моль KCl x 74,55 г KCl
9,10 моль KCl
Голосовать за 0 голос против
Еще
Отчет
Все еще ищете помощи? Получите правильный ответ, быстро.
Задайте вопрос бесплатно
Получите бесплатный ответ на быстрый вопрос.
Ответы на большинство вопросов в течение 4 часов.
ИЛИ
Найдите онлайн-репетитора сейчас
Выберите эксперта и встретьтесь онлайн. Никаких пакетов или подписок, платите только за то время, которое вам нужно.
4.3 Кислотно-основные реакции. Введение в химию
Цели обучения
К концу этого раздела вы сможете:
- Идентифицировать некоторые распространенные кислоты и основания
- Дайте определение кислотно-основным реакциям
- Распознавать и идентифицировать примеры кислотно-щелочных реакций
- Предсказать продукты кислотно-основных реакций.

Кислоты и основания
Определение кислоты часто приводится как любое соединение, которое увеличивает количество ионов водорода (H + ) в водном растворе. Химической противоположностью кислоты является основание. Эквивалентное определение основания состоит в том, что основание – это соединение, которое увеличивает количество гидроксид-иона (OH — ) в водном растворе. Эти первоначальные определения были предложены Аррениусом (тот же человек, который предложил ионную диссоциацию) в 1884 г., поэтому они упоминаются как Определение по Аррениусу кислоты и основания соответственно.
Вы можете понять, что, основываясь на описании атома водорода, ион H  Чтобы представить это химически, мы определяем ион гидроксония H 3 O + (водный), молекула воды с присоединенным к ней дополнительным ионом водорода. как H 3 O + , что представляет собой дополнительный протон, присоединенный к молекуле воды. Мы используем ион гидроксония как более логичный способ появления иона водорода в водном растворе, хотя во многих химических реакциях H + и H 3 O + рассматриваются одинаково.
Чтобы представить это химически, мы определяем ион гидроксония H 3 O + (водный), молекула воды с присоединенным к ней дополнительным ионом водорода. как H 3 O + , что представляет собой дополнительный протон, присоединенный к молекуле воды. Мы используем ион гидроксония как более логичный способ появления иона водорода в водном растворе, хотя во многих химических реакциях H + и H 3 O + рассматриваются одинаково.
В целях этого краткого введения мы рассмотрим только наиболее распространенные типы кислотно-щелочных реакций, происходящих в водных растворах. В этом контексте 9{+}(aq)[/latex]
Процесс, представленный этим уравнением, подтверждает, что хлористый водород является кислотой. При растворении в воде ионы H 3 O + образуются в результате химической реакции, в которой ионы H + переходят от молекул HCl к молекулам H 2 O (рис. 1).
Природа HCl такова, что ее реакция с водой, как только что описана, практически на 100% эффективна: практически каждая молекула HCl, которая растворяется в воде, подвергается этой реакции. Кислоты, которые полностью реагируют таким образом, называются сильными кислотами , а HCl является одним из немногих обычных кислотных соединений, которые классифицируются как сильные (таблица 1).
Значительно большее количество соединений ведут себя как слабые кислоты и лишь частично реагируют с водой, оставляя подавляющее большинство растворенных молекул в их исходной форме и генерируя относительно небольшое количество ионов гидроксония.
| Составная формула | Наименование в водном растворе |
|---|---|
| ВЧ | фтористоводородная кислота |
| ХСN | синильная кислота |
| HC 2 H 3 O 2 | уксусная кислота |
| HNO 2 | азотистая кислота |
| HClO | хлорноватистая кислота |
| HClO 2 | хлорноватистая кислота |
| Н 2 SO 3 | сернистая кислота |
| Н 2 СО 3 | угольная кислота |
| H 3 Заказ на покупку 4 | фосфорная кислота |
Таблица 2. Общие слабые кислоты Общие слабые кислоты | |
Слабые кислоты широко распространены в природе, они частично ответственны за острый вкус цитрусовых, ощущение жжения от укусов насекомых и неприятные запахи, связанные с запахом тела. Известным примером слабой кислоты является уксусная кислота, основной ингредиент пищевых уксусов: 9{-}[/latex](рисунок 2). Использование двойной стрелки в приведенном выше уравнении обозначает частичный аспект реакции этого процесса, понятие, полностью рассмотренное в главах, посвященных химическому равновесию.)
Рисунок 2. (a) Фрукты, такие как апельсины, лимоны и грейпфруты содержат слабокислотную лимонную кислоту. б) уксус содержит слабую уксусную кислоту. (кредит a: модификация работы Скотта Бауэра; кредит b: модификация работы Brücke-Osteuropa/Wikimedia Commons) Основание представляет собой вещество, которое растворяется в воде с образованием гидроксид-ионов, ОН − . Наиболее распространенными основаниями являются ионные соединения, состоящие из катионов щелочных или щелочноземельных металлов (группы 1 и 2) в сочетании с ионом гидроксида, например NaOH и Ca(OH) 2 . Когда эти соединения растворяются в воде, ионы гидроксида высвобождаются непосредственно в раствор. Например, KOH и Ba(OH) 2 растворяются в воде и полностью диссоциируют с образованием катионов (K + и Ba 2+ соответственно) и ионов гидроксида OH — . Эти основания, наряду с другими гидроксидами, полностью диссоциирующими в воде, считаются 9{-}(aq)[/latex]
Когда эти соединения растворяются в воде, ионы гидроксида высвобождаются непосредственно в раствор. Например, KOH и Ba(OH) 2 растворяются в воде и полностью диссоциируют с образованием катионов (K + и Ba 2+ соответственно) и ионов гидроксида OH — . Эти основания, наряду с другими гидроксидами, полностью диссоциирующими в воде, считаются 9{-}(aq)[/latex]
Это уравнение подтверждает, что гидроксид натрия является основанием. При растворении в воде NaOH диссоциирует с образованием ионов Na + и OH — . Это также верно для любого другого ионного соединения, содержащего ионы гидроксида. Поскольку процесс диссоциации практически завершен, когда ионные соединения растворяются в воде в типичных условиях, NaOH и другие ионные гидроксиды классифицируются как сильные основания.
В отличие от ионных гидроксидов, некоторые соединения образуют гидроксид-ионы при растворении в результате химической реакции с молекулами воды. {-}(водн.)[/latex]
{-}(водн.)[/latex]
В типичных условиях только около 1% растворенного аммиака присутствует в виде ионов NH 4 + .
Рисунок 3. Аммиак является слабым основанием, используемым в различных областях. (а) Чистый аммиак обычно применяется в качестве сельскохозяйственного удобрения. (b) Разбавленные растворы аммиака являются эффективными бытовыми чистящими средствами. (кредит a: модификация работы Национальной службы охраны ресурсов; кредит b: модификация работы pat00139)Кислотно-основные реакции
Кислотно-щелочная реакция — это реакция, в которой ион водорода H + переносится от одного химического соединения к другому. Такие реакции имеют центральное значение для многочисленных природных и технологических процессов, начиная от химических превращений, происходящих в клетках, в озерах и океанах, и заканчивая промышленным производством удобрений, фармацевтических препаратов и других веществ, необходимых обществу. Поэтому предмет кислотно-щелочной химии заслуживает тщательного обсуждения.
Поэтому предмет кислотно-щелочной химии заслуживает тщательного обсуждения.
Реакция между кислотой и основанием называется кислотно-основной реакцией или реакцией нейтрализации . Хотя кислоты и основания имеют свой собственный уникальный химический состав, кислота и основание нейтрализуют химический состав друг друга, образуя довольно безобидное вещество — воду. Фактически, общая кислотно-щелочная реакция представляет собой
кислота + основание [латекс]\longrightarrow[/latex] вода + соль
, где термин соль используется для определения любого ионного соединения (растворимого или нерастворимого). ), который образуется в результате реакции между кислотой и основанием. В химии слово соль относится не только к поваренной соли. Например, сбалансированное химическое уравнение для реакции между HCl(водн.) и KOH(водн.) имеет вид
HCl(водн.) + KOH(водн.) [латекс]\longrightarrow[/латекс] H 2 O(л) + KCl(водн. )
)
, где солью является KCl. Подсчитав количество атомов каждого элемента, мы находим, что в качестве продукта образуется только одна молекула воды. Однако в реакции между HCl(водн.) и Mg(OH) 2 (водн.) для баланса химического уравнения требуются дополнительные молекулы HCl и H 2 O:
2 HCl(водн.) + Mg(OH) 2 (водн.) [латекс]\longrightarrow[/латекс] 2 H 2 O(л) + MgCl 2 (водн.)
Здесь соль представляет собой MgCl 2 . Это одна из нескольких реакций, которые происходят, когда тип антацида — основание — используется для лечения желудочной кислоты.
Существуют кислотно-основные реакции, которые не подчиняются приведенному выше «общему кислотно-основному уравнению». Например, сбалансированное химическое уравнение для реакции между HCl (водн.) и NH 3 (водн.) равно 9.0003
HCl(водн.) + NH 3 (водн.) [латекс]\longrightarrow[/латекс] NH 4 Cl(водн.)
Пример 1
Напишите реакции нейтрализации каждой кислоты и основания.
A) HNO 3 (AQ) и BA (OH) 2 (AQ) B) H 3 PO 4 (AQ) и CA (OH) 2 (AQ)
Решение
Сначала мы напишем химическое уравнение с формулами реагентов и ожидаемых продуктов; тогда мы сбалансируем уравнение.
a) Ожидаемыми продуктами являются вода и нитрат бария, поэтому начальная химическая реакция будет следующей: 2 O(ℓ) + Ba(NO 3 ) 2 (водный)
Чтобы сбалансировать уравнение, нам нужно понять, что будет две молекулы H 2 O, поэтому две молекулы HNO 3 требуются:
2HNO 3 (водн.) + Ba(OH) 2 (водн.) [латекс]\longrightarrow[/латекс] 2H 2 O(ℓ) + Ba(NO 3 ) 2 (водн.)
Это химическое уравнение теперь сбалансировано.
b) Ожидаемыми продуктами являются вода и фосфат кальция, поэтому исходное химическое уравнение имеет вид латекс] H 2 O(ℓ) + Ca 3 (PO 4 ) 2 (s)
Согласно правилам растворимости Ca 3 (PO 3 4 )0044 нерастворим, поэтому он имеет метку фазы (s). Чтобы сбалансировать это уравнение, нам нужны два иона фосфата и три иона кальция; мы получаем шесть молекул воды, чтобы сбалансировать уравнение:
Чтобы сбалансировать это уравнение, нам нужны два иона фосфата и три иона кальция; мы получаем шесть молекул воды, чтобы сбалансировать уравнение:
2 H 3 PO 4 (водн.) + 3 Ca(OH) 2 (водн.) [латекс]\longrightarrow[/латекс]6 H 2 O(ℓ) + Ca 3 (PO 4 ) 2 (s)
Это химическое уравнение теперь сбалансировано.
Проверь себя
Напишите реакцию нейтрализации между H 2 SO 4 (водн.) и Sr(OH) 2 (водн.).
Ответ
H 2 SO 4 (AQ) +SR (OH) 2 (AQ) [Latex] \ LongrightRow [/latex] 2 H 2 4444. ) + SrSO 4 (водн.)
Реакции нейтрализации представляют собой один из типов химических реакций, которые протекают, даже если один реагент не находится в водной фазе. Например, химическая реакция между HCl(aq) и Fe(OH) 3 (т) по-прежнему протекает по уравнению 3 (водн.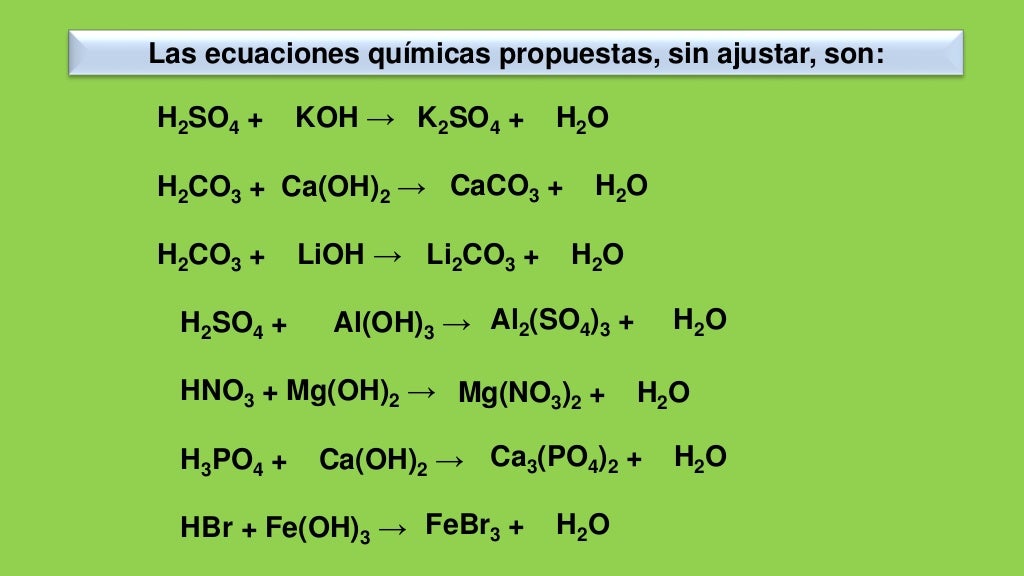 )
)
, хотя Fe(OH) 3 не растворяется. Когда известно, что Fe(OH) 3 (s) является компонентом ржавчины, это объясняет, почему некоторые чистящие растворы для пятен ржавчины содержат кислоты — в результате реакции нейтрализации образуются растворимые и смываемые продукты. Одним из способов удаления ржавчины и пятен ржавчины является промывка кислотами, такими как HCl, но HCl следует использовать с осторожностью!
Полные и суммарные ионные реакции для реакций нейтрализации будут зависеть от того, растворимы ли реагенты и продукты, даже если кислота и основание реагируют. Например, в реакции HCl(водн.) и NaOH(водн.)
HCl(водн.) + NaOH(водн.) [латекс]\longrightarrow[/латекс]H 2 O(л) + NaCl(водн.)
полная ионная реакция
H + (водн.) + Cl — (водн.) + Na + (водн.) + OH — (водн.) [латекс]\longrightarrow[/latex]H 2 O(ℓ) + Na + (водн.) + Cl − (водн. )
)
Ионы Na + (водн.) и Cl − (водн.) они имеют
H + (водн.) + OH — (водн.) [латекс]\longrightarrow[/латекс] H 2 O(ℓ)
в качестве результирующего ионного уравнения. Если бы мы хотели записать это с точки зрения иона гидроксония, H 3 O + (водн.), мы бы написали это как
H 3 O + (водн.) + OH − (водн.) [латекс]\longrightarrow[/латекс] 2H 2 O(ℓ)
За исключением введения дополнительной молекулы воды, эти два суммарных ионных уравнения эквивалентны.
Исследуйте микроскопическое представление сильных и слабых кислот и оснований.
Газообразующие кислотно-основные реакции
Движущей силой некоторых кислотно-щелочных реакций является образование газа. Обычно образуются газы H 2 , O 2 и CO 9 .0043 2 .
Например:
2HCl(водн.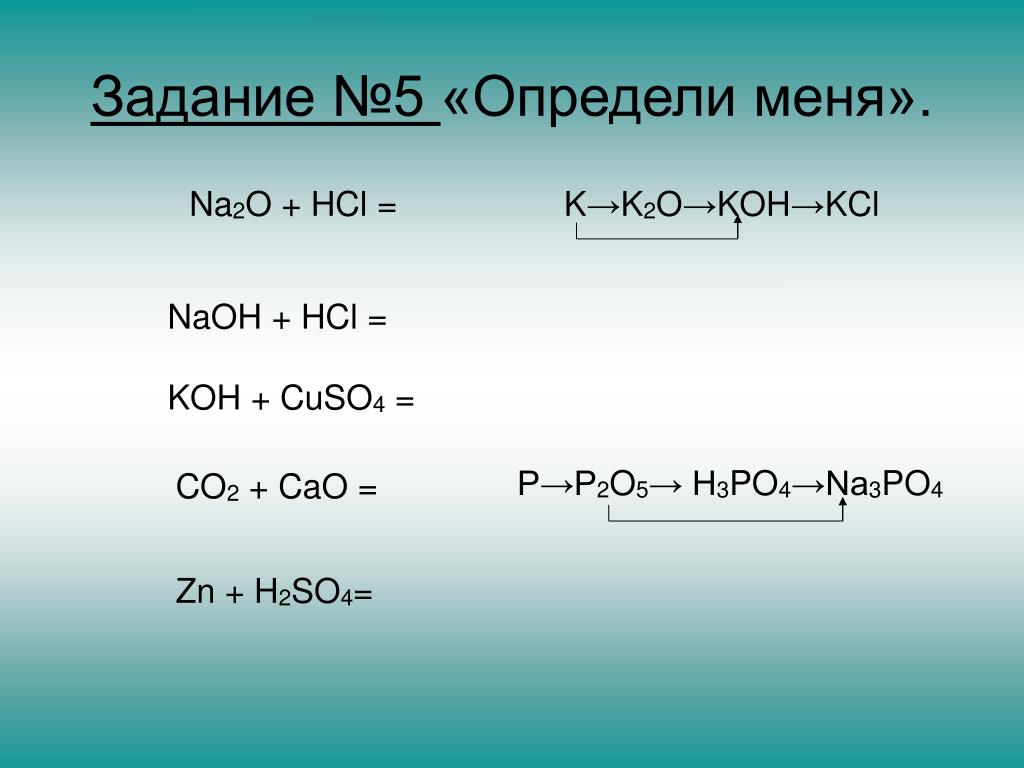 ) + Na 2 CO 3 (водн.) [латекс]\longrightarrow[/латекс] H 2 CO 3 (водн.) + 2NaCl(водн.) [латекс]\longrightarrow[/латекс ] CO 2 (г) + H 2 O(ж) + 2NaCl(водн.)
) + Na 2 CO 3 (водн.) [латекс]\longrightarrow[/латекс] H 2 CO 3 (водн.) + 2NaCl(водн.) [латекс]\longrightarrow[/латекс ] CO 2 (г) + H 2 O(ж) + 2NaCl(водн.)
Приведенный выше пример можно рассматривать как кислотно-щелочную реакцию с последующим разложением. Движущей силой в этом случае является газообразование. Разложение H 2 CO 3 на CO 2 и H 2 O — очень распространенная реакция. И Na 2 CO 3 , и NaHCO 3 в смеси с кислотой приводят к газообразующей кислотно-основной реакции.
HCl(водн.) + NaHCO 3 (водн.) [латекс]\longrightarrow[/латекс] H 2 CO 3 (водн.) + NaCl(водн.) [латекс]\longrightarrow[/латекс] CO 2 (г) + H 2 O(ж) + NaCl(водн.)
Приложение Food and Drink: Acids in Foods
Многие продукты и напитки содержат кислоты. Кислоты придают кислый вкус пищевым продуктам, что может сделать их более приятными. Например, апельсиновый сок содержит лимонную кислоту, H 3 С 6 Н 5 О 7 . Обратите внимание, как эта формула показывает атомы водорода в двух местах; первые записанные атомы водорода — это атомы водорода, которые могут образовывать ионы H + , а вторые написанные атомы водорода являются частью цитрат-иона, C 6 H 5 O 7 3− . Лимоны и лаймы содержат гораздо больше лимонной кислоты — примерно в 60 раз больше, — поэтому эти цитрусовые более кислые, чем большинство апельсинов. Уксус представляет собой примерно 5% раствор уксусной кислоты (HC 2 H 3 O 2 ) в воде. Яблоки содержат яблочную кислоту (H 2 C 4 H 4 O 5 ; название яблочная кислота происходит от ботанического названия рода яблок, malus ), а молочная кислота (4HC 3904 5 O 3 ) содержится в вине и кисломолочных продуктах, таких как йогурт и некоторые твороги.
Например, апельсиновый сок содержит лимонную кислоту, H 3 С 6 Н 5 О 7 . Обратите внимание, как эта формула показывает атомы водорода в двух местах; первые записанные атомы водорода — это атомы водорода, которые могут образовывать ионы H + , а вторые написанные атомы водорода являются частью цитрат-иона, C 6 H 5 O 7 3− . Лимоны и лаймы содержат гораздо больше лимонной кислоты — примерно в 60 раз больше, — поэтому эти цитрусовые более кислые, чем большинство апельсинов. Уксус представляет собой примерно 5% раствор уксусной кислоты (HC 2 H 3 O 2 ) в воде. Яблоки содержат яблочную кислоту (H 2 C 4 H 4 O 5 ; название яблочная кислота происходит от ботанического названия рода яблок, malus ), а молочная кислота (4HC 3904 5 O 3 ) содержится в вине и кисломолочных продуктах, таких как йогурт и некоторые твороги.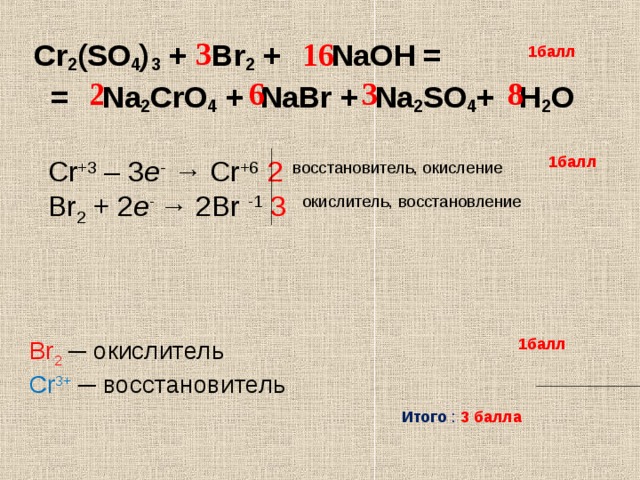
В Таблице 3 «Различные кислоты, содержащиеся в продуктах питания и напитках» перечислены некоторые кислоты, содержащиеся в пищевых продуктах либо в естественном виде, либо в виде добавок. Часто в качестве добавок используются соли кислотных анионов, такие как глутамат натрия (MSG), который представляет собой натриевую соль, полученную из глутаминовой кислоты. Читая список, вы должны прийти к неизбежному выводу, что избежать кислот в еде и напитках невозможно.
| Название кислоты | Кислотная формула | Использование и внешний вид |
|---|---|---|
| уксусная кислота | HC 2 H 3 O 2 | ароматизатор; найдено в уксусе |
| адипиновая кислота | Н 2 С 6 Н 8 О 4 | ароматизатор; содержится в обработанных пищевых продуктах и некоторых антацидах |
| альгиновая кислота | различные | загуститель; содержится в напитках, мороженом и продуктах для похудения |
| аскорбиновая кислота | HC 6 H 7 O 6 | антиоксидант, также известный как витамин С; содержится во фруктах и овощах |
| бензойная кислота | HC 6 H 5 CO 2 | консервант; содержится в обработанных пищевых продуктах |
| лимонная кислота | Н 3 С 6 Н 5 О 7 | ароматизатор; содержится в цитрусовых |
| дегидроуксусная кислота | HC 8 H 7 O 4 | консервант, особенно для клубники и тыквы |
| эритробиновая кислота | HC 6 H 7 O 6 | антиоксидант; содержится в обработанных пищевых продуктах |
| жирные кислоты | разные | загуститель и эмульгатор; содержится в обработанных пищевых продуктах |
| фумаровая кислота | Н 2 С 4 Н 2 О 4 | ароматизатор; кислотный реагент в некоторых разрыхлителях |
| глутаминовая кислота | H 2 C 5 H 7 НЕТ 4 | ароматизатор; содержится в обработанных пищевых продуктах и помидорах, некоторых сырах и соевых продуктах |
| молочная кислота | HC 3 H 5 O 3 | ароматизатор; содержится в вине, йогурте, твороге и других кисломолочных продуктах |
| яблочная кислота | Н 2 С 4 Н 4 О 5 | ароматизатор; содержится в яблоках и незрелых фруктах |
| фосфорная кислота | H 3 Заказ на покупку 4 | ароматизатор; встречается в некоторых колах |
| пропионовая кислота | HC 3 H 5 O 2 | консервант; найдено в выпечке |
| сорбиновая кислота | HC 6 H 7 O 2 | консервант; содержится в обработанных пищевых продуктах |
| стеариновая кислота | HC 18 H 35 O 2 | агент против слеживания; найдено в леденцах |
| янтарная кислота | Н 2 С 4 Н 4 О 4 | ароматизатор; содержится в вине и пиве |
| винная кислота | Н 2 С 4 Н 4 О 6 | ароматизатор; содержится в винограде, бананах и тамариндах |
Таблица 3. Различные кислоты, содержащиеся в продуктах питания и напитках
Различные кислоты, содержащиеся в продуктах питания и напитках
Ключевые понятия и резюме
Химические реакции классифицируются по схожим моделям поведения. Кислотно-основные реакции включают перенос ионов водорода между реагентами.
Общие кислотно-щелочные реакции, также называемые реакциями нейтрализации, можно резюмировать следующим уравнением реакции:
КИСЛОТА(водн.) + ОСНОВАНИЕ(водн.) [латекс]\longrightarrow[/латекс] H 2 O(л) + СОЛЬ(водн.) или (с)
ДВИЖУЩЕЙ СИЛОЙ общей кислотно-щелочной реакции является образование воды.
Газообразующие кислотно-щелочные реакции можно резюмировать следующим уравнением реакции:
КИСЛОТА (водн.) + NaHCO 3 или Na 2 CO 3 (водн.) [латекс]\longrightarrow[/латекс] H 2 O(л) + CO 2 (г) + СОЛЬ (водн.) или (тв)
ДВИЖУЩЕЙ СИЛОЙ газообразующей кислотно-основной реакции является образование газа. Есть три способа
Существует три способа представления реакции нейтрализации с использованием молекулярного уравнения, полного ионного уравнения или результирующего ионного уравнения, как описано в разделе 6.