Концентрация растворов. Правило креста
1 Концентрация растворов и способы ее выражения
2 Задачи на смешение и разбавление растворов
В данном разделе рассмотрены задачи на пересчет концентрации растворов, применение правила креста для нахождения концентрации при смешении и разбавлении растворов. Больше задач на расчет массовой доли растворенного вещества представлены в разделе подготовки к ОГЭ по химии.
Концентрация растворов и способы ее выражения
Задача 1. К 150 г 20% раствора сахарозы добавили 45 г глюкозы. Рассчитайте массовые доли углеводов в новом растворе.
Показать решение »
Решение.
Вначале сахарозы было 30 г:
20 г сахарозы содержится в 100 г раствора
х г — в 150 г
х =30 г
После прибавления глюкозы:
mобщ = m (сахарозы) + m (глюкозы) = 150 + 45 = 195 г
m раствора стала 195 г
Найдем полученные массовые доли сахарозы и глюкозы:
30 г сахарозы содержится в 195 г раствора
х г — в 100 г
х =15,4
ω2 (сахарозы) = 15,4%:
45 г глюкозы содержится в 195 г раствора
х г — в 100 г
х = = 23,1
ω2 (глюкозы) = 23,1%
Задача 2. Для нейтрализации 20 мл 0,1 н раствора кислоты потребовалось 6 мл раствора едкого натра. Определить нормальную концентрацию раствора едкого натра.
Для нейтрализации 20 мл 0,1 н раствора кислоты потребовалось 6 мл раствора едкого натра. Определить нормальную концентрацию раствора едкого натра.
Показать решение »
Решение.
Согласно закону эквивалентов при нейтрализации в точке эквивалентности действует равенство, называемое Золотым правилом аналитики:
СН1×V1 = СН2×V2
0,1×20 = СН2×6
СН2 = 0,3 н.
Задача 3. Нормальная концентрация раствора KNO3 равна 0,2 моль/л. Найти процентную концентрацию раствора KNO3 и молярную концентрацию раствора KNO3. Плотность раствора принять раной 1 г/мл.
Показать решение »
Решение:
Найдем молярную массу и молярную массу эквивалента KNO3.
В данном случае, они совпадают.
М (KNO3) = 39+14+(16×3) = 101 г/моль
Найдем массу KNO3, содержащуюся в его 0,2 н. растворе:
1 н раствор KNO3 содержит – МЭ KNO3 в 1000 мл
Т.е. 1 н – 101 г
0,2 н. – х г
х = 20,2 г
Теперь вычислим молярную концентрацию
1М раствор KNO3 содержит – М KNO3 в 1000 мл
Т.е. 1 М – 101 г
х – 20,2 г
х = 0,2 моль/л
Таким образом, Сн = См = 0,2 моль/л
Далее находим процентную концентрацию.
Сначала необходимо рассчитать массу раствора объемом 1000 мл.
m = ρ×V = 1×1000 = 1000 г
тогда, решая пропорцию, находим:
20,2 г KNO3 содержится – в 1000 г раствора
х г – в 100 г раствора
х = 2,02 г
ω = 2,02%
Задача 4. Вычислите молярную и молярную концентрацию эквивалента (нормальность) 20 % раствора хлорида кальция плотностью 1,178 г/мл.
Вычислите молярную и молярную концентрацию эквивалента (нормальность) 20 % раствора хлорида кальция плотностью 1,178 г/мл.
Показать решение »
Решение.
Найдем массу раствора
mр-ра = V·ρ = 1000 · 1,178 = 1178 г.
Найдем массу CaCl2, содержащуюся в 1178 г. 20 % раствора
20 г CaCl2 содержится в 100 г раствора
х г — в 1178 г раствора
х = 235,6 г.
Молярность определим с помощью соотношения:
См = n/V
n = m/M = 235,6/111 = 2,1 моль
M(CaCl2) = 40+35,5·2 = 111 г/моль
См = 2,1/1 = 2,1 М
Молярная концентрация эквивалента определяется с помощью соотношения:
Сн = nэ/V
Мэ = fэкв· М(CaCl2) = 1/2·111 = 55,5 г/моль
nэ = m/ Мэ = 235,6/55,5 = 4,2 моль
Сн = 4,2/1 = 4,2 н
Задача 5. Чему равна нормальность 30% раствора NaOH плотностью 1,328 г/мл? К 1 л этого раствора прибавили 5 л воды. Вычислите массовую долю полученного раствора.
Чему равна нормальность 30% раствора NaOH плотностью 1,328 г/мл? К 1 л этого раствора прибавили 5 л воды. Вычислите массовую долю полученного раствора.
Показать решение »
Решение.
Найдем массу NaOH, содержащуюся в 1328 г. 30 % раствора используя формулу:
ω(NaOH) = m (NaOH)/m
mр-ра = V·ρ = 1000 · 1,328 = 1328 г.
m(NaOH) = ω(NaOH) · m = 0,3 · 1328 = 398,4 г.
Найдем Молярную концентрацию эквивалента или нормальность:
M(NaOH) = 23+16+1 = 40 г/моль
Сн = nэ/V
Мэ = fэкв· М(NaOH) = 1·40 = 40 г/моль
nэ = m/ Мэ = 398,4/40 = 9,96 моль
Сн = 9,96/1 = 9,96 н
Найдем массу раствора после прибавления 5 л воды:
m2 = 1328 + 5000 = 6328 г
Далее находим процентную концентрацию или массовую долю вещества.
ω2(NaOH) = m (NaOH)/m2 = 398,4/6328 = 0,063 или 6,3 %
Задача 6. К 3 л 10 % раствора HNO3 плотностью 1,054 г/мл прибавили 5 л 2 % раствора той же кислоты плотностью 1,009 г/мл. Вычислите массовую долю в процентах и молярную концентрацию полученного раствора, объем которого равен 8 л.
Показать решение »
Решение.
Найдем массу растворов объемом 3 л и 5 л
m1= V1·ρ = 3000·1,054 = 3162 г
m2= V2·ρ = 5000·1,009 = 5045 г
Найдем массу HNO3, содержащуюся в 3162 г. 10 % раствора
10 г HNO3 содержится в 100 г ее раствора
х1 г — в 3162 г раствора
х1 = 316,2 г
Найдем массу HNO3, содержащуюся в 5045 г. 2 % раствора
2 г HNO3 содержится в 100 г ее раствора
х2 г — в 5045 г раствора
х2 = 100,9 г
При смешивании:
m (HNO3) = 316,2+100,9 = 417,1 г
mр-ра (HNO3) = 3162+5045 = 8207 г
Найдем Молярность
См = n/V
n = m/M = 417,1/63 = 6,62 моль
M(HNO3) = 1+14+16·3 = 63 г/моль
См= 6,62/1 = 6,62 М
ω(HNO3) = m (HNO3)/mр-ра = 417,1/8207 = 0,05 или 5 %
Задача 7. Определить молярность, нормальность, моляльность и титр 4 % раствора FeSO4 объем которого равен 1,5 л, плотность 1037 кг/м3
Определить молярность, нормальность, моляльность и титр 4 % раствора FeSO4 объем которого равен 1,5 л, плотность 1037 кг/м3
Показать решение »
Решение.
M (FeSO4) = 56+32+16·4 = 152 г/моль
Мэ = fэкв· М(FeSO4) = 1/2·152 = 76 г/моль
Найдем m раствора объемом 1,5 л
m = V·ρ = 1,5·10-3 ·1037 = 1,56 кг
Найдем m 4 % раствора
m(FeSO4) = ω(FeSO4) · mр-ра = 0,04·1,56 = 0,0624 кг = 62,4 г
Найдем молярность, которая определяется как количество молей растворенного вещества в одном литре раствора
n = m/М = 62,4/152 = 0,41 моль
См = n/V = 0,41/1,5 = 0,274 М
Найдем нормальность:
nэ = m/Мэ = 62,4/76 = 0,82 моль
Сн = nэ/V = 0,82/1,5 = 0,547 н
Моляльная концентрация равна:
b (x) = n(x)/m
Масса растворителя равна: mH2O = 1560-62,4 = 1497,6 г = 1,5 кг
b (FeSO4) = n(FeSO4)/m = 0,41/1,5 = 0,27 моль/кг
Титр определим следующим образом:
Т (х) = m (х)/V
Т (FeSO4) = m (FeSO4)/V = 62,4/1500 = 0,0416 г/мл
Задачи на смешение и разбавление растворов
Такие задачи можно решить с помощью правила креста или правила смешения. Суть его заключается в составлении «креста», в виде которого располагают две прямые линии. В центре пишут ту концентрацию, которую надо получить, у концов линий креста слева – концентрации исходных растворов (большую – сверху, меньшую — снизу), у концов линий креста справа – искомые концентрации (или массы) растворов, которые получают вычитанием по направлению линий из большей величины меньшей. В общем виде схема решения задач по правилу креста имеет вид:
Суть его заключается в составлении «креста», в виде которого располагают две прямые линии. В центре пишут ту концентрацию, которую надо получить, у концов линий креста слева – концентрации исходных растворов (большую – сверху, меньшую — снизу), у концов линий креста справа – искомые концентрации (или массы) растворов, которые получают вычитанием по направлению линий из большей величины меньшей. В общем виде схема решения задач по правилу креста имеет вид:
Таким образом, следует взять mА грамм раствора с массовой долей а% и прибавить к нему mB грамм раствора с массовой долей b%. Если надо узнать, какие массы растворов данной концентрации следует взять, чтобы получить заданную массу раствора новой концентрации, то сначала определяют отношение mА и mB . Затем пропорционально этому отношению делят заданную массу.
Задача 8. Сколько граммов раствора с массовой долей серной кислоты 96% необходимо влить в 1 л воды, чтобы получить раствор с массовой долей 10%
Показать решение »
Решение.
Для решения данной задачи используем правило креста.
Чистый растворитель (воду) можно представить как раствор с массовой долей растворенного вещества 0%
Определим m раствора с ω (H2SO4) = 96%, который надо влить в 1 л воды:
10 г H2SO4 надо влить в 86 г воды
х г — 1000 г
х = 116,28 г
m (р-ра H2SO4) = 116,28 г
Задача 9. Сколько мл 0,5 М и 0,1 М растворов азотной кислоты следует взять для приготовления 1000 мл 0,2 М раствора.
Показать решение »
Решение.
По правилу креста, определяем в каких соотношениях следует взять 0,5 М и 0,1 М растворы азотной кислоты, чтобы получить раствор заданной концентрации:
V0.5/V0.1 = 0,1/0,3 = 1/3
Взяв 0,1 л и 0,3 л исходных растворов, получим 0,4 л 0,2 М раствора HNO3, но по условию задачи нужно получить 1 л. Для этого разделим 1 л на две части в соотношении 1:3, составив пропорции:
Для этого разделим 1 л на две части в соотношении 1:3, составив пропорции:
Для 0,5 М раствора HNO3
из 0,1 л 0,5 М раствора получим 0,4 л 0,2 М р-ра HNO3
х1 л — 1 л
х1 = 0,25 л
Для 0,1 М раствора HNO3
из 0,3 л 0,5 М раствора получим 0,4 л 0,2 М р-ра HNO3
х2 л — 1 л
х2 = 0,75 л
Категории ОБЩАЯ ХИМИЯ, РастворыРазработка урока по химии на тему: «Решение задач на молярную концентрацию»
Оценочный лист
_____________________________________________________
№1 | №2 | №3 | №4 | №5 | №6 | Итог | Оценка | ||
1 | «Собрать колбу» | ||||||||
2 | «Восстанови последовательность» |
Оценочный лист
_____________________________________________________
№1 | №2 | №3 | №4 | №5 | №6 | Итог | Оценка | ||
1 | «Собрать колбу» | ||||||||
2 | «Восстанови последовательность» |
Оценочный лист
_____________________________________________________
№1 | №2 | №3 | №4 | №5 | №6 | Итог | Оценка | ||
1 | «Собрать колбу» | ||||||||
2 | «Восстанови последовательность» |
Оценочный лист
_____________________________________________________
№1 | №2 | №3 | №4 | №5 | №6 | Итог | Оценка | ||
1 | «Собрать колбу» | ||||||||
2 | «Восстанови последовательность» |
Оценочный лист
_____________________________________________________
№1 | №2 | №3 | №4 | №5 | №6 | Итог | Оценка | ||
1 | «Собрать колбу» | ||||||||
2 | «Восстанови последовательность» |
Оценочный лист
_____________________________________________________
№1 | №2 | №3 | №4 | №5 | №6 | Итог | Оценка | ||
1 | «Собрать колбу» | ||||||||
2 | «Восстанови последовательность» |
Класс – 10 (химия)
Проверено _____________
Дата: 25. 11.15г.
11.15г.
Урок № 22
Тема урока: Решение расчетных задач на вычисление процентной и молярной концентрации растворов.
Цель: развитие знаний учащихся о решение расчетных задач на вычисление процентной и молярной концентрации растворов.
Образовательные задачи: учить решать расчетные задачи с использованием понятия «растворы», «концентрация растворов», применять полученные знания на практике, закрепить знания о физических характеристиках растворов и растворенных веществ, умения рассчитывать молярные массы веществ, проверить способность к самостоятельной деятельности.
Развивающие задачи: развивать логическое мышление, наблюдательность, способность к анализу и синтезу, коммуникативные навыки работы в группе, формировать навыки самоконтроля. Стимулировать познавательную деятельность
Воспитательные задачи: способствовать формированию ответственного отношения к учению, готовности к мобилизации усилий и безошибочное выполнение заданий, проявить наибольшую активность в их выполнении; воспитывать культуру учебного труда, навыки экономного расходования времени, формировать гуманные качества личности учащихся, совершенствовать навыки общения.
Методы: информативно-прикладной с элементами фронтальной беседы, фронтальная беседа, решение химических задач.
Тип урока : решение задач.
Оборудование: учебник, интерактивная доска, раздаточный материал, таблица Менделеева.
Ход урока.
Организационный момент:
Приветствие.
Целеполагание.
Психологический настрой.
Опрос в виде интеллектуального тренинга.
Чем является вода для многих твердых, жидких и газообразных веществ? растворителем
Какие признаки растворов вы знаете? Однородность и прозрачность
Что образует вода со многими веществами? Растворы
Основные характеристики растворов…..(слайд)
Какое понятие существует в химии между растворимым веществом и растворителем? Концентрация растворов
3. Изучение нового материала и решение задач.
Изучение нового материала и решение задач.
Ученик решает задачу у доски.
Условие: 30 г нитрата калия добавили в 170 г воды. Определите процентную концентрацию полученного раствора.
Задача №1.
В растворе объемом 700 мл содержится хлорид
магния массой 9,5 г. Определите молярную концентрацию растворенного вещества.
Дано: Решение:
V = 700млили 0,7л М (МgСl2 ) = 24 + 35,5*2 =
m (МgСl2 ) = 9,5 г 95г/моль
m 9,5г
См =-—— = ———- = 0, 143 моль/л, или 0,143М
М*V 95г/моль*0,7
Ответ: См (МgСl2 ) = 0, 143 моль/л, или 0,143М
Работа в группах.
«Собрать колбу»
Задача №1. 10 г нитрата калия добавили в 80 г воды. Определите процентную концентрацию полученного раствора. (11%)
10 г нитрата калия добавили в 80 г воды. Определите процентную концентрацию полученного раствора. (11%)
Задача №2. Рассчитайте массу сахара и обьем воды которые нужно взять для приготовления 600 г сиропа с массовой долей сахара в нем 10%. (60г, 540г)
Задача №3. Вычислите массу раствора NaCl с массовой долей NaCl 3% и плотностью 1,02г/мл, если обьем раствора 600мл. (1836)
Задача №4. Вычислите массу раствора NaОН с массовой долей NaОН 5% и плотностью 2,01 г/мл, если обьем раствора 800мл. (8040)
Задача №5. В 500 мл воды растворили 15,46г гидроксида натрия. Определите массовую долю гидроксида натрия в полученном растворе. (3%)
Задача №6. К 80 граммам раствора соли прибавили 40 г воды. Вычислите массовую долю соли в исходном растворе, если после разбавления, она стала равной 18%. (27%)
(27%)
«Восстановить последовательность»
Задача №1. Вычислите молярную концентрацию азотной кислоты, если в растворе объёмом 2л содержится 12,6 г вещества. (0,1М)
Задача №2. Определите массу растворенного вещества, содержащегося в растворе объемом 500 мл с молярной концентрацией КОН 0,1 моль/л. (2800г)
Задача №3. Определите массу растворенного вещества, содержащегося в растворе объемом 200мл с концентрацией NН4 NО3 0,025 моль/л. (400г)
Задача №4. Вычислите молярную концентрацию гидроксида натрия, если в растворе объёмом 8,6л содержится 18,5 г вещества. (0,05 М)
Задача №5. Определите массу растворенного вещества, содержащегося в растворе объемом 300 мл с молярной концентрацией NН4Сl 0,01 моль/л. (160,5 г)
Рефлексия.

1.Какова цель нашего урока?
2.Достигли ли мы цели?
3.Что представляло наибольшую трудность?
4. На уроке я работал…
5.Своей работой на уроке я…
6.Урок для меня показался…
7. Материал урока мне был…
8. Мое настроение…
Выводы . Оценивание.
Домашнее задание: Решение задач на карточках.
1.Какова цель нашего урока?___________________________________
__________________________________________________________
2.Достигли ли мы цели?_____________________________________
3.Что представляло наибольшую трудность?___________________
__________________________________________________________
4. На уроке я работал…______________________________________
На уроке я работал…______________________________________
5.Своей работой на уроке я…__________________________________
6.Урок для меня показался…__________________________________
7. Материал урока мне был…_________________________________
8. Мое настроение…__________________________________________
1.Какова цель нашего урока?___________________________________
__________________________________________________________
2.Достигли ли мы цели?_____________________________________
3.Что представляло наибольшую трудность?___________________
__________________________________________________________
4. На уроке я работал…______________________________________
5.Своей работой на уроке я…__________________________________
6. Урок для меня показался…__________________________________
Урок для меня показался…__________________________________
7. Материал урока мне был…_________________________________
8. Мое настроение…__________________________________________
1.Какова цель нашего урока?___________________________________
__________________________________________________________
2.Достигли ли мы цели?_____________________________________
3.Что представляло наибольшую трудность?___________________
__________________________________________________________
4. На уроке я работал…______________________________________
5.Своей работой на уроке я…__________________________________
6.Урок для меня показался…__________________________________
7. Материал урока мне был…_________________________________
8. Мое настроение…__________________________________________
Мое настроение…__________________________________________
Задачи по растворам
Способы выражения состава ( концентрации) растворов
Содержание растворенного вещества в растворе может быть выражено либо безразмерными единицами – долями или процентами, либо величинами размерными – концентрациями.
В системе СИ единицей массы является кг, количества вещества – моль, объема – куб. м.
Молярная масса имеет размерность г/моль и числена равна . Количественная характеристика
— моль. Различают моль молекул, атомов или ионов. Количества моль молекуь рассчитывают по формуле:
Известно несколько способов выражения концентрации растворов.
Массовая доля – масса вещества в 1 г или 100 г раствора.
где — масса вещества, -масса раствора
Молярная концентрация (–отношение количества
где n-число
молей вещества; m-масса
вещества, г; М-молярная масса вещества.
Молярную концентрацию выражают в Вместо обозначений или моль/л допускается обозначение М.
Моляльная концентрация ()–количество молей вещества в 1 кг растворителя..
где — масса растворителя
Молярная концентрация эквивалента –отношение массы вещества (в молярных массах эквивалента), содержащейся в системе, к объему V этой системы.
Молярных массах эквивалента вещества (моль) – это масса 1 моль эквивалента вещества, равная произведению фактора эквивалентности () на молярную массу вещества В.
-фактор эквивалентности вещества В
Молярная концентрация эквивалента выражают в , принято называть нормальностью Допускают обозначение «н».
Фактор
эквивалентности ()–
безразмерная величина- число, обозначающее,
какая доля реальной частицы вещества
x
эквивалентна одному электрону в данной
кислотно-основной реакции или одному
электрону в данной ОВР. Для реакции Одна частица А эквивалентна b/a
частицам вещества B.
.
Для реакции Одна частица А эквивалентна b/a
частицам вещества B.
.
Фактор эквивалентности имеет вид меньше единицы.
Например, для реакции
Между и существует зависимость
Молярная концентрация в 1/f раз меньше молярной концентрации эквивалента
Молярная доля компонента в растворе
При взаимодействии растворов, концентрация которых выражена как нормальность, расчеты производят по выражению
1.Какой объем 0,3 н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 см3?
Решение. Так как вещества взаимодействуют между
собой в эквивалентных соотношениях, то
растворы равной нормальности реагируют
в равных объемах. При разных нормальностях
объемы растворов реагирующих веществ
обратно пропорциональны их нормальностям,
т.е. V1CН1 =V2CН2
.
При разных нормальностях
объемы растворов реагирующих веществ
обратно пропорциональны их нормальностям,
т.е. V1CН1 =V2CН2
.
Нормальность раствора NaOH рассчитываем по формуле:
Из выражения
Ответ: 26,7 см.
2.Вычислите эквивалентную и моляльную концентрации 20,8%-ного раствора плотностью 1,12 г/. Сколько граммов кислоты содержится в 4 л этого раствора?
Решение. Массовая доля в процентах показывает количество граммов растворенного вещества в 100 г раствора. Следовательно, в 100 г раствора содержится 20,8 г .
Масса растворителя в этом растворе составляет 100-20,8=79,2 г. Мольная масса равна 63 г/моль. Моляльную концентрацию раствора находим из формулы:
Эквивалентная
масса
=М/1=63,0/1=63,0
г/моль, объем 100 г раствора находим из
формулы
мл
или 0,08929 л.
Эквивалентная концентрация или нормальность показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора, то из формулы
н.
В 4 л этого раствора содержится:
г кислоты.
3. На нейтрализацию 31 см3 0,16 н. раствора щелочи требуется 217 см3 раствора Н2SO4. Чему равны нормальность и титр раствора Н2SO4?
Решение. Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной нормальности реагируют в равных объемах. При разных нормальностях объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е.
V1CН1 =V2CН2 31*0,16=217 CН2,
откуда CН2=31*0,16/217=0,02286
н.
Т=Сн mЭ/1000, откуда Т=0,02286*49/1000=0,001120 г/см3.
Ответ: 0,023 н.; 1,12*10-3 г/см3.
4. Растворимость гидрофосфата аммония в воде при 20С 69г. Вычислить массовую долю и молярную концентрацию этого раствора, если =1,21 г/мл.
Решение. Растворимость вещества измеряется содержанием вещества в его насыщенном растворе.
Коэффициент растворимости – масса вещества растворяющегося при данных условиях в 100 г растворителя с образованием насыщенного раствора. при данной температуре.
Массовая доля – масса вещества в 1 г или 100 г раствора.
где — масса вещества, -масса раствора
Молярная концентрация (–отношение количества вещества В (моль), содержащегося в системе, к объему V этой системы:
где n-число молей вещества; m-масса вещества, г; М-молярная масса вещества.
Молярную концентрацию выражают в Вместо обозначений или моль/л допускается обозначение М.
Из условий задачи и определения растворимости масса вещества =69 г, масса растворителя =100 г, масса раствора =100+69=169 г. Массовую долю раствора рассчитываем по уравнению: =.
Молярная масса гидрофосфата аммония равна (14+4)х2+1+31+(16х4)=134 г/моль. Объем раствора или 0,13967 л. Из выражения
Ответ: 40,83%; 3,68 моль/л
5.Вычислите эквивалентную и моляльную концентрации 20,8%-ного раствора плотностью 1,12 г/. Сколько граммов кислоты содержится в
4 л этого раствора?
Сколько граммов кислоты содержится в
4 л этого раствора?Решение. Массовая доля в процентах показывает количество граммов растворенного вещества в 100 г раствора. Следовательно, в 100 г раствора содержится 20,8 г .
Масса растворителя в этом растворе составляет 100-20,8=79,2 г. Мольная масса равна 63 г/моль. Моляльную концентрацию раствора находим из формулы:
Эквивалентная масса =М/1=63,0/1=63,0 г/моль, объем 100 г раствора находим из формулы мл или 0,08929 л.
Эквивалентная концентрация или нормальность показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора, то из формулы
н.
В 4 л этого раствора содержится:
г кислоты.
Задача. Рассчитать массовую долю раствора, содержащего 50 г хлорида кальция и 250 г воды.
Задача. В
150 г воды растворено 30 г кристаллогидрата
.
Вычислить массовую долю кристаллогидрата
и безводного сульфата железа (II)
в растворе.
В
150 г воды растворено 30 г кристаллогидрата
.
Вычислить массовую долю кристаллогидрата
и безводного сульфата железа (II)
в растворе.
Решение. или 16,7%
Молярная масса . Равна 278 г/моль, а — 152 г/моль. В 30 г кристаллогидрата содержится 16,4 г безводной соли. Тогда
Задача. При насыщенный раствор содержит 52,4% соли. Найти коэффициент растворимости соли при этой температуре.
Решение. Коэффициент растворимости находим из пропорции:
На 47,6 г воды приходится 52,4 г.
На 100 г « Х г
Таким образом, растворимость при равна 110 г в 100 г воды.
Задача. Вычислить моляльность, нормальность и молярность 15%-ного раствора (по массе) серной кислоты, если г/мл.
Решение. Для расчета используем 100 г раствора,
который содержит 15 г серной кислоты.
объем раствора в литрах.
Моляльную конц. рассчитываем по формуле
Нормальность раствора рассчитываем по формуле
Молярную долю рассчитываем по выражению
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
При упаривании раствора хлорида натрия массой 500г с массовой долей соли 1% получен новый раствор массой 150г. Вычислите массовую долю и молярную долю соли в новом растворе.
Вычислите рН 3,8% раствора HCl (=1,017 г/мл).Какой объем 2М раствора гидроксида калия потребуется для нейтрализации 10мл указанного раствора HCl.
Вычислите рН, молярную, моляльную и моль-эквивалентную концентрации 20% раствора серной кислоты плотностью 1,12 г/мл.

Сколько воды надо добавить к раствору массой 3кг и с массовой долей соли 20% для получения раствора с массовой долей 15%?
Вычислите молярную, моляльную концентраци и молярную долю гидроксида натрия в растворе, содержащем 12 г гидроксида натрия в 50 г воды (р-ра = 1,2 г/мл).
Сколько воды необходимо прибавить к 80 мл 20%-го раствора хлорида натрия (ρ= 1,148 г/мл), чтобы получить 10%- й раствор (=1,07 г/мл)? Вычислите молярную концентрацию последнего.
Вычислите молярность, моляльность и мольную долю вещества в растворе Н3РО4 с массовой долей 30% и плотностью 1,18 г/мл.
Растворимость гидрокарбоната натрия в воде при 25С 24,8г. Вычислите массовую долю и молярную концентрацию этого раствора, если =1,1 г/мл.
Вычислите произведение растворимости PbBr2 при 25C, если растворимость соли при этой температуре равна 1,3210-2 моль/л.

Вычислите массы воды и CaCl26H2O, необходимые для приготовления 500 мл раствора хлористого кальция с массовой долей соли 40% и плотностью 1,4 г/мл. Определите молярную и моляльную концентрацию раствора.
Растворимость сульфата натрия в воде при 25°С 27,9г. Вычислите массовую долю и моляльную концентрацию этого раствора, если r=1,28 г/мл.
Растворимость хлорида натрия при 20°С составляет 35,9г, а при 60С- 37,22г. Вычислите массу осадка, который образуется при охлаждении 500г раствора насыщенного при 60С до 20С.
Вычислите произведение растворимости хромата серебра (Ag2CrO4), если при 18°С в 500мл воды растворяется 0,0166г этой соли.
Вычислите объем концентрированной серной кислоты H2SO4 с плотностью 1,84 г/мл и массовой долей 98% следует взять для получения 800мл раствора с концентрацией 3М?
Сколько воды надо добавить к раствору массой 3кг и с массовой долей соли 20% для получения раствора с массовой долей 5 %?
6.
 Определить
массовую долю вещества в растворе,
полученном смещением 300 г 25%-ного и 400 г
40%-ного (по массе) растворов этого
вещества
Определить
массовую долю вещества в растворе,
полученном смещением 300 г 25%-ного и 400 г
40%-ного (по массе) растворов этого
веществаВычислите молярную, моляльную концентрации и мольную долю нитрата натрия в 10% растворе (= 1,06 г/мл).
4Сколько воды надо добавить к раствору массой 3кг и с массовой долей соли 20% для получения раствора с массовой долей 15%?
Вычислите объем 37% раствора азотной кислоты (=1,23г/мл), необходимый для приготовления 1л 25% (=1,14г/мл).
Вычислите молярную, моляльную, моль-эквивалентную концентрацию 10% раствора серной кислоты с плотностью 1,06 г/мл.
3. Вычислите молярную и моляльную концентрации 20 и 40% растворов этанола в воде, если плотности растворов равны 0,969 и 0,935 г/мл соответственно. Плотность этанола равна 0,789 г/мл.
Вычислите объем воды, который необходимо прибавить к 10 мл 20%-го раствора хлорида натрия (ρ= 1,152 г/мл), чтобы получить 4%-й раствор?
Растворимость сульфата натрия в воде при 25°С 27,9г.
 Вычислите массовую долю и моляльную
концентрацию этого раствора, если
r=1,28 г/мл.
Вычислите массовую долю и моляльную
концентрацию этого раствора, если
r=1,28 г/мл.Вычислите молярную, моляльную, моль-эквивалентную концентрацию 15% раствора фосфорной кислоты с плотностью 1,085 г/мл.
При упаривании раствора хлорида натрия массой 500г с массовой долей соли 1% получен новый раствор массой 150г. Вычислите массовую долю и молярную долю соли в новом растворе.
Вычислите массы воды и CaCl26H2O, необходимые для приготовления 500 мл раствора хлористого кальция с массовой долей соли 40% и плотностью 1,4 г/мл. Определите молярную и моляльную концентрацию раствора.
Вычислите молярность, моляльность и мольную долю вещества в растворе Н3РО4 с массовой долей 30% и плотностью 1,18 г/мл.
4. Вычислите молярную и моляльную концентрации 10% раствора ортофосфорной кислоты, если =1,055 г/мл.

4. Вычислите молярную, моляльную концентрации и рН 10% раствора гидроксида натрия плотностью 1,05 г/мл.
3. Вычислите молярную и моляльную концентрацию 20% раствора NH4Cl (=1,057 г/мл). Рассчитать мольную долю соли.
Рассчитайте молярную, моляльную концентрации и рН 10% раствора гидроксида натрия плотностью 1,05 г/мл.
Вычислите объем 37% раствора азотной кислоты (=1,23г/мл), необходимый для приготовления 1л 25% (=1,14г/мл).
Растворимость гидрокарбоната натрия в воде при 25С 24,8г. Вычислите массовую долю и молярную концентрацию этого раствора, если =1,1 г/мл.
Вычислите произведение растворимости PbBr2 при 25C, если растворимость соли при этой температуре равна 1,3210-2 моль/л.
Плотность раствора карбоната калия 1,22 г/мл.
 Из 1
л раствора действием соляной кислоты
выделено 33,6 л СО2.Вычислите
моляльную концентрацию раствора и
мольную долю соли.
Из 1
л раствора действием соляной кислоты
выделено 33,6 л СО2.Вычислите
моляльную концентрацию раствора и
мольную долю соли.Вычислите молярную, моляльную, моль- эквивалентную концентрацию 10% раствора сульфата меди (=1,04 г/мл).
5. Вычислите произведение растворимости хромата серебра (Ag2CrO4), если при 18°С в 500мл воды растворяется 0,0166г этой соли.
Вычислите объем концентрированной серной кислоты H2SO4 с плотностью 1,84 г/мл и массовой долей 98% следует взять для получения 800мл раствора с концентрацией 3М?
6. К 100мл 10% раствора NaCl (r= 1,12 г/мл) прилили 100 мл 0,02 М раствор нитрата серебра. Вычислите концентрацию Cl— и Ag+ в растворе, если ПР(AgCl)= 1,8×10-10.
При упаривании раствора хлорида натрия массой 500г с массовой долей соли 1% получен новый раствор массой 150г.
 Рассчитать массовую
долю и молярную долю соли в новом
растворе.
Рассчитать массовую
долю и молярную долю соли в новом
растворе.Сколько воды необходимо прибавить к 80 мл 20%-го раствора хлорида натрия (ρ= 1,148 г/мл), чтобы получить 10%- й раствор (=1,07 г/мл)? Рассчитайте молярную концентрацию последнего.
7
Примеры решения задач
Задача 1. Определите молярность, нормальность и мольную долю 16,08% раствора H2SO4 (r =1,1 г/см3).
РЕШЕНИЕ. Молярная концентрация (молярность) определяется по формуле , где m=16,08г — масса H2SO4, содержащаяся в 100г раствора (из определения массовой доли).
Объем 100г р-ра V = = » 0,091л.
Следовательно, Cм = =1,8 моль/л .
Нормальность рассчитывается по формуле Сн = , Z = 2
(кислота двухосновная), таким образом. Сн = = 3,6 моль/л.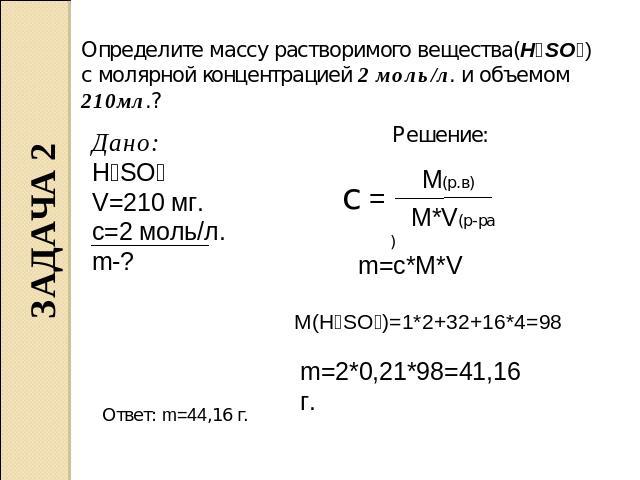
Зная молярную концентрацию и фактор эквивалентности fэкв= , нормальную концентрацию можно рассчитать и по формуле
= = 3,6 моль/л.
Мольная доля определяется по формуле
. = =0,164моль. Масса воды =
= 100 – 16,08 = 83,92 г. =4,662 моль.
Таким образом, =0,034.
Задача 2. Сколько миллилитров 60% раствора СН3СООН (r =1,07 г/см3) потребуется для приготовления 200 мл 0,1М раствора.
РЕШЕНИЕ. Масса уксусной кислоты в 200 мл (0,2л) 0,1М раствора СН3СООН рассчитывается по формуле m = CMMV = 0,1моль/л∙60г/моль∙0,2л =1,2г (М = 60 г/моль). Масса 60% раствора, в котором содержится
1,2г СН3СООН, определяется из формулы, ω,% = 100%.
= 2г. Таким образом, необходимый объем 60% раствора кислоты V= = = 1,87см3=1,87мл.
Задача 3. В каком соотношении надо смешать растворы 12% и 3% азотной кислоты для получения 10% раствора?
РЕШЕНИЕ. Для решения задачи воспользуемся правилом креста.
12 10 — 3 = 7
10
3 12 — 10 = 2
Значит, для получения 10% раствора азотной кислоты необходимо смешать 7 частей (масс) 12% раствора и 2 части (массы) 3%.
Задача 4. Рассчитать концентрацию ионов водорода в растворе HCN (См = 10-3 М ), если a= 4,2∙10-3.
РЕШЕНИЕ.Диссоциация цианистоводородной кислоты протекает по уравнению HCN ↔ H+ + CN—; концентрации ионов [H+] и [CN—] в растворе равны между собой ( так как nН+ : nСN— = 1:1, где n- стехиометрические коэффициенты) т.е. [H+] = [CN—] = aCм, моль/л; Тогда [H+] = [CN—] = 4,2∙10-3∙ 10-3 = 4,2×10-7 моль/л.
Задача 5.Рассчитать концентрацию ионов водорода и гидроксид-ионов в рстворе NH4OH, концентрацией См= 0,01М, если Кд= 1,8×10-5.
РЕШЕНИЕ.: Гидроксид аммония диссоциирует следующим образом:
NH4OH ↔ NH4+ + OH—, константа диссоциации имеет вид
Кд= ;
концентрации ионов аммония [NН4+] и гидроксида [OH—] совпадают
(n(NH4+) :n(OH—) = 1:1), обозначим их за х:
[NH4+] = [OH—] = х моль/л, тогда выражение для Кд примет вид
1,8×10-5 = х2/ 0,01-х. Считая, что х << См, решаем уравнение
1,8×10-5=x2/ 0,01, относительно х:
х = =4,2∙10-4моль/л; [OH—]= 4,2∙10-4 моль/л.
Концентрации ионов водорода и гидроксида связаны через ионное произведение воды Кw= [H+][OH—] =10-14, выразим концентрацию ионов водорода [H+] = Kw/[OH—] и рассчитаем её значение:
[H+]=1×10-14/4,2×10-4 = 2,3×10-11моль/л.
Задача 6. Определить рН раствора НСl (a=1), если См =2∙10-3 М.
РЕШЕНИЕ.Диссоциация соляной кислоты протекает по уравнению
HCl ® H+ + Cl—, концентрация ионов водорода [H+] = a Cм =1∙2∙10-3 = =2∙10-3 моль/л. Водородный показатель рН = — lg[H+] = — lg2∙10-3 = 2,7.
Задача 7. Определить молярную концентрацию гидроксида аммония, если рН=11, а Кд=1,8∙10-5.
РЕШЕНИЕ. Концентрация ионов водорода [H+]=10—pH=10-11моль/л. Из ионного произведения воды определяем концентрацию [OH—]
[OH—] = Kw/ [H+]=10-14/10-11 =10-3моль/л.
Гидроксид аммония — слабое основание и характеризуется уравнением реакции диссоциации NH4OH ↔ NH4+ + OH—. Выражение для константы диссоциации
Кд =
из закона Оствальда следует, что [NH4+ ] = [OH—] = a∙Cм, а Кд= a2См. Объединяя уравнения, получим См=[OH—]2/Kд = 10-6/ 1.8∙10-5 = 0,056 моль/л.
Задача 8. Концентрация насыщенного раствора (См) Mg(OH)2 равна 1,1•10-4 моль/л. Записать выражение для ПРи вычислить его величину.
Записать выражение для ПРи вычислить его величину.
РЕШЕНИЕ.В насыщенном растворе Mg(OH)2 устанавливается равновесие между осадком и раствором Mg(OH)2 ↔ Mg2++2OH—, для которого выражение ПР имеет вид ПР= [Mg2+][OH—]2. 158
Зная концентрации ионов, можно найти его численное значение. Учитывая полную диссоциацию Mg(OH)2, концентрация егонасыщенного раствора
См= [Mg2+]= 1,1×10-4 моль/л, а [OH—] = 2[Mg2+] = 2,2×10-4 моль/л. Следовательно, ПР= [Mg2+][OH—]2 =1,1. 10-4× (2,2 10-4)2 = 5,3. 10-12.
Задача 9.Вычислить концентрацию насыщенного раствора и ПР хромата серебра, если в 0,5 л воды растворяется 0,011 г соли.
РЕШЕНИЕ.Для определения молярной концентрации насыщенного раствора Ag2CrO4 воспользуемся формулой , где m— масса растворенного вещества (г), М- молярная масса ( г/моль), V — объем раствора (л). М(Ag2CrO4) =332 г/моль. См = 9,48.10-5 моль/л. Растворение хромата серебра (I) сопровождается полной (a=1) диссоциацией соли:
М(Ag2CrO4) =332 г/моль. См = 9,48.10-5 моль/л. Растворение хромата серебра (I) сопровождается полной (a=1) диссоциацией соли:
Ag2CrO4 ↔ 2Ag++ CrO42-
ПР=[Ag+]2[CrO42-],
где [CrO42-] = См = 9,48.10-5 моль/л, а [Ag+] = 2 См =1,896× 10-4 моль/л. Таким образом, ПР = (1,896× 10-4)2 (9,48 ×10-5) = 3,4 ×10-12.
Задача 10. Можно ли приготовить растворы соли СаСО3 с концентрациями СаСО3 С1 =10-2 М и С2 = 10-6 М , если ПР СаСО3 = 3,8× 10-9.
РЕШЕНИЕ.Зная величину ПР, можно рассчитать концентрацию насыщенного раствора соли и, сравнив ее с предлагаемыми концентрациями, сделать вывод о возможности или невозможности приготовления растворов. Растворение карбоната кальция протекает по схеме CaCO3 ↔ Ca2+ +CO32- В данном уравнении n = m = 1, тогда
Растворение карбоната кальция протекает по схеме CaCO3 ↔ Ca2+ +CO32- В данном уравнении n = m = 1, тогда
= ≈ 6,2•10-5моль/л ,
С1> См – раствор приготовить нельзя, так как будет выпадать осадок;
С2< См – раствор приготовить можно.
Дата добавления: 2021-01-26; просмотров: 159; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Примеры решения задач по химии
1. Вычислите растворимость поваренной соли в воде при 20°С, массовую долю соли (w), молярную концентрацию соли (С) в насыщенном растворе, если при выпаривании досуха насыщенного при 20°С раствора объёмом 217,4 мл (rр–ра = 1,15 г/мл) масса сухого остатка составила 66,2 г.
Решение – обратимся к определениям:
Мс = 23 + 35,5 = 58,5 г/моль,
где: mс – масса соли (г), Мс – молярная масса соли, nс – количество соли (моль).
Набор известных простых формул позволит быстро получить результат.
Итак, количество соли в растворе:
2. Коэффициент растворимости хлорида калия при 90°С равен 54, а при 20°С – соответственно 34. Вычислите массу кристаллов соли, образовавшихся при охлаждении горячего насыщенного раствора массой 300 г от 90°С до 20°С.
Решение – учтём, что коэффициент растворимости показывает отношение массы растворённого вещества (г) к массе растворителя (100 г) в насыщенном при данной температуре растворе. Надо понимать, что при нагревании растворитель как бы принимает всё больше и больше вещества и раствор становится всё крепче и крепче. Наоборот, при охлаждении растворитель уже не держит столько растворённого вещества – растворимость-то уменьшается. Избыток выпадает в осадок.
В нашем случае из условия следует, что массовая доля соли в насыщенном при 90°С растворе равна:
Если масса раствора 300 г, то очевидно, что масса соли в насыщенном горячем растворе
а масса воды
Именно эта вода при охлаждении раствора с учётом коэффициента растворимости удержит в растворе только:
–столько соли может быть в нашем растворе при 20°С.
Разница ( ) выпадает в осадок:
mкрист = 105,3 – 66,2 = 39,1 г
3. Определите состав мирабилита, содержащего в основном гидратированный сульфат натрия с небольшой долей нелетучих примесей (3,4 масс.%), если при прокаливании до постоянной массы образца минерала (10 г) потеря массы составила 5,4 г.
Решение – во-первых, ясно, что в образце масса собственно кристаллогидрата с учётом примесей составляет 10(1 – 0,034) = 9,66 г.
Во-вторых, прокаливание до постоянной массы означает полную дегидратацию по уравнению:
Далее – как обычно:
-по уравнению реакции
-по условию задачи
9,66 г крист.-гидр. – 5,4 г h3O
Откуда (142 + 18х)5,4 = 18х9,66 и х = 10.
Значит, мирабилит – это десятиводный сульфат натрия с небольшой долей примесей.
4. Определите массу этиленгликоля (НОСН2СН2ОН), который нужно растворить в воде объёмом 1 литр для приготовления антифриза с температурой замерзания –35°С. Криоскопическая константа воды 1,86.
Криоскопическая константа воды 1,86.
Решение. По 2 закону Рауля: , где Kk – криоскопическая постоянная растворителя (воды), Cm – моляльность раствора, моль/кг.
Моляльность раствора (моль/кг):
Поэтому:
Молярная масса этиленгликоля: = 62 г/моль,
C учётом плотности воды r = 1 кг/л, =rV = 1 кг, получаем ответ:
5. Вычислите объём (м3, н. у.) водорода, выделившегося при электролизе слегка подсоленной (для лучшей проводимости) воды массой 1 т.
Решение – проще некуда:
= 18 г/моль, Vo = 22,4 л/моль – мольный объём (объём одного моля любого газа при нормальных условиях).
-по уравнению реакции
-по условию задачи
6. Вычислите минимальный расход (м3) воды для гашения извести после прокаливания известняка массой 10 т с заметной долей (20 %) инородных примесей.
Решение – сущий пустяк:
С учётом примесей масса карбоната кальция в известняке 8 т = 8106 г.
Глядя на уравнения обжига и гашения, видим, что мольное соотношение разлагающегося карбоната CaCO3, оксида кальция CaO и воды h3O равно 1 : 1 : 1, т. е. моль на моль. И опять:
-по уравнению реакции
-по условию задачи
7. В стакане с водой объёмом 250 мл растворили сульфат магния массой 30 г. Вычислите массовую долю соли в растворе, плотность раствора (г/мл), молярную концентрацию соли.
Решение. Основные данные для решения:
8. Вычислите количество (моль) гидроксида калия в растворе объёмом 6 л, в котором массовая доля основания равна 12,2 %. Плотность раствора 1,15 г/мл.
Решение.
9. Вычислите количество (моль) кристаллогидрата , который смешали с водой (100 моль) и получили раствор MgCl2 с массовой долей соли, равной 16,9 %.
Решение. В данном случае необходимо понимать, что растворяем кристаллогидрат, а массовая доля рассчитана на безводную соль. Учтём, что
Учтём, что
10. Вычислите массовую долю гидроксида натрия в растворе (плотность 1,2), в котором молярная концентрация основания равна 6 моль/л.
Решение. Возьмём банку с раствором, к примеру, объёмом 3 л. Тогда, если , то n = СV = 6 моль/л3л = 18 моль. MNaOH = 40 г/моль
m = n M = 18 моль40 г/моль = 720 г – такова масса NaOH в растворе.
Масса раствора при известной плотности:
mр–ра = r*V = 1,2 г/мл*3000 мл = 3600 г.
11. Вычислите молярную концентрацию серной кислоты в растворе, получившемся при смешении крепкого раствора кислоты (V= 44 мл, w = 49 %, r = 1,137) с водой. Объём разбавленного раствора 2,5 л.
Определим количество серной кислоты , воспользовавшись параметрами крепкого раствора: mр–ра = rV = 1,137 г/мл44 мл = 50 г.
Следовательно, mк = wmр-ра = 0,49*50 = 24,5 г. При получаем
12. Вычислите объём (л) раствора соли с молярной концентрацией 3 моль/л, необходимого для приготовления разбавленного раствора этой соли объёмом 5 л и концентрацией соли 0,3 моль/л.
Решение. Сообразим, что в разбавленном растворе количество соли должно составлять
13. Вычислите массу (г) раствора серной кислоты (массовая доля кислоты 80 %), который необходимо смешать с другим раствором серной кислоты массой 0,75 кг (массовая доля кислоты 10 %) для получения раствора с массовой долей кислоты 30 %.
Решение. Сконструируем результат:
14. Вычислите объём (мл) раствора серной кислоты (w = 19,6 %, r = 1,136) для приготовления разбавленного раствора объёмом 500 мл, в котором эквивалентная концентрация кислоты равна 0,2 экв/л (r = 1).
Решение. В разбавленном растворе количество (экв) кислоты составляет
n = СV = 0,2 экв/л0,5 л = 0,1 экв, а масса кислоты (М = 98 г/моль, Э = 98 / 2 = 49 г/экв) mк= 0,1 экв49 г/экв = 4,9 г.
15. В воде содержатся катионы и анионы, концентрации (мэкв/л) которых составляют: Ca2+ – 2,5; Na+ – 1,8; Mg2+ – 0,7; HCO3– – 2,9; Cl– – 1,5; SO42– – 0,6. Определите величины общей, временной и постоянной жёсткости воды.
Определите величины общей, временной и постоянной жёсткости воды.
Решение. Содержание ионов натрия не влияет на величину жёсткости воды. Общая жёсткость определяется суммарным содержанием (мэкв/л) ионов жёсткости:
Временная жёсткость – часть общей, определяемая содержанием (мэкв/л) HCO3– – ионов, но, заметим, Жвр < Жобщ. В нашем случае
Жвр = 2,9 мэкв/л
Так как общая жёсткость есть сумма временной и постоянной жёсткости, то постоянную жёсткость можно рассчитать по разности общей и временной жёсткости:
Жпост = Жобщ – Жвр = 3,2 – 2,9 = 0,3 мэкв/л.
Если в условии этой же задачи концентрация ионов HCO3– составляла бы, к примеру, не 2,9, а 3,9 мэкв/л, то временная жёсткость была бы равна общей жёсткости: Ж`вр = 3,2 мэкв/л, а вот на долю постоянной жёсткости не осталось бы ничего: Ж`пост = Жобщ – Ж`вр = 3,2 – 3,2 = 0 мэкв/л.
16. Вычислите временную, постоянную и общую жёсткость воды, в образце которой объёмом 125 мл обнаружили гидрокарбонат кальция массой 40,5 мг, хлорид натрия массой 115 мг, хлорид кальция массой 11,1 мг, сульфат магния массой 33 мг.
Решение. Хлорид натрия не является солью жёсткости. Временная жёсткость определяется концентрацией гидрокарбоната кальция, а постоянная – концентрацией хлорида кальция и сульфата магния. Рассчитаем эквивалентные массы солей жёсткости
17. Временная (кальциевая) жёсткость в образце воды равна 8 мэкв/л. Вычислите массу (г) накипи после кипячения такой воды объёмом 1,5 м3.
Решение. При кипячении происходит разложение гидрокарбоната кальция по уравнению:
Масса накипи равна массе образовавшегося карбоната кальция. По закону эквивалентов число эквивалентов (n) CaCO3равно числу эквивалентов Ca(HCO3)2:
18. В большую бочку (300 л) с жёсткой водой для её умягчения высыпали и растворили ортофосфат натрия массой 131,2 г. Умягчили, но остаточная жёсткость, как показал анализ, составила 2 мэкв/л. Какова была первоначальная жёсткость воды в бочке?
Решение. Понижение жёсткости объясняется осаждением катионов жёсткости в виде осадков нерастворимых фосфатов. По закону эквивалентов число эквивалентов израсходованного фосфата натрия должно быть равно числу эквивалентов солей жёсткости, бывших в бочке.
По закону эквивалентов число эквивалентов израсходованного фосфата натрия должно быть равно числу эквивалентов солей жёсткости, бывших в бочке.
Достаточно разделить это число на объём воды в бочке, и мы получим величину понижения жёсткости:
Задачи по химии, решение задач по химии
На практике мы иногда сталкиваемся с задачами, связанными с определением количественной оценкой веществ, вступающих в химические реакции, оценкой количества получаемых в этой реакции продуктов, интересующих нас веществ. Хозяйкам наверняка часто приходится определять процентное содержание того или иного вещества в растворе и сколько того или другого вещества при этом надо взять. Как правильно рассчитать количество вещества, которое бы нейтрализовало или обезвредило другое вещество? Сколько газа выделится, если к раствору лимонной кислоты добавить соду? Как приготовить, например, 5%-й раствор марганцовки, а также много других задач, встречаемых в бытовой практике.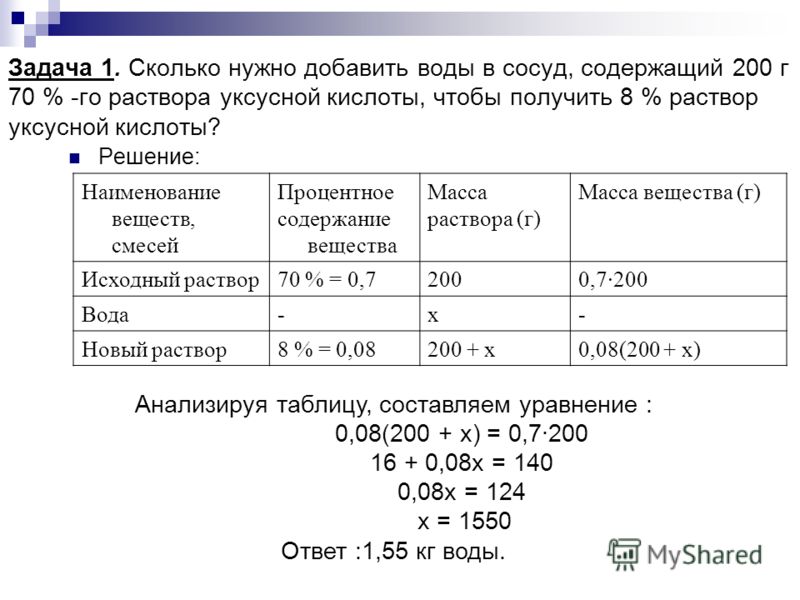
Цель статьи Решение задач по химии — показать, как можно легко решать подобные задачи, не прибегая к сложным химическим расчётам, а применяя лишь общие знания из курса математики и немного общих знаний из химии.
Что нужно знать для решения задач по химии
Кстати, что Вам необходимо знать для решения простых задач по химии:
M — молярная масса (молекулярная масса вещества) — эту величину для простых веществ берут из таблицы Менделеева (число, записанное в правом нижнем углу каждого элемента, например, у углерода M(C)=12,01115 г/моль, при этом дробную часть обычно отбрасывают). Если это газ (например, водород), то M(H2) =1 x 2 =2 г/моль), и так для всех элементов — газов.
В основном мы имеем дело со сложными веществами, молярная масса которых равна сумме молярных масс входящих в него простых элементов, например, углекислый газ (CO2): M(CO2) = 12+16×2 = 44 г/моль.
W — концентрация вещества — это сколько вещества по массе содержится в 100 г раствора, например 5% раствор содержит 5 г сухого вещества и 95 г растворителя.
Ну что ж, рассмотрим наиболее широко распространённую задачку о том, как определить процентное содержание вещества в растворе и сколько нужно взять при этом вещества и самого раствора.
Задача по химии 1
Имеется 200 мл 25% раствора уксусной кислоты (CH3 -COOH). Сколько нужно взять воды, чтобы из этого раствора приготовить раствор 5% уксусной кислоты?
Решение:
(М раствора) = (М растворенного вещества) + (М растворителя)
1) По формуле W1 = (M вещества) / (М раствора) определим массу растворенного вещества:
(M вещества) = W1 x (М раствора), т. е. 0,25 x 200 = 50 г.
е. 0,25 x 200 = 50 г.
2) Чтобы получить раствор меньшей концентрации, нужно его разбавить водой, при этом масса растворенного в нём вещества не изменется. Поэтому запишем такую же формулу для нового раствора:
W2 = (M вещества) / ( М растворенного вещества + М растворителя ). Подставив числа, получим:
0,05 = 50 / (М растворителя + 50), откуда находим, что М растворителя = 950 г.
3) Итак, масса нового раствора будет равна (М растворенного вещества) + (М растворителя) = 50 + 950 = 1000 г (1л). Зная массу имевшегося раствора (200 г) и массу нового раствора (1000 г) определяем, что выду нужно добавить 800 г. Ответ: 800 г.
Иногда требуется решить обратную задачу:
Имеется раствор 250 г с концентрацией 5%. Требуется определить, сколько необходимо взять растворимого вещества, чтобы повысить концентрацию раствора до 25%?
Решение:
1) Воспользуемся формулой W1 = (M вещества) / (М раствора) и определим массу рстворимого вещества в имеющемся 5% растворе и массу воды в этом растворе:
(M вещества) = 0,05 x 250 = 12,5 г. , значит масса (М растворителя) = (М раствора) — (M вещества) = 250 — 12,5 = 237,5 г.
, значит масса (М растворителя) = (М раствора) — (M вещества) = 250 — 12,5 = 237,5 г.
2) Запишем формулу для нового раствора:
W2 = (M нового вещества) / ( М нового вещества + М растворителя ). Подставив числа, получим:
0,25 = (M нового вещества) / ( М нового вещества + 237,5 ), откуда М нового вещества = 79,16 г.
3) Итак, в ранее имевшемся 5% рстворе содержалось 12,5 г растворенного вещества, а в новом растворе его содержится 79,16 г., значит для получения нового раствора нужно добавить 79,16- 12,5 г = 66,66 г вещества. Ответ: 66,66 г.
Здесь вы можете рассчитать свои растворы, их концентрации для своих практических целей, проверить себя!
Задача по химии 2
Задача на определение количества продуктов реакции или реагентов.
Допустим такое условие. Нам нужно обезвредить кислую среду. Вы случайно разлили 200 мл соляной кислоты (HCl), а под руками оказалась стиральная сода (Na2CO3) (или второе её название — кальцинированная сода). Так вот: сколько нужно взять стиральной соды, чтобы обезвредить 200 мл соляной кислоты!?
Нам нужно обезвредить кислую среду. Вы случайно разлили 200 мл соляной кислоты (HCl), а под руками оказалась стиральная сода (Na2CO3) (или второе её название — кальцинированная сода). Так вот: сколько нужно взять стиральной соды, чтобы обезвредить 200 мл соляной кислоты!?
Решение:
Запишем уравнение химической реакции соляной кислоты со стиральной содой:
2HCl + Na2CO3 => 2NaCl + H2O + CO2.
Из начального курса химии мы знаем, что при реакции кислоты с солью образуется другая кислота (более слабая) и другая соль. В нашем случае образуется угольная кислота, которая сразу же распадается на воду и углекислый газ, и раствор поваренной соли.
Теперь по таблице Менделеева нужно определить молекулярные массы веществ соляной кислоты (2 х HCl) и стиральной соды (Na2CO3). Молекулярная масса с ложного вещества считается как сумма масс входящих в него веществ с учётом количества атомов в молекуле и числа молекул!
Например молекулярная масса 2-x молекул HCl: Mr (HCl) = 2 x (1+ 35,5)= 73 г/моль;
молекулярная масса 1 молекула Na2CO3: Mr (Na2CO3) = 2 х 23 + 12 + 16 х 3)= 106 г/моль
Теперь осталось составить пропорцию:
73 мл (HCl) вступают в реакцию с 106 г Na2CO3
200 мл (HCl) вступают в реакцию с X г Na2CO3, откуда находим, что X = 200 х 106 / 73 = 290 г.
Так вот, чтобы обезвредить 73 мл разлитой кислоты (концентрированной) нужно её смешать с 290 г стиральной соды. Всё!
Такая химическая задачка может немного усложниться, если учитывать концентрацию кислоты. В этом случае, мы должны посчитать, сколько чистого вещества находится в растворе (как в предыдущей задаче 1), а затем составить пропорцию с найденным количеством соляной кислоты. Но в любом случае если даже кислота будет иметь меньшую концентрацию, то наше решение с избытком удовлетворит решение, так как, в таком случае сода будет взята в избытке!
Задача по химии 3
Нужно рассчитать, сколько % каждого простого вещества находится в сложном веществе — CaSO4 — гипс.
Решение:
Берём таблицу Менделеева и находим общую относительную молекулярную массу CaSO4: (помним, что общая молекулярная сложного вещества равна сумме молекулярных масс входящих в него простых веществ — выбираем из таблицы)
M (CaSO4) = 40 + 32 +16×4 = 136 г/моль
Теперь рассчитываем долю каждого элемента в отдельности:
40:136 =0,29 (29%)
32:136 = 0,24 (24%)
Процентное содержание кислорода находим как оставшуюся часть задачи: (100%-29%-24% = 47%). Вот и всё.
Вот и всё.
Задача по химии 4
Доводилось ли Вам читать на упаковках продуктов срок годности продуктов! Наверняка! Там стоит дата изготовления и срок хранения при определённой температуре. Но не всегда удаётся хранить продукты при рекомендуемой температуре. Так вот! Можно определить срок хранения продукта, зная условия его рекомендуемого хранения. Итак, задача по химии:
Имеется торт с кремом, срок хранения которого 4 дня при температуре +50C. Вопрос: как долго этот торт можно хранить при температуре +250C?
Решение:
Прежде всего, при решении таких задач (задача по химии на скорость химической реакции) существует правило:
при повышении температуры на каждые 10 0C скорость химической реакции увеличивается в 2…4 раза
откуда следует формула
Vt2 = Vt2*Y (t2-t1) / 10 , где
Vt1 — скорость реакции (рекомендуемая)
Vt2 — скорость реакции при новых условиях
Y — коэффициент равный 2, 3 или 4 (пр решении задач обычно принимается 3)
t1 — температура хранения (рекомендуемая, указанная на упаковке)
t2 — температура хранения при новых условиях
Итак, в нашем случае: t1 = +50C
; t2 = +250C; коэффициент Y = 3
тогда Vt2 / Vt1 = Y(25 — 5) / 10C = 31,5C = 32 = 9 раз.
Итак, если хранить торт при температуре +250C, вместо +50C, то он может храниться по времени в 9 раз меньше, а именно: 4 суток = 96 часов, тогда 96 / 9 = 1,5 часа. Вот так!
6.1: Расчет молярности (задачи) — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 98779
ЗАДАЧА \(\PageIndex{1}\)
Объясните, что меняется и что остается неизменным при разбавлении 1,00 л раствора NaCl до 1,80 л.
- Ответить
Количество молей в разбавлении всегда остается одним и тем же.
Концентрация и объемы изменяются при разбавлении.

ЗАДАЧА \(\PageIndex{2}\)
Что значит, когда мы говорим, что образец раствора соли объемом 200 мл и образец раствора соли объемом 400 мл имеют одинаковую молярность? В чем сходство двух образцов? Чем отличаются эти два образца?
- Ответить
Два образца содержат одинаковую долю молей соли в литрах раствора, но имеют разное фактическое количество молей.
ЗАДАЧА \(\PageIndex{3}\)
Определите молярность каждого из следующих растворов:
- 0,444 моль CoCl 2 в 0,654 л раствора
- 98,0 г фосфорной кислоты, H 3 PO 4 , в 1,00 л раствора
- 0,2074 г гидроксида кальция, Ca(OH) 2 , в 40,00 мл раствора
- 10,5 кг Na 2 SO 4 ·10H 2 O в 18,60 л раствора
- 7,0 × 10 −3 моль I 2 в 100,0 мл раствора
- 1,8 × 10 4 мг HCl в 0,075 л раствора
- Ответить на
0,679 М
- Ответ б
1,00 М
- Ответ c
0,06998 М
- Ответ d
1,75 М
- Ответ e
0,070 М
- Ответ f
6,6 М
- Нажмите здесь, чтобы посмотреть видео о решении
- youtube.com/embed/-uBCmBOVmak?vq=hd1080″ frameborder=»0″ allowfullscreen=»true»>
ЗАДАЧА \(\PageIndex{4}\)
Определите молярность каждого из следующих растворов:
- 1,457 моль KCl в 1,500 л раствора
- 0,515 г H 2 SO 4 в 1,00 л раствора
- 20,54 г Al(NO 3 ) 3 в 1575 мл раствора
- 2,76 кг CuSO 4 ·5H 2 O в 1,45 л раствора
- 0,005653 моль Br 2 в 10,00 мл раствора
- 0,000889 г глицина, C 2 H 5 NO 2 , в 1,05 мл раствора
- Ответить на
0,9713 М
- Ответ b
5,25 × 10 -3 М
- Ответ c
6,122 × 10 -2 М
- Ответ d
7,62 М
- Ответ e
0,5653 М
- Ответ f
1,13 × 10 -2 М
ЗАДАЧА \(\PageIndex{5}\)
Рассчитайте количество молей и массу растворенного вещества в каждом из следующих растворов:
(a) 2,00 л 18,5 M H 2 SO 4 , концентрированная серная кислота
(b) 100,0 мл 3,8 × 10 −5 M 0 натрия леталианида натрия минимальной концентрации в сыворотке крови
(c) 5,50 л 13,3 M H 2 CO, формальдегид, используемый для «фиксации» образцов тканей
(d) 325 мл 1,8 × 10 −6 M FeSO 14 14 , минимальная концентрация сульфата железа, определяемая по вкусу в питьевой воде
- Ответить на
37,0 моль H 2 SO 4
3,63 × 10 3 г H 2 SO 4
- Ответ b
3,8 × 10 −6 моль NaCN
1,9 × 10 −4 г NaCN
- Ответ c
73,2 моль H 2 CO
2,20 кг H 2 CO
- Ответ d
5,9 × 10 −7 моль FeSO 4
8,9 × 10 −5 г FeSO 4
- Нажмите здесь, чтобы посмотреть видео о решении
- youtube.com/embed/U5oOnL7NCgk?vq=hd1080″ frameborder=»0″ allowfullscreen=»true»>
ЗАДАЧА \(\PageIndex{6}\)
Рассчитайте молярность каждого из следующих растворов:
(a) 0,195 г холестерина, C 27 H 46 O, в 0,100 л сыворотки, средняя концентрация холестерина в сыворотке человека
(b) 4,25 г NH 3 в 0,500 л раствора , концентрация NH 3 в бытовом аммиаке
(c) 1,49 кг изопропилового спирта, C 3 H 7 OH, в 2,50 л раствора, концентрация изопропилового спирта в медицинском спирте
(d) 0,029 г I 2 в 0,100 л раствора, растворимость I 2 в воде при 20 °C
- Ответ a
5,04 × 10 −3 М
- Ответ b
0,499 М
- Ответ c
9,92 М
- Ответ d
1,1 × 10 −3 М
ПРОБЛЕМА \(\PageIndex{7}\)
В 1,0 л молока содержится около 1,0 г кальция в виде Ca 2+ . Какова молярность Ca 2+ в молоке?
Какова молярность Ca 2+ в молоке?
- Ответить
0,025 М
- Нажмите здесь, чтобы посмотреть видео о решении
-
ПРОБЛЕМА \(\PageIndex{8}\)
Какой объем 1,00- М Fe(NO 3 ) 3 раствора можно развести для приготовления 1,00 л раствора с концентрацией 0,250 М ?
- Ответить
0,250 л
ПРОБЛЕМА \(\PageIndex{9}\)
Если 0,1718 л раствора 0,3556- M C 3 H 7 OH разбавить до концентрации 0,1222 М , каков объем полученного раствора?
- Ответить
0,5000 л
- Нажмите здесь, чтобы посмотреть видео о решении
- youtube.com/embed/GSI-w0ocbxU?vq=hd1080″ frameborder=»0″ allowfullscreen=»true»>
ЗАДАЧА \(\PageIndex{10}\)
Какой объем раствора 0,33- M C 12 H 22 O 11 можно развести для приготовления 25 мл раствора с концентрацией 0,025 М ?
- Ответить
1,9 мл
ЗАДАЧА \(\PageIndex{11}\)
Какая концентрация раствора NaCl получается, когда 0,150 л 0,556- М раствора испаряют до тех пор, пока объем не уменьшится до 0,105 л?
- Ответить
0,794 М
- Нажмите здесь, чтобы посмотреть видео о решении
ЗАДАЧА \(\PageIndex{12}\)
Какова молярность разбавленного раствора, когда каждый из следующих растворов разбавлен до заданного конечного объема?
- 1,00 л 0,250- М раствора Fe(NO 3 ) 3 разводят до конечного объема 2,00 л
- 0,5000 л 0,1222- М раствора С 3 Н 7 ОН разводят до конечного объема 1,250 л
- 2,35 л 0,350- М раствора H 3 PO 4 разводят до конечного объема 4,00 л
- 22,50 мл 0,025- М раствора C 12 H 22 O 11 разбавлен до 100,0 мл
- Ответить на
0,125 М
- Ответ b
0,04888 М
- Ответ c
0,206 М
- Ответ d
0,0056 М
ЗАДАЧА \(\PageIndex{13}\)
Какова конечная концентрация раствора, полученного, когда 225,5 мл 0,09988- М раствора Na 2 CO 3 испаряют до объема раствора уменьшается до 45,00 мл?
- Ответить
0,5005 М
- Нажмите здесь, чтобы посмотреть видео о решении
- youtube.com/embed/qbUYHRxXYzE?vq=hd1080″ frameborder=»0″ allowfullscreen=»true»>
ПРОБЛЕМА \(\PageIndex{14}\)
Для лаборатории общей химии была приобретена бутыль объемом 2,00 л с раствором концентрированной HCl. Раствор содержал 868,8 г HCl. Какова молярность раствора?
- Ответить
11,9 М
ЗАДАЧА \(\PageIndex{15}\)
Для эксперимента в лаборатории общей химии требуется 2,00- М раствор HCl. Сколько мл 11,9 М HCl потребуется для получения 250 мл 2,00 М HCl?
- Ответить
42,0 мл
- Нажмите здесь, чтобы посмотреть видео о решении
ЗАДАЧА \(\PageIndex{16}\)
Какой объем раствора 0,20- M K 2 SO 4 содержит 57 г K 2 SO 4 ?
- Ответить
1,6 л
ПРОБЛЕМА \(\PageIndex{17}\)
Агентство по охране окружающей среды США (EPA) устанавливает ограничения на количество токсичных веществ, которые могут сбрасываться в канализационную систему. Предельные значения установлены для ряда веществ, в том числе для шестивалентного хрома, который ограничивается 0,50 мг/л. Если промышленность сбрасывает шестивалентный хром в виде дихромата калия (K 2 Cr 2 O 7 ), какова максимально допустимая молярность этого вещества?
Предельные значения установлены для ряда веществ, в том числе для шестивалентного хрома, который ограничивается 0,50 мг/л. Если промышленность сбрасывает шестивалентный хром в виде дихромата калия (K 2 Cr 2 O 7 ), какова максимально допустимая молярность этого вещества?
- Ответить
4,8 × 10 −6 М
- Нажмите здесь, чтобы посмотреть видео о решении
Авторы
Пол Флауэрс (Университет Северной Каролины, Пембрук), Клаус Теопольд (Университет Делавэра) и Ричард Лэнгли (Государственный университет Стивена Ф. Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Скачать бесплатно на http://cnx.
 org/contents/85abf193-2бд…[email protected]).
org/contents/85abf193-2бд…[email protected]).- Аделаида Кларк, Орегонский технологический институт
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.
- Теги
Молярность раствора: Численные задачи с растворами
Наука > Химия > Растворы и их коллигативные свойства > Численные задачи на молярность В этой статье мы будем изучать численные задачи для расчета молярности данного раствора.
Пример – 01:
Раствор NaOH (молярная масса 40 г моль -1 ) был получают растворением 1,6 г NaOH в 500 см3 3 воды. Рассчитать молярность раствора NaOH.
Дано: Масса NaOH = 1,6 г, молярная масса NaOH = 40 г моль -1 , объем воды = 500 см 3 = 500 мл = 0,5 л
Найти: Молярность =?
Решение:
Число молей = заданная масса/ молекулярная масса = 1,6 г/40 г моль -1 = 0,04 моль
Молярность = количество молей растворенного вещества/объем раствора в л
Молярность = 0,04 моль/0,5 л = 0,08 моль л -1
Ans0: молярность раствора NaOH составляет 0,08 моль л -1 или 0,08 моль/л
решения.
Дано: Масса растворенного вещества (едкого натра) = 4 г, объем раствора = 200 мл = 0,2 л
Кому Найти: Молярность раствора =?
Раствор:
Молярная масса едкого растворенного вещества (каустическая сода NaOH) = 23 г x1 + 16 г x 1 + 1 г x 1 = (23 + 16 + 1) г = 40 г
Число молей едкого растворенного вещества (едкого натра) = задано масса/молекулярная масса = 4 г/40 г = 0,1
Молярность раствора = количество молей растворенного вещества/объем раствора в л = 0,1/0,2 = 0,5 М
Ответ: молярность раствора едкого натра составляет 0,5 моль л -1 или 0,5 М
Пример – 03:
Рассчитайте молярность 5,3 г безводного карбоната натрия
растворяют в 100 мл раствора.
Дано: Масса растворенного вещества (карбоната натрия) = 5,3 г, объем раствор = 100 мл = 0,1 л
Найти: Молярность раствора =?
Решение:
Молярная масса (Na 2 CO 3 ) = 23 г х 2 + 12 г х 1 + 16 г х 3 = (46 + 12 + 48) г = 106 г
Количество молей (Na 2 CO 3 ) = задано масса/молекулярная масса = 5,3 г/106 г = 0,05
Молярность раствора = количество молей растворенного вещества/объем раствора в л = 0,05/0,1 = 0,5 М
Ответ: молярность раствора карбоната натрия 0,5 моль л -1 или 0,5 M
Пример – 04:
Рассчитайте молярность 0,365 г чистого газообразного HCl, растворенного в 50 мл раствора.
Дано: Масса растворенного вещества (HCl) = 0,365 г, объем раствора = 50 мл. = 0,05 л
К Найти: Молярность раствора =?
Решение:
Молярная масса HCl = 1 г x 1 + 35,5 г x 1 = (1 + 35,5) г = 36,5 г
Число молей HCl = заданная масса/молекулярная масса = 0,365 г/ 36,5 г = 0,01
Молярность раствора = Количество молей растворенного вещества/объем раствора в л = 0,01/0,05 = 0,2 М
Ответ: молярность раствора HCl 0,2 моль л -1 или 0,2 М
Пример – 05:
Рассчитайте молярность 5,85 г NaCl, растворенного в 200 мл
решение.
Дано: Масса растворенного вещества (NaCl) = 5,85 г, объем раствора = 200 мл = 0,2 л
К Найти: Молярность раствора =?
Решение:
Молярная масса NaCl = 23 г x 1 + 35,5 г x 1 = (23 + 35,5) г = 58,5 г
Число молей NaCl = заданная масса/молекулярная масса = 5,85 г/ 58,5 г = 0,1
Молярность раствора = Количество молей растворенного вещества/объем раствора в л = 0,1/0,2 = 0,5 М
Ответ: молярность раствора NaCl составляет 0,5 моль л -1 или 0,5 моль/л
решение.
Дано: Масса растворенного вещества (NaCl) = 20,6 г, объем раствора = 500 мл = 0,5 л
До Найти: Молярность раствора =?
Решение:
Молярная масса NaBr = 23 г x 1 + 80 г x 1 = (23 + 80) г = 103 г
Количество молей NaBr = заданная масса/молекулярная масса = 20,6 г/ 103 г = 0,2
Молярность раствора = Количество молей растворенного вещества/объем раствора в л = 0,2/0,5 = 0,4 М
Ответ: молярность раствора NaBr 0,4 моль л -1 или 0,4 М
Пример – 07:
Рассчитайте молярность чистой воды, если ее плотность равна 1 г/мл.
Дано: Плотность воды = 1 г/мл
Найти: Молярность чистой воды =?
Решение:
Рассмотрим 1000 мл воды
Масса воды = объем x плотность = 1000 мл x 1 г/мл = 1000 г
Молярная масса воды = 1 г x 2 + 16 г x 1 = (2 + 16) г = 18 г
Количество молей воды = заданная масса/молекулярная масса = 1000/ 18 г = 55,5
Молярность чистой воды = количество молей растворенное вещество/объем раствора в л = 55,55/1 = 55,55 М
Ответ: Молярность чистой воды составляет 55,55 моль л -1 или 55,5 М
Пример – 08:
Рассчитайте количество безводного карбоната натрия требуется для получения 250 мл децимолярного раствора.
Дано: объем раствора = 250 мл = 0,25 л, молярность = десятимолярная = М/10 = 0,1 М
К Найти: Масса безводного натрия карбонат =?
Решение:
Молярность = количество молей растворенного вещества/объем решение в L
0,1 = число молей растворенного вещества/0,25
количество молей растворенного вещества = 0,1 x 0,25 = 0,025 моль г x 2 + 12 г x 1 + 16 г x 3 = (46 + 12 + 48) g = 106 г
Количество молей = заданная масса/молекулярная масса
Масса Na 2 CO 3 = Количество молей x молекулярная масса
Масса Na 2 CO 3 = 106 x 0,025 = 2,65 г
Ответ: необходимое количество карбоната натрия составляет 2,65 г
Пример – 09:
Серная
кислота составляет 95,8 % по массе.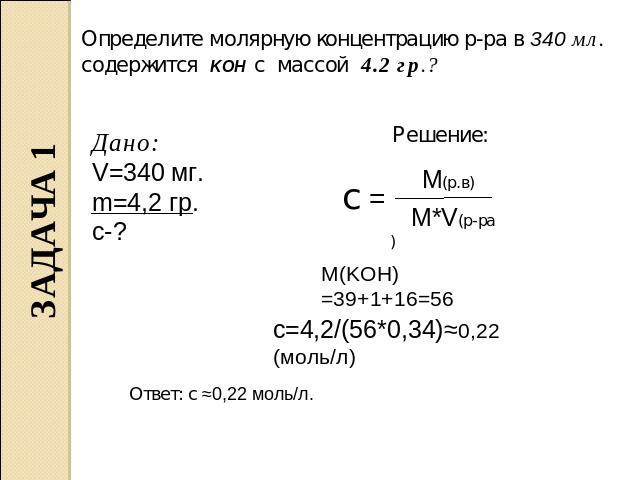 Рассчитать молярность и молярную долю H 2 SO 4 плотностью 1,91 г см -3 . Дано H = 1, S = 32, O = 16.
Рассчитать молярность и молярную долю H 2 SO 4 плотностью 1,91 г см -3 . Дано H = 1, S = 32, O = 16.
Дано: % по массе = 95,8 %, плотность раствора = 1,91 г см -3
Найти: Мольная доля =? Молярность =?
Раствор:
Рассмотреть 100 г раствора
Масса H 2 SO 4 = 95,8 г и масса молекулярная масса воды (H 2 O) = 1 г x 2 + 16 г x 1 = 18 г моль -1
Молекулярная масса H 2 SO 4 = 1 г x 2 + 32 г x 1 + 16 г x 4 = 98 г моль -1
Число молей воды = n A = 4,2 г/18 г = 0,2333 моль
Число молей H 2 SO 4 = n B = 95,8 г/ 98 г = 0,9776 моль
Общее число молей = n A + n B + n C = 0,2333 + 0,9776 = 1,2109
Молярная доля H 2 SO 4 = x B = n B /(n A + n B ) = 0,9776/1,2109 = 0,8073
/1,91 г см -3 = 52,36 см 3 = 52,36 мл = 0,05236 л
Молярность раствора = Количество молей растворенного вещества/объем раствора в л = 0,9776/0,05236 = 18,67 М
Ответ: Моль доля H 2 SO 4 равна 0,8073, а молярность раствора составляет 18,67 моль л -1 или 18,67 М
Пример – 10:
Коммерчески доступная концентрированная соляная кислота представляет собой
водный раствор, содержащий 38% газообразного HCl по массе. Если его плотность 1,1 г см -3 ,
рассчитать молярность раствора HCl, а также рассчитать мольную долю HCl
и Н 2 O.
Если его плотность 1,1 г см -3 ,
рассчитать молярность раствора HCl, а также рассчитать мольную долю HCl
и Н 2 O.
Дано: % по массе = 38 %, плотность раствора = 1,1 г см -3
Найти: Мольная доля =? Молярность =?
Раствор:
Рассмотрим 100 г раствора
Масса HCl = 38 г и масса H 2 O = 100 – 38 г = 62 г
Молекулярная масса воды (H 2 O) = 1 г x 2 + 16 г x 1 = 18 г моль -1
Молекулярная масса HCl = 1 г x 1 + 35,5 г x 1 = 36,5 г моль -1
Количество молей воды = n A = 62 г/ 18 г = 3,444 моль
Число молей HCl = n B = 38 г/ 36,5 г = 1,041 моль
Общее количество молей = n A + n B + n C = 3,444 + 1,041 = 4,485
Мольная доля HCl = x B = n B /(n A + n B ) = 1,041/4,485 = 0,2321
Мольная доля H 2 O = x A = n A /(n A +n B ) = 3,444/4,485 = 0,7679
Плотность раствора = 1,1 г см -3
Объем раствора = Масса раствора / плотность = 100 г/1,1 г см -3 = 90,91 см 3 = 90,91 мл = 0,09091 л
Молярность раствора = Количество молей растворенного вещества/объем раствора в л = 1,041/0,09091 = 11,45 М
Ответ: Молярность раствора 11,45 моль л -1 или 11,45 М, молярная доля HCl составляет 0,2321, а доля H 2 O is 0,7679
Пример – 11:
Имеющаяся в продаже концентрированная соляная кислота представляет собой
водный раствор, содержащий 40% газообразного HCl по массе. Если его плотность 1,2 г см -3 ,
рассчитать молярность раствора HCl.
Если его плотность 1,2 г см -3 ,
рассчитать молярность раствора HCl.
Дано: % по массе = 40 %, плотность раствора = 1,2 г см -3
Найти: Молярность =?
Раствор:
Рассмотреть 100 г раствора
Масса HCl = 40 г и масса H 2 O = 100 – 40 г = 60 г
Молекулярная масса HCl = 1 г x 1 + 35,5 г x 1 = 36,5 г моль -1
Число молей HCl = n B = 40 г/ 36,5 г = 1,096 моль
Плотность раствора = 1,2 г см -3
Объем раствора = масса раствора / плотность = 100 г/1,2 г см -3 = 83,33 см 3 = 83,33 мл = 0,08333 л
Молярность раствора = Количество молей растворенного вещества/объем раствора в L = 1,096/0,08333 = 13,15 М
Ответ: Молярность раствора 13,15 моль л -1 или 13,15 моль/л
Пример – 12:
Рассчитайте молярность раствора, содержащего 50 г NaCl
500 г раствора и плотностью 0,936 г/см 3 .
Дано: Масса растворенного вещества (NaCl) = 50 г, масса раствора = 500 г, плотность раствора = d = 0,936 г/см 3 .
Найти: Молярность раствора = M =?
Молярная масса NaCl = 23 г x 1 + 35,5 г x 1 = (23 + 35,5) г = 58,5 г
Число молей NaCl = заданная масса/молекулярная масса = 50 г/ 58,5 г = 0,8547
Плотность раствора = 0,936 г см -3
Объем раствора = масса раствора / плотность = 500 г /0,936 г см -3 = 534,2 см 3 = 534,2 мл = 0,5342 л
Молярность раствора = Количество молей растворенного вещества/объем раствора в л = 0,8547/0,5342 = 1,6 М
ANS: Молярность раствора NaCl составляет 1,6 моль L -1 или 1,6 м
Предыдущая тема: Численные проблемы на моле
Следующая тема: численная проблема на молалле
Наука> Наука> Наука> Наука> Наука> Наука> Наука> Наука> Наука> Наука> Наука> Наука> Наука> Наука> Наука> Наука> На науке Решения и их коллективные свойства > Численные задачи на молярность
Практические задачи на молярность и учебное пособие
Физика
- Автор: Брайан Стокер MA
- Дата 7 апреля 2014 г.

Молярность
Молярность – это мера концентрации вещества в растворе, выраженная в виде количества вещества на единицу объема раствора. Вопросы о молярности находятся в HESI и NLN PAX
. Как решать практические задачи на определение молярности
. Молярность также называется концентрацией количества вещества, концентрацией количества, концентрацией вещества или просто концентрацией.
Молярность раствора просто означает количество молей, содержащихся в каждом литре раствора. Чтобы лучше понять концепцию молярности раствора, необходимо сначала понять некоторые связанные термины.
* Растворенное вещество – растворяемое вещество, такое как сахар или ртуть.
* Растворитель – относится к жидкости, в которой растворяется растворенное вещество.
* Раствор – относится к смеси растворителя и растворенного вещества, так что раствор равен растворителю плюс растворенное вещество.
Молярность раствора, таким образом, является мерой молярной концентрации растворенного вещества в растворе. Молярность раствора измеряется в молях растворенного вещества на литр раствора или моль/литр. Например, если молярность раствора ртути равна 1М, это просто означает, что в каждом 1 литре раствора содержится 1 моль сахара.
Формула молярности = моли растворенного вещества/общее количество литров раствора
Вот типичная практическая задача определения молярности:
Если 2 моля соли растворяются, чтобы образовался 1 литр раствора, рассчитайте молярность раствора.
а. 1 М раствор
б. 1,5 М раствор
c. 2 М раствор
d. 2,5 М раствор
Формула для расчета молярности, когда даны моли растворенного вещества и литры раствора = моли растворенного вещества/литры раствора.
Моль растворенного вещества = 2 моля сахара
Литры раствора = 1 литр
Молярность раствора = 2 моля растворителя/1 литр раствора = 2 М раствора.
Практические задачи на молярность
1. Рассчитайте молярность раствора сахара, если 4 литра раствора содержат 8 молей сахара?
а. 0,5 М
б. 8 М
с. 2 М
д. 80 M
2. Какова молярность раствора, содержащего 5 молей растворенного вещества в 250 миллилитрах раствора?
а. 20 М
б. 15 М
с. 0,104 М
д. 1,25 М
3. Сколько молей N A OH необходимо растворить в воде, чтобы получить 4 литра 2,0 М раствора?
а. 0,50 М
б. 2 М
с. 8 моль
д. 0,5 моль
4. Сколько молей Na необходимо для приготовления 4,5 литров 1,5 М раствора Na?
а. 6,75 моль
б. 0,33 М
в. 0,33 моль
д. 3 М
5. Молярность раствора может быть определена как:
a. атомная масса элемента
б. моль раствора на литр растворенного вещества
c. моль растворенного вещества на литр раствора
моль растворенного вещества на литр раствора
d. масса растворителя на литр раствора
6. Чтобы рассчитать молярность раствора, когда растворенное вещество указано в граммах, а объем раствора в миллилитрах, необходимо сначала:
a. Преобразуйте граммы в моли, но оставьте объем раствора в миллилитрах
б. Преобразовать объем раствора в миллилитрах в литры, но оставить граммы в молях
c. Перевести граммы в моли и перевести объем раствора из миллилитров в литры
d. Ничего из вышеперечисленного
7. Молярность водного раствора CaCl определяется как
a. моль CaCl на миллилитр раствора
b. граммов CaCl на литр воды
c. граммов CaCl на миллилитр раствора
d. моль CaCl на литр раствора
Ключ ответа
1. C
Молярность = моль растворенного вещества/литр раствора = 8/4 = 2
2. A
Сначала переведите 250 мл в литры, 250/1000 = 0,25, затем рассчитайте молярность = 5 моль/л. 0,25 литра = 20 M
0,25 литра = 20 M
3. C
Для раствора с молярностью 2 требуется 2 M N A OH на литр.
Итак, 4 X 2 = 8 M
4. A
Раствор с молярностью 1,5 M требует 1,5 моль Na на каждый литр растворителя.
1,5 моль Na на 1 л дает 1 л 1,5 М раствора
Следовательно, умножьте молярность желаемого раствора на требуемый конечный объем:
Для 4,5 л требуется 6,75 моль Na, так как 1,5(М)*4,5(л)=6,75 (моль).
5. C
6. C
7. D
Написано , Брайан Стокер, MA. 2014
Дата изменения: Пятница, 8 апреля 2022 г.
Предыдущий пост
Практика простых факторов — Практика с ответами
7 апреля 2014 г.
Следующая запись
PSB HOAE Словарные практические вопросы
9 апреля 2014 г.
суть лекции 10. В этой лекции мы рассмотрим молярность, единицы концентрации и процесс разбавления.
В этой лекции мы рассмотрим молярность, единицы концентрации и процесс разбавления.Сосредоточение решения — важная базовая концепция, которую вы должны хорошо знать, прежде чем мы начнем следующие несколько лекций по решениям. Другими словами, вы не сможете понять, как преобразовывать и использовать информацию о растворах, если мы сначала не обсудим единицы, в которых будет выражаться концентрация указанных растворов.
Существует пять основных способов описания концентрации растворов: 1) Молярность; 2) моляльность; 3) Весовой процент; 4) молярная доля; и 5) частей на миллион или миллиард. Вы должны знать значение каждого из этих терминов и, что более важно, как преобразовать их из одного в другой. Я добавил калькулятор конвертации внизу этой страницы, чтобы помочь вам проверить домашнюю работу и т. д. Но не слишком полагайтесь на него, так как он не будет доступен во время экзаменов.
Молярность: Молярность раствора рассчитывается путем деления молей растворенного вещества на литры раствора. Молярность обозначается заглавной «М».
Молярность обозначается заглавной «М».
Молярность = Моли растворенного вещества / литр раствора
Моляльность: Моляльность раствора рассчитывается путем деления молей растворенного вещества на килограммы растворителя. Моляльность обозначается строчной буквой «м». Когда мы публикуем публикации, мы часто выражаем концентрации в моляльности, потому что, в отличие от молярности, моляльность не зависит от температуры. Эта независимость облегчает ученым всего мира воспроизведение работы. Существует простой метод преобразования молярности в моляльность:
Вот простой пример:
Найдите моляльность 2,5 M H 2 SO 4 . Этот раствор имеет плотность 1,54 г/мл.
Шаг 1. Сделайте предположение. Предположим, у вас есть 1 л раствора. Это очень важный шаг, и количество раствора не указано, но вам нужно иметь конкретное количество для выполнения расчетов, и один литр является лучшим предположением для этой задачи.
Шаг 2. Найдите общую массу раствора. Умножьте 1 л на плотность (1,54 г/мл) на 1000 мл/л. Это дает 1540 граммов раствора.
Шаг 3. Рассчитайте граммы растворенного вещества. 2,5M означает 2,5 моля серной кислоты на один литр раствора. Переведите 2,5 моля в граммы. Молярная масса серной кислоты 98,09 г/моль. 2,5 моль Х 98,09 г/моль = 245,225 г серной кислоты.
Этап 4. Рассчитайте граммы растворителя. 1540 г раствора — 245,225 г растворенного вещества = 1294,775 г или 1,294775 кг растворителя
Шаг 5. Рассчитайте моляльность. 2,5 моля растворенного вещества / 1,294775 кг растворителя = 1,9 моляля H 2 SO 4
Весовой процент (или массовый процент): Весовой процент раствора рассчитывается путем деления массы одного растворенного вещества на общую массу раствора. Это могут быть граммы или килограммы, если единицы измерения обоих выражены одинаково. Затем коэффициент умножается на 100%. Весовой процент обозначается массовым %, а иногда и массовым %.
Мольная доля: Мольная доля одного растворенного вещества в растворе – это просто число молей этого растворенного вещества, деленное на общее количество молей всех растворенных веществ/растворителей. Мольная доля растворенного вещества i записывается как Xi.
Части на миллион (PPM) и Части на миллиард (PPB): «Части на» — это удобное обозначение, используемое для низких и очень низких концентраций. Вообще говоря, это очень похоже на весовые проценты — 1% по весу означает 1 грамм вещества на каждые 100 г образца и (хотя и очень редко) называется pph — части на сотню. Другие сокращения означают:
| ppm | частей на миллион (10 6 ) |
| частей на миллиард | частей на миллиард (10 9 ) |
| п.п. | частей на триллион (10 12 ) |
| ппк | части на квадрилион (10 15 ) |
ppq — это скорее теоретическая конструкция, чем полезное измерение, скорее всего, вы никогда не увидите его в действии. Части на миллион также могут быть выражены в миллиграммах на литр (мг/л).
Части на миллион также могут быть выражены в миллиграммах на литр (мг/л).
Для удобства этот рабочий лист позволяет вам выбирать различные единицы массы, объема и концентрации, а также выполняются необходимые преобразования для получения значения пустой ячейки в нужных единицах. Обратите внимание, что единицей молекулярной массы должен быть г/моль.
Серийное разведение:
Серийное разведение — это процесс, с помощью которого можно приготовить серию растворов, сохраняющих необходимое количество химикатов. Процесс использует каждое последовательно созданное решение в качестве исходного решения для следующего. Расчет очень прост. Уравнение:
Уравнение позволяет рассчитать, какая часть исходного раствора содержит нужное количество молей для более разбавленного раствора. Примечание. Вы можете переходить только от более высокой концентрации к более низкой. Вы не можете «концентрировать» раствор от меньшей концентрации к большей. В следующем видео более подробно показаны расчеты.
В следующем видео более подробно показаны расчеты.
Практические задачи:
Расчет молярности
Рабочий лист серийных разведений
Решения Практические задачи и ответы
Калькулятор молярности [с молярной формулой]
Создано Bogna Szyk и Filip Derma
Рассмотрено Steven Wooding и Jack Bowater
Последнее обновление: 14 марта 2022 г. Определение моля
Этот калькулятор молярности представляет собой инструмент для преобразования массовой концентрации любого раствора в молярную концентрацию (или пересчета граммов на мл). к кротам). Вы также можете рассчитать массу вещества, необходимую для достижения желаемой молярности. Эта статья предоставит вам определение молярности и формулу молярности 9.0030 .
к кротам). Вы также можете рассчитать массу вещества, необходимую для достижения желаемой молярности. Эта статья предоставит вам определение молярности и формулу молярности 9.0030 .
Чтобы понять тему в целом, вам нужно будет узнать определение моля, прочитать абзац о единицах молярности, а также прочитать сравнение двух вводящих в заблуждение понятий: формула молярности против формулы моляльности. Более того, мы подготовили для вас несколько интересных примеров молярных растворов и краткое пошаговое руководство по расчету молярности концентрированного раствора .
В конце вы можете узнать определение титрования и узнать, как найти молярную концентрацию с помощью процесса титрования, что может быть полезно при проведении титрования!
Молярная концентрация – введение
Оглядевшись вокруг, даже если вы сидите дома, вы заметите множество различных объектов. Большинство этих материалов — , а не чистый . На самом деле это смеси.
Смеси состоят из набора различных соединений . Иногда количество элементов может быть довольно большим, а иногда и очень низким, но если в объекте более одного элемента, это смесь. Апельсиновый сок в вашем стакане, чашка чая, моющие средства в ванной или молоко — все эти вещества являются смесями.
Смеси не ограничиваются только жидкостями, твердые вещества и газы могут быть смесями; даже биологические организмы представляют собой очень сложные смеси молекул, газов и ионов, растворенных в воде.
В химии есть два типа смесей:
Гомогенные смеси – Компоненты равномерно распределены по всей смеси, наблюдается только одна фаза вещества . Они также известны как растворы и могут находиться в твердом, жидком или газообразном состоянии. это невозможно просто разделить компоненты смеси, но ни с одним из компонентов не произошло никаких химических изменений. Примеры: сахарная вода, средство для мытья посуды, сталь, жидкость для омывания ветрового стекла, воздух.

Гетерогенные смеси – Компоненты смеси распределены неравномерно и могут иметь участки с разными свойствами. Различные образцы смеси не идентичны . В смеси всегда присутствует не менее двух фаз , а это обычно можно физически разделить на . Несколько примеров таких веществ: кровь, бетон, кубики льда в коле, пицце, Тихий океан.
Концентрация является одним из наиболее известных и наиболее важных параметров для всех, кто работает с любыми химическими веществами или реакциями. Он измеряет, сколько вещества растворено в данном объеме раствора.
Химики используют множество различных единиц для описания концентрации. Однако термин молярность , также известная как молярная концентрация , является наиболее распространенным способом выражения концентрации. Когда реагенты (соединения) выражены в моль единиц, это позволяет записывать их целыми числами в химических реакциях. Это помогает легко работать с их суммами. Во-первых, давайте подробнее рассмотрим, что такое моль , чтобы мы могли двигаться дальше, чтобы выяснить, что такое молярность.
Это помогает легко работать с их суммами. Во-первых, давайте подробнее рассмотрим, что такое моль , чтобы мы могли двигаться дальше, чтобы выяснить, что такое молярность.
Определение моля
моль является единицей измерения количества вещества в системе СИ. Нынешнее определение было принято в 1971 и основан на углероде-12. В нем говорится:
«Моль — это количество вещества в системе, которая содержит столько элементарных частиц, сколько атомов содержится в 0,012 кг углерода-12; его символ — «моль». Когда используется моль, элементарная объекты должны быть указаны и могут быть атомами, молекулами, ионами, электронами, другими частицами или определенными группами таких частиц».
Отсюда следует, что молярная масса углерода-12 составляет ровно 12 граммов на моль, M(¹²C) = 12 г/моль. Слово «вещество» в определении должно указывать (заменяться названием) вещества, о котором идет речь в конкретном применении, например, количество хлорида (HCl) или количество диоксида углерода (CO₂). Крайне важно всегда давать точное описание вовлеченного объекта (как отмечено во второй части определения крота). Это должно быть сделано путем предоставления эмпирической химической формулы рассматриваемого соединения.
Крайне важно всегда давать точное описание вовлеченного объекта (как отмечено во второй части определения крота). Это должно быть сделано путем предоставления эмпирической химической формулы рассматриваемого соединения.
В соответствии с новейшими соглашениями (вступившими в силу с 20 th мая 2019 г.) определение моля состоит в том, что моль — это количество химического вещества, которое содержит точно 6,02214076 × 10 23 частиц, таких как атомы , молекулы, ионы и т.д. Это число известно как константа Авогадро . Его символ — NA или L . Использование числа Авогадро обеспечивает удобный способ учета веса вещества и теоретического выхода химических реакций. Моли позволяют напрямую считать вес из таблицы Менделеева (например, 1 моль N₂ равен 28 г или 1 моль NaCl равен 58,5 г).
Мы можем связать количество объектов X в заданной выборке – N(X), с количеством молей X в той же выборке – n(X), соотношением: n(X) = N(X)/ NA . N(X) безразмерно, а n(X) имеет единицу моля в системе СИ.
N(X) безразмерно, а n(X) имеет единицу моля в системе СИ.
Что такое молярность?
Чтобы вас не запутали схожие химические термины, имейте в виду, что молярность означает точно такое же, как молярная концентрация (М) . Молярность выражает концентрацию раствора. Определяется как количество молей вещества или растворенного вещества, растворенных в литре раствора (не на литр растворителя!). молярность раствора раствора, выраженная в единицах плотности (обычно г/л или г/мл).
Молярная масса – это масса 1 моля растворенного вещества. Выражается в граммах на моль. Это постоянное свойство каждого вещества — например, молярная масса воды примерно равна 18 г/моль.
Наш калькулятор также может найти массу вещества, которое необходимо добавить в раствор для получения желаемой молярной концентрации, по формуле:
масса / объем = концентрация = молярность * молярная масса
где масса — масса растворенного вещества (вещества) в граммах, а объем — общий объем раствора в литрах.
Молярность имеет множество применений. Одним из них является расчет разбавления раствора.
Единицы молярности
Единицы молярной концентрации: моль на кубический дециметр . Они обозначаются как моль/дм³ , а также M (произносится как «моль»). Молярную концентрацию растворенного вещества иногда сокращают, заключая в квадратные скобки химическую формулу растворенного вещества, например, концентрацию анионов гидроксида можно записать как [OH⁻]. Во многих старых книгах или статьях вы можете найти различные единицы измерения молярных растворов – 9.0099 моль на литр (моль/л) . Помните, что один кубический дециметр равен одному литру, поэтому эти два обозначения выражают одни и те же числовые значения.
Раньше химики использовали концентрацию как вес растворенного вещества/объем . В настоящее время, поскольку моль стала наиболее распространенным способом указания количества химического вещества, вместо него обычно используется молярность.
Обратите внимание, что молярность довольно часто можно спутать с термином молярность . Моляльность обычно пишется строчными буквами 9.0099 м , а молярность (о чем было сказано выше) с большой буквы М . Мы объясним разницу между этими двумя в параграфе ниже.
Молярность также играет важную роль при расчете ионной силы раствора.
Как рассчитать молярность
- Выберите вещество . Предположим, что это соляная кислота (HCl).
- Найдите молярную массу вашего вещества. Для соляной кислоты он равен 9.0029 36,46 г/моль .
- Определите массовую концентрацию вашего вещества – вы можете либо ввести ее напрямую, либо заполнить поля для массы вещества и объема раствора. Предположим, что у вас есть 5 г HCl в 1,2-литровом растворе .
- Преобразуйте приведенные выше выражения, чтобы получить формулу молярности. Так как
масса/объем = молярность * молярная масса, томасса/(объем * молярная масса) = молярность.
- Подставить известные значения для расчета молярности:
молярность = 5 / (1,2 * 36,46) = 0,114 моль/л = 0,114 M. - Вы также можете использовать этот калькулятор молярности, чтобы найти массовую концентрацию или молярную массу. Просто введите оставшиеся значения и посмотрите, как он сделает всю работу за вас.
Молярность против моляльности
Давайте рассмотрим различия между этими двумя химическими понятиями с одинаковыми названиями: молярность и молярность . Надеемся, что после прочтения этого абзаца у вас не останется сомнений по поводу этой темы.
Оба термина используются для выражения концентрации раствора, но между ними есть существенная разница. В то время как молярность описывает количество вещества на единицу объема раствора, моляльность определяет концентрацию как количество вещества на единицу массы растворителя . Другими словами, моляльность — это количество молей растворенного вещества (растворенного материала) на килограмм растворителя (в котором растворено растворенное вещество).
Возможен пересчет из молярности в моляльность и наоборот. Чтобы сделать этот сдвиг, используйте следующую формулу:
молярность = (моляльность * массовая_плотность_раствора) / (1 + (моляльность * молярная_масса_растворенного вещества))
Молярный раствор – примеры из жизни
Как вы уже знаете, смеси и растворы всегда окружают нас, и они являются постоянной частью окружающей среды. В таблице ниже вы можете найти список порядков молярной концентрации с примерами, взятыми из естественной среды.
В таблице ниже вы можете найти список порядков молярной концентрации с примерами, взятыми из естественной среды.
| Молярность | Префикс СИ | Значение | Товар |
|---|---|---|---|
| 10⁻¹⁵ | FM | 2 FM | Бактерии в поверхностной морской воде (1×10⁹/л) |
| 10⁻¹⁴ | – | 50–100 фМ | [Золото](расчет:531) в морской воде |
| 10⁻¹² | пМ | 19:51–21:80 | [Норма](расч.:472) диапазон эритроцитов в крови взрослого мужчины |
| 10⁻⁷ | – | 101 нМ | Ионы гидроксония и гидроксида в чистой воде при 25 °C | г.
| 10⁻⁴ | – | 180–480 мкМ | Нормальный диапазон для [мочевой кислоты](расч.:755) в [крови](расч.:760) |
| 10⁻³ | мМ | 7,8 мМ | Верхний предел для здорового [глюкозы в крови] (расчет: 737) через 2 часа после еды |
| 10⁻² | см | 44,6 мМ | Чистый [идеальный газ] (расчет: 435) при 0 °C и 101,325 кПа |
| 10⁻¹ | дМ | 140 мМ | г.[Ионы натрия в плазме крови](расчет:822) |
| 10² | чМ | 118,8 М | Чистый осмий при 20 °C (22,587 г/см³) |
| 10⁴ | чМ | 24 км | [Гелий](расчет:975) в солнечном ядре (150 г/см³ * 65%) |
Определение молярной концентрации титрованием
Титрование – это метод, с помощью которого можно найти концентрацию неизвестного раствора , основанный на его химической реакции с раствором известной концентрации. Этот процесс основан на добавлении титранта (с известной концентрацией и объемом) к известному количеству неизвестного раствора (аналита) до завершения реакции. Затем вы можете определить концентрацию аналита, измерив объем использованного титранта.
Выполните следующие действия, чтобы определить молярность неизвестного раствора методом титрования:
- Приготовьте концентрации – Поместите аналит в колбу Эрленмейера, а титрант в бюретку.

- Смешайте концентрации – Добавляйте титрант к аналиту до тех пор, пока не будет достигнута конечная точка. Вы можете найти этот момент, наблюдая за изменением цвета. Используйте для этой цели кислотно-щелочной индикатор. Если вы использовали фенолфталеин, вы заметите изменение цвета с розового на бесцветный.
- Рассчитайте молярность – Используйте формулу титрования. Если соотношение титранта и аналита составляет 1:1, используйте уравнение:
молярность_кислоты * объем_кислоты = молярность_основания * объем_основания.
Для соотношений, отличных от 1:1, необходимо изменить формулу.
Пример: Для титрования 25 мл раствора NaOH требуется 35 мл 1,25 М соляной кислоты. В этом случае вы можете использовать формулу 1:1, потому что один моль HCl реагирует с одним молем NaOH. Затем умножьте молярность кислоты на объем кислоты – 1,25 * 35 = 43,75 и результат на объем основания. Молярность основания равна
Молярность основания равна 43,75 / 25 = 1,75 М .
Вы также можете определить молярную концентрацию раствора, используя закон Бера–Ламберта–Бугера.
Обязательно ознакомьтесь с нашим аллигационным калькулятором, если вам интересно узнать, как получить различные концентрации раствора.
Часто задаваемые вопросы
Как рассчитать pH по молярности?
- Рассчитайте концентрацию кислотного/щелочного компонента вашего раствора.
- Рассчитайте концентрацию H + или OH — в вашем растворе, если ваш раствор кислый или щелочной, соответственно.
- Расчет -log[H + ] для кислых растворов . Результат – рН.
- Для щелочных растворов найдите -log[OH — ] и вычтите его из 14.
Как приготовить молярный раствор?
- Найдите молекулярную массу вещества, из которого вы хотите приготовить молярный раствор, в г/моль.

- Умножьте молекулярную массу вещества на количество молей , которое вы хотите получить, что в данном случае равно 1.
- Взвесьте количество граммов, которое вы подсчитали на шаге 2 вашего вещества, и поместите его в контейнер.
- Отмерьте 1 литр выбранного вами растворителя и добавьте его в тот же контейнер. Теперь у вас есть молярный раствор .
Что такое молярный объем?
Молярный объем равен объему, который занимает один моль вещества при определенной температуре и давлении. Его находят путем деления молярной массы на плотность вещества при данной температуре и давлении.
Как найти родинки по молярности?
- Найдите молярность и объем вашего раствора.
- Убедитесь, что единицы измерения объема такие же, как и объемной части молярности (например, мл и моль/мл).
- Умножьте объем на молярность.
 Это количество присутствующих родинок.
Это количество присутствующих родинок.
Соответствует ли молярность концентрации?
Молярность не совпадает с концентрацией , хотя они очень похожи . Концентрация является мерой того, сколько молей вещества растворено в количестве жидкости, и может иметь любые единицы измерения объема. Молярность — это тип концентрации, а именно молей на литр раствора.
Как приготовить молярный раствор?
- Найдите молекулярную массу вещества, из которого вы хотите приготовить молярный раствор, в г/моль.
- Умножьте молекулярную массу вещества на количество молей , которое вы хотите получить, что в данном случае равно 1.
- Взвесьте количество граммов, которое вы подсчитали на шаге 2 вашего вещества, и поместите его в контейнер.
- Отмерьте 1 литр выбранного вами растворителя и добавьте его в тот же контейнер.
 Теперь у вас есть молярный раствор .
Теперь у вас есть молярный раствор .
Какова молярность воды?
Вода имеет молярность 55,5 М . 1 литр воды весит 1000 г, а молярность это число молей на литр; Найти молярность воды — это то же самое, что найти количество молей воды в 1000 г. Поэтому мы делим вес на молярную массу, чтобы получить моли, 1000 / 18,02 = 55,5 M.
Почему мы используем молярность?
Молярность является полезной мерой для использования при обсуждении концентрации . Поскольку концентрация имеет широкий диапазон размеров единиц, от нанограммов на миллилитр до тонн на галлон, она составляет проще иметь известную метрику для быстрого сравнения концентраций без необходимости заниматься преобразованиями. Это молярность (М), то есть количество молей на литр.
Bogna Szyk and Filip Derma
Molar Mass
г/моль
Концентрация
Молярность
Масса вещества
Объем
Проверьте 37.
Моли и расчет молярности | Аптечная математика — это просто!
Что такое молярность?
При работе с растворами в лабораторных условиях мы часто выражаем концентрацию одним из следующих способов:
- Объем/объемные проценты | (об./об.)%
- Масса/объем в процентах | (м/об)%
- Частей на миллион | ppm
- Молярность | М или моль/л
Вслед за предыдущей статьей из этой серии , теперь мы обратим внимание на один из наиболее распространенных способов выражения концентрации – с использованием молярности.
Молярность , иногда называемая молярной концентрацией, определяется как концентрация вещества в растворе, выраженная в молях растворенного вещества на литр раствора. Моляр (символ М или моль/л) — это единица, используемая для выражения молярных концентраций. Раствор с концентрацией 1 М имеет 1 моль вещества, растворенного в 1 л растворителя.
- 1 М NaCl в воде = 1 моль NaCl на 1 литр воды.

- 1 моль/л NaCl в воде = 1 моль NaCl на 1 литр воды.
- 0,05 М щавелевой кислоты в ацетоне = 0,05 моль щавелевой кислоты на 1 л ацетона
- 0,05 моль/л щавелевой кислоты в ацетоне = 0,05 моль щавелевой кислоты на 1 л ацетона
- 0,03 М аспирин в этаноле = 0,03 моля аспирина на 1 литр этанола.
- 0,03 моль/л аспирина в этаноле = 0,03 моль аспирина на 1 литр этанола.
Как рассчитать молярность:
Как правило, в лабораторных условиях, таких как академические, нередко приходится работать с объемами растворителя менее литра по соображениям здоровья и безопасности, а также для сокращения затрат. В таких случаях известные количества химического вещества растворяют в объемах менее одного литра, а концентрацию обычно выражают в молярности (М или моль/л). Обратите внимание, что некоторые используют M и моль / л взаимозаменяемо.
Теперь мы рассмотрим несколько примеров, чтобы попытаться помочь вам понять, как рассчитать молярность и как выполнять расчеты с молярностью. Для этого вам понадобится периодическая таблица элементов.
Для этого вам понадобится периодическая таблица элементов.
Задача 1:
«0,02 моль D-ксилозы растворили в 160 мл воды. Выразите концентрацию в моль/л».
Соотношение между молярностью, молями и объемом показано ниже.
где M = молярность (M или моль/л), n = количество молей (моль) и v = объем (л).
Шаг 1:
Определите, какую формулу использовать.
Нам дали количество молей вещества и объем используемого растворителя. Мы не знаем концентрации в молях. Чтобы решить Задачу 1, нам нужно будет использовать Формулу 1.
Шаг 2:
Преобразование единиц.
Количество молей D-ксилозы уже выражено в молях, поэтому здесь нет необходимости выполнять какие-либо преобразования. С другой стороны, объем растворителя выражается в мл, поэтому нам нужно будет преобразовать объем из мл в л.
160 мл воды = 0,160 л воды.
Шаг 3:
Используйте Формулу 1.
Теперь, когда мы используем правильные единицы измерения, мы можем теперь использовать Формулу 1 для определения концентрации в молярности.
Ответ на задачу 1:
Концентрация водного раствора D-ксилозы 0,125 моль/л или 0,125 М.
Задача 2:
«Неизвестное количество противогрибкового миконазол (структура и химическая формула приведены ниже) растворяли в 50 мл растворителя с образованием раствора с концентрацией 0,001 М. Определить массу миконазола, использованного для приготовления указанного раствора, в миллиграммах».
C 18 H 14 C l4 N 2O
Шаг 1:
4
Нам дали объем и концентрацию. Мы не знаем количество родинок. По этой причине нам нужно будет использовать формулу 2 для определения количества молей используемого миконазола. Используя соотношение между массой, молями и молекулярной массой, мы можем позже преобразовать число молей в массу (см. предыдущую статью).
предыдущую статью).
Шаг 2:
Преобразование единиц.
Концентрация уже выражена в M, поэтому нам не нужно делать здесь никаких преобразований. С другой стороны, объем растворителя выражается в мл, поэтому нам нужно будет преобразовать объем из мл в л.
50 мл растворителя = 0,050 л растворителя.
Шаг 3:
Используйте Формулу 2.
Теперь, когда мы используем правильные единицы измерения, мы можем использовать Формулу 1 для определения количества молей.
Шаг 4:
Преобразование молей в массу
Напомним из предыдущей статьи, что связь между молями и массой выглядит следующим образом:
молекулярная масса миконазола определена как 416,13 г/моль. Теперь, когда мы знаем как количество молей миконазола, так и его молекулярную массу, мы можем теперь использовать приведенную выше формулу для определения массы миконазола, используемого для образования 0,001 М раствора.
Шаг 5:
Преобразование граммов в миллиграммы.
Нас попросили выразить массу в мг.
0,0208 г = 20,8 мг
Ответ на задачу 2:
20,8 мг миконазола растворяли в 50 мл растворителя с образованием раствора с концентрацией 0,001 М.
Задача 3:
стажер приготовил раствор цис-(-)-карвеола (152,24 г/моль), компонента масла мяты колосовой, для поляриметрических исследований. Учитывая, что 2200 мг цис-(-)-карвеола растворяли в 20 мл растворителя с образованием вышеупомянутого раствора, выразите концентрацию раствора, приготовленного стажером, в молярности (М)».Шаг 1:
Определите, какие формулы использовать.
Вспомните взаимосвязь между массой, молями и молекулярной массой. Заданы объем растворителя, масса и молекулярная масса цис-(-)-карвеола. Мы не знаем концентрации в молях. По этой причине нам нужно будет использовать формулу 1. Однако нам дана масса, а не число молей. По этой причине нам нужно будет преобразовать массу в моли, используя одну из формул, показанных в предыдущей статье.
По этой причине нам нужно будет преобразовать массу в моли, используя одну из формул, показанных в предыдущей статье.
Шаг 2:
Преобразование единиц.
Все формулы, которые нам нужны для решения этой задачи, требуют массы и объема в граммах (г) в литрах (л) соответственно.
2200 мг цис-(-)-карвеола = 2,2 г цис-(-)-карвеола.
20 мл растворителя = 0,020 л растворителя.
Шаг 3:
Используйте формулы.
Преобразование массы в моли:
Использовать формулу 1:
Ответ на задание 3:
Из 2200 мг вещества, растворенных в 20 мл растворителя, обучаемый приготовил раствор цис-(-)-карвеола с концентрацией 0,725 моль/л для поляриметрических исследований.
Задача 4:
«Предположим, вам нужно приготовить 50 мл 25 мМ водного раствора KBr. Сколько KBr (в граммах) необходимо для образования 50 мл 25 мМ водного раствора KBr?»
Сколько KBr (в граммах) необходимо для образования 50 мл 25 мМ водного раствора KBr?»
Шаг 1:
Определите, какие формулы использовать.
Нам дали объем растворителя и концентрацию раствора. Мы не знаем требуемого количества KBr. По этой причине нам нужно будет использовать формулу 2. Используя соотношение между молями, молекулярной массой и массой, мы можем определить количество KBr, необходимое для образования 50 мл 25 мМ водного раствора KBr.
Нам не предоставили молекулярную массу KBr, поэтому нам нужно будет обратиться к периодической таблице, чтобы определить ее молекулярную массу, используя сумму атомных масс K и Br (работает как 1190,0 г/моль). Водный означает, что растворителем является вода.
Шаг 2:
Преобразование единиц измерения.
Преобразование из миллилитра в литр:
50 мл = 0,05 л
Преобразование из миллимолярного в моляр:
25 мм = 0,025 м
Шаг 3:
Используйте формы
.




 Определить
массовую долю вещества в растворе,
полученном смещением 300 г 25%-ного и 400 г
40%-ного (по массе) растворов этого
вещества
Определить
массовую долю вещества в растворе,
полученном смещением 300 г 25%-ного и 400 г
40%-ного (по массе) растворов этого
вещества Вычислите массовую долю и моляльную
концентрацию этого раствора, если
r=1,28 г/мл.
Вычислите массовую долю и моляльную
концентрацию этого раствора, если
r=1,28 г/мл.
 Из 1
л раствора действием соляной кислоты
выделено 33,6 л СО2.Вычислите
моляльную концентрацию раствора и
мольную долю соли.
Из 1
л раствора действием соляной кислоты
выделено 33,6 л СО2.Вычислите
моляльную концентрацию раствора и
мольную долю соли. Рассчитать массовую
долю и молярную долю соли в новом
растворе.
Рассчитать массовую
долю и молярную долю соли в новом
растворе.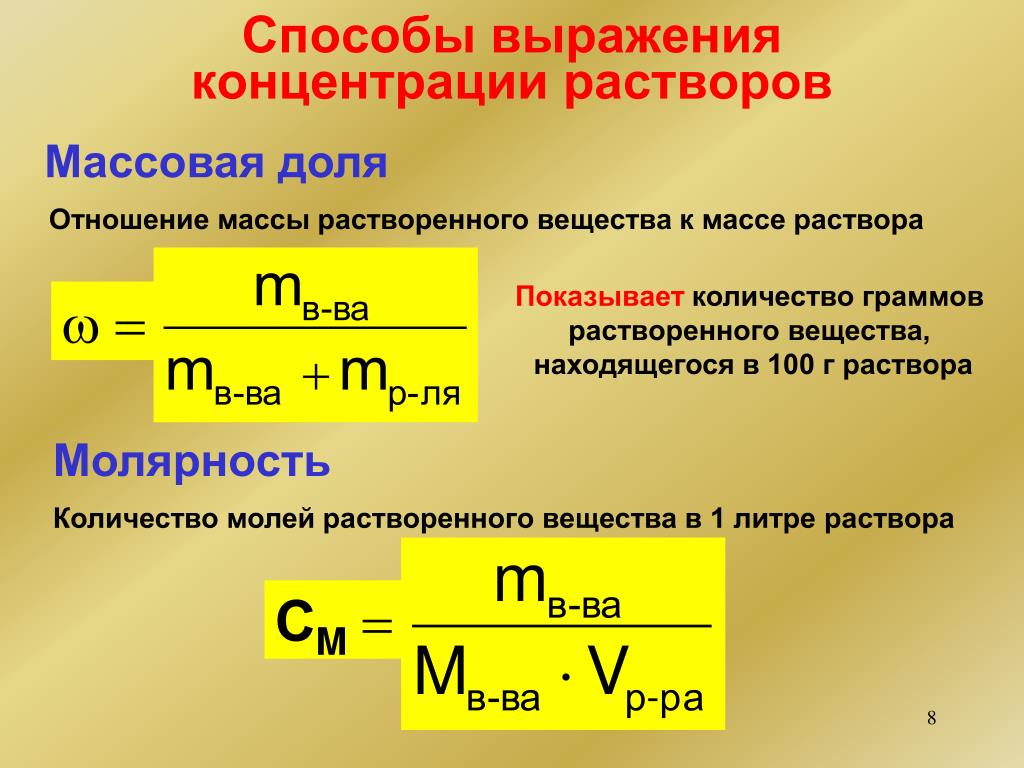
 org/contents/85abf193-2бд…
org/contents/85abf193-2бд…