что, как сбалансировать и часто задаваемые вопросы
ЧАС2SO4 + Zn(НЕТ3)2 показывает, как протекает реакция между H2SO4 и Zn(НЕТ3)2 это происходит. Обсудим, как Zn(NO3)2 реагирует с H2SO4 в этой статье.
Нитрат цинка [Zn(NO3)2] реагирует с серной кислотой [H2SO4] с образованием соли и кислоты. ЧАС2SO4 является кислотой и сильным обезвоживающий агент распространен в органической химии как дегидратор. Zn(НЕТ3)2 представляет собой бесцветное кристаллическое неорганическое соединение, растворимое как в спирте, так и в воде. Он содержится в его Zn (NO3)2.6H2О форма.
Эта статья поможет вам узнать об интересных фактах H2SO4 + Zn(НЕТ3)2, как энтальпия реакции, межмолекулярные силы и химическое уравнение следующим образом:
Что является произведением H2SO4 и Zn(НЕТ3)2Сульфат цинка (ZnSO4) и расширение Азотная кислота (HNO3) – продукты, образующиеся в H2SO4 + Zn(НЕТ3)2 реакция. Химическое уравнение реакции:
Химическое уравнение реакции:
Zn (НЕТ3)2 + H2SO4= ZnSO4 + ННО3
Какой тип реакции Н2SO4+ Zn(НЕТ3)2ЧАС2SO4 + Zn(НЕТ3)2 — это двойное смещение реакция.
Как сбалансировать H2SO4+ Zn(НЕТ3)2ЧАС2SO4 + Zn(НЕТ3)2 сбалансированное химическое уравнение,
Zn (НЕТ3)2 + H2SO4= ZnSO4 + 2ХНО3
- Неуравновешенное химическое уравнение для данной реакции имеет вид
- Zn (НЕТ3)2 + H2SO4= ZnSO4 + ННО3
- Проверить, одинаково ли число атомов, присутствующих в обеих частях химического уравнения, или нет.

- Атомы водорода, азота и кислорода не сбалансированы, что можно исправить, умножив коэффициент 2 на HNO.3.
- Таким образом, сбалансированное химическое уравнение для H2SO4 + Zn(НЕТ3)2 является,
- Zn (НЕТ3)2 + H2SO4= ZnSO4 + 2ХНО3
титрование из H2SO4 и Zn(НЕТ3)2 невозможно, так как H2SO4 является кислотой, но Zn (NO3)2 не является основанием и поэтому не может быть оттитрован серной кислотой.
H2SO4+ Zn(НЕТ3)2 чистое ионное уравнениеЧАС2SO4 + Zn(НЕТ3)2 результирующее ионное уравнение выглядит следующим образом;
Нет РеZn2+ (водн. ) + 2NO3– (водн.) + 2H+ (водн.) + SO42- (водн.) = Zn2+ (водн.) + SO42- (водн.) + 2H+ (водн.) + 2NO3– (водный)действие
) + 2NO3– (водн.) + 2H+ (водн.) + SO42- (водн.) = Zn2+ (водн.) + SO42- (водн.) + 2H+ (водн.) + 2NO3– (водный)действие
Чтобы получить результирующее ионное уравнение, необходимо выполнить следующие шаги:
- Напишите общее сбалансированное молекулярное уравнение.
- Zn (НЕТ3)2 + H2SO4= ZnSO4 + 2ХНО3
- Укажите для каждого соединения его химическое состояние, например твердое, жидкое или газообразное.
- Zn (НЕТ3)2 (водн.) + Н2SO4(водн.) = ZnSO4 (водн.) + 2HNO3(водный)
- Разложите электролитические соединения на их ионные формы..
- Устраните ионы-наблюдатели, присутствующие с обеих сторон химического уравнения.
 В нашем случае все ионы являются ионами-спектаторами; следовательно, это случай отсутствия реакции.
В нашем случае все ионы являются ионами-спектаторами; следовательно, это случай отсутствия реакции.
Н2SO4 + Zn(НЕТ3)2 не образует сопряженной пары,
- Сопряженная пара HNO3 является его сопряженным основанием NO3–.
- Сопряженная пара H2SO4 состоит из Н2SO4 и его сопряженное основание HSO4–.
ЧАС2SO4 + Zn(НЕТ3)2 реакция имеет следующие межмолекулярные силы,
- Компания межмолекулярные силы между ZnSO4 являются ионными связями.
- H2SO4 молекулы содержат водородные связи между их молекулами.

- Диполь-диполь и Лондонские дисперсионные силы присутствуют между HNO3 молекулы.
ЧАС2SO4 + Zn(НЕТ3)2 энтальпия реакции -4.27 кДж/моль. стандартная энтальпия образования для реагентов и продуктов выглядит следующим образом:
| Молекулы | Энтальпия реакции (кДж/моль) |
|---|---|
| ЧАС2SO4 | -909.27 |
| Zn (НЕТ3)2 | -563.89 |
| ZnSO4 | -1063.16 |
| HNO3 | -207.36 |
Следовательно, ∆fH: (Стандартная энтальпия образования продуктов) – (Стандартная энтальпия образования реагентов)
ΔfГ: [-1063. 16 – 207.36] – [-909.27 – 563.89]
16 – 207.36] – [-909.27 – 563.89]
ΔfН: -4.27 кДж/моль
Н2SO4+ Zn(НЕТ3)2 буферный растворЧАС2SO4 + Zn(НЕТ3)2 не буферный раствор потому что буферный раствор содержит слабую кислоту с сопряженным основанием, но здесь H2SO4 является сильной кислотой.
Н2SO4+ Zn(НЕТ3)2 полная реакцияЧАС2SO4 + Zn(НЕТ3)2 является завершенной реакцией, и дальнейший процесс не остается.
Н2SO4+ Zn(НЕТ3)2 экзотермическая или эндотермическая реакцияЧАС2SO4 + Zn(НЕТ3)2 является экзотермической реакцией, потому что ее энтальпия реакции имеет небольшое, но отрицательное значение.
ЧАС2SO4 + Zn(НЕТ3)2 не окислительно-восстановительный потенциал реакция. Степени окисления соединений в ходе реакции не изменялись.
Н2SO4+ Zn(НЕТ3)2 реакция осажденияЧАС2SO4 + Zn(НЕТ3)2 не является реакцией осаждения. Все образующиеся продукты находятся в водном состоянии.
Н2SO4+ Zn(НЕТ3)2 обратимая или необратимая реакцияЧАС2SO4 + Zn(НЕТ3)2 является необратимой реакцией при нормальных условиях температуры и давления.
Н2SO4+ Zn(НЕТ3)2 реакция смещенияЧАС2SO4 + Zn(НЕТ3)2 это двойное смещение или реакция метатезиса солей. H2 и Zn вытесняют друг друга из соответствующих соединений с образованием новых продуктов.
H2 и Zn вытесняют друг друга из соответствующих соединений с образованием новых продуктов.
В этой статье делается вывод, что ZnSO4 представляет собой ионное соединение, образующееся в ходе реакции H2SO4 и Zn(НЕТ3)2. Ионное уравнение H2SO4 + Zn(НЕТ3)2 не существует, так как все компоненты находятся в водном состоянии. Образующуюся в итоге азотную кислоту следует тщательно отделить.
Контрольна робота 1 9 клас
Запитання 1
У якому з наведених варіантів рівняння дисоціації речовини записане ПРАВИЛЬНО:
варіанти відповідей
Al2(SO4)3 = 3Al3+ + 2SO42-
Al2(SO4)3 = 2Al+3 + 2SO42-
Ba(OH)2 = Ba2+ + 2OH—
Ba(OH)2 = Ba2+ + 2OH-2
Запитання 2
За кількістю і складом реагентів і продуктів реакції, хімічні реакції поділяють на. ..
..
варіанти відповідей
необоротні і оборотні
окисно- відновні, без зміни ступенів окиснення елементів
екзотермічні, ендотермічні
сполучення, розкладу, заміщення, обміну
Запитання 3
Укажіть реакцію заміщення, що належить до ендотермічних:
варіанти відповідей
MnO2 + 2C = Mn + 2CO; ΔΗ = +293 кДж
2CO + O2 = 2CO2; ΔΗ = -282 кДж
H2O + C = CO + H2; ΔΗ = -132 кДж
SiO2 + 2Mg = Si + 2MgO; ΔΗ = +392 кДж
Запитання 4
Окисно-відновні — це реакції, в яких…
варіанти відповідей
не змінюється ступінь окиснення елементів
змінюється ступінь окиснення елементів
визначення реакцій не повязано зі ступенем окиснення елементів
Запитання 5
Укажіть ступінь окиснення елемента в простій речовині:
варіанти відповідей
позитивний і дорівнює номеру групи елемента:
негативний і дорівнює номеру групи елемента — 8
Запитання 6
Укажіть ступінь окиснення Мангану в калій перманганаті KMnО4:
варіанти відповідей
Запитання 7
Виберіть електронні рівняння, де зображений процес відновлення:
варіанти відповідей
Mn+7 + 5е = Mn+2
2Cl-1 — 2е = Cl20
Al+3 + 3е = Al0
Cr+3 — 3е = Cr+6
Запитання 8
Установіть кількість електронів, що беруть участь у процесі, який відображено схемою: Мn+4 → Mn+7:
варіанти відповідей
Запитання 9
Максимальний ступінь окиснення Сульфуру
варіанти відповідей
Запитання 10
В ході хімічної реакції відновник
варіанти відповідей
приєднує електрони і його ступінь окиснення збільшується
приєднує електрони і його ступінь окиснення зменшується
віддає електрони і його ступінь окиснення збільшується
віддає електрони і його ступінь окиснення зменшується
Запитання 11
Урівняйте рівняння з допомогою електронного балансу.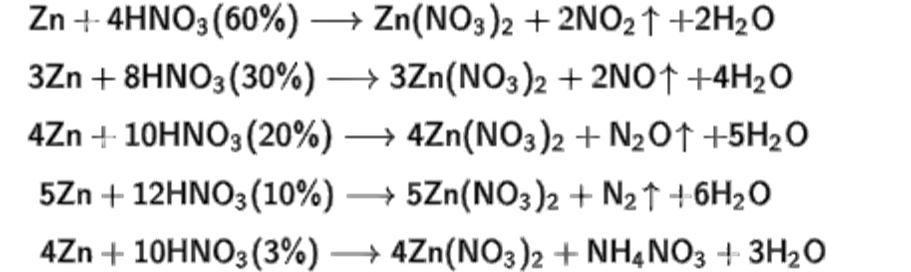 Вкажіть суму коефіцієнтів в рівнянні Zn + HNO3(k) = Zn(NO3)2 + H2O + N2
Вкажіть суму коефіцієнтів в рівнянні Zn + HNO3(k) = Zn(NO3)2 + H2O + N2
Фото надіслати.
варіанти відповідей
Запитання 12
Обери правильнi твердження
варіанти відповідей
На швидкiсть хiмiчних реакцiй впливають концентрації реагентів.
Природа реагентiв майже не впливає на швидкiсть хiмiчних реакцiй
На швидкість хімічних реакцій впливає ступiнь подрiбнення твердих речовин.
На швидкiсть хiмiчних реакцiй впливає тiльки природа реагентiв
Запитання 13
Термохімічний розклад вапняку (кальцій карбонату) відбувається за термохімічним рівнянням
СаСО3(тв.) = СаО (тв.) + СО2(г.) : ∆Н = +180 кДж/моль
Обчисли кількість теплоти, що поглинається під час розкладу вапняку масою 300 г
Фото розв’язку надіслати.
варіанти відповідей
480 кДж
540 кДж
320 кДж
290 кДж
Запитання 14
Електролітична дисоціація – це процес . ……..
……..
варіанти відповідей
а) утворення розчину
б) дифузії
в) розпаду електролітів на йони
г) утворення диполю
Запитання 15
Виберіть лише катіони
варіанти відповідей
а) Mg2+
б) SO42-
в) Fе3+
г) Ni2+
д) NO3—
Запитання 16
У результаті дисоціації сульфатної кислоти утворюються йони:
варіанти відповідей
а) Cu2+ та SO42─
б) 2Н+ та SO42─
в) Н+ та SO32─
г) H+ та SO2—
Запитання 17
Виберіть правильне твердження до хімічного рівняння
AgNO3 + NaCl = AgCl↓ + NaNO3
варіанти відповідей
а) Реакція не відбувається
б) Реакція, яка відбувається з утворенням газу
г) Реакція, яка відбувається з утворенням осаду
д) Реакція, які відбувається з утворенням Н2О
Запитання 18
Електроліт має ступінь дисоціації 20%. Скільки молекул розпалося на йони з кожних 200 молекул?
Скільки молекул розпалося на йони з кожних 200 молекул?
варіанти відповідей
Запитання 19
Для виявлення йонів Ba2+ потрібно використати
варіанти відповідей
варіанти відповідей
AgNO3
Ba(OH)2
Запитання 20
Кислотне середовище
варіанти відповідей
pH = 7
pH > 7
pH < 7
Запитання 21
Яка з реакцій відповідає скороченому йонно-молекулярному рівнянню
Н+ + ОН– = Н2О?
варіанти відповідей
HCl + Cu(OH)2 = CuOHCl + H2O
HBr + KOH = KBr + H2O
2HNO3 + Fe(OH)2 = Fe(NO3)2 + 2H2O
H2SO3 + RbOH = RbHSO3 + H2O
Запитання 22
Обери формули речовин, які є сильними електролітами:
варіанти відповідей
H2SiO3
Zn3(PO4)2
Zn(NO3)2
Cr(OH)3
Запитання 23
Оберіть ряд сполук, утворений лише речовинами-електролітами
варіанти відповідей
C6H12O6, CO2, HBr, KOH
H2SO4, LiOH, CaCl2, HNO3
H2S, Mn2O7, Sn(NO3)2, AlCl3
NaOH, H2O, H3PO4, KCl
Запитання 24
У якому середовищі фенолфталеїн має малинове забарвлення?
варіанти відповідей
нейтральне
будь-яке
Запитання 25
До індикаторів належить:
варіанти відповідей
лакмус
фенолфталеїн
кухонна сіль
метиловий оранжевий
правильної відповіді немає
Запитання 26
Виберіть твердження, яке визначає масову частку розчиненої речовини в розчині як відношення:
варіанти відповідей
маси розчину до його об’єму
маси розчиненої речовини до маси розчину
маси розчину до маси розчиненої речовини
маси розчиненої речовини до маси розчинника
Запитання 27
Як називається однорідна суміш змінного складу?
варіанти відповідей
розчин
розчинник
розчинена речовина
масова частка
Запитання 28
Реакціцї йонного обміну відбуваються до кінця, якщо
варіанти відповідей
випадає осад
виділяється газ
утворюється малодисоційована речовина — вода
утворюються розчинні речовини
Створюйте онлайн-тести
для контролю знань і залучення учнів
до активної роботи у класі та вдома
Створити тест
Натисніть «Подобається», щоб слідкувати за оновленнями на Facebook
Координационные ансамбли Zn(NO3)2 с 4-пирполи-2-еном и поликарбоксилатами: структурная диверсификация и фотолюминесцентные свойства
Координационные ансамбли Zn(NO
3 ) 2 с 4-пирполи-2-еном и поликарбоксилатами: структурная диверсификация и фотолюминесцентные свойства†Донг Лю* и Ю Ге, и Ни-Я Ли, и Вэй Ма и и Сяо-Ян Тан* б
Принадлежности автора
* Соответствующие авторы
и Колледж химии и материаловедения Хуайбэйского педагогического университета, Хуайбэй 235000, КНР
 edu.cn
edu.cn Факс: +86-561-3806281
б Школа химии и материаловедения, Технологический институт Чаншу, Чаншу 215500, Цзянсу, КНР
Электронная почта: [email protected]
Аннотация
Five zinc coordination polymers, {[Zn 2 (1,4-BDC) 2 (ppene)]·2H 2
O} n ( 1 ), {[Zn(CCN)(ппен)]·H 2 O} n ( 2 ), {[Zn(5-Me-1,3-BDC)(ppene)]·2H 2 O} n ( 3 ), {[ZN 2 (5-NH 2 -1,3-BDC) 2 (PPENE)] · 3H 2 (PPENE)] · 3H 2 7777777777 (PPENE)]] · 3H 2 777777 (PPENE)]] · 3H 2 (PPENE)]] · 3H 2 (PPENE)]. O} n ( 4 ) и [Zn 2 (BTA)(H 2 BTA)9(Hppene)0054 2
O} n ( 4 ) и [Zn 2 (BTA)(H 2 BTA)9(Hppene)0054 2  Соединение 1 демонстрирует трехмерную тройную взаимопроникающую сеть pcu с символом Шлефли 4 12 6 3 . 2 показывает шестикратный взаимопроникающий каркас с 6 6 топологией алмазоида. 3 представляет собой лестничную 2D (4,4) сеть. 4 отображает двумерный (3,4)-связный каркас с символом Шлефли (6 3 )(6 5 8). 5 содержит сложный трехмерный (3,4,6)-связанный супрамолекулярный каркас, основанный на взаимном соединении двумерных координационных полимеров посредством взаимодействий водородных связей. Супрамолекулярный каркас соединения 5 denotes a point symbol of (4·8 2 ) 2 (6 4
Соединение 1 демонстрирует трехмерную тройную взаимопроникающую сеть pcu с символом Шлефли 4 12 6 3 . 2 показывает шестикратный взаимопроникающий каркас с 6 6 топологией алмазоида. 3 представляет собой лестничную 2D (4,4) сеть. 4 отображает двумерный (3,4)-связный каркас с символом Шлефли (6 3 )(6 5 8). 5 содержит сложный трехмерный (3,4,6)-связанный супрамолекулярный каркас, основанный на взаимном соединении двумерных координационных полимеров посредством взаимодействий водородных связей. Супрамолекулярный каркас соединения 5 denotes a point symbol of (4·8 2 ) 2 (6 4  Также были исследованы термостабильность и фотолюминесцентные свойства этих пяти координационных полимеров в твердом состоянии.
Также были исследованы термостабильность и фотолюминесцентные свойства этих пяти координационных полимеров в твердом состоянии.Zn(NO3)2·2h3O (Zn[NO3]2[h3O]2) Кристаллическая структура — SpringerMaterials
Получить доступ СИФ Скачать справку (pdf)
У вас нет доступа к этому содержимому
Опции доступа
Дополнительные опции доступа
- Свяжитесь с нами, если вам нужна помощь в доступе к этому контенту
- Узнайте об институциональных подписках
Просмотр трехмерной интерактивной структуры
Цитировать эту страницу
- Цитата
Кристаллографические данные
Параметры ячейки
Стандартизированные данные | ||||
|---|---|---|---|---|
| Космическая группа | У вас нет доступа к этому контентуОпции доступаДополнительные опции доступа
| |||
| и | ||||
| б | ||||
| с | ||||
| α | ||||
| β | ||||
| γ | ||||
| а/б | ||||
| б/к | ||||
| к/с | ||||
| В | ||||
Координаты атома
Стандартизированный
У вас нет доступа к этому содержимомуПараметры доступаДополнительные возможности доступа
| |||||||||
Опубликовано
У вас нет доступа к этому контентуОпции доступаДополнительные опции доступа
| |||||||
Параметры смещения
изотропный
У вас нет доступа к этому контентуОпции доступаДополнительные опции доступа
| |||
Анизотропный
У вас нет доступа к этому контентуОпции доступаДополнительные опции доступа
| ||||||
Детали эксперимента
У вас нет доступа к этому содержимому
Опции доступа
Дополнительные опции доступа
- Свяжитесь с нами, если вам нужна помощь в доступе к этому контенту
- Узнайте об институциональных подписках
Справка
У вас нет доступа к этому содержимому
Опции доступа
Дополнительные опции доступа
- Свяжитесь с нами, если вам нужна помощь в доступе к этому контенту
- Узнайте об институциональных подписках
3D интерактивная структура
У вас нет доступа к этому контенту
Опции доступа
Дополнительные опции доступа
- Свяжитесь с нами, если вам нужна помощь в доступе к этому контенту
- Узнайте об институциональных подписках
Об этом контенте
PAULING FILE Multinaries Edition – 2012 г.
sd_1713507
© Springer и система данных о фазах материалов (MPDS), Швейцария и Национальный институт материаловедения (NIMS), Япония, 2016 г.
Пьер Виллар, Система данных о фазах материалов (MPDS), CH-6354 Вицнау, Швейцария
вилларс[email protected]
Цитировать этот контент
Пьер Виллар (главный редактор), PAULING FILE in: Inorganic Solid Phases,
SpringerMaterials (онлайн-база данных), Springer, Гейдельберг (ред.


 В нашем случае все ионы являются ионами-спектаторами; следовательно, это случай отсутствия реакции.
В нашем случае все ионы являются ионами-спектаторами; следовательно, это случай отсутствия реакции.