Вариант №22
Федеральное агентство по образованию ВПО «Вологодский государственный технический университет» | ||
КОНТРОЛЬНАЯ РАБОТА
ПО ХИМИИ
Студент группы ЗСА-11: Старков В.А.
Шифр: №08033215031
Адрес: г.Вологда, ул.Ленинградская д.66 кв.303
Вологда
2010
22. 4,086 10–3 кг металла вытесняют из кислоты 1,4 л водорода, измеренного при н.у. Эта же масса металла вытесняет 12,95 10
 Вычислите эквивалентную массу свинца.
Вычислите эквивалентную массу свинца.РЕШЕНИЕ
Дано: m (Me) = 4,086 10–3 кг m (Pb) = 12,95 10–3 кг V (H2) = 1,4 л mэкв (Pb) = ? | N2 + O2 → 2NO 1). Найдем количество вещества 0,5×1021 молекул азота: 2). По уравнению реакции из 1 моль азота образуется 2 моль оксида азота (II). Следовательно, из 8,3×10-4 моль образуется 1,66×10 -3 моль оксида азота (II). 3). |
Ответ: | V (NO) = 0,037 л |
72. Исходя из степени окисления атомов соответствующих элементов, дайте мотивированный ответ на вопрос: какой из двух гидроксидов является более сильным основанием: СuOH или Сu(ОН)2; Fe(ОН)2 или Fe(ОН)3; Sn(ОН)2 или Sn(ОН)4? Напишите уравнения реакций, доказывающих амфотерность гидроксида олова (II).
РЕШЕНИЕ
С увеличением степени окисления увеличиваются кислотные свойства гидроксидов металлов. Следовательно, более сильными основаниями являются:
А) более сильное основание СuOH (степень окисления меди +1), а более слабое основание Сu(ОН)2 (степень окисления меди +2)
Б) более сильное основание Fe(ОН)2 (степень окисления железа +2), а более слабое основание Fe(ОН)3 (степень окисления железа +3)
В) более сильное основание Sn(ОН)2 (степень окисления олова +2), а более слабое основание Sn(ОН)4 (степень окисления олова +4)
Уравнения реакций, доказывающих амфотерность гидроксида олова (II):
Sn(ОН)2 + 2HCl → SnCl2 + H2O
Хлорид олова (II)
Sn(ОН)2 + 2KOH → K2[Sn(OH)4]
Тетрагидроксостаннит калия
122.
 Рассчитайте δh ZnSo4, если известно, что:
Рассчитайте δh ZnSo4, если известно, что:2ZnS + 3O2 = 2ZnO + 2SO2, ΔH= –890,0 кДж;
2SO2 + O2 = SO3, ΔH = –196,6 кДж;
ZnSO4 = ZnO + SO3, ΔH = +234,0 кДж.
Решение
3078,5
Теплота образования сульфата цинка представляет собой изменение энтальпии при реакции образования 1 моля этого соединения из простых веществ.
Так как невозможно провести прямую реакцию образования сульфата цинка из цинка, кислорода и серы:
Zn
то вычислить теплоту образования этого соединения можно из тепловых эффектов других (промежуточных) реакций, ведущих в конечном итоге к его образованию:
2ZnS + 3O2 → 2ZnO + 2SO2, ΔH = –890,0 кДж;
2SO2 + O2 → 2SO3, ΔH = –196,6 кДж;
ZnSO4 → ZnO +
SO3, ΔH =
+234,0 кДж.
Последнюю реакцию для удобства можно записать по-другому:
ZnO + SO3 → ZnSO4, ΔH = -234,0 кДж.
Сумма тепловых эффектов соответствующих реакций, в эквимолярном соотношении, и с учетом реакции образования сульфида цинка, будет численно равна теплоте образования сульфата цинка:
S + Zn → ZnS, ΔH = –205,4 кДж;
ZnS + 3/2O2 → ZnO + SO2, ΔH = –445,0 кДж;
SO2 + ½ O2 → SO3, ΔH = –98,3 кДж;
ZnO +
SO3
Следовательно, равно:
172. Исходные концентрации азота и водорода в реакции N2 + 3H2 → 2NH3 были (моль/л): [N2] =2, [H2] = 8. К моменту наступления равновесия прореагировало 10% исходного количества азота. Вычислить давление газовой смеси в этот момент, если температура ее была 5000С.
Сульфат цинка, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип
=-269°C3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
{2 + }}\] окисляется C.\[CuS{O_4}\] ионизируется D.\[CuS{O_4}\] гидролизуетсяДата последнего обновления: 13 февраля 2023 г.
•
Всего просмотров: 258k
•
Просмотров сегодня: 6,47k
Ответ
Verified
258k+ просмотров
Подсказка: Это реакция замещения, когда сульфат меди и цинк реагируют с сульфатом меди. Это также окислительно-восстановительная реакция, потому что степень окисления меди изменяется от +2 до 0, а степень окисления цинка изменяется от 0 до +2.
Полный пошаговый ответ:
Если нам дан ряд реактивности или даже если мы знаем об этом, мы будем знать, что цинк более активен, чем медь. Таким образом, когда цинк погружают в раствор сульфата меди, будучи более реакционноспособным, чем медь, цинк легко вытесняет медь из раствора сульфата меди и образует собственную соль, то есть сульфат цинка, который можно увидеть в виде осадка на дне стакана.
Такие реакции называются реакциями замещения. В этих реакциях более активный металл замещает менее активный металл из своей соли и образует собственный солевой раствор. Цвет раствора меняется с синего цвета сульфата меди на зеленый сульфата цинка, и мы можем видеть слой сульфата цинка возле куска металла.
Мы можем понять механизм этой реакции по движению электронов. Электроны с поверхности цинка переносятся на ионы меди (II) в растворе. При очень небольшом количестве цинка мы получаем частичное восстановление Cu(II) до Cu(I), но при добавлении большого количества цинка медь осаждается на поверхности электрода.
Давайте теперь разберемся с окислительно-восстановительной реакцией. В окислительно-восстановительной реакции одно соединение восстанавливается, а другое окисляется. Здесь мы можем записать химическую реакцию как 9- }\]
Следовательно, правильный вариант (A).
Примечание: Электролиз водного раствора сульфата меди приводит к переносу металлической меди с анода на катод, и мы говорим, что сульфат меди ионизируется в водном растворе, а ионы остаются такими же, как и в растворе.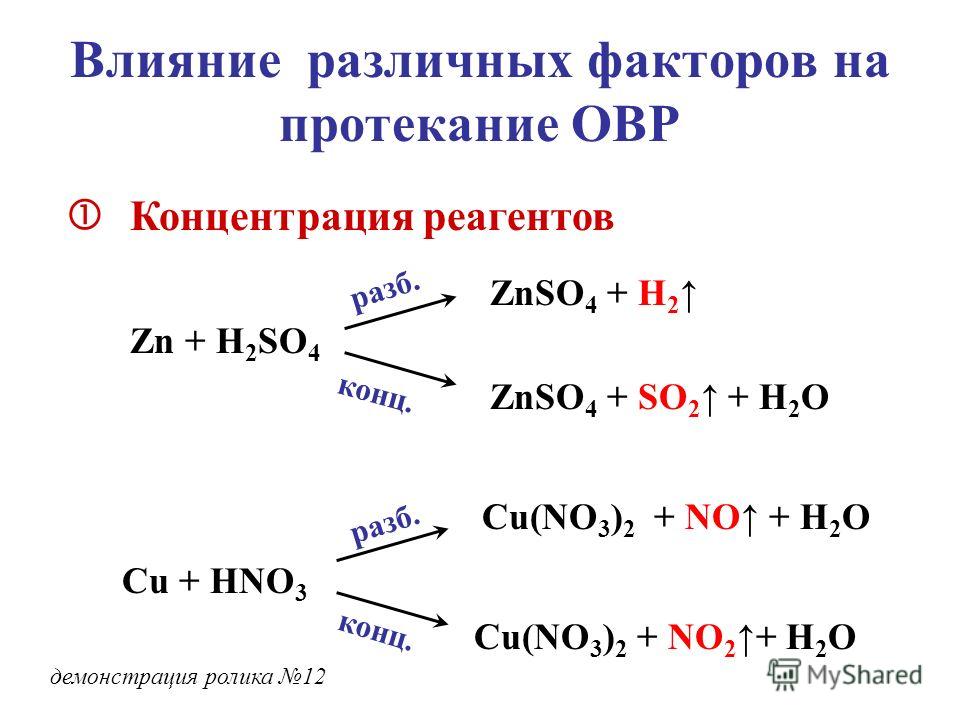 Гидролиз сульфата меди невозможен, так как он уже имеет кислотную природу.
Гидролиз сульфата меди невозможен, так как он уже имеет кислотную природу.
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53967
Золото и серебро широко используются для изготовления ювелирных изделий. Одна из причин, по которой эти металлы используются для этой цели, заключается в том, что они очень нереакционноспособны. Они не вступают в реакцию при контакте с большинством других металлов, поэтому с большей вероятностью сохранят целостность в сложных условиях. Никто не хочет, чтобы его любимое украшение развалилось!
Прямые окислительно-восстановительные реакции
Когда полоску металлического цинка помещают в синий раствор сульфата меди (II) (рисунок ниже), сразу же начинается реакция, когда полоска цинка начинает темнеть.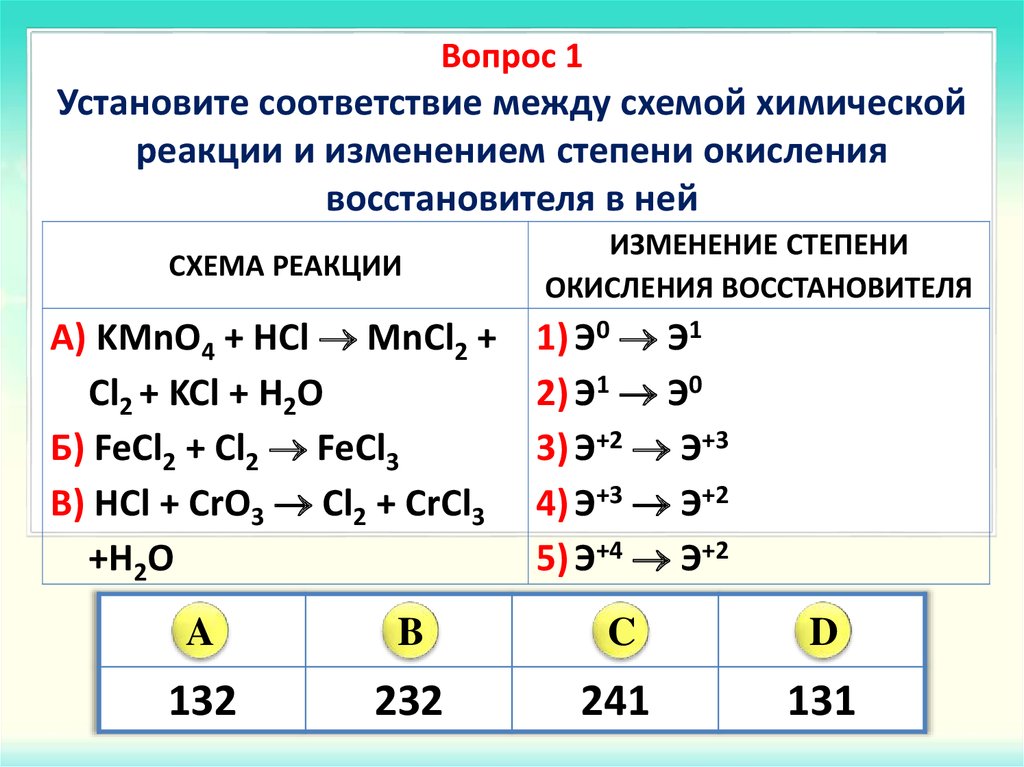 Если оставить в растворе на более длительный период времени, цинк будет постепенно распадаться из-за окисления до ионов цинка. В то же время ионы меди (II) из раствора восстанавливаются до металлической меди (см. второй рисунок ниже), что приводит к обесцвечиванию синего раствора сульфата меди (II). 9{2+}} \left( aq \right) + \ce{Cu} \left( s \right) \end{array}\nonumber \]
Если оставить в растворе на более длительный период времени, цинк будет постепенно распадаться из-за окисления до ионов цинка. В то же время ионы меди (II) из раствора восстанавливаются до металлической меди (см. второй рисунок ниже), что приводит к обесцвечиванию синего раствора сульфата меди (II). 9{2+}} \left( aq \right) + \ce{Cu} \left( s \right) \end{array}\nonumber \]
Почему эта реакция протекает самопроизвольно? Ряд активности представляет собой список элементов в порядке убывания реактивности. Элемент, стоящий выше в ряду активности, способен вытеснить элемент, стоящий ниже в ряду, в реакции однократного замещения. В этой серии также перечислены элементы в порядке легкости окисления. Элементы наверху окисляются легче всего, а элементы внизу — труднее всего. В таблице ниже показаны ряды активности вместе с полуреакцией окисления каждого элемента. 9-}\)
Обратите внимание, что цинк указан выше меди в ряду активности. это означает, что цинк легче окисляется, чем медь. Вот почему ионы меди (II) могут действовать как окислитель при контакте с металлическим цинком. Ионы любого металла с содержанием ниже цинка, например свинца или серебра, окислят цинк в аналогичной реакции. Эти типы реакций называются прямыми окислительно-восстановительными реакциями , потому что электроны перетекают непосредственно от атомов одного металла к катионам другого металла. Однако никакой реакции не произойдет, если полоску металлической меди поместить в раствор ионов цинка, потому что ионы цинка не способны окислять медь. Другими словами, такая реакция неспонтанна.
Вот почему ионы меди (II) могут действовать как окислитель при контакте с металлическим цинком. Ионы любого металла с содержанием ниже цинка, например свинца или серебра, окислят цинк в аналогичной реакции. Эти типы реакций называются прямыми окислительно-восстановительными реакциями , потому что электроны перетекают непосредственно от атомов одного металла к катионам другого металла. Однако никакой реакции не произойдет, если полоску металлической меди поместить в раствор ионов цинка, потому что ионы цинка не способны окислять медь. Другими словами, такая реакция неспонтанна.
Резюме
- Приведен ряд активности металлов.
- Описаны параметры самопроизвольных реакций между металлами.
Эта страница под названием 23.1: Прямые окислительно-восстановительные реакции распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.

 Вычислим, какой
объем занимает данное количество
вещества:
Вычислим, какой
объем занимает данное количество
вещества: