| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Определить кислотность pH | 0.76M(HCl)(solution) | |
| 4 | Найти массу одного моля | H_2O | |
| 5 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 6 | Найти массу одного моля | H | |
| 7 | Найти число нейтронов | Fe | |
| Найти число нейтронов | Tc | ||
| 9 | Найти конфигурацию электронов | H | |
| 10 | Найти число нейтронов | Ca | |
| 11 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 12 | Найти число нейтронов | C | |
| 13 | Найти число протонов | H | |
| 14 | Найти число нейтронов | O | |
| 15 | Найти массу одного моля | CO_2 | |
| 16 | Баланс | (a+b/c)(d-e)=f | |
| 17 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 18 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 19 | Найти атомную массу | H | |
| 20 | Определить, растворима ли смесь в воде | H_2O | |
| 21 | Найти конфигурацию электронов | Na | |
| 22 | Найти массу одного атома | H | |
| 23 | Найти число нейтронов | Nb | |
| 24 | Найти число нейтронов | Au | |
| 25 | Найти число нейтронов | Mn | |
| 26 | Найти число нейтронов | Ru | |
| 27 | Найти конфигурацию электронов | O | |
| 28 | Найти массовую долю | H_2O | |
| 29 | Упростить | корень пятой степени 243 | |
| 30 | Определить, растворима ли смесь в воде | NaCl | |
| 31 | Найти эмпирическую/простейшую формулу | H_2O | |
| 32 | Найти степень окисления | H_2O | |
| 33 | Найти конфигурацию электронов | K | |
| 34 | Найти конфигурацию электронов | Mg | |
| 35 | Найти конфигурацию электронов | Ca | |
| 36 | Найти число нейтронов | Rh | |
| Найти число нейтронов | Na | ||
| 38 | Найти число нейтронов | Pt | |
| 39 | Найти число нейтронов | Be | Be |
| 40 | Найти число нейтронов | Cr | |
| 41 | Найти массу одного моля | H_2SO_4 | |
| 42 | Найти массу одного моля | HCl | |
| 43 | Найти массу одного моля | Fe | |
| 44 | Найти массу одного моля | C | |
| 45 | Найти число нейтронов | Cu | |
| 46 | Найти число нейтронов | S | |
| 47 | Найти степень окисления | H | |
| 48 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 49 | Найти атомную массу | O | |
| 50 | Найти атомное число | H | |
| 51 | Найти число нейтронов | Mo | |
| 52 | Найти число нейтронов | Os | |
| 53 | Найти массу одного моля | NaOH | |
| 54 | Найти массу одного моля | O | |
| 55 | Найти конфигурацию электронов | H | |
| 56 | Найти конфигурацию электронов | Fe | |
| 57 | Найти конфигурацию электронов | C | |
| 58 | Найти массовую долю | NaCl | |
| 59 | Найти массу одного моля | K | |
| 60 | Найти массу одного атома | Na | |
| 61 | Найти число нейтронов | N | |
| 62 | Найти число нейтронов | Li | |
| 63 | Найти число нейтронов | V | |
| 64 | Найти число протонов | N | |
| 65 | Вычислить | 2+2 | |
| 66 | Упростить | H^2O | |
| 67 | Упростить | h*2o | |
| 68 | Определить, растворима ли смесь в воде | H | |
| 69 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 70 | Найти степень окисления | NaCl | |
| 71 | Найти степень окисления | H_2O | |
| 72 | Найти атомную массу | He | He |
| 73 | Найти атомную массу | Mg | |
| 74 | Вычислить | (1.0*10^-15)/(4.2*10^-7) | |
| 75 | Найти число электронов | H | |
| 76 | Найти число электронов | O | |
| 77 | Найти число электронов | S | |
| 78 | Найти число нейтронов | Pd | |
| 79 | Найти число нейтронов | Hg | |
| 80 | Найти число нейтронов | B | |
| 81 | Найти массу одного атома | Li | |
| 82 | Найти массу одного моля | H_2O | |
| 83 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 84 | Найти число протонов | Be | Be |
| 85 | Найти массу одного моля | Na | |
| 86 | Найти конфигурацию электронов | Co | |
| 87 | Найти конфигурацию электронов | S | |
| 88 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 89 | Баланс | H_2+O_2→H_2O | |
| 90 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 91 | Найти конфигурацию электронов | P | |
| 92 | Найти конфигурацию электронов | Pb | |
| 93 | Найти конфигурацию электронов | Al | |
| 94 | Найти конфигурацию электронов | Ar | |
| 95 | Найти массу одного моля | O_2 | |
| 96 | Найти массу одного моля | H_2 | |
| 97 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 98 | Найти число нейтронов | K | |
| 99 | Найти число нейтронов | P | |
| 100 | Найти число нейтронов | Mg |
www.mathway.com
CaCO3, степень окисления углерода и др элементов
Общие сведения о карбонате кальция и степени окисления в CaCO3
Брутто-формула – CaCO3. Молярная масса равна – 100,09 г/моль.

Рис. 1. Карбонат кальция. Внешний вид.
Практически не растворяется в воде. Разлагается кислотами, хлоридом аммония в растворе. Переводится в раствор избытком диоксида углерода: в результате образуется гидрокарбонат кальция (Ca(HCO3)2), который определяет временную жесткость природных вод.
CaCO3, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав карбоната кальция, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Степень окисления кальция постоянна и равна номеру группы Периодической системы Д.И. Менделеева, в которой он расположен со знаком плюс (кальций – металл), т.е. (+2).
Степень окисления кислорода в составе кислот, а, следовательно, и их остатков равна (-2). Для нахождения степени окисления углерода примем её значение за «х» и определим его при помощи уравнения электронейтральности:
(+2) + х + 3× (-2) = 0;
2 + х — 6 = 0;
x – 4 = 0;
x = +4.
Степень окисления углерода в карбонате кальция равна (+4):
Ca+2C+4O-23.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
какова степень окисления у h3CO3
она просто о*уительная !!!
В Н2СО3 степени окисления: Р (1+), С (4+) ,О (2-)
У водорода +1,у SO3 -2
именно чего степень окисления? водород +1 кислород -2 углерод +4
В Н2СО3 степени окисления: Р (1+), С (4+) ,О (2-)
touch.otvet.mail.ru
CCl4, степень окисления углерода и хлора в нем
Общие сведения о четыреххлористом углероде и степени окисления в CCl4
Плотность – 1,5954 г/см3. Брутто-формула – CCl4 (строение молекулы изображено на рис. 1). Молярная масса равна 153,82 г/моль.
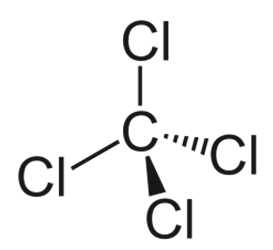
Рис. 1. Строение молекулы тетрахлорметана.
Нерастворим в воде, однако при нагревании в этом тетрахлорметана в этом растворителе до температуры равной 250oC подвергается гидролизу. Смешивается со многими органическими растворителями.
CCl4, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав тетрахлорметана, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Тетрахлор метан – это галогенпроизводное метана, в котором все атомы водорода были замещены на атомы хлора. Это означает, что степени окисления углерода в метане и тетрахлорметане равны.
Метан – это соединение углерода с водородом, которое по сути представляет собой гидрид углерода. Как известно, степень окисления водорода в гидридах неметаллов равна (+1). Для нахождения степени окисления углерода примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 4×(+1) = 0;
x +4 = 0;
x = -4.
Степень окисления углерода в метане равна (-4), значит и в тетрахлорметане имеет такое же значение:
С—4Cl+14.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
степень окисления K2SO4 и СaSO3. помагите пожалуйста) напишите степень окисления в скобках))
Степень окисления определить достаточно легко. Нужно помнить что: 1) молекула всегда электронейтральна, т. е. в ней количество плюсов = количеству минусов. 2) у многих химических элементов степень окисления одна во всех соединениях. Например у кислорода практически всегда в сложных веществах степень ок-я равна -2. У водорода чаще всего +1. Для металлов степень окисления можно посмотреть в верхней строчке таблицы растворимости. Там же можно найти и степень окисления неметаллов, входящих в состав бескислородных кислот — сульфид-ион -2, фторид-, хлорид-, бромид- и иодид-ионы -1. Теперь собственно ваши примеры. 1)Сульфат калия. В таблице растворимости находим калий, у него заряд +1. У кислорода, как говорилось выше, -2. Ищем степень ок-я серы, помня что в молекуле кол-во +=кол-ву -. Калия в молекуле 2, кислорода 4. Значит уже есть два плюса калия (2*(+1)) на восемь минусов кислорода (4*(-2)). Не хватает шести плюсов, их даст сера. Проверяйте: 8 плюсов (+2+6)= 8 минусов (4*(-2)) Итог: калий (+1), сера (+6), кислород (-2). 2) Сульфиткальция. В таблице растворимости находим кальций, у него заряд +2. У кислорода, как говорилось выше, -2. Ищем степень ок-я серы, помня что в молекуле кол-во +=кол-ву -. Кальция в молекуле 1, кислорода 3. Значит уже есть два плюса кальция (1*(+2)) на шесть минусов кислорода (3*(-2)). Не хватает четыре плюса, их даст сера. Проверяйте: 6 плюсов (+2+4)= 6 минусов (3*(-2)) Итог: кальций (+2), сера (+4), кислород (-2). Ещё два примерчика от меня 1) КНСО3 По таблице растворимости смотрим калий- (+1), водород (+1). Кислород – (-2). Считаем: (+1)+(+1) + х — количество плюсов, 3*(-2)=-6 – т. е. минусов будет 6. 2+х=6 Значит степень ок-я углерода в гидрокарбонате калия (+4). 2) бромид железа (!!!) – ГеВч3 У железа степень ок-я может быть (+2) и (+3). Степень ок-я брома в бромидах (по таблице растворимости) (-1). Кол-во плюсов (+х) должно быть равно кол-ву минусов. Ионов брома исходя из формулы – три. Значит и минусов будет три, т. к. (3*(-1)). Значит степень ок-я железа должна быть (+3). Надеюсь, это поможет вам в дальнейшем самостоятельно определять степень ок-я в любых веществах. Удачи!
В сульфате калия: калий +1, сера +6, кислород -2. В сульфите кальция: кальций +2, сера +4, кислород -2.
touch.otvet.mail.ru
