Существует несколько способов выражения концентрации растворов — Мегаобучалка
Молярная концентрация, или молярность (СM)– количество вещества (ν) растворенного компонента, содержащееся в 1 литре (дм3) раствора:
[моль/л], (14)
Молярная концентрация эквивалентов (Сэкв), (нормальная концентрация или нормальность N) – количество вещества эквивалентов (νэкв) растворенного компонента, содержащееся в 1 литре (дм3) раствора:
Сэкв (N) = νэкв/ V [моль-экв/л] (15)
Моляльная концентрация или моляльность (b) – количество вещества (ν) растворенного компонента в 1 кг раствора:
[моль/кг], (16)
Массовая доля (ω) – отношение массы растворенного вещества (mр.в.) к массе раствора (mр-ра) Ее рассчитывают, выражая в долях единицы или в процентах. Массовая доля, выраженная в процентах, называется
(17)
Процентная концентрация показывает массу растворенного вещества, содержащегося в 100 г раствора. Например, ω(KOH) = 3% означает, что в 100 г этого раствора содержится 3 г KOH и 97 г H2O.
Молярная доля (Ni) – отношение количества вещества растворенного компонента (nв-ва) (или растворителя, nр-ля) к суммарному количеству вещества всех компонентов раствора. Например, в системе, состоящей из растворителя и одного растворенного вещества, молярная доля растворенного вещества равна:
, (18)
Молярная доля растворителя:
(19)
Примеры решения задач
Пример 1. Определить молярную концентрацию раствора NaOH с массовой долей 10% и плотностью r =1,1 г/см3.
Р е ш е н и е. 1) Записываем выражение для молярной концентрации раствора NaOH :
2) 10%-ный раствор – это 10гNaOH в 100г раствора. Находим количество вещества NaOH, содержащееся в 10 г:
, mNaOH = 10 г, MNaOH = 23 + 16 +1 = 40 г/моль
, т.е. 0,25 моль NaOH содержится в 100 г раствора.
3) Находим объем раствора массой 100 г:
m=V×r, = 0,091 л
4) Рассчитываем молярную концентрацию:
Ответ: молярная концентрация раствора гидроксида натрия с массовой долей 10% составляет 2,74 моль/л
Пример 2. Найти молярную долю растворенного вещества в растворе сахарозы с массовой долей 67%.
Р е ш е н и е. 1) Вспомним, что молярная доля растворенного вещества равна:
67%-ный (по массе) раствор означает, что в 100 г раствора содержится 67 г сахарозы и 33 г воды.
2) Определяем количество вещества сахарозы и количество вещества воды:
nв-ва = 67/342 = 0,196 моль, nр-ля = 33/18 = 1,83 моль
Следовательно, молярная доля сахарозы равна:
Ответ: молярная доля сахарозы в растворе сахарозы с массовой долей 67% составляет 0,097.
Пример 3. Какой объем серной кислоты с массовой долей 96% (плотностью 1,84 г/см3) и какую массу воды нужно взять для приготовления 100 мл 15%-ного (по массе) раствора H2SO4 (r = 1,10 г/см3).
Р е ш е н и е. 1) Найдем массу 100 мл 15% раствораH2SO4:
mH2SO4-р-ра = V×r = 100×1,10 =110 г
2) Из формулы массовой доли находим массу серной кислоты, содержащейся в этом растворе:
; mH2SO4 =
3) Найдем массу 96% раствора, содержащего 16,5 г H2SO4:
4) Находим объем 96 %-ного раствора серной кислоты:
Ответ: для приготовления 100мл 15%-ного раствора H2SO4 потребуется 9,3 мл 96%-ного раствора серной кислоты и 110 – 16,5 = 93,5 г воды.
Коллоидные растворы
Дисперсные системы — это системы, состоящие как минимум из двух веществ, одно из которых измельчено и распределено в другом.
То вещество, которое образует в дисперсной системе сплошную фазу, называют дисперсионной средой,а то, что распределено в среде – дисперсной фазой.Гомогенные дисперсные системы называют истинными растворами или просто растворами. Линейные размеры их частиц не превышают размеров отдельных ионов и молекул – до 1 нм. Гетерогенные дисперсные системы подразделяются на
Коллоидные системы, дисперсионная среда которых жидкость, называются коллоидными растворами или золями. Их можно рассматривать как частный случай истинных растворов. Дисперсная фаза – это растворенное вещество, а дисперсионная среда – растворитель.
Для получения коллоидных растворов используются любые реакции, в результате которых образуются труднорастворимые соединения:
FeCl3 + 3H2O = Fe(OH)3↓ + 3HCl (20)
AgNO3 + KI = AgI↓ +KNO3 (21)
Ba(Cl)2 + Na2SO4 = BaSO4↓+ 2NaCl (22)
Структурной единицей коллоидного раствора является мицелла – это отдельная частица дисперсной фазы с жидкой дисперсионной средой. Рассмотрим образование мицеллы на примере реакции (21). Избыток одного из компонентов действует как стабилизатор коллоидного раствора, то есть как вещество, препятствующее агрегации коллоидных частиц в более крупные и выпадению их в осадок.
Пусть в избытке будет азотнокислое серебро. Труднорастворимый AgI образует кристаллический агрегат, состоящий из m молекул AgI. Агрегат адсорбирует на поверхности ионы Ag+, находящиеся в избытке. Они придают агрегату положительный заряд и называются потенциалопределяющими ионами.Агрегат и потенциалопределяющие ионы образуют ядро (m AgI) n Ag+. С заряженной поверхностью ядра устойчиво связано некоторое число ионов противоположного знака – противоионов –(n-x)NO3–. Потенциалопределяющие ионы и связанные противоионы образуют адсорбционный слой. Агрегат вместе с адсорбционным слоем называется гранулой или коллоидной частицей. Она имеет электрический заряд, совпадающий с зарядом потенциалопределяющего иона (х+). В состав коллоидной частицы входит только часть имеющихся в растворе противоионов. Остальные противоионы
Строение мицеллы золя иодида серебра имеет вид:
ядро
{[mAgI]nAg+(n-x)NO3—}x+ ∙ xNO3—
агрегат адсорбционный диффузионный
слой слой
Если в растворе избыток KI, то мицелла будет иметь вид:
{[mAgI]nI—(n-x)K+ }x— ∙ xK+
Строение мицеллы золя сульфата бария, полученного по реакции (22) с избытком хлорида бария: {[m BaSO4] n Ba2+ 2(n-x)Cl—}2x+ 2xCl—
Строение мицеллы золя Fe(OH)3: {[m (FeOH)3] nFe3+ 3(n-x)Cl— }3x+ 3xCl—
Устойчивость– способность коллоидных систем сохранять свое состояние и свойства неизменными с течением времени. Различают два вида устойчивости: кинетическую (седиментационную) и агрегативную. Кинетическая устойчивость характеризует способность частиц дисперсной фазы оставаться во взвешенном состоянии благодаря интенсивному броуновскому движению. Агрегативная устойчивость характеризует способность частиц дисперсной фазы противостоять их агрегации, т.е. укрупнению и слипанию. Это обусловлено наличием одноименного электрического заряда частиц дисперсной фазы, вызывающего их взаимное отталкивание. Устойчивость золя можно нарушить, устранив одноименный заряд коллоидных частиц. Это можно сделать при добавлении электролита. Потеря агрегативной устойчивости золя приводит к укрупнению частиц дисперсной фазы , их слипанию Этот процесс называют
Коагулирующим действием обладает тот ион, который заряжен противоположно частице. Коагулирующая способность электролита возрастает с увеличением заряда коагулирующего иона. Например, для золя иодида серебра коагулирущим действием будут обладать такие анионы, как Cl—, SO42-, PO43—. Из них наилучшим коагулирующим действием обладает ион PO43-. Процесс коагуляции начинается только после достижения определенной минимальной концентрации электролита, которая называется порогом коагуляции.
Примерный состав коагулята золей иодида серебра и гидроксида железа:
{[mAgI]nAg+ nNO3—}0 ,{ [m (FeOH)3] nFe3+ 3nCl— }0
Примеры решения задач
Пример 1. Золь иодида серебра AgI получен при добавлении к 0,02 л 0,01 М раствора KI 0,028 л 0,005М раствора AgNO3. Определите заряд частиц полученного золя и напишите формулу его мицеллы.
Д а н о: СKI = 0,01 моль/л; СAgNO3 = 0,005 моль/л, VKI = 0,02 л; V AgNO3 = 0,028 л.
Определить заряд полученного золя. Написать формулу мицеллы золя.
Р е ш е н и е. При смешении растворов AgNO3и KI
Определяем количество AgNO3 и KI, участвующих в реакции:
СVAgNO3= 0,005×0,028 = 1,4×10-4 моль
CVKI= 0,02×0,01 = 2,0×10-4 моль
Расчет показывает, что в растворе избыток KI, следовательно, ядром коллоидных частиц золя иодида серебра будут адсорбироваться ионы I– и частицы золя приобретают отрицательный заряд. Противоионами являются ионы К+. Формула мицеллы золя иодида серебра при условии избытка KI:
{[mAgI] nI– (n–x)K+}–x ×xK+
Пример 2. Какой объем 0,002 М раствора BaCl2 надо добавить к 0,03 л 0,0006 М раствора Al2(SO4)3, чтобы получить положительно заряженные частицы золя сульфата бария. Напишите формулу мицеллы золя BaSO4.
Д а н о: СBaCl2 = 0,002 моль/л; С Al2(SO4)3 = 0,0006 моль/л, V Al2(SO4)3= 0,03 л.
Найти VBaCl2. Написать формулу мицеллы золя.
Р е ш е н и е. Образование золя BaSO4 происходит в соответствии с уравнением реакции: 3BaCl2 + Al2(SO4)3 = 3BaSO4 + 2AlCl3
Если вещества участвуют в стехиометрическом соотношении, то справедливо соотношение: (CV)BaCl2 = (CV)Al2(SO4)3, следовательно
VBaCl2 =
Для получения положительных частиц золя BaSO4 в растворе должен быть избыток хлорида бария по сравнению с сульфатом алюминия. Значит, для реакции необходимо взять более 0,009 л 0,002М раствора BaCl2. Формула мицеллы золя сульфата бария: {[mBaSO4] ×nBa2+ 2(n-x)Cl– }2x+×2xCl–
Пример 3. Золь сульфида цинка был получен при взаимодействии растворов Zn(NO3)2 и Na2S. Определите, какой из электролитов был в избытке, если противоионы в электрическом поле движутся к аноду. Напишите формулу мицеллы золя.
Р е ш е н и е. Образование золя ZnS происходит в соответствии с уравнением реакции: Zn(NO3)2 + Na2S = ZnS + 2NaNO3
Анод – положительно заряженный электрод, к нему движутся отрицательно заряженные частицы. Значит противоионы мицеллы имеют отрицательный заряд, а сама мицелла заряжена положительно, что возможно при условии избытка Zn(NO3)2. На поверхности агрегата ZnS адсобируются потенциалопределяющие ионы Zn2+ (так как раствор Zn(NO3)2 в избытке), создавая таким образом положительный заряд мицеллы. Агрегат и потенциалопределяющие ионы образуют ядро, с которым связываются противоионы – NO3–.
Таким образом, в избытке был взят раствор Zn(NO3)2. Формула мицеллы золя иодида серебра при условии избытка Zn(NO3)2:
{[m ZnS ] ×nZn2+ 2(n-x)NO3–} 2x+×2xNO3–
megaobuchalka.ru
Как рассчитать молярность раствора Как? Так!
Содержимое:
4 метода:
Молярность описывает соотношение между молями растворенного вещества и объемом раствора. Чтобы получить подробное представление о том, как найти молярность раствора, когда даны моли, литры, граммы и/или миллилитры, читайте далее.
Шаги
Метод 1 Вычисление молярности, если даны моли и объем
- 1 Выучите основную формулу для вычисления молярности. Молярность равна количеству молей вещества, поделенному на объем раствора в литрах. Следовательно, ее можно записать в следующем виде: молярность = моли растворенного вещества / литры раствора
- Пример: какова молярность раствора, содержащего 0,75 моль NaCl в 4,2 литрах?
- 2 Проанализируйте пример. Нахождение молярности требует от вас знания количества молей и литров. Если в задаче даны оба этих значения, никаких предварительных расчетов делать не нужно.
- Пример:
- Моли = 0,75 моль NaCl
- Объем = 4,2 л
- Пример:
- 3 Разделите количество молей на количество литров. Получившееся соотношение даст вам количество молей на литр раствора, также известное как молярность.
- Пример: молярность = моли растворенного вещества / литры раствора = 0,75 моль / 4,2 л = 0,17857142
- 4 Запишите ответ. Округлите получившееся число до сотых или тысячных, в зависимости от требований вашего преподавателя. Когда вы записываете ответ, сокращайте «молярность» буквой «M» и указывайте химическую формулу растворенного вещества.
- Пример: 0,179 M NaCl
Метод 2 Вычисление молярности, если даны масса и объем
- 1 Выучите основную формулу для вычисления молярности. Молярность выражает отношение количества молей растворенного вещества к литрам раствора, или его объему. В виде формулы молярность выражается следующим образом: молярность = моли растворенного вещества / литры раствора
- Пример: какова молярность раствора, полученного растворением 3,4 г KMnO4 в 5.2 л воды?
- 2 Проанализируйте задачу. Чтобы найти молярность, необходимо знать количество молей и количество литров. Если количество молей не задано, но есть количество объем раствора и масса растворенного вещества, то для того, чтобы продолжить решение, вам нужно рассчитать количество молей растворенного вещества.
- Пример:
- Масса = 3,4 г KMnO4
- Объем = 5,2 л
- Пример:
- 3 Найдите молярную массу растворенного вещества. Чтобы найти число молей, зная массу, или граммы, использованного растворенного вещества, вы должны сначала определить его молярную массу. Это можно сделать, сложив отдельные молярные массы всех элементов, входящих в состав растворенного вещества. Найдите молярные массы элементов с помощью таблицы Менделеева.
- Пример:
- Молярная масса K = 39,1 г
- Молярная масса Mn = 54,9 г
- Молярная масса O = 16,0 г
- Общая молярная масса = K + Mn + O+ O +O + O = 39,1+ 54,9 + 16,0 + 16,0 + 16,0 + 16,0 =158,0 г
- Пример:
- 4 Пересчитайте граммы в моли. Теперь, когда у вас есть молярная масса растворенного вещества, вам нужно разделить количество грамм на растворенного вещества на его формульную (молярную) массу.
- Пример: граммы растворенного вещества /молярная масса растворенного вещества =3,4 г / 158 г/моль = 0,0215 моль
- 5 Разделите количество молей на количество литров. Теперь, когда у вас есть количество молей, вы можете разделить это значение на количество литров раствора для того, чтобы найти молярность.
- Пример: молярность = моли растворенного вещества / литры раствора = 0,0215 моль /5,2 л = 0,04134615
- 6 Запишите полученный ответ. Следует округлить число до такого количества знаков после запятой, которого требует от вас ваш преподаватель. Обычно это два или три знака. Кроме того, когда вы записываете ответ, сокращайте «молярность» буквой «M» и указывайте растворенное вещество.
- Пример: 0,004 M KMnO4
Метод 3 Вычисление молярности, если даны моли и миллилитры
- 1 Выучите основную формулу. Чтобы найти молярность, нужно вычислить количество молей растворенного вещества в литре раствора. Миллилитры использовать нельзя. Общая формула, используемая для выражения молярности имеет следующий вид: молярность = моли растворенного вещества / литры раствора
- Пример: Какова молярность раствора, содержащего 1,2 моля CaCl2 в 2905 миллилитрах?
- 2 Проанализируйте задачу. Для вычисления молярности нужно знать количество молей и количество литров. Если объем задан в миллилитрах, а не в литрах, тогда вам придется перевести объем в литры перед тем, как продолжить расчет.
- Пример:
- Моли = 1,2 моль CaCl2
- Объем = 2905 мл
- Пример:
- 3 Переведите миллилитры в литры. Найдите количество литров, разделив количество миллилитров на 1000, так как в 1 литре содержится 1000 миллилитров. Обратите внимание, что вы также можете переместить запятую на три знака влево
- Пример: 2905 мл * (1 л / 1000 мл) = 2,905 л
- 4 Разделите количество молей на количество литров. Теперь, когда у вас есть количество литров, вы можете разделить количество молей растворенного вещества на это значение, чтобы получить молярность раствора.
- Пример: молярность = моли растворенного вещества / литры раствора = 1,2 моль 22 /2,905 л = 0,413080895
- 5 Запишите ответ. Округлите ответ в соответствии с требованиями вашего преподавателя (обычно до второго или третьего знака). Когда вы записываете ответ, сокращайте «молярность» буквой «M» и указывайте растворенное вещество.
- Пример: 0,413 M CaCl2
Метод 4 Дополнительная практическая задача
- 1 Найдите молярность раствора, полученного растворением 5,2 г NaCl в 800 мл воды. Определите значения, данные в задаче: масса в граммах и объем в миллилитрах.
- Масса = 5,2 г NaCl
- Объем = 800 мл воды
- 2 Найдите молярную массу NaCl. Для этого сложите молярную массу натрия, Na, и хлора,Cl.
- Молярная масса Na = 22,99 г/моль
- Молярная масса Cl = 35,45 г/моль
- Молярная масса NaCl = 22,99 + 35,45 =58,44 г/моль
- 3 Разделите массу растворенного вещества на его молярную массу. В данном примере молярная масса NaCl равна 58,44 г/моль.
- Моли NaCl = 5,2 г NaCl / 58,44 = 0,08898 моль = 0,9 моль
- 4 Разделите 800 мл воды на 1000. Поскольку в литре содержится 1000 мл, то, чтобы найти количество литров, вам нужно будет разделить количество миллилитров в этой задаче на 1000.
- Вы также можете рассматривать это действие как умножение 800 мл на коэффициент перевода 1л / 1000 мл.
- Для ускорения процесса вы можете просто переместить десятичную запятую на три знака влево, ничего не перемножая и не деля.
- Объем = 800 л * (1 л / 1000 мл) = 800 мл / 1000 мл = 0,8 л
- 5 Разделите количество молей растворенного вещества на количество литров раствора. Чтобы найти молярность, вам необходимо разделить 0,09 моль, количество молей растворенного NaCl, на объем растворенного вещества в литрах.
- молярность = моли растворенного вещества / литры раствора = 0,09 моль / 0,8 л =0,01125 моль/л.
- 6 Приведите ответ в порядок. Округлите ваш ответ до двух или трех знаков после запятой и сократите молярность буквой «M».
Прислал: Шестакова Мария . 2017-11-11 18:25:51
kak-otvet.imysite.ru
Как вычислить молярную и нормальную концентрацию
Автор КакПросто!
Под термином «концентрация» понимают величину, характеризующую долю вещества, находящегося в каком-либо определенном объеме или массе раствора. Чем больше эта доля, тем выше концентрация. Ее можно выразить через различные показатели: массовую долю, молярность, моляльность, нормальность, титр. Молярная концентрация – величина, показывающая, сколько молей данного вещества находится в одном литре раствора.

Статьи по теме:
Инструкция
Допустим, вам известно, что в 500 миллилитрах раствора серной кислоты содержится 49 граммов этого вещества. Вопрос: какова молярная концентрация этого раствора? Запишите точную формулу вещества – Н2SO4, после чего посчитайте его молекулярную массу. Она складывается из атомных масс элементов, с учетом их индексов. 1*2 + 32 + 4*16 = 98 атомных единиц массы. Молярная масса любого вещества численно равна его молекулярной массе, только выражается в граммах/моль. Следовательно, один моль серной кислоты весит 98 граммов. Сколько же молей составляет изначальное количество кислоты, равное 49 граммам? Разделите: 49/98 = 0,5. Следовательно, 0,5 молей серной кислоты содержится в 500 миллилитрах раствора. Сколько же молей было бы в 1 литре? Разумеется, один. Значит, у вас одномолярный раствор серной кислоты. Или, как принято записывать, 1М раствор.А что такое нормальная концентрация? Это величина, показывающая, сколько эквивалентов вещества (то есть такое количество его молей, которое вступает в реакцию с одним молем водорода) содержится в одном литре раствора. Размерность нормальной концентрации — моль-экв/л или г-экв/л. Она обозначается буквами «н» или «N».
Рассмотрите пример с той же серной кислотой. Вы уже вычислили, что ее раствор одномолярный. А какова будет ее нормальная концентрация? Для ответа на этот вопрос вам необходимо учесть, что согласно закону эквивалентов, все вещества реагируют друг с другом в эквивалентных соотношениях. Таким образом, величина нормальности раствора серной кислоты зависит от того, в какую реакцию с каким веществом она вступит.
Например, Н2SO4 + NaOH = NaHSO4 + h3O. В этой реакции на каждую молекулу едкого натра приходится также одна молекула серной кислоты (или на один эквивалент щелочи – один эквивалент кислоты). Следовательно, в данном случае раствор кислоты однонормальный (1N или просто N).
Но если щелочь взята в избытке, то реакция протечет так: Н2SO4 + 2NaOH = Na2SO4 + 2h3O. И тогда, поскольку на каждую молекулу кислоты приходится уже две молекулы щелочи, то раствор кислоты будет двухнормальным (2N).
Совет полезен?
Статьи по теме:
Не получили ответ на свой вопрос?
Спросите нашего эксперта:
www.kakprosto.ru
Раствора молярность — Справочник химика 21
Растворимость вещества определяется его концентрацией в насыщенном растворе. Растворимость газов в жидкостях зависит от природы растворяемого газа и растворителя, давления газа, температуры и от присутствия в растворе различных веществ, особенно электролитов. Числовое значение растворимости газа в жидкости зависит от способа ее выражения. Растворимость газов выражают числом граммов газа в 100 г чистого растворителя или в 100 г раствора, числом молей газа в 1000 г растворителя или в 1 л раствора, молярной долей. Кроме того, растворимость газов в жидкостях характеризуют коэффициентом растворимости а или коэффициентом погло- [c.381]Концентрация — это отношение массы растворенного вещества к объему раствора (массовая концентрация) или отношение количества вещества к объему раствора (молярная концентрация). Единицами этих концентраций служат соответственно г/л и моль/л. В аналитической практике используются также норма.чь-ная, или эквивалентная концентрация, равная отношению количества эквивалента вещества к с ему раствора. Единицей этой концентрации является моль/л. [c.247]
Нормальностью раствора называется концентрация его, выраженная числом грамм-эквивалентов растворенного вещества, содержащихся в 1 л раствора. Близок к этому способ выражения состава раствора молярностью его, когда концентрация выражается числом молей растворенного вещества в 1 л. Титром большей частью называется состав раствора, выраженный числом граммов растворенного вещества, содержащихся в 1 мл раствора. [c.296]
Молярная доля N — отношение количества вещества одного из компонентов раствора к общему количеству вещества всех компонентов раствора. Молярная доля некоторого компонента i в растворе Л/, обычно выражается в процентах (%). [c.148]
Решение, Вычислим массу чистого гидроксида калия (в миллиграммах) I) 3 мл раствора (молярная масса КОН равна 5(5 г/моль) [c.254]
Молярная доля представляет собой отношение количества данного компонента в молях к общему количеству молей всех компонентов в растворе. Молярностью называется количество данного компонента в молях в одном литре раствора. Моляльность определяется как количество вещества в молях, приходящееся на 1000 г растворителя. [c.180]
Таким образом, мы получили 0,106 Мл раствор. Молярность этого раствора определить по имеющимся данным невозможно, так как нам неизвестен ни объем уксусной кислоты, ни то, выполняется ли приближение аддитивности объемов при растворении уксусной кислоты в этаноле. [c.79]
Расчет по понижению температуры замерзания. Для реальных растворов молярную долю растворителя в уравнении (125.18) заменяют на активность [c.369]
Характеристикой раствора является количество растворенного вещества, содержащегося в определенном весовом или объемном количестве раствора. Эта характеристика называется концентрацией. Концентрация бывает весовой (процентной) и объемной (молярной или нормальной). Процентная концентрация выражается количеством граммов вещества, которое содержится в 100 г раствора. Молярная (нормальная) концентрация выражается количеством грамм-молекул (грамм-эквивалентов) растворенного вещества, которое содержится в 1 л раствора. [c.26]
Иногда концентрацию выражают числом киломолей С, растворенного вещества в I м раствора (молярная концентрация). Это, однако, не всегда удобно, так как концентрация раствора вследствие термического расширения зависит от температуры. В связи с этим часто также пользуются моляльностью т,, т. е. количеством растворенного вещества (молей) в 1 кг растворителя (воды), величина которой не зависит от температуры. Между молярной долей и моляльностью в водных растворах существует соотношение [c.173]
В экспериментальной термодинамике в качестве переменных концентрации часто используют число молей на 1000 г растворителя (моляльность) и число молей на литр раствора (молярность). Последняя величина имеет тот недостаток, что она зависит от температуры. [c.170]
Растворы, осмотическое давление которых одинаково с осмотическим давлением клеток и тканей, называются изоосмотическими или изотоническими. Растворы, молярная концентрация которых, а стало быть и осмотическое давление, выше, чем внутри клеток и тканей, называются гипертоническими. Растворы, молярная концентрация которых, а следовательно, и осмотическое давление, ниже, чем в клетках и тканях, называются гипотоническими. [c.181]
Важнейшей характеристикой раствора является его состав. Наиболее распространен способ выражения состава раствора через массовые проценты. Так, 20%-ый раствор какого-либо вещества— это раствор, в 100 г которого содержится 20 г этого вещества. Другой часто используемый способ выражения состава раствора — молярная концентрация, которая показывает число молен растворенного вещества в 1 л раствора. Иногда пользуются титром раствора. Титр выражается числом граммов растворенного вещества в I мл раствора. [c.93]
При выражении концентрации через количество растворенного вещества, приходящегося на единицу объема раствора (молярная концентрация), следует учитывать, что вследствие зависимости объема растворителя от температуры концентрация растворенного вещества будет изменяться с температурой. Поэтому при проведении точных экспериментов растворитель следует отмерять не по объему, а по массе. Концентрация, выраженная числом молей растворенного вещества на 1000 г растворителя, называется моляльной. При исследовании зависимостей свойств раствора от количества растворенного вещества удобно пользоваться мольными долями или мольными процентами. [c.93]
По содержанию растворенного вещества растворы относятся к концентрированным, когда количество растворенного вещества сравнимо с количеством растворителя, и разбавленные, когда количество растворенного вещества невелико. Концентрация растворов выражается в массовых, атомных или мольных процентах, в молях на литр раствора (молярность с), в молях на 1000 г растворителя (моляльность т) и т. д. [c.79]
Ответ. В данном растворе молярная концентрация НКОз равна 2,15 моль/л. [c.243]
Для разбавленных растворов молярная концентрация примерно равна моляльной. Тогда, определив с из уравнения (10.3) и подставив в уравнение (10.19), получим [c.95]
Взятое вещество находится в виде раствора, молярная концентрация которого равна С. Химический потенциал растворенного вещества выражается формулой [c.65]
В насыщенном растворе молярные свободные энтальпии твердого и растворенного вещества равны
www.chem21.info
Молярность — это… Что такое Молярность?
МОЛЯРНОСТЬ — раствора концентрация раствора, характеризуемая числом молей растворенного вещества в 1 л раствора … Большой Энциклопедический словарь
МОЛЯРНОСТЬ — МОЛЯРНОСТЬ, см. КОНЦЕНТРАЦИЯ … Научно-технический энциклопедический словарь
молярность — МОЛЛЬНОСТЬ – число молей растворенного вещества в 1 л раствора. Напр., одномолярный раствор содержит 1 моль вещества на 1 л. (Источник: «Микробиология: словарь терминов», Фирсов Н.Н., М: Дрофа, 2006 г.) … Словарь микробиологии
молярность — сущ., кол во синонимов: 1 • концентрация (23) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
молярность — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN molarityM … Справочник технического переводчика
молярность — – число молей компонента в 1 л раствора. Словарь по аналитической химии [3] … Химические термины
Молярность — Концентрация величина, характеризующая количественный состав раствора. Согласно правилам ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л) … Википедия
МОЛЯРНОСТЬ — (molarity) концентрация раствора, выраженная через массу (в граммах) растворенного вещества, содержащуюся в литре раствора, в отношении к его молекулярной массе (по другому молярность это число молей, содержащееся в одном литре раствора).… … Толковый словарь по медицине
молярность — раствора, концентрация раствора, характеризуемая числом молей растворённого вещества в 1 л раствора. * * * МОЛЯРНОСТЬ МОЛЯРНОСТЬ раствора, концентрация раствора, характеризуемая числом молей растворенного вещества в 1 л раствора … Энциклопедический словарь
молярность — molinė koncentracija statusas T sritis Standartizacija ir metrologija apibrėžtis Ištirpusios medžiagos molių kiekis 1 l tirpalo. atitikmenys: angl. molar concentration; molarity vok. molare Konzentration, f; Molarität, f; Stoffmengenkonzentration … Penkiakalbis aiškinamasis metrologijos terminų žodynas
молярность — molinė koncentracija statusas T sritis chemija apibrėžtis Medžiagos molių kiekis vienetiniame tūryje (ppr. mol/l). atitikmenys: angl. molar concentration; molarity rus. молярная концентрация; молярность … Chemijos terminų aiškinamasis žodynas
dic.academic.ru
Молярность раствора | Задача 51
Приготовление раствора с известной молярностью
Рассмотрим задачу, в которой концентрации разных веществ выражены различными способами. В этом случае наиболее разумно перевести концентрации всех растворов в массовую долю и лишь после этого приступать к решению задачи.
3адача 51.
Какие массы 6,1 М раствора NаОН в воде (р = 1,219 г/мл) и 4% (масс.) необходимо взять для приготовления 500 г 2,77 молярного (р = 1,109 г/мл) раствора NаОН?
Дано:
молярная концентрация 1-го р-ра: СM(NаОН)в 1 исх. p-pа = 6,1 моль/л;
плотность 1-го р-ра: pр-ра = 1,2 19 г/мл;
массовая доля NаОН во 2-м растворе: (NаОН)во 2 p-ре = 4%;
масса конечного раствора m = 500 г;
молярная концентрация конечного р-ра: СM(NаОН) = 2,77моль/л.;
плотность конечного раствора: ркон р-ра = 1,109 г/мл.
Найти:
массы 1-го и 2-го исходных растворов: m1исх р-ра; m2 исх. р-ра.
Решение:
Отобразим условие задачи в виде рисунка:
Молярность непосредственно связана с объемом. Но при изменении концентрации меняется плотность раствора. Это приводит к тому, что сумма объемов исходных растворов не равна объему конечного. Поэтому все расчеты необходимо проводить, основываясь на массовой доле.
Схематично алгоритм решения можно представить так:
Сначала перейдем от молярных концентраций к массовой доле для конечного и первого исходного раствора.
а) Первый исходный раствор.
Проведем расчет для 1 л 6,1 молярного раствора. В нем содержится 6,1 моль NаОН.
m(NаОН) = n(МаОН) . М(NаОН) = 6,1 . 40 = 244 г.
Масса 1 л раствора определяется по его плотности.
б) Конечный раствор.
Проведем расчет для 1 л раствора с молярной концентрацией 2,77 моль/л.
В 1 литре этого раствора содержится 2,77 моль NаОН.
1. Обозначим массу первого исходного 20%-ного раствора NaОН величиной «а»: m1исх р-ра = а г.
Тогда масса второго исходного 4%-ного раствора NaОН получится:
m2 исх. р-рa = mкон. р-рa – m1 исх. р-рa = (500 – а)
2. Теперь определяем массу чистого NaОН в каждом из трех растворов:
3. Масса чистого NaОН в конечном растворе складывается из сумм масс NaОН в исходных двух растворах. Составим математическое уравнение:
Решая его, получаем: а = 187,5.
4. Величиной «а» мы обозначали массу первого 20%-ного раствора, следовательно: m1 исх. р-ра = 187,5 г
Массу же второго исходного раствора мы получим как разность масс конечного и первого исходного растворов:
m2 исх. р-рa = mкон. р-рa – m1 исх. р-рa = 500 – 187,5 = 312,5 г.
Ответ: m1 исх. р-ра = 187,5 г; m2 исх. р-ра = 312,5 г. Необходимо взять 187,5 г 6,1 молярного раствора и 312,5 г 4% раствора.
Определение объемов сливаемых друг с другом растворов с известной молярностью
Решим задачу, в которой требуется определить объем сливаемых друг с другом растворов при известной молярной концентрации.
Задача 52.
Определить объем 4,5 М (р = 1,26 г/мл) и 1,3 М (р = 1,08 г/мл) растворов Н2SO4, необходимых для приготовления путем их смешивания 2,8 М раствора (р = 1,17 г/мл) объемом 300 мл.
Дано:
молярная концентрация 1-го р-ра: СM(Н2SO4) в 1 исх. р-ре = 4,5 моль/л;
плотность 1-го раствора: р1исх. р-ра = 1,26 г/мл;
молярная концентрация 2-го р-ра: СМ(Н2SO4)во2 исх. р-ре =1,3 моль/л;
плотность 2-го раствора: р2 исх.р-ра = 1.08 г/мл;
молярная концентрация конечного р-ра: СМ(Н2SO4)кон. р-ра = 2,8 моль/л;
плотность конечного раствора: ркон. р-ра = 1,17 г/мл;
объем конечного раствора: Vкон. р-ра = 300 мл.
Найти:
объемы исходных растворов: V1 исх. р-ра; V2 исх. р-ра.
Решение:
Отобразим условие задачи в виде рисунка:
Так как V1 исх. р-ра + V2 исх. р-ра ≠ Vкон. p-ра. Следовательно, нам не удастся объем второго раствора выразить как разность между объемом конечного и первого растворов. Остается единственный вариант, перейти от молярных концентраций к массовым долям. Далее вычислить массы каждого из исходных растворов и вновь вернуться к объему.
Схематично алгоритм решения можно представить так:
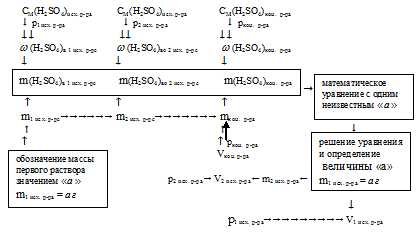
1. Определим массу конечного раствора, зная его объем и плотносnь, получим:
mкон. р-ра = Vкон. р-ра . ркон. р-ра = 300 мл . 1,17 г/мл = 351 г.
2. Перейдем от молярных концентраций к массовой доле для первого и второго исходных растворов и конечного раствора.
а) Первый исходный раствор.
Проведем расчет для 1 л 4,5 молярного раствора. В нем содержится 4,5 моль H2SO4.
m(H2SO4) = n(H2SO4) . М(H2SO4) = 4,5 . 98 = 441 г.
Масса 1 л раствора определяется по его плотности.
б) Второй исходный раствор..
Проведем расчет для 1 л раствора с молярной концентрацией 1,3 моль/л.
В 1 литре этого раствора содержится 1,3 моль H2SO4.
в) Конечный раствор..
Проведем расчет для 1 л раствора с молярной концентрацией 2,8 моль/л.
В 1 литре этого раствора содержится 2,8 моль H2SO4.
Определяем массу чистого H2SO4 в каждом из трех растворов:
3. Масса чистого H2SO4 в конечном растворе складывается из сумм масс H2SO4 в исходных двух растворах. Составим математическое уравнение:
Решая его, получаем: а = 176,3.
4. Величиной «а» мы обозначали массу первого 35%-ного раствора, следовательно: m1 исх. р-ра = 176,3 г;
m2 исх. р-ра = mкон. р-ра – m1 исх. р-ра = 351 – 176,3 = 174,7 г.
5. Рассчитаем объемы исходных растворов, используя формулу:
Ответ: необходимо смешать 140 мл 4,5 М раствора с 161,8 мл 1,3 М раствора.
buzani.ru
Большая Энциклопедия Нефти и Газа, статья, страница 1
Молярность
Cтраница 1
Молярность и нормальность имеют одинаковые единицы измерения, численные значения их для данного раствора не всегда совпадают. [1]
Молярность — число молей растворенного вещества в f л раствора или смеси. [2]
Молярность устанавливают по карбонату кальция ( хч или чда), высушенному при 80 — 100 С до постоянной массы. После полного растворения навески раствор разбавляют водой до метки. [3]
Молярность — это способ выражения концентраций растворов, показывающий, сколько молей растворенного вещества находится в 1 л раствора. Концентрация, выраженная в весовых процентах, представляет собой количество граммов растворенного вещества на 100 см3 конечного раствора. [4]
Молярность для выражения концентрации показывает число грамм-молей вещества, растворенного в литре раствора. [5]
Молярность — концентрация раствора, выраженная в молях вещества, содержащихся в 1 л раствора ( раствора, но не растворителя. Моль ( грамм-молекула) вещества — это количество вещества в граммах, численно равное его молекулярному весу. [6]
Молярность ( См) выражается числом молей растворенного вещества, содержащегося в 1 дм3 ( I л) раствора. Молярный раствор содержит 1 моль растворенного вещества, децимолярный — 0 1 моль, сантимолярный — 0 01 моль, миллимолярный — 0 001 моль. Чтобы приготовить одномолярный раствор NaOH, нужно взвесить 40 г NaOH, внести в мерную литровую колбу, добавить воды до полного растворения и довести уровень воды до метки. [7]
Молярность выражается числом молей растворенного вещества в литре раствора. Растворы определенной молярности в соответствии с числом молей вещества в литре ( 2, 1, 0 1, 0 01, 0 001) называются дву -, одно -, деци -, санти -, милли-молярными. Очевидно, что в одинаковых объемах растворов различных веществ одинаковой молярности содержится одинаковое число молекул растворенного вещества. [8]
Молярность, или молярная концентрация, выражает число молей растворенного вещества, содержащихся в 1 л раствора. [10]
Молярность выражается числом молей вещества в 1 л раствора. [11]
Молярность — это выраженное в молях количество растворенного вещества, содержащееся в одном литре раствора. [12]
Молярность применяемого титрованного раствора для общих целей, как уже говорилось выше, достаточно точ но может быть рассчитана из навески, если применять препараты надежного происхождения. [13]
Молярность представляет собой число, показывающее, сколько грамм-молекул растворенного вещества содержится в 1 л раствора. [14]
Молярность ( 82) — число молей растворенного вещества в одном литре раствора. [15]
Страницы: 1 2 3
www.ngpedia.ru
