| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Определить кислотность pH | 0.76M(HCl)(solution) | |
| 4 | Найти массу одного моля | H_2O | |
| 5 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 6 | Найти массу одного моля | H | |
| 7 | Найти число нейтронов | Fe | |
| Найти число нейтронов | Tc | ||
| 9 | Найти конфигурацию электронов | H | |
| 10 | Найти число нейтронов | Ca | |
| 11 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 12 | Найти число нейтронов | C | |
| 13 | Найти число протонов | H | |
| 14 | Найти число нейтронов | O | |
| 15 | Найти массу одного моля | CO_2 | |
| 16 | Баланс | (a+b/c)(d-e)=f | |
| 17 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 18 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 19 | Найти атомную массу | H | |
| 20 | Определить, растворима ли смесь в воде | H_2O | |
| 21 | Найти конфигурацию электронов | Na | |
| 22 | Найти массу одного атома | H | |
| 23 | Найти число нейтронов | Nb | |
| 24 | Найти число нейтронов | Au | |
| 25 | Найти число нейтронов | Mn | |
| 26 | Найти число нейтронов | Ru | |
| 27 | Найти конфигурацию электронов | O | |
| 28 | Найти массовую долю | H_2O | |
| 29 | Упростить | корень пятой степени 243 | |
| 30 | Определить, растворима ли смесь в воде | NaCl | |
| 31 | Найти эмпирическую/простейшую формулу | H_2O | |
| 32 | Найти степень окисления | H_2O | |
| 33 | Найти конфигурацию электронов | K | |
| 34 | Найти конфигурацию электронов | Mg | |
| 35 | Найти конфигурацию электронов | Ca | |
| 36 | Найти число нейтронов | Rh | |
| Найти число нейтронов | Na | ||
| 38 | Найти число нейтронов | Pt | |
| 39 | Найти число нейтронов | Be | Be |
| 40 | Найти число нейтронов | Cr | |
| 41 | Найти массу одного моля | H_2SO_4 | |
| 42 | Найти массу одного моля | HCl | |
| 43 | Найти массу одного моля | Fe | |
| 44 | Найти массу одного моля | C | |
| 45 | Найти число нейтронов | Cu | |
| 46 | Найти число нейтронов | S | |
| 47 | Найти степень окисления | H | |
| 48 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 49 | Найти атомную массу | O | |
| 50 | Найти атомное число | H | |
| 51 | Найти число нейтронов | Mo | |
| 52 | Найти число нейтронов | Os | |
| 53 | Найти массу одного моля | NaOH | |
| 54 | Найти массу одного моля | O | |
| 55 | Найти конфигурацию электронов | H | |
| 56 | Найти конфигурацию электронов | Fe | |
| 57 | Найти конфигурацию электронов | C | |
| 58 | Найти массовую долю | NaCl | |
| 59 | Найти массу одного моля | K | |
| 60 | Найти массу одного атома | Na | |
| 61 | Найти число нейтронов | N | |
| 62 | Найти число нейтронов | Li | |
| 63 | Найти число нейтронов | V | |
| 64 | Найти число протонов | N | |
| 65 | Вычислить | 2+2 | |
| 66 | Упростить | H^2O | |
| 67 | Упростить | h*2o | |
| 68 | Определить, растворима ли смесь в воде | H | |
| 69 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 70 | Найти степень окисления | NaCl | |
| 71 | Найти степень окисления | H_2O | |
| 72 | Найти атомную массу | He | He |
| 73 | Найти атомную массу | Mg | |
| 74 | Вычислить | (1.0*10^-15)/(4.2*10^-7) | |
| 75 | Найти число электронов | H | |
| 76 | Найти число электронов | O | |
| 77 | Найти число электронов | S | |
| 78 | Найти число нейтронов | Pd | |
| 79 | Найти число нейтронов | Hg | |
| 80 | Найти число нейтронов | B | |
| 81 | Найти массу одного атома | Li | |
| 82 | Найти массу одного моля | H_2O | |
| 83 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 84 | Найти число протонов | Be | Be |
| 85 | Найти массу одного моля | Na | |
| 86 | Найти конфигурацию электронов | Co | |
| 87 | Найти конфигурацию электронов | S | |
| 88 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 89 | Баланс | H_2+O_2→H_2O | |
| 90 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 91 | Найти конфигурацию электронов | P | |
| 92 | Найти конфигурацию электронов | Pb | |
| 93 | Найти конфигурацию электронов | Al | |
| 94 | Найти конфигурацию электронов | Ar | |
| 95 | Найти массу одного моля | O_2 | |
| 96 | Найти массу одного моля | H_2 | |
| 97 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 98 | Найти число нейтронов | K | |
| 99 | Найти число нейтронов | P | |
| 100 | Найти число нейтронов | Mg |
www.mathway.com
NO2, степень окисления азота и кислорода в нем
Общие сведения об оксиде азота (IV) и степени окисления в NO2
Плотность – 2,0527 г/л (н.у.). Брутто-формула – NO2. Молярная масса – 46,01 г/моль. Электронное и пространственное строение молекулы диоксида азота представлено на рис. 1.
Хорошо растворяется в холодной воде (насыщенный раствор ярко-зеленого цвета), полностью реагируя с ней.
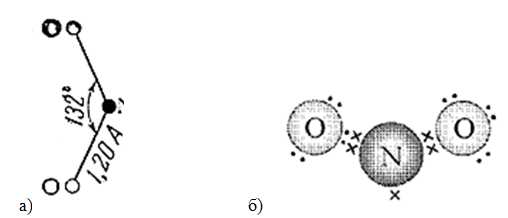
Рис. 1. Строение молекулы оксида азота (IV): а) пространственное с указанием валентного угла и длины связи; б) электронное.
В ОВР проявляет свойства очень сильного окислителя. Вызывает коррозию металлов.
NO2, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав диоксида азота, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Степень окисления кислорода в составе оксидов всегда равна (-2). Для нахождения степени окисления азота примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 2×(-2) = 0;
x — 4 = 0;
x = +4.
Значит степень окисления азота в оксиде азота (IV) равна (+4):
N+4O-22.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
как определять степени окисления ?
Господи. Да запомните простые несколько правил: 1. Сумма всех степеней окисления внутри молекулы всегда равна 0. 2. Простые вещества всегда имеют степень окисления равную 0. Например: Br2^(0) , Na^(0), Al(0), He^(0) и т. д. 3. Ионы щелочных металлов (Li, Na, K, Rb, Cs, Fr) всегда имеют степень окисления равную (+1) 4. Ионы щелочноземельных металлов (Be, Mg, Ca, Sr, Ba, Ra) всегда имеют степень окисления равную (+2) 5. Ион алюминия всегда имеет степень окисления равную (+3) 6. Ионы водорода всегда имеют степень окисления равную (+1), за исключением случаев гидридов. Пример NaH, Cah3, Alh4 и т. д. В этих соединениях ион водорода имеет степень окисления равную (-1) 7. Ионы кислорода всегда имеют степень окисления равную (-2), за исключением случаев пероксидов типа Na2O2, h3O2 и т. д. В этих соединениях степень окисления иона кислорода равна (-1). Естественно есть одно исключение — это соединение кислорода с фтором OF2, тут кислород имеет степень окисления равную (+2) 8. Это не правило, а просто подсказка. Если ион галогена находится на правом конце формулы молекулы, то этот ион галогена имеет степень окисления равную (-1). Пример SbCl4^(-1), BaBr2^(-1) и т. д. 9. Суммарная степень окисления аниона кислотного остатка всегда равна количеству атомов водорода в исходной кислоте со знаком (-) минус. Например: (SO4)^(-2), т. к. в исходной серной кислоте два атом водорода h3SO4, или (РО4)^(-3), т. к. в исходной фосфорной кислоте три атома водорода Н3РО4, или (ClO4)^(-1), т. к. в исходной хлорной кислоте HClO4 всего один атом водорода Ну и примеры: №1. KMnO4, по правилу №3 калий, как щелочной металл, имеет степень окисления =+1. По правилу №7, кислод имеет степень окисления =(-2). Теперь нам осталось определить степень окисления иона марганца Mn. Для этого обозначим степень окисления марганца через Х и составим уровнения по правилу №1. +1+Х+4*(-2)=0, откуда получим Х-7=0 и Х=+7, следовательно заряд иона марганца равен +7, т. е. Mn^(+7). №2. Na2Cr2O7. По правилу №3 натрий, как щелочной металл имеет степень окисления равную +1. По правилу №7 кислород имеет степень окисления (-2). Обозначим через Х степень окисления иона хрома и составим уравнение по правилу №1: 2*(+1)+2*Х+7*(-2)=0, открываем скобки и производим действия 2*Х-12=0, откуда Х=12/2=+6. Следовательно степень окисления иона хрома равна +6. №3 СuSO4. По правилу №9 суммарная степень окисления сульфат-иона, который является кислотным остатком серной кислоты, равна (-2), т. к. исходная серная кислота имеет в своем составе 2 атома водорода. По правилу №7 степень окисления кислорода равна (-2). Следовательно на основании этих двух правил мы можем составить первое уравнение, где Х это степень окисления иона серы в кислотном остатке. Х+4*(-2)=(-2), откуда Х=+6, следовательно ион серы имеет степень окисления=+6. Теперь обозначим У — степень окисления иона меди и составим уравнение на основании правила №1: У+(+6)+4*(-2)=0, откуда У-2=0 и У=+2, следовательно степень окисления иона меди=+2. Если будут проблемы по химии, пиши [email protected], помогу. Денег не беру.
По таблице электроотрицательностей атомов: <a rel=»nofollow» href=»http://ru.wikipedia.org/wiki/Электроотрицательность» target=»_blank»>http://ru.wikipedia.org/wiki/Электроотрицательность</a>
touch.otvet.mail.ru
чему равна степень окисления атомов в простых веществах
КАК ОПРЕДЕЛИТЬ СТЕПЕНЬ ОКИСЛЕНИЯ ВЕЩЕСТВА Инструкция 1 Степень окисления пишется над обозначением элемента, стачала ставится знак, а потом значение. Она может быть отрицательной, положительной или равной нулю. Сумма всех степеней окисления в веществе равна нулю. У некоторых веществ есть постоянные степени окисления во всех соединениях. Например, у металлов она всегда является положительной и равна их валентности (способности присоединять или замещать определенное число атомов или групп атомов) . Щелочные металлы имеют степень окисления +1, а щелочно-земельные — +2. Водород всегда имеет степень окисления +1, исключением являются гидриды, там — -1 (например, KH(-1)). Степень окисления кислорода равна -2, исключения: пероксиды (BaO2(-1)) и фторид кислорода (O(+2)F). Фтор всегда имеет -1(NaF(-1)). 2 Если вещество состоит из одного или нескольких одноименных атомов, т. е. является простым, то степень его окисления равна нулю. Например, h3, Ag, O2, Na и т. д. 3 В сложном веществе в первую очередь расставляем значения степеней окисления у элементов, у которых она не изменяется. Затем составляем уравнение с одной неизвестной, т. е. степень окисления, которую необходимо найти, обозначаем за X. Решаем это уравнение, получаем искомую величину. Следует отметить, что при наличии в сложном веществе несколько атомов одного и того же элемента степень его окисления при составлении уравнения умножается на количество элементов. Рассмотрим на примерах. 4 При необходимости найти степень окисления серы в веществе Na2SO4 поступаем так: сначала расставляем известные нам значения: Na(+1)2SO(-2)4. Обозначаем степень окисления серы за X, записываем уравнение, помня про то, что сумма всех степень окисления всегда равна нулю: 2+X-8 = 0. Решаем: X = 8-2 = +6. Следовательно, степень окисления серы равна +6. 5 Еще один пример: AgNO3. Расставляем: Ag(+1)NO(-2)3. Получаем уравнение: 1+X-6 = 0. Вычисляем: X = 6-1 = +5. Искомое значение найдено.
touch.otvet.mail.ru
