| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Определить кислотность pH | 0.76M(HCl)(solution) | |
| 4 | Найти массу одного моля | H_2O | |
| 5 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 6 | Найти массу одного моля | H | |
| 7 | Найти число нейтронов | Fe | |
| Найти число нейтронов | Tc | ||
| 9 | Найти конфигурацию электронов | H | |
| 10 | Найти число нейтронов | Ca | |
| 11 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 12 | Найти число нейтронов | C | |
| 13 | Найти число протонов | H | |
| 14 | Найти число нейтронов | O | |
| 15 | Найти массу одного моля | CO_2 | |
| 16 | Баланс | (a+b/c)(d-e)=f | |
| 17 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 18 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 19 | Найти атомную массу | H | |
| 20 | Определить, растворима ли смесь в воде | H_2O | |
| 21 | Найти конфигурацию электронов | Na | |
| 22 | Найти массу одного атома | H | |
| 23 | Найти число нейтронов | Nb | |
| 24 | Найти число нейтронов | Au | |
| 25 | Найти число нейтронов | Mn | |
| 26 | Найти число нейтронов | Ru | |
| 27 | Найти конфигурацию электронов | O | |
| 28 | Найти массовую долю | H_2O | |
| 29 | Упростить | корень пятой степени 243 | |
| 30 | Определить, растворима ли смесь в воде | NaCl | |
| 31 | Найти эмпирическую/простейшую формулу | H_2O | |
| 32 | Найти степень окисления | H_2O | |
| 33 | Найти конфигурацию электронов | K | |
| 34 | Найти конфигурацию электронов | Mg | |
| 35 | Найти конфигурацию электронов | Ca | |
| 36 | Найти число нейтронов | Rh | |
| Найти число нейтронов | Na | ||
| 38 | Найти число нейтронов | Pt | |
| 39 | Найти число нейтронов | Be | Be |
| 40 | Найти число нейтронов | Cr | |
| 41 | Найти массу одного моля | H_2SO_4 | |
| 42 | Найти массу одного моля | HCl | |
| 43 | Найти массу одного моля | Fe | |
| 44 | Найти массу одного моля | C | |
| 45 | Найти число нейтронов | Cu | |
| 46 | Найти число нейтронов | S | |
| 47 | Найти степень окисления | H | |
| 48 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 49 | Найти атомную массу | O | |
| 50 | Найти атомное число | H | |
| 51 | Найти число нейтронов | Mo | |
| 52 | Найти число нейтронов | Os | |
| 53 | Найти массу одного моля | NaOH | |
| 54 | Найти массу одного моля | O | |
| 55 | Найти конфигурацию электронов | H | |
| 56 | Найти конфигурацию электронов | Fe | |
| 57 | Найти конфигурацию электронов | C | |
| 58 | Найти массовую долю | NaCl | |
| 59 | Найти массу одного моля | K | |
| 60 | Найти массу одного атома | Na | |
| 61 | Найти число нейтронов | N | |
| 62 | Найти число нейтронов | Li | |
| 63 | Найти число нейтронов | V | |
| 64 | Найти число протонов | N | |
| 65 | Вычислить | 2+2 | |
| 66 | Упростить | H^2O | |
| 67 | Упростить | h*2o | |
| 68 | Определить, растворима ли смесь в воде | H | |
| 69 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 70 | Найти степень окисления | NaCl | |
| 71 | Найти степень окисления | H_2O | |
| 72 | Найти атомную массу | He | He |
| 73 | Найти атомную массу | Mg | |
| 74 | Вычислить | (1.0*10^-15)/(4.2*10^-7) | |
| 75 | Найти число электронов | H | |
| 76 | Найти число электронов | O | |
| 77 | Найти число электронов | S | |
| 78 | Найти число нейтронов | Pd | |
| 79 | Найти число нейтронов | Hg | |
| 80 | Найти число нейтронов | B | |
| 81 | Найти массу одного атома | Li | |
| 82 | Найти массу одного моля | H_2O | |
| 83 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 84 | Найти число протонов | Be | Be |
| 85 | Найти массу одного моля | Na | |
| 86 | Найти конфигурацию электронов | Co | |
| 87 | Найти конфигурацию электронов | S | |
| 88 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 89 | Баланс | H_2+O_2→H_2O | |
| 90 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 91 | Найти конфигурацию электронов | P | |
| 92 | Найти конфигурацию электронов | Pb | |
| 93 | Найти конфигурацию электронов | Al | |
| 94 | Найти конфигурацию электронов | Ar | |
| 95 | Найти массу одного моля | O_2 | |
| 96 | Найти массу одного моля | H_2 | |
| 97 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 98 | Найти число нейтронов | K | |
| 99 | Найти число нейтронов | P | |
| 100 | Найти число нейтронов | Mg |
www.mathway.com
Степени окисления элементов — урок. Химия, 8–9 класс.
Степень окисления — условный заряд атома в соединении, если считать, что связь в нём ионная.
Степень окисления равна числу электронов, смещённых от атома или к атому.
Если электроны смещаются от атома, то его степень окисления положительная. Положительную степень окисления в соединениях имеет атом менее электроотрицательного элемента.
Если смещение электронов происходит к атому, то его степень окисления отрицательная.
Обрати внимание!
В простых веществах сдвига электронов нет, и степень окисления атомов равна \(0\).
Значение степени окисления указывают над знаком химического элемента:
Ca+2O−2, N02.
Обрати внимание!
В сложных веществах степень окисления атомов металла всегда положительная.
Максимальное значение степени окисления металла можно определить по номеру группы, в которой элемент находится в Периодической таблице. Оно равно числу валентных электронов в атоме.
Металлы главных подгрупп в соединениях, как правило, проявляют постоянную степень окисления. У металлов \(IA\) группы она равна \(+1\):
Na+1Cl−1, Li+12O−2.
У металлов \(IIA\) группы степень окисления всегда равна \(+2\):
Mg+2F−12, Ba+2O−2.
Степень окисления алюминия — \(+3\):
Al+32S−23.
Металлы побочных подгрупп проявляют переменные степени окисления:
Fe+2O−2, Fe+32O−23.
Обрати внимание!
Атомы неметаллов имеют как положительные, так и отрицательные степени окисления.
У самого электроотрицательного из неметаллов фтора степень окисления постоянная и равна \(–1\):
H+1F−1, K+1F−1.
Кислород почти всегда имеет степень окисления \(–2\):
Na+12O−2, C+4O2−2.
Исключения — фторид кислорода и пероксиды:
O+2F−12, H+12O−12.
В большинстве соединений степень окисления водорода \(+1\), но в соединениях с металлами она равна \(–1\):
H+1Br−1, N−3H+13, Na+1H−1, Ca+2h3−1.
У атомов остальных неметаллов максимальное значение степени окисления тоже равно номеру группы:
C+4, N+5, S+6.
Минимальное значение степени окисления можно определить, если от номера группы отнять \(8\). Оно определяется числом электронов, которые необходимы атому до завершения внешнего электронного слоя:
C−4, N−3, S−2.
www.yaklass.ru
Ca3(PO4)2, степень окисления фосфора и др элементов
Общие сведения о фосфате кальция и степени окисления в Ca3(PO4)2
Брутто-формула – Ca3(PO4)2. Молярная масса фосфата кальция равна 310,17 г/моль.

Рис. 1. Фосфат кальция – внешний вид.
Не растворяется в воде, кристаллогидратов не образует. Разлагается кислотами. Восстанавливается углеродом при спекании.
Ca3(PO4)2, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав фосфата кальция, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Степень окисления кальция постоянна и равна номеру группы Периодической системы Д.И. Менделеева, в которой он расположен со знаком плюс (кальций – металл), т.е. (+2).
Степень окисления кислотного остатка определяется числом атомов водорода, входящих в состав образующей его кислоты, указанных со знаком минус. Фосфат-ион – это кислотный остаток фосфорной кислоты, формула которой H3PO4. В её составе имеется три атома водорода, следовательно, степень окисления фосфат-иона равна (-3). Степень окисления кислорода в составе кислот, а, следовательно, и их остатков равна (-2). Для нахождения степени окисления фосфора в составе фосфат-иона примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 4× (-2) = -3;
x — 8 = -3;
x = +5.
Степень окисления фосфора в фосфате кальция равна (+5):
Ca+23(P+5O-24)2.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Валентность и степень окисления — Подготовка к ЕГЭ по химии
Валентность —
— это способность атома образовывать определенное количество связей с другими атомами.
Правила определения валентности
1. В молекулах простых веществ: H2, F2, Cl2, Br2, I2 равна единице.
2. В молекулах простых веществ: O2, S8 равна двум.
3. В молекулах простых веществ: N2, P4 и CO — оксиде углерода (II) — равна трем.
4. В молекулах простых веществ, которые образует углерод (алмаз, графит), а также в органических соединениях, которые он образует, валентность углерода равна четырем.
5. В составе сложных веществ водород одновалентен, кислород, в основном, двухвалентен. Для определения валентности атомов других элементов в составе сложных веществ надо знать строение этих веществ.
Степень окисления
– это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (с ионной и ковалентной полярной связью) состоят только из ионов.
Высшая степень окисления элемента равна номеру группы.
Исключения:
фтор высшая степень окисления ноль в простом веществе F20
кислород высшая степень окисления +2 во фториде кислорода О+2F2
Низшая степень окисления элемента равна восемь минус номер группы (по числу электронов, которые атом элемента может принять до завершенного восьми электронного уровня)
Правила определения степени окисления (далее обозначим: ст.ок.)
Общее правило: Сумма всех степеней окисления элементов в молекуле с учетом количества атомов равна нулю (Молекула электронейтральна.), в ионе — равна заряду иона.
I. Степень окисления простых веществ равна нулю: Са0, O20, Cl20
II. ст.ок. в бинарных cоединениях:
Менее электроотрицательный элемент ставится на первое место. (Исключения: С-4Н4+ метан и N-3H3+аммиак)
Нужно помнить, что
— ст.ок. металла всегда положительна
— ст.ок. металлов I, II, III групп главных подгрупп постоянна и равна номеру группы
Для остальных ст.ок. вычисляется по общему правилу.
Более электроотрицательный элемент ставится на второе место, его ст.ок. равна восемь минус номер группы (по числу электронов, которые он принимает до завершенного восьми электронного уровня).
Исключения: пероксиды, например, Н2+1О2-1, Ba+2O2-1 и др. ; карбиды металлов I и II групп Ag2+1C2-1, Ca+2C2-1 и др. (В школьном курсе встречается соединение FeS2 — пирит. Это дисульфид железа. Степень окисления серы в нем (-1) Fe+2S2-1). Это происходит потому, что в этих соединениях есть связи между одинаковыми атомами -О-О-, -S-S-, тройная связь в карбидах между атомами углерода. Степень окисления и валентность элементов в этих соединениях не совпадают: у углерода валентность IV, у кислорода и серы II.
III. Степень окисления в основаниях Ме+n(ОН)nравна количеству гидроксогрупп.
1. в гидроксогруппе ст.ок. кислорода -2, водорода +1, заряд гидроксогруппы 1-
2. ст.ок. металла равна количеству гидроксогрупп
IV. Степень окисления в кислотах:
1. ст.ок. водорода +1, кислорода -2
2. ст.ок. центрального атома вычисляется по общему правилу путем решения простого уравнения
Например, Н3+1РхО4-2
3∙(+1) + х + 4∙(-2) = 0
3 + х – 8 = 0
х = +5 (не забудьте знак +)
Можно запомнить, что у кислот с высшей ст.ок. центрального элемента, соответствующего номеру группы, название будет заканчиваться на –ная:
Н2СО3угольная Н2С+4О3
Н2SiО3 кремниевая (искл.) Н2Si+4О3
НNО3 азотная НN+5О3
Н3PО4 фосфорная Н3P+5О4
Н2SО4 серная Н2S+6О4
НСlО4 хлорная НCl+7О4
НMnО4 марганцовая НMn+7О4
Останется запомнить:
НNО2 азотистая НN+3О2
Н2SО3 сернистая Н2S+4О3
НСlО3 хлорноватая НCl+5О3
НСlО2 хлористая НCl+3О2
НСlОхлорноватистая НCl+1О
V. Степень окисления в солях
у центрального атома такая же, как в кислотном остатке. Достаточно помнить или определить ст.ок. элемента в кислоте.
VI. Степень окисления элемента в сложном ионе равна заряду иона.
Например, NH4+Cl— : записываем ион NхН4+1
х + 4∙(+1) = +1
х= — 3;
ст.ок. азота -3
Например, определить ст.ок. элементов в гексацианоферрате(III) калия К3[Fe(CN)6]
— у калия +1 : К3+1[Fe(CN)6], отсюда заряд иона [Fe(CN)6] 3-
— у железа +3 (указано в названии) [Fe+3(CN)6] 3-, отсюда (CN)66-
— у одной группы (CN)—
— более электроотрицательный азот: у него -3, отсюда (CхN-3)—
х – 3 = — 1
х = +2
ст.ок. углерода +2
VII. Степень окисления углерода в органических соединениях разнообразна и вычисляется, исходя из учета того, что ст.ок. водорода равна +1, кислорода -2
Например, С3Н6
3∙х + 6∙1 = 0
3х = -6
х = -2
ст.ок. углерода -2
(при этом валентность углерода равна IV)
Задание. Определить степень окисления и валентность фосфора в фосфорноватистой кислоте H3PO2.
Вычислим степень окисления фосфора.
Обозначим её за х. Подставим степень окисления водорода +1, а кислорода -2, умножив на соответствующее количество атомов: (+1) ∙ 3 + х + (-2) ∙ 2 = 0, отсюда х = +1.
school4eg.jimdo.com
Валентность химических элементов. Степень окисления химических элементов – HIMI4KA

Валентность является сложным понятием. Этот термин претерпел значительную трансформацию одновременно с развитием теории химической связи. Первоначально валентностью называли способность атома присоединять или замещать определённое число других атомов или атомных групп с образованием химической связи.
Количественной мерой валентности атома элемента считали число атомов водорода или кислорода (данные элементы считали соответственно одно- и двухвалентными), которые элемент присоединяет, образуя гидрид формулы ЭHx или оксид формулы ЭnOm.
Так, валентность атома азота в молекуле аммиака NH3 равна трём, а атома серы в молекуле H2S равна двум, поскольку валентность атома водорода равна одному.
В соединениях Na2O, BaO, Al2O3, SiO2 валентности натрия, бария и кремния соответственно равны 1, 2, 3 и 4.
Понятие о валентности было введено в химию до того, как стало известно строение атома, а именно в 1853 году английским химиком Франклендом. В настоящее время установлено, что валентность элемента тесно связана с числом внешних электронов атомов, поскольку электроны внутренних оболочек атомов не участвуют в образовании химических связей.
В электронной теории ковалентной связи считают, что валентность атома определяется числом его неспаренных электронов в основном или возбуждённом состоянии, участвующих в образовании общих электронных пар с электронами других атомов.
Для некоторых элементов валентность является величиной постоянной. Так, натрий или калий во всех соединениях одновалентны, кальций, магний и цинк — двухвалентны, алюминий — трёхвалентен и т. д. Но большинство химических элементов проявляют переменную валентность, которая зависит от природы элемента — партнёра и условий протекания процесса. Так, железо может образовывать с хлором два соединения — FeCl2 и FeCl3, в которых валентность железа равна соответственно 2 и 3.
Степень окисления — понятие, характеризующее состояние элемента в химическом соединении и его поведение в окислительно-восстановительных реакциях; численно степень окисления равна формальному заряду, который можно приписать элементу, исходя из предположения, что все электроны каждой его связи перешли к более электроотрицательному атому.
Электроотрицательность — мера способности атома к приобретению отрицательного заряда при образовании химической связи или способность атома в молекуле притягивать к себе валентные электроны, участвующие в образовании химической связи. Электроотрицательность не является абсолютной величиной и рассчитывается различными методами. Поэтому приводимые в разных учебниках и справочниках значения электроотрицательности могут отличаться.
В таблице 2 приведена электроотрицательность некоторых химических элементов по шкале Сандерсона, а в таблице 3 — электроотрицательность элементов по шкале Полинга.
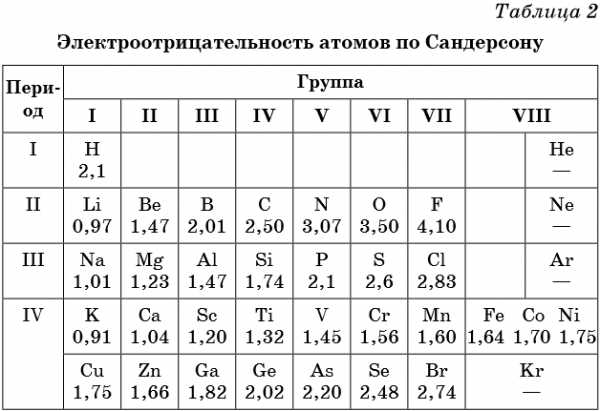
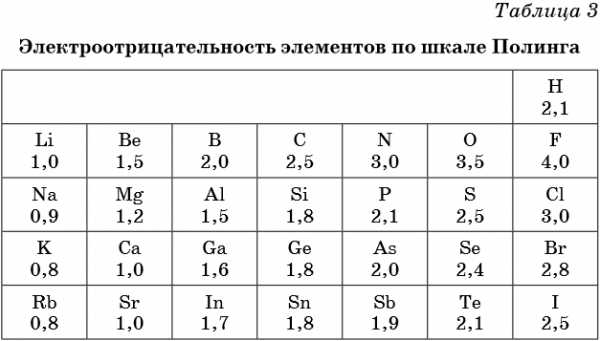
Значение электроотрицательности приведено под символом соответствующего элемента. Чем больше численное значение электроотрицательности атома, тем более электроотрицательным является элемент. Наиболее электроотрицательным является атом фтора, наименее электроотрицательным — атом рубидия. В молекуле, образованной атомами двух разных химических элементов, формальный отрицательный заряд будет у атома, численное значение электроотрицательности у которого будет выше. Так, в молекуле диоксида серы SO2 электроотрицательность атома серы равна 2,5, а значение электроотрицательности атома кислорода больше — 3,5. Следовательно, отрицательный заряд будет на атоме кислорода, а положительный — на атоме серы.
В молекуле аммиака NH3 значение электроотрицательности атома азота равно 3,0, а водорода — 2,1. Поэтому отрицательный заряд будет у атома азота, а положительный — у атома водорода.
Следует чётко знать общие тенденции изменения электроотрицательности. Поскольку атом любого химического элемента стремится приобрести устойчивую конфигурацию внешнего электронного слоя — октетную оболочку инертного газа, то электроотрицательность элементов в периоде увеличивается, а в группе электроотрицательность в общем случае уменьшается с увеличением атомного номера элемента. Поэтому, например, сера более электроотрицательна по сравнению с фосфором и кремнием, а углерод более электроотрицателен по сравнению с кремнием.
При составлении формул соединений, состоящих из двух неметаллов, более электроотрицательный из них всегда ставят правее: PCl3, NO2. Из этого правила есть некоторые исторически сложившиеся исключения, например NH3, PH3 и т.д.
Степень окисления обычно обозначают арабской цифрой (со знаком перед цифрой), расположенной над символом элемента, например:
Для определения степени окисления атомов в химических соединениях руководствуются следующими правилами:
- Степень окисления элементов в простых веществах равна нулю.
- Алгебраическая сумма степеней окисления атомов в молекуле равна нулю.
- Кислород в соединениях проявляет главным образом степень окисления, равную –2 (во фториде кислорода OF2 + 2, в пероксидах металлов типа M2O2 –1).
- Водород в соединениях проявляет степень окисления + 1, за исключением гидридов активных металлов, например, щелочных или щёлочноземельных, в которых степень окисления водорода равна – 1.
- У одноатомных ионов степень окисления равна заряду иона, например: K+ — +1, Ba2+ — +2, Br– — –1, S2– — –2 и т. д.
- В соединениях с ковалентной полярной связью степень окисления более электроотрицательного атома имеет знак минус, а менее электроотрицательного — знак плюс.
- В органических соединениях степень окисления водорода равна +1.
Проиллюстрируем вышеприведённые правила несколькими примерами.
Пример 1. Определить степень окисления элементов в оксидах калия K2O, селена SeO3 и железа Fe3O4.
Оксид калия K2O. Алгебраическая сумма степеней окисления атомов в молекуле равна нулю. Степень окисления кислорода в оксидах равна –2. Обозначим степень окисления калия в его оксиде за n, тогда 2n + (–2) = 0 или 2n = 2, отсюда n = +1, т. е. степень окисления калия равна +1.
Оксид селена SeO3. Молекула SeO3 электронейтральна. Суммарный отрицательный заряд трёх атомов кислорода составляет –2 × 3 = –6. Следовательно, чтобы уравнять этот отрицательный заряд до ноля, степень окисления селена должна быть равна +6.
Молекула Fe3O4 электронейтральна. Суммарный отрицательный заряд четырёх атомов кислорода составляет –2 × 4 = –8. Чтобы уравнять этот отрицательный заряд, суммарный положительный заряд на трёх атомах железа должен быть равен +8. Следовательно, на одном атоме железа должен быть заряд 8/3 = +8/3.
Следует подчеркнуть, что степень окисления элемента в соединении может быть дробным числом. Такие дробные степени окисления не имеют смысла при объяснении связи в химическом соединении, но могут быть использованы для составления уравнений окислительно-восстановительных реакций.
Пример 2. Определить степень окисления элементов в соединениях NaClO3, K2Cr2O7.
Молекула NaClO3 электронейтральна. Степень окисления натрия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хлора за n, тогда +1 + n + 3 × (–2) = 0, или +1 + n – 6 = 0, или n – 5 = 0, отсюда n = +5. Таким образом, степень окисления хлора равна +5.
Молекула K2Cr2O7 электронейтральна. Степень окисления калия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хрома за n, тогда 2 × 1 + 2n + 7 × (–2) = 0, или +2 + 2n – 14 = 0, или 2n – 12 = 0, 2n = 12, отсюда n = +6. Таким образом, степень окисления хрома равна +6.
Пример 3. Определим степени окисления серы в сульфат-ионе SO42–. Ион SO42– имеет заряд –2. Степень окисления кислорода равна –2. Обозначим степень окисления серы за n, тогда n + 4 × (–2) = –2, или n – 8 = –2, или n = –2 – (–8), отсюда n = +6. Таким образом, степень окисления серы равна +6.
Следует помнить, что степень окисления иногда не равна валентности данного элемента.
Например, степени окисления атома азота в молекуле аммиака NH3 или в молекуле гидразина N2H4 равны –3 и –2 соответственно, тогда как валентность азота в этих соединениях равна трём.
Максимальная положительная степень окисления для элементов главных подгрупп, как правило, равна номеру группы (исключения: кислород, фтор и некоторые другие элементы).
Максимальная отрицательная степень окисления равна 8 — номер группы.
Тренировочные задания
1. В каком соединении степень окисления фосфора равна +5?
1) HPO3
2) H3PO3
3) Li3P
4) AlP
2. В каком соединении степень окисления фосфора равна –3?
1) HPO3
2) H3PO3
3) Li3PO4
4) AlP
3. В каком соединении степень окисления азота равна +4?
1) HNO2
2) N2O4
3) N2O
4) HNO3
4. В каком соединении степень окисления азота равна –2?
1) NH3
2) N2H4
3) N2O5
4) HNO2
5. В каком соединении степень окисления серы равна +2?
1) Na2SO3
2) SO2
3) SCl2
4) H2SO4
6. В каком соединении степень окисления серы равна +6?
1) Na2SO3
2) SO3
3) SCl2
4) H2SO3
7. В веществах, формулы которых CrBr2, K2Cr2O7, Na2CrO4, степень окисления хрома соответственно равна
1) +2, +3, +6
2) +3, +6, +6
3) +2, +6, +5
4) +2, +6, +6
8. Минимальная отрицательная степень окисления химического элемента, как правило, равна
1) номеру периода
2) порядковому номеру химического элемента
3) числу электронов, недостающих до завершения внешнего электронного слоя
4) общему числу электронов в элементе
9. Максимальная положительная степень окисления химических элементов, расположенных в главных подгруппах, как правило, равна
1) номеру периода
2) порядковому номеру химического элемента
3) номеру группы
4) общему числу электронов в элементе
10. Фосфор проявляет максимальную положительную степень окисления в соединении
1) HPO3
2) H3PO3
3) Na3P
4) Ca3P2
11. Фосфор проявляет минимальную степень окисления в соединении
1) HPO3
2) H3PO3
3) Na3PO4
4) Ca3P2
12. Атомы азота в нитрите аммония, находящиеся в составе катиона и аниона, проявляют степени окисления соответственно
1) –3, +3
2) –3, +5
3) +3, –3
4) +3, +5
13. Валентность и степень окисления кислорода в перекиси водорода соответственно равны
1) II, –2
2) II, –1
3) I, +4
4) III, –2
14. Валентность и степень окисления серы в пирите FeS2 соответственно равны
1) IV, +5
2) II, –1
3) II, +6
4) III, +4
15. Валентность и степень окисления атома азота в бромиде аммония соответственно равны
1) IV, –3
2) III, +3
3) IV, –2
4) III, +4
16. Атом углерода проявляет отрицательную степень окисления в соединении с
1) кислородом
2) натрием
3) фтором
4) хлором
17. Постоянную степень окисления в своих соединениях проявляет
1) стронций
2) железо
3) сера
4) хлор
18. Степень окисления +3 в своих соединениях могут проявлять
1) хлор и фтор
2) фосфор и хлор
3) углерод и сера
4) кислород и водород
19. Степень окисления +4 в своих соединениях могут проявлять
1) углерод и водород
2) углерод и фосфор
3) углерод и кальций
4) азот и сера
20. Степень окисления, равную номеру группы, в своих соединениях проявляет
1) хлор
2) железо
3) кислород
4) фтор
Ответы
himi4ka.ru
Приложение к уроку по теме «Степень окисления» (8 класс)
Правила определения степени окисления (с.о.)
1. Простые вещества имеют с.о. 0 К0, Mg0, N20, О20, Р0, Н20
2. Всегда отрицательную с.о. имеет фтор F-1
3. Кислород имеет с.о. -2 (кроме фторида кислорода, но он вам не встретится и перекиси водорода Н2+О2—) О-2
4. В большинстве соединений водород имеет с.о. + (кроме соединений с металлами Н—) Н+
5. Металлы всегда имеют положительную с.о.
I группа +1
II группа +2
III группа +3
6. Высшая с.о. всегда положительная (кроме фтора) и равна номеру группы
Низшая с.о. всегда отрицательная (кроме металлов) и равна номер группы -8
7. В соединениях суммарная с.о. всегда равна 0
Правила определения степени окисления (с.о.)
1. Простые вещества имеют с.о. 0 К0, Mg0, N20, О20, Р0, Н20
2. Всегда отрицательную с.о. имеет фтор F-1
3. Кислород имеет с.о. -2 (кроме фторида кислорода, но он вам не встретится и перекиси водорода Н2+О2—) О-2
4. В большинстве соединений водород имеет с.о. + (кроме соединений с металлами Н—) Н+
5. Металлы всегда имеют положительную с.о.
I группа +1
II группа +2
III группа +3
6. Высшая с.о. всегда положительная (кроме фтора) и равна номеру группы
Низшая с.о. всегда отрицательная (кроме металлов) и равна номер группы -8
7. В соединениях суммарная с.о. всегда равна 0
Алгоритм определения степеней окисления по формуле:
Определение степеней окисления (Р2О5) начинают с того элемента, у которого с.о. постоянная или известна в соответствии с правилами, в данном случае кислород
Умножить с.о. на индекс атома (или группы) (– 2 * 5 = – 10)
Полученное число разделить на индекс второго элемента (– 10 / 2 = – 5)
Записать полученную с.о. с противоположным знаком (Р2+5О5-2).
Алгоритм составления формул по названиям:
Записать знаки элементов (частиц) в порядке: на первом месте – положительно заряженную, на втором – отрицательно заряженную ( Al O )
Расставить степени окисления ( Al+3 O-2)
Найти наименьшее общее кратное (НОК) между значениями степеней окисления
Разделить НОК на значение степеней окисления, полученные результаты записать как индексы (6/3=2; 6/3=3 Al2O3)
Алгоритм определения степеней окисления по формуле:
Определение степеней окисления (Р2О5) начинают с того элемента, у которого с.о. постоянная или известна в соответствии с правилами, в данном случае кислород
Умножить с.о. на индекс атома (или группы) (– 2 * 5 = – 10)
Полученное число разделить на индекс второго элемента (– 10 / 2 = – 5)
Записать полученную с.о. с противоположным знаком (Р2+5О5-2).
Алгоритм составления формул по названиям:
Записать знаки элементов (частиц) в порядке: на первом месте – положительно заряженную, на втором – отрицательно заряженную ( Al O )
Расставить степени окисления ( Al+3 O-2)
Найти наименьшее общее кратное (НОК) между значениями степеней окисления
Разделить НОК на значение степеней окисления, полученные результаты записать как индексы (6/3=2; 6/3=3 Al2O3)
1) Определите с.о. элементов в соедининиях
А) Cl2O7, MnO2, P2O5, CaO, Na2O
Б) HCl, NH3, CH4, LiH , PH3, NaH
В) CaS, Al2S3, K2S , MgS, Li2S
Г) NaCl , AlCl3, ZnCl2, KCl
2) Составьте формулы соединений элементов K Mg AL с
— кислородом
— хлором
— серой (II)
3)Определите степени окисления:
фосфора в: PH3, P2O3, H3PO4, Mg3P2;
брома: NaBr, HBrO, KBrO3, Br2O5;
хрома: Cr2O3, K2CrO4, H2Cr2O7, Cr(OH)3;
марганца: MnO, KMnO4, MnCl2, H2MnO4;
серы: CaS, SO3, H2SO3, BaSO4;
хлора: HClO, HClO2, BaCl2, Cl2O7;
железа: Fe2O3, Fe2S3, FeSO4, H2FeO4.
1) Определите с.о. элементов в соедининиях
А) Cl2O7, MnO2, P2O5, CaO, Na2O
Б) HCl, NH3, CH4, LiH , PH3, NaH
В) CaS, Al2S3, K2S , MgS, Li2S
Г) NaCl , AlCl3, ZnCl2, KCl
2) Составьте формулы соединений элементов K Mg AL с
— кислородом
— хлором
— серой (II)
3)Определите степени окисления:
фосфора в: PH3, P2O3, H3PO4, Mg3P2;
брома: NaBr, HBrO, KBrO3, Br2O5;
хрома: Cr2O3, K2CrO4, H2Cr2O7, Cr(OH)3;
марганца: MnO, KMnO4, MnCl2, H2MnO4;
серы: CaS, SO3, H2SO3, BaSO4;
хлора: HClO, HClO2, BaCl2, Cl2O7;
железа: Fe2O3, Fe2S3, FeSO4, H2FeO4.
infourok.ru
Ph4, степень окисления фосфора и водорода в нем
Общие сведения о фосфине и степени окисления в Ph4
Брутто-формула – PH3 (строение молекулы показано на рис. 1). Молярная масса фосфина равна 34,00 г/моль.
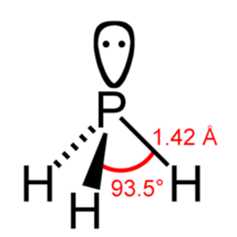
Рис. 1. Строение молекулы фосфина с указанием валентного угла и длины химической связи.
При низких температурах образует твердый кларат 8PH3×46H2O. Плотность – 1,5294 г/л. Температура кипения – (-87,42oC), плавления – (-133,8oC).
В ОВР является сильным восстановителем, окисляется концентрированной серной и азотной кислотами, йодом, кислородом, пероксидом водорода, гипохлоритом натрия. Донорные свойства выражены значительно слабее, чем у аммиака.
Ph4, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав фосфина, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Фосфин – это тривиальное название гидрида фосфора, а, как известно, степень окисления водорода в гидридах равна (+1). Для нахождения степени окисления фосфора примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 3×(+1) = 0;
x + 3 = 0;
x = -3.
Значит степень окисления фосфора в фосфине равна (-3):
P-3H+13.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
