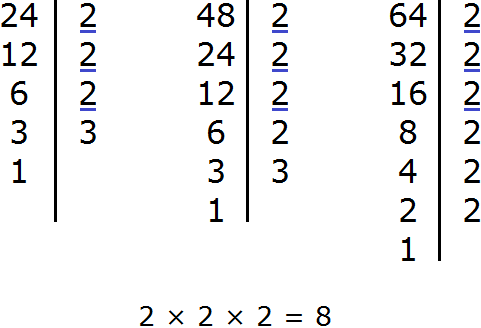Наибольший общий делитель 20 и 24
Калькулятор «Наибольший общий делитель»
Какой наибольший общий делитель у чисел 20 и 24?
Ответ: НОД чисел 20 и 24 это 4
(четыре)
Нахождение наибольшего общего делителя для чисел 20 и 24 используя перечисление всех делителей
Первый способ нахождения НОД для чисел 20 и 24 — это перечисление всех делителей для обоих чисел и выбор из них наибольшего общего:
Все делители числа 20: 1, 2, 4, 5, 10, 20
Все делители числа 24: 1, 2, 3, 4, 6, 8, 12, 24
Следовательно, наибольший общий делитель для чисел 20 и 24 это 4
Нахождение наибольшего общего делителя для чисел 20 и 24 используя разложение чисел на простые множители
Второй способ нахождения наибольшего общего делителя для числе 20 и 24 — это перечисление всех простых множителей для чисел и перемножение общих.
Простые множители числа 20: 2, 2, 5
Простые множители числа 24: 2, 2, 2, 3
Как мы видим, у чисел есть общие простые множители: 2, 2
Для нахождения НОД необходимо их перемножить: 2 × 2 = 4
Похожие расчеты
Поделитесь текущим расчетом
Печать
https://calculat.io/ru/number/greatest-common-factor-of/20—24
<a href=»https://calculat.io/ru/number/greatest-common-factor-of/20—24″>Наибольший общий делитель 20 и 24 — Calculatio</a>
О калькуляторе «Наибольший общий делитель»
Данный калькулятор поможет найти наибольший общий делитель двух чисел. Например, он может помочь узнать какой наибольший общий делитель у чисел 20 и 24? Выберите первое число (например ’20’) и второе число (например ’24’). После чего нажмите кнопку ‘Посчитать’.
Наибольший общий делитель (НОД) для двух чисел - это наибольшее положительное целое число, которое делит каждое из целых чисел с нулевым остатком.
Калькулятор «Наибольший общий делитель»
Таблица наибольших общих делителей
| Число 1 | Число 2 | НОД |
|---|---|---|
| 5 | 24 | 1 |
| 6 | 24 | 6 |
| 7 | 24 | 1 |
| 8 | 24 | 8 |
| 9 | 24 | 3 |
| 10 | 24 | 2 |
| 11 | 24 | 1 |
| 12 | 24 | 12 |
| 13 | 24 | 1 |
| 14 | 24 | 2 |
| 15 | 24 | 3 |
| 16 | 24 | 8 |
| 17 | 24 | 1 |
| 18 | 24 | 6 |
| 19 | 24 | 1 |
| 20 | 24 | 4 |
| 21 | 24 | 3 |
| 22 | 24 | 2 |
| 23 | 24 | 1 |
| 24 | 24 | 24 |
| 25 | 24 | 1 |
| 26 | 24 | 2 |
| 27 | 24 | 3 |
| 28 | 24 | 4 |
| 29 | 24 | 1 |
| 30 | 24 | 6 |
| 31 | 24 | 1 |
| 32 | 24 | 8 |
| 33 | 24 | 3 |
| 34 | 24 | 2 |
Подсчет лимфатических узлов и показатели выживаемости после резекции по поводу рака толстой и прямой кишки
Gastrointest Cancer Res. 2009 март-апрель; 3 (2 Приложение 1): S33–S35.
2009 март-апрель; 3 (2 Приложение 1): S33–S35.
Информация об авторе Информация об авторских правах и лицензии Заявление об ограничении ответственности
Во время резекции толстой и прямой кишки может быть важно удалить и исследовать достаточное количество лимфатических узлов. Более обширная узловая резекция была связана с более низкой частотой рецидивов рака; позволяет более точно определить стадию рака и, таким образом, более целесообразно использовать адъювантную химиотерапию для пациентов с положительными лимфоузлами; и был связан с улучшением выживаемости после резекции рака толстой и прямой кишки. На количество исследованных лимфатических узлов влияют многие факторы, в том числе объем хирургической резекции, возраст пациента, локализация опухоли и методы патологии. Минимум 12 узлов был одобрен в качестве согласованного стандарта для проведения колэктомии в больнице при раке толстой кишки. Однако использование количества лимфатических узлов, исследованных на уровне стационара, не может существенно повлиять на стадирование, использование адъювантной химиотерапии или выживаемость пациентов. При раке прямой кишки повышенное внимание к адекватным периферическим радиальным краям и использование предоперационной лучевой терапии для опухолей промежуточного и высокого риска может усложнить оценку взаимосвязи между количеством исследованных лимфатических узлов и результатами лечения пациентов; данные свидетельствуют о том, что количество лимфатических узлов (общее и количество положительных) в ректальном образце значительно ниже после проведения предоперационной лучевой терапии. Несмотря на то, что остается мало споров о прогностической важности увеличения числа лимфатических узлов для отдельных пациентов, неясно, является ли количество лимфатических узлов полезным индикатором качества больницы.
При раке прямой кишки повышенное внимание к адекватным периферическим радиальным краям и использование предоперационной лучевой терапии для опухолей промежуточного и высокого риска может усложнить оценку взаимосвязи между количеством исследованных лимфатических узлов и результатами лечения пациентов; данные свидетельствуют о том, что количество лимфатических узлов (общее и количество положительных) в ректальном образце значительно ниже после проведения предоперационной лучевой терапии. Несмотря на то, что остается мало споров о прогностической важности увеличения числа лимфатических узлов для отдельных пациентов, неясно, является ли количество лимфатических узлов полезным индикатором качества больницы.
Качество хирургической резекции играет решающую роль в исходах лечения пациентов с раком толстой и прямой кишки. Патологическая стадия, включая гистологическую степень, лимфатическую инвазию, инвазию сосудов, молекулярные маркеры и наличие поражения лимфатических узлов, дает важную прогностическую информацию. В дополнение к описанию степени поражения лимфатических узлов может быть важно исследовать достаточное общее количество лимфатических узлов. Адекватная хирургическая резекция важна для местного контроля рака. Получение большего количества лимфатических узлов может принести пользу пациентам, поскольку позволяет более точно определить стадию рака и правильно использовать адъювантную химиотерапию для пациентов с положительными лимфатическими узлами (стадия III).
В дополнение к описанию степени поражения лимфатических узлов может быть важно исследовать достаточное общее количество лимфатических узлов. Адекватная хирургическая резекция важна для местного контроля рака. Получение большего количества лимфатических узлов может принести пользу пациентам, поскольку позволяет более точно определить стадию рака и правильно использовать адъювантную химиотерапию для пациентов с положительными лимфатическими узлами (стадия III).
В результате наблюдается высокий уровень интереса к подсчету лимфатических узлов и показателям выживаемости пациентов с раком толстой и прямой кишки. В этой статье будет рассмотрена связь между количеством лимфатических узлов и долгосрочной выживаемостью; проверить, существует ли минимальное, подходящее или оптимальное количество лимфатических узлов, которые следует удалить после резекции по поводу рака толстой или прямой кишки; и изучить значение подсчета лимфатических узлов как индикатора качества лечения рака.
За прошедшие годы несколько исследований с использованием ретроспективных когортных данных и данных административных требований продемонстрировали улучшение выживаемости среди больных раком толстой кишки, у которых после резекции было исследовано большее количество узлов. В нескольких обсервационных исследованиях была обнаружена связь между оценкой «адекватного» количества лимфатических узлов и улучшением выживаемости. 1 , 2 Во многих исследованиях преимущества наблюдались в группах стадирования узлов, отмечая улучшение выживаемости с увеличением числа удаленных лимфатических узлов среди пациентов с раком толстой кишки с поражением узлов и поражением узлов. 3 , 4 Поскольку увеличение выживаемости наблюдалось у пациентов с известным поражением лимфатических узлов, было предложено терапевтическое преимущество извлечения верхних лимфатических узлов.
В нескольких обсервационных исследованиях была обнаружена связь между оценкой «адекватного» количества лимфатических узлов и улучшением выживаемости. 1 , 2 Во многих исследованиях преимущества наблюдались в группах стадирования узлов, отмечая улучшение выживаемости с увеличением числа удаленных лимфатических узлов среди пациентов с раком толстой кишки с поражением узлов и поражением узлов. 3 , 4 Поскольку увеличение выживаемости наблюдалось у пациентов с известным поражением лимфатических узлов, было предложено терапевтическое преимущество извлечения верхних лимфатических узлов.
В недавнем систематическом обзоре изучалось, связано ли количество лимфатических узлов, извлеченных после резекции толстой кишки, с выживаемостью. 5 Шестнадцать из 17 исследований, включающих в общей сложности 61 371 пациента, показали положительную связь между количеством исследованных лимфатических узлов и выживаемостью больных раком толстой кишки II и III стадии. Данные убедительны, и существует общее согласие относительно прогностического значения этой переменной для долгосрочной выживаемости отдельных пациентов с раком толстой кишки.
Данные убедительны, и существует общее согласие относительно прогностического значения этой переменной для долгосрочной выживаемости отдельных пациентов с раком толстой кишки.
Однако связь между количеством лимфатических узлов и выживаемостью при раке прямой кишки не столь однородна. Анализ 1664 пациентов из национального межгруппового исследования адъювантной терапии рака прямой кишки выявил связь между большим количеством обследованных узлов и выживаемостью только у пациентов с отрицательными узлами. 6 Хотя такие результаты могут подтверждать роль адекватного извлечения лимфоузлов для определения стадии, установить причинно-следственную связь между степенью резекции, количеством исследованных лимфоузлов и выживаемостью невозможно, поскольку эта связь не наблюдалась у пациентов с позитивными лимфоузлами.
Международный союз по борьбе с раком, Американский объединенный комитет по раку и согласованная группа Национального института рака рекомендовали оценку не менее 12 узлов для обеспечения адекватного отбора проб. 7 – 9 Колледж американских патологоанатомов в течение многих лет рекомендовал патоморфологическое исследование не менее 12 лимфатических узлов, чтобы точно предсказать их отсутствие. 10 Если после тщательного макроскопического исследования обнаружено менее 12 узлов, рекомендуется использовать дополнительные методы улучшения зрения.
7 – 9 Колледж американских патологоанатомов в течение многих лет рекомендовал патоморфологическое исследование не менее 12 лимфатических узлов, чтобы точно предсказать их отсутствие. 10 Если после тщательного макроскопического исследования обнаружено менее 12 узлов, рекомендуется использовать дополнительные методы улучшения зрения.
Тем не менее, популяционные данные показывают, что только 37% больных раком толстой кишки имеют адекватную оценку лимфатических узлов (т. е. исследуют не менее 12 узлов). 11 Фактически, озабоченность по поводу повсеместного занижения стадии больных привела к разработке рекомендаций по рассмотрению возможности адъювантной химиотерапии у больных раком толстой кишки с небольшим количеством обследуемых узлов. 12
В недавнем систематическом обзоре подсчета лимфатических узлов сообщалось о широком диапазоне пороговых значений количества лимфоузлов, необходимого для улучшения выживаемости. 5 Выводы варьировались от 6 узлов 13 до 40 узлов. 14 Минимум в 12 узлов был одобрен многими группами, потому что было предположение о «убывающей отдаче» после изучения 12–17 узлов. 5 Однако неясно, улучшает ли более высокая скорость извлечения лимфатических узлов определение стадии рака толстой кишки, и причинно-следственный механизм между числом лимфатических узлов и выживаемостью остается неясным.
5 Выводы варьировались от 6 узлов 13 до 40 узлов. 14 Минимум в 12 узлов был одобрен многими группами, потому что было предположение о «убывающей отдаче» после изучения 12–17 узлов. 5 Однако неясно, улучшает ли более высокая скорость извлечения лимфатических узлов определение стадии рака толстой кишки, и причинно-следственный механизм между числом лимфатических узлов и выживаемостью остается неясным.
Многие факторы влияют на количество исследованных лимфатических узлов, включая объем хирургической резекции, возраст пациента, расположение опухоли и методы патологии. Факторы пациента также должны быть приняты во внимание; пожилой возраст и ожирение связаны с уменьшением восстановления лимфатических узлов. 11 , 15 Локализация опухоли может играть роль, так как правосторонние опухоли обычно ассоциируются с большим количеством исследованных лимфатических узлов. 5 Количество пораженных лимфатических узлов также может отражать улучшенный иммунный ответ пациента; как таковая, взаимосвязь между количеством узлов и выживаемостью может быть искажена реакцией опухоль-хозяин, поскольку более сильный иммунологический ответ приводит к улучшению выживаемости. 16
5 Количество пораженных лимфатических узлов также может отражать улучшенный иммунный ответ пациента; как таковая, взаимосвязь между количеством узлов и выживаемостью может быть искажена реакцией опухоль-хозяин, поскольку более сильный иммунологический ответ приводит к улучшению выживаемости. 16
Необходимо также учитывать факторы, зависящие от хирурга. Безусловно, объем резекции определяет хирург в операционной. Принятые онкологические принципы хирургической резекции включают резекцию пораженного сегмента толстой кишки и проксимальную перевязку питающей сосудистой ножки с лимфаденэктомией единым блоком связанных дренирующих лимфатических узлов. Если опухоль обнаружена между двумя дренирующими сосудами, важно включить распределение обоих этих сосудов. Патологическая оценка после хирургической резекции имеет решающее значение для определения последующего лечения, поскольку адъювантная химиотерапия показана пациентам с метастазами в лимфатические узлы. Кроме того, лапароскопические резекции толстой кишки должны проводиться по тем же стандартам, что и открытые операции. 17
Кроме того, лапароскопические резекции толстой кишки должны проводиться по тем же стандартам, что и открытые операции. 17
Резекция рака прямой кишки по анатомическим соображениям требует наличия адекватного окружного края. Выполнение тотальной мезоректальной эксцизии (ТМЭ) гарантирует, что жир, сосуды и лимфатические сосуды, содержащиеся в висцеральной тазовой фасции, удаляются единым блоком с ректальным раком. Вовлечение опухоли периферического края является наиболее важным фактором в прогнозировании местного рецидива и независимо увеличивает риск смерти от заболевания. 18 Также следует учитывать различия в объеме патологоанатомического исследования. Исследования показали, что различия в количестве исследованных лимфатических узлов могут быть связаны с тем, что ассистенты патологоанатома обрабатывают образцы 19 , или с практикой самих патологоанатомов. 20
Рак прямой кишки, особенно в контексте неоадъювантной терапии, заслуживает особого внимания при обсуждении частоты обследования лимфатических узлов. Предоперационная лучевая терапия, по-видимому, уменьшает количество исследованных лимфоузлов. 21 Неизвестно, уменьшает ли предоперационная химиолучевая терапия число лимфатических узлов в большей степени, чем только облучение. Из-за более широкого использования предоперационной лучевой терапии у пациентов с раком прямой кишки среднего и высокого риска прогностическое значение количества лимфатических узлов при раке прямой кишки менее ясно.
Предоперационная лучевая терапия, по-видимому, уменьшает количество исследованных лимфоузлов. 21 Неизвестно, уменьшает ли предоперационная химиолучевая терапия число лимфатических узлов в большей степени, чем только облучение. Из-за более широкого использования предоперационной лучевой терапии у пациентов с раком прямой кишки среднего и высокого риска прогностическое значение количества лимфатических узлов при раке прямой кишки менее ясно.
Хотя стадия зависит от количества положительных узлов, большее количество проверенных узлов не обязательно предсказывает наличие большего количества задействованных узлов. Чтобы помочь скорректировать проблему низкого количества лимфатических узлов, было предложено использовать «соотношения лимфатических узлов», чтобы помочь стратифицировать риск у пациентов со стадией III. Исследования показывают, что более низкое отношение количества положительных лимфоузлов к общему количеству исследованных лимфоузлов (рассчитанное как доля) связано как с безрецидивной выживаемостью, так и с общей выживаемостью при раке толстой кишки. 22
22
Недавно Национальный форум по качеству совместно с основными заинтересованными сторонами в области лечения рака, такими как Американское общество клинической онкологии (ASCO), Комиссия по раку Американского колледжа хирургов (CoC) и Национальный комплексный Раковая сеть (NCCN) одобрила минимальное количество 12 лимфатических узлов в качестве меры качества для улучшения результатов лечения пациентов с раком толстой кишки. 23 Хотя существует общепринятая связь между большим количеством извлеченных лимфатических узлов и улучшением долгосрочной выживаемости отдельных пациентов, механизм, лежащий в основе этой связи, полностью неизвестен. Индикатор качества предназначен для применения на уровне стационара, что кажется уместным, учитывая множество переменных, которые могут повлиять на результат. Однако неясно, приведет ли этот показатель в конечном итоге к улучшению выживаемости пациентов с раком толстой кишки.
Основываясь на недавнем анализе на уровне больниц, кажется, что большинство больниц не соответствуют минимальному количеству узлов в 12. 24 , 25 Количество лимфатических узлов, которые больницы исследуют в резекционных образцах рака толстой кишки, по-видимому, не оказывает существенного влияния на стадирование, использование адъювантной химиотерапии или выживаемость пациентов. 25 Вполне вероятно, что неучтенные факторы, связанные с пациентом или больницей, искажают взаимосвязь. Хотя существует консенсус в отношении того, что качество лечения рака можно улучшить, неясно, является ли обеспечение минимального количества лимфатических узлов правильной мерой качества для использования.
24 , 25 Количество лимфатических узлов, которые больницы исследуют в резекционных образцах рака толстой кишки, по-видимому, не оказывает существенного влияния на стадирование, использование адъювантной химиотерапии или выживаемость пациентов. 25 Вполне вероятно, что неучтенные факторы, связанные с пациентом или больницей, искажают взаимосвязь. Хотя существует консенсус в отношении того, что качество лечения рака можно улучшить, неясно, является ли обеспечение минимального количества лимфатических узлов правильной мерой качества для использования.
В то время как минимум 12 узлов обычно считается необходимым для точного стадирования, доказательства в поддержку этой меры как индикатора качества лечения рака отсутствуют на уровне стационара. Многочисленные исследования и достаточные данные подтверждают, что удаление большего количества лимфатических узлов связано с улучшением выживаемости отдельных пациентов, но причинно-следственная связь, лежащая в основе этой взаимосвязи, неизвестна. При резекциях рака важно придерживаться строгих онкологических принципов, включая перевязку сосудов и полную резекцию брыжейки толстой кишки единым блоком, лимфаденэктомию и периферические края (при раке прямой кишки). Кроме того, патологоанатомам важно тщательно исследовать резецированные образцы.
При резекциях рака важно придерживаться строгих онкологических принципов, включая перевязку сосудов и полную резекцию брыжейки толстой кишки единым блоком, лимфаденэктомию и периферические края (при раке прямой кишки). Кроме того, патологоанатомам важно тщательно исследовать резецированные образцы.
Раскрытие потенциальных конфликтов интересов
Д-р Вонг сообщил об отсутствии потенциальных конфликтов интересов.
1. Гольдштейн Н.С. Восстановление лимфатических узлов из 2427 образцов колоректальной резекции pT3 за 45 лет: рекомендации по минимальному количеству восстановленных лимфатических узлов на основе прогностических вероятностей. Ам Джей Патол. 2002;26:179–189. [PubMed] [Google Scholar]
2. Swanson RS, Compton CC, Stewart AK, et al. Прогноз рака толстой кишки T3N0 зависит от количества исследованных лимфатических узлов. Энн Сург Онкол. 2003; 10: 65–71. [PubMed] [Академия Google]
3. Чен С.Л., Бильчик А.Я. Более обширная узловая диссекция улучшает выживаемость при раке толстой кишки I-III стадий. Энн Сург. 2006; 244: 602–610. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Энн Сург. 2006; 244: 602–610. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. LeVoyer TE, Sigurdson ER, Hanlon AL, et al. Выживаемость при раке толстой кишки связана с увеличением числа анализируемых лимфатических узлов: вторичное исследование межгруппового исследования INT-0089. Дж. Клин Онкол. 2003;21:2912–2919. [PubMed] [Google Scholar]
5. Chang GJ, Rodriguez-Bigas MA, Skibber JM, et al. Оценка лимфатических узлов и выживаемость после радикальной резекции рака толстой кишки: систематический обзор. J Natl Cancer Inst. 2007;99: 433–441. [PubMed] [Google Scholar]
6. Tepper JE, O’Connell MJ, Niedzwiecki D, et al. Влияние количества извлеченных узлов на исход у пациентов с раком прямой кишки. Дж. Клин Онкол. 2001; 19: 157–163. [PubMed] [Google Scholar]
7. Собин Л.Х., Грин Ф.Л. Классификация TNM: уточнение количества региональных узлов для pN0. Рак. 2001;92:452. [PubMed] [Google Scholar]
8. Wittekind CH, Wagner G, редакторы. TNM-классификация злокачественных опухолей. Нью-Йорк, штат Нью-Йорк: Спрингер; 1997. Ободочная и прямая кишка; стр. 64–67. [Google Scholar]
Нью-Йорк, штат Нью-Йорк: Спрингер; 1997. Ободочная и прямая кишка; стр. 64–67. [Google Scholar]
9. Nelson H, Petrelli N, Carlin A, et al. Руководство 2000 г. по хирургии рака толстой и прямой кишки. J Natl Cancer Inst. 2001; 93: 583–596. [PubMed] [Google Scholar]
10. Compton CC, Fielding LP, Burgart LJ, et al. Прогностические факторы при колоректальном раке: Консенсусное заявление Коллегии американских патологоанатомов, 1999 г. Arch Pathol Lab Med. 2000; 124:979–994. [PubMed] [Google Scholar]
11. Baxter NN, Virnig DJ, Rothenberger DA, et al. Оценка лимфатических узлов у пациентов с колоректальным раком: популяционное исследование. J Natl Cancer Inst. 2005;97: 219–225. [PubMed] [Google Scholar]
12. Benson AB, Schrag D, Somerfield MR, et al. Рекомендации Американского общества клинической онкологии по адъювантной химиотерапии рака толстой кишки II стадии. Дж. Клин Онкол. 2004; 22:3408–4219. [PubMed] [Google Scholar]
13. Caplin S, Cerottini JP, Bosman FT, et al. Для пациентов с колоректальной карциномой Dukes B (стадия II по TNM) исследование шести или менее лимфатических узлов связано с плохим прогнозом. Рак. 1998; 83: 666–672. [PubMed] [Академия Google]
Для пациентов с колоректальной карциномой Dukes B (стадия II по TNM) исследование шести или менее лимфатических узлов связано с плохим прогнозом. Рак. 1998; 83: 666–672. [PubMed] [Академия Google]
14. Джозеф Н.Э., Сигурдсон Э.Р., Хэнлон А.Л. и соавт. Точность определения отрицательности узлов при колоректальном раке на основе количества узлов, извлеченных при резекции. Энн Сург Онкол. 2003; 10: 213–218. [PubMed] [Google Scholar]
15. Gorog D, Nagy P, Peter A, et al. Влияние ожирения на восстановление лимфатических узлов из образцов ректальной резекции. Патол Онкол Рез. 2003;9:180–183. [PubMed] [Google Scholar]
16. Pages F, Berger A, Camus M, et al. Эффекторные Т-клетки памяти, раннее метастазирование и выживаемость при колоректальном раке. N Engl J Med. 2005; 353: 2654–2666. [PubMed] [Академия Google]
17. Флешман Дж., Сарджент Д.Дж., Грин Э. и др. Лапароскопическая колэктомия при раке не уступает открытой хирургии на основании 5-летних данных исследования COST Study Group. Энн Сург. 2007;246:655–662. [PubMed] [Google Scholar]
Энн Сург. 2007;246:655–662. [PubMed] [Google Scholar]
18. Birbeck KF, Macklin CP, Tiffin NJ, et al. Частота вовлечения окружного края варьируется у разных хирургов и позволяет предсказать результаты хирургического лечения рака прямой кишки. Энн Сург. 2002; 235:449–457. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Остади М.А., Харниш Дж.Л., Стегиенко С. и соавт. Факторы, влияющие на количество лимфатических узлов, извлеченных в образцах колоректального рака. Surg Endosc. 2007;21:2142–2146. [PubMed] [Академия Google]
20. Lemmens VE, van Lijnschoten I, Janssen-Heijnen ML, et al. Образцы практики патологии влияют на оценку лимфатических узлов и исход рака толстой кишки: популяционное исследование. Энн Онкол. 2006; 17: 1803–1809. [PubMed] [Google Scholar]
21. Baxter NN, Morris AM, Rothenberger DA, et al. Влияние предоперационного облучения при раке прямой кишки на последующую оценку лимфатических узлов: популяционный анализ. Int J Radiat Oncol Biol Phys. 2005; 61: 426–431. [PubMed] [Академия Google]
2005; 61: 426–431. [PubMed] [Академия Google]
22. Berger AC, Sigurdson ER, LeVoyer T, et al. Выживаемость при раке толстой кишки связана с уменьшением соотношения метастатических и исследованных лимфатических узлов. Дж. Клин Онкол. 2005; 23:8706–8712. [PubMed] [Google Scholar]
23. Национальный форум по качеству. Спецификации национальных добровольных согласованных стандартов для рака молочной железы и толстой кишки. 2008.
24. Bilimoria KY, Bentrem DJ, Stewart AK, et al. Оценка лимфатических узлов как мера качества рака толстой кишки: табель успеваемости национальной больницы. J Natl Cancer Inst. 2008; 100:1310–1317. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Wong SL, Ji H, Hollenbeck BK, et al. Частота обследования лимфатических узлов в больнице и выживаемость после резекции по поводу рака толстой кишки. ДЖАМА. 2007; 298:2149–2154. [PubMed] [Google Scholar]
Узловая стадия — PMC
злокачественность. Бр Дж Радиол. 1995; 68: 266–70. дои: 10.1259/0007-1285-68-807-266. PMid:7735765. [PubMed] [Академия Google]
дои: 10.1259/0007-1285-68-807-266. PMid:7735765. [PubMed] [Академия Google]
2. Na DG, Lim HK, Byun HS, Kim HD, Ko YH, Baek JH. Дифференциальный диагноз шейной лимфаденопатии: полезность цветной допплерографии. AJR Am J Рентгенол. 1997; 168:1311–6. [PubMed] [Google Scholar]
3. Steinkamp HJ, Mueffelmann M, Böck JC, Thiel T, Kenzel P, Felix R. Дифференциальная диагностика поражений лимфатических узлов: полуколичественный подход с цветной допплерографией. Бр Дж Радиол. 1998; 71: 828–33. [PubMed] [Google Scholar]
4. Чой М.Ю., Ли Дж.В., Джанг К.Дж. Различие между доброкачественными и злокачественными причинами шейной, подмышечной и паховой лимфаденопатии: значение допплеровского спектрального анализа. AJR Am J Рентгенол. 1995;165:981–4. [PubMed] [Google Scholar]
5. Magarelli N, Guglielmi G, Savastano M, et al. Поверхностная воспалительная и первичная неопластическая лимфаденопатия: диагностическая точность энергетической допплерографии. Евр Дж Радиол. 2004; 52: 257–63. doi:10.1016/j.ejrad.2003.10.020. PMid:15544903. [PubMed] [Google Scholar]
doi:10.1016/j.ejrad.2003.10.020. PMid:15544903. [PubMed] [Google Scholar]
6. Adibelli ZH, Unal G, Gül E, Uslu F, Koçak U, Abali Y. Дифференциация доброкачественных и злокачественных шейных лимфатических узлов: значение B-режима и цветная допплерография. Евр Дж Радиол. 1998;28:230–4. doi: 10.1016/S0720-048X(97)00174-5. [PubMed] [Google Scholar]
7. Schroeder RJ, Maeurer J, Gath HJ, Willam C, Hidajat N. Анализ васкуляризации реактивно увеличенных лимфатических узлов с помощью цветной дуплексной сонографии. J Oral Maxillofac Surg. 1999;57:1090–5. doi: 10.1016/S0278-2391(99)90332-4. [PubMed] [Google Scholar]
8. Дорфман Р.Е., Альперн М.Б., Гросс Б.Х., Сандлер М.А. Верхние абдоминальные лимфатические узлы: критерии нормального размера, определенные с помощью КТ. Радиология. 1991; 180:319–22. [PubMed] [Академия Google]
9. Magnusson, A. Размер нормальных забрюшинных лимфатических узлов. Acta Radiol Diagn (Stockh) 1983; 24:315–8. [PubMed] [Google Scholar]
10. Эйнштейн Д.М., Сингер А.А., Чилкот В.А., Десаи Р.К. Абдоминальная лимфаденопатия: спектр данных КТ. Рентгенография. 1991; 11: 457–72. [PubMed] [Google Scholar]
Эйнштейн Д.М., Сингер А.А., Чилкот В.А., Десаи Р.К. Абдоминальная лимфаденопатия: спектр данных КТ. Рентгенография. 1991; 11: 457–72. [PubMed] [Google Scholar]
11. Винникомб С.Дж., Норман А.Р., Николсон В., Муж Дж.Е. Нормальные тазовые лимфатические узлы: оценка с помощью КТ после бипедальной лимфангиографии. Радиология. 1995; 194:349–55. [PubMed] [Академия Google]
12. Гросс Б.Х., Глейзер Г.М., Оррингер М.Б., Спизарный Д.Л., Флинт А. Метастатическая бронхогенная карцинома в лимфатические узлы нормального размера: частота и значимость. Радиология. 1988; 166 (1 часть 1): 71–4. [PubMed] [Google Scholar]
13. Kayser K, Bach S, Bülzebruck H, Vogt-Moykopf I, Probst G. Место, размер и опухолевое поражение резецированных внелегочных лимфатических узлов при раке легкого. Дж. Хирург Онкол. 1990;43:45–9. дои: 10.1002/jso.2930430112. PMid:2153261. [PubMed] [Google Scholar]
14. Staples CA, Müller NL, Miller RR, Evans KG, Nelems B. Узлы средостения при бронхогенной карциноме: сравнение КТ и медиастиноскопии. Радиология. 1988;167:367–72. [PubMed] [Google Scholar]
Радиология. 1988;167:367–72. [PubMed] [Google Scholar]
15. McLoud TC, Bourgouin PM, Greenberg RW, et al. Бронхогенная карцинома: анализ стадирования в средостении с помощью КТ путем корреляционного картирования лимфатических узлов и отбора проб. Радиология. 1992; 182:319–23. [PubMed] [Google Scholar]
16. Brown G, Richards CJ, Bourne MW, et al. Морфологические предикторы состояния лимфатических узлов при раке прямой кишки с использованием МРТ высокого пространственного разрешения с гистопатологическим сравнением. Радиология. 2003; 227: 371–7. doi: 10.1148/radiol.2272011747. Среднее: 12732695. [PubMed] [Google Scholar]
17. Мацукума К., Цукамото Н., Мацуяма Т., Оно М., Накано Х. Предоперационное КТ-исследование лимфатических узлов при раке шейки матки – его корреляция с гистологическими данными. Гинекол Онкол. 1989; 33: 168–71. дои: 10.1016/0090-8258(89)90544-1. [PubMed] [Google Scholar]
18. Yang WT, Lam WW, Yu MY, Cheung TH, Metreweli C. Сравнение динамической спиральной КТ и динамической МРТ в оценке тазовых лимфатических узлов при раке шейки матки. AJR Am J Рентгенол. 2000;175:759–66. [PubMed] [Google Scholar]
AJR Am J Рентгенол. 2000;175:759–66. [PubMed] [Google Scholar]
19. Scatarige JC, Fishman EK, Kuhajda FP, Taylor GA, Siegelman SS. Узловые метастазы с низкой аттенюацией при карциноме яичка. J Comput Assist Томогр. 1983; 7: 682–7. [PubMed] [Google Scholar]
20. Barentsz JO, Jager GJ, van Vierzen PB, et al. Стадирование рака мочевого пузыря после трансуретральной биопсии: ценность быстрой динамической МРТ с контрастным усилением. Радиология. 1996; 201:185–93. [PubMed] [Google Scholar]
21. Noworolski SM, Fischbein NJ, Kaplan MJ, et al. Проблемы динамической МРТ с контрастным усилением шейных лимфатических узлов для выявления метастатического заболевания. J Magn Reson Imaging. 2003; 17: 455–62. дои: 10.1002/jmri.10280. PMid:12655585. [PubMed] [Академия Google]
22. Муж Ю.Э., Кох Д.М. Рак мочевого пузыря. В: Муж Дж. Э., Резнек Р. Х., редакторы. Визуализация в онкологии. Лондон: Мартин Дуниц Лтд.; 2004. стр. 343–74. [Google Scholar]
23. Голлуб М.Дж. , Кастеллино Р.А. Хиллиозные цистерны: потенциальная имитация ретрокруральной лимфаденопатии на КТ. Радиология. 1996; 199: 477–80. [PubMed] [Google Scholar]
, Кастеллино Р.А. Хиллиозные цистерны: потенциальная имитация ретрокруральной лимфаденопатии на КТ. Радиология. 1996; 199: 477–80. [PubMed] [Google Scholar]
24. Schreurs LM, Pultrum BB, Koopmans KP, et al. Лучшая оценка узловых метастазов с помощью слияния ПЭТ/КТ по сравнению с параллельной ПЭТ/КТ при раке пищевода. Противораковый Рез. 2008; 28 (3B): 1867–73. [PubMed] [Академия Google]
25. Tiguert R, Gheiler EL, Tefilli MV, et al. Размер лимфатических узлов не коррелирует с наличием метастазов рака предстательной железы. Урология. 1999; 53: 367–71. doi: 10.1016/S0090-4295(98)00518-4. [PubMed] [Google Scholar]
26. Голимбу М., Моралес П., Аль-Аскари С., Браун Дж. Расширенная тазовая лимфаденэктомия при раке предстательной железы. Дж Урол. 1979; 121: 617–20. [PubMed] [Google Scholar]
27. Sohn KM, Lee JM, Lee SY, Ahn BY, Park SM, Kim KM. Сравнение МРТ и КТ при стадировании рака желудка. AJR Am J Рентгенол. 2000; 174:1551–7. [PubMed] [Академия Google]
28.
29. Kim SH, Choi BI, Lee HP, et al. Рак шейки матки: сравнение данных КТ и МРТ. Радиология. 1990; 175:45–51. [PubMed] [Google Scholar]
30. Kim SH, Kim SC, Choi BI, Han MC. Рак шейки матки: оценка метастазов в тазовые лимфатические узлы с помощью МРТ. Радиология. 1994;190:807–11. [PubMed] [Google Scholar]
31. Williams AD, Cousins C, Soutter WP, et al. Обнаружение метастазов в тазовых лимфатических узлах при гинекологических злокачественных новообразованиях: сравнение КТ, МРТ и позитронно-эмиссионной томографии. AJR Am J Рентгенол. 2001; 177: 343–8. [PubMed] [Google Scholar]
32. Fukuda H, Nakagawa T, Shibuya H. Метастазы в тазовые лимфатические узлы от карциномы в полости таза: диагностика с помощью КТ тонкого среза. Клин Радиол. 1999; 54: 237–42. дои: 10.
33. Oyen RH, Van Poppel HP, Ameye FE, Van de Voorde WA, Baert AL, Baert LV. Стадирование лимфатических узлов локализованной карциномы предстательной железы с помощью КТ и тонкоигольной аспирационной биопсии под контролем КТ: проспективное исследование 285 пациентов. Радиология. 1994; 190:315–22. [PubMed] [Google Scholar]
34. Костакоглу Л., Леонард Дж. П., Коулман М., Голдсмит С. Дж. Роль ФДГ-ПЭТ в лечении лимфомы. Clin Adv Hematol Oncol. 2004;2:115–21. [PubMed] [Академия Google]
35. Eisenhauera EA, Therasse P, Bogaerts J, et al. Новые критерии оценки ответа при солидных опухолях: пересмотренное руководство RECIST (версия 1.1) Eur J Cancer. 2009; 45: 228–47. doi:10.1016/j.ejca.2008.10.026. PM: 19097774. [PubMed] [Google Scholar]
36. Harisinghani MG, Barentsz J, Hahn PF, et al. Неинвазивное обнаружение клинически скрытых метастазов в лимфатических узлах при раке предстательной железы. N Engl J Med. 2003; 348: 2491–9.