Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
youtube.com/embed/4sKc0lcxi7g» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/g4ioDc7sLwU» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/zW5JhiZ4140″ frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
Ответы на контрольную работу по теме «Подгруппа азота» (Габриелян) решебник
Вариант 1.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Число нейтронов в атоме 4N14:
А. 7.
2. Распределение электронов по энергетическим уровням в атоме элемента 2е, 5е соответствует:
Б. Азоту.
3. Азот имеет степень окисления +5 в соединении с формулой:
Г. HN03.
4. Минимальная степень окисления азота в соединении (из перечисленных ниже) с формулой:
А. N2.
5. Из перечисленных химических элементов наибольшей электроотрицательностью в соединениях обладает:
Б. Фосфор.
Фосфор.
6. Наименьший радиус у атома:
Г. F.
7. Только восстановителем может быть вещество с формулой:
Б. Са3Р2.
8. Азотистой кислоте соответствует оксид с формулой:
Б. N203.
9. Самая сильная из кислот, формулы которых:
А. HN03.
10. Коэффициент перед окислителем в реакции, схема которой
Ag + HN03(KOHЦ) —> AgN03 + N02 + Н20:
Б. 4.
ЧАСТЬ Б. Задания со свободным ответом
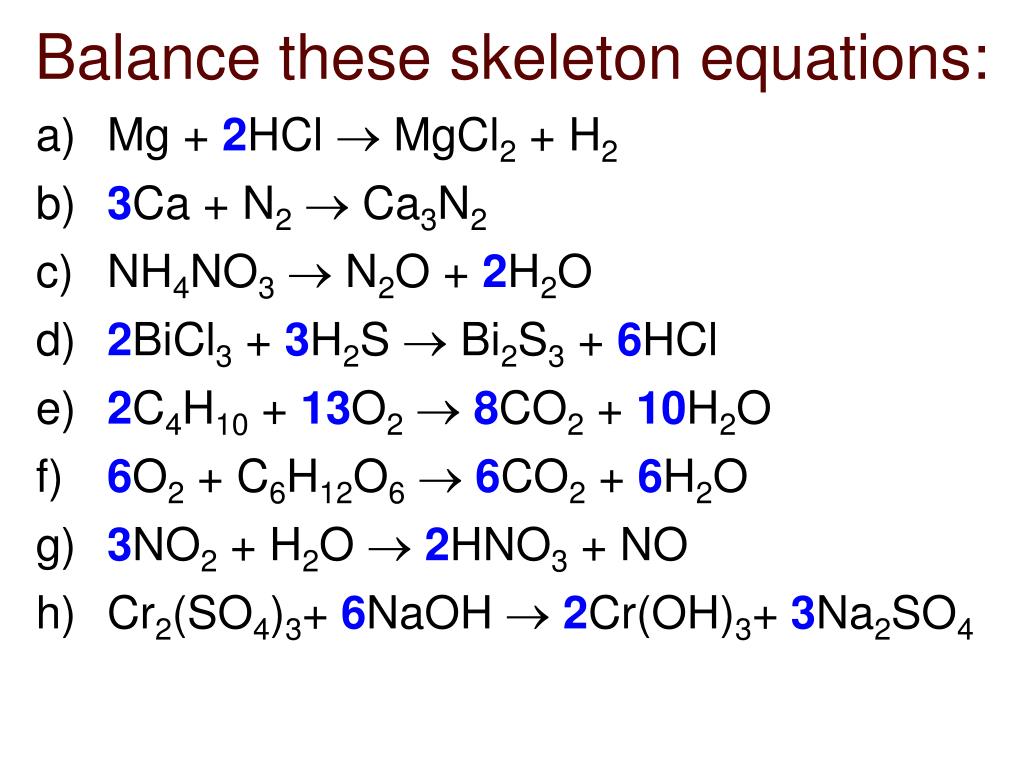
11. Составьте молекулярные уравнения реакций следующих превращений:
Р -> Р205 -> h4P04 -> Na3P04.
Уравнение 1 рассмотрите с точки зрения ОВР, уравнение 3 запишите в ионном виде.
1. 4Р + 5О2 = 2Р2О5
P0 -5e →P+5 восстановитель
O20 + 2*2e→2O-2 окислитель
2. Р2О5 + 3Н2О = 2Н3РО4
3. Н3РО4 + 3NaOH = Na3PO4 + 3h3O
3Н+ + 3OH- = 3h3O
12. Дополните фразу: «Аллотропия — это…»
существование двух и более простых веществ одного и того же химического элемента, различных по строению и свойствам.
13. С какими из веществ, формулы которых: КОН, С02, Zn, CuO, НС1, СаС03, взаимодействует разбавленная азотная кислота? Запишите уравнения возможных реакций в молекулярном виде.
HNO3 + КOH → КNO3 + h3O
3CuO + 6HNO3 = 3Cu(NO3)2 + 3h3O
10HNO3 разбавл. + 4Zn = 4Zn(NO3)2 + Nh5NO3 + 3h3O
2HNO3 + CaCO3 = Ca(NO3)2 + h3O + CO2
14. Закончите схему термического разложения нитрата меди (II):
Cu(N03)2 –> CuO + X + 02↑.
Найдите сумму коэффициентов в уравнении.
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Сумма коэфф. = 9
15. При взаимодействии 37 г гидроксида кальция с сульфатом аммония было получено 15 г аммиака. Вычислите массовую долю выхода аммиака от теоретически возможного.
Ca( OH) 2 +(Nh5 )2 SO4 =CaSO4+2Nh4*h3O
M Ca(OH)2=40+32+2=74г/моль.
n Ca(OH)2 =37: 74=0.5 моль
1 моль Са(ОH)2 : 2 моль Nh4
0.5 :1 моль
M Nh4 = 17г \моль
масса 17*1=17 г.
выход (Nh4)=15: 17=0.88=88%
Вариант 2.
ЧАСТЬ А. Тестовые задания с выбором ответа
Тестовые задания с выбором ответа
1. Число нейтронов в атоме 7N15:
А. 8.
2. Распределение электронов по энергетическим уровням в атоме элемента 2е, 8е, 5е соответствует:
В. Фосфору.
3. Азот имеет степень окисления +4 в соединении с формулой:
B. N02.
4. Минимальная степень окисления фосфора в соединении с формулой:
Б. РН3.
5. Из перечисленных химических элементов наибольшей электроотрицательностью в соединениях обладает:
В. Сера
6. Наименьший радиус у атома, символ которого:
Г. С1.
7. Только восстановителем может быть вещество с формулой:
B. Nh4.
8. Фосфористой кислоте Н3Р03 соответствует оксид с формулой:
В. Р2О3
9. Самая слабая из кислот, формулы которых:
Г. h3Si03.
10. Коэффициент перед окислителем в схеме
Сu + HN03(KOHЦ) —> CU(N03)2 + N02 + Н20:
Б. 4.
ЧАСТЬ Б. Задания со свободным ответом
11.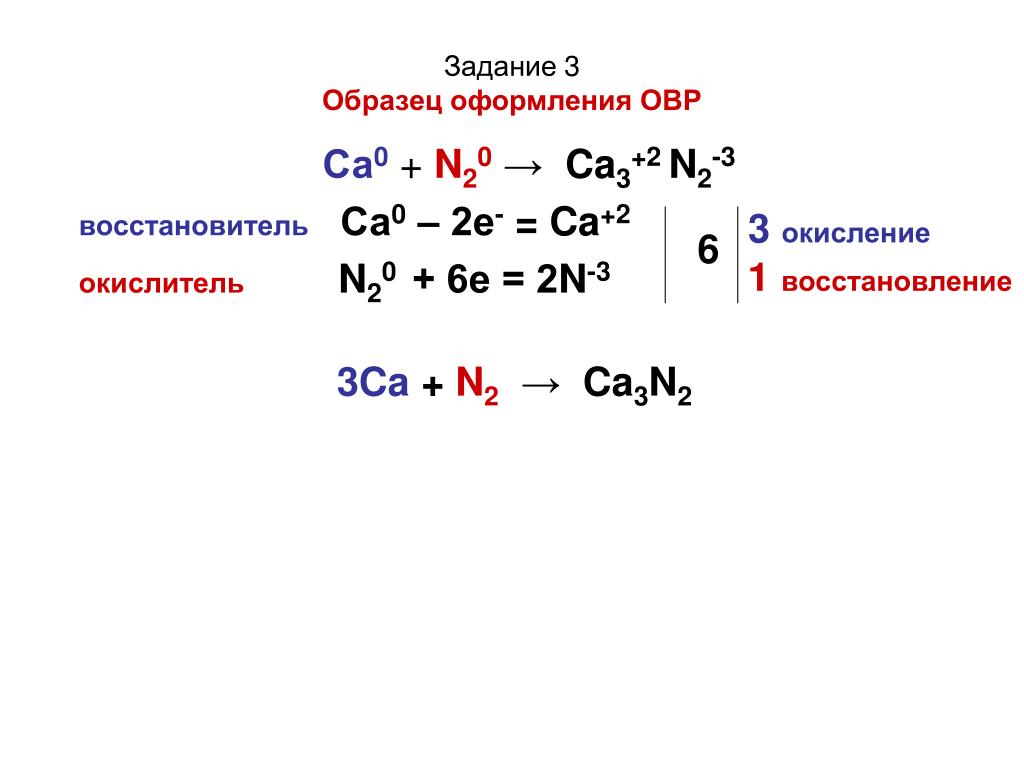 Составьте молекулярные уравнения реакций, идущих по схеме
Составьте молекулярные уравнения реакций, идущих по схеме
NO → N02 → HN03 → NaN03.
Уравнение 1 рассмотрите с точки зрения теории ОВР, уравнение 3 запишите в ионном виде.
1. 2NO + O2 = 2NO2
N+2 -2e→N+4 восстановитель
O20 +2*2e→2O-2 окислитель
2. 4NO2 + O2 + 2h3O = 4HNO3
3. HNO3 + NaOH = NaNO3 + h3O
H+ + OH- = h3O
12. Дополните следующую фразу: «Селитра — это…»
Азотнокислая соль калия, натрия, аммония, употребляемая в технике взрывчатых веществ и в агрономии для удобрений.
13. С какими из веществ, формулы которых: Mg, Ag, AgN03, BaO, C02, KN03, NaOH, взаимодействует ортофосфорная кислота? Запишите уравнения возможных реакций в молекулярном виде.
3NaOH + h4PO4 = Na3PO4 + 3h3O
3 Mg + 2h4PO4 = Mg3(PO4)2↓ + 3h3↑
2h4PO4 +3BaO = Ba3(PO4)2 + 3h3O
Na3PO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3
14. Закончите схему термического разложения нитрата натрия
NaN03 → NaN02 + X.
Найдите сумму коэффициентов в уравнении.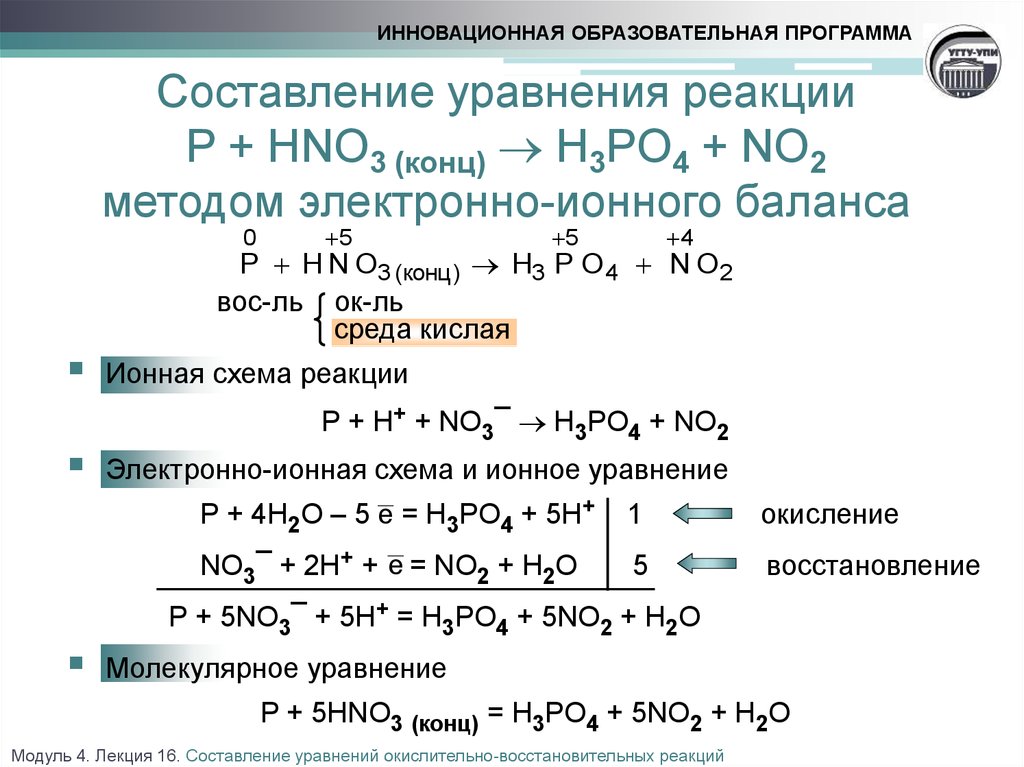
2NaNO3 = 2NaNO2 + O2
Сумма коэффициентов – 5
15. Какой объем аммиака (н. у.) можно получить при взаимодействии 15 м3 азота с избытком водорода, если выход аммиака составляет 10% от теоретически возможного?
N2 + 3h3 = 2Nh4
n(N2) = 15 000 /22,4 = 669 (моль)
n(Nh4) = 2*669 = 1339,28 (моль)
Vтеор.(Nh4) = 1339,28*22,4= 29999 (дм3)
Vпракт. (Nh4) = 29999*0,9 = 26999 (дм3) = 26, 999 м3
Вариант 3.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Число нейтронов в атоме 20Са40:
Б. 20.
2. Распределение электронов по энергетическим уровням в атоме элемента 2е, 5е соответствует:
А. Азоту.
3. Азот имеет степень окисления +2 в соединении с формулой:
Б. NO.
4. Максимальная степень окисления азота в соединении с формулой:
Г. HN03.
5. Из перечисленных химических элементов наименьшей электроотрицательностью в соединениях обладает:
А. Бор.
6. Наибольший радиус у атома химического элемента, символ которого:
Наибольший радиус у атома химического элемента, символ которого:
А. С.
7. Только окислителем может быть вещество с формулой:
Г. Н3Р04.
8. Азотной кислоте соответствует оксид с формулой:
Г. N205.
9. Самая слабая из кислот, формулы которых:
Б. h3Si03.
10. Коэффициент перед окислителем в схеме
Ag + HN03(paзб) —> AgN03 + NO + h30:
Б. 4.
ЧАСТЬ Б. Задания со свободным ответом
11. Составьте молекулярные уравнения реакций по схеме
N2 → Nh4 → Nh4 • Н20 → (Nh5)2S04.
Уравнение 1 рассмотрите с точки зрения теории ОВР, уравнение 3 запишите в ионном виде.
1. N2 + 3h3 = 2Nh4
N20 +2*3е→2N-3 окислитель
h30 -2*1е→2H+1 восстановитель
2. Nh4 + h3O = Nh4*h30
3. 2Nh4*h30 + h3SO4 = (Nh5)2SO4 +2h3O
2Nh4*h30 + 2H+= 2Nh5+ +2h3O
12. Дополните фразу: «Число атомов, входящих в катион аммония…»
равно 5.
13. С какими из веществ, формулы которых: S03, КОН, CaO, Mg, N205, Na2C03, взаимодействует разбавленная азотная кислота? Запишите уравнения возможных реакций в молекулярном виде.
HNO3 (разб.) + КOH = КNO3 + h3O
2HNO3 + CaO = Ca(NO3)2 + h3O
10HNO3 разбавл. + 4Mg = 4Mg(NO3)2 + N2O + 3h3O
2HNO3 + Na2CO3 = 2NaNO3 + h3O + CO2
14. Закончите схему термического разложения нитрата серебра
AgNOg → Ag + X + 02↑.
Укажите сумму коэффициентов в уравнении.
2AgNO3 = 2Ag + 2NO2 + O2
7
15. Азот объемом 56 л (н. у.) прореагировал с избытком водорода. Объемная доля выхода аммиака составляет 50% от теоретически возможного. Рассчитайте объем полученного аммиака.
N2 + 3h3 = 2Nh4
n(N2) = 56 /22,4 = 2,5 (моль)
n(теор.)(Nh4) = 2*2,5 = 5 (моль)
Vпракт. (Nh4) = 5*22,4*0,5 = 56 л
Вариант 4.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Число нейтронов в изотопе 19K39:
В.20.
2. Распределение электронов по энергетическим уровням в атоме элемента 2е, 8е, 5е соответствует:
Б. Фосфору.
3. Азот имеет степень окисления 0 в соединении с формулой:
A. N2.
N2.
4. Максимальная степень окисления фосфора в соединении с формулой:
Г. Н3Р04.
5. Из перечисленных химических элементов наименьшей электроотрицательностью в соединениях обладает:
А. Бериллий.
6. Наибольший радиус у атома химического элемента, символ которого:
A. Si.
7. Только окислителем может быть вещество с формулой:
Г. HN03.
8. Ортофосфорной кислоте соответствует оксид с формулой:
Г. Р2О5.
9. Самая сильная из кислот, формулы которых:
А. HN03.
10. Коэффициент перед окислителем в схеме
Си + HN03(paзб) —> CU(N03)2 + NO + Н20:
Г. 8.
ЧАСТЬ Б. Задания со свободным ответом
11. Составьте молекулярные уравнения реакций по схеме:
NO → N02 → HN03 → Nh5N03.
Уравнение 1 рассмотрите с точки зрения ОВР, уравнение 3 запишите в ионном виде.
1. 2NO + O2 = 2NO2
N+2 -2e→N+4 восстановитель
O20 +2*2e→2O-2 окислитель
2. 4NO2 + O2 + 2h3O = 4HNO3
3. Nh4 + HNO3 = Nh5NO3
Nh4 + HNO3 = Nh5NO3
Nh4 + H+ = Nh5+
12. Дополните фразу: «Аллотропными видоизменениями фосфора являются…»
белый, красный и черный фосфор
13. С какими из веществ, формулы которых: Zn, CuO, Си, NaOH, S02, NaN03, K2C03, взаимодействует ортофосфорная кислота? Запишите уравнения возможных реакций в молекулярном виде.
3NaOH + h4PO4 = Na3PO4 + 3h3O
3 Zn + 2h4PO4 = Zn3(PO4)2↓ + 3h3↑
3CuO + 2h4PO4 = Cu3(PO4)2 + 3h3O
3K2CO3 + 2h4PO4 = 2K3PO4 + 3h3O + 3CO2↑
14. Закончите схему термического разложения нитрата железа (II):
Fe(N03)2 → FeO + N02↑ + X.
Найдите сумму коэффициентов в уравнении.
2Fe(NO3)2 = 2FeO + 4NO2 + O2
15. При сжигании в кислороде 62 г фосфора было получено 130 г оксида фосфора (V) от теоретически возможного. Вычислите массовую долю выхода оксида фосфора (V).
4P + 5O2 = 2P2O5
n(P) = 62/31 = 2 моль
nтеор.( P2O5) = 0,5*2 = 1 моль
mтеор.( P2O5) = 1*142 = 142 г
выход = mпракт./mтеор. = 130/142=0.92 = 92%
= 130/142=0.92 = 92%
Метод полуреакций | Дистанционные уроки
09-Июл-2012 | комментариев 207 | Лолита Окольнова
Решаем Часть С задание №1
Дано уравнение:
h3S + K2Cr2O7 + h3SO4 → …
Как решать такие окислительно-восстановительные реакции?
Уравнивание окислительно-восстановительных реакций
Во-первых, давайте определимся, в каких случаях лучше использовать метод полуреакций:
- реакция происходит в растворе
- в реакции принимают участие больше чем 2 реагента, да и продуктов реакции больше, чем 2
Правила метода полуреакций
(проще всего будет объяснить их сразу на примере)
h3S + K2Cr2O7 + h3SO4 → …
1. Определяем участников окислительно-восстановительного процесса:
K2Cr2O7 — Сr находится в высшей степени окисления — +6, значит бихромат калия будет окислителем, т.
Давайте думать логически.
Допустим, у нас образовался оксид, один из реагентов это серная кислота . Будет она реагировать с оксидом? Конечно! Мы получим Cr3+
Второй реагент — h3S. Сера находится в минимальной степени окисления — -2. Значит, она будет окисляться. До S°.
2. Выписываем участников овр в ионной форме (!) (Т.е., те вещества. которые нельзя разбить на ионы, пишем в том виде, в каком они представлены)
Сr2O7(2)- → Cr(3+)
S(2-) → S(0)
3. Уравниваем количество атомов:
Сr2O7(2-) → 2Cr3(+)
S(2- ) → S(0)
4.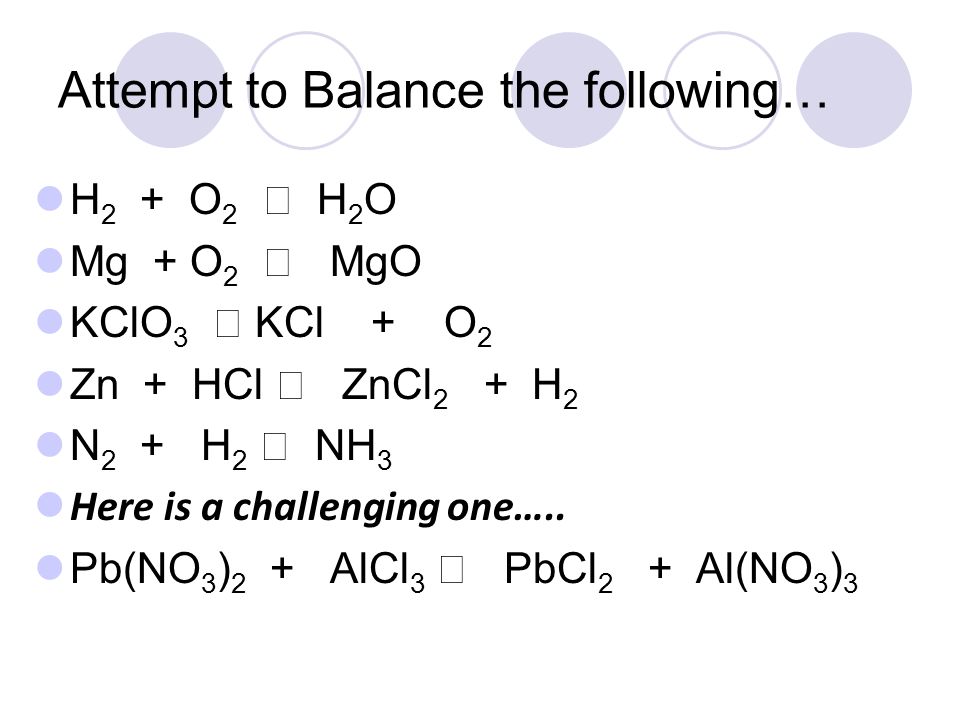 Определяем среду реакции. У нас один из реагентов — серная кислота, значит, среда у нас однозначно кислая.
Определяем среду реакции. У нас один из реагентов — серная кислота, значит, среда у нас однозначно кислая.
В кислой среде раствора уравнивание недостающих атомов идет по схеме:
h3O → H(+)
Причем, воду мы прибавляем в ту часть уравнения, где недостаток кислорода (!)
Сr2O7(2-) → 2Cr(3+) + 7h3O
теперь у нас изменилось количество водорода, надо его уравнять
Сr2O7(2-) +14H(+) → 2Cr(3+) + 7h3O
5. Уравниваем заряды:
Сr2O7(2)- +14H(+) → 2Cr(3+) + 7h3O
итоговый заряд: +12 → +6
Сr2O7(2-) +14H(+) + 6е- → 2Cr(3+) + 7h3O
S2- → S°
-2 0
S(2-) -2е- → S(0)
6. Теперь надо уравнять реакции восстановления и окисления между собой ( чтобы “количество принятых электронов было равно количеству отданных”)
Теперь надо уравнять реакции восстановления и окисления между собой ( чтобы “количество принятых электронов было равно количеству отданных”)
Сr2O7(2)- +14H(+) +6e- → 2Cr(3+) + 7h3O |*1
S(2- ) -2е- → S(0 ) |*3
7. Выписываем все реагенты с учетом коэффициентов и все продукты овр:
Сr2O7(2-) +14H(+) + 3S(2-) → 2Cr(3+) + 7h3O + 3S(0)
8. Дописываем к каждому иону его “половинку” с учетом коэффициентов и сочетаем продукты реакции:
Сr2O7(2-) +14H(+) + 3S(2-) → 2Cr(3+) + 7h3O + 3S(0)
+2K(+) +7SO4(2-) + 6H(+) → +2K(+) +7SO4(2-) + 6H(+)
____________________________________________
K2Cr2O7 + 7h3SO4 + 3h3S → Cr2(SO4)3 + 7h3O + 3S + K2SO4 + 3h3SO4
9. Сокращаем одинаковые молекулы слева и справа:
Сокращаем одинаковые молекулы слева и справа:
K2Cr2O7 + 4h3SO4 + 3h3S → Cr2(SO4)3 + 3S + K2SO4 + 7h3O
Метод полуреакций удобен тем, что можно легко предсказать продукты реакции и сочетания ионов. Да и уравнивать таким способом легче.
Естественно, этот метод подходит только для водных растворов.
Для решения овр такого типа нужно просто натренироваться, для этого предлагаю вам решить следующие овр методом полуреакций:
- MnO2 + O2 + KOH → …
- Cl2 + NaOH → NaClO3 + …
- CrCl3 + H2O2 + KOH → …
Как всегда, в заданиях такого типа (часть С №1) нужно предсказать продукты реакции и уравнять. Если что-то не будет получаться или возникнут вопросы, пишите в комментариях — обсудим.
Как решать окислительно-восстановительные реакции в кислой среде раствора мы разобрали, в щелочной — смотрите << здесь >>
- в ЕГЭ это вопрос C1 — примеры окислительно-восстановительных реакций
- Подписка на рассылку
(Правила комментирования)
шпора овр химия — шпаргалка по овр ЕГЭ
Шпора 8 номер.
1) Li, K, Cs, Rb, Na – Ищем сразу ряд с: h3O, HCl, Br2, спирты и неметаллы (Cl2, S, h3 и тд (на литийсразу берем вариант с азотом)2) Mg – CO2, O2, SO2, SiO2, N2O, NO, NO2, кислоты и неметаллы (Br2, Cl2, S)3) Ca, Sr, Ba–h3O, О2, кислотами и неметаллами (P, S, C, Cl2)4) Al – соли и оксиды более слабых металлов, щелочь и кислота.Так же иногда дается горение вкислороде и галогенах.5) Zn – аналогично алюминию.6) Fe, Cr – раствор кислот окислителей HNO3, h3SO4.7)Кислород, сера, а так же оксиды этих неметаллов (восстанавливаем с 3 до 2 (Fe+Fe2o3=FeO)7) Cu – 2 кислоты окислителя, хлорид железа 3, кислород .8) Щелочи (гидроксиды металлов 1 группы) – кислоты, кислотные оксиды и обязательно (90%случаев) в этом ряде есть соединение с амф свойствами. 9)Оксиды (металлов 1 группы) — кислоты, кислотные оксиды и обязательно (90% случаев) в этомряде есть соединение с амф свойствами. 10) Гидроксиды металлов 2 группы — Ищем сразу ряд с: CO2, SO2, кислоты качественных реакций. 11) Al2O3 и Al(OH)3 —в 1 ряду обязательно оксид\гидроксид с амфотерными свойствами, кислота+ стандартный восстановитель (С, СО2 и Н2), и часто дается фосфорная либо ее ангидрид12) ZnO и Zn(Oh3) идентично с алюминием 13) FeO – ищем сразу восстановители (углерод, угарный и водород) если нет то окислители, 2кислоты, кислород, и тд. 14) Fe2O3 – 70% C, CO, h3 и Al (либо другой более акт металл) кислота+ щелочь 15) Fe(OH)3 – кислоты, оксиды, щелочи и основные оксиды 16) Хром идентичен алюминию.17) CuO — восстановители:Al или металлы активнее чем медь, СО, С, Н2, Nh4, кислоты икислотные оксиды.18) Cu(OH)2 — кислоты и кислотные оксиды, чаще всего галогеноводородные, серная, азотнаякислота и альдегиды.19) Серебро – ищем ряд с 2 кислотами окислителями. А если его соединения то ряд с галогенионами.20) h3 – ряд с кислородом, азотом, активными металлами, и оксидами, которые можновосстановить.21) O2 — ряд с тем что можно до кислить, либо сжечь.
11) Al2O3 и Al(OH)3 —в 1 ряду обязательно оксид\гидроксид с амфотерными свойствами, кислота+ стандартный восстановитель (С, СО2 и Н2), и часто дается фосфорная либо ее ангидрид12) ZnO и Zn(Oh3) идентично с алюминием 13) FeO – ищем сразу восстановители (углерод, угарный и водород) если нет то окислители, 2кислоты, кислород, и тд. 14) Fe2O3 – 70% C, CO, h3 и Al (либо другой более акт металл) кислота+ щелочь 15) Fe(OH)3 – кислоты, оксиды, щелочи и основные оксиды 16) Хром идентичен алюминию.17) CuO — восстановители:Al или металлы активнее чем медь, СО, С, Н2, Nh4, кислоты икислотные оксиды.18) Cu(OH)2 — кислоты и кислотные оксиды, чаще всего галогеноводородные, серная, азотнаякислота и альдегиды.19) Серебро – ищем ряд с 2 кислотами окислителями. А если его соединения то ряд с галогенионами.20) h3 – ряд с кислородом, азотом, активными металлами, и оксидами, которые можновосстановить.21) O2 — ряд с тем что можно до кислить, либо сжечь.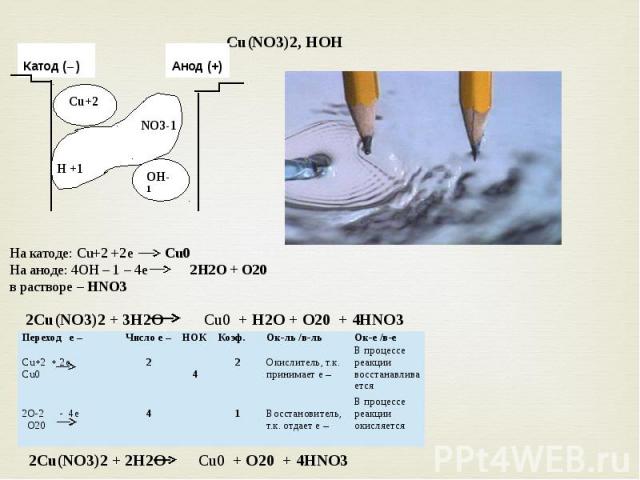 22) F2 (и его все соединения) – ряд с соединениями кремния и лития, а также более слабыесоединения галогенов и кислород.23) Галогены ищем ряд с щелочью, водородом или серой. Соединения галогенов ищем окислителей, соединения серебра (обязательно растворимая соль серебра), или более слабыегалогены в соединениях.24) S и Р ищем кислород, щелочь, металл. На оксиды ищем щелочи, оксиды металлов, истандартные восстановители.25) C и СО стандартные восстановители ищем то что можно восстановить (на углерод ищемводород, на СО тв щелочь)26) СО2 ищем ряд с гидроксидом кальция или все что связанос щелочами, оксидами и магнием СОЛИ ИСКАТЬ ТОЛЬКО КАЧЕСТВЕННЫЕ РЕАКЦИИ!!! А ТАК ЖЕ ОВР!!!!
22) F2 (и его все соединения) – ряд с соединениями кремния и лития, а также более слабыесоединения галогенов и кислород.23) Галогены ищем ряд с щелочью, водородом или серой. Соединения галогенов ищем окислителей, соединения серебра (обязательно растворимая соль серебра), или более слабыегалогены в соединениях.24) S и Р ищем кислород, щелочь, металл. На оксиды ищем щелочи, оксиды металлов, истандартные восстановители.25) C и СО стандартные восстановители ищем то что можно восстановить (на углерод ищемводород, на СО тв щелочь)26) СО2 ищем ряд с гидроксидом кальция или все что связанос щелочами, оксидами и магнием СОЛИ ИСКАТЬ ТОЛЬКО КАЧЕСТВЕННЫЕ РЕАКЦИИ!!! А ТАК ЖЕ ОВР!!!!
Шпоры 32 номер.
1) Si + 2Cl2=SiCl4 2) SiCl4 + 3h3O=h3SiO3 + 4HCl3) Ca3(PO4)2 + 5C + 3SiO2=2P + 5CO + 3CaSiO3 4) Ca3N2 + 6h3= 3Ca(OH)2 + 2Nh4↑5) 2Nh4 + 3CuO=3Cu + 3h3O + N2↑ 6) Cu + 4HNO3(конц.)=Cu(NO3)2 + 2NO2↑ + 2h3O7) 2Cu(NO3)2=2CuO + 4NO2 + O2↑ 8) 4FeS + 7O2=2Fe2O3 + 4SO2↑ 9) 2h3S + SO2=3S↓ + 2h3O 10) S + 6HNO3=h3SO4 + 6NO2↑ + 2h3O 11) 4Al(NO3)3=2Al2O3 + 12NO2↑ + 3O2↑ 12) 2Al2O3=4Al + 3O2↑ (электролиз раствора Al2O3 в расплавекриолита)13) 3KNO3 + 8Al + 5KOH + 18h3O=3Nh4↑ + 8K[Al(OH)4] 17) h3S + Br2=S↓ + 2HBr18) 3Mg + N2=Mg3N2 19) Mg3N2 + 6h3O=3Mg(OH)2↓ + 2Nh4↑ 20) Cr2(SO4)3 + 6Nh4 + 6h3O=2Cr(OH)3↓ + 3(Nh5)2SO4 21) 2Cr(OH)3 + 4KOH + 3h3O2=2K2CrO4 + 8h3O22) 2Ag + 2h3SO4(конц. )=Ag2SO4 + SO2↑ + 2h3O23) 2KClO3=2KCl + 3O2↑ (в присутствии кат-ра) 24) 3Fe + 2O2=Fe3O4 25) Fe3O4 + 8HCl=FeCl2 + 2FeCl3 + 4h3O
)=Ag2SO4 + SO2↑ + 2h3O23) 2KClO3=2KCl + 3O2↑ (в присутствии кат-ра) 24) 3Fe + 2O2=Fe3O4 25) Fe3O4 + 8HCl=FeCl2 + 2FeCl3 + 4h3O
26) 6FeCl2 + 14HCl + K2Cr2O7=6FeCl3 + 2CrCl3 + 2KCl + 7h3O27) 2Na + h3=2Nah38) NaH + h3O=NaOH + h3↑ 29) 2NO2 + 2NaOH=NaNO2 + NaNO3 + h3O30) 2Al + 2NaOH + 6h3= 2Na[Al(OH)4] + 3h3↑ 31) Cu + 2h3SO4=CuSO4 + SO2↑ + 2h3O32) 2CuSO4 + 4KI=2CuI↓ + I2↓ + 2K2SO4 33) 2NaCl + 2h3O=h3↑ + Cl2↑ + 2NaOH (электролиз раствора) 34) Fe2O3 + 6HI=2FeI2 + I2↓ + 3h3O35) Na[Al(OH)4] + CO2=NaHCO3 + Al(OH)3↓ 36) Al2O3 + Na2CO3 (тв.)=2NaAlO2 + CO2↑ (сплавление) 37) Al4C3 + 12HBr=4AlBr3 + 3Ch5↑ 38) 2AlBr3 + 3K2SO3 + 3h3O=2Al(OH)3↓ + 3SO2↑ + 6KBr39) 3SO2 + K2Cr2O7 + h3SO4=K2SO4 + Cr2(SO4)3 + h3O40) Zn + 2KOH + 2h3O=K2[Zn(OH)4] + h3↑ 41) K2[Zn(OH)4]=K2ZnO2 + 2h3O42) K2ZnO2 + 4HCl=2KCl + ZnCl2 + 2h3O43) HI + KHCO3=KI + h3O + CO2↑ 44) 6KI + K2Cr2O7 + 7h3SO4=4K2SO4 + 3I2↓ + Cr2(SO4)3 + 7h3O45) 2AlI3 + 3Na2S + 6h3O=2Al(OH)3↓ + 3h3S↑ + 6NaI46) Fe3O4 + 10HNO3=3Fe(NO3)3 + NO2↑ + 5h3O47) Fe2O3 + Fe=3FeO48) 2Na + O2=Na2O2 (горение) 49) Na2O2 + 4HCl=2NaCl + 2h3O + Cl2↑ 50) 3Cl2 + 10KOH + Cr2O3=2K2CrO4 + 6KCl + 5h3O51) K2CrO4 + BaCl2=BaCrO4↓ + 2KCl52) 2Cu(NO3)2 + 2h3O=2Cu + O2↑ + 4HNO3 (электролизраствора) 53) 6 KOH + 3S=K2SO3 + 2K2S + 3h3O54) 6 KHCO3 + Fe2(SO4)3=2Fe(OH)3↓ + 3K2SO4 + 6CO2↑ 55) KH + h3O=KOH + h3↑ 56) K2ZnO2 + 2h3SO4=K2SO4 + ZnSO4 + 2h3O57) FeSO4 + 2Nh4 + 2h3O=Fe(OH)2↓ + (Nh5)2SO4 58) Fe(OH)2 + 4HNO3(конц.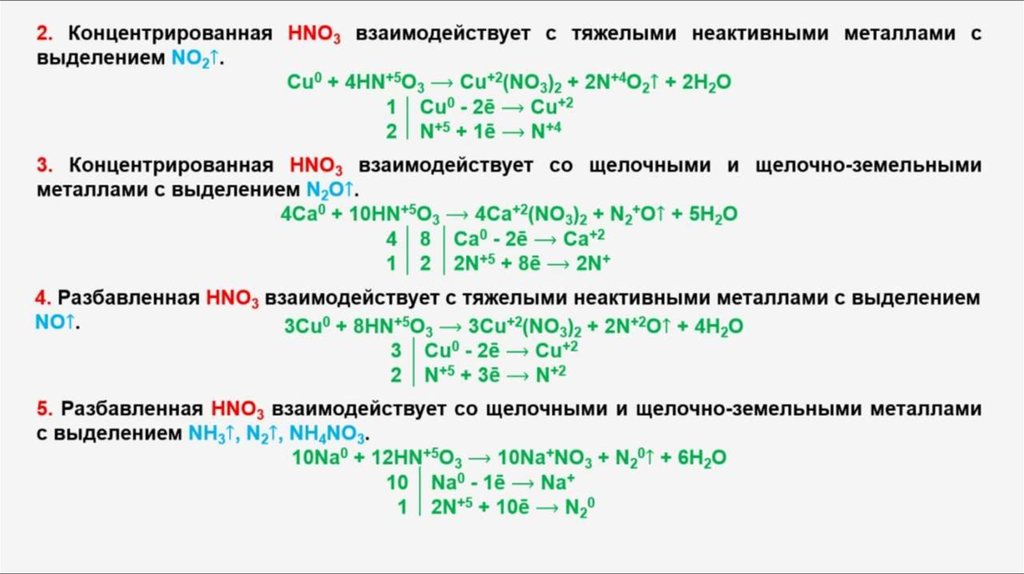 )=Fe(NO3)3 + NO2↑ + 3h3O
)=Fe(NO3)3 + NO2↑ + 3h3O
59) 2Fe(NO3)3 + 3K2CO3 + 3h3O=2Fe(OH)3↓ + 3CO2↑ + 6KNO3
60) 4NO2 + 2Ca(OH)2=Ca(NO3)2 + Ca(NO2)2 + 2h3O 61) 3Ca + 2P=Ca3P2 62) Ca3P2 + 6h3O=3Ca(OH)2 + 2Ph4↑ 63) Ph4 + 8NaMnO4 + 11NaOH=8Na2MnO4 + Na3PO4 + 7h3O64) Na2MnO4 + Na2SO3 + h3O=MnO2↓ + Na2SO4 + 2NaOH65) P + 5HNO3=h4PO4 + 5NO2↑ + h3O 66) 4Zn + 2NO2=4ZnO + N2↑ 67) 2NaNO3=2NaNO2 + O2↑ 68) NaNO2 + Nh5I=NaI + N2↑ + 2h3O69) 2NaI + h3O2 + h3SO4=Na2SO4 + I2↓ + 2h3O70) 3I2 + 6NaOH(р−р)=NaIO3 + 5NaI + 3h3O71) h3O2 + Ag2O=2Ag↓ + O2↑ + h3O 72) ZnS + 3O2=2ZnO + 2SO2↑ 73) Na2[Zn(OH)4] Na2ZnO2 + 2h3O74) 3Cu2O + Na2Cr2O7 + 10h3SO4=6CuSO4 + Cr2(SO4)3 + Na2SO4 +10h3O 75) NaHCO3 + NaOH=Na2CO3 + h3O76) K2Cr2O7(тв.) + 14HCl(конц.)=2CrCl3 + 2KCl + 3Cl2↑ + 7h3O77) 3NaNO2 + 2KMnO4 + h3O=2MnO2↓ + 2KOH + 3NaNO3 78) MnO2 + 4HCl(конц.)=MnCl2 + Cl2↑ + 2h3O79) 2Fe(OH)3 + 6HI=2FeI2 + I2↓ + 6h3O80) 3Na2CO3 + 2CrBr3 + 3h3O=2Cr(OH)3↓ + 6NaBr + 3CO2↑ 81) 5FeCl2 + KMnO4 + 8HCl=5FeCl3 + MnCl2 + KCl + 4h3O82) K2SiO3(р-р) + 2h3O + 2CO2=h3SiO3↓ + 2KHCO3 83) Ba(OH)2 + 2NaHCO3=Na2CO3 + BaCO3↓ + 2h3O84) 6KOH + 3Cl2=KClO3 + 5KCl + 3h3O85) Cr2O3 + KClO3 + 4KOH=2K2CrO4 + KCl + 2h3O86) 4Nh4 + 5O2=4NO + 6h3O (кат. Pt, Cr2O3, t, p)87) 2NO + O2=2NO288) NaNO2 + 2KMnO4 + 2KOH=2K2MnO4 + NaNO3 + h3O89) 8KI(тв.) + 9h3SO4(конц.)=8KHSO4 + 4I2↓ + h3S↑ + 4h3O90) Al2O3 + 2NaOH + 3h3O=2Na[Al(OH)4]91) Na[Al(OH)4] + 4HNO3=NaNO3 + Al(NO3)3 + 4h3O
Pt, Cr2O3, t, p)87) 2NO + O2=2NO288) NaNO2 + 2KMnO4 + 2KOH=2K2MnO4 + NaNO3 + h3O89) 8KI(тв.) + 9h3SO4(конц.)=8KHSO4 + 4I2↓ + h3S↑ + 4h3O90) Al2O3 + 2NaOH + 3h3O=2Na[Al(OH)4]91) Na[Al(OH)4] + 4HNO3=NaNO3 + Al(NO3)3 + 4h3O
92) 2Ca(OH)2 + 2NO2 + 3O2=2Ca(NO3)2 + 2h3O93) K[Al(OH)4] + SO2=KHSO3 + Al(OH)3↓94) 8KOH + PCl5=K3PO4 + 5KCl + 4h3O95) 2KBr(тв) + 2h3SO4(конц., гор.)=K2SO4 + Br2 + SO2↑ + 2h3O96) 3Br2 + 6KOH=5KBr + KBrO3 + 3h3O97) Br2 + K2SO3 + 2NaOH=2NaBr + K2SO4 + h3O98) Fe2O3 + 6HI=2FeI2 + I2 + 3h3O99) Fe2O3 + 2NaOH(тв.)=2NaFeO2 + h3O (сплавление)100) 4NO2 + O2 + 2h3O=4HNO3101) NaFeO2 + 4HNO3(изб.)=NaNO3 +Fe(NO3)3 + 2h3O102) FeO + 4HNO3(конц.)=Fe(NO3)3 + NO2↑ + 2h3O103) Ca2Si + 4h3O=2Ca(OH)2 + Sih5↑104) 3Na2SO3 + Na2Cr2O7 + 4h3SO4= Cr2(SO4)3 + 4Na2SO4 + 4h3O105) 4Mg + 5h3SO4(конц.)=4MgSO4 + h3S↑ + 4h3O106) CuS + 8HNO3(конц.)=CuSO4 + 8NO2↑ + 4h3O107) 3Cu + 8HNO3(разб.)=3Cu(NO3)2 + 2NO↑ + 4h3O108) 2Cu(NO3)2 + 2h3O=2Cu↓ + O2↑ + 4HNO3 (электролизраствора)109) Cu2O + 3h3SO4(конц.)=2CuSO4 + SO2↑ + 3h3O110) 2NaI + 2NaMnO4=I2↓ + 2Na2MnO4 (всильнощелочномрастворе)
ШПОРА 30 НОМЕР
HNO3 Металлы малой активности 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4h3O разбавленная Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2h3O концентрированная МЕТАЛЛЫ ЛЕВЕЕ ВОДОРОДА ВСЕ ПОДВЕРГАЮТСЯ ЗАКОНОМЕРНОСТИ: Nh5NO3 — ОЧ РАЗБ металлы активные и средние при слабом нагревании (металлы средней для тестов не пишем) 4Zn + 10HNO3 = 4Zn(NO3)2 + Nh5NO3 + 3h3O нагрев. 8Na + 10HNO3 = 8NaNO3 + Nh5NO3 + 3h3O
8Na + 10HNO3 = 8NaNO3 + Nh5NO3 + 3h3O
N2 — РАЗБ АКТИВНЫЕ МЕТАЛЛЫ И СРЕДНИЕ ПРИ НАГРЕВАНИИ5Mg + 12HNO3 = 5Mg(NO3)2 + N2 + 6h3O10Fe + 36HNO3 = 10Fe(NO3)3 + 3N2 + 18h3O нагрев. N2O — КОНЦЕТРИРОВАННАЯ С АКТИВНЫМИ МЕТАЛЛАМИ И РАЗБАВЛЕННАЯ БЕЗ НАГРЕВАНИЯс средними (пишем таким образом активные металлы в 30 номере) 4Mg + 10HNO3 = 4Mg(NO3)2 + N2O + 5h3O 8Fe + 30HNO3 = 8Fe(NO3)3 + 3N2O + 15h3ONO — концентрированная при нагревании с средними металлами или же разбавленная (просьба не писать ее, в 2 части! Только в 1!!!)3Zn + 8HNO3 = 3Zn(NO3)2 + 2NO +4 h3ONO2 — концентрированная с металлами средними (пишем в 30 номере).Сюда же 3 металла исключения, которые пассивируют кислоту и реагируют только при нагревании – Al, Cr, Fe.Zn + 4HNO3 = Zn(NO3)2 + 2NO2 + 2h3O Al + 6HNO3 = Al(NO3)3 + 3NO2 + 3h3OРешайсам\самачтописать. Реакции снизу тоже встречаются: FeS2 + 18 HNO3 = FeNO33 + 2 h3SO4 + 15 NO2 + 7 h3O. 6HNO3 + HI = HIO3 + 6NO2 + 3h3O 6HNO3 + HBr = 6NO2 + HBrO3 + 3h3O 10HNO3 + I2 = 2HIO3 + 10NO2 + 4h3O 8HNO3 + h3S = h3SO4 + 8NO2 + 4h3O Cu2S + 12HNO3 = CuSO4 + Cu(NO3)2 + 10NO2 + 6h3OFeS + 12HNO3 = Fe(NO3)3 + h3SO4 + 9NO2 + 5h3OДляфосфорапишемтолькоразбавленную! 3P + 5HNO3 + 2h3O = 5NO + 3h4PO4 3Ph4 + 8HNO3 = 8NO + 3h4PO4 + 4h3O 3PCl3 + 2HNO3 + 8h3O = 2NO + 3h4PO4 + 9HCl 3P2O3 + 4HNO3 + 7h3O = 4NO + 6h4PO4 S + 2HNO3 = 2NO + h3SO4 разб S + 6HNO3 = h3SO4 + 6NO2 + 2h3O конц 3C + 4HNO3 = 4NO + 3CO2 + 2h3O разб C + 4HNO3 = CO2 + 4NO2 + 2h3O Конц 6KI + 8HNO3 → 6KNO3 + 2NO + 3I2 + 4h3OСернаякислотаконцентрированная!Металлы после водорода (медь, серебро, ртуть) реагируют при нагревании и
додиоксида. Cu + 2h3SO4 = CuSO4 + SO2 + 2h3OC Al, Cr и Fe пассивируется, реагируеттолькопринагревании 8Al+15h3SO4(конц.)=4Al2(SO4)3+3h3S↑+12h3O 2Cr+6h3SO4(конц.)=Cr2(SO4)3+3SO2↑+6h3O 2Fe+6h3SO4(конц.)=Fe2(SO4)3+3SO2↑+6h3OМеталлыактивныепишемдосероводорода.8Na + 5h3SO4 = h3S + 4Na2SO4 + 4h3OМеталлы средней группы реагируют как до серы и диоксида, так и до сероводорода. Смотри по условию, обрати внимание на характер газа (ну если простое вещество, то логично что сера). В тестах пишем серу дляметаллов средней активности. В цепочках и 30 номере только диоксид. Zn + 2h3SO4 = ZnSO4 + SO2 + 2h3OРешай сам\сама что писать. Реакцииснизутожевстречаются: 8HI + h3SO4 = h3S + 4I2 + 4h3O 8KI + 5h3SO4 = h3S + 4I2 + 4K2SO4 + 4h3OC + 2h3SO4 = 2SO2 + CO2 + 2h3OS + 2h3SO4 = 3SO2 +2h3O 2HBr + h3SO4 = SO2 + 2h3O + Br2 2KBr + 2h3SO4 = SO2 + K2SO4 + 2h3O + Br2 2P + 5h3SO4 = 5SO2 + 2h4PO4 + 2h3O 2FeO + 4h3SO4 = SO2 + Fe2(SO4)3 + 4h3O 2FeCl2 +4 h3SO4 = SO2 + Fe2(SO4)3 + 4HCl + 2h3O 2Fe3O4 + 10h3SO4 = SO2 + 3Fe2(SO4)3 + 10h3OCu2O + 3h3SO4 = 2CuSO4 + SO2 + 3h3OP2O3 + 2h3SO4 + h3O = 2SO2 + 2h4PO4 Железо 6 валентное получение и каким образом встречается2KClO3 + 3FeSO4 + 12KOH = 3K2FeO4 + 2KCl + 3K2SO4 + 6h3O2Fe + 4KOH + 3O2 = 2K2FeO4 + 2h3OFe2O3 + 3KNO3 + 4KOH = 2K2FeO4 + 3KNO2 + 2h3O2Fe(OH)3 + 10KOH + 3Br2 = 2K2FeO4 + 6KBr + 8h3O2K2FeO4 + 16HCl = 2FeCl3 + 4KCl + 3Cl2 + 8h3O2K2FeO4 + 2Nh4 + 5h3SO4 = N2 + Fe2(SO4)3 + 2K2SO4 + 8h3O
Cu + 2h3SO4 = CuSO4 + SO2 + 2h3OC Al, Cr и Fe пассивируется, реагируеттолькопринагревании 8Al+15h3SO4(конц.)=4Al2(SO4)3+3h3S↑+12h3O 2Cr+6h3SO4(конц.)=Cr2(SO4)3+3SO2↑+6h3O 2Fe+6h3SO4(конц.)=Fe2(SO4)3+3SO2↑+6h3OМеталлыактивныепишемдосероводорода.8Na + 5h3SO4 = h3S + 4Na2SO4 + 4h3OМеталлы средней группы реагируют как до серы и диоксида, так и до сероводорода. Смотри по условию, обрати внимание на характер газа (ну если простое вещество, то логично что сера). В тестах пишем серу дляметаллов средней активности. В цепочках и 30 номере только диоксид. Zn + 2h3SO4 = ZnSO4 + SO2 + 2h3OРешай сам\сама что писать. Реакцииснизутожевстречаются: 8HI + h3SO4 = h3S + 4I2 + 4h3O 8KI + 5h3SO4 = h3S + 4I2 + 4K2SO4 + 4h3OC + 2h3SO4 = 2SO2 + CO2 + 2h3OS + 2h3SO4 = 3SO2 +2h3O 2HBr + h3SO4 = SO2 + 2h3O + Br2 2KBr + 2h3SO4 = SO2 + K2SO4 + 2h3O + Br2 2P + 5h3SO4 = 5SO2 + 2h4PO4 + 2h3O 2FeO + 4h3SO4 = SO2 + Fe2(SO4)3 + 4h3O 2FeCl2 +4 h3SO4 = SO2 + Fe2(SO4)3 + 4HCl + 2h3O 2Fe3O4 + 10h3SO4 = SO2 + 3Fe2(SO4)3 + 10h3OCu2O + 3h3SO4 = 2CuSO4 + SO2 + 3h3OP2O3 + 2h3SO4 + h3O = 2SO2 + 2h4PO4 Железо 6 валентное получение и каким образом встречается2KClO3 + 3FeSO4 + 12KOH = 3K2FeO4 + 2KCl + 3K2SO4 + 6h3O2Fe + 4KOH + 3O2 = 2K2FeO4 + 2h3OFe2O3 + 3KNO3 + 4KOH = 2K2FeO4 + 3KNO2 + 2h3O2Fe(OH)3 + 10KOH + 3Br2 = 2K2FeO4 + 6KBr + 8h3O2K2FeO4 + 16HCl = 2FeCl3 + 4KCl + 3Cl2 + 8h3O2K2FeO4 + 2Nh4 + 5h3SO4 = N2 + Fe2(SO4)3 + 2K2SO4 + 8h3O
2K2FeO4 + 5h3O2 = 2Fe(OH)3 + 4KOH + 4O2 2K2FeO4 + 3h3S = Fe2O3 + 3S + 4KOH + h3OПерекись водорода как окислитель и как восстановитель:h3O2 + 2HI → I2 + 2h3O4h3O2 + PbS = PbSO4 + 4h3O4h3O2 + h3S = h3SO4 + 4h3Oh3O2 + KNO2 = KNO3 + h3Oh3O2 + Na2SO3 = Na2SO4 + h3Oh3O2 + SO2 = h3SO4 5h3O2 + 2KMnO4 + 3h3SO4 = 2MnSO4 + K2SO4 + 5O2 + 8h3O5h3O2 + 2HIO3 = I2 + 5O2 + 6h3O2h3O2 + K2Cr2O7 + 4h3SO4 = Cr2(SO4)3 + K2SO4 + 3O2 + 7h3Oh3O2 + 2KMnO4 + 2KOH = 2K2MnO4 + O2 + 2h3Oh3O2 + Ag2O = 2Ag + O2 + h3O3h3O2 + KClO3 = KCl + 3O2 + 3h3O h3O2 + HClO = O2 + HCl + h3O Хромат и дихромат идентичны марганцу +7 и +6 соответственно: 3h3S + 2K2CrO4 + 2h3O = 2Cr(OH)3 + 3S + 4KOh4K2SO3 + 2K2CrO4 + 5h3O = 2Cr(OH)3 + 3K2SO4 + 4KOH6NaI + 2K2CrO4 + 8h3O = 2Cr(OH)3 + 3I2 + 6NaOH + 4KOh4(Nh5)2S + 2K2CrO4 + 8h3O = 6Nh5OH + 2Cr(OH)3 + 3S + 4KOh4(Nh5)2S + 2K2CrO4 + 2KOH + 2h3O = 2K3[Cr(OH)6] + 3S + 6Nh4 2K2CrO4 + 3NaNO2 + 2KOH + 5Н2О = 2 K3[Cr(OH)6+ 3NaNO3 3h3S + K2Cr2O7 + 4h3SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7h3O6KI + K2Cr2O7 + 7h3SO4 = 3I2 + Cr2(SO4)3 + 4K2SO4 + 7h3OK2Cr2O7 + 6FeSO4 + 7h3SO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7h3O3h3O2 + K2Cr2O7 + 4h3SO4 = Cr2(SO4)3 + K2SO4 + 3O2 + 7h3O3S + 2K2Cr2O7 + 2h3O = 3SO2 + 2Cr2O3 + 4KOh4(Nh5)2S + K2Cr2O7 + h3O = 2Cr(OH)3 + 3S + 6Nh4 + 2KOHКислородосодержащие галогеновые кислоты h3S + HClO = S + HCl + h3O 2NO + h3O + 3HClO = 2HNO3 + 3HClHCl + HClO = Cl2 + h3O
h3O + 5HClO + Br2 = 5HCl + 2HBrO3 2HClO2 + 6HBr = Cl2 + 4h3O + 3Br2 5HClO2 + 2KMnO4 + 3h3SO4 = 5HClO3 + 2MnSO4 + K2SO4 + 3h3O2HClO2 + 3h3O2 = Cl2 + 3O2 + 4h3OHClO3 + 5HCl = 3Cl2 + 3h3O6P + 5HClO3 + 9h3O = 6h4PO4 + 5HCl3Ph4 + 4HClO3 = 3h4PO4 + 4HClHClO3 + 6HI = 3I2 + HCl + 3h3O2HClO3 + I2 = 2HIO3 + Cl2 HClO3 + 3h3S = 3S + HCl + 3h3OHClO4 + 4h3SO3 = 4h3SO4 + HClHClO4 + 4SO2 + 4h3O = 4h3SO4 + HCl3HClO4 + 8NO + 4h3O = 8HNO3 + 3HClPh4 + HClO4 = h4PO4 + HClHClO4 + 2I2 = HIO4 + 2Cl2 7S + 6HClO4 + 4h3O = 7h3SO4 + 3Cl2 HClO4 + 7HCl = 4Cl2 + 4h3O
Na2O2 + 2h3O (хол. ) = 2NaOH + h3O2
) = 2NaOH + h3O2
2Na2O2 + 2h3O (гор.) = 4NaOH + O2↑
NaOH + Al(OH)3 = Na[Al(OH)4]
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
2NO2 + 2NaOH = NaNO3 + NaNO2 + h3O
2NaOH + Si + h3O = Na2SiO3 + h3
3KOH + P4 + 3h3O = 3Kh3PO2 + Ph4↑
2KOH(холодный) + Cl2 = KClO + KCl + h3O
6KOH(горячий) + 3Cl2 = KClO3 + 5KCl + 3h3O
6NaOH + 3S = 2Na2S + Na2SO3 + 3h3O
4KClO3 𝑡°→ KCl + 3KClO4
2KClO3 𝑡°,катализатор (MnO2 )→ 2KCl + 3O2
2Mg + CO2 𝑡°→ 2MgO + C
2Mg + SiO2 𝑡°→ Si + 2MgO
CaCO3 𝑡°→ CaO + CO2
Са(НСО3)2 𝑡°→ CaCO3 + CO2 + h3O
Ca3(PO4)2 + 5C + 3SiO2 t°→ 3CaSiO3 + 5CO + 2P
BaSO4 + 4C = BaS + 4CO
CaC2 + 2h3O = Ca(OH)2 + C2h3↑
Са3Р2 + 6Н2О = 2РН3↑ + 3 Са(ОН)2
Mg3N2 + 3h3SO4 = 3MgSO4 + 2Nh4↑
Mg3N2 + 8HBr = 3MgBr2 + 2Nh5Br
Mg2Si + 4h3O(хол.) = 2Mg(OH)2↓ + Sih5↑
Саh3 + 2h3O = Ca(OH)2 + h3↑
2Al + 2NaOH + 6h3O = 2Na[Al(OH)4] + 3h3
2Al + 6NaOH 𝑡°→ 2Na3AlO3 + 3h3 (сплавление)
8Al + 3KNO3 + 5KOH + 18h3O = 8K[Al(OH)4] + 3Nh4
Al2O3 + 2NaOH + 3h3O = 2Na[Al(OH)4]
2Al2O3 электролиз в расплаве Na3[AlF6] → 4Al + 3O2 (получение алюминия)
на катоде на аноде
K[Al(OH)4] + CO2 = Al(OH)3 + KHCO3
Na[Al(OH)4] + SO2 = Al(OH)3↓ + NaHSO3
Na[Al(OH)4] + 4HCl(избыток) = NaCl + AlCl3 + 4h3O
Na[Al(OH)4] + НCl(недостаток) = Al(OH)3↓ + NaCl + h3O
Na[Al(OH)4] 𝑡⁰→ NaAlO2 + 2h3O
Al(NO3)3 + 3(Nh4 ∙ h3O) = Al(OH)3↓ + 3Nh5Cl
Al2(SO4)3 + 8NaOH(избыток) = 2Na[Al(OH)4] + 3Na2SO4
AlCl3 + 3NaOH(недостаток) = Al(OH)3↓ + 3NaCl
3Fe + 2O2 𝑡°→ Fe3O4
Fe + Fe3O4 𝑡°→ 4FeO
Fe + 2KOH + 3KNO3 = 3KNO2 + K2FeO4 + h3O
2FeCl3 + Fe = 3FeCl2
4Fe(OH)2 + O2 + 2h3O = 4Fe(OH)3↓
2Fe(OH)2 + h3O2 = 2Fe(OH)3
2Fe(OH)3 + 6HI = 2FeI2 + I2 + 6h3O
2Fe(OH)3 + 3Br2 + 10KOH = 2K2FeO4 + 6KBr + 8h3O
4FeS + 7O2 = 2Fe2O3 + 4SO2
2FeCl3 + Cu = 2FeCl2 + CuCl2
(CuOH)2CO3 𝑡°→ 2CuO + CO2 + h3O
2Cu(NO3)2 𝑡°→ 2CuO + 4NO2 + O2
3CuO + 2Nh4 𝑡°→ 3Cu + N2 + 3h3O
Cu2O + 4Nh4 + h3O = 2[Cu(Nh4)2]OH
CuCl + 2Nh4 = [Cu(Nh4)2]Cl
Сu(OH)2 + 4(Nh4 · h3O) = [Cu(Nh4)4](OH)2 + 4h3O
Cu(OH)2 + 4Nh4 = [Cu(Nh4)4](OH)2
2CuCl2 + 4KI = 2CuI + I2 + 4HCl
Mn(NO3)2 𝑡°→ MnO2 + 2NO2
Mn(NO3)2 + PbO2 𝑡°→ MnO2 + Pb(NO3)2
2KMnO4 + 8MnSO4 + 2h3O = 5MnO2 + K2SO4 + 2h3SO4
4HCl + MnO2 = MnCl2 + 2h3O + Cl2↑
2MnO2 + 2h3SO4 = 2MnSO4 + O2 + 2h3O
MnO2 + 2KOH 𝑡°→ K2MnO4 + 2h3O
2KMnO4 → MnO2 + K2MnO4 + O2↑
H+ Mn2+ (бесцветный раствор)
KMnO4 (MnO4─) h3O MnO2 (бурый осадок)
OH─ MnO42─ (раствор зеленого цвета)
2KMnO4 + 3KNO2 + h3O = 3KNO3 + 2MnO2 + 2KOH
2KMnO4 + 5Na2SO3 + 2KOH = 2K2MnO4 + 5Na2SO4 + h3O
K2MnO4 + 2KI + h3O = MnO2 + I2 + 4KOH
2K2MnO4 + Cl2 = 2KMnO4 + 2KCl
3K2MnO4 + 4HСl = 2KMnO4 + MnO2 + 4KCl + 2h3O
(Nh5)2C2O7 𝑡°→ Cr2O3 + N2 + 4h3O
Cr2O3 + 3KNO3 + 4KOH = 2K2CrO4 + 3KNO2 + 2h3O
Cr(OH)3 + 3HCl = CrCl3 + 3h3O
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
2Cr(OH)3 + 3Br2 + 10KOH = 2K2CrO4 + 6KBr + 8h3O
2CrCl3 + 3Br2 + 16KOH = 2K2CrO4 + 6KBr + 6KCl +
8h3O
2CrCl3 + 3h3O2 + 10NaOH = 2Na2CrO4 + 6NaCl + 8h3O
Na2Cr2O7 + 2h3SO4 = 2CrO3 + 2NaHSO4 + h3O
K2Cr2O7 + 3Na2SO3 + 4h3O = 2Cr(OH)3↓ + 3Na2SO4 + 2KOH
2K2CrO4 + 3(Nh5)2S + 2h3O = 2Cr(OH)3↓ + 3S↓ + 6Nh4↑ + 4KOH
K2Cr2O7 + 4h3SO4 + 3KNO2 = Cr2(SO4)3 + 3KNO3 + K2SO4 + 4h3O
K2Cr2O7 + 14HCl = 3Cl2 + 2CrCl3 + 7h3O + 2KCl
h3O Cr(OH)3 серо-зеленый осадок
K2CrO4 (CrO42– )
OH– [Cr(OH)6]3– раствор изумрудно-зеленого цвета
K2Cr2O7 (Cr2O72– ) H+ Cr3+ раствор сине-фиолетового цвета
K2Cr2O7 + 2KOH = 2K2CrO4 + h3O
2C + Na2SO4 = Na2S + CO2
2C + Na2CO3 = 2Na + 3CO
C + 4HNO3(конц.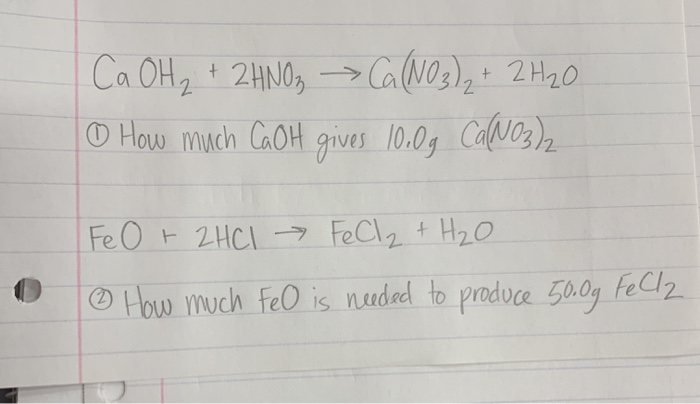 ) = CO2 + 4NO2 + 2h3O
) = CO2 + 4NO2 + 2h3O
С + 2h3SO4 (конц.) = 2SO2 + CO2 + 2h3O
Al4C3 + 12h3O = 4Al(OH)3 + 3Ch5
CaC2 + 2h3O = Ca(OH)2 + C2h3
CO + Cl2 = COCl2
CO + NaOH = HCOONa
(Nh5)2CO3 𝑡°→ 2Nh4 + 2h3O + CO2
Li3N + 3h3O = 3LiOH + Nh4
Ca3N2 + 6HCl = 3CaCl2 + 2Nh4
N2 + 3h3 кататализатор, 𝑡°, 𝑝 ⇔ 2Nh4
N2 + O2 электрический разряд → 2NO
N2 + 3LiH 𝑡°→ Li3N + Nh4
2Nh4 + 3CuO = 3Cu + N2 + 3h3O
4Nh4 + 3O2 = 2N2 + 6h3O
4Nh4 + 5O2 катализатор → 4NO + 6h3O
6Nh4 + CuCl2 = [Cu(Nh4)6]Cl2
4Nh4 + Cu(OH)2 = [Cu(Nh4)4](OH)2
Nh5NO2 𝑡°→ N2 + 2h3O
Nh5NO3 = N2O + 2h3O (190 – 245° C)
2Nh5NO3 = 2NO + 4h3O (250 – 300° C)
2Nh5NO3 = 2N2 + O2 + 4h3O (выше 300° С)
2NO2 + h3O = HNO3 + HNO2
4NO2 + 2h3O + O2 = 4HNO3
2NO2 + 2NaOH = NaNO3 + NaNO2 + h3O
6HNO3 + HI = HIO3 + 6NO2 + 3h3O
2HNO3 + SO2 = h3SO4 + 2NO2
2HNO3 + h3S = S + 2NO2 + 2h3O
8HNO3 + CuS = CuSO4 + 8NO2 + 4h3O
4HNO3 + FeS = Fe(NO3)3 + NO + S + 2h3O
KNO2 + h3O2 = KNO3 + h3O
5KNO2 + 3h3SO4 + 2KMnO4 = 5KNO3 + 2MnSO4 + K2SO4 + 3h3O
3KNO2 + 4h3SO4 + K2Cr2O7 = 3KNO3 + Cr2(SO4)3 + K2SO4 + 4h3O
2KNO2 + 2h3SO4 + 2KI = 2NO + I2 + 2K2SO4 + 2h3O
3KNO2 + Cr2O3 + KNO3 = 2K2CrO4 + 4NO
PCl5 + 4Н2О = Н3РО4 + 5НCl
PCl5 + 8KOH = K3PO4 + 5KCl + 4h3O
Ca3P2 + 6h3O = 3Са(ОН)2 + 2Ph4↑
Mg3P2 + 6HCl = 3MgCl2 + 2Ph4↑
4P + 3KOH + 3h3O = 3Kh3PO2 + Ph4↑ или
2Ph4 + 4O2 = P2O5 + 3h3O
Ph4 + 2O2 = h4PO4
Ph4 + 8HNO3 = h4PO4 + 8NO2 + 4h3O
Cl2 + h3O ↔ HCl + HClO
MnO2 + 4HCl = MnCl2 + Cl2↑ + 2h3O
2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2↑ + 8h3O
KClO3 + 6HCl = KCl + 3Cl2↑ + 3h3O
K2Cr2O7 + 14HCl = 2CrCl3 + 2KCl + 3Cl2↑ + 7h3O
h3SO4(конц. ) + NaCl(тверд.) = NaHSO4 + HCl↑
) + NaCl(тверд.) = NaHSO4 + HCl↑
Кислородсодержащие кислоты:
HClO – хлорноватистая
HClO2 – хлористая
HClO3 – хлорноватая
HClO4 – хлорная
Соли кислородсодержащих кислот.
кислота название солей
HClO гипохлориты
HClO2 хлориты
HClO3 хлораты
HClO4 перхлораты
4KClO3 𝑡° → 3KClO4 + KCl
2KClO3 MnO2 → 2KCl + 3O2↑
2KClO3 + 3S 𝑡° → 2KCl + 3SO2
5KClO3 + 6P 𝑡° → 5KCl + 3P2O5
KClO4 𝑡° → 2O2 + KCl
404 Not Found
404 Not Found- Главная
- Сведения об образовательной организации
- Образование org/ListItem»> Информация об описании образовательных программ ВО
- Рабочие программы дисциплин
- 23.05.03_l_2019
|
|
Оплата Заявка на курсы
Химия.
 Уроки в 9 классе. (Гара Н.Н.)
Уроки в 9 классе. (Гара Н.Н.)%PDF-1.6 % 486 0 obj > endobj 483 0 obj > endobj 485 0 obj >stream Adobe Illustrator CS32015-06-11T15:34:46+03:002015-06-11T17:12:01+03:002015-06-11T17:12:01+03:00
 999996212.000001Millimeters
999996212.000001Millimeters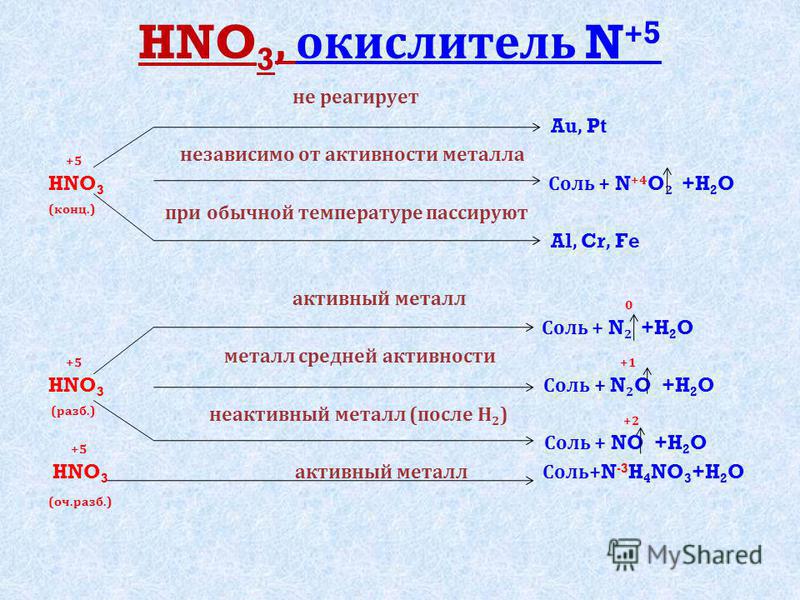 ~~t7ʂqt>.bv$[ZgxAeƠ#5|PmS5K
m~9″`r.ŭeLL3 OmoLzp|{5c &m[ߺz
~~t7ʂqt>.bv$[ZgxAeƠ#5|PmS5K
m~9″`r.ŭeLL3 OmoLzp|{5c &m[ߺzЧистый нитрат кальция
Чистый нитрат кальция Получение безводного нитрата кальция, предоставленное BASFИспользование: Приготовление безводной азотной кислоты, добавка для сохранения чего-н. влажный, производство сухого газообразного диоксида азота путем разложения
Нитрат кальция является удобрением только специального назначения из-за его низкое содержание азота, поэтому его трудно усваивать. это нитрат кальция содержащее удобрение представляет собой двойную соль формулы 5Ca(NO3)2Nh5NO3.10h3O а Nh5NO3 можно было удалить повторной перекристаллизацией из кипящую воду, так как Nh5NO3 гораздо лучше растворим в горячей воде, чем Ca(NO3)2.
Таким образом, в большинстве случаев процесс, который мы выбираем, должен быть аммиачным. реакция нитрат-оксид кальция, которая подробно описана ниже насколько это возможно, чтобы предотвратить разочарование и пустую трату времени.
Следующее описание основано на десятках экспериментальных попыток. оптимизировать и упростить метод.
оптимизировать и упростить метод.
Уравнение реакции: CaO + h3O + 2Nh5NO3 > Ca(NO3)2 + Nh4 + 2h3O
Побочные реакции: Nh4 + h3O > Nh4.h3O
Разложение (нежелательное): Ca(NO3)2 > CaO + 2NO2 + O2
Шаг 1) возьмите 50-килограммовый* мешок удобрения KAS 27 EU или аналогичный нитро продукт(27%N, в основном аммиачная селитра), желательно летом, или вам зададут много вопросов — все равно это не так уж и дорого…
Насыпьте удобрение в несколько ведер и герметично закройте их. хранилище.
Шаг 2) Получите 40 кг* — мешок извести (>92% CaO). Насыпьте лайм в несколько ведер и герметично закройте их для хранения.
* меньшие количества трудно получить
Шаг3) взвешиваем 3,4 части*(по весу или также по объему, если гранулированное удобрение осталось сухим) удобрения KAS 27 и растворить его при сильном перемешивании в наименьшем количестве теплой воды.
Затем дайте постоять несколько минут и осторожно слейте раствор.
от нерастворимых добавок CaCO3 и MgO.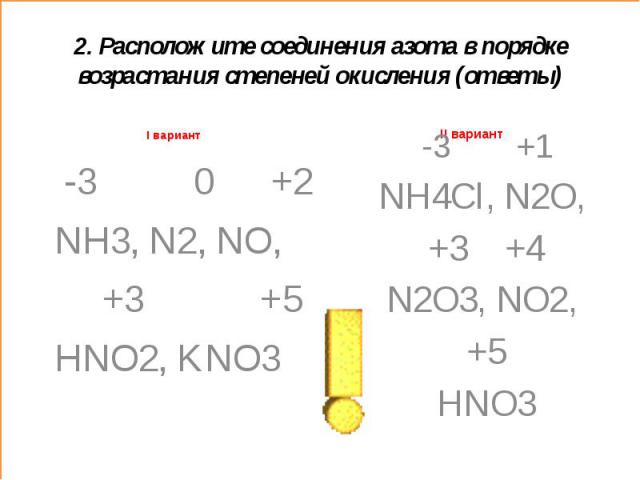
Промойте оставшееся твердое вещество несколькими миллилитрами горячей воды, дайте отстояться и декантируйте. остальное раствор аммиачной селитры.
Подготовьте подходящий горшок для следующего шага, достаточно большой, чтобы поместить выбранный количество реагентов при этом заполняется только на половину его объема.
*только в случае использования европейского союза — удобрения KAS 27, которое содержит около 77% аммиачной селитры; примечание: это удобрение гранулированное, и гранулы имеют точный размер таким образом, что объем (л) равен к весу (кг) — и это очень практично.
Шаг 3) отвесить 1 часть (по весу), — более 2 частей, если хотите чтобы ускорить процесс- извести и поместить ее в кастрюлю.
Шаг 4) Найдите хорошее место снаружи (необходима хорошая вентиляция) и добавьте в 4 или 5 порций при сильном перемешивании раствор аммиачной селитры.
Внимание: используйте защитные очки!
В результате реакции выделится много тепла, и раствор закипит.
Не вдыхайте вредные пары аммиака (интоксикация аммиачным газом). редки из-за сильного запаха, так что не паникуйте, просто будьте осторожны).
Шаг 5) Нагрейте кастрюлю, пока она не закипит.
Сохраняйте смесь влажной, часто добавляя воду.
Не допускайте высыхания смеси, так как она перегреется и достичь температуры разложения нитрата кальция.
Весь процесс преобразования занимает много часов, поэтому оставьте его кипеть на ваш источник тепла и вернуться для частого перемешивания.
Реакция заканчивается, когда после добавления небольшого количества извести уже не наблюдается запаха аммиака или влажного лакмуса бумага не меняет свой цвет, когда ее кладут над горшком.
Шаг 6) добавьте как можно больше холодной воды и перемешайте.
Дайте карбонату кальция и непрореагировавшему гидроксиду кальция осесть. и осторожно перелейте раствор нитрата кальция в подходящие кофейные фильтры.
Вы можете значительно ускорить процесс фильтрации, повесив
шнур через фильтр, это будет поддерживать поток в любое время. Вы можете повторить процесс, добавив воду к оставшемуся слагу, чтобы
получить последние несколько граммов нитрата кальция из него.
Вы можете повторить процесс, добавив воду к оставшемуся слагу, чтобы
получить последние несколько граммов нитрата кальция из него.
Шаг 7) сначала приготовьте раствор до сухости.
Внимание: всегда есть вероятность того, что раствор закипит в тот момент, когда нитрат кальция начинает выпадать в осадок.
Затем тщательно высушите нитрат кальция при температуре от 130 и 400 градусов по Цельсию. (400C — серое свечение, красное свечение выше 500C) Это важно, так как более высокие температуры (красное свечение) разлагают нитрат кальция, образуя сильно ядовитый диоксид азота.
Шаг 9) высушенный нитрат кальция будет таким же твердым, как камень, и наиболее часто его приходится удалять с помощью молотка и зубила. Попробуйте сделать это пока еще горячо, а то нитрат кальция придется сушить опять же, так как он очень гигроскопичен.
Шаг 10), так как нитрат кальция чаще всего потребуется в виде порошка,
раздавите куски кувалдой, удерживая их в подходящем
полиэтиленовый пакет для защиты от влаги.
Хранение: Полностью герметичные контейнеры.
Скорость всего процесса определяется соотношением удобрений и извести (как упомянутый в шаге 3), перемешивание и выбранный реакционный контейнер (широкий предпочтительнее открывать контейнеры).
Что такое нитрат аммония (Nh5NO3)? | КАКАЛИ ГОШ, преподаватель, блогер. Магистр химии.
Нитрат аммония представляет собой химическое, а также неорганическое соединение с молекулярной формулой Nh5NO3 . Это важное N-содержащее удобрение, которое преимущественно используется в сельском хозяйстве.
Белые или серые кристаллы, а также гигроскопичное твердое вещество, хотя и не образует гидратов с водой.
Плотность аммиачной селитры составляет 1,7 г/куб.см. Имеет тригональную кристаллическую структуру. Температура плавления нитрата аммония составляет 442,6 К, а его температура кипения составляет 483 К.
Нитрат аммония хорошо растворим в воде благодаря своей ионной природе.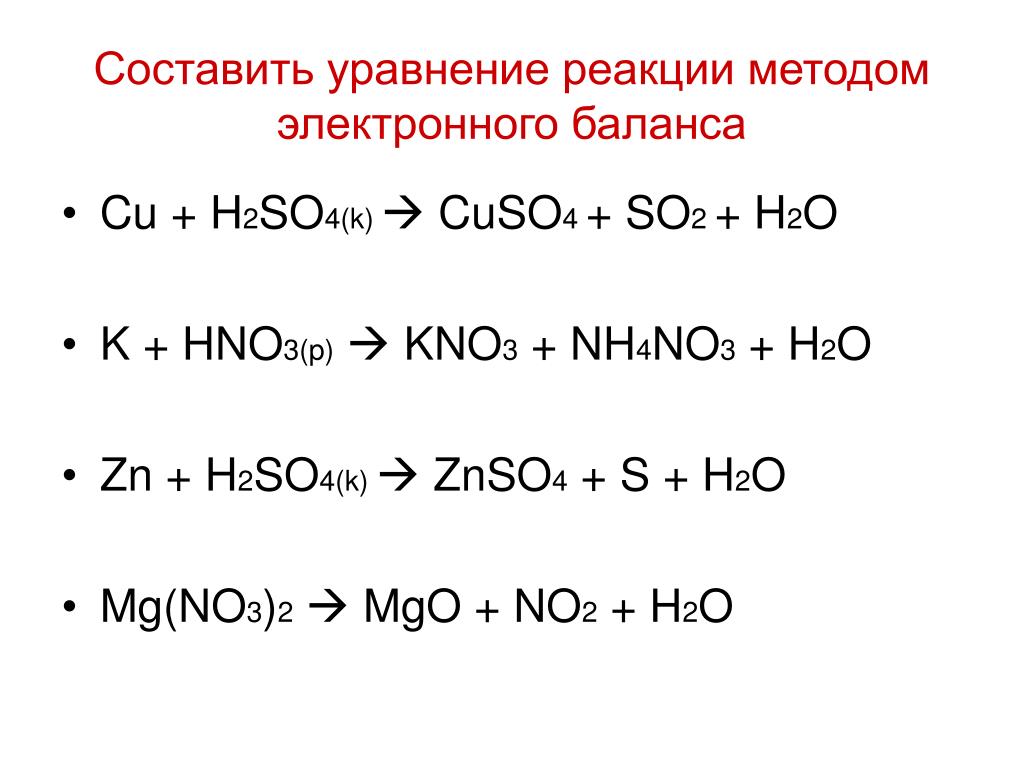 Растворение аммиачной селитры в воде является эндотермическим процессом.
Растворение аммиачной селитры в воде является эндотермическим процессом.
Растворимость Nh5NO3 в воде 1,5 г/см3 при 293К и увеличивается до 10,2 г/см3 при температуре 373К.
Аммиачная селитра является взрывчатым веществом. По этой причине он используется в качестве компонента взрывчатых смесей, которые используются в горнодобывающей промышленности, разработке карьеров и гражданском строительстве.
Он также является основным ингредиентом ANFO ( нитрат аммония / мазут). Аммиачная селитра используется в большинстве взрывчатых веществ.
Тысячи людей погибли в результате взрывов аммиачной селитры в прошлом. В результате многие страны прекращают его использование в качестве взрывчатого вещества.
Читайте также: что такое аммиак?
Масс-дифракционным анализом было доказано, что химическая формула аммиачной селитры : Nh5NO3 . Имеет тригональную кристаллическую структуру.
Имеет тригональную кристаллическую структуру.
В молекуле нитрата аммония присутствуют как ковалентные, так и электролитические связи.
Химические свойства
Аммиачная селитра используется в качестве взрывчатого вещества, которое является компонентом взрывчатого вещества.
Но нитрат аммония сам по себе не взрывоопасен. Его необходимо смешать с первичным взрывчатым веществом, таким как азид, для образования взрывчатой смеси.
При нагревании нитрата аммония он разлагается с образованием закиси азота и воды.
Nh5NO3 ⟶ N2O + 2h3O
При взаимодействии Nh5NO3 с гидроксидами щелочных металлов образуются нитраты металлов и аммиак.
Промышленное производство нитрата аммония осуществляется путем реакции газообразного аммиака с концентрированной азотной кислотой.
Реакция является примером кислотно-щелочной реакции. Реакция протекает бурно, поскольку носит экзотермический характер.
Реакция протекает бурно, поскольку носит экзотермический характер.
HNO3 + Nh4 → Nh5NO3 + нагревание
Аммиачная селитра также может быть получена реакцией металлического олова с холодной и разбавленной азотной кислотой.
5 Sn + 20 HNO3 ⟶ 4Sn (NO3)2 + Nh5NO3 + 3h3O
Другой метод производства представляет собой вариант нитрофосфатного процесса.
Ca (NO3)2 + 2 Nh4 + CO2 + h3O → 2 Nh5NO3 + CaCO3
Продукты, карбонат кальция и нитрат аммония, могут очищаться отдельно.
Нитрат аммония также может быть получен с помощью реакций метатезиса. Реакции показаны ниже.
(Nh5)2SO4 + Ba (NO3)2 → 2 Nh5NO3 + BaSO4
Nh5Cl + AgNO3 → Nh5NO3 + AgCl
Существует два основных варианта использования аммиачной селитры . Эти два, использование аммиачной селитры в качестве удобрения и в качестве взрывчатого вещества.
Удобрение
Аммиачная селитра является важным азотным удобрением, содержащим 35% азота. Он менее концентрирован, чем мочевина.
Он менее концентрирован, чем мочевина.
Преимущество аммиачной селитры перед мочевиной заключается в том, что она более стабильна. Вот почему аммиачная селитра не так быстро теряет азот в атмосфере.
Взрывчатые вещества
Аммиачная селитра является основным компонентом некоторых взрывчатых веществ. Некоторые примеры взрывчатых веществ с нитратом аммония приведены ниже.
Примечательны астролит, аматол (нитрат аммония и тротил), аммонал (нитрат аммония и алюминиевая пудра), ANFO (94% нитрата аммония и 6% мазута), DBX и минол и т. д.
Также используется в горнодобывающей и строительной промышленности в качестве взрывчатого вещества.
Терроризм
Взрывчатые вещества на основе нитрата аммония использовались при взрывах в Дели в 2011 году и при взрывах в Хайдарабаде в 2013 году.
Террористы применили нитрат аммония 9Взрывчатые вещества на основе 0078 для взрывов во многих странах мира. По этой причине многие страны прекращают его использование в качестве взрывчатого вещества.
По этой причине многие страны прекращают его использование в качестве взрывчатого вещества.
Использование в нише
Растворение нитрата аммония в воде сильно эндотермическое. По этой причине он используется в некоторых мгновенных холодных компрессах.
Раствор аммиачной селитры с азотной кислотой также может использоваться в космических кораблях как более энергетическая альтернатива обычному монотопливу гидразину.
Нитрат аммония опасен для здоровья
Несмотря на взрывоопасность, нитрат аммония , как правило, не опасен для здоровья. Это обычно используется в продуктах удобрения.
Нитрат аммония представляет собой азотсодержащее неорганическое соединение. Нитрат аммония представляет собой соль аммиака и азотной кислоты. Он содержит 35% азота, который очень важен для питания растений.
По этой причине аммиачная селитра используется для приготовления N-содержащих удобрений, которые используются в основном в сельском хозяйстве.
Например, растворы мочевины и аммиачной селитры, фосфаты аммония и т. д. Эти удобрения известны как аммиачно-нитратные удобрения.
Аммиачная селитра является известным взрывчатым веществом. Потому что он используется для изготовления различных видов взрывчатых веществ.
Но нитрат аммония сам по себе не является взрывчатым веществом. Следовательно, мы можем безопасно использовать аммиачную селитру .
Однако при определенных условиях случайно взрывается с разрушительной силой. По этой причине смешивание аммиачная селитра с другими взрывчатыми веществами опасна.
Например, при смешивании тротила с аммиачной селитрой образуется опасное взрывчатое вещество под названием аматол.
Опять же, смесь аммиачной селитры и алюминиевой пудры производит взрывчатое вещество под названием аммонал. По вышеуказанной причине аммиачная селитра опасна по своей природе.
Альтернативы нитрату кальция в гидропонных системах и системах фертигации
Нитрат кальция представляет собой неорганическое соединение с формулой Ca(NO 3 ) 2 и в основном используется в качестве компонента удобрений.
В почве и питании растений кальций является королем. Нитрат кальция является единственным дешевым нереакционноспособным водорастворимым кальциевым удобрением, подходящим для капельной подкормки фертигированных культур, поэтому само собой разумеется, что нитрат кальция является властелином среди удобрений. НЕТ реалистичных, долгосрочных альтернатив. К сожалению, кенийские (и угандийские) производители столкнулись с перебоями в поставках нитрата кальция из-за задержек в порту (октябрь 2018 г.). Длительная задержка в очистке контейнеров (и дополнительные расходы) привели к снижению доступности и повышению цен.
Что могут сделать кенийские производители? Как уже упоминалось, прямых альтернатив нитрату кальция не существует, поэтому нам придется быть смелыми, инновационными и двигаться в непроверенных водах…….
Кальций не зря называют королем питательных веществ. Кальций очень важен для здоровья почвы, микробного разнообразия, структуры почвы, защиты от тяжелых металлов и множества других свойств почвы. В качестве поправки к почве у нас есть альтернативы. Земледельцы, которые следуют нашей программе оздоровления почвы и балансируют уровни кальция и pH при посадке и ежегодно, должны иметь достаточный уровень кальция в своих почвах, который поможет им в этом кризисе. Они смогут «добывать» в своей почве кальций и добавлять в нее гипс, кальцитовую известь или доломитовую известь (в зависимости от рекомендаций результатов анализа почвы).
Кальций в гидропонике Производителям гидропоники не так повезло. При посадке производители должны кондиционировать их
среды с гипсом, известью, кальмаром для доведения уровня кальция до оптимального
начало, но количество, которое среда может хранить, очень ограничено, а кальций
очень быстро (за считанные дни!) заканчивается. Вся концепция гидропоники заключается в том, чтобы иметь систему
подкормка питательными веществами, которую можно изменить в мгновение ока…
Вся концепция гидропоники заключается в том, чтобы иметь систему
подкормка питательными веществами, которую можно изменить в мгновение ока…
Кальций является важным вторичным питательным веществом для растений и обычно поставляется в виде питательных растворов в количестве 80-240 частей на миллион. Кальций, имеющий решающее значение для растений, также предотвращает дефицит различных других питательных веществ и является важным компонентом прочных клеточных стенок, что приводит к более крепким культурам с повышенной жизнеспособностью и свойствами хранения (критически важно для экспортируемых культур, которым необходимо достичь места назначения в хорошей форме!).
Кальций откладывается в виде пектата кальция в клеточных стенках. Это означает, что он неподвижен в растениях и не может перемещаться из более старой ткани в более молодую, поэтому он необходим постоянно. Важен для всех растений. Кальций особенно важен для роз, помидоров, перца, крестоцветных и черенков.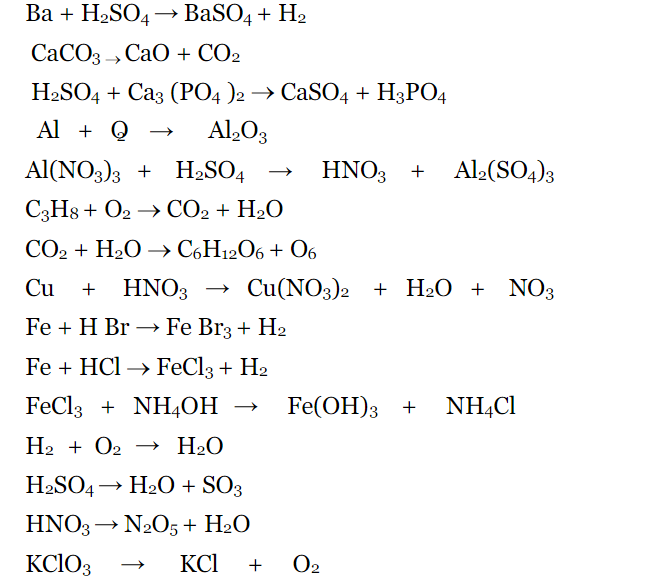
Кальций обеспечивает усвоение других питательных веществ. Это важно для деления корневых клеток и силы клеток. Низкий уровень кальция в корневой ткани делает корни восприимчивыми к почвенным болезням и нематодам. Без деления корней усвоение фосфора замедляется.
Кальций важен для стабильности и функционирования клеточных мембран. Когда поступление кальция замедляется, клеточные мембраны становятся негерметичными, а деление клеток нарушается, вызывая скручивание и коробление новой листвы. Прохудившиеся мембраны более восприимчивы к предуборочным заболеваниям, а также послеуборочному ботритису и кровоподтекам.
Кальций замедляет старение клеток, защищая их от токсинов и этилена, поэтому он важен для поддержания качества и срока годности. Для производителей черенков жизненно важен достаточный уровень кальция — не только для транспортировки, но и для формирования корневых клеток для укоренения.
Из-за того, что он неподвижен, у молодых побегов возникает дефицит кальция, и симптомы включают ожог кончиков листовых культур и верхушечные гнили томатов и стручкового перца. Мягкие «дырявые» клеточные мембраны более восприимчивы к повреждению аэрозолем и тепловому стрессу.
Мягкие «дырявые» клеточные мембраны более восприимчивы к повреждению аэрозолем и тепловому стрессу.
Симптомы дефицита кальция различаются в зависимости от типа растения, сорта, степени тяжести дефицита кальция и условий выращивания. В начале симптомы трудно обнаружить, и в это трудное время важно контролировать уровень кальция с помощью регулярного анализа листьев .
К тому времени, когда симптомы дефицита кальция проявляются, чашевидная форма новой листвы, бледные краевые полосы, повышенное повреждение опрыскиванием, болезни и давление насекомых, пропитанные водой участки на стеблях и листьях и кончиках корней, которые становятся желеобразными, урожайность и качество будут снижены. не подлежит ремонту.
Внимательно следите за сроками хранения цветов и овощей. Поражаются не только клетки снаружи, дефицит кальция влияет и на внутренние клетки. Обратите внимание на черную сердцевину салата, пустую капусту, потемнение внутри цветочных бутонов, потемнение нарезанной фасоли, кукурузу.
Оптимальный уровень кальция в листьях варьируется от растения к растению, но обычно составляет 0,8-2%. Возраст листьев для отбора проб важен, потому что более старые листья неподвижны, как правило, не обнаруживают дефицита. Следовательно, необходимо отобрать самые молодые и зрелые листья для анализа листьев – у роз это будет 3-4 листа на розах, показывающих цвет. Дефицит кальция может привести к потерям > 50%! Поэтому важно держать мяч.
Повышение усвоения кальцияОптимизация питания растений кальцием — это не просто вопрос дозировки. Поглощение кальция сложно и часто неправильно понимают. Почвы, среды и питательные растворы, как правило, имеют достаточное количество кальция, и многие дефициты кальция являются индуцированными дефицитами.
Факторы окружающей среды, факторы урожая, управление раствором, уровень влажности и соотношение элементов — все это взаимодействует, чтобы повлиять на поглощение кальция. Понимание факторов, влияющих на поглощение кальция, поможет нам максимизировать ограниченный кальций, который у нас есть, и повлияет на наш выбор замещающих удобрений.
Поглощение кальция является пассивным процессом, и кальций перемещается в корень и через растение в движении воды, движимом потоком транспирации через ксилему. Таким образом, само собой разумеется, что любые факторы, влияющие на транспирацию, будут влиять на усвоение кальция.
- Высокий уровень освещенности, более низкая влажность, более теплый климат, движение воздуха, оптимальная влажность в корневой зоне, выращивание вне кустов – все это способствует поглощению кальция.
- Сухие корни, высокая влажность, густой рост растений, холодная погода, низкий уровень освещенности, чрезмерное опрыскивание (закрытые устьица), некоторые силикатные и маслянистые продукты (забитые устьица) снижают поглощение кальция.
- Optimum Медь и калий необходимы для прочности ксилемы и эффективности транслокации. Низкие уровни вызывают преждевременное увядание и снижение усвоения кальция
- Избыток азота способствует очень быстрому мягкому росту, вызывая дефицит кальция из-за увядания и увеличивая объем роста, который должен удовлетворять кальций.

- Высокие температуры почвы способствуют поглощению калия и снижают поглощение кальция – мульчируйте/укрывайте почву.
- Цветы и фрукты имеют более низкую скорость транспирации и будут первыми, кто пострадает от дефицита кальция – отсюда вершинная гниль у томатов и перца.
- При слишком низкой влажности – высокая транспирация, и кальций будет быстрее откладываться в нижних листьях, в результате чего его недостаточно для верхних листьев и цветочных почек.
- При очень низкой влажности, в самое жаркое время дня, при сухих почвах, затопленных почвах, высокой засоленности растения могут отключить транспирацию, ограничивая ксилему, закрывая устьица и поворачивая листья – тогда происходит нулевое поглощение кальция.
Теплые и влажные условия в сочетании с ограниченным потоком воздуха и быстрый рост известен как «кальциевый стресс». периоды’ и приводят к ожогу кончиков и гибели точек роста (слепые стреляет).
Оптимизация уровня влажности Растения потребляют меньше воды и, следовательно, кальция из сухих корневых зон. EC накапливается вокруг сухих корней, создавая осмотический стресс, снижая поглощение воды и кальция. Затопленные корни не получают кислорода и закрываются = кальций не поглощается. Оптимальная влажность = оптимальная корневая активность = оптимальное усвоение кальция. Если у вас его нет, приобретите датчик влажности, такой как Aquacheck, и используйте его, чтобы ориентироваться в циклах полива.
EC накапливается вокруг сухих корней, создавая осмотический стресс, снижая поглощение воды и кальция. Затопленные корни не получают кислорода и закрываются = кальций не поглощается. Оптимальная влажность = оптимальная корневая активность = оптимальное усвоение кальция. Если у вас его нет, приобретите датчик влажности, такой как Aquacheck, и используйте его, чтобы ориентироваться в циклах полива.
pH оказывает большое влияние на доступность и усвоение кальция. Низкий рН увеличивает растворимость катионов металлов, которые подавляют усвоение кальция. При высоком pH кальций связывается в виде нерастворимого карбоната (извести), и для нейтрализации карбоната и высвобождения кальция требуются кислые условия.
При посадке в почву в начале делайте полный анализ почвы. Научно рассчитанные добавки извести/доломитовой извести, гипса или серы помогут сбалансировать рН почвы и оптимизировать уровень кальция. Для сред анализ и предварительная подготовка сред уравновешивают рН среды. Кокосовый торф и пемза могут содержать большое количество натрия и калия и поглощать большое количество кальция и азота. Кондиционирование необходимо проводить перед посадкой.
Кокосовый торф и пемза могут содержать большое количество натрия и калия и поглощать большое количество кальция и азота. Кондиционирование необходимо проводить перед посадкой.
Качество поливной воды, количество кислоты и соотношение питательных веществ влияют на непосредственный и долгосрочный рН в корневой зоне.
Сбалансируйте электрическую проводимость почвы (EC)При низком уровне EC растениям трудно поглощать любые питательные вещества. Высокий уровень ЕС в корневой зоне вызывает осмотический стресс, снижая поглощение воды и кальция. Уделите особое внимание поддержанию оптимального уровня ЕС в корневой зоне. Обратите внимание, что анализ капель и стоков в гидропонике может вводить в заблуждение в отношении уровней ЕС в среде, явление, известное как 9.0351 ложный слив .
Мониторинг EC в корневой зоне с регулярным отбором проб для анализа среды 1:1,5 или анализа почвы 1:2. Образцы следует брать свежими, а не высушенными, и отправлять в лабораторию как можно скорее, а не в выходные дни. Анализ чувствителен ко времени и влаге. Отправка образцов в абсорбирующих пакетах (например, бумажных) приведет к высасыванию влаги и даст ложно высокие показания.
Анализ чувствителен ко времени и влаге. Отправка образцов в абсорбирующих пакетах (например, бумажных) приведет к высасыванию влаги и даст ложно высокие показания.
ЕС в корневой зоне представляет собой баланс между ЕС почвы/среды, Капельное и водопоглощение растений.
Сбалансируйте уровни питательных веществНаиболее хорошо сбалансированные питательные растворы с правильным диапазоном ЕС содержат достаточное количество кальция для оптимального усвоения. Баланс является ключевым здесь.
- Дефицит меди и калия вызывает преждевременное увядание, снижение транслокации и снижение усвоения кальция.
- Высокое содержание натрия и калия в корневой зоне конкурирует за поглощение с кальцием И перемещение кальция к растущим кончикам, что является частой причиной ожога кончиков.
- Кальций и магний противоположны в растительной системе и имеют антагонистические взаимодействия. Высокое содержание магния конкурирует с кальцием и вызывает фитотоксичность у растений
- Высокое содержание алюминия, железа и других микроэлементов также являются катионами и конкурируют с кальцием за поглощение.

- Высокий уровень бикарбоната в поливной воде связывается с кальцием, образуя нерастворимую известь, выводя ее из питательного раствора. Они должны быть нейтрализованы правильным дозированием кислоты.
- Важно соотношение нитратов и аммония. Нитрат кальция важен как источник нитрата, особенно для гидропоники. Он хорошо растворяется и быстро усваивается корневой системой. В то время как небольшая доля аммония в корневой зоне помогает ускорить рост в щелочных условиях, при слабом освещении и температуре, аммоний также является катионом (Nh5+) и значительно ухудшает поглощение кальция, и его содержание должно быть снижено до нуля в жаркую погоду и в условиях быстрого роста.
- Высокие фосфаты могут связываться с кальцием, образуя нерастворимый осадок, удаляя как кальций, так и фосфор из зоны досягаемости корней.
- Высокие сульфаты в сочетании с кальцием образуют гипс, растворимость которого ограничена.
- Кальций и бор идут рука об руку — низкий или высокий уровень бора оказывает огромное влияние на усвоение и использование кальция!
Здоровье корневой системы играет жизненно важную роль в обеспечении кальция
поглощение. Корневые болезни, нематоды, вода
вырубленные корни, анаэробные корневые зоны ограничивают поглощение кальция. Запустите регулярные нематоды и корневые болезни
чеки.
Корневые болезни, нематоды, вода
вырубленные корни, анаэробные корневые зоны ограничивают поглощение кальция. Запустите регулярные нематоды и корневые болезни
чеки.
Далее мы обсудим альтернативы нитрату кальция.
Альтернативы нитрату кальцияКак упоминалось ранее, не существует водорастворимых, нереакционноспособных альтернатив нитрату кальция, которые вы можете добавить в свои рецепты фертигации в качестве прямой замены. Итак, здесь я перечислю некоторые варианты, доступные для кальция, чтобы повысить уровень кальция.
ВО-ПЕРВЫХ ЗАМЕТИТЕ, что Нитрат кальция вносит огромный вклад нитратов в ваш рецепт фертигации. Это основное важное питательное вещество, и первое, что должен сделать любой производитель при удалении нитрата кальция из своего рецепта, это убедиться, что уровень азота повышен за счет источников сульфата аммония, MAP, нитрата калия и нитрата магния. Азотная кислота также является очень хорошим источником азота в сочетании с известью или бикарбонатами.
Без кальция в растворимой форме ЕС в рецепте может снизиться – он будет уравновешен подкормкой. При балансировке азота — имейте в виду, что аммоний может быть очень подкисляющим и является катионом — поэтому он конкурирует с поглощением кальция. В идеале вам нужно применять азот в нитратной форме.
1.
ИзвестнякСуществует два типа извести.
- Известковая или сельскохозяйственная известь должна иметь содержание кальция >35% и содержание магния менее 1%
- Доломитовая известь имеет содержание кальция 20-24% и содержание магния 10-14%.
Известь поставляется в виде пыли, ее трудно отмерить и нанести грязно. Обычно его добывают в Кении, поэтому он дешевле и доступнее, чем импортный лайм. Эквивалент карбоната кальция (CCE) хорошей извести должен быть >70%. Это определяется качеством и крупностью извести. Чем мельче известь, тем быстрее она будет реагировать с почвой, высвобождая кальций и повышая рН. Крупные куски не вступают в реакцию и не имеют большого сельскохозяйственного значения.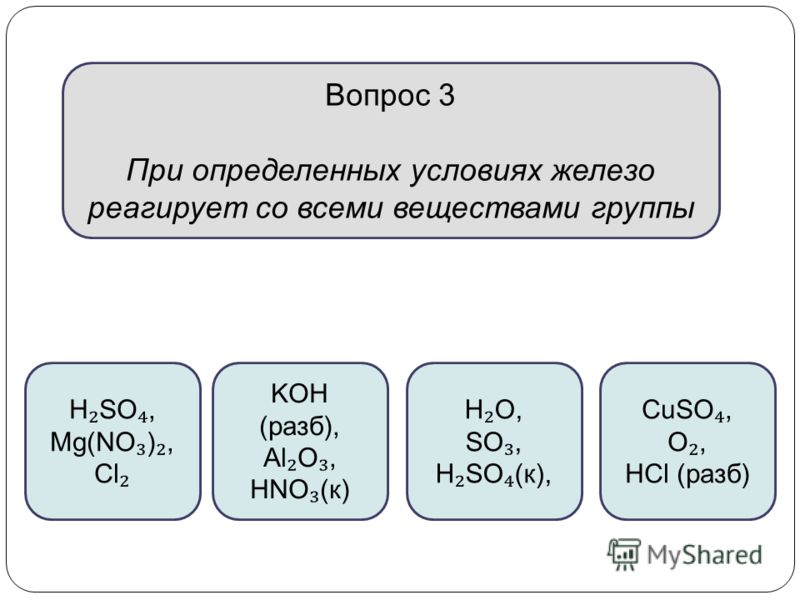 Качество варьируется в зависимости от источника и последующего помола — хорошо проверить качество извести перед ее применением.
Качество варьируется в зависимости от источника и последующего помола — хорошо проверить качество извести перед ее применением.
Известь представляет собой карбонат кальция и магния. Известь добавляет в почву кальций и магний, а карбонат вступает в реакцию с кислотами в почве (например, H+), увеличивая pH почвы до . Известь можно использовать в кислых почвах, необходимое количество определяется на основе полного анализа почвы, который учитывает pH, H+, Ca2+, другие катионы и CEC (тяжесть) почвы научным способом, чтобы правильно сбалансировать pH и катионы.
Внесение слишком большого количества извести называется чрезмерным известкованием и повышает рН почвы. При высоком рН почвы многие питательные вещества запираются, и растения начинают желтеть. Высокий pH почвы можно компенсировать кислой капельной водой или кислыми удобрениями, такими как сульфат аммония. Азотная кислота предпочтительнее для внесения дополнительных нитратов, которых не хватает при применении нитрата кальция.
Серная кислота может работать и дешева, но имеет два недостатка. Один из них очень опасен в обращении и не разрешен некоторыми сертификатами. Серная кислота вносит избыток сульфатов, которые могут временно связывать кальций в виде полурастворимого гипса. Фосфорная кислота может привести к слишком большому количеству фосфатов, которые связывают кальций и железо.
Известь кальциевая нитратная реакция2HNO3 + CaCO3 —–> Ca(NO3)2 + h3O + CO2
Известковая известь реагирует с азотной кислотой с образованием нитрата кальция, воды и двуокиси углерода. Количество зависит от силы кислоты и качества извести.
Как правило, стандартная известь может реагировать недостаточно быстро, чтобы обеспечить достаточное количество кальция. Для гидропоники вам нужен более доступный источник кальция. Почва более буферизирована и пока в почве достаточно Кальция – достаточно регулярно заменять удаление растений подкормками.
2.
Известь микронизированная Известь микронизированная гранулированная дороже из-за дополнительной обработки и импортируется. Но их гораздо легче отмерять и наносить, да и пыли меньше. Гранулы разрушаются при намокании, а микронизированные частицы извести быстро перемещаются в корневую зону и быстро растворяются. Таким образом, они быстрее доставляют кальций, но также быстрее изменяют рН.
Но их гораздо легче отмерять и наносить, да и пыли меньше. Гранулы разрушаются при намокании, а микронизированные частицы извести быстро перемещаются в корневую зону и быстро растворяются. Таким образом, они быстрее доставляют кальций, но также быстрее изменяют рН.
Идея заключалась бы в подкормке гранул в соответствии с расчетной нормой еженедельного внесения кальция (из еженедельного внесения нитрата кальция на гектар). Для гидропоники вы должны чаще применять меньшую норму и внимательно следить за анализом среды и дренажа, пока не получите баланс.
Тщательно измерьте pH и нейтрализуйте щелочность с помощью дополнительной кислоты и/или кислых удобрений. Всегда учитывайте качество воды. Вода с высоким содержанием бикарбонатов должна быть нейтрализована. Гранулированные лаймы включают Calciprill и Magprill от Omya (Lachlan), G Lime от Amiran, Жидкая известь от Dudutech.
3.
Гипс Гипс содержит сульфат кальция. Это доступно локально и относительно недорого. Это должно быть проверено, поскольку качество варьируется от источника к источнику. Он мало растворим в воде со скоростью около 2,2 г/л. Он не влияет напрямую на pH, но может вызвать увеличение EC и сульфатов.
Это доступно локально и относительно недорого. Это должно быть проверено, поскольку качество варьируется от источника к источнику. Он мало растворим в воде со скоростью около 2,2 г/л. Он не влияет напрямую на pH, но может вызвать увеличение EC и сульфатов.
Обычный гипс отлично подходит для подкормки почвы, если в профиле почвы достаточно кальция и вы только дополняете вынос растений. Существуют также микронизированные и «растворимые» гипсовые продукты, которые переходят в раствор намного быстрее и больше подходят для гидропоники. Ezy Flow Gypsum от Dudutech представляет собой микронизированный жидкий гипс, который можно смачивать.
Применение известь и гипс Твердые известковые и гипсовые продукты не следует наносить капельным способом – они очень нерастворимы и засорят вашу систему орошения. Их следует рассыпать по поверхности между растениями и поливать из лейки из шланга. Капельная вода подхватит их и переместит по профилю. Жидкие гипсовые и известковые продукты следует наносить по отдельности в качестве пропитки в качестве последнего орошения дня.
Жидкие гипсовые и известковые продукты следует наносить по отдельности в качестве пропитки в качестве последнего орошения дня.
4.
Известково-аммиачная селитраИзвестково-аммиачная селитра (CAN) не полностью растворима и подходит только для подкормки. Он гигроскопичен и быстро растворяется в поглощаемой из воздуха воде, а затем может переходить в почву/носители. Удобрение марки CAN содержит примерно 8% кальция и 21-27% азота.
Он менее подкисляющий, чем сульфат аммония, и добавляет немного кальция в уравнение. Обычно он содержит около 13% нитратов и 13% ионов аммония. Его следует использовать экономно и только после испытаний в вашей системе. Ионы аммония конкурируют с поглощением ионов кальция и могут вызвать быстрый прилив мягкого роста.
5.
Другие продукты с кальцием Основной кальций Это микроинкапсулированный жидкий кальций, который можно замачивать и который остается доступным в почвенном растворе в течение длительного времени.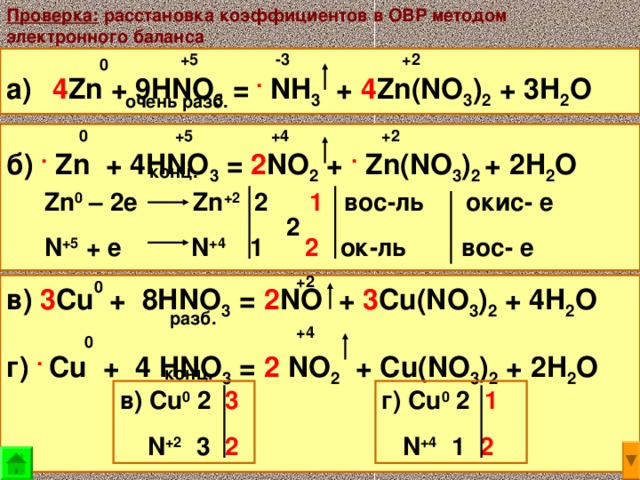 Он производится компанией Cosmocel, доступен в Ocean. (20% кальция) (без сульфатов, нитратов, карбонатов или хлоридов).
Он производится компанией Cosmocel, доступен в Ocean. (20% кальция) (без сульфатов, нитратов, карбонатов или хлоридов).
ICL предлагает ряд удобрений, подходящих для подкормки которые содержат различные уровни кальция и других питательных веществ. ( Агролист Энергетический кальций 11-5-19+9CaO+2,5MgO+TE, Питательный кальций 12-5-27+8CaO+TE, Полисульфат – 17%CaO).
ETG Киноплюс Нафака 18-38-0+5S+2,3Ca+0,2MgO, Киноплюс Хорти 15-9-21+4,75S+2,9Ca+1,5MgO.
Существует также ряд средств, которые могут принести кальций – Декомпакт 9% Са(Амиран), Trafos Green Plus 15,2% Ca, (Элгон), Codasol Plus 12,5% Ca (Twiga), Barrie r 14,8% Ca (Океан), Оса Калпауэр 5% Ca (Новикса).
Применяйте кальциевые примочки в качестве последнего цикла дня, чтобы получить
максимальное поглощение вашими растениями.
Существует также множество различных спреев для листвы, повышающих уровень кальция в растении. Обратите внимание, что кальций перемещается по ксилеме вверх по растению, очень мало перемещается по флоэме вниз к корням. Вам всегда нужно немного кальция в корневой зоне. Зеленые цветочные бутоны и плоды (например, томаты) – имеют меньше устьиц и, как правило, находятся на концах стеблей – сконцентрируйте здесь лиственные опрыскивания для лучшего усвоения.
Спреи для листвы содержат не только кальций, но и другие ингредиенты. Некоторые опрыскивания листвы предназначены для 1-2 опрыскиваний в садовых/кофейных плантациях за сезон, содержат большое количество бора или цинка и не подходят для еженедельного опрыскивания. ВСЕГДА читайте этикетку и сначала проводите тест на фитотоксичность. ( OmyaPro кальций представляет собой лиственный кальций, содержащий 35% чистого кальция). Опрыскивания листьев кальцием необходимо применять регулярно и концентрировать внимание на новом росте.
Всегда рассматривайте всю картину, когда речь идет о питательных веществах. применение – добавьте поливную воду / фертигированные питательные вещества и подкормка питательными веществами и поддержание баланса.
Практический пример – 20 га роз, выращенных в почвеПолный анализ почвы при посадке и добавление научно рассчитанной извести и гипса для балансировки уровня кальция в почве. 500 кг нитрата кальция ежедневно используется для фертигации на площади более 20 га.
Рецепт фертигации скорректирован для снижения содержания нитрата кальция на 50% с использованием нитрата калия и нитрата магния для повышения уровня нитрата и снижения уровня сульфата в программе фертигации. Остаток N добавляют в виде мочевины. Соотношение N:Nh4 в фертигации не превышало 20% N:Nh4. ЕС снижается. N в конечной капельной воде остается постоянным.
250 кг/день /20 га снижение содержания нитрата кальция = 3500 кг/20 га/ 14 дней. т.е. 175 кг CaNO3 на га за 2 недели (34 кг кальция).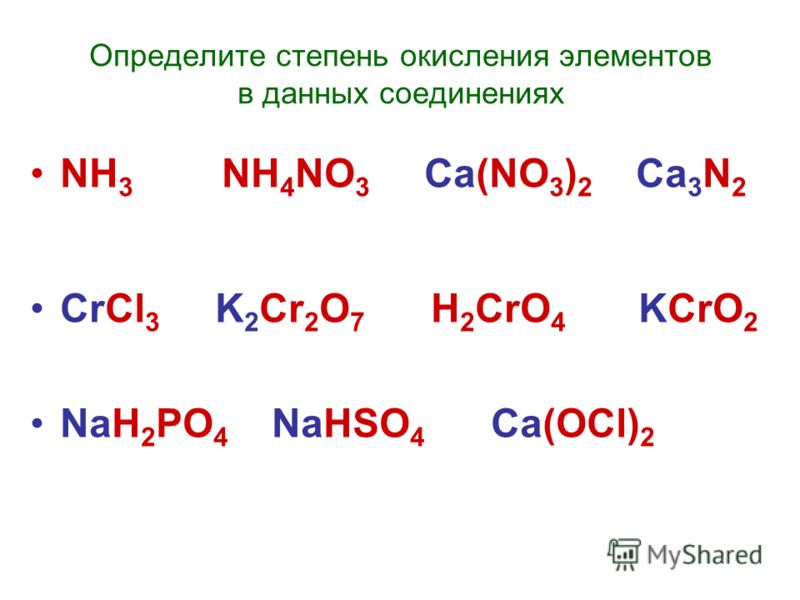 Это работает как подкормка из 150 кг / га гипса (225 Ca) каждые две недели, которую разбрызгивают и смывают в почву с помощью душа.
Это работает как подкормка из 150 кг / га гипса (225 Ca) каждые две недели, которую разбрызгивают и смывают в почву с помощью душа.
Мониторинг доступных питательных веществ с анализом почвы 1:2 каждый месяц и уровни питательных веществ в листьях с анализом листьев каждые две недели и регулировкой программу кормления до тех пор, пока ситуация не стабилизируется.
Для получения известковых/гипсовых/кальциевых удобрений и внекорневых подкормок посетите сайт http://shambaza.com/. Чтобы изменить рецепт, протестировать почву/гидропонику или листья, свяжитесь с нами по адресу [email protected]
Удачного фермерства!
О Рут
Рут Воган является техническим директором Crop Nutrition Laboratory Services Ltd. (CROPNUTS). Рут также является автором статей в ведущих садоводческих журналах Кении, таких как HortFresh Journal, HortiNews и Floriculture. Рут является большим сторонником здоровья почвы, органических веществ, биоугля и секвестрации углерода как способов смягчения последствий изменения климата и повышения продовольственной безопасности. Любит посещать фермеров и знакомиться с различными методами ведения сельского хозяйства
Любит посещать фермеров и знакомиться с различными методами ведения сельского хозяйства
Аммиачная селитра – обзор
ScienceDirectЗарегистрироватьсяВойти
ANFO обычно представляет собой желтоватые сферы, которые медленно растворяются в воде.
Из: Энциклопедия аналитической науки (второе издание), 2005 г.
PlusAdd to Mendeley P.S. Рао, в Энциклопедии токсикологии (третье издание), 2014 г.
Применение
Аммиачная селитра обычно используется в удобрениях; в пиротехнике, гербицидах и инсектицидах; и в производстве закиси азота. Он используется в качестве абсорбента оксидов азота, ингредиента замораживающих смесей, окислителя в ракетном топливе и питательного вещества для дрожжей и антибиотиков. Он также используется во взрывчатых веществах (особенно в виде масляной смеси) для взрывания горных пород и в горнодобывающей промышленности. Нитраты и нитриты используются для вяления мяса и для придания ему характерного вкуса и розового цвета, для предотвращения прогорклости и предотвращения роста Clostridium botulinum споры в мясе или на нем.
Просмотреть главуКнига покупок
Прочитать главу полностью
URL: https://www.sciencedirect.com/science/article/pii/B9780123864543002359
S.B. DuTeaux, в Энциклопедии токсикологии (третье издание), 2014 г.
Характеристики нитрата аммония
Нитрат аммония (NH 4 NO 3 , CAS RN: 6484-52-2) представляет собой кристаллический порошок, цвет которого варьируется от до почти от белого до коричневого. Он классифицируется как окислитель и ускоряет горение при попадании в огонь. Аммиачная селитра сама по себе не горит, но при контакте с другими горючими материалами повышает пожароопасность и поддерживает горение даже при отсутствии О 2 . Когда огонь или источник тепла изолируются в закрытом контейнере с нитратом аммония (например, в баке, транспортном контейнере), реакция может перейти в сильный взрыв в явлении, известном как переход горения в детонацию или ДДТ.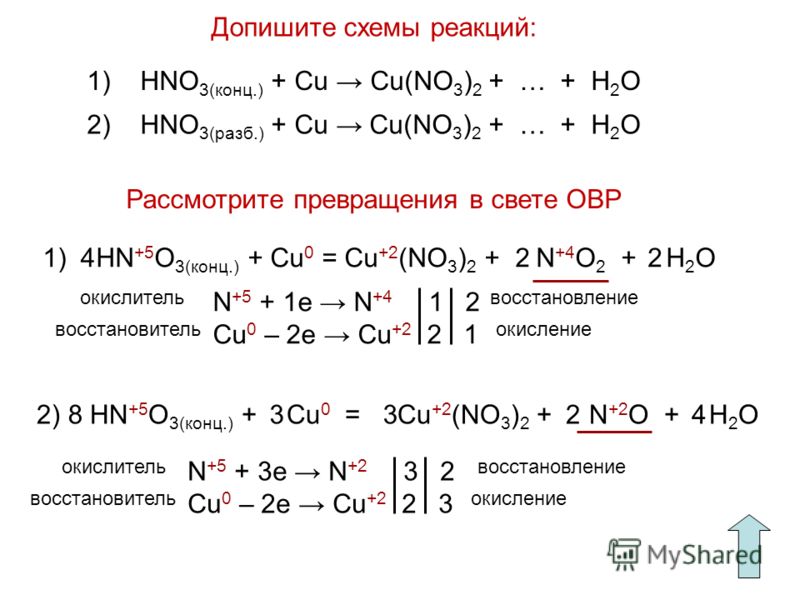
Термическое разложение нитрата аммония происходит при температуре >200 °C. Однако присутствие органических и металлических примесей снижает эту температуру. Как только нитрат аммония начинает разлагаться, может произойти неконтролируемая реакция по мере увеличения теплоты разложения. В результате самоподдерживающейся реакции нитрат аммония может выделять столько тепла, что разложение практически невозможно остановить.
Нитрат аммония реактивен и несовместим с некоторыми органическими и неорганическими соединениями. Смеси суперфосфатов и органических материалов могут воспламенить большое количество нитрата аммония, если внутренняя температура превышает 90 °C. Плавленый нитрат аммония, смешанный с порошкообразными металлами, такими как цинк, медь, свинец и алюминий, может привести к бурной, а иногда и взрывной реакции. Нитрат аммония чувствителен к ударам при смешивании с титаном, оловом или алюминием. Он также будет легче взрываться, если он загрязнен или смешан с горючими материалами, такими как мазут, последний известен как ANFO. Смеси, содержащие мочевину, также могут взрываться.
Смеси, содержащие мочевину, также могут взрываться.
Большие объемы аммиачной селитры следует хранить в одноэтажном, специально отведенном, хорошо вентилируемом негорючем помещении. Если поблизости есть населенные пункты, может быть безопаснее хранить аммиачную селитру снаружи, при условии, что она изолирована от источников тепла, горения или огневых работ (операций, связанных с открытым огнем или выделением тепла и/или искр, таких как сварка). Инциденты, при которых нитрат аммония случайно взорвался, обычно связаны либо с распространением огня на склад, либо со смешением горючего материала с нитратом аммония во время пожара.
Просмотреть главуКнига покупок
Прочитать главу полностью
URL: https://www.sciencedirect.com/science/article/pii/B9780123864543000865
DR.James G. Speicmry, in Environmental Engineers,
3.3.2 Нитрат аммония
Аммоний -нитрат — это нитратная соль аммония (NH 4 NO 3 , иногда написано как N 2 H 4 72 О. ). белое кристаллическое твердое вещество, хорошо растворимое в воде. Преимущественно используется в сельском хозяйстве как высокоазотное удобрение, а также используется в качестве компонента взрывчатых смесей в горнодобывающей промышленности, разработке карьеров и гражданском строительстве.
). белое кристаллическое твердое вещество, хорошо растворимое в воде. Преимущественно используется в сельском хозяйстве как высокоазотное удобрение, а также используется в качестве компонента взрывчатых смесей в горнодобывающей промышленности, разработке карьеров и гражданском строительстве.
Нитрат аммония (NH 4 NO 3 ) получают путем нейтрализации азотной кислоты (HNO 3 ) аммиаком (NH 3 ). Все заводы по производству аммиачной селитры производят водный раствор аммиачной селитры в результате реакции аммиака и азотной кислоты в нейтрализаторе в соответствии со следующим уравнением: концентрирование, (2) образование твердых частиц, (3) окончательная обработка, (4) просеивание и нанесение покрытия и (5) расфасовка продукта в мешки и/или отгрузка навалом. В некоторых случаях растворы могут быть смешаны для продажи в качестве жидких удобрений. Количество используемых рабочих шагов зависит от спецификации продукта. Например, заводы, производящие только растворы аммиачной селитры, используют только операции по формованию раствора, смешиванию растворов и отгрузке сыпучих материалов. Заводы, производящие твердый нитрат аммония, могут использовать все операции. Приблизительно 15–20% (об./об.) аммиачной селитры, приготовленной таким образом, используется для взрывчатых веществ, а остальное — для удобрений.
Заводы, производящие твердый нитрат аммония, могут использовать все операции. Приблизительно 15–20% (об./об.) аммиачной селитры, приготовленной таким образом, используется для взрывчатых веществ, а остальное — для удобрений.
Добавки, такие как нитрат магния или оксид магния, могут быть введены в расплав перед затвердеванием для повышения температуры кристаллического перехода, действия в качестве осушителя (удаления воды) или снижения температуры затвердевания. Продукты иногда покрывают глиной или диатомовой землей, чтобы предотвратить агломерацию во время хранения и транспортировки, хотя добавки могут устранить необходимость в покрытиях. Конечные твердые продукты просеиваются и калибруются, а негабаритные частицы растворяются и возвращаются в процесс.
Нитрат аммония продается в нескольких формах, в зависимости от его использования. Например, жидкий нитрат аммония может продаваться в качестве удобрения, как правило, в сочетании с мочевиной, или жидкий нитрат аммония может быть сконцентрирован с образованием расплава нитрата аммония для использования в процессах образования твердых веществ.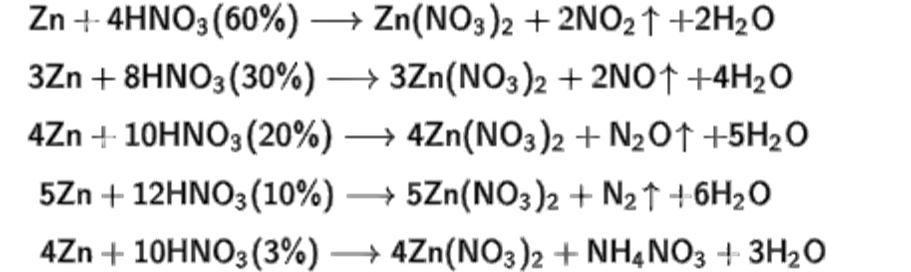 Твердая аммиачная селитра может производиться в виде гранул, зерен, гранул или кристаллов. Гранулы аммиачной селитры могут производиться как в форме с высокой, так и с низкой плотностью, в зависимости от концентрации расплава. Гранулы, гранулы и кристаллы высокой плотности используются в качестве удобрения, в то время как зерна аммиачной селитры используются исключительно во взрывчатых веществах, а гранулы низкой плотности, представляющие собой небольшие агрегаты или шарики материала, чаще всего сухие сферы, образованные из расплавленной жидкости. . Срок prill также используется в производстве для обозначения гранулированного продукта.
Твердая аммиачная селитра может производиться в виде гранул, зерен, гранул или кристаллов. Гранулы аммиачной селитры могут производиться как в форме с высокой, так и с низкой плотностью, в зависимости от концентрации расплава. Гранулы, гранулы и кристаллы высокой плотности используются в качестве удобрения, в то время как зерна аммиачной селитры используются исключительно во взрывчатых веществах, а гранулы низкой плотности, представляющие собой небольшие агрегаты или шарики материала, чаще всего сухие сферы, образованные из расплавленной жидкости. . Срок prill также используется в производстве для обозначения гранулированного продукта.
Производство нитрата аммония приводит к выбросам твердых частиц, аммиака и азотной кислоты. Выбросы аммиака и азотной кислоты происходят в основном при их растворении (нейтрализаторы и концентраторы), а также при их использовании в грануляторах. Твердые частицы являются самым крупным источником и выбрасываются в процессе образования твердых частиц. Градирни и грануляторы являются крупнейшими источниками твердых частиц. Микрогранулы могут образовывать и закупоривать отверстия, увеличивая загрузку мелкой пыли и выбросы.
Градирни и грануляторы являются крупнейшими источниками твердых частиц. Микрогранулы могут образовывать и закупоривать отверстия, увеличивая загрузку мелкой пыли и выбросы.
Выбросы происходят при просеивании в результате ударов твердых частиц нитрата аммония друг о друга и о сита. Большинство этих операций по просеиванию закрыты или имеют частичное покрытие для снижения выбросов. Покрытие продуктов также может создавать некоторые выбросы твердых частиц во время смешивания во вращающихся барабанах. Эта пыль обычно улавливается и перерабатывается для хранения покрытия. Другим источником пыли является расфасовка и погрузка навалом, в основном во время окончательного наполнения, когда из мешков вытесняется запыленный воздух.
Заводы по производству азотной кислоты и аммиачной селитры производят сточные воды, содержащие эти соединения и аммиак. Сточные воды, содержащие аммиак и азотную кислоту, необходимо нейтрализовать для получения аммиачной селитры.
Просмотр книги Глава Чика
Читать полная глава
URL: https://www.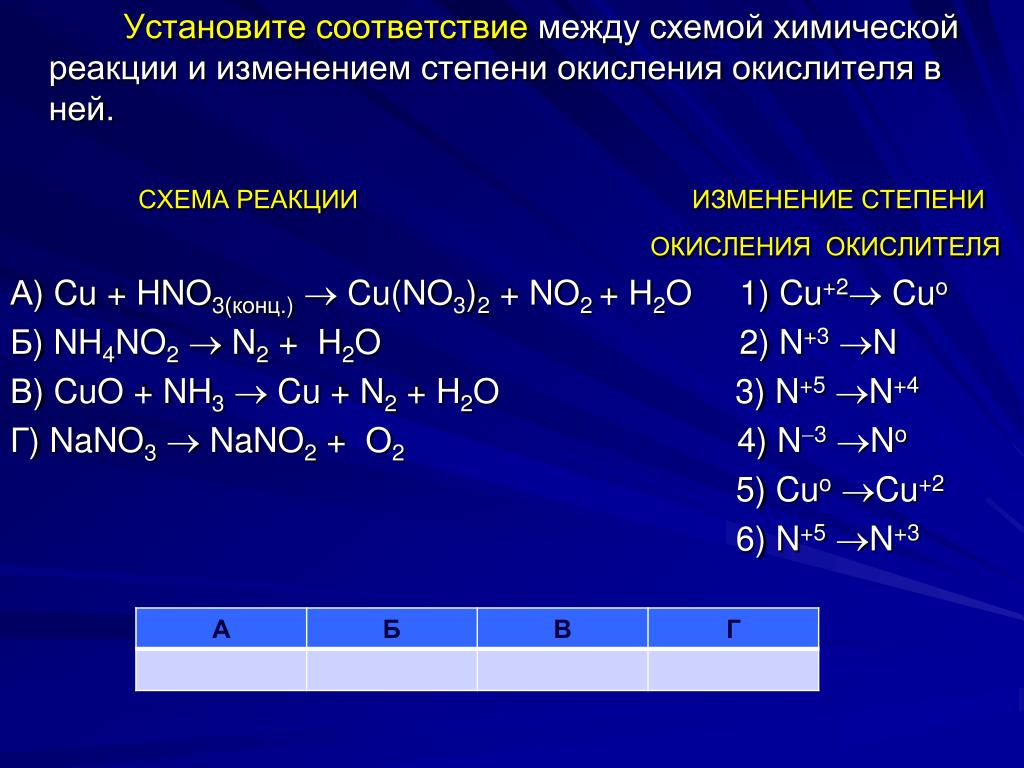 sciendirect.com/science/article/pii/b97801284980035
sciendirect.com/science/article/pii/b97801284980035
Paul N. Cheremisinoff P.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E.E. для обрабатывающей промышленности, 1995
Известково-аммиачная селитра (CAN)
Сначала готовят раствор нитрата аммония путем взаимодействия предварительно нагретого аммиака с азотной кислотой в нейтрализаторе. Теплоту реакции используют на выпаривание и получают 80–83% раствор аммиачной селитры. Этот концентрированный раствор дополнительно концентрируют до получения 92–94% раствора в вакуумном концентраторе. Затем концентрированный раствор аммиачной селитры впрыскивается в гранулятор вместе с регулируемым количеством известняковой муки и рециркулируемой мелочью с сит. Горячие гранулы сушат в роторной сушилке горячим воздухом, просеивают и охлаждают в холодильниках для получения продукта.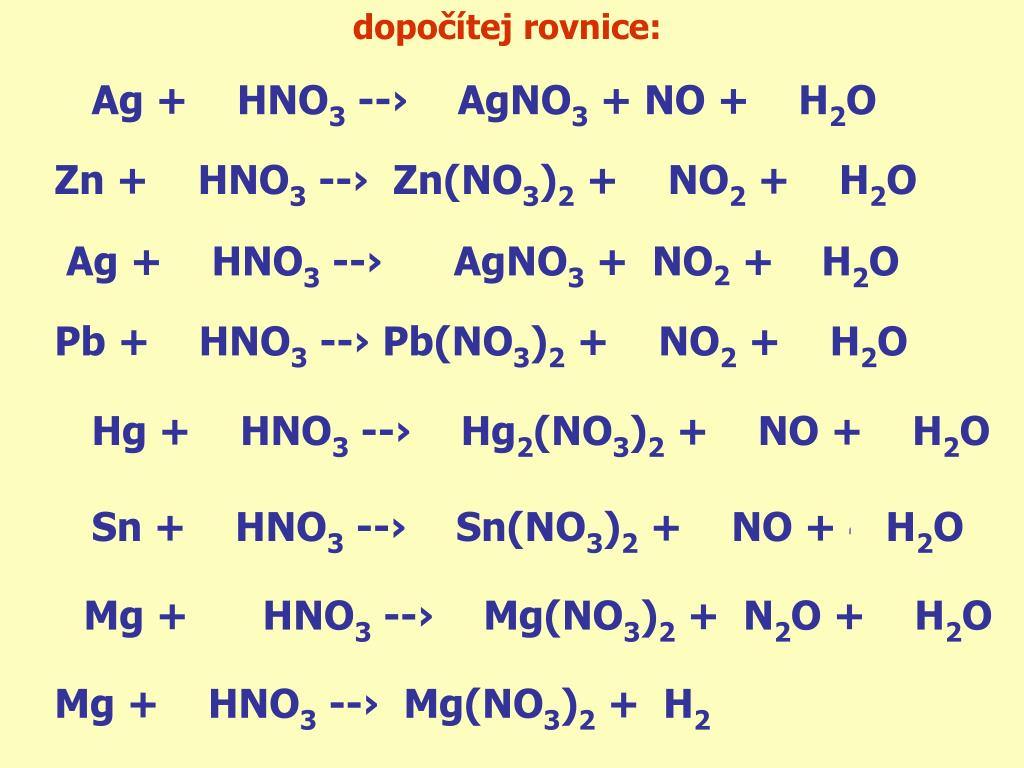 Процесс изготовления представлен на рис. 7–7.
Процесс изготовления представлен на рис. 7–7.
Рис 7–7. Процесс производства известково-аммиачной селитры (CAN).
Просмотр книги Глава Черта
Читать полная глава
URL: https://www.sciendirect.com/science/article/pii/b9780815513889500099
J.R.R.R.R.R.R.R.Sessiess J.R.R.R.R.R.R. 3.13.3.4 Химические свойства почвы Химия почвы представляет собой взаимодействие между почвенным раствором и твердой фазой. Грубо говоря, поверхности почвы можно разделить на четыре группы: силикатная глина; водные оксиды железа, алюминия и магния; карбонаты; и органическое вещество. Большинство реакций протекает на поверхностях, прилегающих к порам почвы. Перерабатываемость данной почвой зависит от доступности площади поверхности частиц почвы, химических свойств поверхности, условий почвенной среды (температуры, влажности и кислородного режима) и природы составляющих отходов. Частицы глины являются реактивной частью почвы; песок и ил составляют скелет почвы. Песок и ил представляют собой все более мелкие частицы исходного исходного материала, тогда как глина состоит из вторичных минералов, образовавшихся под давлением, нагреванием или и тем, и другим (Harpstead et al., 1997). Площадь внешней поверхности 1 г коллоидной глины как минимум в 1000 раз больше, чем у 1 г крупнозернистого песка. Чем больше площадь поверхности, тем выше химическая активность мелкозернистых почв. Однако, как обсуждалось ранее в этой главе, ограничивающим фактором для мелкозернистых почв является контакт сточных вод с поверхностью. Глины состоят из пластинчатых кристаллических единиц, которые слоистые, образуя отдельные частицы. Такая структура обеспечивает обширную площадь поверхности – как внешнюю по отношению к частице, так и внутреннюю между пластинами. Хотя существует много различных составов глины, в этой главе мы будем использовать общую категорию кварцевых глин в качестве примера того, как эти поверхности взаимодействуют с почвенным раствором. Вторым источником электроотрицательности является изоморфное замещение Mg 2+ на Al 3+ или Al 3+ на Si 4+ . Ионы одинакового размера (атомные радиусы) могут заменить ион кремния в тетраэдрическом слое и ион алюминия в октаэдрическом слое (Essington, 2004). Эти заряды позволяют молекулам воды прочно поглощать глиняные поверхности (гидрофильные), обеспечивая наличие воды для создания почвенного раствора. Это взаимодействие между поверхностями анионных частиц и растворенными катионами важно для стабильности агрегатов (т.е. структуры). Две частицы глины, находящиеся в непосредственной близости, могут удерживаться вместе растворенными катионами, которые притягиваются к обеим поверхностям. Прочность связи, удерживающей частицы глины вместе, зависит от расстояния между частицами и валентности ионов. Двухвалентные катионы (например, Ca 2+ и Mg 2+ ), как правило, имеют небольшой ионный радиус и, таким образом, позволяют частицам располагаться близко друг к другу и образовывать прочную связь. Одновалентные ионы, такие как натрий и калий, имеют больший эффективный радиус и могут быть заменены меньшими двухвалентными катионами. Более крупные катионы увеличат расстояние между частицами глины, связь, удерживающая частицы вместе, уменьшится, и результатом может стать дисперсия частиц. Аммоний, нитраты и фосфор являются доступными для растений питательными веществами, которые содержатся в сточных водах и часто связаны с чрезмерным ростом водорослей в поверхностных водах. Эти питательные вещества могут быть удалены системой растение-почва, но для этого может потребоваться сбор растительных материалов. При определенных условиях фосфор может связываться с глиняными поверхностями. Ион фосфата, называемый неокклюдированным фосфором, связан с поверхностью SiO 2 или CaCO 9.0271 3 . Такой фосфор обычно более растворим и доступен для растений. Когда ионы ортофосфата содержатся в матрице аморфных гидратированных оксидов железа и алюминия и аморфных алюмосиликатов, это называется окклюдированным фосфором и не так легкодоступно для растений (Manahan, 1994). Аммоний (NH 4 + ) имеет положительный заряд и является обменным катионом. Если он не вытеснен другими катионами, его можно закрепить на глиняных поверхностях. Однако микробные процессы могут преобразовывать аммоний в нитраты (нитрификация). Нитрат имеет отрицательный заряд и останется в почвенном растворе. Поглощение растениями является надежным средством удаления нитратов в течение вегетационного периода. Если нитраты вызывают беспокойство, то использование сточных вод должно быть ограничено агрономическими потребностями растений в зоне поглощения почвы, а затем следует ежегодно удалять большую часть растительной биомассы, чтобы предотвратить минерализацию органического азота при разложении растений. Просмотреть главуКнига покупок Прочитать главу полностью URL: https://www.sciencedirect.com/science/article/pii/B978012382182 Martin B. Hocking, in Handbook of Chemical Technology and Pollution Control Edition), 2005 г. Производство нитрата аммония является крупнейшим единственным конечным применением азотной кислоты и занимает 10–12 место по объему всех неорганических химических веществ, произведенных как в Канаде, так и в Соединенных Штатах за последние 20 лет (таблица 11.10). Этот интерес был вызван спросом на нитрат аммония в качестве компонента удобрений и ингредиентов взрывчатых веществ. Таблица 11.10. Production of Ammonium Nitrate and Urea in Selected Countries a 
 Силикатные глины обычно представляют собой алюмосиликаты. Частицы глины обычно имеют отрицательный заряд из-за неудовлетворенных валентностей на кристаллических краях пластин кремнезема и глинозема. Слои тетраэдров кремнезема (атом кремнезема с четырехсторонней конфигурацией кислорода) и октаэдра алюминия (атом алюминия в шестисторонней кислородной или гидроксильной структуре) связаны вместе общими атомами кислорода. Треснувшие края кристаллов обнажают кислородные и гидроксильные группы, которые представляют собой суммарный отрицательный заряд. Химические реакции в почве в значительной степени обусловлены наличием на этих поверхностях оксидов и гидроксидов (Brady and Weil, 2007).
Силикатные глины обычно представляют собой алюмосиликаты. Частицы глины обычно имеют отрицательный заряд из-за неудовлетворенных валентностей на кристаллических краях пластин кремнезема и глинозема. Слои тетраэдров кремнезема (атом кремнезема с четырехсторонней конфигурацией кислорода) и октаэдра алюминия (атом алюминия в шестисторонней кислородной или гидроксильной структуре) связаны вместе общими атомами кислорода. Треснувшие края кристаллов обнажают кислородные и гидроксильные группы, которые представляют собой суммарный отрицательный заряд. Химические реакции в почве в значительной степени обусловлены наличием на этих поверхностях оксидов и гидроксидов (Brady and Weil, 2007). Когда Al 3+ заменяет Si 4+ в тетраэдрическом слое, трехвалентный ион приводит к суммарному отрицательному заряду. Обычными катионами, адсорбируемыми глиняными поверхностями, являются H + , Al 3+ , Ca 2+ , Mg 2+ , K + и Na + . Это притяжение катионов вокруг частиц глины приводит к образованию двойного ионного слоя. Частица глины по существу становится анионом и представляет собой внутренний слой. Растворенные катионы образуют внешний слой вокруг поверхности глины (Hiemenz, 1986). Поскольку эти катионы не обязательно должны соответствовать определенным местам в кристаллической решетке глины, они могут быть относительно большими ионами, такими как K + , Na + или NH 4+ . Их называют обменными катионами.
Когда Al 3+ заменяет Si 4+ в тетраэдрическом слое, трехвалентный ион приводит к суммарному отрицательному заряду. Обычными катионами, адсорбируемыми глиняными поверхностями, являются H + , Al 3+ , Ca 2+ , Mg 2+ , K + и Na + . Это притяжение катионов вокруг частиц глины приводит к образованию двойного ионного слоя. Частица глины по существу становится анионом и представляет собой внутренний слой. Растворенные катионы образуют внешний слой вокруг поверхности глины (Hiemenz, 1986). Поскольку эти катионы не обязательно должны соответствовать определенным местам в кристаллической решетке глины, они могут быть относительно большими ионами, такими как K + , Na + или NH 4+ . Их называют обменными катионами. Этот раствор содержит рой ионов, часть которых является катионами, пытающимися уравновесить поверхностные заряды. Этот слой воды не является доступной для растений водой; корни растений не могут извлечь эту воду из частиц глины.
Этот раствор содержит рой ионов, часть которых является катионами, пытающимися уравновесить поверхностные заряды. Этот слой воды не является доступной для растений водой; корни растений не могут извлечь эту воду из частиц глины. Это важное соображение, поскольку сточные воды могут содержать значительное количество одновалентных катионов, таких как натрий из солей и смягчителей воды. Эта потеря агрегации может уменьшить пористость, что приводит к меньшей аэрации и движению воды.
Это важное соображение, поскольку сточные воды могут содержать значительное количество одновалентных катионов, таких как натрий из солей и смягчителей воды. Эта потеря агрегации может уменьшить пористость, что приводит к меньшей аэрации и движению воды. 3.13.3.4.1 Питательные вещества сточных вод
 Второй способ иммобилизации фосфора – осаждение. Осадки являются преобладающим методом удаления фосфора в почвенных системах ( см. Главу 3.11 для получения подробной информации об удалении фосфора осадками). Обычные осадители фосфатов, встречающиеся в почвах, включают Fe, Ca, Mg и Al.
Второй способ иммобилизации фосфора – осаждение. Осадки являются преобладающим методом удаления фосфора в почвенных системах ( см. Главу 3.11 для получения подробной информации об удалении фосфора осадками). Обычные осадители фосфатов, встречающиеся в почвах, включают Fe, Ca, Mg и Al. . Нитраты могут быть ограничивающим условием для определения площади, необходимой для поглощения почвой. При необходимости можно сажать и собирать урожай с высоким поглощением нитратов для поддержания соответствующего баланса питательных веществ.
. Нитраты могут быть ограничивающим условием для определения площади, необходимой для поглощения почвой. При необходимости можно сажать и собирать урожай с высоким поглощением нитратов для поддержания соответствующего баланса питательных веществ. 11.3.1 Справочная информация
 Простота производства и низкая стоимость, около 170 долларов за тонну в США в 1919 г.95, добавить к своей привлекательности продукта. Ценность удобрения определяется как высоким общим содержанием азота (-33%), разделенным между быстродействующим нитратным азотом и более медленно действующим аммонийным азотом, так и простотой сбыта твердого продукта и обращения с ним.
Простота производства и низкая стоимость, около 170 долларов за тонну в США в 1919 г.95, добавить к своей привлекательности продукта. Ценность удобрения определяется как высоким общим содержанием азота (-33%), разделенным между быстродействующим нитратным азотом и более медленно действующим аммонийным азотом, так и простотой сбыта твердого продукта и обращения с ним. Thousands of tonnes 1970 1975 1980 1990 2000 Canada: NH 4 NO 3 777 875 873 1,031 1,110 Urea 367 329 1,274 2,490 3,887 Japan: NH 4 NO 3 37 115 123 8 18 Urea 2,463 3,162 1,770 776 641 U.  S.A.: NH 4 NO 3
S.A.: NH 4 NO 3 5,938 6,430 7,792 6,425 8,244 MUREA 2 829 3,446 7,103 7,368 15,322
- A
- A
- A
- . 46–002 [55а]; ФАО ООН [56], Japan Economic Yearbooks [57], данные предоставлены Verband der Chemischen Industrie e.V. (ВКИ) и Новости химии и техники [3].
- Неорганические соли кальция
- Нитрат щелочноземельных металлов
- Неорганическая соль кальция
- Неорганический оксид
- Inorganic salt
- calcium salt (CHEBI:64205 )
- inorganic nitrate salt (CHEBI:64205 )
Применение взрывчатых веществ варьировалось от смесей с нитроглицерином, чтобы сделать их более безопасными для использования в шахтах, до смесей с бездымными порохами и нитросоединениями, такими как тринитротолуол, до более поздних разработок смесей гранул аммиачной селитры низкой плотности с мазутом. (так называемые взрывчатые вещества ANFO) или в водной суспензии с ускорителями из металлического порошка для производства недорогого «взрывчатого» мощного взрывчатого вещества [58]. Все применения взрывчатых веществ основаны на большом объеме газа, выделяющегося при энергичной детонации нитрата аммония (уравнение 11.52).
Все применения взрывчатых веществ основаны на большом объеме газа, выделяющегося при энергичной детонации нитрата аммония (уравнение 11.52).
11,522Nh5NO3(т)→2N2(г)+4h3O(г)+O2(г)
Кислород потребляется мазутом или легко окисляемым металлом, таким как алюминий или магний, присутствующим для дополнительного выделения тепла и энергии в процесс детонации. Были предложены способы улучшения нормального обращения с нитратом аммония для снижения риска взрыва при обычных условиях транспортировки и хранения [59].
Небольшое, но важное применение нитрата аммония — получение закиси азота для ингаляций для использования в качестве анестетика. Это достигается нагреванием чистого нитрата аммония примерно до 200–250 °C (уравнение 11.53), что дает закись азота, практически не содержащую оксида азота или
11,53Nh5NO3→N2O+2h3O
диоксид азота. Этот продукт также известен как «веселящий газ» и используется в стоматологии для краткосрочной анестезии при удалении моляров и т. д. /science/article/pii/B9780120887965500144
д. /science/article/pii/B9780120887965500144
Дэвид Д. Мирольд, Принципы и приложения почвенной микробиологии (третье издание), 2021 г.
Судьба нитратов в почвенной среде
Как и аммоний, нитрат имеет множество конкурирующих судеб в почвенной экосистеме (рис. 15.2). Поскольку это анион, нитрат легко выщелачивается. Удаление нитратов из почвы путем выщелачивания имеет несколько последствий. Очевидно, что выщелачивание нитратов представляет собой потерю доступного азота из системы растение-почва. Когда нитрат выщелачивается, он должен сопровождаться эквивалентным количеством катионов для поддержания баланса заряда. Таким образом, почвы также обедняются катионами при выщелачивании нитратов. Выщелачивание основных катионов, таких как K + и Ca 2+ , снижает насыщенность почвы основаниями и повышает обменную кислотность. Нитраты, которые вымываются, в конечном итоге попадают в грунтовые и поверхностные воды, где они могут оказывать потенциально неблагоприятное воздействие на окружающую среду. Высокие концентрации нитратов в поверхностных водах могут привести к эвтрофикации (внезапному обогащению природных вод избытком питательных веществ, что может привести к развитию цветения водорослей и другой растительности). Действующие федеральные нормы требуют, чтобы питьевая вода содержала < 10 мг NO 9.0271 3 − -N L −1 (читается как «мг нитратного азота на литр»). Высокие концентрации нитратов также могут быть связаны с метгемоглобинемией (синдром синего ребенка), которая в настоящее время встречается довольно редко. Еще одной опасностью для окружающей среды может быть образование канцерогенных нитрозаминов в результате реакций между нитритом и вторичными аминами.
Высокие концентрации нитратов в поверхностных водах могут привести к эвтрофикации (внезапному обогащению природных вод избытком питательных веществ, что может привести к развитию цветения водорослей и другой растительности). Действующие федеральные нормы требуют, чтобы питьевая вода содержала < 10 мг NO 9.0271 3 − -N L −1 (читается как «мг нитратного азота на литр»). Высокие концентрации нитратов также могут быть связаны с метгемоглобинемией (синдром синего ребенка), которая в настоящее время встречается довольно редко. Еще одной опасностью для окружающей среды может быть образование канцерогенных нитрозаминов в результате реакций между нитритом и вторичными аминами.
Биологическая судьба нитратов включает их ассимиляцию растениями и микроорганизмами и их использование в анаэробных восстановительных процессах, обсуждаемых далее.
Просмотреть главуКнига покупок
Прочитать главу полностью
URL: https://www. sciencedirect.com/science/article/pii/B97801282020250
sciencedirect.com/science/article/pii/B97801282020250
D.S. Powlson, T.M. Addiscott, Encyclopedia of Soils in the Environment, 2005
Формы азотных удобрений
В Европе широко используется аммиачная селитра или известково-аммиачная селитра (CAN). Эти формы поставляют 50% своего азота в виде чистого нитрата и, таким образом, мгновенно увеличивают количество нитрата в верхнем слое почвы с очень низкого значения, обычно около 10 кг нитрата-N га -1 , до 50 кг нитрат-N га -1 или более в зависимости от применяемого количества. Типичное внесение N под пахотные культуры весной, в начале периода быстрого роста сельскохозяйственных культур, может составлять 100–200 кг N га −1 , но обычно делится на две или более порций. N аммония обычно нитрифицируется до нитрата в течение 1–4 недель. Во всем мире мочевина является наиболее часто используемой формой азотного удобрения. Прежде чем азот в мочевине станет доступным для растений, он сначала должен быть преобразован в аммоний (процесс гидролиза мочевины), но это происходит в течение нескольких дней. Затем аммиак подвергается нитрификации в течение 2–3 недель. Таким образом, на практике разница между мочевиной и аммиачной селитрой или КАН с точки зрения воздействия на нитраты почвы довольно мала. Эти превращения можно изучить, пометив N в мочевине или аммонийной или нитратной частях нитрата аммония с помощью 15 N, тяжелый изотоп азота. В некоторых экспериментах на севере Франции, в которых 15 N-меченых удобрений вносились на поля озимой пшеницы в апреле, неповрежденные молекулы мочевины практически не обнаруживались в почве в течение недели после внесения. Весь азот, полученный из мочевины, либо превращался в аммоний, либо в нитраты, поглощался культурой или иммобилизовался почвенными микроорганизмами в течение 2 недель после внесения. При применении нитрата аммония большая часть аммония превращалась в нитрат или поглощалась растениями или микроорганизмами в течение 2 недель. Для внесения в марте, когда температура почвы была ниже, преобразования происходили медленнее, но тенденции те же.
Затем аммиак подвергается нитрификации в течение 2–3 недель. Таким образом, на практике разница между мочевиной и аммиачной селитрой или КАН с точки зрения воздействия на нитраты почвы довольно мала. Эти превращения можно изучить, пометив N в мочевине или аммонийной или нитратной частях нитрата аммония с помощью 15 N, тяжелый изотоп азота. В некоторых экспериментах на севере Франции, в которых 15 N-меченых удобрений вносились на поля озимой пшеницы в апреле, неповрежденные молекулы мочевины практически не обнаруживались в почве в течение недели после внесения. Весь азот, полученный из мочевины, либо превращался в аммоний, либо в нитраты, поглощался культурой или иммобилизовался почвенными микроорганизмами в течение 2 недель после внесения. При применении нитрата аммония большая часть аммония превращалась в нитрат или поглощалась растениями или микроорганизмами в течение 2 недель. Для внесения в марте, когда температура почвы была ниже, преобразования происходили медленнее, но тенденции те же.
Небольшое, но потенциально значимое различие между мочевиной и нитратсодержащими удобрениями заключается в том, что пиковая концентрация нитратов в почве, вероятно, будет меньше при использовании мочевины. Таким образом, мочевина может снизить риск потери нитратов в результате выщелачивания или денитрификации вскоре после применения. Однако с мочевиной некоторая часть азота может быть потеряна в виде газообразного аммиака при некоторых обстоятельствах, и немного больше может быть поглощено микроорганизмами, поскольку они склонны поглощать аммоний, а не нитраты, если они доступны. Общие агротехнические эксперименты показывают лишь небольшие различия в использовании растениями азота из мочевины по сравнению с нитратсодержащими удобрениями.
В продаже имеется ряд добавок, которые замедляют либо гидролиз мочевины, либо нитрификацию, тем самым сохраняя большую долю азота из удобрений в аммиачной форме и уменьшая количество нитратов. В принципе, эти добавки (ингибиторы уреазы или ингибиторы нитрификации) должны уменьшить потери, связанные с нитратами, за счет уменьшения их количества в почве. Хотя это может быть полезно для нитратов, поступающих из удобрений, влияние ингибиторов на общую потерю нитратов, вероятно, будет небольшим, потому что нитраты, образующиеся в результате минерализации органического вещества почвы, обычно являются основным источником. Кроме того, до сих пор их высокая стоимость не позволяла использовать их вместо обычных сельскохозяйственных культур; в некоторой степени они используются для медленного доступа азота к удобрениям для некоторых ценных садовых культур.
Хотя это может быть полезно для нитратов, поступающих из удобрений, влияние ингибиторов на общую потерю нитратов, вероятно, будет небольшим, потому что нитраты, образующиеся в результате минерализации органического вещества почвы, обычно являются основным источником. Кроме того, до сих пор их высокая стоимость не позволяла использовать их вместо обычных сельскохозяйственных культур; в некоторой степени они используются для медленного доступа азота к удобрениям для некоторых ценных садовых культур.
Просмотр книги Глава покупки
Читать полная глава
URL: https://www.sciendirect.com/science/article/pii/b012348530400905x
G.S. 3.42.3.8.2 Дериватизация для изменения летучести Дериватизация аммония из нитрата аммония с помощью хлорформиата приводит к образованию молекулы, которая больше взаимодействует с колонкой и, следовательно, имеет приемлемое время удерживания 6 мин в случае модификации с помощью бутилхлорформиата. Кроме того, добавленная масса производного перемещает молекулярный ион с m/z = 17/18 для Nh4+ и Nh5+ на m/z = 74, 62 и 44 для исходного иона и фрагментов бутилхлорформиата — производный аммиак. 18 Это отдаляет молекулярный ион от интерференции воды, которая может давать пики из-за OH + при m/z = 17 и H 2 O + при m/z = 18. Посмотреть главуКнига покупок Читать главу полностью URL: https://www.sciencedirect.com/science/article/pii/B9780123813732001204 J.H. Falls, S.A. Siegel, в Encyclopedia of Analytical Science (Second Edition), 2005 г. Метод 1 определяет процентное содержание нитрата аммония путем взаимодействия формальдегида с аммонием нитраты, образующие азотную кислоту. Азотную кислоту титруют стандартизированным раствором гидроксида натрия до конечной точки по фенолфталеину или до конечной точки рН. Просмотр книги Глава покупки Читать полная глава URL: https://www.sciendirect.com/science/article/pii/b0123693977001503 18
18 Титрование формальдегидом – метод 1 (используется только для нитрата аммония или сульфатного азота)
 Определенное процентное содержание нитрата аммония можно преобразовать в %N, умножив процентное содержание нитрата аммония на 0,349.978. Процентное содержание сульфата аммония можно определить по реакции формальдегида, дающей серную кислоту. Серную кислоту можно оттитровать гидроксидом натрия, чтобы определить количество присутствующего сульфата аммония. %N из сульфата аммония определяется путем умножения процентного содержания сульфата аммония на 0,212. Этим методом можно определить нитрат аммония в КАС, так как мочевина не будет реагировать. Примечание : Метод 1 в настоящее время менее важен и используется реже, поскольку формальдегид может представлять угрозу безопасности при неправильном использовании.
Определенное процентное содержание нитрата аммония можно преобразовать в %N, умножив процентное содержание нитрата аммония на 0,349.978. Процентное содержание сульфата аммония можно определить по реакции формальдегида, дающей серную кислоту. Серную кислоту можно оттитровать гидроксидом натрия, чтобы определить количество присутствующего сульфата аммония. %N из сульфата аммония определяется путем умножения процентного содержания сульфата аммония на 0,212. Этим методом можно определить нитрат аммония в КАС, так как мочевина не будет реагировать. Примечание : Метод 1 в настоящее время менее важен и используется реже, поскольку формальдегид может представлять угрозу безопасности при неправильном использовании. с показателем COMPUND CALLAT
Version 1.0 Creation date 2010-04-08 22:07:25 UTC Update date 2019-11-26 03:01:26 UTC Primary ID FDB007030 Secondary Accession Numbers Not Available Chemical Information FooDB Name Calcium nitrate Description Calcium nitrate, also known as calcium saltpeter or безводная кальций-азотная кислота относится к классу соединений, известных как нитраты щелочноземельных металлов.  Нитраты щелочноземельных металлов представляют собой неорганические соединения, в которых самым большим оксоанионом является нитрат, а самым тяжелым атомом, не входящим в оксоанион, является щелочноземельный металл. Нитрат кальция можно найти в черной бузине, что делает нитрат кальция потенциальным биомаркером для потребления этого пищевого продукта. Нитрат кальция является потенциально токсичным соединением. Нитрат кальция, также называемый Norgessalpeter (норвежская селитра), представляет собой неорганическое соединение с формулой Ca(NO3)2. Эта бесцветная соль поглощает влагу из воздуха и обычно встречается в виде тетрагидрата. Он в основном используется в качестве компонента удобрений, но имеет и другие применения. Нитрокальцит — это название минерала, представляющего собой гидратированный нитрат кальция, который образуется в виде высолов там, где навоз контактирует с бетоном или известняком в сухой среде, например, в конюшнях или пещерах. Известно множество родственных солей, включая декагидрат нитрата кальция и аммония и декагидрат нитрата кальция и калия.
Нитраты щелочноземельных металлов представляют собой неорганические соединения, в которых самым большим оксоанионом является нитрат, а самым тяжелым атомом, не входящим в оксоанион, является щелочноземельный металл. Нитрат кальция можно найти в черной бузине, что делает нитрат кальция потенциальным биомаркером для потребления этого пищевого продукта. Нитрат кальция является потенциально токсичным соединением. Нитрат кальция, также называемый Norgessalpeter (норвежская селитра), представляет собой неорганическое соединение с формулой Ca(NO3)2. Эта бесцветная соль поглощает влагу из воздуха и обычно встречается в виде тетрагидрата. Он в основном используется в качестве компонента удобрений, но имеет и другие применения. Нитрокальцит — это название минерала, представляющего собой гидратированный нитрат кальция, который образуется в виде высолов там, где навоз контактирует с бетоном или известняком в сухой среде, например, в конюшнях или пещерах. Известно множество родственных солей, включая декагидрат нитрата кальция и аммония и декагидрат нитрата кальция и калия. Метгемоглобинемию можно лечить дополнительным кислородом и 1% раствором метиленового синего, вводимым внутривенно медленно в течение пяти минут с последующим внутривенным промыванием физиологическим раствором. Метиленовый синий восстанавливает железо в гемоглобине до его нормального (восстановленного) кислородсодержащего состояния (L1613) (T3DB).
Метгемоглобинемию можно лечить дополнительным кислородом и 1% раствором метиленового синего, вводимым внутривенно медленно в течение пяти минут с последующим внутривенным промыванием физиологическим раствором. Метиленовый синий восстанавливает железо в гемоглобине до его нормального (восстановленного) кислородсодержащего состояния (L1613) (T3DB). CAS Number 10124-37-5 Structure Synonyms Synonym Source Anhydrous calcium nitrate ChEBI Селитра кальциевая ЧЭБИ Кальция(II) нитрат (1:2) ЧЭБИ Известь азотнокислая Ч20 90 9 Lime saltpeter ChEBI Nitric acid, calcium salt ChEBI Norge saltpeter ChEBI Norway saltpeter ChEBI Norwegian saltpeter ChEBI Селитра ЧЭБИ Кальций азотнокислый безводный Генератор Кальций(II) азотнокислый (1:2) Generator Lime nitric acid Generator Nitrate, calcium salt Generator Calcium nitric acid Generator Calcium nitrate tetrahydrate MeSH Calcium dinitrate биопаук нитрат кальция биопаук нитрат кальция [UN1454] [окислитель] biospider Calcium standard for aas biospider Nitric acid, calcium salt (2:1) biospider Nitrocalcite biospider Saltpeter [norway] biospider Synfat 1006 биопаук Прогнозируемые свойства 92794 Property Value Source logP 0.  028
028 ChemAxon pKa (Strongest Acidic) -1.4 ChemAxon pKa (Strongest Basic) — 6.1 Chemaxon Физиологический заряд -1 Chemaxon Commestor Count 3 .0799 Hydrogen Donor Count 0 ChemAxon Polar Surface Area 68.88 Ų ChemAxon Rotatable Bond Count 0 ChemAxon Refractivity 9.85 m³·mol ⁻ Chemaxon Поляризуемость 3,24 ų Хеменс Количество 0 . ХИМИ 1515 0 151515 0 1515. 0 1515 0 .0820 Bioavailability Yes ChemAxon Rule of Five Yes ChemAxon Ghose Filter No ChemAxon Veber’s Rule No ChemAxon Правило, подобное MDDR Нет ChemAxon Химическая формула CaN2O620 Наименование ИЮПАК Динитрат кальция Идентификатор ИнЧИ ИнЧИ=1S/Ca.  2NO3/c;2*2-1(3)4/q+2;2*-1
2NO3/c;2*2-1(3)4/q+2;2*-1 Ключ ИнЧИ ZCCIPPOKBCJFDN-UHFFFAOYSA-N Изомерные SMILES [Ca++].[O-][N+]([O-])=O.[O-][N+]([O-])=O Средняя молекулярная масса 164,088 Моноизотопная молекулярная масса 163,938226897 Классификация Описание Относится к классу неорганических соединений, известных как нитраты щелочноземельных металлов. Это неорганические соединения, в которых самым большим оксоанионом является нитрат, а самым тяжелым атомом, не входящим в оксоанион, является щелочноземельный металл. Королевство Неорганические соединения Суперкласс Смешанные соединения металлов и неметаллов Класс щелочные металлические металлические металлические соединения Sub Class Нитраты щелочных земных металлов Прямой родитель Alkaline Earth Nitrate Alkaline Earth Nitrate 998 Alkaline Earth Nitrate 998 Alkaline Earth Nitrates 998 Alkaline Earth Nitrates 9998 Alkaline Earth Nitrate 9998. 
Заместители Molecular Framework Not Available External Descriptors Ontology Онтология Термин без онтологии Физико-химические свойства — экспериментальный Physico-Chemical Properties — Experimental Property Value Reference Physical state Not Available Physical Description Not Available Mass Composition Недоступно Температура плавления Недоступно Температура кипения Not Available Experimental Water Solubility Not Available Experimental logP Not Available Experimental pKa Not Available Isoelectric point Not Available Зарядка Недоступно Оптическое вращение Недоступно Spectroscopic UV Data Not Available Density Not Available Refractive Index Not Available Spectra Spectra Not Доступно Внешние ссылки ChemSpider ID Недоступно ChemBL ID Not Available KEGG Compound ID Not Available Pubchem Compound ID 24963 Pubchem Substance ID Not Available ChEBI ID Not Available Phenol-Explorer ID Недоступно DrugBank ID Недоступно HMDB ID Недоступно CRC / DFC (Dictionary of Food Compounds) ID Not Available EAFUS ID Not Available Dr.  Duke ID
Duke ID CALCIUM-NITRATE BIGG ID Not Доступно KNAPSACK ID Недоступно HET ID Недоступно Food Biomarker Ontology 0 Недоступно
9 VMH ID Not Available Flavornet ID Not Available GoodScent ID Not Available SuperScent ID Not Available Wikipedia ID Not Available Phenol-Explorer Metabolite ID Недоступно Дубликат IDS Недоступно Старый DFC IDS Not Available Associated Foods Food Content Range Average Reference Food Reference Биологические эффекты и взаимодействия Воздействие на здоровье / биоактивность Недоступно Ферменты Not Available Pathways Not Available Metabolism Not Available Biosynthesis Not Available Organoleptic Properties Flavours Not Available Файлы MSDS Недоступно Ссылки Справочник по синтезу Недоступно Общий справочник Недоступно Справочник по содержанию — Duke, James. 

 Педагогический (научно-педагогический) состав
Педагогический (научно-педагогический) состав