Описание элемента по положению в Периодической системе 8 класс онлайн-подготовка на Ростелеком Лицей
Строение атома элемента
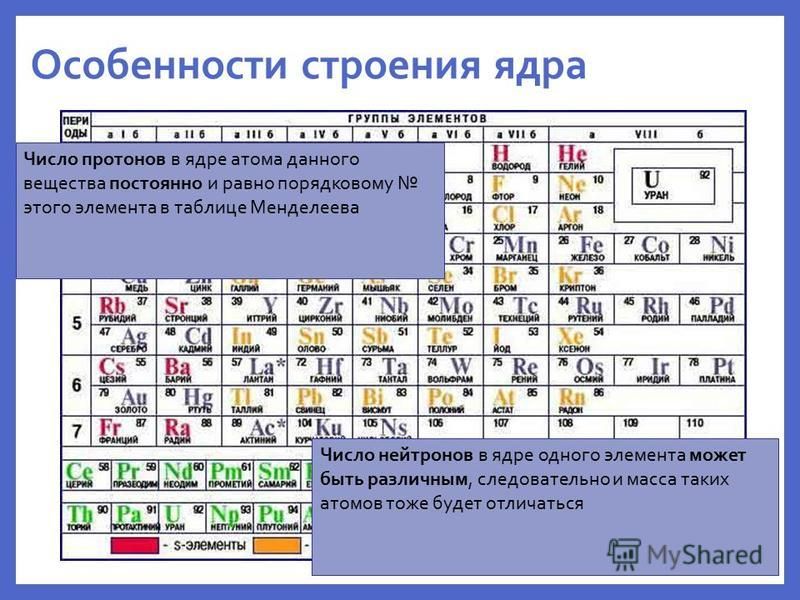
Для того чтобы определить состав ядра и распределение электронов по слоям в атоме химического элемента, нужно знать порядковый номер элемента, номер периода, номер группы и подгруппу в Периодической системе.
Рассмотрим конкретный пример. Определим строение атома калия. Порядковый номер калия равен 19. Порядковый номер определяет число протонов в ядре и общее число электронов в атоме. Число нейтронов в конкретном атоме можно определить по разнице между массовым числом и числом протонов. Для изотопа калия с массовым числом 39 число протонов равно 19, число нейтронов равно 39-19=20, число электронов – 19.
По номеру периода можно определить число электронных слоев в атоме. Калий – элемент 4 периода, значит, все его 19 электронов расположены на 4-х электронных слоях. При этом нужно помнить, что на 1-м слое может максимально находиться не более 2-х электронов, на втором – не более 8. Число электронов на последнем слое равно номеру группы (для элементов главных подгрупп). У калия всего 1 внешний электрон, он находится на 4-м слое. Оставшиеся электроны – на третьем слое. Таким образом, в атоме калия электроны распределяются по слоям в следующем количестве: 2, 8, 8, 1 (рис. 1).
Число электронов на последнем слое равно номеру группы (для элементов главных подгрупп). У калия всего 1 внешний электрон, он находится на 4-м слое. Оставшиеся электроны – на третьем слое. Таким образом, в атоме калия электроны распределяются по слоям в следующем количестве: 2, 8, 8, 1 (рис. 1).
Рис. 1. Схема строения атома калия
Номер группы определяет не только число внешних электронов, но высшую валентность элемента. Численное значение низшей валентности для элементов V-VII групп равно 8 — номер группы. Итак, высшая и единственная валентность калия равна I.
Свойства простого вещества, образованного элементом
По положению элемента в периодической системе можно определить его принадлежность к металлам или неметаллам, а также свойства образованных им высших оксида и гидроксида. Элементы главных подгрупп, лежащие выше диагонали Be-At, относятся к неметаллам. Остальные элементы – металлы. При этом металлические свойства слева направо по периоду ослабевают, а сверху вниз по группе усиливаются.
Таким образом, калий – металл. Его металлические свойства выражены сильнее, чем у натрия и кальция.
Формула и свойства высшего оксида и гидроксида элемента
Если элемент образует простое вещество-металл, то его высший оксид и гидроксид будут основными. Если неметалл – то кислотными. Если переходный металл – то амфотерными (рис. 2).
Рис. 2. Связь свойств элементов и образованных ими соединений
Так как калий – металл, его высший оксид и гидроксид будут проявлять основные свойства.
Составим формулы высшего оксида и гидроксида калия. Высшая валентность калия равна I, значит, формула высшего оксида – К2О, его характер – основный.
Основному оксиду соответствует основание – КОН.
Можно подтвердить основный характер оксида и гидроксида калия, записав уравнения реакций этих веществ с кислотой:
K2O + 2HCl = 2KCl + H2O
KOH + HCl = KCl + H2O
Элементы-неметаллы могут образовать летучие водородные соединения. Чтобы составить формулу летучего водородного соединения неметалла, нужно знать низшую валентность последнего. Например, летучее водородное соединение азота – NH3 (низшая валентность азота равна III). Металлы летучих водородных соединений не образуют.
Чтобы составить формулу летучего водородного соединения неметалла, нужно знать низшую валентность последнего. Например, летучее водородное соединение азота – NH3 (низшая валентность азота равна III). Металлы летучих водородных соединений не образуют.
Если сравнивать калий с соседними по подгруппе и периоду элементами, то можно сказать, что основные свойства его оксида и гидроксида будут ярче выражены, чем у оксидов и гидроксидов натрия и кальция. Рубидий – более активный металл, чем калий. Значит, основные свойства его оксида и гидроксида будут выражены сильнее, чем у оксида и гидроксида калия.
Характеристика серы
Охарактеризуем по плану химический элемент серу, учитывая ее положение в Периодической системе элементов Д. И. Менделеева:
1. Химический знак – S («Эс»)
2. Порядковый номер – 16, VI группа, А подгруппа, 3 период
3. Строение атома:
4. Свойства простого вещества: S – неметалл
5. Высшая и низшая валентность: VI и II
6. Высший оксид: SO3 (кислотный)
Высший оксид: SO3 (кислотный)
Высший гидроксид: H2SO4 (кислота)
7. Формула летучего водородного соединения: H2S
Список литературы
- Оржековский П. А. Химия: 8-й класс: учеб для общеобр. учрежд. / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013. (§§45)
- Рудзитис Г. Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§36)
- Хомченко И. Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с. 35–36)
- Энциклопедия для детей. Том 17. Химия / Глав. ред. В. А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Интернет-портал «InternetUrok.ru» (Источник)
- Дальневосточный Государственный Университет Путей Сообщения (Источник)
Домашнее задание
- с.
 255 №№ 1–3 из учебника П. А. Оржековского «Химия: 8-ый класс» / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013.
255 №№ 1–3 из учебника П. А. Оржековского «Химия: 8-ый класс» / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013. - Охарактеризуйте по вышеприведенному плану химический элемент № 20.
Физики усомнились в «магии» изотопов с 32 нейтронами — Наука
© EPA-EFE/LUKAS BARTH-TUTTAS
ТАСС, 29 января. Физики усомнились в существовании экзотических стабильных сверхтяжелых изотопов с «магическим» числом нейтронов – 32. К такому выводу их привело измерение размеров ядра атомов калия-52, внутри которых есть 33 нейтрона. Их исследование опубликовал научный журнал Nature Physics.
На эту тему
Ядра всех элементов тяжелее водорода состоят из двух типов частиц – положительно заряженных протонов и не имеющих электрического заряда нейтронов. От соотношения этих частиц зависит, насколько атом стабилен: если число протонов не равно количеству нейтронов, то атом становится нестабильным и пытается избавиться от «лишних» частиц. Ученые пока не знают, что управляет этими процессами.
Ученые пока не знают, что управляет этими процессами.
Физики пытаются выяснить это, изучая элементы с так называемым «магическим числом» протонов и нейтронов: 2, 8, 20, 28, 50, 82 и 126. Подобные изотопы стабильнее соседей и распадаются не так, как это предсказывает классическая ядерная физика.
В ходе нового исследования ученые под руководством Аготы Кёсёрюш из Ливерпульского университета (Великобритания) усомнились, что еще одно «магическое» число – 32 нейтрона – действительно обладает теми же свойствами, что и другие. Для этого физики разработали способ синтеза сверхтяжелых изотопов калия и изучили их свойства.
Первые намеки на то, что это число «магическое», специалисты CERN получили в 2013 году после измерений массы и размеров двух сверхтяжелых изотопов кальция – кальция-53 и кальция-54. Для обоих эти параметры значительно расходилась с предсказаниями теории, то есть эти изотопы оказались необычно стабильными.
Кёсёрюш и ее коллеги проверили, так ли это на самом деле.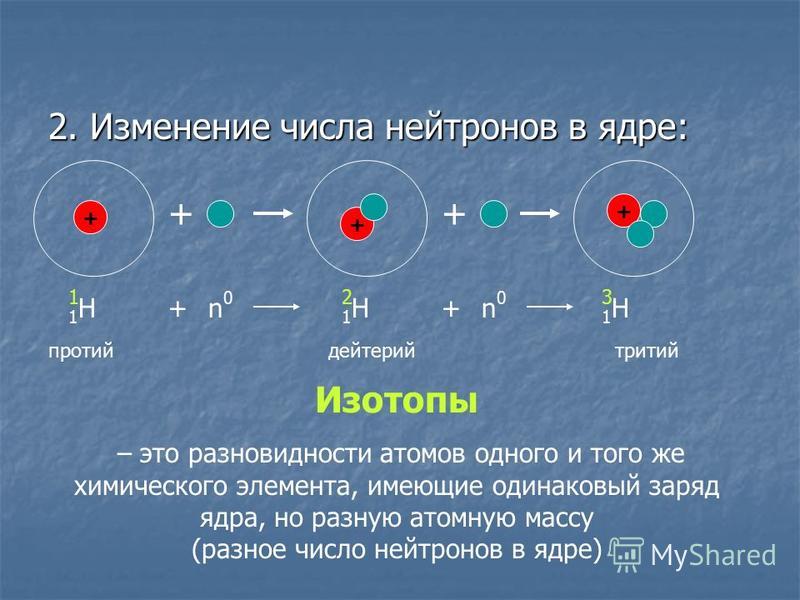 Они провели аналогичные измерения для калия, который находится рядом с кальцием в периодической таблице. Для подобных экспериментов физики разработали новый способ синтеза сверхтяжелых изотопов этого металла при помощи установки ISOLDE, а также новые методы измерений радиуса их атомов.
Они провели аналогичные измерения для калия, который находится рядом с кальцием в периодической таблице. Для подобных экспериментов физики разработали новый способ синтеза сверхтяжелых изотопов этого металла при помощи установки ISOLDE, а также новые методы измерений радиуса их атомов.
Первые эксперименты физики провели на атомах калия-52, в которых содержится 19 протонов и 33 нейтрона. Ученые получили их, обстреливая мишень из урана пучком протонов высоких энергий.
На эту тему
Затем эти атомы подсветили лазером, чтобы понять, как взаимодействия между электронами и ядром влияли на структуру спектра фотонов. Таким образом можно очень быстро и точно определить диаметр атома. Узнать размеры калия-52 другим способом очень сложно, поскольку его период полураспада составляет всего 110 мс.
Оказалось, что резких изменений в радиусе атома в районе 32 нейтронов не существует. Это ставит под сомнение «магию» числа.
Не поверив в такой результат, физики повторили эксперимент и провели дополнительные теоретические расчеты, меняя все возможные параметры и подходы к просчету свойств ядра калия-52. Однако результаты все равно не поменялись, а объяснить полученные аномалии у Кёсёрюш и ее коллег не получилось. То есть физические теории, которые описывают структуру ядер «магических» изотопов, для элементов с нечетным числом протонов и нейтронов работают не всегда корректно.
Однако результаты все равно не поменялись, а объяснить полученные аномалии у Кёсёрюш и ее коллег не получилось. То есть физические теории, которые описывают структуру ядер «магических» изотопов, для элементов с нечетным числом протонов и нейтронов работают не всегда корректно.
Ученые надеются, что создание еще более тяжелых изотопов калия и изучение их свойств поможет узнать, почему теории неправильно описывают их свойства, а также проверить еще одно потенциальное «магическое» число – 34, на существование которого впервые указали прошлогодние эксперименты физиков из Южной Кореи.
Теги
Физика
нейтронов
От
- Участник TechTarget
См. также электрон.
Нейтрон — это субатомная частица, находящаяся в ядре каждого атома, кроме ядра простого водорода. Частица получила свое название из-за отсутствия электрического заряда; это нейтрально. Нейтроны чрезвычайно плотны. В изолированном состоянии один нейтрон имел бы массу всего 1,675 ? 10 -27 кг, но если бы можно было зачерпнуть чайную ложку плотно упакованных нейтронов, получившийся кусок материи весил бы миллионы тонн на поверхности земли.
Нейтроны чрезвычайно плотны. В изолированном состоянии один нейтрон имел бы массу всего 1,675 ? 10 -27 кг, но если бы можно было зачерпнуть чайную ложку плотно упакованных нейтронов, получившийся кусок материи весил бы миллионы тонн на поверхности земли.
Число протонов в ядре элемента называется атомным номером . Этот номер дает каждому элементу свою уникальную идентичность. В атомах любого конкретного элемента, например углерода, число протонов в ядрах всегда одинаково, а число нейтронов может варьироваться. Атом данного элемента, имеющий определенное число нейтронов в ядре, называется 
Нейтроны не должны ограничиваться ядрами атомов. Они могут существовать сами по себе. Когда нейтроны обнаруживаются вне атомных ядер, они приобретают удивительные, причудливые и потенциально опасные свойства. Когда они движутся на высокой скорости, они производят смертельную радиацию. Так называемая 9.Нейтронная бомба 0028
, известная своей способностью убивать людей и животных, оказывая минимальное воздействие на неодушевленные физические структуры, работает, производя шквал высокоскоростных нейтронов. Высокая плотность этих частиц в сочетании с их скоростью придает им огромную энергию. В результате они обладают способностью изменять или даже разрушать ядра атомов, с которыми сталкиваются. Когда большая звезда взрывается, срывая свои внешние слои в виде яркого огненного шара, называемого сверхновой , оставшаяся материя невероятно плотная и коллапсирует под действием собственной гравитации. Когда этот звездный остаток достигает определенной критической плотности, практически все субатомные частицы становятся нейтронами. Получившийся объект представляет собой нейтронную звезду , которая может иметь диаметр меньше, чем у Земли, но при этом иметь массу, в сотни раз превышающую массу Солнца. Нейтронные звезды могут вращаться с высокой скоростью, производя всплески электромагнитного излучения, которые можно услышать в виде периодических импульсов в радиотелескопах. Эти небесные объекты известны как
Получившийся объект представляет собой нейтронную звезду , которая может иметь диаметр меньше, чем у Земли, но при этом иметь массу, в сотни раз превышающую массу Солнца. Нейтронные звезды могут вращаться с высокой скоростью, производя всплески электромагнитного излучения, которые можно услышать в виде периодических импульсов в радиотелескопах. Эти небесные объекты известны как
Последнее обновление: май 2008 г.
тень IT
Shadow IT — это аппаратное или программное обеспечение на предприятии, которое не поддерживается центральным ИТ-отделом организации.
Сеть
- DHCP (протокол динамической конфигурации хоста)
DHCP (Dynamic Host Configuration Protocol) — это протокол управления сетью, используемый для динамического назначения IP-адреса любому .
..
- облачная сеть радиодоступа (C-RAN)
Облачная сеть радиодоступа (C-RAN) — это централизованная архитектура на основе облачных вычислений для сетей радиодоступа.
- потоковая телеметрия сети
Потоковая сетевая телеметрия — это служба сбора данных в режиме реального времени, в которой сетевые устройства, такие как маршрутизаторы, коммутаторы и …
Безопасность
- кража учетных данных
Кража учетных данных — это тип киберпреступления, связанный с кражей удостоверения личности жертвы.
- суверенная идентичность
Самостоятельная суверенная идентичность (SSI) — это модель управления цифровыми удостоверениями, в которой отдельные лица или предприятия владеют единолично …
- Сертифицированный специалист по безопасности информационных систем (CISSP)Certified Information Systems Security Professional (CISSP) — это сертификат информационной безопасности, разработанный .
 ..
..
ИТ-директор
- рассказывание историй о данных
Рассказывание историй о данных — это процесс перевода анализа данных в понятные термины с целью повлиять на деловое решение…
- оншорный аутсорсинг (внутренний аутсорсинг)
Оншорный аутсорсинг, также известный как внутренний аутсорсинг, — это получение услуг от кого-то вне компании, но в пределах …
- FMEA (анализ видов и последствий отказов)
FMEA (анализ видов и последствий отказов) представляет собой пошаговый подход к сбору сведений о возможных точках отказа в …
HRSoftware
- самообслуживание сотрудников (ESS)
Самообслуживание сотрудников (ESS) — это широко используемая технология управления персоналом, которая позволяет сотрудникам выполнять множество связанных с работой .
 ..
.. - платформа обучения (LXP)
Платформа обучения (LXP) — это управляемая искусственным интеллектом платформа взаимного обучения, предоставляемая с использованием программного обеспечения как услуги (…
- Поиск талантов
Привлечение талантов — это стратегический процесс, который работодатели используют для анализа своих долгосрочных потребностей в талантах в контексте бизнеса …
Служба поддержки клиентов
- виртуальный помощник (помощник ИИ)
Виртуальный помощник, также называемый помощником ИИ или цифровым помощником, представляет собой прикладную программу, которая понимает естественный язык …
- жизненный цикл клиента
В управлении взаимоотношениями с клиентами (CRM) жизненный цикл клиента — это термин, используемый для описания последовательности шагов, которые проходит клиент.
 ..
.. - интерактивный голосовой ответ (IVR)
Интерактивный голосовой ответ (IVR) — это автоматизированная система телефонии, которая взаимодействует с вызывающими абонентами, собирает информацию и маршрутизирует …
Что такое атом? Факты о строительных блоках материи
Когда вы совершаете покупку по ссылкам на нашем сайте, мы можем получать партнерскую комиссию. Вот как это работает.
Атомы состоят из ядра, состоящего из протонов и нейтронов, вокруг которых вращаются электроны. (Изображение предоставлено: Рост-9Д через Getty Images) Атомы являются основными единицами материи. По данным Северо-Западного университета, все во Вселенной, кроме энергии, состоит из материи, поэтому атомы составляют все во Вселенной (открывается в новой вкладке). Термин «атом» происходит от греческого слова «неделимый», потому что когда-то считалось, что атомы — это самые маленькие объекты во Вселенной, и их нельзя разделить. Теперь мы знаем, что атомы состоят из трех частиц, известных как субатомные частицы: протоны, нейтроны и электроны, которые состоят из еще более мелких частиц, таких как кварки.
Теперь мы знаем, что атомы состоят из трех частиц, известных как субатомные частицы: протоны, нейтроны и электроны, которые состоят из еще более мелких частиц, таких как кварки.Атомы образовались после Большого Взрыва 13,7 миллиардов лет назад. Когда горячая и плотная новая Вселенная остыла, условия стали подходящими для образования кварков и электронов. Кварки объединились, чтобы сформировать протоны и нейтроны, и эти частицы объединились в ядра. По данным CERN, все это произошло в течение первых нескольких минут существования Вселенной .
Вселенной потребовалось 380 000 лет, чтобы достаточно охладиться, чтобы замедлить электроны, чтобы ядра могли захватить их и образовать первые атомы. По данным лаборатории Джефферсона, самыми ранними атомами были прежде всего водород и гелий, которые до сих пор являются самыми распространенными элементами во Вселенной. Гравитация в конечном итоге заставила облака газа слиться и образовать звезды, а более тяжелые атомы были (и до сих пор) создаются внутри звезд и разлетаются по Вселенной, когда звезда взорвалась (сверхновая).
Связанный: Что такое антиматерия, как она производится и опасна ли она?
Атомные частицы
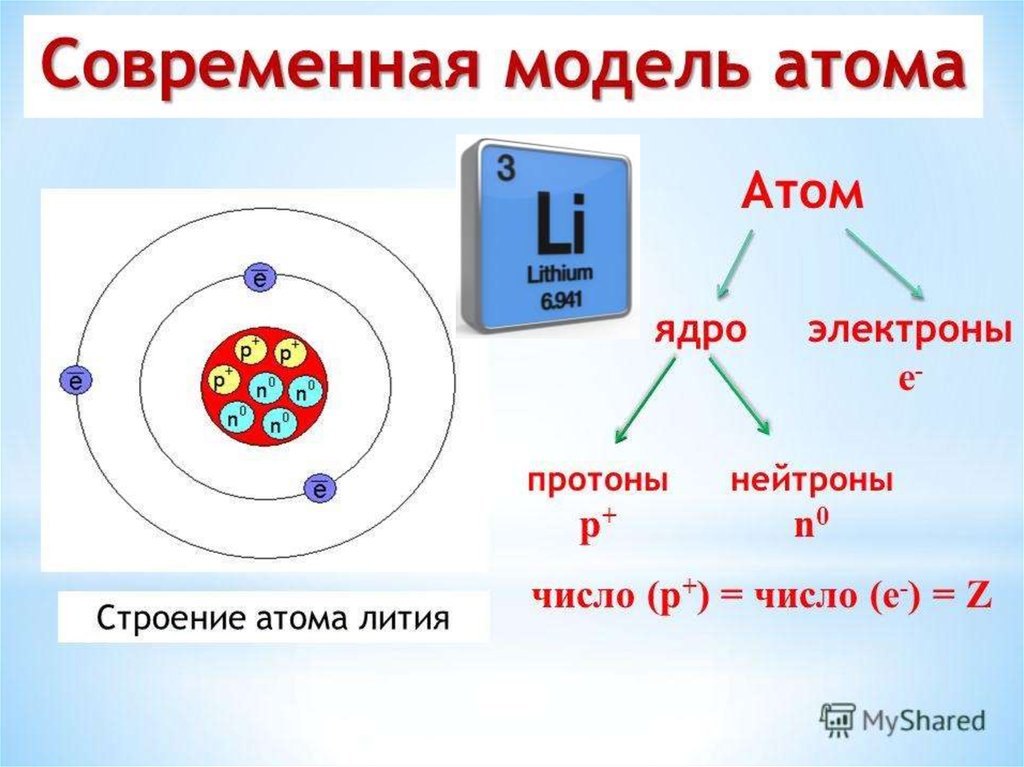
Протоны и нейтроны тяжелее электронов и находятся в ядре в центре атома. Электроны чрезвычайно легкие и существуют в облаке, вращающемся вокруг ядра. По данным Лос-Аламосской национальной лаборатории, электронное облако имеет радиус в 10 000 раз больше, чем ядро .
Протоны и нейтроны имеют примерно одинаковую массу. Однако один протон примерно в 1835 раз массивнее электрона. Атомы всегда имеют одинаковое количество протонов и электронов, и количество протонов и нейтронов обычно также одинаково. Добавление протона к атому создает новый элемент, а добавление нейтрона создает изотоп или более тяжелую версию этого атома.
Ядро
Ядро было открыто в 1911 году Эрнестом Резерфордом, физиком из Новой Зеландии, по данным Американского института физики . В 1920 году Резерфорд предложил название протон для положительно заряженных частиц атома. Он также предположил, что внутри ядра находится нейтральная частица, что Джеймс Чедвик, британский физик и ученик Резерфорда, смог подтвердить в 1932 году. (откроется в новой вкладке). Протоны и нейтроны, из которых состоит ядро, имеют примерно одинаковую массу (протон немного меньше) и имеют одинаковый угловой момент, или спин.
Он также предположил, что внутри ядра находится нейтральная частица, что Джеймс Чедвик, британский физик и ученик Резерфорда, смог подтвердить в 1932 году. (откроется в новой вкладке). Протоны и нейтроны, из которых состоит ядро, имеют примерно одинаковую массу (протон немного меньше) и имеют одинаковый угловой момент, или спин.
Ядро удерживается сильным взаимодействием, одним из четырех основных сил в природе. Эта сила между протонами и нейтронами преодолевает электрическую силу отталкивания, которая в противном случае раздвинула бы протоны в соответствии с законами электричества. Некоторые атомные ядра нестабильны, потому что сила связи различается для разных атомов в зависимости от размера ядра. Эти атомы затем распадаются на другие элементы, такие как углерод-14, распадающийся на азот-14.
Протоны
Протоны — это положительно заряженные частицы, содержащиеся в атомных ядрах. Резерфорд обнаружил их в экспериментах с электронно-лучевыми трубками, которые проводились между 1911 и 1919 годами.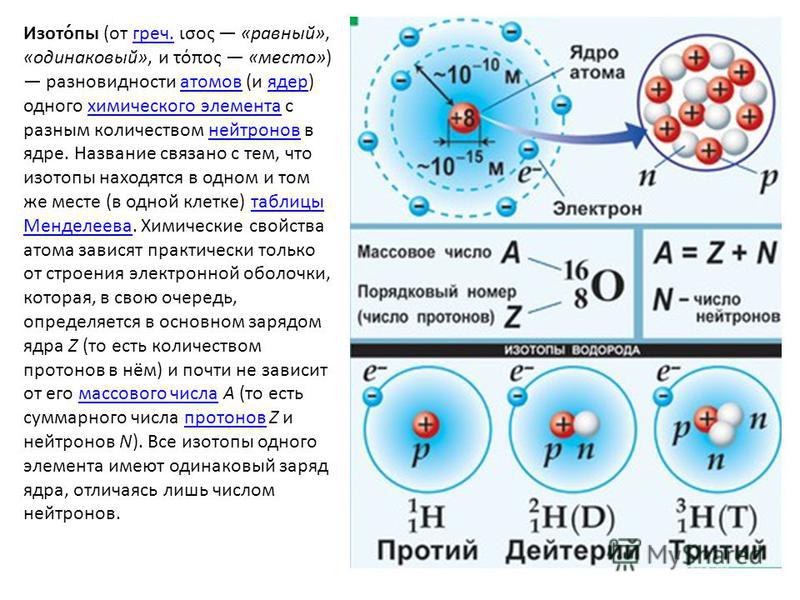 По данным лаборатории Джефферсона, протоны примерно на 99,86% массивнее нейтронов .
По данным лаборатории Джефферсона, протоны примерно на 99,86% массивнее нейтронов .
Количество протонов в атоме уникально для каждого элемента. Например, у атомов углерода шесть протонов, у атомов водорода — один, а у атомов кислорода — восемь. Число протонов в атоме называется атомным номером этого элемента. Количество протонов также определяет химическое поведение элемента. Элементы расположены в Периодической таблице элементов в порядке возрастания атомного номера.
Каждый протон состоит из трех кварков — двух «верхних» кварков (каждый с положительным зарядом на две трети) и одного «нижнего» кварка (с отрицательным зарядом на одну треть) — и они удерживаются вместе другими субатомными частицами, называемыми глюоны, которые не имеют массы.
Электроны
Электроны крошечные по сравнению с протонами и нейтронами, более чем в 1800 раз меньше, чем протон или нейтрон. По данным лаборатории Джефферсона, электроны примерно на 0,054% массивнее нейтронов.
Джозеф Джон (Дж. Дж.) Томсон, британский физик, открыл электрон в 189 г.7, по данным Института истории науки . Первоначально известные как «корпускулы», электроны имеют отрицательный заряд и электрически притягиваются к положительно заряженным протонам. Электроны окружают атомное ядро путями, называемыми орбиталями. Эту идею выдвинул австрийский физик Эрвин Шредингер в 1920-х годах. Сегодня эта модель известна как квантовая модель или модель электронного облака. Внутренние орбитали, окружающие атом, имеют сферическую форму, но внешние орбитали намного сложнее.
Дж.) Томсон, британский физик, открыл электрон в 189 г.7, по данным Института истории науки . Первоначально известные как «корпускулы», электроны имеют отрицательный заряд и электрически притягиваются к положительно заряженным протонам. Электроны окружают атомное ядро путями, называемыми орбиталями. Эту идею выдвинул австрийский физик Эрвин Шредингер в 1920-х годах. Сегодня эта модель известна как квантовая модель или модель электронного облака. Внутренние орбитали, окружающие атом, имеют сферическую форму, но внешние орбитали намного сложнее.
Электронная конфигурация атома относится к расположению электронов в типичном атоме. Согласно данным Лос-Аламосской национальной лаборатории, используя электронную конфигурацию и принципы физики, химики могут предсказать свойства атома, такие как стабильность, температура кипения и проводимость.
Связанный: Что такое квантовая запутанность?
Нейтроны
Существование нейтрона было теоретизировано Резерфордом в 1920 г. и открыто Чедвиком в 1919 г.32, по данным Американского физического общества . Нейтроны были обнаружены в ходе экспериментов, когда атомы стреляли в тонкий лист бериллия. Высвободились субатомные частицы без заряда — нейтрон.
и открыто Чедвиком в 1919 г.32, по данным Американского физического общества . Нейтроны были обнаружены в ходе экспериментов, когда атомы стреляли в тонкий лист бериллия. Высвободились субатомные частицы без заряда — нейтрон.
Нейтроны представляют собой незаряженные частицы, присутствующие во всех атомных ядрах (кроме водорода). Масса нейтрона немного больше массы протона. Как и протоны, нейтроны также состоят из кварков — одного «верхнего» кварка (с положительным зарядом в 2/3) и двух «нижних» кварков (каждый с отрицательным зарядом в одну треть).
История атома
Теория атома восходит как минимум к 440 г. до н.э. Демокриту, греческому ученому и философу. Демокрит, скорее всего, построил свою теорию атомов на работах философов прошлого, по словам Эндрю Дж. Ван Мелсена, автора книги «От атома к атому: история концептуального атома» (издательство Duquesne University Press, 1952).
Демокритовое объяснение атома начинается с камня. Камень, разрезанный пополам, дает две половинки одного и того же камня.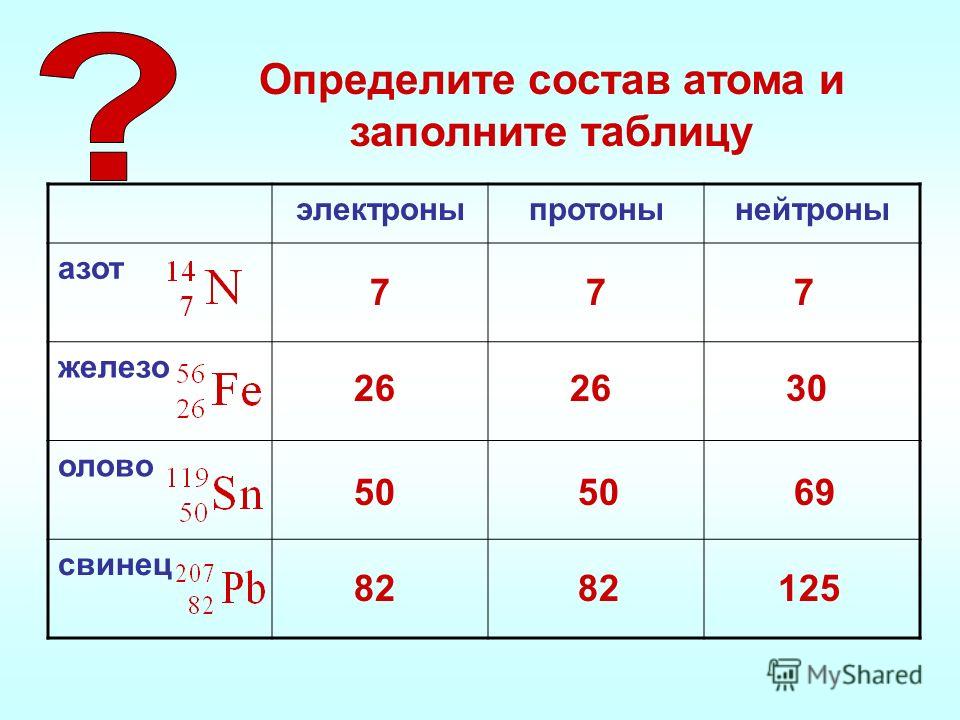 Если бы камень нужно было непрерывно резать, в какой-то момент найдется кусок камня, настолько маленький, что его уже нельзя будет разрезать. Термин «атом» происходит от греческого слова «неделимый», которое, по заключению Демокрита, должно быть точкой, в которой существо (любая форма материи) больше не может быть разделено, согласно образовательному веб-сайту Lumen Learning .
Если бы камень нужно было непрерывно резать, в какой-то момент найдется кусок камня, настолько маленький, что его уже нельзя будет разрезать. Термин «атом» происходит от греческого слова «неделимый», которое, по заключению Демокрита, должно быть точкой, в которой существо (любая форма материи) больше не может быть разделено, согласно образовательному веб-сайту Lumen Learning .
Его объяснение включало идеи о том, что атомы существуют отдельно друг от друга, что существует бесконечное количество атомов, что атомы способны двигаться, что они могут объединяться вместе, создавая материю, но не сливаются, чтобы стать новым атомом, и что их нельзя разделить, согласно Universe Today . Однако, поскольку большинство философов того времени — особенно очень влиятельный Аристотель — считали, что вся материя была создана из земли, воздуха, огня и воды, атомная теория Демокрита была отброшена.
Джон Дальтон, британский химик, опирался на идеи Демокрита в 1803 году, когда он выдвинул свою собственную атомную теорию, по данным химического факультета Университета Пердью . Теория Дальтона включала в себя несколько идей Демокрита, таких как неделимость и неразрушимость атомов, а также то, что различные атомы формируются вместе, чтобы создать всю материю. Дополнения Дальтона к теории включали следующие идеи: что все атомы определенного элемента идентичны, что атомы одного элемента будут иметь различный вес и свойства, чем атомы другого элемента, что атомы не могут быть созданы или уничтожены и что материя образована атомы, объединяющиеся в простые целые числа.
Теория Дальтона включала в себя несколько идей Демокрита, таких как неделимость и неразрушимость атомов, а также то, что различные атомы формируются вместе, чтобы создать всю материю. Дополнения Дальтона к теории включали следующие идеи: что все атомы определенного элемента идентичны, что атомы одного элемента будут иметь различный вес и свойства, чем атомы другого элемента, что атомы не могут быть созданы или уничтожены и что материя образована атомы, объединяющиеся в простые целые числа.
Томсон, британский физик, открывший электрон в 1897 году, доказал, что атомы можно разделить, согласно данным Фонда химического наследия . Он смог определить существование электронов, изучая свойства электрического разряда в электронно-лучевых трубках. Согласно статье Томсона 1897 года, лучи отклонялись внутри трубки, что доказывало наличие чего-то отрицательно заряженного внутри вакуумной трубки.
В 1899 году Томсон опубликовал описание своей версии атома, широко известной как «модель сливового пудинга».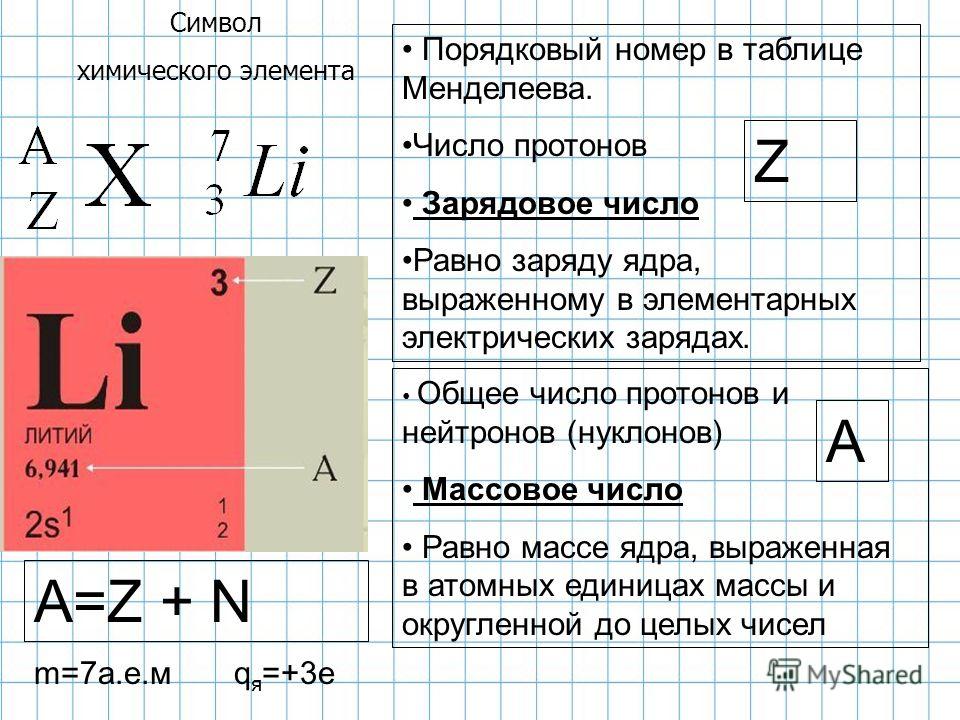 Выдержка из этой статьи находится на сайте Chem Team . Модель атома Томсона включала большое количество электронов, подвешенных в чем-то, что создавало положительный заряд, придавая атому в целом нейтральный заряд. Его модель напоминала сливовый пудинг, популярный британский десерт с изюмом, подвешенным в круглом шаре, похожем на пирог.
Выдержка из этой статьи находится на сайте Chem Team . Модель атома Томсона включала большое количество электронов, подвешенных в чем-то, что создавало положительный заряд, придавая атому в целом нейтральный заряд. Его модель напоминала сливовый пудинг, популярный британский десерт с изюмом, подвешенным в круглом шаре, похожем на пирог.
Следующим ученым, который еще больше модифицировал и усовершенствовал атомную модель, был Резерфорд, который учился у Томсона, по данным химического факультета Университета Пердью. В 1911 году Резерфорд опубликовал свою версию атома, которая включала положительно заряженное ядро, вращающееся вокруг электронов. Эта модель возникла, когда Резерфорд и его помощники стреляли альфа-частицами по тонким листам золота. Согласно данным Лаборатории Джефферсона, альфа-частица состоит из двух протонов и двух нейтронов, удерживаемых вместе одной и той же сильной ядерной силой, которая связывает ядро.
Ученые заметили, что небольшой процент альфа-частиц рассеивался под очень большими углами к первоначальному направлению движения, в то время как большинство проходило насквозь, едва возмущаясь.

 255 №№ 1–3 из учебника П. А. Оржековского «Химия: 8-ый класс» / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013.
255 №№ 1–3 из учебника П. А. Оржековского «Химия: 8-ый класс» / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013.
 ..
.. ..
.. ..
..