Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
превратите бромистый изопентил в предельный углеводород с тем же строением углеводородного скелета и тем же числом углеводородных атомов
написать формулы изомеров C6h26N2
Зробіть ланцюг перетворень
органическая химия
Решите пожалуйста
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/vOuj6t2Zyeg» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/ElMEic2MJ-U» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
H cl2 уравнение реакции. Получение HCl
Цепные реакции включают в свой механизм множество последовательно повторяющихся однотипных элементарных актов (цепь).
Рассмотрим реакцию:
H 2 + Cl 2 = 2HCl
Она состоит из следующих стадий, общих для всех цепных реакций:
1) Инициирование , или зарождение цепи
Cl 2 = 2Cl·
2) Развитие цепи
Cl· + H 2 = HCl + H·
H· + Cl 2 = HCl + Cl·
В результате каждого элементарного акта развития цепи образуется новый радикал
хлора, и эта стадия повторяется вновь и вновь, теоретически — до полного расходования реагентов.
3) Рекомбинация , или обрыв цепи
2Cl· = Cl 2
2H· = H 2
H· + Cl· = HCl
Радикалы, оказавшиеся рядом, могут рекомбинировать, образуя устойчивую частицу (молекулу). Избыток энергии они отдают «третьей частице» — например, стенкам сосуда или молекулам примесей.
Рассматриваемая цепная реакция является неразветвленной , поскольку в элементарном акте развития цепи количество радикалов не возрастает . Цепная реакция взаимодействия водорода с кислородом является разветвленной , т.к. число радикалов в элементарном акте развития цепи увеличивается :
H· + O 2 = OH· + O·
O· + H 2 = OH· + H·
OH· + H 2 = H 2 O + H·
К разветвленным цепным реакциям относятся многие реакции горения.Неконтролируемый рост числа свободных радикалов (как в результате разветвления цепи, так и для неразветвленных реакций в случае слишком быстрого инициирования) может привести к сильному ускорению реакции и взрыву.
Казалось бы, чем больше давление, тем выше концентрация радикалов и вероятнее взрыв. Но на самом деле для реакции водорода с кислородом взрыв возможен лишь в определенных
областях давления: от 1 до 100 мм рт.ст. и выше 1000 мм рт.ст. Это следует из механизма реакции.
При малом давлении большая часть образующихся радикалов рекомбинирует на стенках сосуда, и
реакция идет медленно. При повышении давления до 1 мм рт.ст. радикалы реже достигают стенок,
т.к. чаще вступают в реакции с молекулами. В этих реакциях радикалы размножаются, и происходит
взрыв. Однако при давлении выше 100 мм рт.ст. концентрации веществ настолько возрастают, что
начинается рекомбинация радикалов в результате тройных соударений (например, с молекулой воды),
и реакция протекает спокойно, без взрыва (стационарное течение). Выше 1000 мм рт.ст. концентрации
становятся очень велики, и даже тройных соударений оказывается недостаточно,
чтобы предотвратить размножение радикалов.
Но на самом деле для реакции водорода с кислородом взрыв возможен лишь в определенных
областях давления: от 1 до 100 мм рт.ст. и выше 1000 мм рт.ст. Это следует из механизма реакции.
При малом давлении большая часть образующихся радикалов рекомбинирует на стенках сосуда, и
реакция идет медленно. При повышении давления до 1 мм рт.ст. радикалы реже достигают стенок,
т.к. чаще вступают в реакции с молекулами. В этих реакциях радикалы размножаются, и происходит
взрыв. Однако при давлении выше 100 мм рт.ст. концентрации веществ настолько возрастают, что
начинается рекомбинация радикалов в результате тройных соударений (например, с молекулой воды),
и реакция протекает спокойно, без взрыва (стационарное течение). Выше 1000 мм рт.ст. концентрации
становятся очень велики, и даже тройных соударений оказывается недостаточно,
чтобы предотвратить размножение радикалов.
Вам известна цепная разветвленная реакция деления урана-235, в каждом элементарном акте
которой захватывается 1 нейтрон (играющий роль радикала) и испускается до 3 нейтронов. В
зависимости от условий (например, от концентрации поглотителей нейтронов) для нее также возможно
стационарное течение или взрыв. Это еще один пример корреляции кинетики химических и ядерных процессов.
В
зависимости от условий (например, от концентрации поглотителей нейтронов) для нее также возможно
стационарное течение или взрыв. Это еще один пример корреляции кинетики химических и ядерных процессов.
Приложения
При составлении уравнений окислительно-восстановительных реакций этим методом рекомендуется придерживаться следующего порядка:
1. Запишите схему реакции с указанием исходных и образующихся веществ, определите элементы, которые изменяют в результате реакции степень окисления, найдите окислитель и восстановитель.
2. Составьте электронные уравнения исходя из того, что окислитель принимает электроны , а восстановитель их отдает.
3. Подберите множители (основные коэффициенты) для электронных уравнений так, чтобы число электронов, отданных при окислении, было равно числу электронов, полученных при восстановлении.
4. Расставьте коэффициенты в уравнении реакции.
ПРИМЕР 3: Составить уравнение реакции восстановления оксида железа (III) углеродом . Реакция протекает по схеме:
Реакция протекает по схеме:
Fe 2 O 3 + C → Fe + CO
Решение : Железо восстанавливается, понижая степень окисления от +3 до 0; углерод окисляется, его степень окисления повышается от 0 до +2.
Составим схемы этих процессов.
восстановитель 1| 2Fe +3 + 6e = 2Fe 0 , процесс окисления
окислитель 3| C 0 -2e = C +2 , процесс восстановления
Общее число электронов, отданных восстановителем, должно быть равно общему числу электронов, принятых окислителем. Найдя наименьшее общее кратное между числами 2 и 6, определяем, что молекул восстановителя должно быть три, а молекул окислителя — две, т.е. находим соответствующие коэффициенты в уравнении реакции перед восстановителем, окислителем и продуктами окисления и восстановления.
Уравнение будет иметь вид:
Fe 2 O 3 + 3C = 2Fe + 3CO
Метод электронно-ионных уравнений (полуреакций).При составлении электронно-ионных уравнений учитывают форму существования веществ в растворе (простой или сложный ион, атом или молекула нерастворимого или труднодиссоциирующего в воде вещества).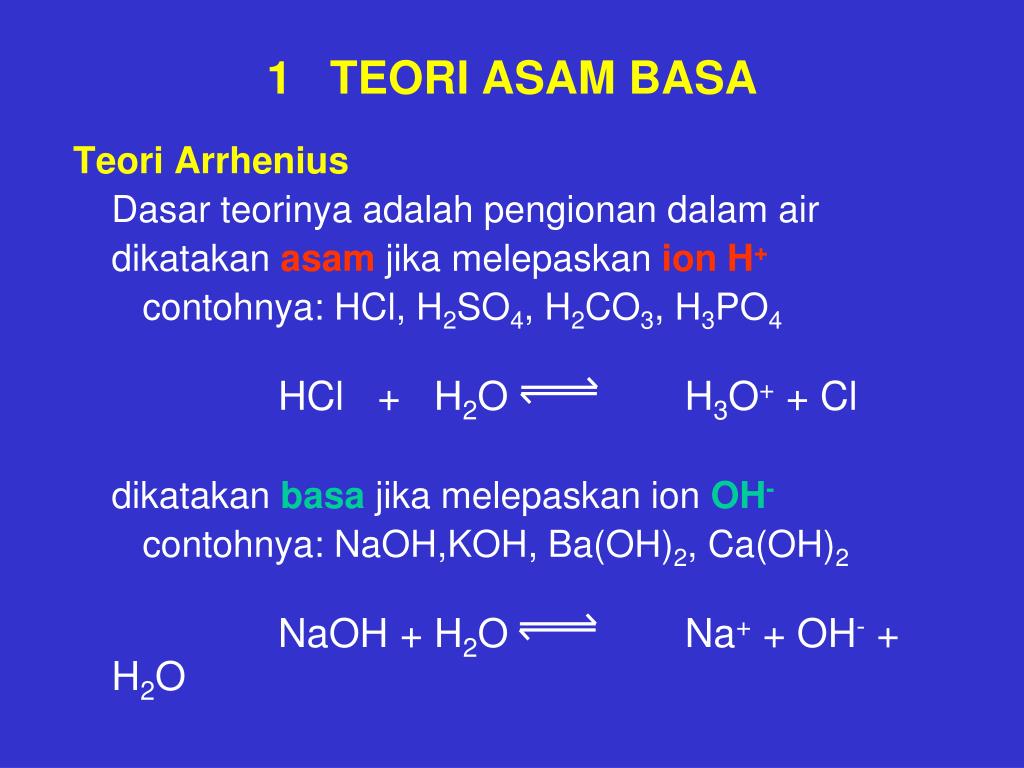
Чтобы составить уравнения окислительно-восстановительных реакций данным методом, рекомендуется придерживаться следующего порядка:
1.Составьте схему реакции с указанием исходных веществ и продуктов реакции, отметьте ионы, изменяющие в результате реакции степень окисления, определите окислитель и восстановитель.
2. Составьте схемы полуреакций окисления и восстановления с указанием исходных и образующихся в условиях реакции ионов или молекул.
3. Уравняйте число атомов каждого элемента в левой и правой частях полуреакций; при этом следует помнить, что в водных растворах в реакциях могут участвовать молекулы воды, ионы Н + или ОН — .
Следует помнить, что в водных растворах связывание избыточного кислорода и присоединение кислорода восстановителем происходят по- разному, в зависимости от рН среды. В кислых растворах избыток кислорода связывается ионами водорода с образованием молекул воды, а в нейтральных и щелочных — молекулами воды с образованием гидроксид-ионов.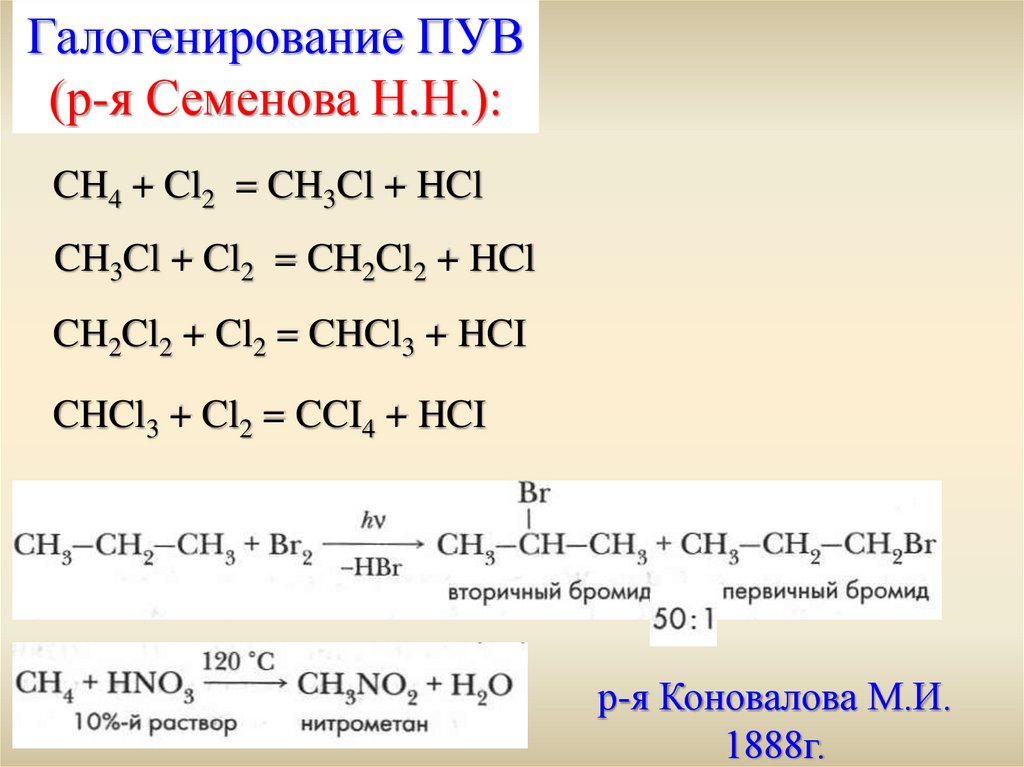 Например,
Например,
MnO 4 — + 8H + + 5e = Mn 2+ + 4H 2 O (кислая среда)
NO 3 — + 6H 2 O + 8e = NH 3 + 9OH — (нейтральная или щелочная среда).
Присоединение кислорода восстановителем осуществляется в кислой и нейтральной средах за счет молекул воды с образованием ионов водорода, а в щелочной среде — за счет гидроксид ионов с образованием молекул воды. Например,
I 2 + 6H 2 O — 10e = 2IO 3 — + 12H + (кислая или нейтральная среда)
CrO 2 — + 4OH — — 3e = CrO 4 2- + 2H 2 O (щелочная среда)
4. Уравняйте суммарное число зарядов в обеих частях каждой полуреакции; для этого прибавьте к левой и правой частям полуреакции необходимое число электронов.
5. Подберите множители (основные коэффициенты) для полуреакций так, чтобы число электронов, отдаваемых при окислении, было равно числу электронов, принимаемых при восстановлении.
6. Сложите уравнения полуреакций с учетом найденных основных коэффициентов.
7. Расставьте коэффициенты в уравнении реакции.
ПРИМЕР 4: Составить уравнение окисления сероводорода хлорной водой.
Реакция протекает по схеме:
H 2 S + Cl 2 + H 2 O → H 2 SO 4 + HCl
Решение. Восстановлению хлора соответствует следующее уравнение полуреакции: Cl 2 + 2e = 2Cl — .
При составлении уравнения полуреакции окисления серы исходим из схемы: H 2 S → SO 4 2- . В ходе этого процесса атом серы связывается с четырьмя атомами кислорода, источником которых служат молекулы воды. При этом образуются восемь ионов Н + ; кроме того, два иона Н + высвобождаются из молекулы Н 2 S.
Всего образуются 10 ионов водорода:
Левая часть схемы содержит только незаряженные частицы, а суммарный заряд ионов в правой части схемы равен +8. Следовательно, в результате окисления высвобождаются восемь электронов:
H 2 S + 4H 2 O → SO 4 2- + 10 H +
Поскольку отношение чисел электронов, принятых при восстановлении хлора и отданных при окислении серы, равно 8?2 или 4?1, то, складывая уравнения полуреакций восстановления и окисления, надо первое из них умножить на 4, а второе — на 1.
Получаем:
Cl 2 + 2e = 2Cl — | 4
H 2 S + 4H 2 O = SO 4 2- + 10H + +8e — | 1
4Cl 2 + H 2 S + 4H 2 O = 8Cl — + SO 4 2- +10H +
В молекулярной форме полученное уравнение имеет следующий вид:
4Cl 2 + H 2 S + 4H 2 O = 8HCl + H 2 SO 4
Одно и то же вещество в различных условиях может окисляться или восстанавливаться до разных степеней окисления соответствующего элемента, поэтому величина эквивалента окислителя и восстановителя также может иметь различные значения.
Эквивалентная масса окислителя равна его молярной массе деленной на число электронов n, которые присоединяет одна молекула окислителя в данной реакции.
Например, в реакции восстановления Cl 2 + 2e = 2Cl — . n = 2 Следовательно, эквивалентная масса Сl 2 равна М/2, т.е. 71/2 = 35,5г/моль.
Эквивалентная масса восстановителя равна его молярной массе деленной на число электронов n, которые отдает одна молекула восстановителя в данной реакции.
Например, в реакции окисления H 2 S + 4H 2 O — 8е = SO 4 2- + 10 H +
n = 8. Следовательно, эквивалентная масса H 2 S равна М/8, т.е. 34,08/8 = 4,26г/моль.
Следовательно, эквивалентная масса H 2 S равна М/8, т.е. 34,08/8 = 4,26г/моль.
Хлороводород в промышленности получают либо прямым синтезом из хлора и водорода, либо из побочных продуктов при хлорировании алканов (метана). Мы будем рассматривать прямой синтез из элементов.
HCl – бесцветный газ с резким, характерным запахом
t° пл = –114,8°C, t° кип = –84°C, t° крист = +57°C, т.е. хлороводород можно получать при комнатной температуре в жидком виде, увеличивая давление до 50 – 60 атм. В газовой и жидкой фазе находится в виде отдельных молекул (отсутствие водородных связей). Прочное соединение Е св = 420 кДж/моль. Начинает разлагаться на элементы при t>1500°C.
2HCl Cl 2 + H 2
Эффективный радиус HCl = 1,28 , диполь – 1,22 .
R Cl — = 1,81 , т.е. протон внедряется в электронное облако иона хлора на треть эффективного радиуса и при этом происходит упрочнение самого соединения, вследствие повышения положительного заряда вблизи ядра иона хлора и уравновешивания отталкивающего действия электронов. Все галогеноводороды образованы аналогично и являются прочными соединениями.
Все галогеноводороды образованы аналогично и являются прочными соединениями.
Хлороводород хорошо растворим в воде в любых соотношениях (в одном объеме H 2 O расторяется до 450 объемов HCl), с водой образует несколько гидратов и дает азеотропную смесь – 20,2% HCl и t° кип = 108,6°C.
Образование хлороводорода из элементов:
Cl 2 + H 2 = 2HCl
Смесь водорода и хлора при освещении взрывается, что указывает на цепной характер реакции.
В начале века Баденштейн предложил следующий механизм реакции:
Инициирование: Cl 2 + hν → ē + Cl 2 +
Цепь: Cl 2 + + H 2 → HCl + H + Cl +
H + Cl 2 → HCl + Cl
Обрыв цепи: Cl + + ē → Cl
Cl + Cl → Cl 2
Но ē в сосуде обнаружен не был.
В 1918 г. Нернст предложил другой механизм:
Инициирование: Cl 2 + hν → Cl + Cl
Цепь: Cl + H 2 → HCl + H
H + Cl 2 → HCl + Cl
Обрыв цепи: H + Cl → HCl
В дальнейшем этот механизм получил дальнейшее развитие и дополнение.
1 стадия – инициирование
реакция Cl 2 + hν → Cl + Cl
Инициируется фотохимическим путем, т. е. путем поглощения кванта света hν. Согласно принципу эквивалентности Эйнштейна каждый квант света может вызвать превращение только одной молекулы. Количественной характеристикой принципа эквивалентности является квантовый выход реакции:
е. путем поглощения кванта света hν. Согласно принципу эквивалентности Эйнштейна каждый квант света может вызвать превращение только одной молекулы. Количественной характеристикой принципа эквивалентности является квантовый выход реакции:
– количество прореагировавших молекул приходящихся на 1 квант света.
γ в обычных фотохимических реакциях ≤1. Однако в случае цепных реакций γ>>1. Например, в случае синтеза HCl γ=10 5 , при распаде H 2 O 2 γ=4.
Если молекула Cl 2 поглотила квант света, то она находится в возбужденном состоянии
10 -8 -10 -3 сек и, если полученной с квантом света энергии хватило для превращения, то происходит реакция, если нет, то молекула снова перейдет в основное состояние, либо с испусканием кванта света (флуоресценция или фосфоресценция), либо электронное возбуждение конверсируется в энергию колебания или вращения.
Посмотрим, что происходит в нашем случае:
Е дис Н 2 = 426,4 кДж/моль
Е дис Cl 2 = 239,67 кДж/моль
Е обр HCl = 432,82 кДж/моль – без облучения реакция не идет.
Квант света имеет энергию Е кв = 41,1*10 -20 Дж. Энергия, необходимая для начала реакции (энергия активации) ровна энергии, затраченной диссоциацию молекулы Cl 2:
т.е. Е Cl2
В отличие от катализа, при котором потенциальный барьер снижается, в случае фотохимических реакций он просто преодолевается за счет энергии кванта света.
Еще одна возможность инициирования реакции – добавление паров Na в смесь H 2 +Cl 2 . Реакция идет при 100°C в темноте:
Na + Cl 2 → NaCl + Cl
Cl + H 2 → HCl + H ………
и образуется до 1000 HCl на 1 атом Na.
2 стадия – продолжение цепи
Реакции продолжения цепи при получении HCl бывают следующих типов:
1. Cl + H 2 → HCl + H E a =2,0 кДж/моль
2. H + Cl 2 → HCl + Cl E a =0,8 кДж/моль
Это звенья цепи.
Скорость данных реакций можно представить следующим образом:
W 1 = K 1 [ H 2 ]
W 2 = K 2 [ Cl 2 ]
Т.к. энергии активации этих реакций малы, то их скорости велики. Цепи в данном случае неразветвленные, а по теории неразветвленных цепей:
W развитие цепи = W ициируется фотохимическим путем, т.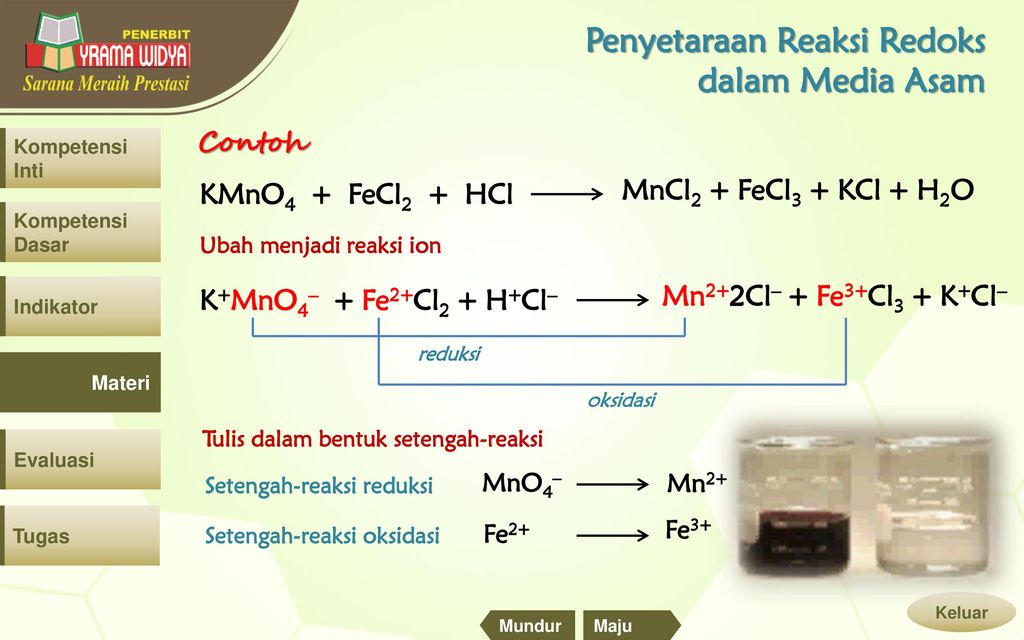 е. путем поглощения кванта светаобрыва,
е. путем поглощения кванта светаобрыва,
Cl + Cl +М → Cl 2 + М,
то W обр = К 2
От реакций 1 и 2 зависит скорость получения HCl
в данном случае W 1 =W 2 , т.к.цепи достаточно длинные (из теории цепных реакций)
Данное кинетическое уравнение справедливо в отсутствие примесей в смеси H 2 + Cl 2 . Если в систему попадет воздух, то кинетическое уравнение будет иное. В частности
W обр = K, т.е. не квадратичный обрыв и ход процесса полностью меняется.
Т.к. есть вещества, являющиеся ингибиторами цепных реакций. Ингибитором реакции образования HCl является кислород:
O 2 + H → O 2 H
Этот радикал малоактивен и может реагировать только с таким же радикалом, регенерируя кислород
O 2 H + O 2 H = O 2 + H 2 O 2
Расчеты показывают, что в присутствии 1% O 2 реакция замедляется в 1000 раз. Еще более сильно замедляет скорость процесса присутствие NCl 3 , который замедляет реакцию в 10 5 раз сильнее, чем кислород. Т.к. хлорид азота может присутствовать в хлоре в процессе его получения в промышленности, необходима тщательная очистка исходного хлора перед синтезом HCl.
9.6: Сочетание стехиометрии и законов идеального газа
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 79589
- Пол Р. Янг
- Университет Иллинойса в Чикаго via ChemistryOnline.com
С пониманием законов идеального газа теперь можно применить эти принципы к задачам химической стехиометрии. Например, металлический цинк и соляная кислота (хлорид водорода, растворенный в воде) реагируют с образованием хлорида цинка (II) и газообразного водорода в соответствии с приведенным ниже уравнением:
2 HCl (водн.) + Zn (т) → ZnCl 2 (водн.) + H 2 (г)
Пример \(\PageIndex{1}\):
Образец чистого цинка массой 5,98 г вводят в реакцию с избытком соляной кислоты и собирают (сухой) газообразный водород при 25,0 °C и 742 мм рт.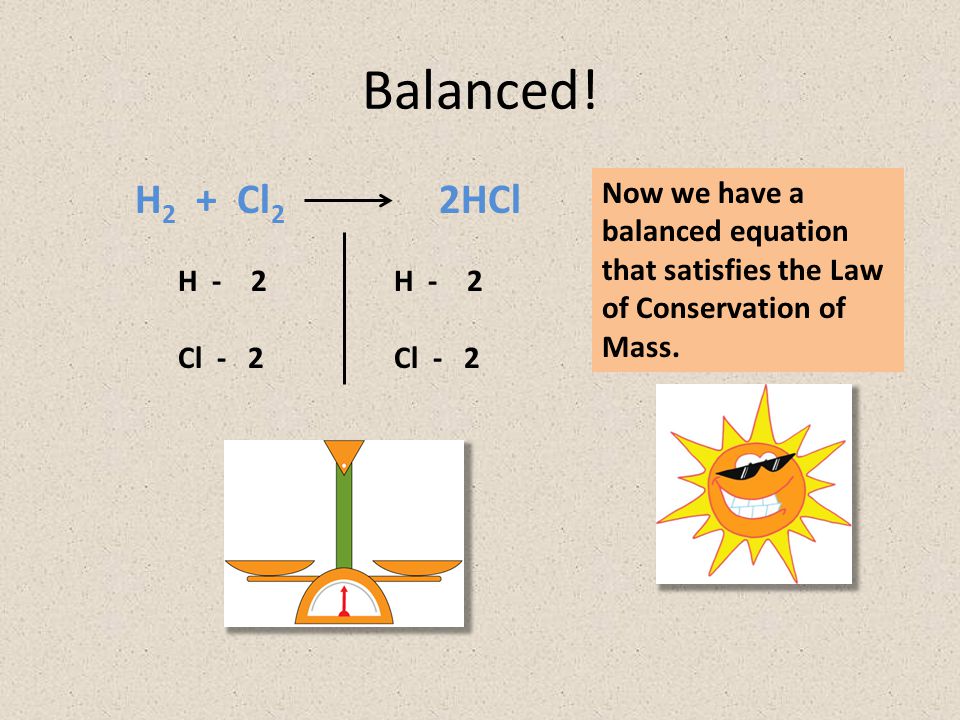 ст. Какой объем газообразного водорода будет произведен?
ст. Какой объем газообразного водорода будет произведен?
Решение
Это задача «одного состояния», поэтому мы можем решить ее, используя закон идеального газа, PV = nRT . Чтобы найти объем газообразного водорода ( V ), нам нужно знать количество молей водорода, которое будет получено в результате реакции. Наша стехиометрия просто один моль водорода на моль цинка , поэтому нам нужно знать количество молей цинка, которые присутствуют в 5,98 граммах металлического цинка. Температура дана в градусах Цельсия, поэтому нам нужно преобразовать в кельвины, а также нам нужно преобразовать мм ртутного столба в атм.
Преобразования :
\[25.0\; С+273=298\; K \номер\]
\[(742\; мм\; рт.ст.)\times \left ( \frac{1\; atm}{760\; мм\; рт.ст.} \right )=0,976\; атм \номер \]
\[(5,98\; г\; Zn)\раз \влево ( \фрак{1,00\; моль}{65,39{-1})(298\; К)}{(0,976\; атм)}=2,29\; L \nonumber \]
Мы также можем использовать тот факт, что один моль газа занимает 22,414 л при СТП, чтобы рассчитать количество молей газа, образующегося в результате реакции. Например, органическая молекула этана (CH 3 CH 3 ) реагирует с кислородом с образованием углекислого газа и воды в соответствии с приведенным ниже уравнением:
Например, органическая молекула этана (CH 3 CH 3 ) реагирует с кислородом с образованием углекислого газа и воды в соответствии с приведенным ниже уравнением:
2 CH 3 CH 3 (г) + 7 O 2 (г) → 4 CO 2 (г) + 6 Н 2 О (г)
Пример \(\PageIndex{1}\):
Неизвестная масса этана подвергается реакции с избытком кислорода, а образовавшийся диоксид углерода отделяется и собирается. Собранный диоксид углерода занимает 11,23 л при нормальных условиях; какая масса этана была в исходной пробе?
Решение
Поскольку объем диоксида углерода измеряется при стандартных нормальных условиях, наблюдаемое значение может быть непосредственно преобразовано в моль диоксида углерода путем деления на 22,414 л моль –1 . Как только известны моли диоксида углерода, стехиометрия задачи может быть использована для непосредственного получения молей этана (молярная масса 30,07 г моль -1 ), что приводит непосредственно к массе этана в образце.
\[(11,23\; L\; CO_{2})\times \left ( \frac{1\; моль}{22,414\; L} \right )=0,501\; моль\; CO_{2} \номер\]
Стехиометрия реакции :
\[(0,501\; моль\; CO_{2})\times \left ( \frac{2\; моль\; CH_{3}CH_ {3}}{4\; моль\; CO_{2}} \справа )=0,250\; моль\; CH_{3}CH_{3} \номер\]
Законы идеального газа позволяют проводить количественный анализ всего спектра химических реакций. Когда вы подходите к этим проблемам, не забудьте сначала решить класс проблемы:
- Если это проблема «одного состояния» (газ производится при одном заданном наборе условий), то вы хотите использовать PV = nRT.
- Если это проблема «двух состояний» (газ меняется с одного набора условий на другой), вы хотите использовать \[\frac{P_{1}V_{1}}{n_{1}T_{1} }=\frac{P_{2}V_{2}}{n_{2}T_{2}} \nonumber \]
- Если объем газа указан в нормальных нормальных условиях, вы можете быстро преобразовать этот объем в моли с помощью деления на 22,414 л моль -1 .

После того, как вы изолировали свой подход, проблемы закона идеального газа не более сложны, чем проблемы стехиометрии, которые мы рассматривали в предыдущих главах.
Упражнение \(\PageIndex{1}\)
- Для надувания автомобильной подушки безопасности требуется около 62 л газообразного азота. Газообразный азот образуется при разложении азида натрия в соответствии с приведенным ниже уравнением 9.0010
2 NaN 3 (т) → 2 Na (т) + 3 N 2 (г)
Какой объем азида азота необходим для получения необходимого объема азида натрия 25 ˚C и 1 атм?
- При нагревании Fe 2 O 3 в присутствии углерода образуется газ CO 2 в соответствии с приведенным ниже уравнением. Образец 96,9 г Fe 2 O 3 нагревают в присутствии избытка углерода и CO 9Произведенный 0039 2 собирается и измеряется при 1 атм и 453 К.
 Какой объем CO 2 будет наблюдаться?
Какой объем CO 2 будет наблюдаться?
2 FE 2 O 3 (S) + 3 C (S) → 4 Fe (S) + 3 CO 2 (G)
7 (G)
7 (G)
7
(G)
7
(G)
7
. цинка и соляной кислоты образует газообразный водород в соответствии с приведенным ниже уравнением. Наблюдается, что неизвестное количество цинка в образце
производит 7,50 л газообразного водорода при температуре 404 К и давлении 1,75 атм. Сколько молей цинка было в образце?
Zn (S) + 2 HCL (AQ) → ZnCl 2 (AQ) + H 2 (G)
. Законы об идеальных газах распространяются под лицензией CC BY-SA 4.0, автором, ремиксом и/или куратором является Пол Р. Янг (ChemistryOnline.com) с помощью исходного контента, отредактированного в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Пол Р. Янг
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- идеальный газ
- закон идеального газа
- Законы идеального газа
- источник@https://en.
 wikibooks.org/wiki/Introductory_Chemistry_Online
wikibooks.org/wiki/Introductory_Chemistry_Online - стехиометрия
- СТП
HCl Структура Льюиса, молекулярная геометрия и гибридизация
Соляная кислота или HCl, без сомнения, является очень сильной кислотой. Это бесцветная, едко пахнущая вода на основе хлора, содержащая кислоту.
Очень часто возникает путаница в отношении хлористого водорода и соляной кислоты, поскольку HCl является химической формулой обоих. Поэтому крайне необходимо развеять это сомнение, прежде чем переходить к какой-либо новой концепции.
Хлористый водород представляет собой газообразную форму, тогда как соляная кислота представляет собой водную форму.
Проще говоря, соляная кислота представляет собой водный раствор хлористого водорода с химической формулой HCl. Все остальные вещи такие же, кроме их физического состояния.
Интересно знать, что другое название соляной кислоты — соляная кислота.
Реакция образования HCl
Газообразный хлор (Cl2) и газообразный водород (h3) быстро соединяются напрямую при температуре выше 250 ℃ для получения HCl
h3 + Cl2 —–> 2HCl
В водном растворе HCl быстро диссоциирует на ион гидроксония (h4O+) и хлорид (Cl-). и это делает соляную кислоту сильной кислотой.
HCl + h3O ——> h4O+ + Cl-
Наряду с указанным выше методом получения HCl существует еще несколько, например: R-Cl + HCl
R-Cl + HF ——> R-F + HCl
Laboratory method- HCl can be produced by reacting sodium chloride with sulfuric acid or with NaHSO4,
NaCl + h3SO4 —–> NaHSO4 + HCl
NaCl + NaHSO4 ——-> HCl + Na2SO4
Hydrolysis хлоридных соединений. Некоторые химически активные соединения хлора, такие как хлорид фосфора, тионилхлориды и ацилхлориды, гидролизуются с образованием HCl в качестве продукта,
PCl5 + h3O —-> POCl3 + HCl
В дополнение к этому есть еще несколько основных вещей о HCl, которые мы должны знать, такие как структура Льюиса, гибридизация и т. д.
д.
Итак, давайте попробуем разобраться в этих темах подробно и получить больше знаний об этом соединении!
HCl Точечная структура Льюиса
Прежде чем перейти к точечной структуре HCl, важно знать основы структуры Льюиса.
Проще говоря, структура Льюиса — это распределение электронов вокруг атомов, которое помогает нам определить количество и типы связей в соединении.
Есть несколько простых шагов, которые мы можем выполнить, чтобы получить структуру точек Льюиса любого соединения.
- Прежде всего, нам нужно рассчитать общее количество валентных электронов, присутствующих в молекуле, путем суммирования валентных электронов всех атомов.
- Во-вторых, нам нужно выбрать центральный атом, который обычно является наименее электроотрицательным атомом или атомом с наиболее доступными позициями.
- Третьим шагом будет набросок скелетной структуры молекулы с использованием только одинарных связей.

- Далее электроны, оставшиеся после образования одинарных связей в скелетной структуре, должны быть заполнены вокруг атомов для выполнения октета. Целесообразно начинать с электроотрицательных атомов и двигаться к электроположительным.
- Нужно перепроверить выполнение октета для всех атомов. Если есть какая-то ошибка, мы должны выполнить то же самое, дав несколько облигаций.
- Наконец, все атомы должны иметь минимально возможный формальный заряд. Мы можем проверить это, используя следующую формулу: —
Теперь давайте перейдем к HCl,
HCl имеет только 2 атома, поэтому создать для него структуру точек Льюиса довольно просто!
Давайте сначала узнаем общее количество валентных электронов;
Водород = 1
Хлор = 7
Всего = 8
Хлор, будучи галогеном, нуждается в еще одном электроне, чтобы завершить свой октет.
Точно так же водороду требуется еще один электрон, чтобы получить октет, потому что самая внешняя оболочка водорода может содержать до 2 электронов.
Таким образом, между двумя атомами образуется одинарная связь, что приводит к образованию ковалентной связи.
Изображение, прикрепленное ниже, дает гораздо более четкое представление о вышеупомянутой концепции;
Молекулярная геометрия HCl
Согласно теории VSEPR, HCl имеет линейную молекулярную геометрию/форму и тетраэдрическую электронную геометрию. Валентный угол равен 180°.
Приведенная выше схема теории VSEPR ясно показывает, что HCl представляет собой молекулу типа AXE3, где
A = центральный атом = Cl здесь
X = атом, связанный с A = H здесь
E = неподеленная пара на A = 3 (у Cl есть 3 неподеленных пары)
Теперь может возникнуть вопрос о разнице между молекулярной геометрией /форма и электронная геометрия. Давайте узнаем, что это за две геометрии!
Электронная геометрия учитывает все электронные пары при определении геометрии молекулы.
Тогда как молекулярная геометрия включает только атомы.
Проще говоря, неподеленные пары учитываются в случае электронной геометрии, но не в случае молекулярной геометрии/формы.
Таким образом, мы можем видеть, что при рассмотрении неподеленных пар Cl структура соляной кислоты является тетраэдрической. А когда неподеленными парами пренебрегают, HCl показывает линейную форму.
Гибридизация HCl
HCl не имеет гибридизации, поскольку HCl является линейной двухатомной молекулой, в которой атом H и атом Cl связаны ковалентно. Так что никакой дополнительной устойчивости не требуется.
Будучи двухатомной молекулой, она имеет только один атом в качестве окружающего атома. Таким образом, может быть только одна возможность структуры, и поэтому для этой молекулы не требуется дополнительной стабильности.
Гибридизация молекулы может быть предсказана либо по диаграмме теории VSEPR, либо по формуле;
H = ½ [V+M-C+A] Здесь
H= гибридизация
V= количество валентных электронов
M= нет. одновалентного атома
одновалентного атома
C= заряд катиона
A= заряд аниона
Теперь, если H= 2 = Sp гибридизация
H= 3 = Sp2 гибридизация
H= 4 = Sp3 гибридизация
9 H= 5 = гибридизация Sp3d
H= 6 = гибридизация Sp3d2
Со всем этим мы можем очень легко найти гибридизацию любой молекулы!
Диаграмма молекулярных орбиталей HCl
Проще говоря, теория молекулярных орбиталей представляет собой образование молекулярных орбиталей путем комбинации атомных орбиталей атомов в молекуле.
Эта теория помогает нам узнать о расположении электронов на орбиталях, а также о порядке связей.
Диаграмма молекулярных орбиталей может быть объяснена как;
Мы можем ясно видеть атомные орбитали H и Cl, а также МО HCl на изображении выше.
3s-орбиталь хлора обладает гораздо меньшей энергией. Поэтому взаимодействие с 1s-орбиталью водорода невозможно.
Итак, 3p-орбиталь (3px, 3py, 3pz) хлора с энергией, сравнимой с энергией 1s-орбитали водорода, смешивается с орбиталью водорода.
Здесь происходит только сигма-перекрытие. Это связано с тем, что, хотя 3p-орбиталь Cl и 1s H объединяются вместе, симметрия обоих различна.
В результате возможно только сигма-перекрытие.
Таким образом, мы видим, что МО HCl имеет 6 пар несвязывающих электронов и одну пару связывающих электронов, которая находится на 𝛔3pz-орбитали.
Кроме того, электроны сигма-связи будут располагаться ближе к Cl из-за его более высокого значения электроотрицательности.
Все эти концепции важны для полного понимания диаграммы молекулярных орбиталей HCl.
Полярность HCl
Молекула HCl является полярной из-за более высокой электроотрицательности хлора, чем водорода.
Хлор оттягивает основной заряд в сторону и становится отрицательным полюсом, а водород становится положительным. Таким образом, молекула считается полярной молекулой.
Таким образом, молекула считается полярной молекулой.
Для получения более подробной информации необходимо также прочитать статью о полярности HCl.
Физические свойства HCl
Теперь поговорим немного о физических свойствах этого соединения. Молярная масса HCl составляет 36,46 г/моль. Кроме того, HCl имеет очень низкую температуру кипения, то есть -85,05 ℃, а температура плавления составляет -114,2 ℃.
Можно сказать, что свойства могут меняться в зависимости от молярности HCl.
Это соединение находит широкое применение в различных областях, начиная от производства поливинилхлорида для формования пластика в промышленности и заканчивая домашним хозяйством, где разбавленная HCl используется в качестве средства для удаления накипи.
HCl используется при производстве желатина в пищевой промышленности. Он также используется в пищевых добавках и обработке кожи.
Рафинирование металлов, травление стали, производство органических и неорганических соединений, контроль pH — вот еще несколько областей применения HCl.
Заключение
Хотя HCl используется по-разному в разных областях, мы должны принимать меры безопасности при ее использовании. Концентрированная HCl оказывает сильное разъедающее действие на кожу человека и может вызвать серьезные повреждения. Пары также вредны и могут вызвать кашель, удушье и раздражение в горле.
Иногда эти повреждения становятся серьезными и необратимыми. Так что лучше быть осторожным и внимательным при использовании этого химиката.
Я попытался охватить все важные факторы HCl, которые мы должны понять, прежде чем переходить к реакциям HCl. Я надеюсь, что это было полезно так или иначе, и вы получили немного больше знаний об этом соединении!
| Газ |
Подробнее о газе Хлор Хлор представляет собой химически активный элемент галогена с главным образом токсическими и раздражающими свойствами. Стандартные пределы сигналов тревоги для ЕС составляют 0,5 частей на миллион / 1 часть на миллион, при 15-минутном пределе STEL 1 часть на миллион. Угарный газ Бесшумный убийца, один из самых опасных и коварных газов, продукт неполного сгорания ископаемого топлива. Даже самые низкие концентрации накапливаются в крови, поэтому предел кратковременного воздействия (STEL) или максимально допустимая концентрация накопленного воздействия составляет всего 20 частей на миллион, а ежедневное 8-часовое максимально допустимое среднее накопленное воздействие (TWA — Time Weighted Average) составляет 100 частей на миллион. Существует большая опасность в домах, использующих ископаемое топливо, и это часть процесса на металлургических заводах, электростанциях, нефтехимических предприятиях и т. д. Стандартные настройки нижнего и верхнего также накапливается в организме, поэтому стандартный предел STEL также составляет 100 частей на миллион, а предел TWA составляет 20 частей на миллион. Углекислый газ Углекислый газ представляет собой бесцветный газ без вкуса и запаха, тяжелее воздуха, текущая концентрация которого в атмосфере Земли составляет прибл. Типичные настройки сигнализации детектора в пределах диапазона ЕС Низкий = 5 000 частей на миллион, Высокий = 30 000 частей на миллион, TWA = 5 000 частей на миллион, STEL = 30 000 частей на миллион. Детекторы СО2, благодаря их широкому применению практически во всех сферах жизни, заслуживают все большего внимания. Оксид этилена Оксид этилена представляет собой органическое соединение с высокой реакционной способностью. Это очень опасный, ядовитый, канцерогенный, мутагенный, бесцветный и легковоспламеняющийся газ со слегка сладковатым запахом. С другой стороны, благодаря своим химическим характеристикам в качестве сырья он имеет огромное и незаменимое применение в подавляющем большинстве перерабатывающих отраслей промышленности. Он используется в производстве моющих средств, растворителей, пластмасс и различных органических химикатов, за исключением этиленгликоля, полиэтиленгликоля, этаноламина и сложных гликолей. ETO имеет один из самых широких диапазонов концентрации воспламеняемости в воздухе в целом. Нижний предел взрываемости (НПВ) составляет 2,6 % по объему (об./об.), а верхний (ВПВ) составляет 100 % об./об. Высокий = 7 частей на миллион ВодородПервый, самый легкий и вездесущий элемент во Вселенной. Из-за малой плотности он «убегает» в космос, поэтому в чистом виде его на Земле немного. Он является частью промышленных процессов, особенно в нефтехимической, нефтяной и пищевой промышленности. Это часть зеленой энергии будущего. Водород не токсичен для человеческого организма, но чрезвычайно огнеопасен и взрывоопасен, поэтому основные риски и опасности заключаются в этом. Диапазон его воспламеняемости/взрывоопасности составляет от 4,00% (НПВ) до 77,00% (ВПВ) по объему (об./об.) в воздухе. Стандартные пределы настроек сигнализации в частях на миллион: Нижний = 100 частей на миллион, Верхний = 400 частей на миллион. Сероводород Сероводород представляет собой ядовитый, бесцветный и едкий газ, который возникает как побочный продукт разложения органических веществ без присутствия кислорода (болотные угодья, сточные воды) анаэробными микроорганизмами. Он также встречается в вулканических газах, геотермальных источниках и вдоль месторождений природного газа (до 30%) и сырой нефти. Он также встречается в организме человека как продукт метаболизма и даже в дыхании при некоторых нарушениях. Крупнейшими промышленными источниками выбросов сероводорода являются нефтеперерабатывающие заводы (процесс гидрообессеривания нефти — ГДС, процесс Клауса), газовые заводы, нефтехимическая, фармацевтическая промышленность, коксовые печи, бумажные фабрики и системы канализации и дренажа. Положительной стороной этого очень ядовитого газа является то, что в очень малых концентрациях (50 частей на миллиард) он может ощущаться как неприятный запах тухлых яиц, так что это первое предупреждение. Однако при быстром увеличении концентрации (что бывает чаще всего) слизистая оболочка и обоняние парализуются, неприятный запах полностью исчезает, а токсичность возрастает. Стандартные настройки для нижнего и верхнего порогов срабатывания сигнализации составляют 5 частей на миллион и 10 частей на миллион, а газ также накапливается в организме, поэтому стандартный предел STEL составляет 10 частей на миллион, а предел TWA — 5 частей на миллион. Хлористый водородХлористый водород представляет собой бесцветный реакционноспособный и токсичный газ при комнатной температуре, который вступает в реакцию с водяным паром с образованием соляной кислоты, водного раствора той же химической формулы. Хлористый водород в основном используется для производства соляной кислоты, которая используется в химической и фармацевтической промышленности. Это важное вещество в производстве виниловых и алкилхлоридов. Вдыхание хлористого водорода вызывает раздражение, удушье и воспаление дыхательных путей, отек легких и смерть при более высоких концентрациях. Стандартные настройки защитных устройств в ЕС для диапазонов HCl от Low = 5 ppm / High = 10 ppm, TWA = 5 ppm, STEL = 10 ppm. В соответствии со стандартами и рекомендациями ЕС установлены пределы срабатывания сигнализации защитных устройств Низкий = 0,9 промилле, Верхний = 4,5 промилле, TWA (8 ч) = 0,9 промилле, STEL (15 мин) = 4,5 промилле. Фтористый водород Фтористый водород представляет собой чрезвычайно токсичное и опасное соединение фтора и водорода с температурой кипения 19,5°С, поэтому в природе встречается как в виде газа, так и в виде жидкости. При контакте с водой (водяным паром) образуется сильная и едкая фтористоводородная кислота, которая может вызвать быструю слепоту за счет разрушения роговицы и сильного повреждения кожи. Стандартные настройки защитных устройств в ЕС для диапазона HF от Low = 1,5 ppm / High = 3 ppm, TWA = 1,8 ppm, STEL = 3 ppm Горючая группа газов (углеводороды) Встречаются практически в каждом сегменте жизни. Наиболее известным представителем является природный газ (метан, Ч5), а комбинации молекул углерода и водорода практически не ограничены. Мы используем их в качестве источников энергии во всех эндотермических процессах и практически во всех отраслях промышленности (химической, нефтяной, фармацевтической, нефтехимической). Самой большой проблемой является их воспламеняемость и взрывоопасность, а по большей части токсичность. Они представляют собой один из самых больших рисков во всех отраслях. Воспламеняемость напрямую зависит от их концентрации в воздушной смеси и колеблется между НПВ — нижним пределом взрываемости и НПВ — верхним пределом взрываемости. Стандартные пределы настроек сигнализации в ЕС: Низкий = 10 % НПВ, Верхний = 20 % НПВ Аммиак Аммиак представляет собой бесцветный, токсичный, раздражающий и легковоспламеняющийся газ с характерным запахом, который используется во многих промышленных процессах. , и является продуктом метаболизма живых существ. Среди его опасных свойств наиболее ярко выражена токсичность. Он горюч, с несколько более высокими температурами воспламенения и самовоспламенения (132°С/651°С). Раздражает органы дыхания и слизистые оболочки живых организмов. Он присутствует в химических и нефтехимических процессах (производство удобрений), сельском хозяйстве, фармацевтике, производстве газа, ферментации, очистке сточных вод, холодильной промышленности, а также используется в качестве противомикробного или чистящего средства. Концентрации выше 5000 частей на миллион токсичны для человека и млекопитающих. Пределы аварийного сигнала для ЕС составляют 20 частей на миллион / 50 частей на миллион при одинаковых значениях TWA и STEL. Монооксид азота Оксид азота (II) (моноксид азота) представляет собой бесцветный токсичный, реакционноспособный и раздражающий свободнорадикальный газ, который не горюч, но, подобно кислороду, способствует возгоранию легковоспламеняющихся материалов. Он очень токсичен при вдыхании или всасывании через кожу. Имеет резкий и сладкий запах. Он используется как важное соединение в химической промышленности и органической химии (гидроксиламин). Он также важен в биологии организмов как молекула-мессенджер в связи между сердечно-сосудистой, нервной и иммунной системами. Это значительный загрязнитель воздуха из-за автомобильных выхлопов и озоноразрушающее вещество из-за его свободных радикалов. Концентрации от 60 до 150 частей на миллион вызывают немедленное сильное раздражение носа и слизистой оболочки. Концентрации 100–150 частей на миллион опасны при воздействии в течение 30–60 минут, а концентрации выше 200 частей на миллион могут быть смертельными. Стандартные настройки защитных устройств в диапазоне ЕС от Low = 2 ppm / High = 5 ppm, TWA = 2 ppm. Учитывая низкую токсичность NO в течение короткого периода времени, органы ЕС не сообщают о конкретных значениях STEL (Рекомендация EU SCOEL по монооксиду азота, 06-2014). Двуокись азота Закись азота (IV) (двуокись азота) представляет собой ядовитый и химически активный газ, а также окислитель, усиливающий горение горючих материалов. Он красновато-коричневый при 21,2°С, желтоватый при более низких температурах. Вдыхание больших количеств может быть фатальным для человеческого организма. Он интенсивно используется в химической и перерабатывающей промышленности, специализированных лабораториях и в фармацевтике, особенно в процессах стерилизации. В перерабатывающей промышленности он используется для синтеза азотной кислоты, важного химического сырья. Это один из парниковых газов, производимых автомобилями внутреннего сгорания, и низкие концентрации в загрязненном воздухе оказывают негативное влияние на дыхательные пути, особенно у более чувствительных групп населения. Стандартные настройки защитных устройств в ЕС для диапазонов NO2 от Low = 0,5 ppm / High = 1 ppm, TWA = 0,5 ppm, STEL = 1 ppm. КислородГаз, необходимый для жизни, в концентрации 20,9% по объему делает нашу планету уникальной. Он поддерживает горение и является частью почти всех природных и созданных человеком процессов, происходящих на Земле. Концентрации ниже 16,0% об/об вызывают сонливость и спутанность сознания, а ниже 6% об/об смерть. Он также опасен в высоких концентрациях, поскольку увеличивает воспламеняемость материала. Концентрации выше 24,0% по объему могут вызвать самовозгорание одежды. Стандартные пределы настроек сигнализации в ЕС: Низкий = 19,5 % об./об., Высокий = 23,5 % об./об. Ядовитый газ имеет светло-голубой оттенок и сильный резкий запах, напоминающий хлор. Он образуется под действием УФ-лучей и электрических разрядов на кислород, и его важнейшая роль заключается в защите земной жизни через мантию в атмосфере. Это чрезвычайно сильный окислитель, намного сильнее стандартного кислорода. Концентрация озона выше 50 частей на миллион может быть смертельной для взрослого человека. Стандартные настройки защитных устройств в ЕС для диапазона O3 от Low = 0,1 ppm / High = 0,3 ppm. Фосфин Фосфин представляет собой чрезвычайно ядовитый бесцветный легковоспламеняющийся газ с неприятным запахом, напоминающим запах тухлой рыбы. Он тяжелее воздуха. В чистом виде совершенно не имеет запаха. Это высокотоксичный респираторный яд даже в очень низких концентрациях. Самое важное применение фосфина — в процессе фумигации, где он является очень эффективным, дешевым и быстродействующим фумигантом, не оставляющим следов на обрабатываемом продукте. |
|---|

 09.11
09.11


 Какой объем CO 2 будет наблюдаться?
Какой объем CO 2 будет наблюдаться? wikibooks.org/wiki/Introductory_Chemistry_Online
wikibooks.org/wiki/Introductory_Chemistry_Online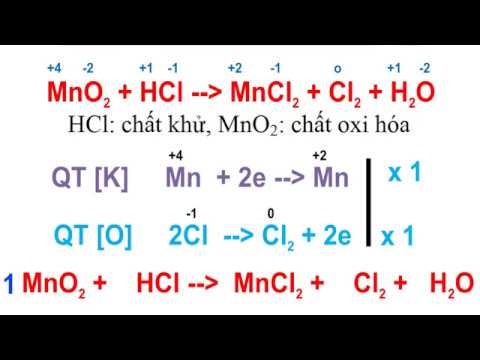
 К сожалению, из-за этого его первое массовое применение было в виде боевого яда. Парадокс заключается в том, что ионы хлора необходимы для поддержания любой формы жизни на Земле. Он используется во многих промышленных процессах, особенно в химической и фармацевтической промышленности, а также в нефтехимии. Это широко распространенное дезинфицирующее средство, и его наиболее известное применение — дезинфекция питьевой воды, бассейнов и общественных туалетов, где скрыты основные опасности. В концентрациях выше 3 частей на миллион люди ощущают его из-за очень характерного запаха. Он опасен уже в концентрациях выше 5 ppm. При концентрации 30 ppm вызывает кашель и рвоту, а выше 50 ppm вызывает необратимое поражение органов дыхания. Он смертелен в концентрациях выше 1000 частей на миллион.
К сожалению, из-за этого его первое массовое применение было в виде боевого яда. Парадокс заключается в том, что ионы хлора необходимы для поддержания любой формы жизни на Земле. Он используется во многих промышленных процессах, особенно в химической и фармацевтической промышленности, а также в нефтехимии. Это широко распространенное дезинфицирующее средство, и его наиболее известное применение — дезинфекция питьевой воды, бассейнов и общественных туалетов, где скрыты основные опасности. В концентрациях выше 3 частей на миллион люди ощущают его из-за очень характерного запаха. Он опасен уже в концентрациях выше 5 ppm. При концентрации 30 ppm вызывает кашель и рвоту, а выше 50 ppm вызывает необратимое поражение органов дыхания. Он смертелен в концентрациях выше 1000 частей на миллион. Газ без вкуса и запаха, прозрачен, неузнаваем и накапливается в крови (гемоглобине) со сродством в 240 раз выше, чем у кислорода! Концентрация 300 частей на миллион в воздухе (ppm) уже смертельна для взрослого человека.
Газ без вкуса и запаха, прозрачен, неузнаваем и накапливается в крови (гемоглобине) со сродством в 240 раз выше, чем у кислорода! Концентрация 300 частей на миллион в воздухе (ppm) уже смертельна для взрослого человека. 450 частей на миллион. Это продукт дыхания живых существ и сжигания ископаемого топлива. Он усваивается зелеными растениями и используется в процессе фотосинтеза. Основной парниковый газ отвечает за нагрев атмосферы. Сам по себе газ не токсичен и не горюч, но его высокая концентрация может вытолкнуть кислород из помещения и вызвать удушье. Его более высокая концентрация в помещении является верным показателем присутствия живности, поэтому этот факт используется при обнаружении незаконного перевозки людей или животных. Это важный элемент для измерения общего качества воздуха. Его промышленное применение очень широкое — он используется в пищевой и фармацевтической промышленности, производстве природного газа, виноделии, пожарной сигнализации, холодильной технике, сельском хозяйстве, медицине, в качестве инертного газа в компрессорах и сварочных процессах, а также в качестве общего компенсатора давления. Концентрация 7%-10% (70 000 — 100 000 ppm) в воздухе может вызвать удушье. Допустимые концентрации в закрытых рабочих помещениях составляют прибл.
450 частей на миллион. Это продукт дыхания живых существ и сжигания ископаемого топлива. Он усваивается зелеными растениями и используется в процессе фотосинтеза. Основной парниковый газ отвечает за нагрев атмосферы. Сам по себе газ не токсичен и не горюч, но его высокая концентрация может вытолкнуть кислород из помещения и вызвать удушье. Его более высокая концентрация в помещении является верным показателем присутствия живности, поэтому этот факт используется при обнаружении незаконного перевозки людей или животных. Это важный элемент для измерения общего качества воздуха. Его промышленное применение очень широкое — он используется в пищевой и фармацевтической промышленности, производстве природного газа, виноделии, пожарной сигнализации, холодильной технике, сельском хозяйстве, медицине, в качестве инертного газа в компрессорах и сварочных процессах, а также в качестве общего компенсатора давления. Концентрация 7%-10% (70 000 — 100 000 ppm) в воздухе может вызвать удушье. Допустимые концентрации в закрытых рабочих помещениях составляют прибл.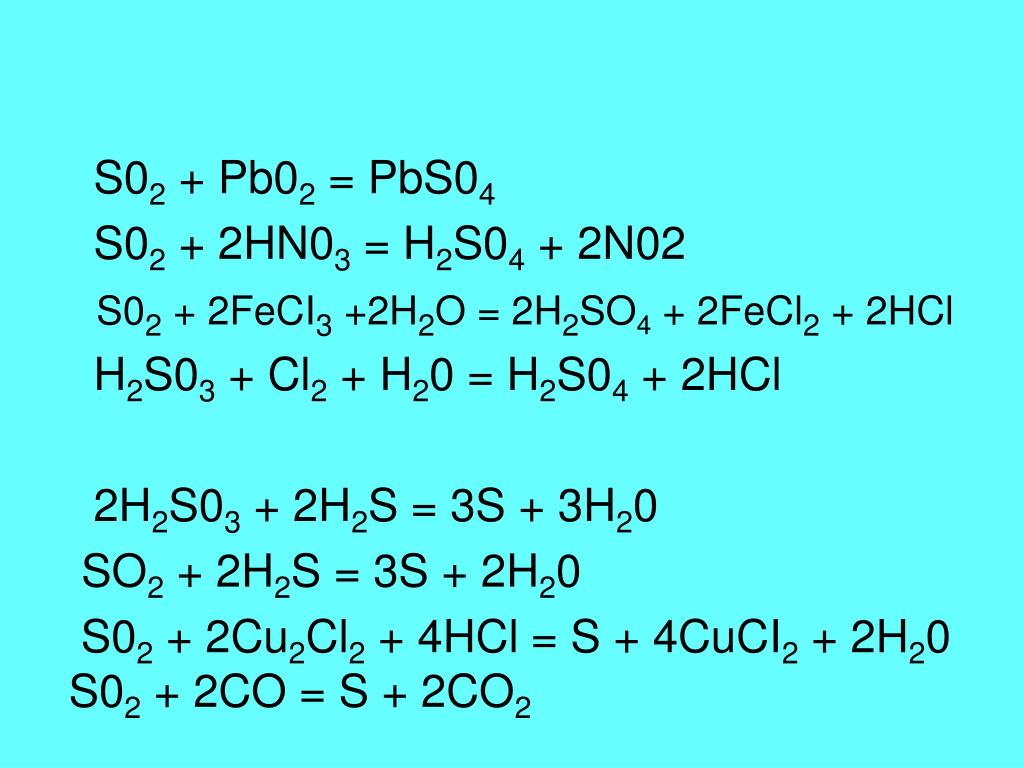 2500 ppm, выше этого предела возможно общее ухудшение работоспособности (сонливость, утомляемость, умственная замедленность).
2500 ppm, выше этого предела возможно общее ухудшение работоспособности (сонливость, утомляемость, умственная замедленность). Применяется как в качестве дезинфицирующего средства, так и в процессе стерилизации, особенно в больницах, медицинских учреждениях и аптеках.
Применяется как в качестве дезинфицирующего средства, так и в процессе стерилизации, особенно в больницах, медицинских учреждениях и аптеках.
 При концентрациях выше 50 ppm возникают нарушения зрения.
При концентрациях выше 50 ppm возникают нарушения зрения.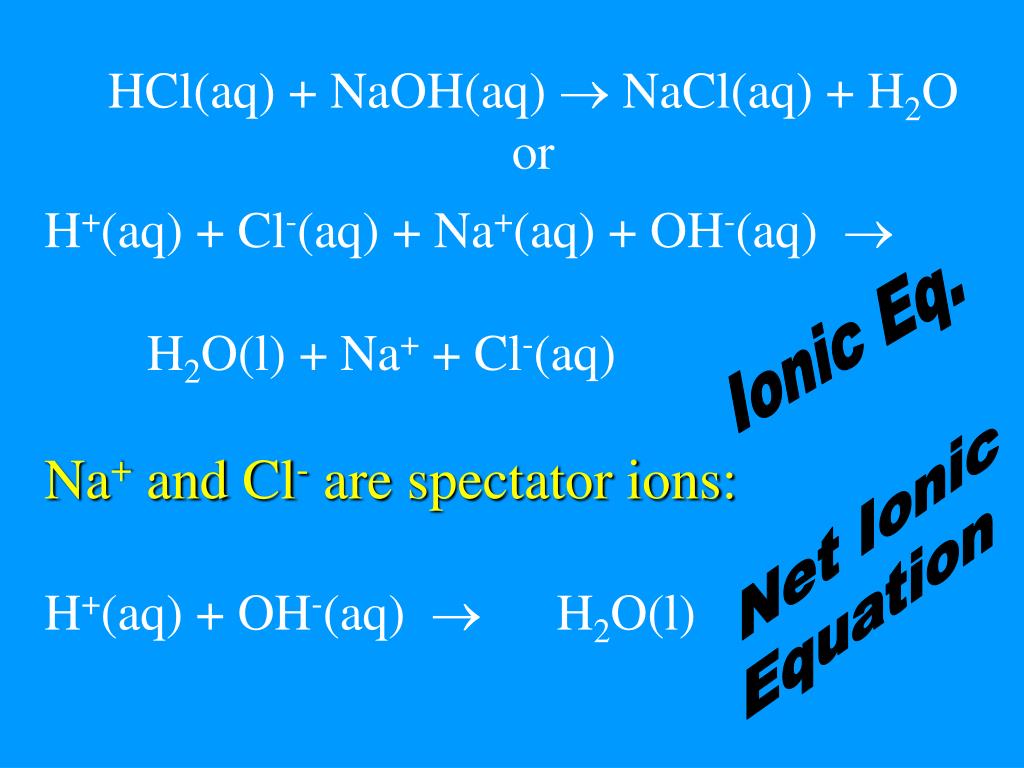 с температурой кипения чуть выше комнатной (25,6°С). Это одно из самых токсичных веществ, обычно используемых в промышленности. Всего 36 молекул HCN на миллион молекул, смешанных с воздухом (36 частей на миллион), могут убить здорового взрослого человека в течение 2 часов. С другой стороны, это очень ценное вещество в химической и фармацевтической промышленности, особенно в начальных реакциях для получения полезных органических соединений в органической химии и фармацевтической промышленности.
с температурой кипения чуть выше комнатной (25,6°С). Это одно из самых токсичных веществ, обычно используемых в промышленности. Всего 36 молекул HCN на миллион молекул, смешанных с воздухом (36 частей на миллион), могут убить здорового взрослого человека в течение 2 часов. С другой стороны, это очень ценное вещество в химической и фармацевтической промышленности, особенно в начальных реакциях для получения полезных органических соединений в органической химии и фармацевтической промышленности. В основном используется в нефтехимической промышленности, органической химии (для фторорганических соединений), в качестве катализатора и растворителя.
В основном используется в нефтехимической промышленности, органической химии (для фторорганических соединений), в качестве катализатора и растворителя. При концентрациях метана в воздухе от 4,4% до 17% по объему искра вызывает взрыв, поэтому 4,4% об./об. Ch5 = 100% НПВ.
При концентрациях метана в воздухе от 4,4% до 17% по объему искра вызывает взрыв, поэтому 4,4% об./об. Ch5 = 100% НПВ.


 В нижних слоях атмосферы встречается как загрязнитель и вредный газ, воздействующий на дыхательные пути. В промышленности он чаще всего используется для дезинфекции больших помещений и предприятий (больницы, пищевая промышленность), стерилизации (фармацевтика), обеззараживания воды, дезодорации помещений, санитарии бассейнов, отбеливания, дезинфекции сельскохозяйственной продукции и многих других подобных применений.
В нижних слоях атмосферы встречается как загрязнитель и вредный газ, воздействующий на дыхательные пути. В промышленности он чаще всего используется для дезинфекции больших помещений и предприятий (больницы, пищевая промышленность), стерилизации (фармацевтика), обеззараживания воды, дезодорации помещений, санитарии бассейнов, отбеливания, дезинфекции сельскохозяйственной продукции и многих других подобных применений.