Химическая реакция
Гурына Ира
Химия для 9 классаХимическими реакциями называются явления, при которых одни вещества, обладающие определенным составом и свойствами, превращаются в другие вещества — с другим составом и другими свойствами. При этом в составе атомных ядер изменений не происходит.
Признаки химических реакций
- Выделение/поглощение тепла или света
- Изменение цвета
- Выделение газа
- Выделение/растворение осадка
- Изменение запаха
Условия протекания реакций обмена
- Выпадение осадка
- Выделение газа
- Образование слабого электролита
Химическим уравнением (уравнением химической реакции) называют условную запись химической реакции с помощью химических формул, числовых коэффициентов и математических символов.
Закон сохранения массы веществ
Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Классификация химических реакций
Химические реакции по количеству исходных веществ и продуктов реакции:
- реакция соединения
- реакция разложения
- реакции замещения
- реакция обмена
Реакция соединения
Реакция соединения — реакции между двумя простыми веществами, или между несколькими сложными, при этом образуется одно сложное или более сложное вещество.
- А + В = АВ
- АВ + СД = АВСД
Пример
- CaO + h3O = Ca(OH)2
- PbO + SiO2 = PbSiO3
- 2Na + Cl2 = 2NaCl
Реакция разложения
Реакция разложения — реакции, при которых из одного вещества образуется несколько простых или сложных веществ.
- АВСД = АВ + СД
Пример
- Cu(OH)2 = CuO + h3O
- CaCO3 = CaO + CO2
- Nh5Cl = Nh4 + HCl
- (CuOH)2CO3 = 2CuO + CO2 + h3O
Реакции замещения
Реакции замещения — реакции между сложным и простым веществами, при которых атомы простого вещества замещают один из атомов сложного.
- АВ + С = СВ + А
- АВ + С = АС + В
Пример
- CuSO4 + Fe = FeSO4 + Cu
- 2KBr + Cl2 = 2KCl + Br2
Реакция обмена
Реакция обмена — реакции между двумя сложными веществами, при которых они обмениваются своими составными частями.
- АВ + СД = АД + СВ
Пример
- AgNO3 + KBr = AgBr + KNO3
- NaOH + HCl = NaCl + h3O
Полезные ссылки
Источник материала
Поделиться Share Tweet
CO + PbO = CO2 + Pb
| Поиск |
окись углерода + окись свинца(ii) = двуокись углерода + свинец | Температура: 300 — 400
Новости Только 5% НАСЕЛЕНИЯ знают
Рекламное объявление
Содержание
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
| svg.png» substance-weight=»28.0101″> СО | + | PbO | → | CO 2 | + | Pb | |
| carbon monoxide | lead(ii) oxide | carbon dioxide | ВЫДЕЛА | ||||
| 0006 | |||||||
| 1 | 1 | 1 | 1 | Hệ số | |||
| Nguyên — Phân tử khối (g/ Мол) | |||||||
| Số MOL | |||||||
| Khối lượng (g) |
Рекламное объявление
Дополнительная информация об уравнении CO + PbO → CO
2 + PbВ каких условиях CO (окись углерода) реагирует с PbO (оксидом свинца(ii)) ?
Температура: 300–400°C
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель.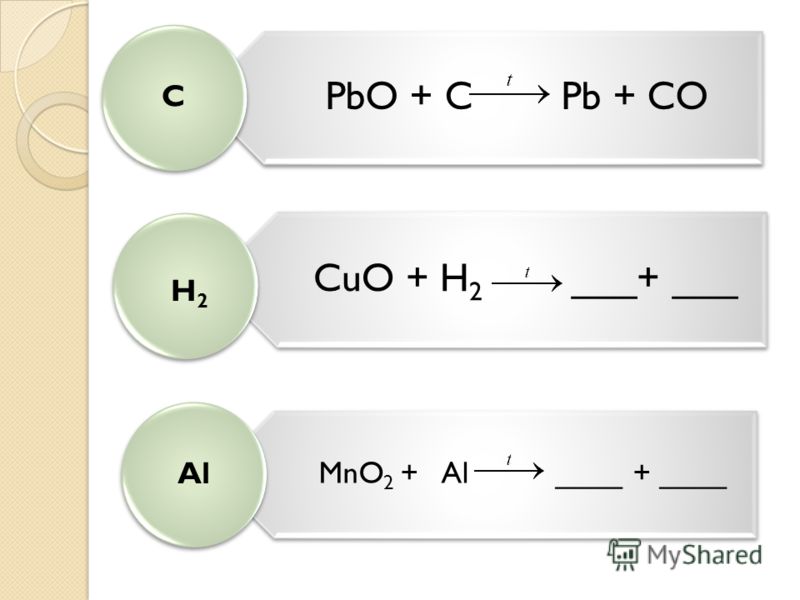 Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции с образованием CO2 (двуокись углерода) и Pb (свинец)?
В полном предложении вы также можете сказать, что CO (окись углерода) реагирует с PbO (оксидом свинца (ii)) и производит CO2 (углекислый газ) и Pb (свинец)
Явление после того, как CO (окись углерода) (ii) оксид)
Это уравнение не несет никакой конкретной информации о явлении.
В этом случае вам просто нужно наблюдать, чтобы убедиться, что вещество продукта Пб (свинец), появляющийся в конце реакции.
Или если какое-либо из следующих реагентов PbO (оксид свинца(ii)), исчезающий
Какую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Категории уравнения
Дополнительные вопросы, связанные с химическими реакциями CO + PbO → CO
2 + PbВопросы, связанные с реагентом CO (окись углерода)
Каковы химические и физические характеристики CO (окись углерода)? В каких химических реакциях используется CO (окись углерода) в качестве реагента?
Вопросы, связанные с реагентом PbO (оксид свинца(ii))
Каковы химические и физические характеристики PbO (оксид свинца(ii))? Какие химические реакции происходят с PbO (оксидом свинца(ii)) в качестве реагента ?
Вопросы, связанные с продуктом CO2 (двуокись углерода)
Каковы химические и физические характеристики CO2 (оксида свинца(ii))?Каковы химические реакции, в результате которых CO2 (двуокись углерода) является продуктом?
Вопросы, связанные с продуктом Pb (свинец)
Каковы химические и физические характеристики Pb (оксида свинца(ii))? Каковы химические реакции, в которых Pb (свинец) является продуктом?
Уравнения с CO в качестве реагента
окись углерода
CO + H 2 O + PdCl 2 → 2HCl + CO 2 + Pd 2CO + O 2 → 2CO 2 4CO + Fe 3 O 4 → 3Fe + 4CO 2 Просмотреть все уравнения с CO в качестве реагента
Уравнения с PbO в качестве реагента
оксид свинца(ii)
2NH 3 + 3PbO → 3H 2 O + N 2 + 3Pb C + PbO → CO + Pb 4HCl + PbO → Cl
Рекламное объявление
Уравнения с PbO в качестве произведения
оксид свинца(ii)
2Pb(НО 3 ) 2 → 4НО 2 + 4O 2 + 2PbO O 2 + 2Pb → 2PbO 2Pb 3 O 4 → O 2 + 6PbO Просмотреть все уравнения с PbO в качестве продукта
Уравнения с PbO в качестве произведения
оксид свинца(ii)
2Pb(NO 3 ) 2 → 4NO 2 + 4O 2 + 2PbO O 2 + 2Pb → 2PbO 2Pb 3 O 4 → O 2 + 6PbO Просмотреть все уравнения с PbO в качестве продукта
Фазовые отношения в системе PbO-CO2 и разложение церуссита1 | Американский минералог
Пропустить пункт назначения навигации
Исследовательская статья|
01 октября 1964 г.
Дэвид А. Грисафе;
Уильям Б. Уайт
Американский минералог (1964) 49 (9-10): 1184–1198.
История статьи
получено:
18 января 1964
принято:
15 апреля 1964
первый онлайн:
06 июля 2018
- Цитировать
- Посмотреть эту цитату
- Добавить в менеджер цитирования
- Делиться
- Твиттер
- MailTo
- Инструменты
Получить разрешения
- Поиск по сайту
Цитирование
Дэвид А. Грисафе, Уильям Б. Уайт; Фазовые соотношения в системе PbO-CO 2 и разложение церуссита. Американский минералог 1964; 49 (9-10): 1184–1198. doi:
Грисафе, Уильям Б. Уайт; Фазовые соотношения в системе PbO-CO 2 и разложение церуссита. Американский минералог 1964; 49 (9-10): 1184–1198. doi:
Скачать файл цитирования:
- Рис (Зотеро)
- Реф-менеджер
- EasyBib
- Подставки для книг
- Менделей
- Бумаги
- Конечная примечание
- РефВоркс
- Бибтекс
Разложение PbCO 3 было исследовано равновесными методами в диапазоне от 200 до 900°C и от 15 до 1400 бар PCO2. Четыре промежуточные оксикарбонатные фазы: 2PbCO 3 · PbO, PbCO 3 · PbO, PbCO 3 · 2PbO и 4PbCO 3 · 3PbO; они были охарактеризованы оптическими и порошковыми данными x лучей. Проекция фазы P-T для реакций твердое тело-пар в системе показывает инвариантные точки твердого тела-пар при 530°С и 207 бар и при 570°С и 380 бар.
