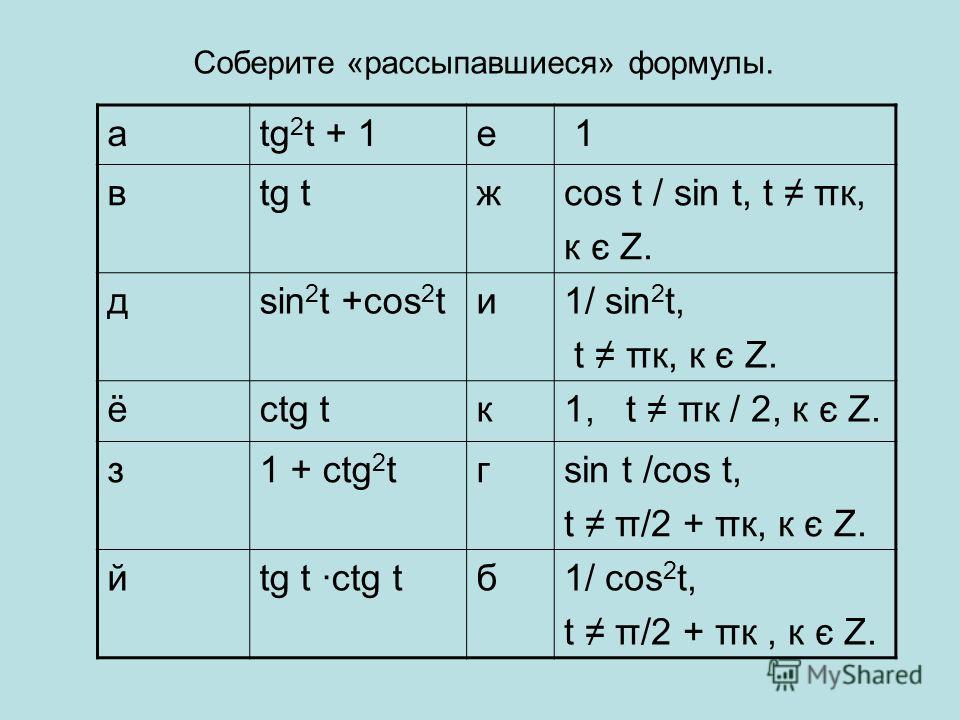
Раздел недели: Плоские фигуры. Свойства, стороны, углы, признаки, периметры, равенства, подобия, хорды, секторы, площади и т.д. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Поиск на сайте DPVA Поставщики оборудования Полезные ссылки О проекте Обратная связь Ответы на вопросы. Оглавление Таблицы DPVA.ru — Инженерный Справочник | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация/ / Математический справочник / / Таблицы численных значений. (Таблица квадратов, кубов, синусов ….) + Таблицы Брадиса / / Таблица котангенсов углов от 0° — 360°. Поделиться:
 Введите свой запрос: Введите свой запрос: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Коды баннеров проекта DPVA.ru Консультации и техническая | Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса. Free xml sitemap generator | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
цены, описание, аналоги в каталоге www.dieselgenerators.ru
по запросу
купить в 1 клик оформить заказ
Добавить в сравнение Версия для печати Стоимость доставки
Характеристики
Основная информация
Мощность номинальная : 360 кВт
Мощность максимальная : 400 кВт
Напряжение : 230/400 В
Число фаз : 3
Частота : 50 Гц
Инверторная модель : нет
Тип генератора : Синхронный
Пуск : электростартер
Степень автоматизации : 2 — автозапуск
Исполнение : открытое
Функция сварки : нет
Расход топлива при 75% нагрузке :
74. 2 л/ч
2 л/ч
Объем топливного бака : 600 л
Модель : CTG 513C с АВР
Сведения о двигателе
Габариты
Производитель
Внимание!
Работы по монтажу и пусконаладке генератора, должны производиться опытными инженерами со специальными знаниями в области электрификации.
Игнорируя данные правила, снижается моторесурс и значительно повышается риск выхода из строя
электростанции. Так же, в случае отсутствия акта о вводе в эксплуатацию производитель
электрооборудования вправе отказать в гарантийном ремонте.
Варианты исполнения
- CTG 513C в контейнере с АВР
Цена:
по запросу
Мощность номинальная 360 кВт
Топливо дизель
Напряжение 230/400 В
Исполнение в контейнере
подробнее
- CTG 513C в контейнере
Цена:
по запросу
Мощность номинальная 360 кВт
Топливо дизель
Напряжение 230/400 В
Исполнение в контейнере
подробнее
- CTG 513C в кожухе с АВР
Цена:
по запросу
Мощность номинальная 360 кВт
Топливо дизель
Напряжение 230/400 В
Исполнение в кожухе
подробнее
- CTG 513C в кожухе
Цена:
по запросу
Мощность номинальная 360 кВт
Топливо дизель
Напряжение 230/400 В
Исполнение в кожухе
подробнее
- CTG 513C
Цена:
по запросу
Мощность номинальная 360 кВт
Топливо дизель
Напряжение 230/400 В
Исполнение открытое
подробнее
| 1 | Найти объем | сфера (5) | |
| 2 | Найти площадь | окружность (5) | |
| 3 | Найти площадь поверхности | сфера (5) | |
| 4 | Найти площадь | окружность (7) | |
| 5 | Найти площадь | окружность (2) | |
| 6 | Найти площадь | окружность (4) | |
| 7 | Найти площадь | окружность (6) | |
| 8 | Найти объем | сфера (4) | |
| 9 | Найти площадь | окружность (3) | |
| 10 | Вычислить | (5/4(424333-10220^2))^(1/2) | |
| 11 | Разложить на простые множители | 741 | |
| 12 | Найти объем | сфера (3) | |
| 13 | Вычислить | 3 квадратный корень из 8*3 квадратный корень из 10 | |
| 14 | Найти площадь | окружность (10) | |
| 15 | Найти площадь | окружность (8) | |
| 16 | Найти площадь поверхности | сфера (6) | |
| 17 | Разложить на простые множители | 1162 | |
| 18 | Найти площадь | окружность (1) | |
| 19 | Найти длину окружности | окружность (5) | |
| 20 | Найти объем | сфера (2) | |
| 21 | Найти объем | сфера (6) | |
| 22 | Найти площадь поверхности | сфера (4) | |
| 23 | Найти объем | сфера (7) | |
| 24 | Вычислить | квадратный корень из -121 | |
| 25 | Разложить на простые множители | 513 | |
| 26 | Вычислить | квадратный корень из 3/16* квадратный корень из 3/9 | |
| 27 | Найти объем | прямоугольный параллелепипед (2)(2)(2) | |
| 28 | Найти длину окружности | окружность (6) | |
| 29 | Найти длину окружности | окружность (3) | |
| 30 | Найти площадь поверхности | сфера (2) | |
| 31 | Вычислить | 2 1/2÷22000000 | |
| 32 | Найти объем | прямоугольный параллелепипед (5)(5)(5) | |
| 33 | Найти объем | прямоугольный параллелепипед (10)(10)(10) | |
| 34 | Найти длину окружности | окружность (4) | |
| 35 | Перевести в процентное соотношение | 1.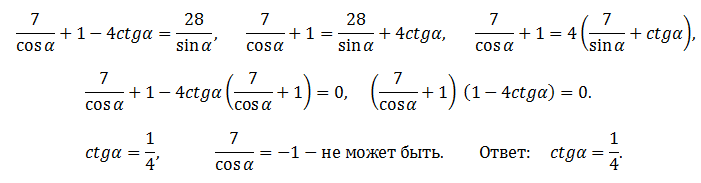 2-4*-1+2 2-4*-1+2 | |
| 45 | Разложить на простые множители | 228 | |
| 46 | Вычислить | 0+0 | |
| 47 | Найти площадь | окружность (9) | |
| 48 | Найти длину окружности | окружность (8) | |
| 49 | Найти длину окружности | окружность (7) | |
| 50 | Найти объем | сфера (10) | |
| 51 | Найти площадь поверхности | сфера (10) | |
| 52 | Найти площадь поверхности | сфера (7) | |
| 53 | Определить, простое число или составное | 5 | |
| 54 | Перевести в процентное соотношение | 3/9 | |
| 55 | Найти возможные множители | 8 | |
| 56 | Вычислить | (-2)^3*(-2)^9 | |
| 57 | Вычислить | 35÷0. 2 2 | |
| 60 | Преобразовать в упрощенную дробь | 2 1/4 | |
| 61 | Найти площадь поверхности | сфера (12) | |
| 62 | Найти объем | сфера (1) | |
| 63 | Найти длину окружности | окружность (2) | |
| 64 | Найти объем | прямоугольный параллелепипед (12)(12)(12) | |
| 65 | Сложение | 2+2= | |
| 66 | Найти площадь поверхности | прямоугольный параллелепипед (3)(3)(3) | |
| 67 | Вычислить | корень пятой степени из 6* корень шестой степени из 7 | |
| 68 | Вычислить | 7/40+17/50 | |
| 69 | Разложить на простые множители | 1617 | |
| 70 | Вычислить | 27-( квадратный корень из 89)/32 | |
| 71 | Вычислить | 9÷4 | |
| 72 | Вычислить | 2+ квадратный корень из 21 | |
| 73 | Вычислить | -2^2-9^2 | |
| 74 | Вычислить | 1-(1-15/16) | |
| 75 | Преобразовать в упрощенную дробь | 8 | |
| 76 | Оценка | 656-521 | |
| 77 | Вычислить | 3 1/2 | |
| 78 | Вычислить | -5^-2 | |
| 79 | Вычислить | 4-(6)/-5 | |
| 80 | Вычислить | 3-3*6+2 | |
| 81 | Найти площадь поверхности | прямоугольный параллелепипед (5)(5)(5) | |
| 82 | Найти площадь поверхности | сфера (8) | |
| 83 | Найти площадь | окружность (14) | |
| 84 | Преобразовать в десятичную форму | 11/5 | |
| 85 | Вычислить | 3 квадратный корень из 12*3 квадратный корень из 6 | |
| 86 | Вычислить | (11/-7)^4 | |
| 87 | Вычислить | (4/3)^-2 | |
| 88 | Вычислить | 1/2*3*9 | |
| 89 | Вычислить | 12/4-17/-4 | |
| 90 | Вычислить | 2/11+17/19 | |
| 91 | Вычислить | 3/5+3/10 | |
| 92 | Вычислить | 4/5*3/8 | |
| 93 | Вычислить | 6/(2(2+1)) | |
| 94 | Упростить | квадратный корень из 144 | |
| 95 | Преобразовать в упрощенную дробь | 725% | |
| 96 | Преобразовать в упрощенную дробь | 6 1/4 | |
| 97 | Вычислить | 7/10-2/5 | |
| 98 | Вычислить | 6÷3 | |
| 99 | Вычислить | 5+4 | |
| 100 | Вычислить | квадратный корень из 12- квадратный корень из 192 |
59807-15: ADF-MULTI, CTG-MULTI, TC-MULTI Преобразователи термоэлектрические многозонные
Назначение
Преобразователи термоэлектрические многозонные ADF-MULTI, CTG-MULTI, TC-MULTI (далее по тексту — термопреобразователи или ТП) предназначены для многоточечных измерений температуры жидких и газообразных сред, не агрессивных к материалу защитной оболочки или гильзы ТП, в т.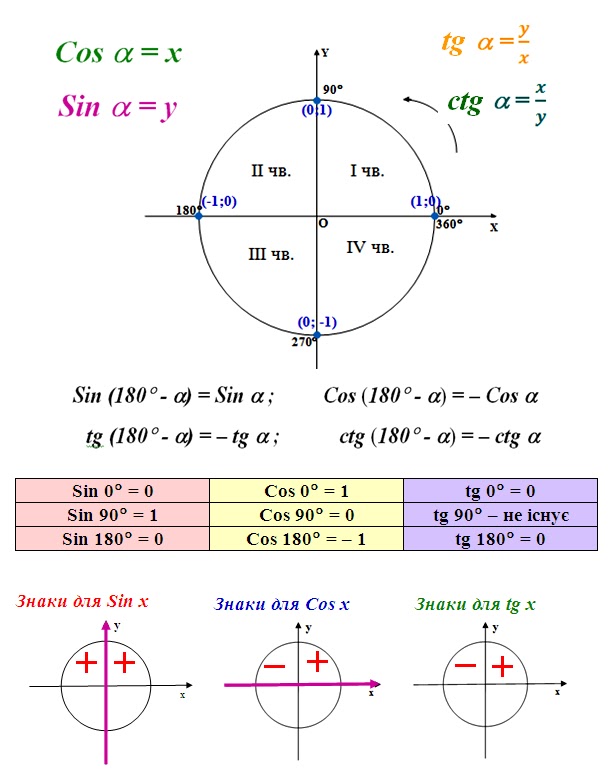 ч., для измерений и контроля температурного профиля в химических реакторах различных типов, в установках каталитического крекинга, гидроочистки, гидрокрекинга в ректификационных/фракционирующих колоннах при перегонке сырой нефти, а также в других установках.
ч., для измерений и контроля температурного профиля в химических реакторах различных типов, в установках каталитического крекинга, гидроочистки, гидрокрекинга в ректификационных/фракционирующих колоннах при перегонке сырой нефти, а также в других установках.
Описание
Принцип работы термопреобразователей основан на термоэлектрическом эффекте -генерировании термоэлектродвижущей силы (ТЭДС), возникающей из-за разности температур между двумя соединениями различных металлов или сплавов, образующих часть одной и той же цепи.
Конструктивно термопреобразователи представляют собой сборку нескольких одинарных или двойных термопар (от 2-х до 24-ти штук), изготовленных из термопарного кабеля с минеральной (MgO) изоляцией термоэлектродов и имеющего защитную оболочку из нержавеющей стали (марки 316) или инконеля (марки 600). Свободные концы термопар пронумерованы в соответствии с зоной расположения рабочего спая и выведены через монтажный фланец и кабельные вводы в соединительную коробку прямоугольной формы, изготовленную из нержавеющей стали или алюминия, внутри которой размещены контактные клеммы (зажимы) внешних цепей.
Свободные концы от термопар выведены через монтажный фланец и кабельные вводы в металлическую соединительную коробку прямоугольной формы, где пронумерованы в соответствии с зоной расположения рабочих спаев термопар. В соединительную коробку могут быть установлены измерительные преобразователи утвержденных типов. Конструкция и размеры коробки определяются количеством и типом измерительных преобразователей или контактных колодок. Термопреобразователи могут использоваться с дополнительной защитной гильзой, изготовленной из нержавеющей стали или других жаропрочных сплавов.
Термопреобразователи ADF-MULTI, CTG-MULTI, TC-MULTI различаются по конструктивному исполнению соединительной головки.
Фотография и чертеж общего вида ТП представлены на рисунках 1, 2.
Технические характеристики
Рабочий диапазон измерений, пределы допускаемых отклонений ТЭДС от НСХ термопреобразователей по ГОСТ Р 8.585-2001 (МЭК 60584-2) в температурном эквиваленте в зависимости от типа НСХ по ГОСТ Р 8. о
о
+1 о» +1
Таблица 2
|
Условное обозначение НСХ |
Класс допуска |
Рабочий диапазон измеряемых температур, °С |
Пределы допускаемых отклонений ТЭДС от НСХ, °С |
|
E |
2 |
от минус 40 до плюс 333 св. плюс 333 до плюс 900 |
± 2,5 ± 0,0075 t |
|
J |
2 |
от минус 40 до плюс 333 св. плюс 333 до плюс 750 |
± 2,5 ± 0,0075 t |
|
К |
2 |
от минус 40 до плюс 333 св. плюс 333 до плюс 1100 |
± 2,5 ± 0,0075 t |
Электрическое сопротивление изоляции при температуре (25±10)°С и относительной
влажности воздуха от 30 до 80 %, МОм (при 500 В), не менее……………………………….500
Количество чувствительных элементов в термопреобразователях, шт. : …….от 2 до 24
: …….от 2 до 24
Максимальная длина монтажной части термопреобразователей, мм:………………40000
Минимальный диаметр одного ТП (без защитной гильзы), мм:………………………….4
Рабочие условия эксплуатации термопреобразователей:
— температура окружающей среды, °С: ………………..от минус 40 до плюс 85;
— относительная влажность окружающего воздуха, %………………………….до 98
Средний срок службы, лет, не менее……………………………………………………10
По защищенности от воздействия окружающей среды ТП являются пыле-, влагозащищенными, и соответствуют коду IP65 и выше по ГОСТ 14254-96 (МЭК 60529).
Знак утверждения типа
Знак утверждения типа наносится на титульный лист эксплуатационной документации типографским способом, а также на шильдик, прикрепленный к ТП.
Комплектность
Преобразователь термоэлектрический (модификация и исполнение — в соответствии с заказом) — 1 шт.
Паспорт — 1 экз.
Руководство по эксплуатации и монтажу — 1 экз.
Поверка
осуществляется по ГОСТ 8.338-2002 «ГСИ. Преобразователи термоэлектрические. Методика поверки». ТП подлежат только первичной поверке при выпуске из производства.
Основные средства поверки:
— эталонные 1, 2, 3-го разрядов ТП типа ППО в диапазоне температур от плюс 300 до плюс 1200 °С;
— эталонные 2, 3-го разрядов ТП типа ПРО в диапазоне температур от плюс 600 до плюс 1800°С;
— термометр сопротивления ЭТС-100 эталонный 3 разряда с погрешностью по ГОСТ 8.558 в диапазоне температуры от минус 196 °С до плюс 660 °С;
— многоканальный прецизионный измеритель температуры МИТ 8.10 с пределами допускаемой основной абсолютной погрешности измерения напряжения ±(10-4 U+1) мкВ, где U -измеряемое напряжение, мВ; сопротивления ±(10-5R+5 10-4), где R — измеряемое сопротивление, Ом.
— термостат с флюидизированной средой FB-08, рабочий диапазон температур от плюс 50 до плюс 700 °С
— жидкостные термостаты переливного типа серии ТПП-1 с диапазоном температур от минус 60 до плюс 300 °С;
— горизонтальная трубчатая печь сопротивления типа МТП-2М с диапазоном температур от плюс 300 до плюс 1100 °С;
— вертикальная трубчатая печь сопротивления с максимальной рабочей температурой не менее 1800 °С.
Примечания: при поверке допускается применение других средств измерений и вспомогательного оборудования, удовлетворяющих по точности и техническим характеристикам требованиям ГОСТ 8.338-2002.
Сведения о методиках (методах) измерений приведены в соответствующем разделе паспорта и Руководства по эксплуатации и монтажу.
Нормативные и технические документы, устанавливающие требования к преобразователям термоэлектрическим многозонным ADF-MULTI, CTG-MULTI, TC-MULTI
ГОСТ 6616-94 Преобразователи термоэлектрические. Общие технические условия.
ГОСТ Р 8.585-2001 ГСИ. Термопары. Номинальные статические характеристики преобразования.
Международный стандарт МЭК 60584-1 Термопары. Часть 1. Градуировочные таблицы. Международный стандарт МЭК 60584-2 Термопары. Часть 2. Допуски.
Техническая документация фирмы-изготовителя.
ГОСТ 8.558-2009 ГСИ. Государственная поверочная схема для средств измерений температуры ГОСТ 8.338-2002 ГСИ. Преобразователи термоэлектрические.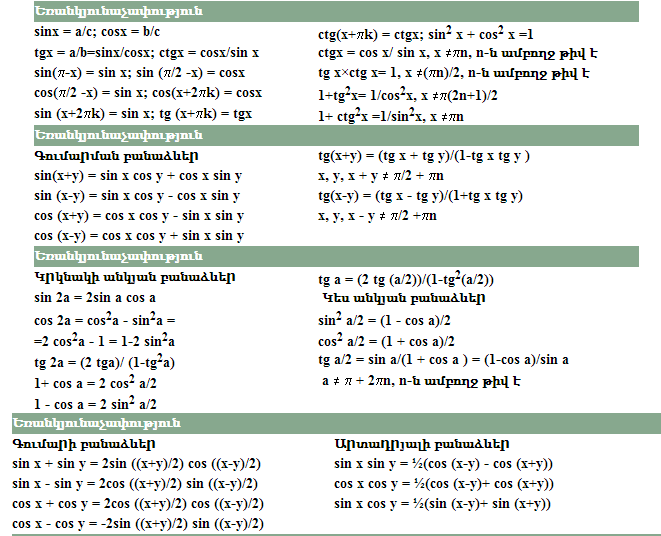 Методика поверки.
Методика поверки.
Рекомендации к применению
Осуществление производственного контроля за соблюдением установленных законодательством Российской Федерации требований промышленной безопасности к эксплуатации опасного производственного объекта.
ДНК со скольжением цепей, образованные длинными (CAG)*(CTG) повторами: повторы со скольжением и соединения со скольжением
. 2002 15 октября; 30 (20): 4534-47.
doi: 10.1093/nar/gkf572.
Кристофер Пирсон 1 , Мэнди Тэм, Юх-Хва Ван, С. Эрин Монтгомери, Арвин С. Дар, Джон Д. Клири, Керри Никол
принадлежность
- 1 Программа генетики и геномной биологии, Больница для больных детей, 555 University Avenue, Elm Wing 11-135, Торонто, Онтарио M5G 1X8, Канада.
 [email protected]
[email protected]
- PMID: 12384601
- PMCID: PMC137136
- DOI: 10.1093/нар/gkf572
Бесплатная статья ЧВК
Кристофер Э. Пирсон и соавт. Нуклеиновые Кислоты Res. .
Бесплатная статья ЧВК
. 2002 15 октября; 30 (20): 4534-47.
doi: 10.1093/nar/gkf572.
Авторы
Кристофер Пирсон 1 , Мэнди Тэм, Юх-Хва Ван, С. Эрин Монтгомери, Арвин Си Дар, Джон Д. Клири, Керри Никол
Эрин Монтгомери, Арвин Си Дар, Джон Д. Клири, Керри Никол
принадлежность
- 1 Программа генетики и геномной биологии, Больница для больных детей, 555 University Avenue, Elm Wing 11-135, Торонто, Онтарио M5G 1X8, Канада. [email protected]
- PMID: 12384601
- PMCID: PMC137136
- DOI: 10.1093/нар/gkf572
Абстрактный
Ассоциированная с заболеванием экспансия повторов (CTG)*(CAG), вероятно, связана с ДНК со скольжением цепей. Существует два типа скользящих ДНК (S-ДНК): скользящие гомодуплексные S-ДНК образуются между двумя цепями, имеющими одинаковое количество повторов; и гетеродуплексные проскальзывающие промежуточные соединения (SI-ДНК) образуются между двумя цепями, имеющими разное количество повторов. Мы представляем первую характеристику S-ДНК, образованных релевантными для заболевания длинами повторов (CTG) * (CAG), которые содержали все предсказанные компоненты, включая выскальзывающие повторы и выскальзывающие соединения, где два плеча трехстороннего соединения были состоит из комплементарных парных повторов. В S-ДНК множественные короткие выскальзывания повторов CTG или CAG происходили по всему тракту повторов. Поразительно, но в SI-ДНК большая часть избыточных повторов выскальзывает в предпочтительных местах вдоль дуплекса Уотсона-Крика, полностью спаренного основаниями, образуя определенные трехсторонние соединения выскальзывания. Неожиданно выскальзывающие повторы CAG и выскользнувшие CTG были преимущественно в конформациях случайной спирали и шпильки соответственно. И соединения, и выскальзывания могут быть распознаны белками, метаболизирующими ДНК: только цепь с избытком повторов была гиперчувствительна к расщеплению специфичной для соединения эндонуклеазой Т7 I, в то время как выскользнувший CAG предпочтительно связывался с одноцепочечным связывающим белком.
Мы представляем первую характеристику S-ДНК, образованных релевантными для заболевания длинами повторов (CTG) * (CAG), которые содержали все предсказанные компоненты, включая выскальзывающие повторы и выскальзывающие соединения, где два плеча трехстороннего соединения были состоит из комплементарных парных повторов. В S-ДНК множественные короткие выскальзывания повторов CTG или CAG происходили по всему тракту повторов. Поразительно, но в SI-ДНК большая часть избыточных повторов выскальзывает в предпочтительных местах вдоль дуплекса Уотсона-Крика, полностью спаренного основаниями, образуя определенные трехсторонние соединения выскальзывания. Неожиданно выскальзывающие повторы CAG и выскользнувшие CTG были преимущественно в конформациях случайной спирали и шпильки соответственно. И соединения, и выскальзывания могут быть распознаны белками, метаболизирующими ДНК: только цепь с избытком повторов была гиперчувствительна к расщеплению специфичной для соединения эндонуклеазой Т7 I, в то время как выскользнувший CAG предпочтительно связывался с одноцепочечным связывающим белком. . Наблюдалась превосходная корреляция размера выскальзывания S-ДНК и SI-ДНК с размером изменений длины путей, наблюдаемых в покоящихся и пролиферирующих тканях пораженных пациентов, что позволяет предположить, что S-ДНК и SI-ДНК являются мутагенными. промежуточные продукты в этих тканях, возникающие во время подверженного ошибкам метаболизма ДНК и ошибок репликационной вилки.
. Наблюдалась превосходная корреляция размера выскальзывания S-ДНК и SI-ДНК с размером изменений длины путей, наблюдаемых в покоящихся и пролиферирующих тканях пораженных пациентов, что позволяет предположить, что S-ДНК и SI-ДНК являются мутагенными. промежуточные продукты в этих тканях, возникающие во время подверженного ошибкам метаболизма ДНК и ошибок репликационной вилки.
Цифры
Рисунок 1
S-ДНК содержат участки не-B-ДНК.…
Рисунок 1
S-ДНК содержат участки не-B-ДНК. ( A ) Последовательность распознавания…
фигура 1 S-ДНК содержат участки не-B-ДНК. ( A ) Последовательность узнавания рестриктазы Bbv I многократно повторяется в тракте повторов CTG/CAG. Фланговые неповторяющиеся последовательности показаны строчными буквами, а повторяющиеся — прописными. Стрелки указывают ожидаемые и подтвержденные участки расщепления. ( B ) 32 P-меченые (CTG) 15 или (CAG) 15 олигонуклеотиды расщепляли Bbv I по отдельности или в виде гибридизированной смеси. Продукты разделяли на геле для секвенирования. В одиночку ни один из них не был восприимчив к Bbv I пищеварения, а дуплекс (CTG) 15 ·(CAG) 15 был. Исходные ДНК (–) и продукты переваривания Bbv I (+). Местоположение повтора указано как для 32 P-меченых (CTG) 15 , так и для (CAG) 15 олигонуклеотидов; относительная интенсивность продукта варьируется в зависимости от конечного эффекта. ( C ) Гель-очищенный Eco RI– Hin линейная форма dIII (L), S-ДНК (S) и SI-ДНК (SI) уникально радиоактивно меченые в 9Сайт 0095 Eco RI на нитях CTG или CAG расщепляли Bbv I (Материалы и методы) и продукты разделяли на денатурирующих акриламидных гелях.
Фланговые неповторяющиеся последовательности показаны строчными буквами, а повторяющиеся — прописными. Стрелки указывают ожидаемые и подтвержденные участки расщепления. ( B ) 32 P-меченые (CTG) 15 или (CAG) 15 олигонуклеотиды расщепляли Bbv I по отдельности или в виде гибридизированной смеси. Продукты разделяли на геле для секвенирования. В одиночку ни один из них не был восприимчив к Bbv I пищеварения, а дуплекс (CTG) 15 ·(CAG) 15 был. Исходные ДНК (–) и продукты переваривания Bbv I (+). Местоположение повтора указано как для 32 P-меченых (CTG) 15 , так и для (CAG) 15 олигонуклеотидов; относительная интенсивность продукта варьируется в зависимости от конечного эффекта. ( C ) Гель-очищенный Eco RI– Hin линейная форма dIII (L), S-ДНК (S) и SI-ДНК (SI) уникально радиоактивно меченые в 9Сайт 0095 Eco RI на нитях CTG или CAG расщепляли Bbv I (Материалы и методы) и продукты разделяли на денатурирующих акриламидных гелях. Показаны схемы очищенных ДНК и расположение уникальных радиоактивных меток, обозначенных закрашенными ромбами. Каждая из комплементарных цепей (CTG и CAG), содержащая либо 30, либо 50 повторов, анализировалась индивидуально в каждой из шести возможных структур. Лестницы секвенирования Максама и Гилберта (G>A) указывали положения нуклеотидов и указывали количество повторов, которые читались 5’→3′, так что первая повторяющаяся единица CTG соответствует последней повторяющейся единице CAG. Только (КТГ) 9Нити 0101 50 и (CAG) 50 в SI-ДНК демонстрировали определенные области защиты (обозначены скобками). Показан анализ цепи CTG 2 P, меченной на 5′-конце ( Eco RI). Анализ цепи CAG дал аналогичные результаты. Анализ каждой нити в каждой из структурных конформаций обобщен на рисунке 4.
Показаны схемы очищенных ДНК и расположение уникальных радиоактивных меток, обозначенных закрашенными ромбами. Каждая из комплементарных цепей (CTG и CAG), содержащая либо 30, либо 50 повторов, анализировалась индивидуально в каждой из шести возможных структур. Лестницы секвенирования Максама и Гилберта (G>A) указывали положения нуклеотидов и указывали количество повторов, которые читались 5’→3′, так что первая повторяющаяся единица CTG соответствует последней повторяющейся единице CAG. Только (КТГ) 9Нити 0101 50 и (CAG) 50 в SI-ДНК демонстрировали определенные области защиты (обозначены скобками). Показан анализ цепи CTG 2 P, меченной на 5′-конце ( Eco RI). Анализ цепи CAG дал аналогичные результаты. Анализ каждой нити в каждой из структурных конформаций обобщен на рисунке 4.
Рисунок 2
S-ДНК содержат участки одноцепочечной…
Рисунок 2
S-ДНК содержат участки одноцепочечной ДНК. ( A ) MBN специально распознает одноцепочечные…
( A ) MBN специально распознает одноцепочечные…
S-ДНК содержат участки одноцепочечной ДНК. ( A ) MBN специфически распознает одноцепочечную ДНК; стрелки указывают на наблюдаемые участки разрыва. ( Б – E ) Гель-очищенный Hin dIII– Eco RI линейная форма (L), S-ДНК (S) и SI-ДНК (SI) однозначно радиоактивно меченые в сайте Hin dIII либо на Цепи CTG или CAG расщепляли MBN (Материалы и методы) и продукты разделяли на денатурирующих акриламидных гелях. Показаны схемы очищенных ДНК и расположение уникальных радиоактивных меток, обозначенных полыми или заполненными ромбами. Каждая из комплементарных цепей (CTG и CAG), содержащая либо 30, либо 50 повторов, анализировалась отдельно в каждой из очищенных структур. Лестницы секвенирования (не показаны) указывают положения нуклеотидов, а указанные номера повторов считываются 5’→3′, так что первая повторяющаяся единица CTG соответствует последней повторяющейся единице CAG. Продукты переваривания линейных форм не обнаружены. Только более длинные нити из 50 повторов в SI-ДНК демонстрировали специфические области гиперчувствительности (обозначенные стрелками и скобками). В то время как гиперчувствительные участки локализованы, на (CAG) 9 их больше.0101 50 , чем на цепочке (CTG) 50 . Анализ каждой нити в каждой из структурных конформаций обобщен на рисунке 4.
Продукты переваривания линейных форм не обнаружены. Только более длинные нити из 50 повторов в SI-ДНК демонстрировали специфические области гиперчувствительности (обозначенные стрелками и скобками). В то время как гиперчувствительные участки локализованы, на (CAG) 9 их больше.0101 50 , чем на цепочке (CTG) 50 . Анализ каждой нити в каждой из структурных конформаций обобщен на рисунке 4.
Рисунок 3
S-ДНК содержат соединения ДНК. (…
Рисунок 3
S-ДНК содержат соединения ДНК. ( A ) Бактериофаг T7endoI специфически распознает трехстороннюю…
Рисунок 3 S-ДНК содержат соединения ДНК. ( A ) Бактериофаг T7endoI специфически распознает трехсторонние и четырехсторонние соединения ДНК; стрелки указывают места разрыва. ( B – E ) Гель-очищенный Hin dIII– Eco RI линейная форма (L), S-ДНК (S) и SI-ДНК (SI) структуры с уникальной радиоактивной меткой в сайте Hin dIII либо на цепях CTG, либо на цепях CAG расщепляли с помощью T7endoI (Материалы и методы) и продукты разделяли на денатурирующих акриламидных гелях. Показаны схемы очищенных ДНК и расположение уникальных радиоактивных меток, обозначенных полыми или заполненными ромбами. Каждая из комплементарных цепей (CTG и CAG), содержащая либо 30, либо 50 повторов, анализировалась отдельно в каждой из очищенных структур. Исходные ДНК (–) и продукты расщепления T7endoI (+). Лестницы секвенирования (не показаны) указывают положения нуклеотидов, а указанные номера повторов считываются 5’→3′, так что первая повторяющаяся единица CTG соответствует последней повторяющейся единице CAG. Для линейных форм (не показаны) продуктов переваривания обнаружено не было. Только более длинная цепь из 50 повторов в SI-ДНК демонстрировала специфические области гиперчувствительности (обозначенные скобками), разграниченные участками пиков (обозначенные стрелками).
( B – E ) Гель-очищенный Hin dIII– Eco RI линейная форма (L), S-ДНК (S) и SI-ДНК (SI) структуры с уникальной радиоактивной меткой в сайте Hin dIII либо на цепях CTG, либо на цепях CAG расщепляли с помощью T7endoI (Материалы и методы) и продукты разделяли на денатурирующих акриламидных гелях. Показаны схемы очищенных ДНК и расположение уникальных радиоактивных меток, обозначенных полыми или заполненными ромбами. Каждая из комплементарных цепей (CTG и CAG), содержащая либо 30, либо 50 повторов, анализировалась отдельно в каждой из очищенных структур. Исходные ДНК (–) и продукты расщепления T7endoI (+). Лестницы секвенирования (не показаны) указывают положения нуклеотидов, а указанные номера повторов считываются 5’→3′, так что первая повторяющаяся единица CTG соответствует последней повторяющейся единице CAG. Для линейных форм (не показаны) продуктов переваривания обнаружено не было. Только более длинная цепь из 50 повторов в SI-ДНК демонстрировала специфические области гиперчувствительности (обозначенные скобками), разграниченные участками пиков (обозначенные стрелками). Анализ каждой нити в каждой из структурных конформаций суммирован на рисунке 4.
Анализ каждой нити в каждой из структурных конформаций суммирован на рисунке 4.
Рисунок 4
Резюме ферментативного зондирования…
Рисунок 4
Резюме ферментативного исследования S-ДНК. ( A ) Очищенные гелем ДНК были структурно…
Рисунок 4 Резюме ферментативного зондирования S-ДНК. ( A ) Очищенные гелем ДНК структурно исследовали с помощью Bbv I, MBN или T7endoI, как показано на рисунках 11–3. Каждая из комплементарных цепей (CTG и CAG), содержащая либо 30, либо 50 повторов, анализировалась индивидуально в каждой из гель-очищенных структур; линейная форма (L), ускользающие гомодуплексы S-ДНК (S) и ускользающие промежуточные гетеродуплексы SI-ДНК (SI). Нити (C T / A G) 30 и (C T / A G) 50 показаны неповторяющимися боковыми сторонами в виде тонких линий, а повторяющиеся участки — жирными линиями. Центр повторных трактов указан стрелками. Для SI-ДНК каждая из комплементарных цепей выровнена от центра повторяющихся участков. Каждый разрезной участок обозначен вертикальной чертой; относительная интенсивность спайности представлена высотой столбца (Материалы и методы).
Центр повторных трактов указан стрелками. Для SI-ДНК каждая из комплементарных цепей выровнена от центра повторяющихся участков. Каждый разрезной участок обозначен вертикальной чертой; относительная интенсивность спайности представлена высотой столбца (Материалы и методы).
Рисунок 5
Электронно-микроскопические анализы S-ДНК…
Рисунок 5
Электронно-микроскопические анализы S-ДНК +/– SSB. ( A – D ) Электрон…
Рисунок 5 Электронно-микроскопические анализы S-ДНК +/– SSB. ( А – D ) Электронно-микроскопические анализы гель-очищенных (CTG) 50 ·(CAG) 50 ДНК; линейная форма (L), соскользнувший гомодуплекс S-ДНК (S) и (CTG) 50 · (CAG) 30 и (CTG) 30 · (CAG) 50 соскользнувшие промежуточные гетеродуплексы (SI). Тракты повторов содержатся на фрагменте Nde I– Hin dIII, который имеет 265 и 63 п.н. 5′ и 3′, соответственно, тракта (CTG) n . На крайних левых панелях показаны схематические изображения структур ДНК, на средних панелях показаны микрофотографии гель-очищенных образцов «голой» ДНК, а на крайних правых панелях показаны микрофотографии тех же ДНК в присутствии одноцепочечного связывающего белка (+ ССБ). Подробности смотрите в тексте. Микрофотографии показаны в обратном контрасте. Полоса размера в правом нижнем углу составляет 122 нм. ( E ) Резюме анализов одноцепочечного связывания; качественный и количественный анализы связывания SSB были определены и сведены в таблицу. ( F и G ) Электронно-микроскопический анализ гель-очищенных родственных SI-ДНК (CTG) 50 ·(CAG) 17 и (CTG) 17 ·(CAG) 50 . Повторы содержатся в том же фрагменте Nde I– Hin dIII, что и для (A–D).
Тракты повторов содержатся на фрагменте Nde I– Hin dIII, который имеет 265 и 63 п.н. 5′ и 3′, соответственно, тракта (CTG) n . На крайних левых панелях показаны схематические изображения структур ДНК, на средних панелях показаны микрофотографии гель-очищенных образцов «голой» ДНК, а на крайних правых панелях показаны микрофотографии тех же ДНК в присутствии одноцепочечного связывающего белка (+ ССБ). Подробности смотрите в тексте. Микрофотографии показаны в обратном контрасте. Полоса размера в правом нижнем углу составляет 122 нм. ( E ) Резюме анализов одноцепочечного связывания; качественный и количественный анализы связывания SSB были определены и сведены в таблицу. ( F и G ) Электронно-микроскопический анализ гель-очищенных родственных SI-ДНК (CTG) 50 ·(CAG) 17 и (CTG) 17 ·(CAG) 50 . Повторы содержатся в том же фрагменте Nde I– Hin dIII, что и для (A–D). Увеличение для всех панелей одинаковое. Крайние левые панели показывают схематические изображения структур ДНК. Верхние изображения (F) и (G) показывают разветвленные молекулы с определенным трехсторонним соединением выскальзывания с выскальзыванием в конформации шпильки. На нижних панелях показаны молекулы без ответвлений, наблюдаемые в том же очищенном гелем образце SI-ДНК. На нижней микрофотографии (F) видны как «безразветвленная», так и «разветвленная» молекула. «Безветвящиеся» молекулы имели длину, аналогичную длине n = 17 линейная форма (не показана), которая электрофоретически мигрировала значительно быстрее, чем SI-ДНК. Указана относительная доля ветвящихся и безветвистых видов в данной пробе.
Увеличение для всех панелей одинаковое. Крайние левые панели показывают схематические изображения структур ДНК. Верхние изображения (F) и (G) показывают разветвленные молекулы с определенным трехсторонним соединением выскальзывания с выскальзыванием в конформации шпильки. На нижних панелях показаны молекулы без ответвлений, наблюдаемые в том же очищенном гелем образце SI-ДНК. На нижней микрофотографии (F) видны как «безразветвленная», так и «разветвленная» молекула. «Безветвящиеся» молекулы имели длину, аналогичную длине n = 17 линейная форма (не показана), которая электрофоретически мигрировала значительно быстрее, чем SI-ДНК. Указана относительная доля ветвящихся и безветвистых видов в данной пробе.
Рисунок 6
Структурные особенности ДНК с проскальзыванием цепи…
Рисунок 6
Структурные особенности скользящих цепей ДНК. Схематические модели S-ДНК, SI-ДНК, выскальзывающих повторов и…
Схематические модели S-ДНК, SI-ДНК, выскальзывающих повторов и…
Структурные особенности скользящих цепей ДНК. Схематические модели S-ДНК, SI-ДНК, выскальзывающих повторов и выскальзывающих соединений, основанные на зондировании Bbv I, MBN, T7endoI (рис. 1–3, обобщены на рис. 4), связывании SSB и электронном микроскопические анализы (рис. 5). ( A ) Гомодуплекс S-ДНК с множественными небольшими выскальзываниями (3–10 повторов), образованными по всему повторному тракту. ( B ) Гетеродуплекс, SI-ДНК. (КТГ) 30 ·(CAG) 50 SI-ДНК экструдировала 25-й CAG-повторы до 45-го, тогда как сестринская SI-ДНК (CTG) 50 ·(CAG) 30 экструдировала 10-й CTG-повторы до 30-го. Предпочтительные сайты расщепления MBN и T7endoI обозначены номерами повторяющихся звеньев (читать 5’→3′, так что первое повторяющееся звено CTG соответствует последнему повторяющемуся звену CAG). ( C ) Схематическое изображение двух возможных конформаций выскальзывающих повторов. Размер стрелок отражает наблюдаемые относительные пропорции каждого из них. ( D ) Конструкции выскальзывающего соединения. Показаны три возможные схемы спаривания оснований в трехсторонних переходах. В зависимости от нуклеотида при обмене плечами Уотсона-Крика и выскальзывания, соединения могут быть полностью спаренными основаниями или могут содержать одно или два несовпадающих основания на цепи, противоположной выскальзывающим повторам. Полностью спаренные и две непарные изоформы основного соединения могут легко меняться местами.
( C ) Схематическое изображение двух возможных конформаций выскальзывающих повторов. Размер стрелок отражает наблюдаемые относительные пропорции каждого из них. ( D ) Конструкции выскальзывающего соединения. Показаны три возможные схемы спаривания оснований в трехсторонних переходах. В зависимости от нуклеотида при обмене плечами Уотсона-Крика и выскальзывания, соединения могут быть полностью спаренными основаниями или могут содержать одно или два несовпадающих основания на цепи, противоположной выскальзывающим повторам. Полностью спаренные и две непарные изоформы основного соединения могут легко меняться местами.
См. это изображение и информацию об авторских правах в PMC
Похожие статьи
Скользящие (CTG). (CAG) повторы локуса миотонической дистрофии: зондирование поверхности анти-ДНК-антителами.
Тэм М., Эрин Монтгомери С.
 , Кекис М., Столлар Б.Д., Прайс ГБ, Пирсон СЕ.
Там М. и др.
Дж Мол Биол. 2003 г., 19 сентября; 332 (3): 585-600. doi: 10.1016/s0022-2836(03)00880-5.
Дж Мол Биол. 2003.
PMID: 12963369
, Кекис М., Столлар Б.Д., Прайс ГБ, Пирсон СЕ.
Там М. и др.
Дж Мол Биол. 2003 г., 19 сентября; 332 (3): 585-600. doi: 10.1016/s0022-2836(03)00880-5.
Дж Мол Биол. 2003.
PMID: 12963369Взаимопревращающиеся конформации соскользнувших соединений ДНК, образованные тринуклеотидными повторами, влияют на результат репарации.
Slean MM, Reddy K, Wu B, Nichol Edamura K, Kekis M, Nelissen FH, Aspers RL, Tessari M, Schärer OD, Wijmenga SS, Pearson CE. Слин М.М. и др. Биохимия. 2013 5 февраля; 52 (5): 773-85. дои: 10.1021/bi301369b. Epub 2013 22 января. Биохимия. 2013. PMID: 23339280 Бесплатная статья ЧВК.
MSh3 человека связывается со структурами ДНК с тринуклеотидными повторами, связанными с нейродегенеративными заболеваниями.

Пирсон К.Э., Эвел А., Ачарья С., Фишел Р.А., Синден Р.Р. Пирсон К.Э. и др. Хум Мол Жене. 1997 г., июль; 6(7):1117-23. дои: 10.1093/hmg/6.7.1117. Хум Мол Жене. 1997. PMID:
83Структуры ДНК со скользящими цепями.
Синден Р.Р., Питлос-Синден М.Дж., Потаман В.Н. Синден Р.Р. и соавт. Фронт биосай. 2007 1 сентября; 12: 4788-99. дои: 10.2741/2427. Фронт биосай. 2007. PMID: 17569609 Обзор.
Связанная с заболеванием повторная нестабильность и репарация несоответствия.
Schmidt MHM, Pearson CE. Шмидт М.Х.М. и др. Восстановление ДНК (Amst). 2016 Февраль; 38: 117-126. doi: 10.1016/j.dnarep.2015.11.008. Epub 2015 12 декабря. Восстановление ДНК (Amst). 2016. PMID: 26774442 Обзор.

Посмотреть все похожие статьи
Цитируется
Взаимодействие FAN1-MLh2 влияет на репарацию межцепочечных поперечных связей ДНК и повторов соскользнувших CAG/CTG.
Порро А., Мохиуддин М., Зурфлух С., Спегг В., Дай Дж., Ил Ф., Ропарс В., Коллотта Г., Фишвик К.М., Мозаффари Н.Л., Геруа Р., Жирични Дж., Альтмейер М., Шарбонье Дж.Б., Пирсон К.Э., Сартори А.А. Порро А. и др. Научная реклама 2021 июль 30;7(31):eabf7906. doi: 10.1126/sciadv.abf7906. Печать 2021 июль. Научная реклама 2021. PMID: 34330701 Бесплатная статья ЧВК.
Универсальный целевой экран для обнаружения двунаправленных ингибиторов транскрипции заболевания тринуклеотидных повторов.
Hagler LD, Krueger SB, Luu LM, Lanzendorf AN, Mitchell NL, Vergara JI, Curet LD, Zimmerman SC.
 Хаглер Л.Д. и соавт.
ACS Med Chem Lett. 2021 21 мая;12(6):935-940. doi: 10.1021/acsmedchemlett.1c00064. электронная коллекция 2021 10 июня.
ACS Med Chem Lett. 2021.
PMID: 34141072
Бесплатная статья ЧВК.
Хаглер Л.Д. и соавт.
ACS Med Chem Lett. 2021 21 мая;12(6):935-940. doi: 10.1021/acsmedchemlett.1c00064. электронная коллекция 2021 10 июня.
ACS Med Chem Lett. 2021.
PMID: 34141072
Бесплатная статья ЧВК.Конформационная и миграционная динамика трехсторонних соединений скользящей цепи ДНК, содержащих тринуклеотидные повторы.
Ху Т., Мортен М.Дж., Магеннис С.В. Ху Т и др. Нац коммун. 2021 8 января; 12 (1): 204. doi: 10.1038/s41467-020-20426-3. Нац коммун. 2021. PMID: 33420051 Бесплатная статья ЧВК.
Топоизомераза II вносит вклад в двуцепочечные разрывы ДНК, опосредованные вторичной структурой.
Шлахта К., Манукян А., Раймер Х.М., Сингх С., Саламон А., Го В., Лобачев К.С., Ван Ю.Х. Шлахта К.
 и др.
Нуклеиновые Кислоты Res. 2020 9 июля; 48 (12): 6654-6671. дои: 10.1093/нар/гкаа483.
Нуклеиновые Кислоты Res. 2020.
PMID: 32501506
Бесплатная статья ЧВК.
и др.
Нуклеиновые Кислоты Res. 2020 9 июля; 48 (12): 6654-6671. дои: 10.1093/нар/гкаа483.
Нуклеиновые Кислоты Res. 2020.
PMID: 32501506
Бесплатная статья ЧВК.Небольшая ДНК-связывающая молекула соскользнувшего CAG индуцирует сокращения тринуклеотидных повторов in vivo.
Накамори М., Паниграхи ГБ, Ланни С., Галл-Дункан Т., Хаякава Х., Танака Х., Луо Дж., Отабэ Т., Ли Дж., Саката А., Карон М.С., Джоши Н., Прасолава Т., Чан К., Массон Дж.Й., Уолд MS, Wang X, Lee MYWT, Huddleston J, Munson KM, Davidson S, Layeghifard M, Edward LM, Gallon R, Santibanez-Koref M, Murata A, Takahashi MP, Eichler EE, Shlien A, Nakatani K, Mochizuki H, Pearson СЕ. Накамори М. и соавт. Нат Жене. 2020 фев; 52 (2): 146-159. doi: 10.1038/s41588-019-0575-8. Epub 2020 14 февраля. Нат Жене. 2020. PMID: 32060489 Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
вещества
Грантовая поддержка
- R01 CA085826/CA/NCI NIH HHS/США
- CA85826/CA/NCI NIH HHS/США
ДНК со скольжением цепей, образованные длинными (CAG)·(CTG) повторами: повторы с выскальзыванием и соединения с выскальзыванием
1. Cummings C.J. and Zoghbi, H.Y. (2000) Четырнадцать и подсчет: распутывание болезней тринуклеотидных повторов. Гум. Мол. Генетика., 9, 909–916. [PubMed] [Google Scholar]
Cummings C.J. and Zoghbi, H.Y. (2000) Четырнадцать и подсчет: распутывание болезней тринуклеотидных повторов. Гум. Мол. Генетика., 9, 909–916. [PubMed] [Google Scholar]
2. Ричардс Р.И. и Сазерленд Г.Р. (1992) Динамические мутации: новый класс мутаций, вызывающих болезни человека. Ячейка, 70, 709–712. [PubMed] [Google Scholar]
3. Синден Р. Р. (2001) Нейродегенеративные заболевания. Истоки нестабильности. Природа, 411, 757–758. [PubMed] [Google Scholar]
4. Чонг С.С., МакКолл А.Е., Кота Дж., Субрамони С.Х., Орр Х.Т., Хьюз М.Р. и Зогби, Х.Ю. (1995)Гаметическая и соматическая тканеспецифическая гетерогенность расширенного повтора SCA1 CAG при спиноцеребеллярной атаксии типа 1. Nature Genet., 10, 344–350. [PubMed] [Академия Google]
5. Марторелл Л., Монктон Д.Г., Гамез Дж., Джонсон К.Дж., Гич И., де Мунен А.Л. и Байгет, М. (1998) Прогрессирование гетерогенности длины соматических повторов CTG в клетках крови больных миотонической дистрофией. Гум. Мол. Генетика. , 7, 307–312. [PubMed] [Google Scholar]
, 7, 307–312. [PubMed] [Google Scholar]
6. Телениус Х., Кремер Б., Голдберг Ю.П., Тейлманн Дж., Эндрю С.Е., Цейслер Дж., Адам С., Гринберг С., Айвз, Э.Дж., Кларк, Л.А. и др. . (1994)Соматический и гонадный мозаицизм гена болезни Гентингтона CAG повторяется в головном мозге и сперме. Nature Genet., 6, 409–414. [PubMed] [Google Scholar]
7. Thornton C.A., Johnson,K. и Moxley, R.T., III (1994). Пациенты с миотонической дистрофией имеют большее расширение CTG в скелетных мышцах, чем в лейкоцитах. Анна. Неврол., 35, 104–107. [PubMed] [Google Scholar]
8. Хасида Х., Гото Дж., Курисаки Х., Мизусава Х. и Канадзава, И. (1997)Региональные различия в экспансии повтора CAG при спиноцеребеллярных атаксиях: дентаторубрально-паллидолуизианская атрофия, болезнь Мачадо-Джозефа и спиноцеребеллярная атаксия типа 1. Ann. Нейрол., 41, 505–511. [PubMed] [Академия Google]
9. Такано Х., Онодера О., Такахаси Х., Игараси С., Ямада М., Ояке М., Икеучи Т., Коиде Р., Танака Х. , Ивабути, К. и Цудзи, С. (1996)Соматический мозаицизм расширенных повторов CAG в головном мозге пациентов с дентаторубрально-паллидолуизовой атрофией: динамика митотической нестабильности, зависящая от клеточной популяции. Являюсь. Дж. Хам. Генетика., 58, 1212–1222. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Ивабути, К. и Цудзи, С. (1996)Соматический мозаицизм расширенных повторов CAG в головном мозге пациентов с дентаторубрально-паллидолуизовой атрофией: динамика митотической нестабильности, зависящая от клеточной популяции. Являюсь. Дж. Хам. Генетика., 58, 1212–1222. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Танака Ф., Собуэ Г., Дою М., Ито Ю., Ямамото М., Шимада Н., Ямамото К., Рику С., Хсидзуме Ю. и Мицума, Т. (1996) Дифференциальный паттерн тканеспецифического соматического мозаицизма расширенных тринуклеотидных повторов CAG при дентаторубро-паллидолуизовой атрофии, болезни Мачадо-Джозефа и рецессивной спинальной и бульбарной мышечной атрофии, сцепленной с Х-хромосомой. Дж. Нейрол. наук, 135, 43–50. [PubMed] [Google Scholar]
11. Martorell L., Johnson,K., Boucher,C.A. и Байгет, М. (1997)Соматическая нестабильность миотонической дистрофии (CTG) n повторов во время развития плода человека. Гум. Мол. Генетика., 6, 877–880. [PubMed] [Академия Google]
12. Ворле Д., Кеннеркнехт И., Вольф М., Эндерс Х., Швеммле С. и Штейнбах, П. (1995) Heterogeneity of DM kinase Repeat Repeat в различных тканях плода и дальнейшее распространение во время клеточной пролиферации in vitro : свидетельство случайного участия метил-направленной репарации несоответствия ДНК в стабильности триплетных повторов. Гум. Мол. Генетика., 4, 1147–1153. [PubMed] [Google Scholar]
Ворле Д., Кеннеркнехт И., Вольф М., Эндерс Х., Швеммле С. и Штейнбах, П. (1995) Heterogeneity of DM kinase Repeat Repeat в различных тканях плода и дальнейшее распространение во время клеточной пролиферации in vitro : свидетельство случайного участия метил-направленной репарации несоответствия ДНК в стабильности триплетных повторов. Гум. Мол. Генетика., 4, 1147–1153. [PubMed] [Google Scholar]
13. Клири Дж.Д., Николь К., Ван Ю. и Пирсон, К.Е. (2002) Свидетельство цис — действующие факторы в опосредованной репликацией нестабильности тринуклеотидных повторов в клетках приматов. Nature Genet., 31, 37–46. [PubMed] [Google Scholar]
14. Паниграхи Г.Б., Клири, Д.Д. и Пирсон, К.Е. (2002) In vitro (CTG). (CAG) экспансии и делеции экстрактами клеток человека. Дж. Биол. Chem., 277, 13926–13934. [PubMed] [Google Scholar]
15. Bowater R.P. and Wells, R.D. (2001) Нестабильная жизнь триплетных повторов ДНК, связанная с наследственными заболеваниями человека. прог. Нуклеиновая Кислота Рез. Мол. биол., 66, 159–202. [PubMed] [Google Scholar]
прог. Нуклеиновая Кислота Рез. Мол. биол., 66, 159–202. [PubMed] [Google Scholar]
16. Wells RD (1996) Молекулярные основы генетической нестабильности триплетных повторов. Дж. Биол. Chem., 271, 2875–2878. [PubMed] [Google Scholar]
17. Пирсон К.Э. и Синден Р.Р. (1998) Структуры ДНК с тринуклеотидными повторами: динамические мутации из динамической ДНК. Курс. мнение Структура биол., 8, 321–330. [PubMed] [Google Scholar]
18. McMurray C.T. (1999) Вторичная структура ДНК: общий и причинный фактор распространения болезней человека. проц. Натл акад. науч. США, 96, 1823–1825 гг. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Pearson C.E., Ewel,A., Acharya,S., Fishel,R.A. и Синден, Р.Р. (1997) MSh3 человека связывается со структурами ДНК с тринуклеотидными повторами, связанными с нейродегенеративными заболеваниями. Гум. Мол. Ген., 6, 1117–1123. [PubMed] [Google Scholar]
20. Четсанга С.Дж., Бойд В., Петерсон Л. и Рашлоу, К. (1975)Одноцепочечные участки ДНК старых мышей. Природа, 253, 130–131. [PubMed] [Google Scholar]
Природа, 253, 130–131. [PubMed] [Google Scholar]
21. Наканиси К., Сима А., Фукуда М. и Фуджита, С. (1979) Связанное с возрастом увеличение одноцепочечных участков ДНК клеток мозга и печени мышей. мех. Старение Дев., 10, 273–281. [PubMed] [Google Scholar]
22. Прайс Г.Б., Модак, С.П. и Макинодан, Т. (1971) Возрастные изменения в ДНК тканей мыши. Наука, 171, 917–920. [PubMed] [Google Scholar]
23. Джонсон Р. и Стрелер, Б.Л. (1972) Потеря генов, кодирующих рибосомную РНК, в стареющих клетках мозга. Природа, 240, 412–414. [PubMed] [Google Scholar]
24. Стрелер Б.Л. и Чанг, член парламента (1979) Потеря гибридизуемой рибосомной ДНК из постмитотических тканей человека при старении: II. Сравнение возрастных потерь в коре головного мозга человека, гиппокампе и соматосенсорной коре. мех. Старение Дев., 11, 379–382. [PubMed] [Google Scholar]
25. Стрелер Б.Л., Чанг, М.П. и Джонсон, Л.К. (1979) Потеря гибридизуемой рибосомной ДНК из постмитотических тканей человека в процессе старения: I. Зависимая от возраста потеря в миокарде человека. мех. Старение Дев., 11, 371–378. [PubMed] [Google Scholar]
Зависимая от возраста потеря в миокарде человека. мех. Старение Дев., 11, 371–378. [PubMed] [Google Scholar]
26. Гейси А.М., Гоэллнер Г., Юраник Н., Макура С. и МакМюррей, К.Т. (1995) Тринуклеотидные повторы, которые увеличиваются в размерах при заболеваниях человека, образуют шпилечные структуры in vitro . Ячейка, 81, 533–540. [PubMed] [Google Scholar]
27. Петрушка Дж., Арнхейм, Н. и Гудман, М.Ф. (1996) Стабильность внутрицепочечных структур шпилек, образованных триплетными повторами ДНК класса CAG/CTG, ассоциированными с неврологическими заболеваниями. Nucleic Acids Res., 24, 1992–1998. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Pearson C.E. and Sinden, R.R. (1998) В Уэллсе, Р.Д. и Уоррен, С.Т. (ред.), Генетическая нестабильность и наследственные неврологические заболевания , 1-е изд. Academic Press, Нью-Йорк, стр. 585–621.
29. Лилли Д.М. (2000) Структуры спиральных соединений в нуклеиновых кислотах. Q. Rev. Biophys. , 33, 109–159. [PubMed] [Google Scholar]
, 33, 109–159. [PubMed] [Google Scholar]
30. Лилли Д.М. и Уайт, М.Ф. (2001) Ферменты, расщепляющие соединения. Природа Преподобный Мол. Cell Biol., 2, 433–443. [PubMed] [Google Scholar]
31. Pearson C.E. and Sinden, R.R. (1996) Альтернативные структуры в дуплексной ДНК, образованные в тринуклеотидных повторах локусов миотонической дистрофии и ломкой Х. Биохимия, 35, 5041–5053. [PubMed] [Академия Google]
32. Пирсон К.Э., Эйхлер Э.Э., Лоренцетти Д., Крамер С.Ф., Зогби Х.Ю., Нельсон Д.Л. и Синден, Р.Р. (1998) Прерывания в триплетных повторах SCA1 и FRAXA снижают склонность и сложность образования ДНК с проскальзыванием (S-DNA). Биохимия, 37, 2701–2708. [PubMed] [Google Scholar]
33. Pearson C.E., Wang, Y.H., Griffith, J.D. и Синден, Р.Р. (1998) Структурный анализ ДНК с скользящей цепью (S-DNA), образованной в (CTG)n. (CAG)n повторяется из локуса миотонической дистрофии. Nucleic Acids Res., 26, 816–823. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Шибальский В., Ким С.К., Хасан Н. и Подхайска, А.Дж. (1991) Рестриктазы класса IIS — обзор. Джин, 100, 13–26. [PubMed] [Google Scholar]
Шибальский В., Ким С.К., Хасан Н. и Подхайска, А.Дж. (1991) Рестриктазы класса IIS — обзор. Джин, 100, 13–26. [PubMed] [Google Scholar]
35. Winkle S.A., Aloyo, M.C., Morales, N., Zambrano, T.Y. и Ширди, Р.Д. (1991) Повышенная реактивность соединения B-Z для расщепления ферментом рестрикции Mbo I. Biochemistry, 30, 10601–10606. [PubMed] [Google Scholar]
36. Подгайска А.Ю. и Шибальский, В. (1985) Преобразование эндонуклеазы FokI в универсальный фермент рестрикции: расщепление ДНК фага M13mp7 в заранее определенных местах. Джин, 40, 175–182. [PubMed] [Академия Google]
37. Мурчие А.И., Португалия, Дж. и Лилли, Д.М. (1991) Расщепление четырехстороннего соединения ДНК рестрикционным ферментом, охватывающим точку обмена цепями. EMBO J., 10, 713–718. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Вонг Д.М. и Ветмур, Дж.Г. (1994) Некоторые эндонуклеазы рестрикции класса IIS могут расщеплять трехстороннее соединение ДНК. Джин, 150, 63–66. [PubMed] [Google Scholar]
39. Hartenstine M.J., Goodman, M.F. и Петрушка, Дж. (2000)Укладка оснований и четное/нечетное поведение петель шпилек при проскальзывании и расширении триплетных повторов ДНК с помощью ДНК-полимеразы. Дж. Биол. хим., 275, 18382–1839.0. [PubMed] [Google Scholar]
Hartenstine M.J., Goodman, M.F. и Петрушка, Дж. (2000)Укладка оснований и четное/нечетное поведение петель шпилек при проскальзывании и расширении триплетных повторов ДНК с помощью ДНК-полимеразы. Дж. Биол. хим., 275, 18382–1839.0. [PubMed] [Google Scholar]
40. Ю А., Дилл Дж. и Митас, М. (1995) Богатые пуринами последовательности тринуклеотидных повторов d(CAG)15 и d(GAC)15 образуют шпильки. Nucleic Acids Res., 23, 4055–4057. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Садовский П.Д. (1971) Эндонуклеаза бактериофага Т7. I. Свойства фермента, очищенного от инфицированных фагом Т7 Escherichia coli B. J. Biol. хим., 246, 209–216. [PubMed] [Google Scholar]
42. de Massy B., Weisberg, R.A. и Штудиер, Ф.В. (1987) Эндонуклеаза гена 3 бактериофага Т7 расщепляет конформационно разветвленные структуры в двухцепочечной ДНК. Дж. Мол. биол., 193, 359–376. [PubMed] [Google Scholar]
43. Lu M., Guo, Q., Studier, F.W. и Калленбах, Н.Р. (1991)Разрешение разветвленных ДНК-субстратов эндонуклеазой I Т7 и ее ингибирование.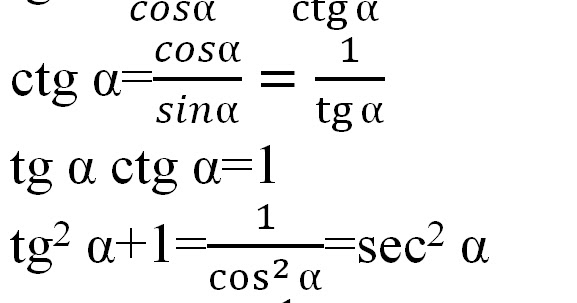 Дж. Биол. Chem., 266, 2531–2536. [PubMed] [Google Scholar]
Дж. Биол. Chem., 266, 2531–2536. [PubMed] [Google Scholar]
44. Дикки П., Макфадден Г. и Морган, А.Р. (1987) Сайт-специфическое расщепление синтетических аналогов соединения Холлидея и родственных структур разветвленной ДНК эндонуклеазой бактериофага Т7 I. J. Biol. Chem., 262, 14826–14836. [PubMed] [Академия Google]
45. Машал Р.Д., Кунц Дж. и Скляр, Дж. (1995) Обнаружение мутаций путем расщепления гетеродуплексов ДНК резольвазами бактериофагов. Nature Genet., 9, 177–183. [PubMed] [Google Scholar]
46. Ломан Т.М. и Феррари, М.Э. (1994) Одноцепочечный ДНК-связывающий белок Escherichia coli : множественные способы связывания ДНК и кооперативы. Анну. Rev. Biochem., 63, 527–570. [PubMed] [Google Scholar]
47. Laskowski M. Sr (1980) Очистка и свойства нуклеазы бобов мунг. Methods Enzymol., 65, 263–276. [PubMed] [Академия Google]
48. Каботянский Э.Б., Чжу С., Каллик Д.А. и Рот, Д.Б. (1995)Открытие шпильки одноцепочечными нуклеазами. Nucleic Acids Res. , 23, 3872–3881. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, 23, 3872–3881. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Болдуин Р.Л. (1968) Кинетика образования спирали и проскальзывания сополимера dAT. В Пуллман, Б. (ред.), Симпозиум по молекулярным ассоциациям в биологии . Academic Press, Нью-Йорк, стр. 145–162.
50. Оливера Б.М. и Леман, И.Р. (1968) Ферментативное соединение полинуклеотидов. 3. Гомополимерная пара полидеоксиаденилат-полидезокситимидилат. Дж. Мол. биол., 36, 261–274. [PubMed] [Академия Google]
51. Леонтис Н.Б., Квок В. и Ньюман, Дж.С. (1991) Стабильность и структура трехсторонних соединений ДНК, содержащих неспаренные нуклеотиды. Nucleic Acids Res., 19, 759–766. [Бесплатная статья PMC] [PubMed] [Google Scholar]
52. Welch J.B., Walter,F. и Лилли, Д.М. (1995) Два неэквивалентных изомера складывания трехстороннего соединения ДНК с неспаренными основаниями: зависимость сложенной конформации от последовательности. Дж. Мол. биол., 251, 507–519. [PubMed] [Google Scholar]
53. Смит Г.П. (1976) Эволюция повторяющихся последовательностей ДНК путем неравного кроссовера. Наука, 191, 528–535. [PubMed] [Google Scholar]
Смит Г.П. (1976) Эволюция повторяющихся последовательностей ДНК путем неравного кроссовера. Наука, 191, 528–535. [PubMed] [Google Scholar]
54. Richard G.F., Goellner, G.M., McMurray, G.T. и Хабер, Дж.Е. (2000) Индуцированная рекомбинацией экспансия тринуклеотидных повторов CAG у дрожжей включает комплекс MRE11-RAD50-XRS2. EMBO J., 19, 2381–2390. [Бесплатная статья PMC] [PubMed] [Google Scholar]
55. Kennedy L. and Shelbourne, P.F. (2000) Драматическая мутационная нестабильность в стриатуме мышей с БХ: способствует ли полиглутаминовая нагрузка клеточно-специфической уязвимости при болезни Гентингтона? Гум. Мол. Генет., 9, 2539–2544. [PubMed] [Google Scholar]
56. Роше В.А., Яворски А., Канг С., Крамер С.Ф., Ларсон Дж.Е., Гейдрок Д.П., Уэллс Р.Д. и Синден, Р.Р. (1996) Одноцепочечный ДНК-связывающий белок повышает стабильность триплетных повторов CTG в Escherichia coli . J. Bacteriol., 178, 5042–5044. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Мэнли К., Ширли, Т.Л., Флаэрти, Л. и Мессер, А. (1999) Дефицит Msh3 предотвращает in vivo соматическую нестабильность повтора CAG у трансгенных мышей с болезнью Гентингтона. Nature Genet., 23, 471–473. [PubMed] [Академия Google]
Мэнли К., Ширли, Т.Л., Флаэрти, Л. и Мессер, А. (1999) Дефицит Msh3 предотвращает in vivo соматическую нестабильность повтора CAG у трансгенных мышей с болезнью Гентингтона. Nature Genet., 23, 471–473. [PubMed] [Академия Google]
58. Ковтун И.В. и МакМюррей, К.Т. (2001)Экспансия тринуклеотидов в гаплоидных зародышевых клетках путем восстановления разрывов. Nature Genet., 27, 407–411. [PubMed] [Google Scholar]
59. Ван Ден Брук В.Дж., Нелен М.Р., Вансинк Д.Г., Корвинкель М.М., те Риле Х., Гроенен П.Дж. и Виринга, Б. (2002)Поведение соматической экспансии повтора (CTG)(n) у нокаутных мышей с миотонической дистрофией по-разному зависит от белков восстановления несоответствия Msh4 и Msh6. Гум. Мол. Генетика., 11, 191–198. [PubMed] [Академия Google]
60. Мур Х., Гринвелл П.В., Лю С.П., Арнхейм Н. и Питс, Т.Д. (1999) Триплетные повторы образуют вторичные структуры, которые избегают репарации ДНК в дрожжах. проц. Натл акад. науч. США, 96, 1504–1509 гг. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Билл К.А., Тагиан, Д.Г., Дюран, В.А. и Николофф, Дж.А. (2001) Смещение репарации больших несоответствий петель во время рекомбинации в клетках млекопитающих зависит от длины и структуры петли. Мутат. рез., 485, 255–265. [PubMed] [Академия Google]
Билл К.А., Тагиан, Д.Г., Дюран, В.А. и Николофф, Дж.А. (2001) Смещение репарации больших несоответствий петель во время рекомбинации в клетках млекопитающих зависит от длины и структуры петли. Мутат. рез., 485, 255–265. [PubMed] [Академия Google]
Vuelos baratos de Seattle a Cartagena desde $208
Начальный отдел основной страницы страницы
Los precios estuvieron disponibles durante los últimos 7 días y comienzan desde $208 para vuelos sencillos erendo vspecificos uely, parado vuelos parado vuelos 510 $510 Los precios у ла disponibilidad están sujetos cambios. Апликанские термины adicionales.
Todas las ofertas
Solo ida
Viaje redondo
лун. 6 фев
МОРЕ
Сиэтл
CTG
Картахена
208 $ Индивидуальная цена, Precio hase 7 часов $ 208Solo ida
Precio hace 7 часов
JetBlue Airways
6 90. 30 DE OCT
SEA
Сиэтл
CTG
CARTAGENA
$ 248 SOLO IDA, Precio HACE 15 HORAS $ 248SOLO IDA
Precio HACE 15 HORAS
JetBlue Airways
DOM.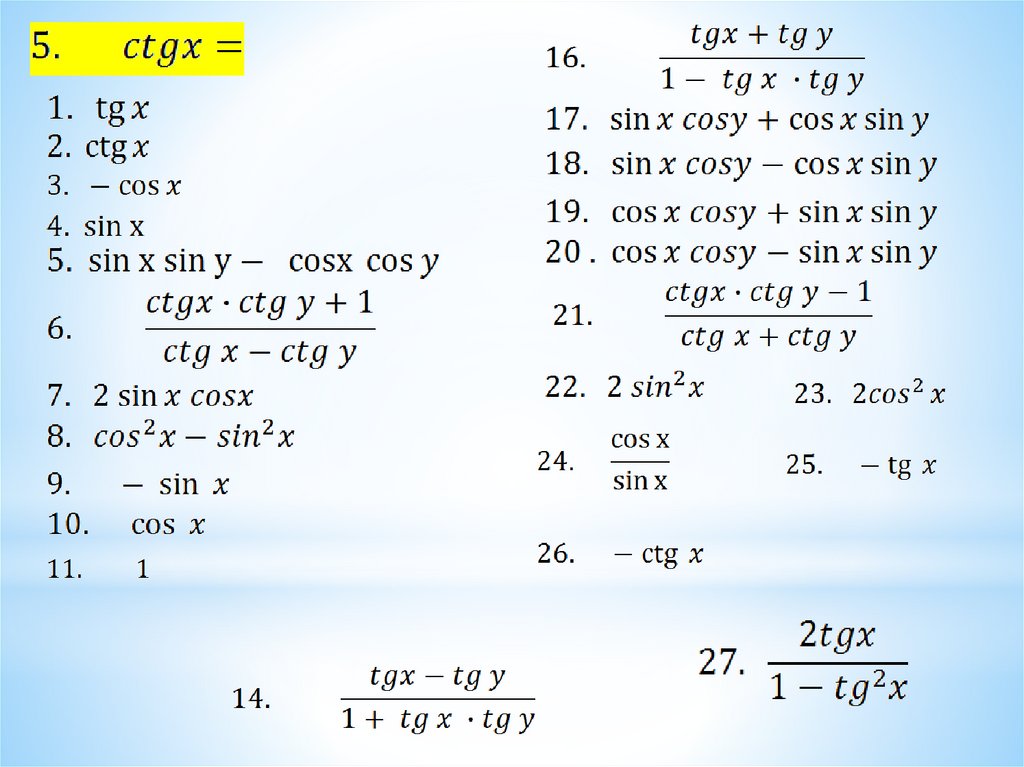 19 марта
19 марта
ЮВА
Сиэтл
CTG
Картахена
251 $ Индивидуальная цена, цена 10 часов 251 $Индивидуальная цена
цена 10 часов
JetBlue Airways
дом. 5 DE FEB
SEA
Сиэтл
CTG
CARTAGENA
$ 259 SOLO IDA, Precio HACE 2 Días $ 259Solo IDA
Precio HACE 2 Días
JetBlue Airways
DOM. 22 de ene
SEA
Сиэтл
CTG
Картахена
265 долл. США Соло ида, цена 1 день 265 долл. СШАSolo ida
Precio hase 1 días
JetBlue Airways
дом. 30 DE OCT
SEA
Сиэтл
CTG
CARTAGENA
$ 273 Solo IDA, Precio HACE 15 HORAS $ 273SOLO IDA
Precio HACE 15 HORAS
JetBlue Airways
DOM. 5 марта
SEA
Сиэтл
CTG
Картахена
289 $ Индивидуальная покупка, Precio hase 3 días 289 $Solo ida
Precio has 3 días
JetBlue Airways
сопр.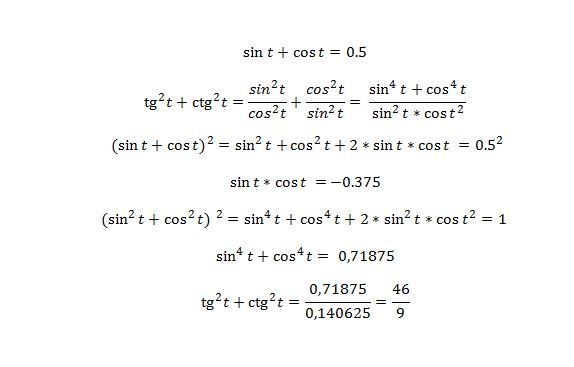 28 DE OCT
28 DE OCT
SEA
Сиэтл
CTG
CARTAGENA
$ 290 SOLO IDA, Precio HACE 19 HORAS $ 290SOLO IDA
Precio HACE 19
JetBlue Airways
DOM. 19 DE MAR
SEA
Сиэтл
CTG
Cartagena
$ 291 Solo Ida, Precio Hace 10 Horas $ 291Solo IDA
Precio Hace 10 Horas
JetBlue Airways
Sáb. 25 дек 9 фев0003
SEA
Сиэтл
CTG
Картахена
293 $ Solo ida, Precio hase 3 días $ 293Solo ida
Precio has 3 dias
2 American Airlines
3 900 23 декабря — июль. 9 DE FEB
SEA
SEATTLE
CTG
CARTAGENA
$ 510 VIAJE REDONDO, Precio HACE 1 Días 510Viaje Redondo
Precio HACE 1 Días
Jetblue Airways
Lun. 23 де эн — мье. 8 фев
SEA
Сиэтл
CTG
CARTAGENA
$ 516 VIAJE REDONDO, Precio HACE 1 Días $ 516Viaje Redondo
Precio Hace 1 Días
JetBlue Airways
Lun. 23 де эн — мье. 8 DE FEB
23 де эн — мье. 8 DE FEB
SEA
Сиэтл
CTG
Cartagena
$ 530 Viaje Redondo, Precio Hace 1 Días $ 530Viaje Redondo
Precio Hace 1 Días
Jetblue Airways
DOM. 30 дек — ви. 4 ноя
SEA
Сиэтл
CTG
CARTAGENA
$ 549 VIAJE REDONDO, Precio HACE 5 Días $ 549Viaje Redondo
Precio Hace 5 Días
Jetblue Airways
Vie. 20 де эн — ию. 9 DE FEB
SEA
SEATTLE
CTG
CARTAGENA
$ 553 VIAJE REDONDO, Precio HACE 1 Días $ 553Viaje Redondo
Precio HACE 1 Días
JetBlue Airways
DOM. 15 де эн — ви. 27 де ен
SEA
Сиэтл
CTG
CARTAGENA
$ 555 VIAJE REDONDO, Precio HACE 1 Días $ 555Viaje Redondo
Precio Hace 1 Días
JetBlue Airways
Vie. 20 де эне — мье. 8 DE FEB
20 де эне — мье. 8 DE FEB
SEA
Сиэтл
CTG
Cartagena
$ 573 Viaje Redondo, Precio Hace 1 Días $ 573Viaje Redondo
Precio HACE 1 Días
JetBlue Airways
DOM. 15 де эне — мие. 1 дек
SEA
Сиэтл
CTG
CARTAGENA
$ 575 VIAJE REDONDO, Precio HACE 1 Días $ 575Viaje Redondo
Precio Hace 1 Días
JetBlue Airways
DOM. 23 дек — св. 28 DE OCT
SEA
Сиэтл
CTG
CARTAGENA
$ 584 VIAJE REDONDO, Precio HACE 5 HORAS $ 584VIAJE REDONDO
Precio HACE 5 HORAS
American Airlines
Sáb. 21 де ена — ви. 3 дек 9 фев0003
SEA
Сиэтл
CTG
Cartagena
$ 585 Viaje Redondo, Precio Hace 1 Días $ 585Viaje Redondo
Precio Hace 1 Días
American Airlines
- 40.
 Últimas tendencias en Expedia
Últimas tendencias en Expedia
b7f9d16c-0876-4b8c-8e7f-94d6719dce8e48e16b3b-804f-470e-8d9d-37d3d2e4507300000000-0000-0000-d92a-d7d35da11c38
Slipped (CTG)·(CAG) Repeats of the Myotonic Dystrophy Locus: Зондирование поверхности антителами к ДНК
ScienceDirectRegisterSign в
View PDF
- Доступ через Ваше учреждение
Том 332, выпуск 3, 19 сентября 2003 г., страница 585-600
HTTP./10.2. S0022-2836(03)00880-5Получить права и содержание
По меньшей мере 15 заболеваний человека были связаны с зависимой от длины экспансией геноспецифических (CTG)·(CAG) повторов, включая миотоническую дистрофию (DM1) и спиноцеребеллярную атаксию тип 1 (SCA1). Расширение повторов, вероятно, связано с необычными структурами ДНК. Мы структурно охарактеризовали такую ДНК с (CTG) n ·(CAG) n повторов различной длины ( n = 17–79) с помощью гель-электрофореза с высоким разрешением и исследовали их поверхности с помощью анти-ДНК антител с известной специфичностью.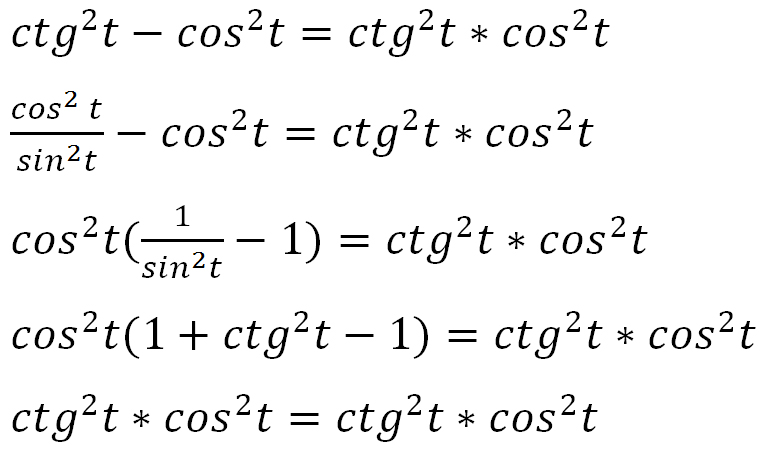 Мы получили гомодуплексные S-ДНК, которые представляют собой (CTG) x · (CAG) y , где x = y , и гетеродуплексные SI-ДНК, которые являются гибридами, где x > y или3 х < у . S-ДНК образовывала множество различных видов соскользнувших изомеров, на что указывают ее множественные электрофоретические виды. Напротив, SI-ДНК образовывали различные структуры, на что указывает ограниченное количество электрофоретических видов для всех возможных пар длин повторов. Сестринские SI-ДНК с избытком CAG-повторов всегда мигрировали медленнее, чем их сестринские SI-ДНК с избытком CTG-повторов. Поразительно, но как склонность к образованию скользящих структур, так и структура S-ДНК, но не SI-ДНК, различались для одинаковых длин повторов CTG/CAG между локусами DM1 и SCA1, подчеркивая роль фланкирования цис -элементы в S-ДНК, но не в формировании SI-ДНК. Скользящие структуры связаны структурой и нуклеотид-специфическими антителами против ДНК.
Мы получили гомодуплексные S-ДНК, которые представляют собой (CTG) x · (CAG) y , где x = y , и гетеродуплексные SI-ДНК, которые являются гибридами, где x > y или3 х < у . S-ДНК образовывала множество различных видов соскользнувших изомеров, на что указывают ее множественные электрофоретические виды. Напротив, SI-ДНК образовывали различные структуры, на что указывает ограниченное количество электрофоретических видов для всех возможных пар длин повторов. Сестринские SI-ДНК с избытком CAG-повторов всегда мигрировали медленнее, чем их сестринские SI-ДНК с избытком CTG-повторов. Поразительно, но как склонность к образованию скользящих структур, так и структура S-ДНК, но не SI-ДНК, различались для одинаковых длин повторов CTG/CAG между локусами DM1 и SCA1, подчеркивая роль фланкирования цис -элементы в S-ДНК, но не в формировании SI-ДНК. Скользящие структуры связаны структурой и нуклеотид-специфическими антителами против ДНК. Связывание анти- В -ДНК антител было снижено как для S-ДНК, так и для SI-ДНК по сравнению с их линейными формами. SI-ДНК связывали анти- Z -ДНК-антитела, в то время как S- и SI-ДНК связывали анти-крестообразные антитела, обнаруживая общие характеристики между соответствующими структурами ДНК и ДНК со сдвигом. Такие особенности повторов могут распознаваться клеточными белками, которые, как известно, связываются с такими структурами.
Связывание анти- В -ДНК антител было снижено как для S-ДНК, так и для SI-ДНК по сравнению с их линейными формами. SI-ДНК связывали анти- Z -ДНК-антитела, в то время как S- и SI-ДНК связывали анти-крестообразные антитела, обнаруживая общие характеристики между соответствующими структурами ДНК и ДНК со сдвигом. Такие особенности повторов могут распознаваться клеточными белками, которые, как известно, связываются с такими структурами.
Расширение (CTG) n ·(CAG) n тринуклеотидных повторяющихся последовательностей связано с 15 генетическими заболеваниями человека. 1 Среди них миотоническая дистрофия (DM1), спинально-мозжечковая атаксия типа 1 (SCA1) и болезнь Гентингтона (HD). Механизм, приводящий к повторной нестабильности, неизвестен, но считается, что альтернативные структуры ДНК являются важными мутагенными промежуточными продуктами. Тринуклеотидные повторы имеют склонность к образованию структур ДНК с проскальзыванием, в которых комплементарные нити ДНК демонстрируют нерегламентное выравнивание.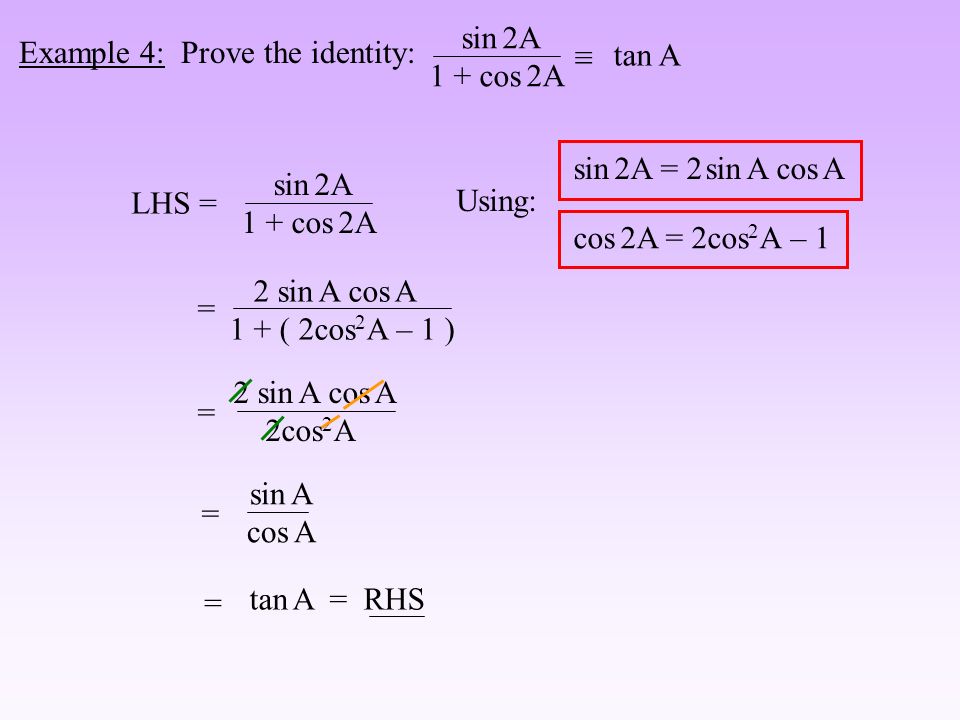 Эти структуры могут приводить к аберрантной репликации ДНК и/или склонной к ошибкам репарации ДНК, что приводит к повторной амплификации. Оценка биофизической структуры ДНК с проскальзыванием облегчит понимание их метаболизма, что должно пролить свет на роль структур ДНК с проскальзыванием в нестабильности.
Эти структуры могут приводить к аберрантной репликации ДНК и/или склонной к ошибкам репарации ДНК, что приводит к повторной амплификации. Оценка биофизической структуры ДНК с проскальзыванием облегчит понимание их метаболизма, что должно пролить свет на роль структур ДНК с проскальзыванием в нестабильности.
Мы создали модели ДНК с скользящей цепью, образованные тринуклеотидными повторами, ассоциированными с заболеванием. Гомодуплексные структуры со скольжением S-ДНК индуцируются денатурацией и ренатурацией (редуплексированием) цепей ДНК, содержащих тракт тринуклеотидного повтора. 2 S-ДНК составляют (CTG) x · (CAG) y , где x = y . Эти структуры включают внерегистровое выравнивание двух цепей, которые удерживаются вместе за счет спаривания Уотсона-Крика в тандемных повторах. Гибридизация нитей, содержащих повторы разной длины, приводит к образованию гетеродуплексных промежуточных звеньев, SI-ДНК. SI-ДНК (CTG) x ·(CAG) y , где x ≠ y . Структуры S-ДНК могут обеспечить точную модель интермедиатов нестабильности в непролиферирующих геномах, 2., 3., 4. в то время как структуры SI-ДНК могут отражать промежуточные продукты экспансии/делеции в ответвлениях репликации или восстановления разрывов/разрывов.4. , 5., 6.
Структуры S-ДНК могут обеспечить точную модель интермедиатов нестабильности в непролиферирующих геномах, 2., 3., 4. в то время как структуры SI-ДНК могут отражать промежуточные продукты экспансии/делеции в ответвлениях репликации или восстановления разрывов/разрывов.4. , 5., 6.
Три линии доказательств подтверждают, что S-ДНК и SI-ДНК являются хорошими моделями мутагенных интермедиатов нестабильности. Эффекты (1) длины повторного тракта и (2) чистоты повторного тракта на формирование структуры коррелируют с их влиянием на генетическую стабильность у людей, и (3) биофизически S-ДНК и SI-ДНК удивительно стабильны. 2 Формирование структур было очень чувствительным к длине повтора. Более длинные тракты могут легче образовывать скользящие структуры с резким увеличением способности образовывать скользящие структуры при длине 30–50 повторов, длине порога генетической стабильности. 2., 7. Неповторяющиеся нарушения чистоты тринуклеотидных трактов обеспечивают стабильность, в то время как чистые участки аналогичной длины генетически нестабильны и связаны с болезнью.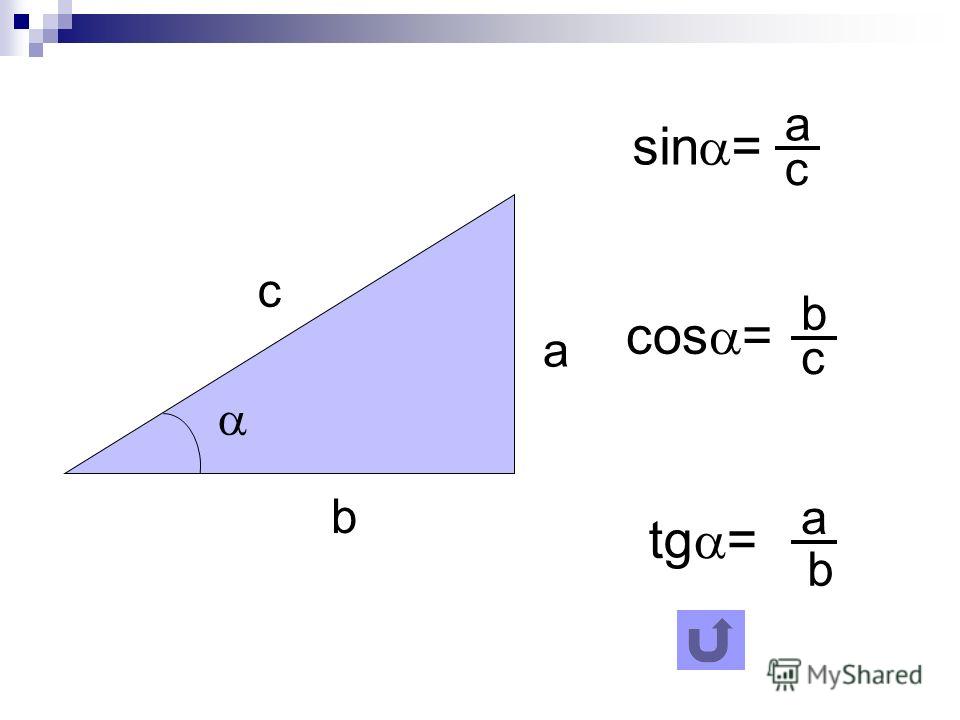 Формирование скользящей структуры устраняется наличием повторяющихся прерываний, что указывает на роль образования скользящей структуры в повторяющейся нестабильности. 8 S-ДНК и SI-ДНК отличаются от других необычных структур ДНК (крестообразные, Z -ДНК) 8 , поскольку они не требуют сверхспирального натяжения, что позволяет предположить, что они могут образовывать in vivo и могут возникать при репликации развилки, участки репарации или рекомбинации.
Формирование скользящей структуры устраняется наличием повторяющихся прерываний, что указывает на роль образования скользящей структуры в повторяющейся нестабильности. 8 S-ДНК и SI-ДНК отличаются от других необычных структур ДНК (крестообразные, Z -ДНК) 8 , поскольку они не требуют сверхспирального натяжения, что позволяет предположить, что они могут образовывать in vivo и могут возникать при репликации развилки, участки репарации или рекомбинации.
Здесь мы дополнительно охарактеризовали ДНК, содержащие DM1 (CTG) n ·(CAG) n повторы различной длины (17, 30, 50 и 79) в линейных, S и SI- формы ДНК. Анализ был выполнен с использованием гель-электрофореза и зондирования поверхности специфическими антителами против ДНК. При электрофорезе как S-ДНК, так и SI-ДНК мигрировали медленно по сравнению с их линейными дуплексными формами, а SI-ДНК с избытком CAG-повторов в шпильке всегда мигрировали медленнее, чем их родственные SI-ДНК с избытком CTG-повторов. Зондирование с восемью анти-ДНК антителами против крестообразных ДНК, Z -ДНК, нативная B -ДНК и специфические основания одноцепочечной ДНК подразумевают наличие трех- или четырехсторонних соединений ДНК, непарных оснований тимидиновых остатков и не- B -образных структур в скользящих -нитевые ДНК.
Зондирование с восемью анти-ДНК антителами против крестообразных ДНК, Z -ДНК, нативная B -ДНК и специфические основания одноцепочечной ДНК подразумевают наличие трех- или четырехсторонних соединений ДНК, непарных оснований тимидиновых остатков и не- B -образных структур в скользящих -нитевые ДНК.
Фрагменты секций
Для исследования влияния длины повтора на образование ДНК с проскальзыванием были приготовлены структуры из серии геномных клонов DM1, которые различались только длиной (CTG) n ·(CAG) n повторный тракт. Длина трактов варьировала от нормального генетически стабильного диапазона ( n = 17 или 30) до увеличенной нестабильной длины ( n = 50 или 79). Скользящие ДНК формировали путем денатурации/ренатурации (Материалы и методы). Гомодуплексные S-ДНК, содержащие две нити с одинаковым количеством повторов, были образованы
. В этом отчете были выявлены структурные различия между S-ДНК и SI-ДНК: (1) для данной длины повторов S-ДНК образуют многочисленные виды скользящих изомеров, в то время как SI-ДНК образуют преимущественно одну отчетливую структуру; (2) как определено по сниженному связыванию анти- B , SI-ДНК содержат измененную B -форму двойной спирали по сравнению либо с S-ДНК, либо с линейными формами; (3) SI-ДНК, в отличие от S-ДНК, могут иметь больше общих характеристик с левосторонней Z -ДНК; (4) различия между плазмидами
, содержащими геномные (CTG) DM1 человека n · (CAG) n повторы ( n = 17, 30, 50 или 79) и неповторяющимися последовательностями человека по бокам повтора (участки 417–436 и 451–494 с регистрационным номером S86455). Тракт повтора окружен уникальными сайтами рестрикции Eco RI и Hin dIII в 59 п.н. и 54 п.н. 3′ и 5′ тракта CTG, соответственно. Плазмиды, содержащие геномные повторы SCA1 человека (CAG) n ·(CTG) n ( n =30, 49 60 или 74) с неповторяющимися человеческими членами
Тракт повтора окружен уникальными сайтами рестрикции Eco RI и Hin dIII в 59 п.н. и 54 п.н. 3′ и 5′ тракта CTG, соответственно. Плазмиды, содержащие геномные повторы SCA1 человека (CAG) n ·(CTG) n ( n =30, 49 60 или 74) с неповторяющимися человеческими членами
Мы благодарим нашу лабораторию обсуждения. Мы благодарим доктора Дж. Ромменса за контрольные антитела против β-галактозидазы. Авторы с сожалением отмечают смерть нашего соавтора и коллеги Джеральда Б. Прайса в ходе этой работы и посвящают ему эту работу. Эта работа была поддержана грантами Канадского института исследований в области здравоохранения (CIHR) и Ассоциации мышечной дистрофии США (C.E.P.). КЭП является научным сотрудником CIHR и научным сотрудником Канадской сети генетических заболеваний.
Ссылки (43)
- E.B. Kmiec и др.
Левосторонняя ДНК и реакция синаптического спаривания, стимулируемая белком Ustilago rec1
Клетка
(1985)
- T.
 Kubota et al.
Kubota et al. Усиление окислительного расщепления ДНК сайтами связывания двух антител против двухцепочечной ДНК
J. Biol. хим.
(1996)
- С. Канг и др.
Обогащенные GC фланкирующие тракты снижают кинетику образования триплексов внутримолекулярной ДНК
Журнал биол. хим.
(1992)
- К.М. Салливан и др.
Преобладающее влияние фланкирующих последовательностей на локальный структурный переход в ДНК
Клетка
(1986)
- Б.Н. ван Бюрен и др.
Структура раствора тройного соединения ДНК, содержащего два неспаренных тимидиновых основания. Идентификация признаков последовательности, которые определяют выбор конформера
J. Mol. биол.
(2000)
- Т. Кубота и др.
Моноклональное антитело против двухцепочечной ДНК от аутоиммунной мыши MRL/Mp-lpr/lpr: специфичность и идиотип в сывороточных иммуноглобулинах
Immunol.
 Письма
Письма(1986)
- Д.Г. Сэнфорд и др.
Характеристика сайтов связывания антител против Z-ДНК на
Z -ДНК с помощью спектроскопии ядерного магнитного резонансаJ. Biol. хим.
(1990)
- К. Штайнметцер и др.
Моноклональное антитело против крестообразной формы и взаимодействие крестообразной ДНК
J. Mol. биол.
(1995)
- Л. Фраппье и др.
Характеристика специфичности связывания двух антикрестообразных ДНК-моноклональных антител
J. Biol. хим.
(1989)
- Л. Фраппье и др.
Моноклональные антитела к крестообразным структурам ДНК
Дж. Мол. биол.
(1987)
Анализ антител к ДНК
Методы Enzymol.
(1992)
Кинетика ренатурации ДНК
J.
 Mol. биол.
Mol. биол.(1968)
Структура разветвленных молекул ДНК: гель-ретардация и атомно-силовая микроскопия
Дж. Мол. биол.
(1999)
Повторы CTG, связанные с генетическим заболеванием человека, по своей природе являются гибкими
J. Mol. биол.
(1998)
Тринуклеотидные повторяющиеся структуры ДНК: динамические мутации из динамической ДНК
Curr. мнение Структура биол.
(1998)
J. Biol. хим.
(2002)
Вклад
цис- -элементов в нестабильность повторов, ассоциированную с заболеванием: клинические и экспериментальные данныеCytogenet.
 Геном Res.
Геном Res.(2003)
Альтернативные структуры в дуплексной ДНК, образующиеся в составе тринуклеотидных повторов локусов миотонической дистрофии и ломкой Х
Биохимия
(1996)
Прерывания в триплетных повторах SCA1 и FRAXA снижают склонность и сложность образования ДНК с ускользающими цепями (S-DNA)
ДНК со скользящей нитью, образованные длинными (CAG)(CTG) повторами: скользящие повторы и скользящие соединения
Nucl. Кислоты рез.
(2002)
Доказательства
цис -действующих факторов в опосредованной репликацией нестабильности тринуклеотидных повторов в клетках приматовNature Genet.
(2002)
На неверном пути ДНК: Молекулярные механизмы нестабильности генома, опосредованной повторами из которых являются тяжелыми, дегенеративными и в настоящее время не поддаются лечению или профилактике.
 В этом обзоре мы сначала описываем молекулярные механизмы индуцированной повторами токсичности, которая является связующим звеном между экспансией повторов и патологией. Затем мы рассматриваем альтернативные структуры ДНК, образованные расширяемыми повторами, и рассматриваем доказательства того, что образование этих структур лежит в основе нестабильности повторов. Далее мы опишем последствия наличия длинных структурообразующих повторов на молекулярном уровне: соматическую и межгенерационную нестабильность, хрупкость и индуцированный повторами мутагенез. Мы обсуждаем причины гендерной предвзятости в нестабильности повторов между поколениями и тканевую специфичность нестабильности соматических повторов. Мы также рассматриваем известные пути, в которых репликация ДНК, транскрипция, репарация ДНК и состояние хроматина взаимодействуют и тем самым способствуют нестабильности повторов. Затем мы обсудим возможные причины сохранения болезнетворных повторов ДНК в геноме. Мы описываем доказательства, свидетельствующие о том, что эти повторы являются платой за преимущества наличия обильных повторов простых последовательностей для функции и эволюционируемости эукариотического генома.
В этом обзоре мы сначала описываем молекулярные механизмы индуцированной повторами токсичности, которая является связующим звеном между экспансией повторов и патологией. Затем мы рассматриваем альтернативные структуры ДНК, образованные расширяемыми повторами, и рассматриваем доказательства того, что образование этих структур лежит в основе нестабильности повторов. Далее мы опишем последствия наличия длинных структурообразующих повторов на молекулярном уровне: соматическую и межгенерационную нестабильность, хрупкость и индуцированный повторами мутагенез. Мы обсуждаем причины гендерной предвзятости в нестабильности повторов между поколениями и тканевую специфичность нестабильности соматических повторов. Мы также рассматриваем известные пути, в которых репликация ДНК, транскрипция, репарация ДНК и состояние хроматина взаимодействуют и тем самым способствуют нестабильности повторов. Затем мы обсудим возможные причины сохранения болезнетворных повторов ДНК в геноме. Мы описываем доказательства, свидетельствующие о том, что эти повторы являются платой за преимущества наличия обильных повторов простых последовательностей для функции и эволюционируемости эукариотического генома. Наконец, мы обсудим два нерешенных фундаментальных вопроса: (1) почему повторяющееся поведение различается между модельными системами и человеческими родословными, и (2) можем ли мы использовать современные знания о механизмах нестабильности повторов для лечения болезней повторной экспансии?
Наконец, мы обсудим два нерешенных фундаментальных вопроса: (1) почему повторяющееся поведение различается между модельными системами и человеческими родословными, и (2) можем ли мы использовать современные знания о механизмах нестабильности повторов для лечения болезней повторной экспансии?Отсутствие MutSβ приводит к образованию проскальзывающих ДНК для сокращений CTG/CAG в репликационных вилках приматов
2016, восстановление ДНК
Ускользающие ДНК могут также образовываться во время репликации HeLa, но короткие выскальзывания будут восстановлены механизмом MMR и, следовательно, будет необнаружимым. Дополнительными данными, подтверждающими, что сформированные выскальзывания были короткими, является относительно медленная электрофоретическая миграция реплицированного материала, очень похожая на короткие выскальзывания (рис. 3) [76]. Наши данные предполагают, что проскальзывающие ДНК, образованные во время репликации LoVo, сохранялись, избегая процессинга из-за отсутствия белков MMR, поскольку мы смогли уменьшить частоту появления этих структур путем добавления MutSβ.

Обычно болезнетворные CAG/CTG-повторы расширяются, но в редких случаях пораженные семьи могут демонстрировать высокий уровень сокращения расширенного повтора среди потомства. Понимание нестабильности важно, поскольку прекращение расширения или усиление сокращений может быть клинически полезным. Комплекс репарации несоответствия MutSβ необходим для экспансии CAG/CTG у мышей и пациентов. Как ни странно, по неизвестным механизмам MutSβ-дефицитные мыши испытывают сокращения вместо расширения. Известно, что репликация с использованием CTG или CAG в качестве шаблона отстающей нити вызывает сокращение или расширение соответственно; однако взаимодействие между репликацией и репарацией, приводящее к этой нестабильности, остается неясным. Чтобы понять, как могут возникать повторные сокращения, мы выполнили in vitro SV40-опосредованная репликация плазмид, содержащих повторы, при наличии или отсутствии репарации несоответствия. В частности, мы отделили репарацию от репликации: репликация, опосредованная MutSβ- и MutSα-дефицитными человеческими клетками или клеточными экстрактами, продуцировала гетеродуплексы ДНК со смещением в направлении репликации, обусловленной сокращением, но не расширением.
 Репликация в присутствии MutSβ не способствовала сохранению продуктов репликации, содержащих гетеродуплексы со сдвигом ДНК. Пострепликационная репарация проскальзывающих ДНК с помощью экстрактов, содержащих MutSβ, устраняла проскользнувшие ДНК. Т.о., MutSβ-дефицит, вероятно, усиливает повторные сокращения, т.к. MutSβ защищает от сокращений путем восстановления выскальзывания матричных цепей. Репликационная недостаточность LigaseI или мутанта LigaseI, взаимодействующего с PCNA, выявила образование проскальзывающей ДНК на отстающих цепях. Наши результаты показывают, что различные механизмы приводят к расширению или сокращению и поддерживают ингибирование MutSβ в качестве терапевтической стратегии для усиления сокращения расширенных повторов.
Репликация в присутствии MutSβ не способствовала сохранению продуктов репликации, содержащих гетеродуплексы со сдвигом ДНК. Пострепликационная репарация проскальзывающих ДНК с помощью экстрактов, содержащих MutSβ, устраняла проскользнувшие ДНК. Т.о., MutSβ-дефицит, вероятно, усиливает повторные сокращения, т.к. MutSβ защищает от сокращений путем восстановления выскальзывания матричных цепей. Репликационная недостаточность LigaseI или мутанта LigaseI, взаимодействующего с PCNA, выявила образование проскальзывающей ДНК на отстающих цепях. Наши результаты показывают, что различные механизмы приводят к расширению или сокращению и поддерживают ингибирование MutSβ в качестве терапевтической стратегии для усиления сокращения расширенных повторов.Остановка репликации и образование гетеродуплекса в тринуклеотидных повторах CAG/CTG путем репарации несоответствия
2016, репарация ДНК клетки млекопитающих индуцировали образование молекул, которые были интерпретированы как продукты расщепления шпилек нуклеазой, что подтверждает существование таких вторичных структур in vivo.
 Совсем недавно Axford и коллеги [73] использовали антитела, направленные против крестообразных структур [74], для иммунопреципитации ДНК, выделенной из тканей пациентов с миотонической дистрофией. Они показали, что иммунопреципитированная ДНК была обогащена вторичными структурами, предполагая, что такие структуры существуют in vivo, в нереплицирующейся ДНК.
Совсем недавно Axford и коллеги [73] использовали антитела, направленные против крестообразных структур [74], для иммунопреципитации ДНК, выделенной из тканей пациентов с миотонической дистрофией. Они показали, что иммунопреципитированная ДНК была обогащена вторичными структурами, предполагая, что такие структуры существуют in vivo, в нереплицирующейся ДНК.Экспансия тринуклеотидных повторов ответственна по меньшей мере за два десятка неврологических расстройств. Механизмы, ведущие к такому большому расширению повторяющейся ДНК, до сих пор плохо изучены. Было высказано предположение, что временная остановка репликационной вилки трактом повтора может запускать проскальзывание вновь синтезированной нити по ее матрице, что приводит к расширению или сокращению триплетного повтора. Однако такой механизм так и не был официально доказан. Здесь мы показываем, что пауза репликационной вилки и нестабильность тринуклеотидных повторов CAG/CTG являются несцепленными, стабильными и нестабильными повторами, проявляющими одинаковую склонность к остановке репликационных вилок при интеграции в природную хромосому дрожжей.
 Мы обнаружили, что остановка вилки репликации зависит от целостности системы восстановления несоответствия, особенно комплекса Msh3p-Msh6p, что позволяет предположить, что прямое взаимодействие белков MMR со вторичными структурами, образованными тринуклеотидными повторами in vivo, запускает паузу вилки репликации. С помощью иммунопреципитации хроматина мы также показываем, что Msh3p обогащен участками тринуклеотидных повторов как в стабильной, так и в нестабильной ориентации, причем это обогащение зависит от MSh4 и MSH6 . Наконец, мы показываем, что сверхэкспрессия MSh3 способствует образованию гетеродуплексных областей, что приводит к увеличению сокращений и расширений повторных трактов CAG/CTG во время репликации, причем эти гетеродуплексы зависят как от МШ4 и МШ6 . Эти гетеродуплексные области не обнаруживались при сверхэкспрессии мутантного гена msh3 — E768A , в котором был мутирован домен АТФазы. Наши результаты раскрывают две новые роли белков восстановления несоответствия: стабилизация гетеродуплексных областей и временное блокирование вилок репликации, проходящих через такие повторы.
Мы обнаружили, что остановка вилки репликации зависит от целостности системы восстановления несоответствия, особенно комплекса Msh3p-Msh6p, что позволяет предположить, что прямое взаимодействие белков MMR со вторичными структурами, образованными тринуклеотидными повторами in vivo, запускает паузу вилки репликации. С помощью иммунопреципитации хроматина мы также показываем, что Msh3p обогащен участками тринуклеотидных повторов как в стабильной, так и в нестабильной ориентации, причем это обогащение зависит от MSh4 и MSH6 . Наконец, мы показываем, что сверхэкспрессия MSh3 способствует образованию гетеродуплексных областей, что приводит к увеличению сокращений и расширений повторных трактов CAG/CTG во время репликации, причем эти гетеродуплексы зависят как от МШ4 и МШ6 . Эти гетеродуплексные области не обнаруживались при сверхэкспрессии мутантного гена msh3 — E768A , в котором был мутирован домен АТФазы. Наши результаты раскрывают две новые роли белков восстановления несоответствия: стабилизация гетеродуплексных областей и временное блокирование вилок репликации, проходящих через такие повторы. Обе роли могут включать прямые взаимодействия между белками MMR и вторичными структурами, образованными трактами тринуклеотидных повторов, хотя косвенные взаимодействия не могут быть формально исключены.
Обе роли могут включать прямые взаимодействия между белками MMR и вторичными структурами, образованными трактами тринуклеотидных повторов, хотя косвенные взаимодействия не могут быть формально исключены.Детерминанты позиционирования нуклеосом
2007, Journal of Molecular Biology
В предыдущем отчете было показано, что один сайт в нуклеосоме, собранный на синтетической последовательности позиционирования, известной как Фрагмент 67, гиперчувствителен к перманганату. Сайт необходим для позиционной активности и расположен в 1,5 витка от диады, которая представляет собой область высокой кривизны ДНК в нуклеосоме. Здесь была исследована чувствительность к перманганату фрагмента 601 позиционирования нуклеосом, чтобы расширить набор данных последовательностей нуклеосом, содержащих KMnO 4 гиперчувствительные участки. Остаток гиперреактивного Т в шести обнаруженных сайтах, а также один во Фрагменте 67 и три в позиционной последовательности 5S рДНК содержался на стадии ТА.
 Семь из десяти последовательностей имели форму CTAGPuG или родственную последовательность TTAAPu. Эти мотивы были также обнаружены в сайтах связывания нескольких белков, регулирующих транскрипцию, которые изгибают ДНК. Чтобы оценить значимость этих сайтов, детерминанта позиционирования размером 10 п.н. во фрагменте 67 была удалена и заменена девятью последовательностями из 5S рДНК и фрагмента 601. Результаты показали, что эти производные фрагменты способствуют высокой стабильности и позиционированию нуклеосом по сравнению с к управляющей последовательности, которая содержала шаг AT вместо шага TA. Важность этапа ТА была дополнительно проверена путем замены одной пары оснований во фрагменте 67, и результаты показали, что стабильность и активность позиционирования следуют порядку: ТА > TG > TT ≥ TC ≈ GG ≈ GA ≈ AT. Также было показано, что последовательности, граничащие со стадией ТА, имеют решающее значение для стабильности и позиционирования нуклеосом. Позиционирование нуклеосом было восстановлено почти до уровней дикого типа с помощью (CTG) 3 , которые могут образовывать скользящие нитевидные структуры и с выпуклостями одного основания, которые изгибают ДНК.
Семь из десяти последовательностей имели форму CTAGPuG или родственную последовательность TTAAPu. Эти мотивы были также обнаружены в сайтах связывания нескольких белков, регулирующих транскрипцию, которые изгибают ДНК. Чтобы оценить значимость этих сайтов, детерминанта позиционирования размером 10 п.н. во фрагменте 67 была удалена и заменена девятью последовательностями из 5S рДНК и фрагмента 601. Результаты показали, что эти производные фрагменты способствуют высокой стабильности и позиционированию нуклеосом по сравнению с к управляющей последовательности, которая содержала шаг AT вместо шага TA. Важность этапа ТА была дополнительно проверена путем замены одной пары оснований во фрагменте 67, и результаты показали, что стабильность и активность позиционирования следуют порядку: ТА > TG > TT ≥ TC ≈ GG ≈ GA ≈ AT. Также было показано, что последовательности, граничащие со стадией ТА, имеют решающее значение для стабильности и позиционирования нуклеосом. Позиционирование нуклеосом было восстановлено почти до уровней дикого типа с помощью (CTG) 3 , которые могут образовывать скользящие нитевидные структуры и с выпуклостями одного основания, которые изгибают ДНК. Результаты этого исследования предполагают, что локальные структуры ДНК важны для позиционирования и что изменения одиночных пар оснований в этих сайтах могут оказывать сильное влияние на те геномные функции, которые зависят от упорядоченных нуклеосом.
Результаты этого исследования предполагают, что локальные структуры ДНК важны для позиционирования и что изменения одиночных пар оснований в этих сайтах могут оказывать сильное влияние на те геномные функции, которые зависят от упорядоченных нуклеосом.Предрасположенная к ошибкам репарация скользящих повторов (CTG CAG) и расширение, связанное с заболеванием
2006, Генетическая нестабильность и неврологические заболевания
Соматический мозаицизм расширенных повторений CAG CTG у людей и мышей: динамика, механизмы и последствия
2006, Генетическая нестабильность и неврологические заболевания
. Исследование. охлаждение тела на механику дыхательной системы и гистерезис у крыс
Respiratory Physiology & Neurobiology, Volume 189, Issue 1, 2013, pp. 52-58
Литературные отчеты и теоретические соображения предполагают, что охлаждение тела может влиять на дыхательную механику in vivo .
 Для проверки этой гипотезы были исследованы здоровые крысы с использованием метода окклюзии конечного надувания в контрольных условиях и после полного охлаждения тела. Рассчитывали параметры дыхательной механики, площади гистерезиса, инспираторную работу дыхания, его эластическую и резистивную составляющие. После охлаждения тела (средняя ректальная температура от 36,6 ± 0,25 до 32,1 ± 0,26 °С) омическое и добавочное вязкоупругое сопротивления дыхательной системы, гистерезис, общая инспираторная работа дыхания и его резистивная составляющая возрастали. Достоверных изменений средних значений статической и динамической эластичности дыхательной системы и связанного с ней эластического компонента работы дыхания не выявлено. Эти данные свидетельствуют о том, что охлаждение тела увеличивает механическую инспираторную работу дыхания за счет увеличения диссипации резистивного давления. Этот эффект очевиден даже при ограниченных колебаниях температуры, и предполагается, что он может иметь место в случае случайной или терапевтической гипотермии.
Для проверки этой гипотезы были исследованы здоровые крысы с использованием метода окклюзии конечного надувания в контрольных условиях и после полного охлаждения тела. Рассчитывали параметры дыхательной механики, площади гистерезиса, инспираторную работу дыхания, его эластическую и резистивную составляющие. После охлаждения тела (средняя ректальная температура от 36,6 ± 0,25 до 32,1 ± 0,26 °С) омическое и добавочное вязкоупругое сопротивления дыхательной системы, гистерезис, общая инспираторная работа дыхания и его резистивная составляющая возрастали. Достоверных изменений средних значений статической и динамической эластичности дыхательной системы и связанного с ней эластического компонента работы дыхания не выявлено. Эти данные свидетельствуют о том, что охлаждение тела увеличивает механическую инспираторную работу дыхания за счет увеличения диссипации резистивного давления. Этот эффект очевиден даже при ограниченных колебаниях температуры, и предполагается, что он может иметь место в случае случайной или терапевтической гипотермии.
Исследовательская статья
Отбор генов на основе модулей коэкспрессии для распознавания рака
Журнал теоретической биологии, том 362, 2014 г., стр. 75-82
Профили экспрессии генов используются для распознавания образцов пациентов для диагностики рака и терапия. Отбор генов имеет решающее значение для высокой производительности распознавания. В обычных методах отбора генов гены рассматриваются как независимые индивидуумы, и корреляция между генами не используется эффективно. В этом описании предлагается метод отбора генов на основе модулей коэкспрессии для распознавания рака. Во-первых, в наборе данных о раке строится взвешенная корреляционная сеть в соответствии с корреляцией между каждой парой генов, идентифицируются разные модули из этой сети, а значимые модули выбираются для последующего исследования. Во-вторых, на основе этих информативных модулей прирост информации применяется для выбора генов признаков для распознавания рака. Затем с помощью LOOCV проводятся эксперименты с различными алгоритмами классификации, и результаты показывают, что предложенный метод обеспечивает лучшую точность классификации, чем традиционные методы отбора генов.
 Наконец, с помощью анализа обогащения онтологии генов была подтверждена биологическая значимость совместно экспрессируемых генов в определенных модулях.
Наконец, с помощью анализа обогащения онтологии генов была подтверждена биологическая значимость совместно экспрессируемых генов в определенных модулях.Научная статья
Топология функциональных сетей МРТ всего мозга: улучшение усеченной безмасштабной модели
Physica A: Статистическая механика и ее приложения, том 405, 2014 г., стр. 151-158
Сети соединений в человеческом мозгу были предметом интенсивных недавних исследований, однако их топология до сих пор изучена лишь частично. Мы анализируем взвешенные сети, рассчитанные по данным функциональной магнитно-резонансной томографии (фМРТ), полученным в ходе выполнения задания. Расширяя предыдущую работу в этой области, наш анализ сохраняет все связи между всеми вокселами в данных фМРТ всего мозга, вычисляя корреляции между примерно 200 000 вокселей на субъекта для 10 субъектов. Мы оцениваем степень, в которой этот богатый набор данных может быть описан существующими моделями безмасштабной или экспоненциально усеченной безмасштабной топологии, а также сравниваем результаты по большому количеству более сложных топологических моделей.
 Наши результаты показывают, что новая «логарифмическая квадратичная» модель, представленная в этой статье, значительно лучше подходит для сетей функциональных связей на уровне вокселей в человеческом мозге.
Наши результаты показывают, что новая «логарифмическая квадратичная» модель, представленная в этой статье, значительно лучше подходит для сетей функциональных связей на уровне вокселей в человеческом мозге.Исследовательская статья
Использование биологических знаний для построения нечетких сетей генных ассоциаций
Applied Soft Computing, Volume 42, 2016, pp. 144-155
Сети генных ассоциаций стали одним из наиболее важных подходов к моделированию биологических процессов с помощью данных экспрессии генов. Согласно литературным данным, методы, основанные на совместной экспрессии, являются основными подходами к идентификации сетей ассоциаций генов, поскольку такие методы могут идентифицировать паттерны экспрессии генов в наборе данных и могут определять отношения между генами. Эти методы обычно имеют два принципиальных недостатка. Во-первых, они зависят от качества исходного набора данных для построения надежных моделей из-за чувствительности к шуму данных.
 Во-вторых, эти методы требуют, чтобы пользователь выбрал пороговое значение, чтобы определить, является ли отношение биологически значимым. Из-за этих недостатков такие методы могут игнорировать некоторую важную информацию.
Во-вторых, эти методы требуют, чтобы пользователь выбрал пороговое значение, чтобы определить, является ли отношение биологически значимым. Из-за этих недостатков такие методы могут игнорировать некоторую важную информацию.Мы представляем новый нечеткий подход под названием FyNE (Fuzzy NETworks) для моделирования сетей ассоциаций генов. FyNE имеет две основные особенности. Во-первых, он может справляться с шумом данных, используя протокол на основе нечетких множеств. Во-вторых, предлагаемый подход может включать предварительные биологические знания на этапе моделирования с помощью функции нечеткого агрегирования. Эти особенности помогают получить некоторое представление о сомнительных отношениях генов.
Производительность FyNE проверялась в четырех различных экспериментах. Во-первых, улучшение, предлагаемое FyNE по сравнению с результатами метода, основанного на совместной экспрессии, с точки зрения идентификации сетей генов, было продемонстрировано на разных наборах данных из разных организмов.
 Во-вторых, результаты, полученные FyNE, показали его низкую чувствительность к шумовым данным в эксперименте со случайностью. Кроме того, FyNE может вывести генные сети с биологической структурой в топологическом анализе. Наконец, правильность предложенного нами метода была подтверждена сравнением его эффективности с некоторыми репрезентативными методами идентификации генных сетей 9.0003
Во-вторых, результаты, полученные FyNE, показали его низкую чувствительность к шумовым данным в эксперименте со случайностью. Кроме того, FyNE может вывести генные сети с биологической структурой в топологическом анализе. Наконец, правильность предложенного нами метода была подтверждена сравнением его эффективности с некоторыми репрезентативными методами идентификации генных сетей 9.0003Исследовательская статья
Эффективное заполнение длинных пробелов в ДНК в бесклеточной системе млекопитающих: потенциально новый
анализ репликации ДНК in vitroBiochimie, том 95, выпуск 2, 2013 г., стр. 320-328
К анализу репликации ДНК млекопитающих in vitro подходили по-разному. Используя кольцевые дуплексные субстраты с разрывами, содержащие одноцепочечный участок ДНК из 500 оснований, мы сконструировали бесклеточную систему млекопитающих, в которой может воспроизводиться физиологическая репликация ДНК. Реакция плазмидного субстрата с гэпом с неочищенными экстрактами клеток HeLaS3 человека индуцирует эффективный синтез ДНК in vitro .
 Индуцированный синтез сильно ингибировался афидиколином и полностью зависел от добавленного в систему dNTP. В клеточных экстрактах, в которых PCNA ступенчато истощалась путем иммунопреципитации, синтез ДНК соответственно снижался. Эти данные свидетельствуют о том, что в этой системе могут функционировать главным образом репликативные ДНК-полимеразы, особенно pol дельта. Кроме того, в этой системе синтез ДНК поддается количественной оценке, что позволяет нам оценить эффективность индуцированной репликации ДНК. Наша система чувствительно и количественно обнаружила снижение эффективности репликации ДНК в ДНК-субстратах, поврежденных окислением или УФ-сшиванием, и в присутствии мощного терминатора цепи, ara-CTP. Количественная оценка репликации ДНК млекопитающих может дать различные преимущества не только в фундаментальных исследованиях, но и в разработке лекарств.
Индуцированный синтез сильно ингибировался афидиколином и полностью зависел от добавленного в систему dNTP. В клеточных экстрактах, в которых PCNA ступенчато истощалась путем иммунопреципитации, синтез ДНК соответственно снижался. Эти данные свидетельствуют о том, что в этой системе могут функционировать главным образом репликативные ДНК-полимеразы, особенно pol дельта. Кроме того, в этой системе синтез ДНК поддается количественной оценке, что позволяет нам оценить эффективность индуцированной репликации ДНК. Наша система чувствительно и количественно обнаружила снижение эффективности репликации ДНК в ДНК-субстратах, поврежденных окислением или УФ-сшиванием, и в присутствии мощного терминатора цепи, ara-CTP. Количественная оценка репликации ДНК млекопитающих может дать различные преимущества не только в фундаментальных исследованиях, но и в разработке лекарств.Исследовательская статья
Отрицательная эластичность легких у пациентов со спонтанным дыханием на искусственной вентиляции легких
IFAC-PapersOnLine, том 50, выпуск 1, 2017 г.
 , стр. 15179-15184 принятие решений для пациентов на механической вентиляции (МВ) в отделении интенсивной терапии (ОИТ). Однако большинство математических моделей разработаны для пациентов с полной седацией и не особенно надежны для применения к пациентам со спонтанным дыханием (СБ). Мониторинг дыхательной механики пациентов с SB требует инвазивных клинических протоколов и оборудования, которые клинически слишком интенсивны для выполнения. Предыдущее исследование выдвинуло гипотезу о том, что отрицательная эластичность возникает у пациентов с ПС из-за усилий, прилагаемых пациентом. Таким образом, эта статья направлена на дальнейшее исследование распределения отрицательной эластичности у пациентов с SB путем расширения неинвазивной модели изменяющейся во времени эластичности. Захватив и проанализировав распределение отрицательной эластичности у пациента с SB, он может обеспечить более последовательный мониторинг и принятие решений, особенно для пациентов с SB. В этом исследовании использовались клинические данные 5 пациентов с МВ из больницы Крайстчерч.
, стр. 15179-15184 принятие решений для пациентов на механической вентиляции (МВ) в отделении интенсивной терапии (ОИТ). Однако большинство математических моделей разработаны для пациентов с полной седацией и не особенно надежны для применения к пациентам со спонтанным дыханием (СБ). Мониторинг дыхательной механики пациентов с SB требует инвазивных клинических протоколов и оборудования, которые клинически слишком интенсивны для выполнения. Предыдущее исследование выдвинуло гипотезу о том, что отрицательная эластичность возникает у пациентов с ПС из-за усилий, прилагаемых пациентом. Таким образом, эта статья направлена на дальнейшее исследование распределения отрицательной эластичности у пациентов с SB путем расширения неинвазивной модели изменяющейся во времени эластичности. Захватив и проанализировав распределение отрицательной эластичности у пациента с SB, он может обеспечить более последовательный мониторинг и принятие решений, особенно для пациентов с SB. В этом исследовании использовались клинические данные 5 пациентов с МВ из больницы Крайстчерч. Площадь под кривой (AUC) для изменяющейся во времени эластичности, E drs , оценивается и анализируется у каждого пациента с SB. Результаты представлены в виде медианы и межквартильного диапазона (IQR) для непрерывных данных в общей сложности за 82 часа. В результате было обнаружено, что все пациенты имеют распределение отрицательной эластичности, причем у пациентов 1 и 3 распределение отрицательной эластичности выше из-за усилия SB. Среднее значение отрицательной эластичности для всех пациентов колеблется от -0,66 см H 90 101 2 90 102 0 с/л до -2,27 см H 90 101 2 90 102 0 с/л. Отрицательная эластичность возникает, когда в плевральной полости пациента создается отрицательное давление, в результате чего объем воздуха поступает в легкие. Таким образом, фиксируя и просматривая распределение отрицательной эластичности у пациентов с SB, можно обеспечить более последовательный мониторинг и принятие решений, особенно для пациентов с SB.
Площадь под кривой (AUC) для изменяющейся во времени эластичности, E drs , оценивается и анализируется у каждого пациента с SB. Результаты представлены в виде медианы и межквартильного диапазона (IQR) для непрерывных данных в общей сложности за 82 часа. В результате было обнаружено, что все пациенты имеют распределение отрицательной эластичности, причем у пациентов 1 и 3 распределение отрицательной эластичности выше из-за усилия SB. Среднее значение отрицательной эластичности для всех пациентов колеблется от -0,66 см H 90 101 2 90 102 0 с/л до -2,27 см H 90 101 2 90 102 0 с/л. Отрицательная эластичность возникает, когда в плевральной полости пациента создается отрицательное давление, в результате чего объем воздуха поступает в легкие. Таким образом, фиксируя и просматривая распределение отрицательной эластичности у пациентов с SB, можно обеспечить более последовательный мониторинг и принятие решений, особенно для пациентов с SB.
- †
S.
 E.M. и М.К. внесли одинаковый вклад в это исследование.
E.M. и М.К. внесли одинаковый вклад в это исследование.
Copyright © 2003 Elsevier Science Ltd. Все права защищены.
Supermicro AOM-CTG-i2SM-12 2-портовая плата адаптера MicroLP 10GbE SFP+ с Intel 82599EN
- Продукция
- Supermicro AOM-CTG-i2SM-12 2-портовая плата адаптера MicroLP 10GbE SFP+ 1 с Intel 82598EN 9004 9004 9004
Small MicroLP, подходит для 12-узловых систем Supermicro MicroCloud
Виртуализация, гибкость для сетей LAN и SAN, встроенный модуль NC-SI
Технология Intel QuickData, VMDq и PC-SIG SR-IOV, соответствие RoHS 6/6
Dual SFP 10Gb Разъемы, поддержка медных и оптоволоконных кабелей прямого подключения
10-гигабитный Ethernet-адаптер AOM-CTG-i2SM-12 — это самый компактный и масштабируемый 10-гигабитный Ethernet-адаптер для современных требовательных сред центров обработки данных.
Благодаря встроенному интерфейсу NC-SI этот адаптер обеспечивает подключение как для передачи данных, так и для удаленного управления, что упрощает прокладку кабелей в центре обработки данных.
AOM-CTG-i2SM-12 разработан в фирменном и малогабаритном форм-факторе MicroLP для соответствия 12-узловым системам Supermicro MicroCloud.

Основанный на сетевом контроллере Intel 10GbE 82599ES, он отвечает высоким требованиям центров обработки данных следующего поколения, предоставляя функции виртуализации, гибкость для сетей LAN и SAN и проверенную надежную производительность.
- 9000 Air Services (Hebei Airlines) 9000
HELITY Copter Airlines (HTY)
Hello Jets (h4)
Helvetic (2L)
Hesa Airlines (H8)
Hex’Air (UD)
Himalaya Airlines (H9) 9003 9003 Авиация Hinter (
)
HiSky (h5)
HiSky (H7)
Hong Kong Airlines (HX)
Hong Kong Express (UO)
Hongtu Airlines (A6)
Hunnu Air (MR)
IBC Airways (II)
Iberia (IB)
Ibex Airlines
Ibom Air (QI)
Icelandair (FI)
Iliamna Air Taxi (V8)
IndiGo Airlines (6E)
Int Air Iles (IIA)
interCaribbean Airways (JY)
InterSky (3L)
ИрАэро (IO)
Иран Эйр (IR)
Iran Air Tours (B9)
Iran Aseman (EP)
Иракские авиалинии (IA)
Island Air Express (I4)
Island Air Service (2O)
Israir (6H)
Izhavia) 90 (Izhavia)
Jamaica Air Shuttle (J6)
Jambojet (JM)
Japan Airlines (JL)
Jazeera Airways (J9)
JC International Airlines (QD)
Jeju Air (7C) 9006 9006 Jet 9000 Jetair Caribbean (4J)
JetBlue (B6)
Jetsmart (JA)
JetStar (JQ)
JetStar (GK)
Jetstar Asia (3K)
Jetsuitex (XE)
Airlines Jin Jin Jin Jin Jin JIN JIN JIN JIN JIN JINJ
Jordan Aviation (R5)
Joy Air (JR)
JTA (NU)
Jubba Airways (JZ)
Jubba Airways (3J)
Juneyao Airlines (HO)
Kaiserair (Kai)
66666666666666666666666666666666 Kam Air (RQ)
KC International (3Q)
Kenmore Air (M5)
Kenya Airways (KQ)
Key Lime Air (KG)
Kish Air (Y9)
KLM (KL)
Komiaviatrans (KO)
Korean Air (KE)
3 90viaSSJ)
3
KrasA Airlines (KY)
Kuwait Airways (KU)
La Compagnie (B0)
La Costena (NIS)
LAM Mozambique (TM)
Lanhsa Airlines (LNH)
Lamei Airlines (003) 90 90 (QV)
Lao Skyway (LK)
LASER Airlines (QL)
Latam (LA)
Latam Ecuador (XL)
Liat (LI)
Libyan Airlines (LN)
Livyan Wings (YL)
Lion Air (JT)
Livingston (JN)
Loganair (JT)
Livingston (JN)
(JT)
(JN)
(JT)
LM)
Loong Air (GJ)
LOT (LO)
Lucky Air (8L)
Lufthansa (LH)
Lufttransport (LTR)
Luxair (LG)
Luxwing (BN)
MAHAN AIRES (W5)
Malaysia Airlines (MH)
Maldivian (Q2)
Malindo Air (OD)
Mandarin Airlines (AE)
Mann Yadanarpon (7Y)
Mauritania Airlines (L6)
Maya Island Air (2M)
MAYAir (MYI)
3 MHS
3 MHS
3
MIAT Монгольские авиалинии (OM)
Ближний Восток (ME)
Midwest Airlines (Египет) (WV)
Mombasa Air Safari (RRV)
Myanmar (UB)
Myanmar Airways (8M)
Na Air 900 IN)
Nas Air (XY)
Nauru Airlines (ON)
Neos (NO)
Nepal Airlines (RA)
Nesma Airlines (NE)
Niger Airlines (6N)
Nile Air (NP)
Nok Air (DD)
(N5)
Нордавиа (5N)
NordStar (Y7)
Nordwind (N4)
Norlandair (FNA)
Norse Atlantic Airways (N0)
North-western Airways (03J3 900 Airways) 9000 )
Норвежский (D8)
Норвежский (DY)
Nouvelair (BJ)
Okay Airways (BK)
Olympic Air (OA)
Oman Air (WY)
Orbest (6O)
Orenair (R2)
SAS0 (SK0003 SAS0) )9 Coastal Airlines (8P)
Пакистан (PK)
Pan Pacific Airlines (8Y)
Papillon Airways (HI)
Paranair (ZP)
Pascan Aviation (P6)
Passaredo (2Z каждый) 900 )
Pegas Fly (EO)
Pegasus (ПК)
People’s Viennaline (PE)
Perimeter Aviation (YP)
Петропавловск-Камчатский (PTK)
Philippine Airlines (PR)
Pineapple Air (PNP)
Ultra Plus (OG)
3
Победа (DP)
Полярные авиалинии (PI)
Портер (PD)
Precision Air (PW)
Primera Air (PF)
Proflight Zambia (P0)
Qas (03)
Provincial Airlines (03)
Provincial Airlines (03) QF)
Qatar Airways (QR)
Qazaq Air (IQ)
Qingdao Airlines (QW)
Ravn Alaska (7H)
Red Wings (WZ)
Regional (YS)
Regional Air (8N) 900L3 Express
3
3
Royal Air Maroc (AT)
Royal Brunei Airlines (BI)
Royal Jordanian (RJ)
Ruili Airlines (DR)
RusLine (7R)
RUTACA Airlines (5R)
RwandAir (W03) 9000 Air Service (7S)
Ryanair (Франция)
Ryanair UK (RK)
S7 Airlines (S7)
Safair (FA)
Safarilink Aviation (F2)
SalamAir (OV)
Sansa (RZ)
SATENA (9R)
Саудовская Аравия (SV)
Scat Air (DV)
Scenic Airlines (YR)
Scoot (TR)
Seaborne Airlines (BB) 9003 9003 Servant 90irER (Servant)
Serene Air (8D)
Северсталь (D2)
Shaheen Air (NL)
Shandong Airlines (SC)
Shanghai Airlines (FM)
Sharp Airlines (SH)
Shenzhen Airlines (ZH)
Shree Airlines (N9)
Sichuan Airlines (3U)
Silver Air (0SLD)6
Silver Airways (3M)
Simrik Airlines (RMK)
Singapore Airlines (SQ)
Skippers (HK)
SKS Airways (KI)
Sky Airline (h3)
Sky Angkor0 9006 Airlines (ZA003) Скай Экспресс (GQ)
Skybus (IOS)
SkyGreece (GW)
Skyjet (DU)
Skymark Airlines (BC)
Skytrans Airlines (QN)
SkyWork Bay Airlines (SX)
SmartWings (6y3 Air) 900 900 2E)
Solaseed Air (6J)
Solomon Airlines (IE)
Somon Air (SZ)
Sounds Air (S8)
South African Airways (SA)
Southern Air Charter (PL)
Southern Airways 90 Экспресс (9X)
Southwest Airlines (WN)
Spicejet (SG)
Spirit Airlines (NK)
Spring Airlines (9C)
Spring Airlines Japan (IJ)
SriLankan Airlines (UL)
Sriwijaya Air (SJ)
(0PV) 9009St Barth
Star Air (S5)
Star Flyer (7G)
Star Peru (2I)
Starbow (S9)
Starlux Airlines (JX)
STP Airways (8F)
9 Sun Airways 0 (SD) Country Airlines (SY)
Sundair (SR)
SunExpress (XQ)
Sunrise Airways (S6)
Sunwing (WG)
Suparna Airlines (Y8)
Super Air Jet (IU)
Surinam Airways (PY)
(00X3063) (WO)Sylt Air (7E)
Sirian Air (RB)
TAAG Angola (DT)
Taban Air (HH)
TAG Airlines (5U)
TAME (EQ)
6
3 )
TAP Portugal (TP)
Taquan Air (K3)
TAR Aerolíneas (YQ)
Tarco Air (3T)
Tarom (RO)
Tassili Airlines (SF)
TezJet Airlines (TEZ)
Thai AirAsia (FD)
3
AirAsia (X6X6X6X) Thai Airways (TG)
Thai Lion Air (SL)
Thai Smile (WE)
Thai Summer Airways (9T)
Thai Vietjet Air (VZ)
Thunder Airlines (THU)
Tianjin Airlines (GS)
Тибетские авиалинии (ТВ)
Тайгерэйр (ИТ)
Toumai Air (9D)
Tradewind Aviation (TJ)
Trans Air Congo (Q8)
Trans Guyana Airways (TGY)
TransAsia (GE)
Transavia (TO)
900H006 () Трансавиабалтика (КТБ)
Трансвест Эйр (4T)
Тригана Эйр (Ил)
Тропик Эйр (9N)
Тропик Эйрвейз (ТИ)
Царадиа (ТЗ)
TUI 9 003 003 (X3)
TUI Fly (ТБ)
TUI Fly (OR)
Tunisair (TU)
TunisAir Express (UG)
Turkish Airlines (TK)
Turkmenistan Airlines (T5)
TUS Airways (U8)
Twin Air (TW3)
Джет (Т7)
Украина Междунар.

Двухпортовая карта адаптера MicroLP 10GbE SFP+, Intel 82599EN — для систем MicroCloud и Twin Server с слотом расширения microLP Для системной интеграции/комплекта, ТОЛЬКО
https://www. wiredzone.com/shop/product/10020913-supermicro-aom-ctg-i2sm-12-2-port-microlp-10gbe-sfp-adapter-card-with-intel-82599en-7783
wiredzone.com/shop/product/10020913-supermicro-aom-ctg-i2sm-12-2-port-microlp-10gbe-sfp-adapter-card-with-intel-82599en-7783
325,50 $
325,50 $ 325,5 USD325,50 $
Опция недоступна
БЕСПЛАТНАЯ ДОСТАВКА
Такой комбинации не существует.
Добавить в корзину
Extra Specifications for Supermicro AOM-CTG-i2SM-12 2-Port MicroLP 10GbE SFP+ Adapter Card with Intel 82599EN
| Main Specifications | |||
| Device Type | 10 Gigabit Ethernet Adapter | ||
| Form Фактор | MicroLP | ||
| Размеры (ШxГxВ) | Размеры печатной платы карты: 113 мм (4,45 дюйма) x 49 мм (1,93 дюйма) | ||
| Расширение/связь | |||
| Расширение/подключение | Dual 10GbE SFP+ | ||
| Разное | |||
| Особенности /CPUs, Tx/Rx IP, возможности разгрузки контрольной суммы SCTP, TCP и UDP (IPv4, IPv6), масштабирование на стороне приема и передачи для сред Windows и масштабируемый ввод-вывод для сред Linux | |||
| Cables Required | SFP+ Direct attach copper cables | ||
| Fiber-optic cables (with required optional SFP+ transceivers) | |||
| Compatible Servers | SYS-5039MC-h22TRF (X11SCE-F) | ||
| SYS-5039MS-H22TRF (x11SSE-F) | |||
| Стандарты соответствия | ROHS COMPERINT 6/6 | ||
| СЕТИ | |||
| Функции управления | Поддержка Preboot eXecution Environment (PXE), счетчики статистики Simple Network Management Protocol (SNMP) и Remote Network Monitoring (RMON), удаленная загрузка iSCSI, NC-SI для удаленного управления, поддержка Asset Management на платформах Supermicro , Теги активов контроллера, такие как номер детали, версия, серийный номер и MAC-адреса поддержка управления потоком | ||
| Программное обеспечение / системные требования | |||
| ОС. | Условия окружающей среды | ||
| Условия эксплуатации | Рабочая температура: от 0°C до 55°C (от 32°F до 131°F) | ||
| Температура хранения: от -40°C до 70°C (-40°F) до 158°F) | |||
| Влажность: 90% неконденсирующей относительной влажности при 35 ° C | |||
| Варранта: | 3 годы. |
| Провайдер: | Supermicro |
| Телефон: | 305-640-0300 |
| URL: | Нажмите здесь для веб -сайта производителя |
| . |
| Если вам нужна техническая поддержка для этого товара, обращайтесь: | |
| Поставщик: | Supermicro |
| Type of Support: | FULL |
| Phone No.: | 408-503-8000 |
| URL: | Click here for Manufacturer Website |
Direct рейсы из Картахены (CTG)
40-Mile Air (Q5)
9 Air (AQ)
Advanced Air (AN)
Aegean (A3)
Aer Lingus (EI)
9 Aero Contractors (003)
Аэро Монголия (M0)
Aero vip (RVP)
Aeroflot (SU)
Aerolineas Argentinas (AR)
Aerolíneas Mas (N3)
Aerolíneas Sosa (S0)
Aerolink Uganda (A8)
Aeromar (VW)
Aeromexico (AM)
Aerovías DAP (V5)
афганская авиалиния (HN)
Africa World Airlines (AW)
African Express (XU)
Afrijet (J7)
Afriqiyah (8U) Air 9000 )
Эйр Алжири (AH)
Air Alsie (6I)
Air Antilles Express (3S)
Air Arabia (G9)
Air Arabia Egypt (E5)
Air Arabia Maroc (3O)
Air Astana (KC)
Air Austral (UU) )
Air Baltic (BT)
Air Belgium (KF)
Air Bishkek (KR)
Air Botswana (BP)
Air Burkina (2J)
Air Busan (BX)
Air Cairo (SM) 900
Air Caledonie (TY)
Air Canada (AC)
Air Caraibes (TX)
Air Caucasus (UY)
Air Century (Y2)
Air Changan (9H)
Air Chathams (3C)
Air China (CA)
Air Choice One (3E)
Air Corsica
Air Cote D’Ivoire (HF)
Air Creebec (YN)
Air Do (HD)
Air Dolomiti (EN)
Air Europa (UX)
Air Excel (XLL)
Air Excurions (
Air Excurions) X4)
Air Flamenco (F4)
Air France (AF)
Air Greenland (GL)
Air Guilin (GT)
Air India (AI)
Air Inuit (3H)
Air KBZ (K7)
Air Kiribati (IK)
Air Labrador (WJ)
3 Air Lianica (
)
Air Loyaute (RLY)
Air Macau (NX)
Air Madagascar (MD)
Air Malta (KM)
Air Marshall Islands (CWM)
Air Mauritius (MK)
90 Air Moldova 0UAir New Zealand (NZ)
Air Niugini (PX)
Air North (4N)
Air Panama (7P)
Air Peace (P4)
Air Pegasus (OP)
Air Rarotonga (GZ)
Air Saint Pierre (PJ)
Air Senegal (HC)
Air Seoul (RS)Air Serbia (JU)
Air Seychelles (HM)
Air Sunshine (RSI)
Air Tahiti (VT)
Air Tahiti Nui (TN)
Air Tanzania (T)
3 Air Tindi
Air Transat (TS)
Air Vanuatu (NF)
Air Zimbabwe (UM)
Air-India Express (IX)
AirAsia (QZ)
AirAsia (AK)
AirAsia (Z2)
AirAsia India (I5)
AirAsia Japan (DJ)AirAsia
Airblue (PA)
Aircalin (SB)
AirKenya Express (P2)
Airlines of Tasmania (ATM)
Airlines PNG (CG)
Airlink (4Z)
Airnorth (TL)
3 9
Akasa Air (QP)
Al-Naser Airlines (NR)
Alaska (AS)
Alaska Seaplane (J5)
AlbaStar (AP)
Albawings (2B)
Alexandria (DQ)
Alidaunia (LID)
Alitalia (AZ)
Allegiant (G4)
Alliance Air (9I)
Alliance Airlines (QQ)
Alrosa (6R)
Amakusa Airlines (MZ)
Amapola Flyg (HP)
Amaszonas (Z8)
9006 90 American Airlines (AA003) NH)Ангарские авиалинии (2G)
Anguilla Air (Q3)
APG Airlines (GP)
Arajet (DM)
Ariana (FG)
Arik Air (W3)
Arkia (IZ)
9006 Aruba Airlines (00A6Airways) Armenia Airways (AG)
Asia Atlantic Airlines (HB)
Asiana Airlines (OZ)
ASKY Airlines (KP)
ASL Airlines (5O)
Astra Airlines (A2)
ATA Airlines (TBZ)
Atlantic Airways 90 (RC)
Auric Air (UI)
Aurigny (GR)
Aurora (HZ)
Austrian (OS)
Avelo Airlines (XP)
Avia Traffic (YK)
Aviair (GD)
SalvTAador Avianca (AV3) 9000
Aviator Airlines (T9)
Avion Express (x9)
Avior (9V)
Азербайджан (J2)
Azimuth (A4)
Azores Airlines (S4)
Azul (AD)
Azors Airlines (S4)
Azul (AD)
9
9
9
9
9
9
9
9
9
9
Azors Airlines. (ZF)
(ZF)
Badr Airlines (J4)
Bahamasair (UP)
Bamboo Airways (QH)
Bangkok Airways (PG)
BAR Aviation (HE)
Batik Air (ID)
Bearskin Airlines (JV)
Beijing Capital (JD)
3 06
Belavia Belleair (LZ)Bering Air (8E)
Berjaya Air (J8)
Berniq Airways (NB)
Bestfly Cabo Verde (3B)
Biman Airlines (BG)
Binter Canarias Эйр (0B)
Острова Блу (SI)
Bluebird Airways (BZ)
BoA (OB)
Borajet (YB)
Boutique Air (4B)
BRA (TF)
Breeze Airways (MX)
British Airways 600006 British Airways (SN)
Buddha Air (U4)
Bulgaria Air (FB)
Buraq Air (UZ)
CAA (BU)
Cabo Verde Airlines (VR)
CAI Second (VE)
Ca Airs Expressways (9Q)
Калифорния Пасифик Эйрлайнз (4A)
Calm Air (MO)
Camair-Co (QC)
Cambodia Angkor Air (K6)
Canadian North (5T)
Canaryfly (PM)
Cape Air (9K) Caribbean Airlines (
)
Caspian Airlines (CPN)
Cathay Dragon (KA)
Cathay Pacific (CX)
Cayman Airways (KX)
CEBGO (DG)
CEBU Pacific (5J)
CEBGA (C2)
9
. (5Z)
(5Z)
Централ Маунтин Эйр (9M)
Chalair (CE)
Chengdu Airlines (EU)
China Airlines (CI)
China Eastern (MU)
China Express (G5)
China Southern (CZ)
China United (KN)
6 Cinnamon Air (C7)
Citilink (QG)
Coastal Aviation (CQ)
Colorful Guizhou Airlines (GY)
Condor (DE)
Congo Airways (8Z)
Contour Aviation (LF)
63 Convia )
Копа Эйрлайнз (CM)
Копенгаген Airtaxi (CAT)
Corendon (XR)
Corendon (XC)
Corendon (CD)
Corsair (SS)
Airlines Coratia
Cuban )
Cyprus Airways (CY)
Czech Airlines (OK)
Daallo Airlines (D3)
Danish Air (DX)
Delta (DL)
Directflight (DCT)
Divi (
Divi)
Donghai Airlines (DZ)
Druk Air (KB) 9Edelweiss (MS)
EL AL (LY)
Elite Airways (7Q)
Emirates (EK)
Equaflight Service (E7)
Estelar (E4)
Estelar (ES)
9000ET (Эфиопия) Airlines
Etihad Airways (EY)
EuroAtlantic (YU)
Eurolot (K2)
Eurowings (4Y)
Eurowings (EW)
EVA Air (BR)
Evelop Airlines (E9)
Everts Air (5V)
9 Executive (9AIRZD)EWA (OW)EZ Air (7Z)
Far Eastern Air (FE)
Fastjet (FN)
Felix Airways (FXX)
Felix Airways (FO)
Fiji Airways (FJ)
6 air
)Firefly (FY)
Flair Airlines (F8)
FlexFlight (W2)
Florida West (RF)
Fly Always (8W)
Fly Arna (G6)
Fly Baghdad (IF)
Fly Corporate (FC)
Fly Jamaica (OJ) 9000 Montserrat (5M)
Fly One (5F)
Fly Oya (YI)
Fly Pelican (FP)
flyadeal (F3)
Flybe (BE)
Flydubai (FZ)

 2900
2900 7046
7046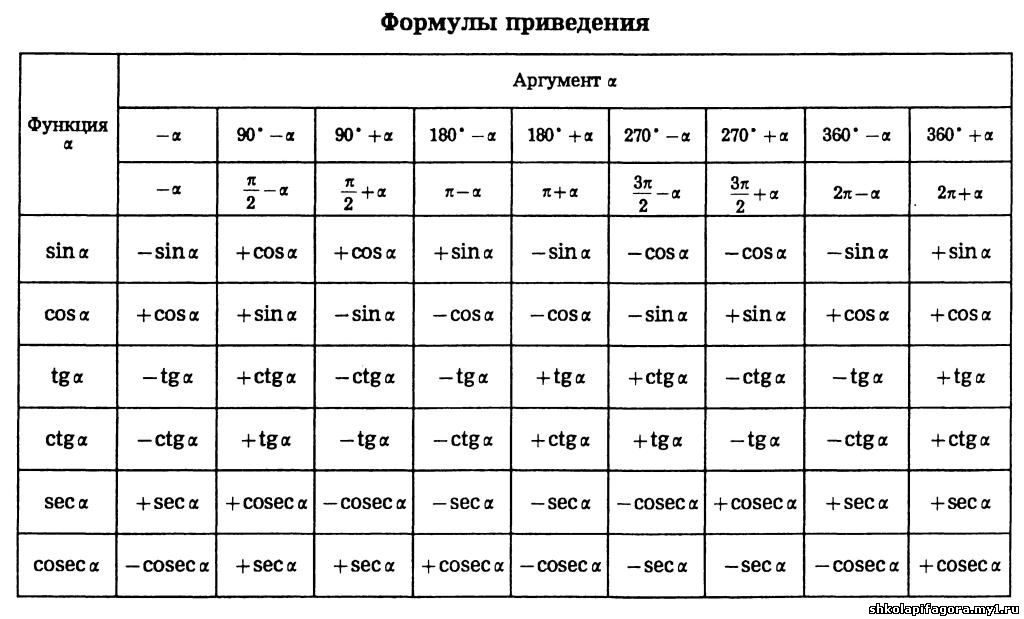 3559
3559 4826
4826 0000
0000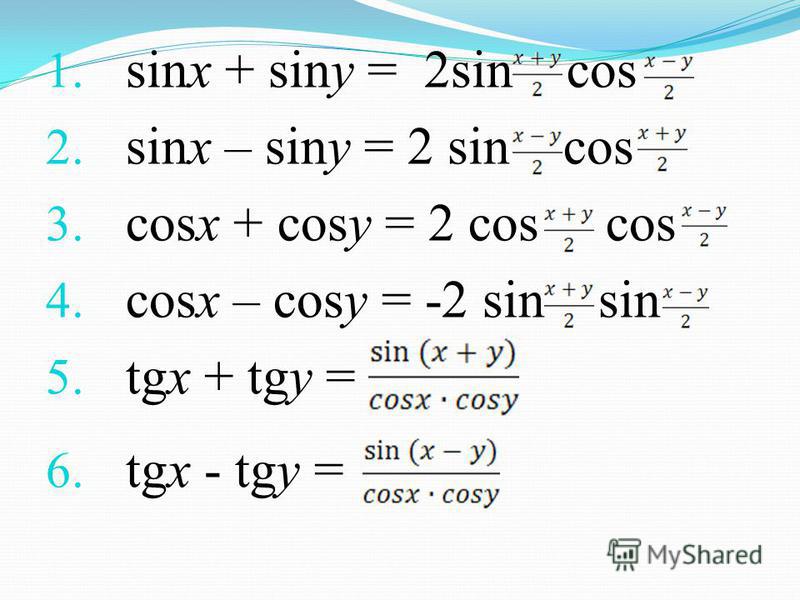 6745
6745 4245
4245 2126
2126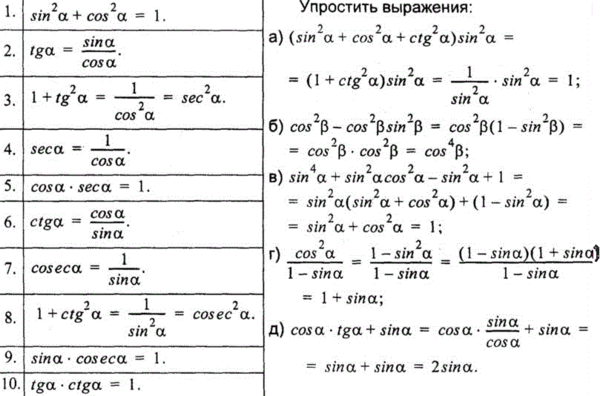 0175
0175 1228
1228 3249
3249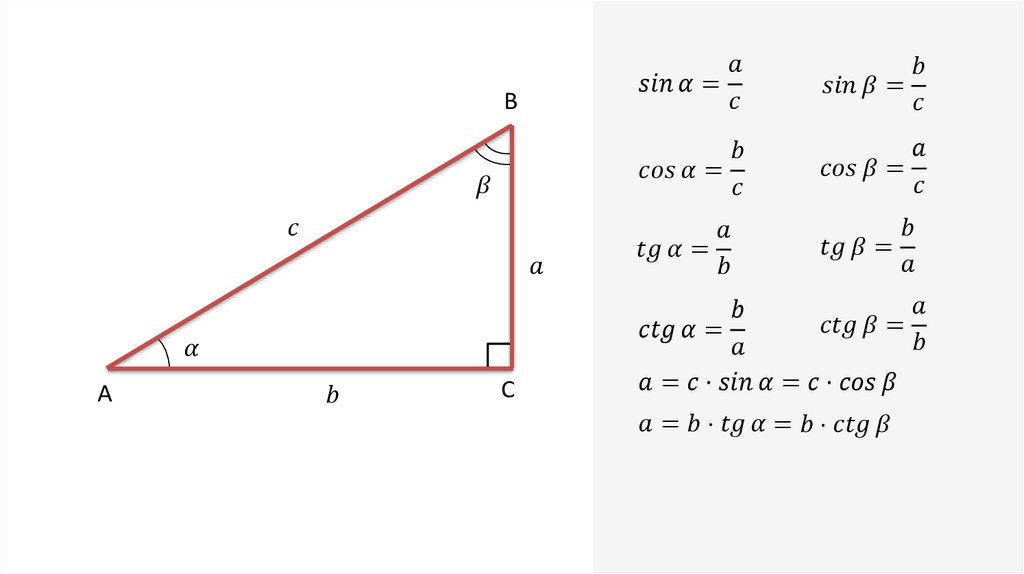 5543
5543 8391
8391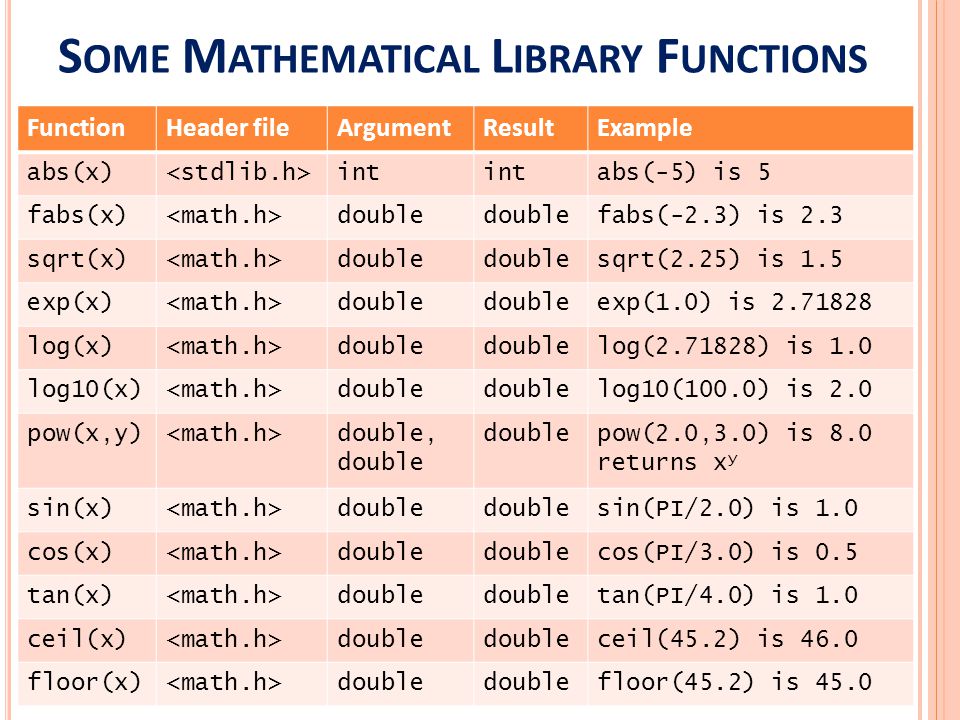 2349
2349 8807
8807 2709
2709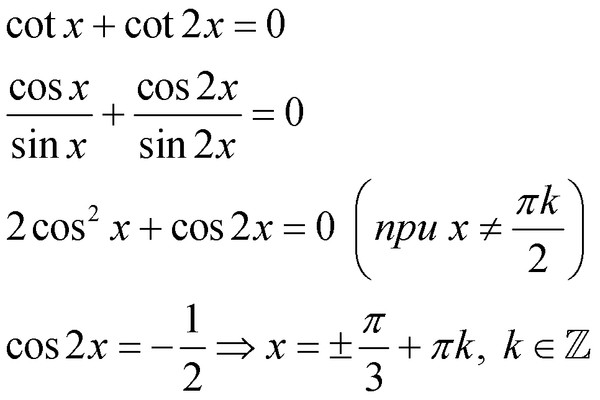 5144
5144 6363
6363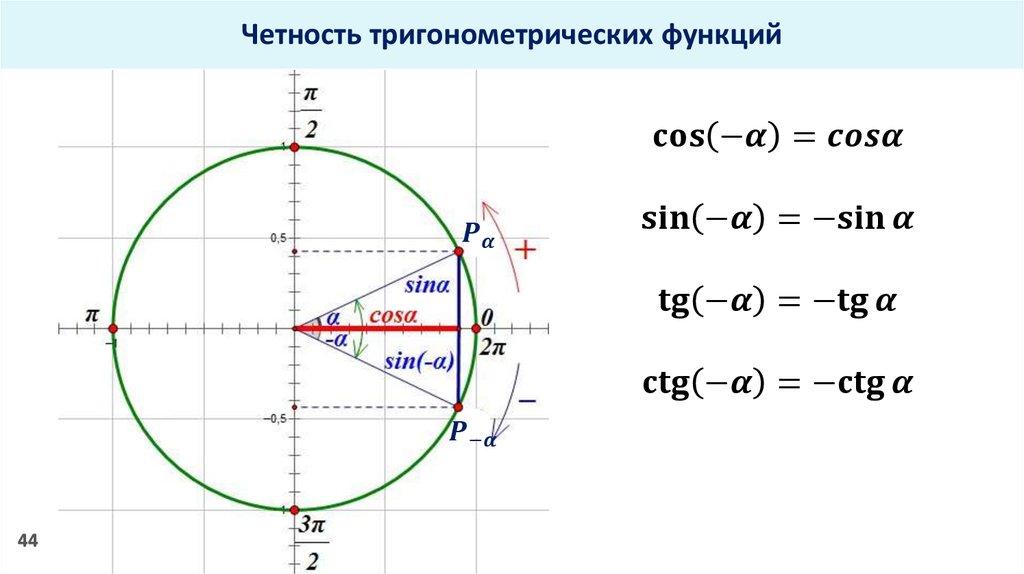 3315
3315 2460
2460 4281
4281 9657
9657 6494
6494 4040
4040 1944
1944 0175
0175 2126
2126 4245
4245 6745
6745 0000
0000 4826
4826 3559
3559 7046
7046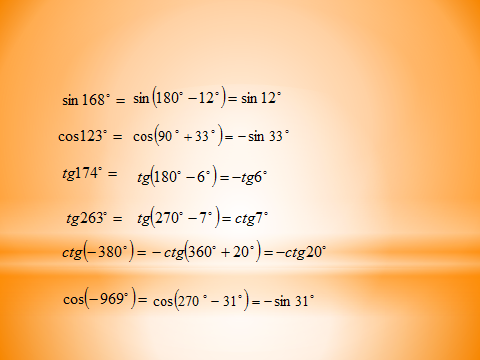 6363
6363

 , Кекис М., Столлар Б.Д., Прайс ГБ, Пирсон СЕ.
Там М. и др.
Дж Мол Биол. 2003 г., 19 сентября; 332 (3): 585-600. doi: 10.1016/s0022-2836(03)00880-5.
Дж Мол Биол. 2003.
PMID: 12963369
, Кекис М., Столлар Б.Д., Прайс ГБ, Пирсон СЕ.
Там М. и др.
Дж Мол Биол. 2003 г., 19 сентября; 332 (3): 585-600. doi: 10.1016/s0022-2836(03)00880-5.
Дж Мол Биол. 2003.
PMID: 12963369

 Хаглер Л.Д. и соавт.
ACS Med Chem Lett. 2021 21 мая;12(6):935-940. doi: 10.1021/acsmedchemlett.1c00064. электронная коллекция 2021 10 июня.
ACS Med Chem Lett. 2021.
PMID: 34141072
Бесплатная статья ЧВК.
Хаглер Л.Д. и соавт.
ACS Med Chem Lett. 2021 21 мая;12(6):935-940. doi: 10.1021/acsmedchemlett.1c00064. электронная коллекция 2021 10 июня.
ACS Med Chem Lett. 2021.
PMID: 34141072
Бесплатная статья ЧВК.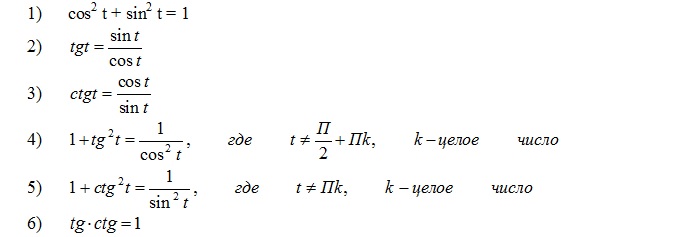 и др.
Нуклеиновые Кислоты Res. 2020 9 июля; 48 (12): 6654-6671. дои: 10.1093/нар/гкаа483.
Нуклеиновые Кислоты Res. 2020.
PMID: 32501506
Бесплатная статья ЧВК.
и др.
Нуклеиновые Кислоты Res. 2020 9 июля; 48 (12): 6654-6671. дои: 10.1093/нар/гкаа483.
Нуклеиновые Кислоты Res. 2020.
PMID: 32501506
Бесплатная статья ЧВК. Últimas tendencias en Expedia
Últimas tendencias en Expedia Kubota et al.
Kubota et al.  Письма
Письма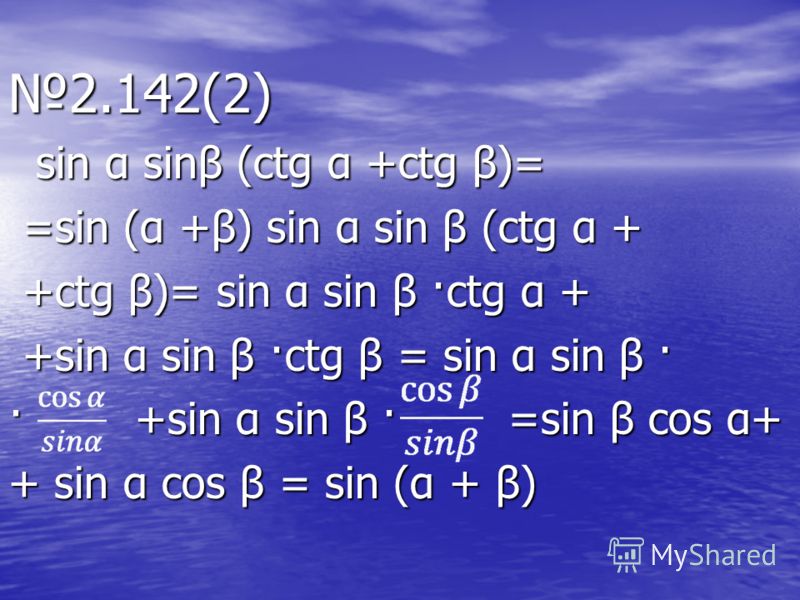 В этом обзоре мы сначала описываем молекулярные механизмы индуцированной повторами токсичности, которая является связующим звеном между экспансией повторов и патологией. Затем мы рассматриваем альтернативные структуры ДНК, образованные расширяемыми повторами, и рассматриваем доказательства того, что образование этих структур лежит в основе нестабильности повторов. Далее мы опишем последствия наличия длинных структурообразующих повторов на молекулярном уровне: соматическую и межгенерационную нестабильность, хрупкость и индуцированный повторами мутагенез. Мы обсуждаем причины гендерной предвзятости в нестабильности повторов между поколениями и тканевую специфичность нестабильности соматических повторов. Мы также рассматриваем известные пути, в которых репликация ДНК, транскрипция, репарация ДНК и состояние хроматина взаимодействуют и тем самым способствуют нестабильности повторов. Затем мы обсудим возможные причины сохранения болезнетворных повторов ДНК в геноме. Мы описываем доказательства, свидетельствующие о том, что эти повторы являются платой за преимущества наличия обильных повторов простых последовательностей для функции и эволюционируемости эукариотического генома.
В этом обзоре мы сначала описываем молекулярные механизмы индуцированной повторами токсичности, которая является связующим звеном между экспансией повторов и патологией. Затем мы рассматриваем альтернативные структуры ДНК, образованные расширяемыми повторами, и рассматриваем доказательства того, что образование этих структур лежит в основе нестабильности повторов. Далее мы опишем последствия наличия длинных структурообразующих повторов на молекулярном уровне: соматическую и межгенерационную нестабильность, хрупкость и индуцированный повторами мутагенез. Мы обсуждаем причины гендерной предвзятости в нестабильности повторов между поколениями и тканевую специфичность нестабильности соматических повторов. Мы также рассматриваем известные пути, в которых репликация ДНК, транскрипция, репарация ДНК и состояние хроматина взаимодействуют и тем самым способствуют нестабильности повторов. Затем мы обсудим возможные причины сохранения болезнетворных повторов ДНК в геноме. Мы описываем доказательства, свидетельствующие о том, что эти повторы являются платой за преимущества наличия обильных повторов простых последовательностей для функции и эволюционируемости эукариотического генома. Наконец, мы обсудим два нерешенных фундаментальных вопроса: (1) почему повторяющееся поведение различается между модельными системами и человеческими родословными, и (2) можем ли мы использовать современные знания о механизмах нестабильности повторов для лечения болезней повторной экспансии?
Наконец, мы обсудим два нерешенных фундаментальных вопроса: (1) почему повторяющееся поведение различается между модельными системами и человеческими родословными, и (2) можем ли мы использовать современные знания о механизмах нестабильности повторов для лечения болезней повторной экспансии?
 Репликация в присутствии MutSβ не способствовала сохранению продуктов репликации, содержащих гетеродуплексы со сдвигом ДНК. Пострепликационная репарация проскальзывающих ДНК с помощью экстрактов, содержащих MutSβ, устраняла проскользнувшие ДНК. Т.о., MutSβ-дефицит, вероятно, усиливает повторные сокращения, т.к. MutSβ защищает от сокращений путем восстановления выскальзывания матричных цепей. Репликационная недостаточность LigaseI или мутанта LigaseI, взаимодействующего с PCNA, выявила образование проскальзывающей ДНК на отстающих цепях. Наши результаты показывают, что различные механизмы приводят к расширению или сокращению и поддерживают ингибирование MutSβ в качестве терапевтической стратегии для усиления сокращения расширенных повторов.
Репликация в присутствии MutSβ не способствовала сохранению продуктов репликации, содержащих гетеродуплексы со сдвигом ДНК. Пострепликационная репарация проскальзывающих ДНК с помощью экстрактов, содержащих MutSβ, устраняла проскользнувшие ДНК. Т.о., MutSβ-дефицит, вероятно, усиливает повторные сокращения, т.к. MutSβ защищает от сокращений путем восстановления выскальзывания матричных цепей. Репликационная недостаточность LigaseI или мутанта LigaseI, взаимодействующего с PCNA, выявила образование проскальзывающей ДНК на отстающих цепях. Наши результаты показывают, что различные механизмы приводят к расширению или сокращению и поддерживают ингибирование MutSβ в качестве терапевтической стратегии для усиления сокращения расширенных повторов. Совсем недавно Axford и коллеги [73] использовали антитела, направленные против крестообразных структур [74], для иммунопреципитации ДНК, выделенной из тканей пациентов с миотонической дистрофией. Они показали, что иммунопреципитированная ДНК была обогащена вторичными структурами, предполагая, что такие структуры существуют in vivo, в нереплицирующейся ДНК.
Совсем недавно Axford и коллеги [73] использовали антитела, направленные против крестообразных структур [74], для иммунопреципитации ДНК, выделенной из тканей пациентов с миотонической дистрофией. Они показали, что иммунопреципитированная ДНК была обогащена вторичными структурами, предполагая, что такие структуры существуют in vivo, в нереплицирующейся ДНК.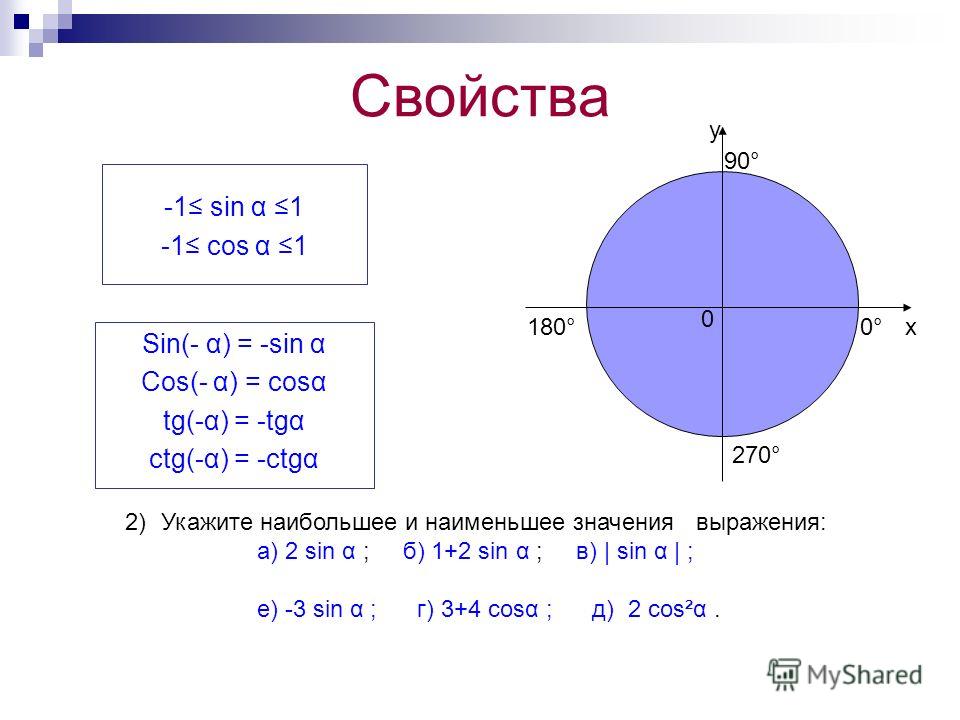 Мы обнаружили, что остановка вилки репликации зависит от целостности системы восстановления несоответствия, особенно комплекса Msh3p-Msh6p, что позволяет предположить, что прямое взаимодействие белков MMR со вторичными структурами, образованными тринуклеотидными повторами in vivo, запускает паузу вилки репликации. С помощью иммунопреципитации хроматина мы также показываем, что Msh3p обогащен участками тринуклеотидных повторов как в стабильной, так и в нестабильной ориентации, причем это обогащение зависит от MSh4 и MSH6 . Наконец, мы показываем, что сверхэкспрессия MSh3 способствует образованию гетеродуплексных областей, что приводит к увеличению сокращений и расширений повторных трактов CAG/CTG во время репликации, причем эти гетеродуплексы зависят как от МШ4 и МШ6 . Эти гетеродуплексные области не обнаруживались при сверхэкспрессии мутантного гена msh3 — E768A , в котором был мутирован домен АТФазы. Наши результаты раскрывают две новые роли белков восстановления несоответствия: стабилизация гетеродуплексных областей и временное блокирование вилок репликации, проходящих через такие повторы.
Мы обнаружили, что остановка вилки репликации зависит от целостности системы восстановления несоответствия, особенно комплекса Msh3p-Msh6p, что позволяет предположить, что прямое взаимодействие белков MMR со вторичными структурами, образованными тринуклеотидными повторами in vivo, запускает паузу вилки репликации. С помощью иммунопреципитации хроматина мы также показываем, что Msh3p обогащен участками тринуклеотидных повторов как в стабильной, так и в нестабильной ориентации, причем это обогащение зависит от MSh4 и MSH6 . Наконец, мы показываем, что сверхэкспрессия MSh3 способствует образованию гетеродуплексных областей, что приводит к увеличению сокращений и расширений повторных трактов CAG/CTG во время репликации, причем эти гетеродуплексы зависят как от МШ4 и МШ6 . Эти гетеродуплексные области не обнаруживались при сверхэкспрессии мутантного гена msh3 — E768A , в котором был мутирован домен АТФазы. Наши результаты раскрывают две новые роли белков восстановления несоответствия: стабилизация гетеродуплексных областей и временное блокирование вилок репликации, проходящих через такие повторы. Обе роли могут включать прямые взаимодействия между белками MMR и вторичными структурами, образованными трактами тринуклеотидных повторов, хотя косвенные взаимодействия не могут быть формально исключены.
Обе роли могут включать прямые взаимодействия между белками MMR и вторичными структурами, образованными трактами тринуклеотидных повторов, хотя косвенные взаимодействия не могут быть формально исключены. Семь из десяти последовательностей имели форму CTAGPuG или родственную последовательность TTAAPu. Эти мотивы были также обнаружены в сайтах связывания нескольких белков, регулирующих транскрипцию, которые изгибают ДНК. Чтобы оценить значимость этих сайтов, детерминанта позиционирования размером 10 п.н. во фрагменте 67 была удалена и заменена девятью последовательностями из 5S рДНК и фрагмента 601. Результаты показали, что эти производные фрагменты способствуют высокой стабильности и позиционированию нуклеосом по сравнению с к управляющей последовательности, которая содержала шаг AT вместо шага TA. Важность этапа ТА была дополнительно проверена путем замены одной пары оснований во фрагменте 67, и результаты показали, что стабильность и активность позиционирования следуют порядку: ТА > TG > TT ≥ TC ≈ GG ≈ GA ≈ AT. Также было показано, что последовательности, граничащие со стадией ТА, имеют решающее значение для стабильности и позиционирования нуклеосом. Позиционирование нуклеосом было восстановлено почти до уровней дикого типа с помощью (CTG) 3 , которые могут образовывать скользящие нитевидные структуры и с выпуклостями одного основания, которые изгибают ДНК.
Семь из десяти последовательностей имели форму CTAGPuG или родственную последовательность TTAAPu. Эти мотивы были также обнаружены в сайтах связывания нескольких белков, регулирующих транскрипцию, которые изгибают ДНК. Чтобы оценить значимость этих сайтов, детерминанта позиционирования размером 10 п.н. во фрагменте 67 была удалена и заменена девятью последовательностями из 5S рДНК и фрагмента 601. Результаты показали, что эти производные фрагменты способствуют высокой стабильности и позиционированию нуклеосом по сравнению с к управляющей последовательности, которая содержала шаг AT вместо шага TA. Важность этапа ТА была дополнительно проверена путем замены одной пары оснований во фрагменте 67, и результаты показали, что стабильность и активность позиционирования следуют порядку: ТА > TG > TT ≥ TC ≈ GG ≈ GA ≈ AT. Также было показано, что последовательности, граничащие со стадией ТА, имеют решающее значение для стабильности и позиционирования нуклеосом. Позиционирование нуклеосом было восстановлено почти до уровней дикого типа с помощью (CTG) 3 , которые могут образовывать скользящие нитевидные структуры и с выпуклостями одного основания, которые изгибают ДНК.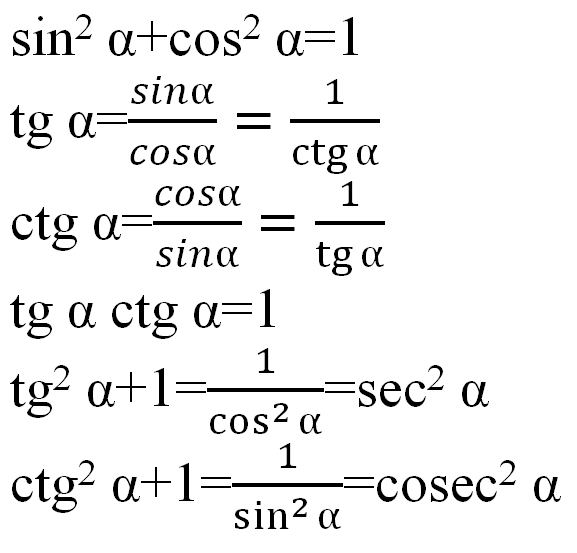 Результаты этого исследования предполагают, что локальные структуры ДНК важны для позиционирования и что изменения одиночных пар оснований в этих сайтах могут оказывать сильное влияние на те геномные функции, которые зависят от упорядоченных нуклеосом.
Результаты этого исследования предполагают, что локальные структуры ДНК важны для позиционирования и что изменения одиночных пар оснований в этих сайтах могут оказывать сильное влияние на те геномные функции, которые зависят от упорядоченных нуклеосом. Для проверки этой гипотезы были исследованы здоровые крысы с использованием метода окклюзии конечного надувания в контрольных условиях и после полного охлаждения тела. Рассчитывали параметры дыхательной механики, площади гистерезиса, инспираторную работу дыхания, его эластическую и резистивную составляющие. После охлаждения тела (средняя ректальная температура от 36,6 ± 0,25 до 32,1 ± 0,26 °С) омическое и добавочное вязкоупругое сопротивления дыхательной системы, гистерезис, общая инспираторная работа дыхания и его резистивная составляющая возрастали. Достоверных изменений средних значений статической и динамической эластичности дыхательной системы и связанного с ней эластического компонента работы дыхания не выявлено. Эти данные свидетельствуют о том, что охлаждение тела увеличивает механическую инспираторную работу дыхания за счет увеличения диссипации резистивного давления. Этот эффект очевиден даже при ограниченных колебаниях температуры, и предполагается, что он может иметь место в случае случайной или терапевтической гипотермии.
Для проверки этой гипотезы были исследованы здоровые крысы с использованием метода окклюзии конечного надувания в контрольных условиях и после полного охлаждения тела. Рассчитывали параметры дыхательной механики, площади гистерезиса, инспираторную работу дыхания, его эластическую и резистивную составляющие. После охлаждения тела (средняя ректальная температура от 36,6 ± 0,25 до 32,1 ± 0,26 °С) омическое и добавочное вязкоупругое сопротивления дыхательной системы, гистерезис, общая инспираторная работа дыхания и его резистивная составляющая возрастали. Достоверных изменений средних значений статической и динамической эластичности дыхательной системы и связанного с ней эластического компонента работы дыхания не выявлено. Эти данные свидетельствуют о том, что охлаждение тела увеличивает механическую инспираторную работу дыхания за счет увеличения диссипации резистивного давления. Этот эффект очевиден даже при ограниченных колебаниях температуры, и предполагается, что он может иметь место в случае случайной или терапевтической гипотермии.
 Наконец, с помощью анализа обогащения онтологии генов была подтверждена биологическая значимость совместно экспрессируемых генов в определенных модулях.
Наконец, с помощью анализа обогащения онтологии генов была подтверждена биологическая значимость совместно экспрессируемых генов в определенных модулях. Наши результаты показывают, что новая «логарифмическая квадратичная» модель, представленная в этой статье, значительно лучше подходит для сетей функциональных связей на уровне вокселей в человеческом мозге.
Наши результаты показывают, что новая «логарифмическая квадратичная» модель, представленная в этой статье, значительно лучше подходит для сетей функциональных связей на уровне вокселей в человеческом мозге. Во-вторых, эти методы требуют, чтобы пользователь выбрал пороговое значение, чтобы определить, является ли отношение биологически значимым. Из-за этих недостатков такие методы могут игнорировать некоторую важную информацию.
Во-вторых, эти методы требуют, чтобы пользователь выбрал пороговое значение, чтобы определить, является ли отношение биологически значимым. Из-за этих недостатков такие методы могут игнорировать некоторую важную информацию. Во-вторых, результаты, полученные FyNE, показали его низкую чувствительность к шумовым данным в эксперименте со случайностью. Кроме того, FyNE может вывести генные сети с биологической структурой в топологическом анализе. Наконец, правильность предложенного нами метода была подтверждена сравнением его эффективности с некоторыми репрезентативными методами идентификации генных сетей 9.0003
Во-вторых, результаты, полученные FyNE, показали его низкую чувствительность к шумовым данным в эксперименте со случайностью. Кроме того, FyNE может вывести генные сети с биологической структурой в топологическом анализе. Наконец, правильность предложенного нами метода была подтверждена сравнением его эффективности с некоторыми репрезентативными методами идентификации генных сетей 9.0003 Индуцированный синтез сильно ингибировался афидиколином и полностью зависел от добавленного в систему dNTP. В клеточных экстрактах, в которых PCNA ступенчато истощалась путем иммунопреципитации, синтез ДНК соответственно снижался. Эти данные свидетельствуют о том, что в этой системе могут функционировать главным образом репликативные ДНК-полимеразы, особенно pol дельта. Кроме того, в этой системе синтез ДНК поддается количественной оценке, что позволяет нам оценить эффективность индуцированной репликации ДНК. Наша система чувствительно и количественно обнаружила снижение эффективности репликации ДНК в ДНК-субстратах, поврежденных окислением или УФ-сшиванием, и в присутствии мощного терминатора цепи, ara-CTP. Количественная оценка репликации ДНК млекопитающих может дать различные преимущества не только в фундаментальных исследованиях, но и в разработке лекарств.
Индуцированный синтез сильно ингибировался афидиколином и полностью зависел от добавленного в систему dNTP. В клеточных экстрактах, в которых PCNA ступенчато истощалась путем иммунопреципитации, синтез ДНК соответственно снижался. Эти данные свидетельствуют о том, что в этой системе могут функционировать главным образом репликативные ДНК-полимеразы, особенно pol дельта. Кроме того, в этой системе синтез ДНК поддается количественной оценке, что позволяет нам оценить эффективность индуцированной репликации ДНК. Наша система чувствительно и количественно обнаружила снижение эффективности репликации ДНК в ДНК-субстратах, поврежденных окислением или УФ-сшиванием, и в присутствии мощного терминатора цепи, ara-CTP. Количественная оценка репликации ДНК млекопитающих может дать различные преимущества не только в фундаментальных исследованиях, но и в разработке лекарств.