Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Решено
Реакция изомеризации пентана.
Гидролиз NA3PO4
напишите уравнение реакции дегидрирования пентана ,назвать все продукты реакции
Признаки сходства ковалентной и ионной хим связей
Объемные доли компонентов в природном газе некоторого месторождения составляют: метана — 93%, этана — 2%, пропана — 1,5%, бутана — 1,2 %, азота -1,8%, углекислого газа — 0,5%. Вычислите массовые доли
Пользуйтесь нашим приложением
Балансирано уравнение на химичната реакция
Резултати от търсенето на химическо уравнение
Новини Само 5% от НАСЕЛЕНИЕТО биха знаели
реклама
1 резултати намерени
Показване на уравнение от 1 да се 1 Страница 1 — Моля, превъртете до края, за да видите повече резултати
Резултат от уравнение №1
Щракнете, за да видите допълнителни подробности и да изчислите теглото / mol >>
| 5460″>Cu | + | НО | + | 1 / 2O2 | → | H2O | + | CuCl2 | |
| мед | хлороводород | кислород | вода | меден (ii) хлорид | |||||
| (rắn) | (дд) | (кхи) | (дълга) | (rắn) | |||||
| (đỏ) | (không màu) | (không màu) | (không màu) | ||||||
| 1 | 1 | 1 / 2 | 1 | 1 | Hệ số | ||||
| Nguyên — Phân tử khối (g / mol) | |||||||||
| Số mol | |||||||||
| Khối lượng (g) |
реклама
Допълнителна информация за уравнението Cu + НО + 1 / 2O
2 → Х2O + CuCl2Какво е реакционното състояние на Cu (мед) реагира с HCl (хлороводород) реагира с O2 (кислород)?
Не е намерена информация за това химично уравнение
Обяснение: Идеалните условия на околната среда за реакция, като температура, налягане, катализатори и разтворител.
Как могат да се случат реакции и да произведат h3O (вода) и CuCl2 (меден(ii) хлорид)?
Cu реагира с HCl в присъствието на O2
Феномен, след като Cu (мед) реагира с HCl (хлороводород) реагира с O2 (кислород)
Това уравнение няма конкретна информация за явлението.
В този случай просто трябва да наблюдавате, за да видите дали продуктът е вещество CuCl2 (меден (ii) хлорид), появяващ се в края на реакцията.
Или ако някое от следните реагентни вещества O2 (кислород), изчезва
Каква е друга важна информация, която трябва да знаете за реакцията
Нямаме повече информация за тези химични реакции.
Категории на уравнение
Щракнете, за да видите допълнителни подробности и да изчислите теглото / mol >>
Допълнителни въпроси, свързани с химичните реакции Cu + НО + 1 / 2O
2 → Х2O + CuCl2Въпроси, свързани с реагент Cu (мед)
Какви са химичните и физичните характеристики на Cu (мед)?Какви са химичните реакции, които имат Cu (мед) като реагент?
Въпроси, свързани с реагента HCl (хлороводород)
Какви са химичните и физичните характеристики на HCl (хлороводород)?Какви са химичните реакции, които имат HCl (хлороводород) като реагент?
Въпроси, свързани с реагент O2 (кислород)
Какви са химичните и физичните характеристики на O2 (кислород)?Кои са химичните реакции, които имат O2 (кислород) като реагент?
Въпроси, свързани с продукта h3O (вода)
Какви са химичните и физичните характеристики на h3O (кислород)?Какви са химичните реакции, които имат h3O (вода) като продукт?
Въпроси, свързани с продукта CuCl2 (меден(ii) хлорид)
Какви са химичните и физичните характеристики на CuCl2 (кислород)?Какви са химичните реакции, които имат CuCl2 (меден(ii) хлорид) като продукт?
реклама
1 резултати намерени
Показване на уравнение от 1 да се 1 Page 1
Допълнителна информация за веществата, които се използват от уравнението
Реакция на Cu (đồng) реагира с HCl (аксит клохидричен) и O2 (окси) продукция h3O (nước)
Реакция, при която се получава вещество Cu (đồng) (мед)
C + Cu2O → CO + 2Cu 2 Ал + 3CuO → Al2O3 + 3Cu C + 2CuO → 2Cu + CO2
Реакция, при която се получава вещество HCl (axit clohidric) (хлороводород)
Cl2 + C3H8 → HCl + C3H7Cl CO + H2O + PdCl2 → 2HCl + CO2 + Pd C2H5Cl → C2H4 + НО
Реакция, при която се получава вещество O2 (oxi) (кислород)
2CaOCl2 → О2 + 2CaCl2 2Cu (NO3)2 → 2CuO + 4NO2 + O2 2AgNO3 → 2 Ag + 2NO2 + O2
Реакция, при която се получава вещество h3O (nước) (вода)
3NH4НЕ3 + CH2 → 7Н2O + 3N2 + CO2 NaOH + C6H5Br → C6H5На + H2O + NaBr 2H2S + 3O2 → 2Н2O + 2SO2
Реакция, при която се получава вещество CuCl2 (Đồng (II) clorua) (меден (ii) хлорид)
CuO + 2HCl → Н2O + CuCl2 Cu (OH)2 + 2HC2 → XNUMXH2O + CuCl2 Cl2 + Cu → CuCl2
Медь.
 Химия меди и ее соединений
Химия меди и ее соединенийМедь
1. Положение меди в периодической системе химических элементов
2. Электронное строение меди
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
Оксид меди (II)
- Способы получения
- Химические свойства
Оксид меди (I)
- Химические свойства
Гидроксид меди (II)
- Химические свойства
Соли меди
Медь
Положение в периодической системе химических элементов
Медь расположена в 11 группе (или в побочной подгруппе II группы в короткопериодной ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение меди
Электронная конфигурация меди в основном состоянии:
+29Cu 1s22s22p63s23p63d104s1 1s 2s 2p
3s 3p 4s 3d
У атома меди уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень.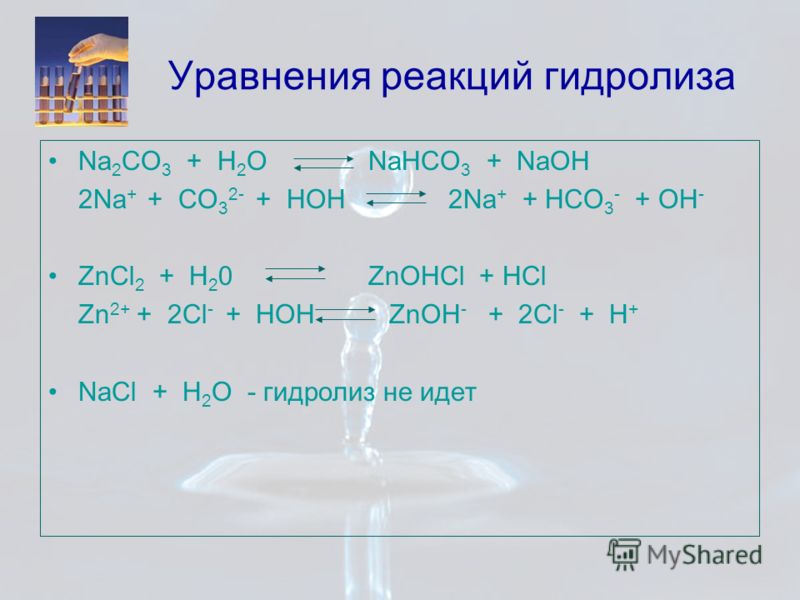
Физические свойства
Медь – твердый металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Медь относительно легко поддается механической обработке. В природе встречается в том числе в чистом виде и широко применяется в различных отраслях науки, техники и производства.
Изображение с портала zen.yandex.com/media/id/5d426107ae56cc00ad977411/uralskaia-boginia-liubvi-5d6bcceda660d700b075a12d
Температура плавления 1083,4оС, температура кипения 2567оС, плотность меди 8,92 г/см3.
Медь — ценный металл в сфере вторичной переработки. Сдав лом меди в пункт приема, Вы можете получить хорошее денежное вознаграждение. Подробнее про прием лома меди.
Нахождение в природе
Медь встречается в земной коре (0,0047-0,0055 масс.%), в речной и морской воде. В природе медь встречается как в соединениях, так и в самородном виде. В промышленности используют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Также распространены и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2(OH)2CO3. Иногда медь встречается в самородном виде, масса которых может достигать 400 тонн.
Также распространены и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2(OH)2CO3. Иногда медь встречается в самородном виде, масса которых может достигать 400 тонн.
Способы получения меди
Медь получают из медных руд и минералов. Основные методы получения меди — электролиз, пирометаллургический и гидрометаллургический.
- Гидрометаллургический метод: растворение медных минералов в разбавленных растворах серной кислоты, с последующим вытеснением металлическим железом.
Например, вытеснение меди из сульфата железом:
CuSO4 + Fe = Cu + FeSO4
Видеоопыт взаимодействия сульфата меди (II) с железом можно посмотреть здесь.
- Пирометаллургический метод: получение меди из сульфидных руд. Это сложный процесс, который включает большое количество реакций.
 Основные стадии процесса:
Основные стадии процесса:
1) Обжиг сульфидов:
2CuS + 3O2 = 2CuO + 2SO
2) восстановление меди из оксида, например, водородом:
CuO + H2 = Cu + H2O
- Электролиз растворов солей меди:
2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4
Качественные реакции на ионы меди (II)
Качественная реакция на ионы меди +2 – взаимодействие солей меди (II) с щелочами. При этом образуется голубой осадок гидроксида меди(II).
Например, сульфат меди (II) взаимодействует с гидроксидом натрия:
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
Соли меди (II) окрашивают пламя в зеленый цвет.
Химические свойства меди
В соединениях медь может проявлять степени окисления +1 и +2.
1. Медь — химически малоактивный металл. При нагревании медь может реагировать с некоторыми неметаллами: кислородом, серой, галогенами.
1.1. При нагревании медь реагирует с достаточно сильными окислителями, например, с кислородом, образуя CuО, Cu2О в зависимости от условий:
4Cu + О2 → 2Cu2О
2Cu + О2 → 2CuО
1.2. Медь реагирует с серой с образованием сульфида меди (II):
Cu + S → CuS
Видеоопыт взаимодействия меди с серой можно посмотреть здесь.
1.3. Медь взаимодействует с галогенами. При этом образуются галогениды меди (II):
Cu + Cl2 = CuCl2
Сu + Br2 = CuBr2
Но, обратите внимание:
2Cu + I2 = 2CuI
Видеоопыт взаимодействия меди с хлором можно посмотреть здесь.
1.4. С азотом, углеродом и кремнием медь не реагирует:
Cu + N2 ≠
Cu + C ≠
Cu + Si ≠
1.5. Медь не взаимодействует с водородом.
Cu + H2 ≠
1.6. Медь взаимодействует с кислородом с образованием оксида:
2Cu + O2 → 2CuO
2. Медь взаимодействует и со сложными веществами:
2.1. Медь в сухом воздухе и при комнатной температуре не окисляется, но во влажном воздухе, в присутствии оксида углерода (IV) покрывается зеленым налетом карбоната гидроксомеди (II):
2Cu + H2O + CO2 + O2 = (CuOH)2CO3
2. 2. В ряду напряжений медь находится правее водорода и поэтому не может вытеснить водород из растворов минеральных кислот (разбавленной серной кислоты и др.).
2. В ряду напряжений медь находится правее водорода и поэтому не может вытеснить водород из растворов минеральных кислот (разбавленной серной кислоты и др.).
Например, медь не реагирует с разбавленной серной кислотой:
Cu + H2SO4 (разб.) ≠
Видеоопыт взаимодействия меди с соляной кислотой можно посмотреть здесь.
2.3. При этом медь реагирует при нагревании с концентрированной серной кислотой. При нагревании реакция идет, образуются оксид серы (IV), сульфат меди (II) и вода:
Cu + 2H2SO4(конц.) → CuSO4 + SO2 + 2H2O
2.4. Медь реагирует даже при обычных условиях с азотной кислотой.
С концентрированной азотной кислотой:
Cu + 4HNO3(конц. ) = Cu(NO3)2 + 2NO2 + 2H2O
) = Cu(NO3)2 + 2NO2 + 2H2O
С разбавленной азотной кислотой:
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O
Реакция меди с азотной кислотой
2.5. Растворы щелочей на медь практически не действуют.
2.6. Медь вытесняет металлы, стоящие правее в ряду напряжений, из растворов их солей.
Например, медь реагирует с нитратом ртути (II) с образованием нитрата меди (II) и ртути:
Hg(NO3)2 + Cu = Cu(NO3)2 + Hg
2.7. Медь окисляется оксидом азота (IV) и солями железа (III)
2Cu + NO2 = Cu2O + NO
2FeCl3 + Cu = 2FeCl2 + CuCl2
Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Способы получения оксида меди (II)
Оксид меди (II) можно получить различными методами:
1. Термическим разложением гидроксида меди (II) при 200°С:
Cu(OH)2 → CuO + H2O
2. В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С:
2Cu + O2 2CuO
3. В лаборатории оксид меди (II) также получают прокаливанием солей (CuOH)2CO3, Cu(NO3)2:
(CuOH)2CO3 2CuO + CO2 + H2O
2Cu(NO3)2 2CuO + 4NO2 + O2
Химические свойства оксида меди (II)
Оксид меди (II) – основный оксид (при этом у него есть слабо выраженные амфотерные свойства). При этом он является довольно сильным окислителем.
При этом он является довольно сильным окислителем.
1. При взаимодействии оксида меди (II) с сильными и растворимыми кислотами образуются соли.
Например, оксид меди (II) взаимодействует с соляной кислотой:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
Видеоопыт взаимодействия оксида меди (II) с серной кислотой можно посмотреть здесь.
2. Оксид меди (II) вступает в реакцию с кислотными оксидами.
Например, оксид меди (II) взаимодействует с оксидом серы (VI) с образованием сульфата меди (II):
CuO + SO3 → CuSO4
3. Оксид меди (II) не взаимодействует с водой.
4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
Например, оксид меди (II) окисляет аммиак:
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Оксид меди (II) можно восстановить углеродом, водородом или угарным газом при нагревании:
СuO + C → Cu + CO
Видеоопыт взаимодействия оксида меди (II) с водородом можно посмотреть здесь.
Более активные металлы вытесняют медь из оксида.
Например, алюминий восстанавливает оксид меди (II):
3CuO + 2Al = 3Cu + Al2O3
Оксид меди (I)
Оксид меди (I) Cu2O – твердое кристаллическое вещество коричнево-красного цвета.
Способы получения оксида меди (I)
В лаборатории оксид меди (I) получают восстановлением свежеосажденного гидроксида меди (II), например, альдегидами или глюкозой:
CH3CHO + 2Cu(OH)2 → CH3COOH + Cu2O↓ + 2H2O
CH2ОН(CHOН)4СНО + 2Cu(OH)2 → CH2ОН(CHOН)4СООН + Cu2O↓ + 2H2O
Химические свойства оксида меди (I)1. Оксид меди (I) обладает основными свойствами.
При действии на оксид меди (I) галогеноводородных кислот получают галогениды меди (I) и воду:
Например, соляная кислота с оксидом меди (I) образует хлорид меди (I):
Cu2O + 2HCl = 2CuCl↓ + H2O
2. При растворении Cu2O в концентрированной серной, азотной кислотах образуются только соли меди (II):
Cu2O + 3H2SO4(конц.) = 2CuSO4 + SO2 + 3H2O
Cu2O + 6HNO3(конц.) = 2Cu(NO3)2 + 2NO2 + 3H2O
5Cu2O + 13H2SO4 + 2KMnO4 = 10CuSO4 + 2MnSO4 + K2SO4 + 13H2O
3. Устойчивыми соединениями меди (I) являются нерастворимые соединения (CuCl, Cu2S) или комплексные соединения [Cu(NH3)2]+. Последние получают растворением в концентрированном растворе аммиака оксида меди (I), хлорида меди (I):
Последние получают растворением в концентрированном растворе аммиака оксида меди (I), хлорида меди (I):
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH
CuCl + 2NH3 = [Cu(NH3)2]Cl
Аммиачные растворы солей меди (I) взаимодействуют с ацетиленом:
СH ≡ CH + 2[Cu(NH3)2]Cl → СuC ≡ CCu + 2NH4Cl + 2NH3
4. В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность:
Например, при взаимодействии с угарным газом, более активными металлами или водородом оксид меди (II) проявляет свойства окислителя:
Cu2O + CO = 2Cu + CO2
Cu2O + H2 = 2Cu + H2O
3Cu2O + 2Al = 6Cu + Al2O3
А под действием окислителей, например, кислорода — свойства восстановителя:
2Cu2O + O2 = 4CuO
Гидроксид меди (II)
Способы получения гидроксида меди (II)
1. Гидроксид меди (II) можно получить действием раствора щелочи на соли меди (II).
Гидроксид меди (II) можно получить действием раствора щелочи на соли меди (II).
Например, хлорид меди (II) реагирует с водным раствором гидроксида натрия с образованием гидроксида меди (II) и хлорида натрия:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
Химические свойства
Гидроксид меди (II) Сu(OН)2 проявляет слабо выраженные амфотерные свойства (с преобладанием основных).
1. Взаимодействует с кислотами.
Например, взаимодействует с бромоводородной кислотой с образованием бромида меди (II) и воды:
Сu(OН)2 + 2HBr = CuBr2 + 2H2O
Cu(OН)2 + 2HCl = CuCl2 + 2H2O
2. Гидроксид меди (II) легко взаимодействует с раствором аммиака, образуя сине-фиолетовое комплексное соединение:
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
3. При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
Cu(OH)2 + 2NaOH(конц.) = Na2[Cu(OH)4]
Но этой реакции в ЕГЭ по химии пока нет!
4. При нагревании гидроксид меди (II) разлагается:
Сu(OH)2 → CuO + H2O
Соли меди
Соли меди (I)
В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность. Как восстановители они реагируют с окислителями.
Например, хлорид меди (I) окисляется концентрированной азотной кислотой:
CuCl + 3HNO3(конц.) = Cu(NO3)2 + HCl + NO2 + H2O
Также хлорид меди (I) реагирует с хлором:
2CuCl + Cl2 = 2CuCl2
Хлорид меди (I) окисляется кислородом в присутствии соляной кислоты:
4CuCl + O2 + 4HCl = 4CuCl2 + 2H2O
Прочие галогениды меди (I) также легко окисляются другими сильными окислителями:
2CuI + 4H2SO4 + 2MnO2 = 2CuSO4 + 2MnSO4 + I2 + 4H2O
Иодид меди (I) реагирует с концентрированной серной кислотой:
4CuI + 5H2SO4(конц. гор.) = 4CuSO4 + 2I2 + H2S + 4H2O
гор.) = 4CuSO4 + 2I2 + H2S + 4H2O
Сульфид меди (I) реагирует с азотной кислотой. При этом образуются различные продукты окисления серы на холоде и при нагревании:
Cu2S + 8HNO3(конц.хол.) = 2Cu(NO3)2 + S + 4NO2 + 4H2O
Cu2S + 12HNO3(конц.гор.) = Cu(NO3)2 + CuSO4 + 10NO2 + 6H2O
Для соединений меди (I) возможна реакция диспропорционирования:
2CuCl = Cu + CuCl2
Комплексные соединения типа [Cu(NH3)2]+ получают растворением в концентрированном растворе аммиака:
CuCl + 3NH3 + H2O → [Cu(NH3)2]OH + NH4Cl
Соли меди (II)
В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства.
Например, соли меди (II) окисляют иодиды и сульфиты:
2CuCl2 + 4KI = 2CuI + I2 + 4KCl
2CuCl2 + Na2SO3 + 2NaOH = 2CuCl + Na2SO4 + 2NaCl + H2O
Бромиды и иодиды меди (II) можно окислить перманганатом калия:
5CuBr2 + 2KMnO4 + 8H2SO4 = 5CuSO4 + K2SO4 + 2MnSO4 + 5Br2 + 8H2O
Соли меди (II) также окисляют сульфиты:
2CuSO4 + Na2SO3 + 2H2O = Cu2O + Na2SO4 + 2H2SO4
Более активные металлы вытесняют медь из солей.
Например, сульфат меди (II) реагирует с железом:
CuSO4 + Fe = FeSO4 + Cu
Cu(NO3)2 + Fe = Fe(NO3)2 + Cu
Сульфид меди (II) можно окислить концентрированной азотной кислотой. При нагревании возможно образование сульфата меди (II):
При нагревании возможно образование сульфата меди (II):
CuS + 8HNO3(конц.гор.) = CuSO4 + 8NO2 + 4H2O
Еще одна форма этой реакции:
CuS + 10HNO3(конц.) = Cu(NO3)2 + H2SO4 + 8NO2↑ + 4H2O
При горении сульфида меди (II) образуется оксид меди (II) и диоксид серы:
2CuS + 3O2 2CuO + 2SO2↑
Соли меди (II) вступают в обменные реакции, как и все соли.
Например, растворимые соли меди (II) реагируют с сульфидами:
CuBr2 + Na2S = CuS↓ + 2NaBr
При взаимодействии солей меди (II) с щелочами образуется голубой осадок гидроксида меди (II):
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Электролиз раствора нитрата меди (II):
2Cu(NO3)2 + 2Н2О → 2Cu + O2 + 4HNO3
Некоторые соли меди при нагревании разлагаются, например, нитрат меди (II):
2Cu(NO3)2 → 2CuO + 4NO2 + O2
Основный карбонат меди разлагается на оксид меди (II), углекислый газ и воду:
(CuOH)2CO3 → 2CuO + CO2 + H2O
При взаимодействии солей меди (II) с избытком аммиака образуются аммиачные комплексы:
CuCl2 + 4NH3 = [Cu(NH3)4]Cl2
При смешивании растворов солей меди (II) и карбонатов происходит гидролиз и по катиону слабого основания, и по аниону слабой кислоты:
2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3↓ + 2Na2SO4 + CO2
1) Через раствор хлорида меди (II) с помощью графитовых электродов пропускали постоянный электрический ток. Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия. Выделившийся на аноде газообразный продукт электролиза пропустили через горячий раствор гидроксида натрия. Напишите уравнения описанных реакций.
Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия. Выделившийся на аноде газообразный продукт электролиза пропустили через горячий раствор гидроксида натрия. Напишите уравнения описанных реакций.
2) Вещество, полученное на катоде при электролизе расплава хлорида меди (II), реагирует с серой. Полученный продукт обработали концентрированной азотной кислотой, и выделившийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
3) Неизвестная соль бесцветна и окрашивает пламя в желтый цвет. При легком нагревании этой соли с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа и образованием соли меди. При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций.
4) При взаимодействии раствора соли А со щелочью было получено студенистое нерастворимое в воде вещество голубого цвета, которое растворили в бесцветной жидкости Б с образованием раствора синего цвета. Твердый продукт, оставшийся после осторожного выпаривания раствора, прокалили; при этом выделились два газа, один из которых бурого цвета, а второй входит в состав атмосферного воздуха, и осталось твердое вещество черного цвета, которое растворяется в жидкости Б с образованием вещества А. Напишите уравнения описанных реакций.
5) Медную стружку растворили в разбавленной азотной кислоте, и раствор нейтрализовали едким кали. Выделившееся вещество голубого цвета отделили, прокалили (цвет вещества изменился на черный), смешали с коксом и повторно прокалили. Напишите уравнения описанных реакций.
6) В раствор нитрата ртути (II) добавили медную стружку. После окончания реакции раствор профильтровали, и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций.
При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций.
7) Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.
8) Твердое вещество, образующееся при нагревании малахита, нагрели в атмосфере водорода. Продукт реакции обработали концентрированной серной кислотой, внесли в раствор хлорида натрия, содержащий медные опилки, в результате образовался осадок. Напишите уравнения описанных реакций.
9) Соль, полученную при растворении меди в разбавленной азотной кислоте, подвергли электролизу, используя графитовые электроды. Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций.
Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций.
10) Твердый продукт термического разложения малахита растворили при нагревании в концентрированной азотной кислоте. Раствор осторожно выпарили, и твердый остаток прокалили, получив вещество черного цвета, которое нагрели в избытке аммиака (газ). Напишите уравнения описанных реакций.
11) К порошкообразному веществу черного цвета добавили раствор разбавленной серной кислоты и нагрели. В полученный раствор голубого цвета приливали раствор едкого натра до прекращения выделения осадка. Осадок отфильтровали и нагрели. Продукт реакции нагревали в атмосфере водорода, в результате чего получилось вещество красного цвета. Напишите уравнения описанных реакций.
12) Неизвестное вещество красного цвета нагрели в хлоре, и продукт реакции растворили в воде. В полученный раствор добавили щелочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливании, который имеет черный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций.
В полученный раствор добавили щелочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливании, который имеет черный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций.
13) Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты полностью поглощены водой, а над твердым остатком пропустили водород. Напишите уравнения описанных реакций.
14) Черный порошок, который образовался при сжигании металла красного цвета в избытке воздуха, растворили в 10%-серной кислоте. В полученный раствор добавили щелочь, и выпавший осадок голубого цвета отделили и растворили в избытке раствора аммиака. Напишите уравнения описанных реакций.
15) Вещество черного цвета получили, прокаливая осадок, который образуется при взаимодействии гидроксида натрия и сульфата меди (II). При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
16) Металлическую медь обработали при нагревании йодом. Полученный продукт растворили в концентрированной серной кислоте при нагревании. Образовавшийся раствор обработали раствором гидроксидом калия. Выпавший осадок прокалили. Напишите уравнения описанных реакций.
17) К раствору хлорида меди (II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
18) Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Напишите уравнения описанных реакций.
Напишите уравнения описанных реакций.
19) Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
20) Газ, полученный при взаимодействии железных опилок с раствором соляной кислоты, пропустили над нагретым оксидом меди (II) до полного восстановления металла. полученный металл растворили в концентрированной азотной кислоте. Образовавшийся раствор подвергли электролизу с инертными электродами. Напишите уравнения описанных реакций.
21) Йод поместили в пробирку с концентрированной горячей азотной кислотой. Выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
22) Оранжевый оксид меди поместили в концентрированную серную кислоту и нагрели. К полученному голубому раствору прилили избыток раствора гидроксида калия. выпавший синий осадок отфильтровали, просушили и прокалили. Полученное при этом твердое черное вещество в стеклянную трубку, нагрели и пропустили над ним аммиак. Напишите уравнения описанных реакций.
23) Оксид меди (II) обработали раствором серной кислоты. При электролизе образующегося раствора на инертном аноде выделяется газ. Газ смешали с оксидом азота (IV) и поглотили с водой. К разбавленному раствору полученной кислоты добавили магний, в результате чего в растворе образовалось две соли, а выделение газообразного продукта не происходило. Напишите уравнения описанных реакций.
24) Оксид меди (II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка. Напишите уравнения описанных реакций.
Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка. Напишите уравнения описанных реакций.
25) Нитрат меди (II) прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекает с выделением бурого газа. Напишите уравнения описанных реакций.
26) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ пропустили через раствор гидроксида кальция. В котором выпал осадок. Часть газа не поглотилась, его пропустили над твердым веществом черного цвета, полученным при прокаливании нитрата меди (II). В результате образовалось твердое вещество темно-красного цвета. Напишите уравнения описанных реакций.
Напишите уравнения описанных реакций.
27) Концентрированная серная кислота прореагировала с медью. Выделившийся при газ полностью поглотили избытком раствора гидроксида калия. Продукт окисления меди смешали с расчетным количеством гидроксида натрия до прекращения выпадения осадка. Последний растворили в избытке соляной кислоты. Напишите уравнения описанных реакций.
1.
CuCl2 Cu + Сl2
на катоде на аноде
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 =2CuO + 4NO2↑ + O2↑
6NaOH(гор.) + 3Cl2 = NaClO3 + 5NaCl + 3H2O
2.
CuCl2 = Cu + Сl2
на катоде на аноде
Cu + S = CuS
CuS + 8HNO3(конц. гор.) = CuSO4 + 8NO2↑ + 4H2O
гор.) = CuSO4 + 8NO2↑ + 4H2O
или CuS + 10HNO3(конц.) = Cu(NO3)2 + H2SO4 + 8NO2↑ + 4H2O
4NO2 + 2Ba(OH)2 = Ba(NO3)2 + Ba(NO2)2 + 2H2O
3.
NaNO3(тв.) + H2SO4(конц.) = HNO3 + NaHSO4
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
2NaNO3 = 2NaNO2 + O2↑
4.
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
CuO + 2HNO3 = Cu(NO3)2 + H2O
5. 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
Cu(NO3)2 + 2КOH = Cu(OH)2↓ + 2КNO3
Cu(OH)2 = CuO + H2O
CuO + C Cu + CO
6. Hg(NO3)2 + Cu = Cu(NO3)2 + Hg
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 5H2SO4 = CuSO4 + 4NH4HSO4 + 2H2O
7. Cu2O + 6HNO3(конц.) = 2Cu(NO3)2 + 2NO2 + 3H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
4NO2 + O2 + 2H2O = 4HNO3
10HNO3 + 4Mg = 4Mg(NO3)2 + N2O + 5H2O
8. (CuOH)2CO3 = 2CuO + CO2 + H2O
(CuOH)2CO3 = 2CuO + CO2 + H2O
CuO + H2 = Cu + H2O
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
CuSO4 + Cu + 2NaCl = 2CuCl↓ + Na2SO4
9.
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3
на катоде на аноде
2Na + O2 = Na2O2
2Na2O2 + CO2 = 2Na2CO3 + O2
10.
(CuOH)2CO3 = 2CuO + CO2 + H2O
CuO + 2HNO3 = Cu(NO3)2 + H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
3CuO + 2NH3 = 3Cu + N2 + 3H2O
11.
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 = CuO + H2O
CuO + H2 = Cu + H2O
12.
Cu + Cl2 = CuCl2
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
Cu(OH)2 = CuO + H2O
CuO + C = Cu + CO
13.
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
4NO2 + O2 + 2H2O = 4HNO3
CuO + H2 = Cu + H2O
14.
2Cu + O2 = 2CuO
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + NaOH = Cu(OH)2↓ + Na2SO4
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
15.
СuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 = CuO + H2O
CuO + C = Cu + CO
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
16.
2Cu + I2 = 2CuI
2CuI + 4H2SO4 = 2CuSO4 + I2 + 2SO2 + 4H2O
СuSO4 + 2KOH = Cu(OH)2 + K2SO4
Cu(OH)2 = CuO + H2O
17.
2CuCl2 + 2Na2CO3 + H2O = (CuOH)2CO3 + CO2 + 4NaCl
(CuOH)2CO3 = 2CuO + CO2 + H2O
CuO + H2 = Cu + H2O
3Cu + 8HNO3(разб. ) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
18.
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
Сu(NO3)2 + 2NH3· H2O = Cu(OH)2↓ + 2NH4NO3
Cu(OH)2 + 4NH3· H2O = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 3H2SO4 = CuSO4 + 2(NH4)2SO4 + 2H2O
19) Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
Сu(NO3)2 + 2NH3· H2O = Cu(OH)2↓ + 2NH4NO3
Cu(OH)2 + 4NH3· H2O = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 6HCl = CuCl2 + 4NH4Cl + 2H2O
20.
Fe + 2HCl = FeCl2 + H2
CuO + H2 = Cu + H2O
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3
21.
I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2O
4NO2 + 2H2O + O2 = 4HNO3
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
22.
Cu2O + 3H2SO4 = 2CuSO4 + SO2 + 3H2O
СuSO4 + 2KOH = Cu(OH)2 + K2SO4
Cu(OH)2 = CuO + H2O
3CuO + 2NH3 = 3Cu + N2 + 3H2O
23.
CuO + H2SO4 = CuSO4 + H2O
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4
4NO2 + O2 + 2H2O = 4HNO3
10HNO3 + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
24.
CuO + CO = Cu + CO2
Cu + Cl2 = CuCl2
2CuCl2 + 2KI = 2CuCl↓ + I2 + 2KCl
CuCl2 + 2AgNO3 = 2AgCl↓ + Cu(NO3)2
.
25.
2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑
CuO + H2SO4 = CuSO4 + H2O
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4
Cu + 4HNO3(конц. ) = Cu(NO3)2 + 2NO2↑ + 2H2O
) = Cu(NO3)2 + 2NO2↑ + 2H2O
26.
H2C2O4 = CO↑ + CO2↑ + H2O
CO2 + Ca(OH)2 = CaCO3 + H2O
2Cu(NO3)2 =2CuO + 4NO2↑ + O2↑
CuO + CO = Cu + CO2
27.
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
SO2 + 2KOH = K2SO3 + H2O
СuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Понравилось это:
Нравится Загрузка…
Химические свойства металлов — с чем реагируют? Свойства и таблица
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
4Li + O2 = 2Li2O
натрий образует пероксид
2Na + O2 = Na2O2
калий, рубидий и цезий — надпероксид
K + O2 = KO2
Остальные металлы с кислородом образуют оксиды:
2Mg + O2 = 2MgO
2Al + O2 = Al2O3
2Zn + O2 = 2ZnO (при нагревании)
4Cr + 3O2 = 2Cr2O3
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
Например, так делает железо:
4Fe + 3O2 (воздух) + 6H2O(влага) = 4Fe(OH)3
С галогенами металлы образуют галогениды:
2Na + Cl2 = 2NaCl
Mg + Cl2 = MgCl2
2Al + 3Br2 = 2AlBr3
Zn + Cl2 =ZnCl2
2Cr + 3Cl2 = 2CrCl3
Медный порошок реагирует с хлором и бромом (в эфире):
Cu + Cl2 = CuCl2
Cu + Br2 = CuBr2
При взаимодействии с водородом образуются гидриды:
2Na + H2 = 2NaH
Ca + H2 +СaH2
Zn + H2 =ZnH2
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
2K + S = K2S
Сa + S = CaS
2Al + 3S = Al2S3
2Cr + 3S = Cr2S3
Cu +S = CuS
Реакции с фосфором протекают до образования фосфидов (при нагревании):
3K + P = K3P
3Mg + 2P = Mg3P2
3Zn + 2P = Zn3P2
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
2Li + 2C = Li2C2
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
Ca + 2C = CaC2
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
6Li + N2 = 2Li3N
3Mg + N2 = Mg3N2
2Al + N2 = 2AlN
2Cr + N2 = 2CrN
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется h3. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
2Li + 2H2O = 2LiOH + H2
Ca + 2H2O = Ca(OH)2 + H2
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Результат данной реакции — образование оксида.
Cr + H2O = Cr2O3 + H2
Zn + H2O = ZnO + H2
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Металлы IА группы:
2K + H2SO4 (раствор) = K2SO4 + H2
8K + 5H2SO4 (конц) = 4K2SO4 + H2S + 4H2O
8Na + 10HNO3 (раствор) = 8NaNO3 + NH4NO3 + 3H2O
3Na + 4HNO3 (конц) = 3NaNO3 + NO + 2H2О
Металлы IIА группы
Mg + H2SO4 (раствор) = MgSO4 + H2
4Mg + 5H2SO4 (конц) = 4MgSO4 + H2S + 4H2O
Mg+ 4HNO3 (конц) = Mg(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 (раствор) = 4Mg(NO3)2 + 2N2O + 5H2O
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
2Li + 2NH3 = 2LiNH2 + H2
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2
2K + 2C6H5OH = 2C6H5OK + H2
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
8Al + 3Fe3O4 = 4Al2O3 + 9Fe (алюмотермия)
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + Nh5NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Характеристики меди, реакция металла с азотной кислотой
It looks like you are visiting our site from Germany. Please switch to our regional site for more relevant pricing, product details, and special offers.
Choose another country
Устойчивый металл Vs. сильный окислитель
Твитнуть
Отправить
[Deposit Photos]Медь — старейший металл, используемый людьми с давних времен. Медь имеет латинское название — cuprum. Ее порядковый номер — 29. В периодической системе Менделеева медь расположена в четвертом периоде, в первой группе.
Медь имеет латинское название — cuprum. Ее порядковый номер — 29. В периодической системе Менделеева медь расположена в четвертом периоде, в первой группе.
Физические и химические свойства меди
Медь — это тяжелый металл розово-красного цвета с ковкой и мягкой структурой. Температура кипения меди — более 1000 °С. Сuprum — хороший электро- и теплопроводник, плавится при 1084 °С, плотность металла — 8,9 г/см³, в природе встречается в самородном виде.
Атом меди имеет 4 уровня. На валентной 4s-орбитали расположен один электрон. Во время химического взаимодействия с другими веществами от атома отщепляется 1—3 отрицательно заряженные частицы, в результате чего образуются соединения меди со степенью окисления «+3», «+2», «+1». Максимальной устойчивостью обладают двухвалентные производные меди.
[Deposit Photos]Медь обладает низкой реакционной способностью. Существует две основные степени окисления металла, проявляющиеся в соединениях: «+1» и «+2». Вещества, в которых данные значения заменяются на «+3», встречаются редко. Медь взаимодействует с углекислым газом, воздухом, соляной кислотой и другими соединениями при очень высоких температурах. На поверхности металла образуется защитная оксидная пленка, которая предохраняет медь от дальнейшего окисления и делает металл стабильным и малоактивным.
Существует две основные степени окисления металла, проявляющиеся в соединениях: «+1» и «+2». Вещества, в которых данные значения заменяются на «+3», встречаются редко. Медь взаимодействует с углекислым газом, воздухом, соляной кислотой и другими соединениями при очень высоких температурах. На поверхности металла образуется защитная оксидная пленка, которая предохраняет медь от дальнейшего окисления и делает металл стабильным и малоактивным.
Медь взаимодействует с простыми веществами: галогенами, селеном, серой. Металл способен формировать двойные соли или комплексные соединения. Почти все сложные соединения этого химического элемента (кроме оксидов) — это ядовитые вещества. Вещества, которые образовала одновалентная медь, легко окисляются до двухвалентных аналогов.
В химических реакциях медь выступает в качестве малоактивного металла. Металл не растворяется в воде в обычных условиях. В сухом воздухе не протекает коррозия металла, но при нагревании медь покрывается черным оксидным налетом. Химическая устойчивость элемента проявляется при действии углерода, безводных газов, нескольких органических соединений, спиртов и фенольных смол. Для меди характерны реакции комплексообразования, в результате которых выделяются окрашенные соединения. Медь имеет сходства с металлами щелочной группы, связанные с формированием производных одновалентного ряда.
Химическая устойчивость элемента проявляется при действии углерода, безводных газов, нескольких органических соединений, спиртов и фенольных смол. Для меди характерны реакции комплексообразования, в результате которых выделяются окрашенные соединения. Медь имеет сходства с металлами щелочной группы, связанные с формированием производных одновалентного ряда.
Взаимодействие с азотной кислотой
Медь растворяется в азотной кислоте. Эта реакция осуществляется из-за окисления металла сильным реагентом. Азотная кислота (разбавленная и концентрированная), проявляет окислительные свойства с растворением меди.
Молекула азотной кислоты [Deposit Photos]При реакции металла с разбавленной кислотой образуется нитрат меди и двухвалентный оксид азота в соотношении 75%:25%. Уравнение реакции:
8HNO₃ + 3Cu → 3Cu(NO₃)₂ + 2NO + 4H₂O
В реакции участвует 1 моль меди и 3 моля концентрированной азотной кислоты. При растворении меди раствор сильно разогревается, в результате чего происходит термическое разложение окислителя и наблюдается выделение дополнительного объема азотных оксидов. Уравнение реакции:
При растворении меди раствор сильно разогревается, в результате чего происходит термическое разложение окислителя и наблюдается выделение дополнительного объема азотных оксидов. Уравнение реакции:
4HNO₃ + Cu → Cu(NO₃) + 2NO₂ + 2H₂O
Такой способ растворения меди имеет недостаток: во время реакции меди с азотной кислотой происходит выделение большого количества азотных оксидов. Для улавливания (или нейтрализации) азотных оксидов требуется специальное оборудование, потому процесс этот слишком затратный. Растворение меди в азотной кислоте считается завершенным, когда полностью прекращается выработка летучих азотистых оксидов. Температура реакции — 60—70 °С. Следующий этап — спуск раствора из химического реактора. После этого на дне реактора остаются куски меди, не вступившие в реакцию. К полученной жидкости добавляется вода и проводится фильтрация. Нажмите здесь, чтобы изучить свойства меди на примере взаимодействия с другими веществами.
Азотная кислота и медь: реакция на примере опыта
Проследить всю реакцию азотной кислоты и меди можно на примере опыта, положив в концентрированную азотную кислоту пластинку меди. Происходит выделение бурого газа: сначала медленное, затем более сильное. Раствор приобретает зеленую окраску. Если в избытке добавлять медь в процессе реакции, раствор постепенно окрасится в голубой цвет. Реакция меди с азотной кислотой происходит с выделением тепла и токсичного газа, имеющего резкий запах.
Происходит выделение бурого газа: сначала медленное, затем более сильное. Раствор приобретает зеленую окраску. Если в избытке добавлять медь в процессе реакции, раствор постепенно окрасится в голубой цвет. Реакция меди с азотной кислотой происходит с выделением тепла и токсичного газа, имеющего резкий запах.
Взаимодействие меди с концентрированной азотной кислотой относится к окислительно-восстановительным реакциям. Восстановителем здесь является металл, а окислителем — азотная кислота. Уравнение реакции:
Cu + 4HNO₃ = Cu(NO₃)₂ + 2NO₂↑ + 2H₂O
Реакция экзотермическая, поэтому при самопроизвольном разогреве смеси реакция ускоряется.
Реакция меди с азотной кислотой начинается при комнатной температуре. Металл покрывается пузырьками, они всплывают и наполняют пробирку бурым газом — NO₂ (токсичным ядовитым диоксидом азота с резким запахом). Этот газ в 1,5 раза тяжелее воздуха.
Реакция меди с азотной кислотой протекает в два этапа:
- на первом этапе кислота окисляет медь до оксида меди, выделяя диоксид азота;
- на втором этапе оксид меди реагирует с новыми порциями кислоты, образуя нитрат меди Cu(NO₃)₂.
 Смесь разогревается, и реакция протекает быстрее.
Смесь разогревается, и реакция протекает быстрее.
Итог: металл растворился и образовался раствор нитрата меди. Благодаря нитрату меди полученный раствор имеет зеленый или голубой цвет (оттенок будет зависеть от количества использованной воды).
Твитнуть
Отправить
Больше статей о химии:
- Эксперимент «Несгораемая купюра» Почему купюра не горит?
- Эксперимент «Химический маятник» Реакция Белоусова-Жаботинского
Делайте эксперименты дома!
Трансмутация
Узнать больше
Попробовать
Уравнение реакции HCl Zn, ОВР, сокращенное-ионное уравнение.
 Уравнение реакции HCl Zn, ОВР, сокращенное-ионное уравнение Zn hcl уравнение реакции в ионном виде
Уравнение реакции HCl Zn, ОВР, сокращенное-ионное уравнение Zn hcl уравнение реакции в ионном видеЦинк (Zn) — химический элемент, принадлежащий к группе щелочноземельных металлов. В периодической таблице Менделеева располагается под номером 30, что означает, что заряд ядра атома, число электронов и протонов тоже равно 30. Цинк находится в побочной II группе IV периода. По номеру группы можно определить количество атомов, которые находятся на его валентном или внешнем энергетическом уровне — соответственно, 2.
Цинк как типичный щелочной металл
Цинк — это типичный представитель металлов, в нормальном состоянии имеет голубовато-серый цвет, легко окисляется на воздухе, приобретая на поверхности оксидную пленку (ZnO).
Как типичный амфотерный металл цинк взаимодействует с кислородом воздуха: 2Zn+O2=2ZnO — без температуры, с образованием оксидной пленки. При нагревании образуется белый порошок.
Сам оксид реагирует с кислотами с образованием соли и воды:
2ZnO+2HCl=ZnCl2+h3O.
С растворами кислот. Если цинк обычной чистоты, то уравнение реакции HCl Zn ниже.
Zn+2HCl= ZnCl2+h3 — молекулярное уравнение реакции.
Zn (заряд 0) + 2H (заряд +) + 2Cl (заряд -) = Zn (заряд +2) + 2Cl (заряд -)+ 2H (заряд 0) — полное Zn HCl ионное уравнение реакции.
Zn + 2H(+) = Zn(2+) +h3 — С.И.У. (сокращенное ионное уравнение реакции).
Реакция цинка с соляной кислотой
Данное уравнение реакции HCl Zn относится к типу окислительно-восстановительных. Это можно доказать тем, что у Zn и h3 в ходе реакции изменился заряд, наблюдалось качественное проявление реакции, а также наблюдалось присутствие окислителя и восстановителя.
В данном случае h3 является окислителем, так как с. о. водорода до начала реакции была «+», а после стала «0». Он участвовал в процессе восстановления, отдавая 2 электрона.
Zn является восстановителем, он участвует в окислении, принимая 2 электрона, повышая с.о. (степень окисления).
Также это реакция замещения. В ходе нее участвовало 2 вещества, простое Zn и сложное — HCl. В результате реакции образовалось 2 новых вещества, а также одно простое — h3 и одно сложное — ZnCl2. Так как Zn расположен в ряду активности металлов до h3, он вытеснил его из вещества, которое реагировала с ним.
В ходе нее участвовало 2 вещества, простое Zn и сложное — HCl. В результате реакции образовалось 2 новых вещества, а также одно простое — h3 и одно сложное — ZnCl2. Так как Zn расположен в ряду активности металлов до h3, он вытеснил его из вещества, которое реагировала с ним.
Пора двигаться дальше. Как мы уже знаем, полное ионное уравнение нуждается в «чистке». Необходимо удалить те частицы, которые присутствуют и в правой, и в левой частях уравнения. Эти частицы иногда называют «ионами-наблюдателями»; они не принимают участия в реакции.
В принципе, ничего сложного в этой части нет. Нужно лишь быть внимательным и осознавать, что в некоторых случаях полное и краткое уравнения могут совпадать (подробнее — см. пример 9).
Пример 5 . Составьте полное и краткое ионные уравнения, описывающие взаимодействие кремниевой кислоты и гидроксида калия в водном растворе.
Решение . Начнем, естественно, с молекулярного уравнения:
H 2 SiO 3 + 2KOH = K 2 SiO 3 + 2H 2 O.
Кремниевая кислота — один из редких примеров нерастворимых кислот; записываем в молекулярной форме. KOH и K 2 SiO 3 пишем в ионной форме. H 2 O, естественно, записываем в молекулярной форме:
H 2 SiO 3 + 2K + + 2OH — = 2K + + SiO 3 2- + 2H 2 O.
Видим, что ионы калия не изменяются в ходе реакции. Данные частицы не принимают участия в процессе, мы должны убрать их из уравнения. Получаем искомое краткое ионное уравнение:
H 2 SiO 3 + 2OH — = SiO 3 2- + 2H 2 O.
Как видите, процесс сводится к взаимодействию кремниевой кислоты с ионами OH — . Ионы калия в данном случае не играют никакой роли: мы могли заменить КОН гидроксидом натрия или гидроксидом цезия, при этом в реакционной колбе протекал бы тот же самый процесс.
Пример 6 . Оксид меди (II) растворили в серной кислоте. Напишите полное и краткое ионные уравнения данной реакции.
Решение . Основные оксиды реагируют с кислотами с образованием соли и воды:
H 2 SO 4 + CuO = CuSO 4 + H 2 O.
Соответствующие ионные уравнения приведены ниже. Думаю, комментировать что-либо в данном случае излишне.
2H + + SO 4 2- + CuO = Cu 2+ + SO 4 2- + H 2 O
2H + + CuO = Cu 2+ + H 2 O
Пример 7 . C помощью ионных уравнений опишите взаимодействие цинка с соляной кислотой.
Решение . Металлы, стоящие в ряду напряжений левее водорода, реагируют с кислотами с выделением водорода (специфические свойства кислот-окислителей мы сейчас не обсуждаем):
Zn + 2HCl = ZnCl 2 + H 2 .
Полное ионное уравнение записывается без труда:
Zn + 2H + + 2Cl — = Zn 2+ + 2Cl — + H 2 .
К сожалению, при переходе к краткому уравнению в заданиях такого типа школьники часто делают ошибки. Например, убирают цинк из двух частей уравнения. Это грубая ошибка! В левой части присутствует простое вещество, незаряженные атомы цинка. В правой части мы видим ионы цинка. Это совершенно разные объекты! Попадаются и еще более фантастические варианты. Например, в левой части зачеркиваются ионы H+, а в правой — молекулы H 2 . Мотивируют это тем, что и то, и другое является водородом. Но тогда, следуя этой логике, можно, например, считать, что H 2 , HCOH и CH 4 — это «одно и тоже», т. к. во всех этих веществах содержится водород. Видите, до какого абсурда можно дойти!
Например, в левой части зачеркиваются ионы H+, а в правой — молекулы H 2 . Мотивируют это тем, что и то, и другое является водородом. Но тогда, следуя этой логике, можно, например, считать, что H 2 , HCOH и CH 4 — это «одно и тоже», т. к. во всех этих веществах содержится водород. Видите, до какого абсурда можно дойти!
Естественно, в данном примере мы можем (и должны!) стереть только ионы хлора. Получаем окончательный ответ:
Zn + 2H + = Zn 2+ + H 2 .
В отличие от всех разобранных выше примеров, данная реакция является окислительно-восстановительной (в ходе данного процесса происходит изменение степеней окисления). Для нас, однако, это совершенно непринципиально: общий алгоритм написания ионных уравнений продолжает работать и здесь.
Пример 8 . Медь поместили в водный раствор нитрата серебра. Опишите происходящие в растворе процессы.
Решение . Более активные металлы (стоящие левее в ряду напряжений) вытесняют менее активные из растворов их солей. Медь находится в ряду напряжений левее серебра, следовательно, вытесняет Ag из раствора соли:
Медь находится в ряду напряжений левее серебра, следовательно, вытесняет Ag из раствора соли:
Сu + 2AgNO 3 = Cu(NO 3) 2 + 2Ag↓.
Полное и краткое ионные уравнения приведены ниже:
Cu 0 + 2Ag + + 2NO 3 — = Cu 2+ + 2NO 3 — + 2Ag↓ 0 ,
Cu 0 + 2Ag + = Cu 2+ + 2Ag↓ 0 .
Пример 9 . Напишите ионные уравнения, описывающие взаимодействие водных растворов гидроксида бария и серной кислоты.
Решение . Речь идет о хорошо знакомой всем реакции нейтрализации, молекулярное уравнение записывается без труда:
Ba(OH) 2 + H 2 SO 4 = BaSO 4 ↓ + 2H 2 O.
Полное ионное уравнение:
Ba 2+ + 2OH — + 2H + + SO 4 2- = BaSO 4 ↓ + 2H 2 O.
Пришло время составлять краткое уравнение, и тут выясняется интересная деталь: сокращать, собственно, нечего. Мы не наблюдаем одинаковых частиц в правой и левой частях уравнения. Что делать? Искать ошибку? Да нет, никакой ошибки здесь нет. Встретившаяся нам ситуация нетипична, но вполне допустима. Здесь нет ионов-наблюдателей; все частицы участвуют в реакции: при соединении ионов бария и сульфат-аниона образуется осадок сульфата бария, а при взаимодействии ионов H + и OH — — слабый электролит (вода).
«Но, позвольте!» — воскликните вы. — «Как же нам составлять краткое ионное уравнение?»
Никак! Вы можете сказать, что краткое уравнение совпадает с полным, вы можете еще раз переписать предыдущее уравнение, но смысл реакции от этого не изменится. Будем надеяться, что составители вариантов ЕГЭ избавят вас от подобных «скользких» вопросов, но, в принципе, вы должны быть готовы к любому варианту развития событий.
Пора начинать работать самостоятельно. Предлагаю вам выполнить следующие задания:
Упражнение 6 . Составьте молекулярные и ионные уравнения (полное и краткое) следующих реакций:
- Ba(OH) 2 + HNO 3 =
- Fe + HBr =
- Zn + CuSO 4 =
- SO 2 + KOH =
Как решать задание 31 на ЕГЭ по химии
В принципе, алгоритм решения данной задачи мы уже разобрали. Единственная проблема заключается в том, что на ЕГЭ задание формулируется несколько… непривычно. Вам будет предложен список из нескольких веществ. Вы должны будете выбрать два соединения, между которыми возможна реакция, составить молекулярное и ионные уравнения. Например, задание может формулироваться следующим образом:
Например, задание может формулироваться следующим образом:
Пример 10 . В вашем распоряжении имеются водные растворы гидроксида натрия, гидроксида бария, сульфата калия, хлорида натрия и нитрата калия. Выберите два вещества, которые могут реагировать друг с другом; напишите молекулярное уравнение реакции, а также полное и краткое ионные уравнения.
Решение . Вспоминая свойства основных классов неорганических соединений , приходим к выводу, что единственная возможная реакция — это взаимодействие водных растворов гидроксида бария и сульфата калия:
Ba(OH) 2 + K 2 SO 4 = BaSO 4 ↓ + 2KOH.
Полное ионное уравнение:
Ba 2+ + 2OH — + 2K + + SO 4 2- = BaSO 4 ↓ + 2K + + 2OH — .
Краткое ионное уравнение:
Ba 2+ + SO 4 2- = BaSO 4 ↓.
Кстати, обратите внимание на интересный момент: краткие ионные уравнения получились идентичными в данном примере и в примере 1 из первой части данной статьи. На первый взгляд, это кажется странным: реагируют совершенно разные вещества, а результат одинаковый. В действительности, ничего странного здесь нет: ионные уравнения помогают увидеть суть реакции, которая может скрываться под разными оболочками.
В действительности, ничего странного здесь нет: ионные уравнения помогают увидеть суть реакции, которая может скрываться под разными оболочками.
И еще один момент. Давайте попробуем взять другие вещества из предложенного списка и составить ионные уравнения. Ну, например, рассмотрим взаимодействие нитрата калия и хлорида натрия. Запишем молекулярное уравнение:
KNO 3 + NaCl = NaNO 3 + KCl.
Пока все выглядит достаточно правдоподобно, и мы переходим к полному ионному уравнению:
K + + NO 3 — + Na + + Cl — = Na + + NO 3 — + K + + Cl — .
Начинаем убирать лишнее и обнаруживаем неприятную деталь: ВСЕ в этом уравнении является «лишним». Все частица, присутствующие в левой части, мы находим и в правой. Что это означает? Возможно ли такое? Да, возможно, просто никакой реакции в данном случае не происходит; частицы, изначально присутствовавшие в растворе, так и останутся в нем. Реакции нет!
Видите, в молекулярном уравнении мы спокойно написали чепуху, но «обмануть» краткое ионное уравнение не удалось. Это тот самый случай, когда формулы оказываются умнее нас! Запомните: если при написании краткого ионного уравнения, вы приходите к необходимости убрать все вещества, это означает, что либо вы ошиблись и пытаетесь «сократить» что-то лишнее, либо данная реакция вообще невозможна.
Это тот самый случай, когда формулы оказываются умнее нас! Запомните: если при написании краткого ионного уравнения, вы приходите к необходимости убрать все вещества, это означает, что либо вы ошиблись и пытаетесь «сократить» что-то лишнее, либо данная реакция вообще невозможна.
Пример 11 . Карбонат натрия, сульфат калия, бромид цезия, соляная кислота, нитрат натрия. Из предложенного перечня выберите два вещества, которые способны прореагировать друг с другом, напишите молекулярное уравнение реакции, а также полное и краткое ионные уравнения.
Решение . В приведенном списке присутствуют 4 соли и одна кислота. Соли способны реагировать друг с другом только в том случае, если в ходе реакции образуется осадок, но ни одна из перечисленных солей не способна образовать осадок в реакции с другой солью из этого списка (проверьте этот факт, пользуясь таблицей растворимости !) Кислота способна прореагировать с солью лишь в том случае, когда соль образована более слабой кислотой. Серная, азотная и бромоводородная кислоты не могут быть вытеснены действием HCl. Единственный разумный вариант — взаимодействие соляной кислоты с карбонатом натрия.
Серная, азотная и бромоводородная кислоты не могут быть вытеснены действием HCl. Единственный разумный вариант — взаимодействие соляной кислоты с карбонатом натрия.
Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2
Обратите внимание: вместо формулы H 2 CO 3 , которая, по идее, должна была образоваться в ходе реакции, мы пишем H 2 O и CO 2 . Это правильно, т. к. угольная кислота крайне неустойчива даже при комнатной температуре и легко разлагается на воду и углекислый газ.
При записи полного ионного уравнения учитываем, что диоксид углерода не является электролитом:
2Na + + CO 3 2- + 2H + + 2Cl — = 2Na + + 2Cl — + H 2 O + CO 2 .
Убираем лишнее, получаем краткое ионное уравнение:
CO 3 2- + 2H + = H 2 O + CO 2 .
А теперь поэкспериментируйте немного! Попробуйте, как мы это сделали в предыдущей задаче, составить ионные уравнения неосуществимых реакций. Возьмите, например, карбонат натрия и сульфат калия или бромид цезия и нитрат натрия. Убедитесь, что краткое ионное уравнение вновь окажется «пустым».
- рассмотрим еще 6 примеров решения заданий ЕГЭ-31,
- обсудим, как составлять ионные уравнения в случае сложных окислительно-восстановительных реакций,
- приведем примеры ионных уравнений с участием органических соединений,
- затронем реакции ионного обмена, протекающие в неводной среде.
Цинк (Zn) — химический элемент, принадлежащий к группе щелочноземельных металлов. В периодической таблице Менделеева располагается под номером 30, что означает, что заряд ядра атома, число электронов и протонов тоже равно 30. Цинк находится в побочной II группе IV периода. По номеру группы можно определить количество атомов, которые находятся на его валентном или внешнем энергетическом уровне — соответственно, 2.
Цинк как типичный щелочной металл
Цинк — это типичный представитель металлов, в нормальном состоянии имеет голубовато-серый цвет, легко окисляется на воздухе, приобретая на поверхности оксидную пленку (ZnO).
Как типичный амфотерный металл цинк взаимодействует с кислородом воздуха: 2Zn+O2=2ZnO — без температуры, с образованием оксидной пленки. При нагревании образуется белый порошок.
При нагревании образуется белый порошок.
Сам оксид реагирует с кислотами с образованием соли и воды:
2ZnO+2HCl=ZnCl2+h3O.
С растворами кислот. Если цинк обычной чистоты, то уравнение реакции HCl Zn ниже.
Zn+2HCl= ZnCl2+h3 — молекулярное уравнение реакции.
Zn (заряд 0) + 2H (заряд +) + 2Cl (заряд -) = Zn (заряд +2) + 2Cl (заряд -)+ 2H (заряд 0) — полное Zn HCl ионное уравнение реакции.
Zn + 2H(+) = Zn(2+) +h3 — С.И.У. (сокращенное ионное уравнение реакции).
Реакция цинка с соляной кислотой
Данное уравнение реакции HCl Zn относится к типу окислительно-восстановительных. Это можно доказать тем, что у Zn и h3 в ходе реакции изменился заряд, наблюдалось качественное проявление реакции, а также наблюдалось присутствие окислителя и восстановителя.
В данном случае h3 является окислителем, так как с. о. водорода до начала реакции была «+», а после стала «0». Он участвовал в процессе восстановления, отдавая 2 электрона.
Zn является восстановителем, он участвует в окислении, принимая 2 электрона, повышая с. {2+} + 2e- &-> Cu(s)} & (E &= \pu{0,34 В})\\
\ce{2H+ + 2e- &-> h3} & (E &= \pu{0 V})
\end{выравнивание}
{2+} + 2e- &-> Cu(s)} & (E &= \pu{0,34 В})\\
\ce{2H+ + 2e- &-> h3} & (E &= \pu{0 V})
\end{выравнивание}
Что меня смущает, так это то, что в решении у нас будут $\ce{H+}$, $\ce{Cl-}$ и $\ce{Cu(s)}$, которые все являются произведениями в уравнениях (кроме $\ce{H+}$). Я понимаю, что для обратного уравнения (окисление) потенциал окисления определяется отрицательным значением потенциала восстановления. Мне интересно, если мы сначала посмотрим на медь и хлор, является ли единственным вариантом для окисления $\ce{Cl-}$ в растворе (с $E = \pu{-1,36 V}$)? Кроме того, может ли медь также быть только окисленной (при $E = \pu{-0,34 В}$)? И если оба эти утверждения верны, значит ли это, что эти два вообще не могут реагировать не потому, что общая сумма $E$ отрицательна, а потому, что они оба могут только окисляться?
- электрохимия
- восстановительный потенциал
$\endgroup$
13
$\begingroup$
Могу я просто уточнить, не вдаваясь в детали конкретной проблемы, если у вас есть Cu(s) в растворе (как у вас здесь), может ли он ТОЛЬКО окисляться? По сути, вы ищете, есть ли в растворе что-нибудь, что может окислять медь?
Давайте рассмотрим ваш запрос дольше. Для подобных электрохимических задач сначала нужно составить список исходных материалов и возможных продуктов. Проведите мысленный эксперимент еще до того, как просмотрите таблицы. Это долгий путь, но он поможет вам в решении будущих проблем. 9-$ в Cl$_2$? Это можно легко устранить, потому что для того, чтобы медь окислилась, она должна еще больше восстановиться, что невозможно.
Для подобных электрохимических задач сначала нужно составить список исходных материалов и возможных продуктов. Проведите мысленный эксперимент еще до того, как просмотрите таблицы. Это долгий путь, но он поможет вам в решении будущих проблем. 9-$ в Cl$_2$? Это можно легко устранить, потому что для того, чтобы медь окислилась, она должна еще больше восстановиться, что невозможно.
На этом этапе вы можете использовать электродные потенциалы. Напомним, катод относится к восстановлению, а анод относится к окислению. Ecell= E$_{катод}$-E$_{анод}$
Ecell= E(для водородной полуэлемента, т.к. он восстанавливается) — E(медный полуэлемент)
Ecell= 0,00- (+0,34) = — 0,34 В
Знак минус показывает, что в данных условиях это невозможно. 92- + h3O}$$
$\endgroup$
2
$\begingroup$
Хорошо, если вы возьмете кусок металлической меди (я использую водопроводную медь, высокой чистоты) в концентрированной HCl, медь со временем очистится от покрытия Cu2O. [EDIT] Цитировать источник:
[EDIT] Цитировать источник:
Медьобладает отличной атмосферной коррозионной стойкостью. Он естественным образом покрывается оксидной пленкой, меняя цвет на темно-коричневый/черный в нормальных атмосферных условиях. Позже на поверхности меди на открытом воздухе образуется зеленая патина с различной интенсивностью в зависимости от того, где и как подвергается воздействию поверхность.
Итак, проведите эксперимент с металлической медью, сделав фотографии до и после, и посмотрите, заметно ли они отличаются.
Основная химия, согласно Википедии, цитата:
Хлорид меди(I)… представляет собой белое твердое вещество, мало растворимое в воде, но хорошо растворимое в концентрированной соляной кислоте. Загрязненные образцы выглядят зелеными из-за присутствия хлорида меди (II) (CuCl2).
Также образует хлорокомплекс с концентрированной HCl:
Он образует комплексы с ионами галогенидов, например, образуя h4O+ CuCl2- в концентрированной соляной кислоте.
Итак, ожидаемые реакции в концентрированной HCl, очистка от любого покрытия Cu2O:
$\ce{HCl + h3O <=> h4O+ + Cl-}$
$\ce{Cu2O + 2 HCl -> 2 CuCl (s) + h3O}$
$\ce{CuCl (s) + h4O+ + Cl- <=> (h4O)CuCl2 (водн.)}$
Я проводил эксперименты, в которых добавляли много NaCl, создавая присутствие растворимой меди (в виде NaCuCl2). Википедия также цитирует препарат оксихлорида меди на основе этого преобразования растворимости меди согласно уравнениям (6) и уравнениям (7) здесь, где:
$\ce{ Cu (тв) + CuCl2 (водн.) -> 2 CuCl2 (тв.)}$
$\ce{ 2 CuCl (тв.) + 2 NaCl (водн.) -> 2 NaCuCl2 (водн.)}$
Никакой другой очевидной реакции со свежеочищенной медью не происходит.
$\endgroup$
$\begingroup$
Трех уравнений, которые вы перечислили, недостаточно, чтобы ответить на вопрос. Электрохимические потенциалы приведены для стандартных условий, если не указано иное. Теперь, когда вы помещаете кусок меди в 1 M HCl, [H +] составляет 1 M (стандарт), [Cl-] составляет 1 M (стандарт) и [Cu++] равен нулю (нестандарт). Уравнение для рассмотрения 9-12 M
Теперь, когда вы помещаете кусок меди в 1 M HCl, [H +] составляет 1 M (стандарт), [Cl-] составляет 1 M (стандарт) и [Cu++] равен нулю (нестандарт). Уравнение для рассмотрения 9-12 M
Конечная концентрация меди в этой реакции очень мала (3 триллионные доли моля на литр, 190 миллионных долей по весу), но не равна нулю. И я не учел, что h3 не находится при стандартном давлении (1 атм), что немного поднимет напряжение, а также возможное [Cu++]. Таким образом, медь не является полностью инертной в 1 М HCl. И это при условии, что вы говорите об инертной атмосфере, такой как 100% N2.
В реальной жизни это было бы сделано на воздухе (O2 = 0,2 атм). А кислород подберет электроны и отдаст гидроксил: 9-14, а не 1 М). Итак, теперь медь может окислиться и раствориться.
Ты мне не веришь? Капните немного HCl (1 М или больше) на монетку и наблюдайте, как она разъедает — и когда она пробивает внутреннюю часть цинка, пузыри!
$\endgroup$
6
Твой ответ
Зарегистрируйтесь или войдите
Зарегистрироваться через Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Обязательно, но не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
Химия меди — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3722
- Джим Кларк
- Школа Труро в Корнуолле
Медь относится к тому же семейству периодической таблицы, что и серебро и золото, поскольку у каждого из них есть один s-орбитальный электрон поверх заполненной электронной оболочки, которая образует металлические связи. Это сходство электронной структуры делает их похожими по многим характеристикам. Все они обладают очень высокой тепло- и электропроводностью и являются ковкими металлами. Среди чистых металлов при комнатной температуре медь имеет вторую по величине электрическую и теплопроводность после серебра.
Это сходство электронной структуры делает их похожими по многим характеристикам. Все они обладают очень высокой тепло- и электропроводностью и являются ковкими металлами. Среди чистых металлов при комнатной температуре медь имеет вторую по величине электрическую и теплопроводность после серебра.
Введение
Использование меди восходит к глубокой истории. Медные бусы были найдены на территории современного Ирака, датируемого 9000 годом до нашей эры. Металл относительно легко добывать и очищать, что способствует его раннему и широкому использованию. Однако, будучи мягким, он непригоден для изготовления надежных инструментов и оружия. Первые кузнецы еще за 3000 лет до нашей эры научились сочетать медь с другими металлами для получения более прочных сплавов. Латунь (медь и цинк) и бронза (медь и олово) являются двумя примерами. Символ и название меди происходят от латинского 9.0035 cuprum , что буквально означает «с острова Кипр», ранний источник медной руды.
До 1982 года пенни США были из чистой меди. Теперь они в основном цинковые с тонкой оболочкой из меди. Большая часть добываемой сегодня меди очищается и вытягивается в проволоку для использования в электротехнической промышленности. Значительная часть также используется в производстве водопроводных труб. Медь, конечно же, имеет характерный цвет, который знаком большинству людей. Он является одним из лучших электрических проводников и устойчив к коррозии от большинства кислот (кроме азотной и горячей концентрированной серной). При воздействии элементов в течение определенного периода времени на нем образуется зеленоватый налет или патина, представляющая собой карбонат меди (II), защитное покрытие, предотвращающее дальнейший износ.
Теперь они в основном цинковые с тонкой оболочкой из меди. Большая часть добываемой сегодня меди очищается и вытягивается в проволоку для использования в электротехнической промышленности. Значительная часть также используется в производстве водопроводных труб. Медь, конечно же, имеет характерный цвет, который знаком большинству людей. Он является одним из лучших электрических проводников и устойчив к коррозии от большинства кислот (кроме азотной и горячей концентрированной серной). При воздействии элементов в течение определенного периода времени на нем образуется зеленоватый налет или патина, представляющая собой карбонат меди (II), защитное покрытие, предотвращающее дальнейший износ.
Залежи и извлечение меди
Медь встречается как в связанном, так и в свободном состоянии, а также во многих рудах. Важными рудами меди являются медный пирит (\(CuFeS_2\)), куприт и медный глянец. Медные руды в основном находятся на севере Индии. Извлечение меди также включает в себя множество стадий. Руда, используемая для добычи, представляет собой медный колчедан, который измельчается, концентрируется и затем нагревается в присутствии воздуха. При нагревании влага удаляется, а колчедан меди превращается в сульфид железа и сульфид меди.
Руда, используемая для добычи, представляет собой медный колчедан, который измельчается, концентрируется и затем нагревается в присутствии воздуха. При нагревании влага удаляется, а колчедан меди превращается в сульфид железа и сульфид меди.
\[ 2CuFeS_2 + O_2 \rightarrow Cu_2S + 2FeS + SO_2 \]
Доменная печь предназначена для нагрева смеси обожженной руды, порошкообразного кокса и песка. В доменной печи происходят реакции окисления. Сульфид железа образует оксид железа, который соединяется с кремнеземом и образует шлак (\(FeSiO_2\)).
\[ 2FeS + 3O_2 \rightarrow 2FeO + 2SO_2\]
\[ FeO + SiO_2 \rightarrow FeSiO_3\]
Сульфид меди образует закись меди, которая частично превращается в сульфид меди.
\[ Cu_2S + 3 O_2 \rightarrow 2Cu_2O + 2SO_2\]
\[ Cu_2O + FeS \rightarrow Cu_2S + FeO\]
Этот сульфид меди содержит некоторое количество сульфида железа и называется штейном. Штейн удаляют из основного выхода доменной печи. Удаленный штейн переводится в бессемеровский конвертер, который внутри футерован оксидом магния. Этот преобразователь имеет трубы, через которые подается горячий воздух и \(SiO_2\). В этом конвертере \(Cu_2S\) преобразуется в \(Cu_2O\), а \(FeS\) превращается в \(FeO\). Закись железа образует шлак с \(SiO_2\). Образующийся оксид меди реагирует с Cu2S и образует медь.
Этот преобразователь имеет трубы, через которые подается горячий воздух и \(SiO_2\). В этом конвертере \(Cu_2S\) преобразуется в \(Cu_2O\), а \(FeS\) превращается в \(FeO\). Закись железа образует шлак с \(SiO_2\). Образующийся оксид меди реагирует с Cu2S и образует медь.
\[ 2Cu_2O + Cu_2S \rightarrow 6Cu + SO_2\]
Полученную медь очищают электролизом.
Реакции ионов меди(II) в растворе
Простейшим ионом, который медь образует в растворе, является типичный синий ион гексааквамеди(II) — [Cu(H 2 O) 6 ] 2+ .
Реакции ионов гексааквамеди(II) с ионами гидроксида
Ионы гидроксида (например, из раствора гидроксида натрия) удаляют ионы водорода из водных лигандов, присоединенных к иону меди. Как только ион водорода был удален из двух молекул воды, у вас остался комплекс без заряда — нейтральный комплекс. Он нерастворим в воде, и образуется осадок.
Цветовая кодировка показывает, что это не реакция обмена лиганда. Кислороды, которые первоначально были связаны с медью, все еще связаны в нейтральном комплексе.
Кислороды, которые первоначально были связаны с медью, все еще связаны в нейтральном комплексе.
В пробирке изменение цвета:
Реакции ионов гексааквамеди(II) с раствором аммиака
Аммиак действует как основание и как лиганд. При небольшом количестве аммиака ионы водорода отрываются от гексаакваиона точно так же, как и в случае гидроксид-иона, с образованием того же нейтрального комплекса. 9{2+} + H_2O\]
Примечание
Вы можете удивиться, почему это второе уравнение дается исходя из исходного гексаакваиона, а не нейтрального комплекса. Объяснить, почему осадок снова растворяется, довольно сложно. Полное объяснение вы найдете на странице о реакциях между ионами гексааква и раствором аммиака.
Изменения цвета:
Реакция ионов гексааквамеди(II) с ионами карбоната
Вы просто получаете осадок того, что вы можете представить как карбонат меди(II). 9{2-} + 6H_2O\]
Поскольку реакция обратима, вы получаете смесь цветов из-за обоих комплексных ионов. Цвет иона тетрахлоркупрата (II) можно также описать как оливково-зеленый или желтый. Если к зеленому раствору добавить воду, он снова станет синим.
Цвет иона тетрахлоркупрата (II) можно также описать как оливково-зеленый или желтый. Если к зеленому раствору добавить воду, он снова станет синим.
Реакция ионов гексааквамеди(II) с ионами йодида
Ионы меди(II) окисляют ионы йодида до молекулярного йода, и в процессе сами восстанавливаются до йодида меди(I).
9- (aq)\]
Когда раствор тиосульфата натрия вливается из бюретки, окраска йода тускнеет. Когда почти все кончится, добавьте немного раствора крахмала. Он обратимо реагирует с йодом, образуя темно-синий комплекс крахмал-йод, который гораздо легче увидеть.
Медленно добавляйте последние несколько капель раствора тиосульфата натрия, пока не исчезнет синяя окраска. Если вы проследите пропорции реакции с помощью двух уравнений, вы обнаружите, что на каждые 2 моля ионов меди (II), с которыми вы должны были начать, вам нужно 2 моля раствора тиосульфата натрия. Зная концентрацию раствора тиосульфата натрия, легко рассчитать концентрацию ионов меди(II).
Некоторые важные химические вещества меди(I)
Диспропорционирование ионов меди(I) в растворе
Химия меди(I) ограничивается реакцией, которая протекает с участием простых ионов меди(I) в растворе. Это хороший пример диспропорционирования — реакции, при которой что-то окисляется и восстанавливается. Ионы меди (I) в растворе диспропорционируют с образованием ионов меди (II) и осадка меди. Реакция:
Любая попытка получить простое соединение меди(I) в растворе приводит к этому. Например, если вы взаимодействуете с оксидом меди (I) с горячей разбавленной серной кислотой, вы можете ожидать получения раствора сульфата меди (I) и воды. На самом деле вы получаете коричневый осадок меди и синий раствор сульфата меди (II) из-за реакции диспропорционирования.
\[ Cu_2O + H_2SO_4 \rightarrow Cu + CuSO_4 + H_2O\]
Стабилизация степени окисления меди(I)
Мы уже видели, что йодид меди(I) образуется в виде не совсем белого осадка, если добавить раствора иодида калия в раствор, содержащий ионы меди(II). Иодид меди(I) практически нерастворим в воде, поэтому реакции диспропорционирования не происходит. Точно так же хлорид меди (I) может быть получен в виде белого осадка (реакция описана ниже). Если его отделить от раствора и как можно быстрее высушить, он останется белым. Однако при контакте с водой он медленно становится синим по мере образования ионов меди (II). Реакция диспропорционирования происходит только с простыми ионами меди (I) в растворе.
Иодид меди(I) практически нерастворим в воде, поэтому реакции диспропорционирования не происходит. Точно так же хлорид меди (I) может быть получен в виде белого осадка (реакция описана ниже). Если его отделить от раствора и как можно быстрее высушить, он останется белым. Однако при контакте с водой он медленно становится синим по мере образования ионов меди (II). Реакция диспропорционирования происходит только с простыми ионами меди (I) в растворе.
Образование комплексов меди(I) (кроме комплексов с водой в качестве лиганда) также стабилизирует степень окисления меди(I). Например, оба [Cu(NH 3 ) 2 ] + и [CuCl 2 ] — представляют собой комплексы меди (I), которые не диспропорционируют . Хлорсодержащий комплекс образуется при растворении оксида меди(I) в концентрированной соляной кислоте. Вы можете представить, что это происходит в два этапа. Сначала образуется хлорид меди(I): 9-_{(aq)}\]
Вы можете получить белый осадок хлорида меди(I) (упомянутый выше), добавляя к этому раствору воду. Это обращает последнюю реакцию, удаляя лишний хлорид-ион.
Это обращает последнюю реакцию, удаляя лишний хлорид-ион.
Авторы и авторство
Эта страница под названием «Химия меди» распространяется по незаявленной лицензии, ее автором, ремиксом и/или куратором является Джим Кларк.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Джим Кларк
- Показать страницу TOC
- № на стр.
- Метки
- медь
- медный пирит
- замена лиганда
| 1 | Найдите количество нейтронов | Х | |
| 2 | Найдите массу 1 моля | Н_2О | |
| 3 | Весы | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найдите массу 1 моля | Х | |
| 5 | Найдите количество нейтронов | Фе | |
| 6 | Найдите количество нейтронов | Тк | |
| 7 | Найдите электронную конфигурацию | Х | |
| 8 | Найдите количество нейтронов | Са | |
| 9 | Весы | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найдите количество нейтронов | С | |
| 11 | Найдите число протонов | Х | |
| 12 | Найдите количество нейтронов | О | |
| 13 | Найдите массу 1 моля | СО_2 | |
| 14 | Весы | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найдите атомную массу | Х | |
| 16 | Определить, растворимо ли соединение в воде | Н_2О | |
| 17 | Найдите электронную конфигурацию | На | |
| 18 | Найдите массу отдельного атома | Ч | |
| 19 | Найдите количество нейтронов | № | |
| 20 | Найдите количество нейтронов | Золото | |
| 21 | Найдите количество нейтронов | Мн | |
| 22 | Найдите количество нейтронов | Ру | |
| 23 | Найдите электронную конфигурацию | О | |
| 24 | Найдите массовые проценты | Н_2О | |
| 25 | Определите, растворимо ли соединение в воде | NaCl | |
| 26 | Найдите эмпирическую/самую простую формулу | Н_2О | |
| 27 | Найдите числа окисления | Н_2О | |
| 28 | Найдите электронную конфигурацию | К | |
| 29 | Найдите электронную конфигурацию | мг | |
| 30 | Найдите электронную конфигурацию | Са | |
| 31 | Найдите количество нейтронов | Rh | |
| 32 | Найдите количество нейтронов | На | |
| 33 | Найдите количество нейтронов | Пт | |
| 34 | Найдите количество нейтронов | Бе | Быть |
| 35 | Найдите количество нейтронов | Кр | |
| 36 | Найдите массу 1 моля | Н_2SO_4 | |
| 37 | Найдите массу 1 моля | HCl | |
| 38 | Найдите массу 1 моля | Фе | |
| 39 | Найдите массу 1 моля | С | |
| 40 | Найдите количество нейтронов | Медь | |
| 41 | Найдите количество нейтронов | С | |
| 42 | Найдите числа окисления | Х | |
| 43 | Весы | CH_4+O_2→CO_2+H_2O | |
| 44 | Найдите атомную массу | О | |
| 45 | Найдите атомный номер | Х | |
| 46 | Найдите количество нейтронов | Пн | |
| 47 | Найдите количество нейтронов | ОС | |
| 48 | Найдите массу 1 моля | NaOH | |
| 49 | Найдите массу 1 моля | О | |
| 50 | Найдите электронную конфигурацию | Фе | |
| 51 | Найдите электронную конфигурацию | С | |
| 52 | Найдите массовые проценты | NaCl | |
| 53 | Найдите массу 1 моля | К | |
| 54 | Найдите массу отдельного атома | На | |
| 55 | Найдите количество нейтронов | Н | |
| 56 | Найдите количество нейтронов | Ли | |
| 57 | Найдите количество нейтронов 92О | ||
| 60 | Упростить | ч*2о | |
| 61 | Определить, растворимо ли соединение в воде | Х | |
| 62 | Определение плотности на STP | Н_2О | |
| 63 | Найдите числа окисления | NaCl | |
| 64 | Найдите атомную массу | Он | Он |
| 65 | Найдите атомную массу | мг | |
| 66 | Найдите число электронов | Х | |
| 67 | Найдите количество электронов | О | |
| 68 | Найдите число электронов | С | |
| 69 | Найдите количество нейтронов | Пд | |
| 70 | Найдите количество нейтронов | рт. ст. ст. | |
| 71 | Найдите количество нейтронов | Б | |
| 72 | Найдите массу отдельного атома | Ли | |
| 73 | Найдите эмпирическую формулу | Н=12%, С=54%, N=20 | , , |
| 74 | Найдите число протонов | Быть | Быть |
| 75 | Найдите массу 1 моля | На | |
| 76 | Найдите электронную конфигурацию | Со | |
| 77 | Найдите электронную конфигурацию | С | |
| 78 | Весы | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Весы | Н_2+О_2→Н_2О | |
| 80 | Найдите электронную конфигурацию | Р | |
| 81 | Найдите электронную конфигурацию | Пб | |
| 82 | Найдите электронную конфигурацию | Ал | |
| 83 | Найдите электронную конфигурацию | Ар | |
| 84 | Найдите массу 1 моля | О_2 | |
| 85 | Найдите массу 1 моля | Н_2 | |
| 86 | Найдите количество нейтронов | К | |
| 87 | Найдите количество нейтронов | Р | |
| 88 | Найдите количество нейтронов | мг | |
| 89 | Найдите количество нейтронов | Вт | |
| 90 | Найдите массу отдельного атома | С | |
| 91 | Упростить | н/д+кл | |
| 92 | Определить, растворимо ли соединение в воде | Н_2SO_4 | |
| 93 | Определение плотности на STP | NaCl | |
| 94 | Найдите числа окисления | C_6H_12O_6 | |
| 95 | Найдите числа окисления | На | |
| 96 | Определить, растворимо ли соединение в воде | C_6H_12O_6 | |
| 97 | Найдите атомную массу | Кл | |
| 98 | Найдите атомную массу | Фе | |
| 99 | Найдите эмпирическую/самую простую формулу | СО_2 | |
| 100 | Найдите количество нейтронов | Мт |
МЕДЬ На этой странице рассматриваются некоторые аспекты химии меди, необходимые для сдачи экзаменов уровня A в Великобритании. Реакции ионов меди(II) в растворе Простейшим ионом, который медь образует в растворе, является типичный синий ион гексааквамеди(II) — [Cu(H 2 О) 6 ] 2+ . | ||
Примечание: Если вас не устраивают сложные ионы (в том числе то, как они связаны и называются), вам стоит пройти по этой ссылке и изучить первые пару страниц в меню сложных ионов, прежде чем продолжить. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
Реакция ионов гексааквамеди(II) с гидроксид-ионами Ионы гидроксида (например, из раствора гидроксида натрия) удаляют ионы водорода из водных лигандов, присоединенных к иону меди. После того, как ион водорода будет удален из двух молекул воды, останется комплекс без заряда — нейтральный комплекс. Он нерастворим в воде, и образуется осадок. | ||
Примечание: Цветовая кодировка показывает, что этот не является реакцией обмена лиганда. Кислороды, которые первоначально были связаны с медью, все еще связаны в нейтральном комплексе. | ||
В пробирке изменение цвета: | ||
Примечание: Вы найдете подробное обсуждение реакций между гексааква-ионами и ионами гидроксида, если перейдете по этой ссылке. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
Реакции ионов гексааквамеди(II) с раствором аммиака Аммиак действует как основание и лиганд. При небольшом количестве аммиака ионы водорода отрываются от гексаакваиона точно так же, как и в случае гидроксид-иона, с образованием того же нейтрального комплекса. Этот осадок растворяется, если добавить избыток аммиака. Аммиак заменяет воду в качестве лиганда с образованием ионов тетраамминдиаквамеди(II). Обратите внимание, что заменены только 4 из 6 молекул воды. | ||
Примечание: Вы можете удивиться, почему это второе уравнение дается исходя из исходного гексаакваиона, а не нейтрального комплекса. Объяснить, почему осадок снова растворяется, довольно сложно. Полное объяснение вы найдете на странице о реакциях между ионами гексааква и раствором аммиака. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
Изменения цвета: Реакция ионов гексааквамеди(II) с карбонат-ионами Вы просто получаете осадок того, что можно представить как карбонат меди(II). | ||
Примечание: Только одна из экзаменационных комиссий уровня A в Великобритании хочет этого, и это упрощение, которое они делают.  На самом деле осадок лучше описать как основной карбонат с формулой вида xCuCO 3 ,yCu(OH) 2 ,zH 2 О. На самом деле осадок лучше описать как основной карбонат с формулой вида xCuCO 3 ,yCu(OH) 2 ,zH 2 О.Вы найдете подробное обсуждение реакций между ионами гексааква и ионами карбоната, если перейдете по этой ссылке. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
Реакция лигандного обмена с участием ионов хлорида Если добавить концентрированную соляную кислоту в раствор, содержащий ионы гексааквамеди(II), шесть молекул воды заменятся четырьмя ионами хлорида. Происходящая реакция обратима. Поскольку реакция обратима, вы получаете смесь цветов из-за обоих комплексных ионов. Цвет иона тетрахлоркупрата (II) может быть описан как оливково-зеленый или желтый. Если к зеленому раствору добавить воды, он снова станет синим. | ||
Примечание: Более подробно эта реакция описана на странице, посвященной реакциям обмена лигандами.  Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
Реакция ионов гексааквамеди(II) с иодид-ионами Простая реакция Ионы меди(II) окисляют иодид-ионы до йода, и в процессе сами восстанавливаются до йодида меди(I). | ||
Примечание: Если вам нужно, вы можете узнать больше о степенях окисления, перейдя по этой ссылке. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | ||
Исходная грязно-коричневая смесь выпадает в не совсем белый осадок йодида меди(I) в растворе йода. | ||
Примечание: У меня было несколько попыток правильно подобрать этот цвет, но мое программное обеспечение продолжает немного изменять его, поскольку я адаптирую диаграмму для использования в Интернете.  Цвет раствора йода на самом деле довольно сильно варьируется в зависимости от его концентрации, поэтому меня это не слишком беспокоит! Цвет раствора йода на самом деле довольно сильно варьируется в зависимости от его концентрации, поэтому меня это не слишком беспокоит! | ||
Использование этой реакции для определения концентрации ионов меди(II) в растворе Если пипеткой отобрать известный объем раствора, содержащего ионы меди(II), в колбу, а затем добавить избыток раствора йодида калия, получится только что описанная реакция. Вы можете найти количество йода, выделившегося при титровании раствором тиосульфата натрия. При вливании раствора тиосульфата натрия из бюретки окраска йода тускнеет. Когда почти все кончится, добавьте немного раствора крахмала. Он обратимо реагирует с йодом, образуя темно-синий комплекс крахмал-йод, который гораздо легче увидеть. Вы медленно добавляете последние несколько капель раствора тиосульфата натрия, пока не исчезнет синяя окраска. Если вы проследите пропорции реакции с помощью двух уравнений, вы обнаружите, что на каждые 2 моля ионов меди (II), с которыми вы должны были начать, вам нужно 2 моля раствора тиосульфата натрия. Если известна концентрация раствора тиосульфата натрия, легко рассчитать концентрацию ионов меди(II). | ||
Примечание: Если вы не очень хорошо разбираетесь в расчетах титрования, вам может быть интересна моя книга расчетов по химии. Этот конкретный пример подробно рассматривается на страницах 66-67. | ||
Некоторые основные химические соединения меди(I) Диспропорционирование ионов меди(I) в растворе Химия меди(I) ограничена реакцией, которая протекает с участием простых ионов меди(I) в растворе. Это хороший пример диспропорционирования — реакции, в которой что-то окисляется и восстанавливается. Ионы меди(I) в растворе диспропорционируют с образованием ионов меди(II) и осадка меди. Реакция: Любая попытка получить простое соединение меди(I) в растворе приводит к этому. Например, при реакции оксида меди(I) с горячей разбавленной серной кислотой можно ожидать получения раствора сульфата меди(I) и воды. На самом деле вы получаете коричневый осадок меди и синий раствор сульфата меди (II) из-за реакции диспропорционирования. Стабилизация степени окисления меди(I) Нерастворимые соединения меди(I) Мы уже видели, что йодид меди(I) образуется в виде не совсем белого осадка, если добавить раствор йодида калия в раствор, содержащий ионы меди(II). Иодид меди(I) практически нерастворим в воде, поэтому реакции диспропорционирования не происходит. Аналогичным образом можно получить хлорид меди(I) в виде белого осадка (реакция описана ниже). Если его отделить от раствора и как можно быстрее высушить, он останется белым. Однако при контакте с водой он медленно становится синим по мере образования ионов меди (II). Реакция диспропорционирования происходит только с простыми ионами меди(I) в растворе. Комплексы меди(I) Образование комплексов меди(I) (кроме комплексов с водой в качестве лиганда) также стабилизирует степень окисления меди(I). Например, как [Cu(NH 3 ) 2 ] + , так и [CuCl 2 ] — представляют собой комплексы меди(I), которые не диспропорционируют. Хлорсодержащий комплекс образуется при растворении оксида меди(I) в концентрированной соляной кислоте. Можно представить, что это происходит в два этапа. Сначала образуется хлорид меди(I): Но в присутствии избытка ионов хлорида из HCl это реагирует с образованием стабильного растворимого комплекса меди(I). Вы можете получить белый осадок хлорида меди(I) (упомянутый выше), добавляя к этому раствору воду. Это обращает последнюю реакцию, удаляя лишний хлорид-ион.
В меню переходных металлов. . . В меню неорганической химии. . . В главное меню . . . © Джим Кларк, 2003 г. (изменено в июле 2015 г.) | ||
химическая реакция | Определение, уравнения, примеры и типы
сжигание
Посмотреть все СМИ
- Ключевые люди:
- Антуан Лавуазье Клод-Луи Бертолле Вильгельм Оствальд Анри-Луи Ле Шателье Сэр Дерек Х. Р. Бартон
- Похожие темы:
- кислотно-основная реакция механизм реакции окислительно-восстановительная реакция ионообменная реакция фотохимическая реакция
Просмотреть весь связанный контент →
Популярные вопросы
Каковы основы химических реакций?
- Химическая реакция – это процесс, в котором одно или несколько веществ, также называемых реагентами, превращаются в одно или несколько различных веществ, известных как продукты.
 Вещества – это либо химические элементы, либо соединения.
Вещества – это либо химические элементы, либо соединения. - Химическая реакция перестраивает составляющие атомы реагентов для создания различных веществ в качестве продуктов. Свойства продуктов отличаются от свойств реагентов.
- Химические реакции отличаются от физических изменений, которые включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если произойдет физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней.
Подробнее ниже: Основные понятия о химических реакциях
химический элемент
Узнайте об этом типе вещества, которое не может быть разложено на более простые вещества обычными химическими процессами.химическое соединение
Узнайте об этом типе вещества, которое можно разложить на более простые вещества с помощью обычных химических процессов.Что происходит с химическими связями, когда происходит химическая реакция?
Согласно современному взгляду на химические реакции, связи между атомами в реагентах должны быть разрушены, а атомы или части молекул снова собираются в продукты путем образования новых связей. Энергия поглощается для разрыва связей, а энергия выделяется по мере образования связей. В некоторых реакциях энергия, необходимая для разрыва связей, больше энергии, выделяемой при образовании новых связей, и конечным результатом является поглощение энергии. Следовательно, в реакции могут образовываться различные типы связей. Кислотно-основная реакция Льюиса, например, включает образование ковалентной связи между основанием Льюиса, веществом, которое поставляет электронную пару, и кислотой Льюиса, веществом, которое может принимать электронную пару. Аммиак является примером основания Льюиса. Пара электронов, расположенных на атоме азота, может быть использована для образования химической связи с кислотой Льюиса.
Энергия поглощается для разрыва связей, а энергия выделяется по мере образования связей. В некоторых реакциях энергия, необходимая для разрыва связей, больше энергии, выделяемой при образовании новых связей, и конечным результатом является поглощение энергии. Следовательно, в реакции могут образовываться различные типы связей. Кислотно-основная реакция Льюиса, например, включает образование ковалентной связи между основанием Льюиса, веществом, которое поставляет электронную пару, и кислотой Льюиса, веществом, которое может принимать электронную пару. Аммиак является примером основания Льюиса. Пара электронов, расположенных на атоме азота, может быть использована для образования химической связи с кислотой Льюиса.
химическая связь
Узнайте о различных типах химической связи.кислотно-основная реакция: реакции кислот Льюиса
Узнайте о кислотно-основных реакциях Льюиса.Как классифицируются химические реакции?
Химики классифицируют химические реакции несколькими способами: по типу продукта, по типу реагентов, по результату реакции и по механизму реакции. Часто данную реакцию можно отнести к двум или даже трем категориям, включая реакции газообразования и реакции осаждения. Многие реакции производят газ, такой как двуокись углерода, сероводород, аммиак или двуокись серы. Подъем теста для торта вызван газообразующей реакцией между кислотой и пищевой содой (гидрокарбонатом натрия). Классификация по типам реагентов включает кислотно-основные реакции и окислительно-восстановительные реакции, которые включают перенос одного или нескольких электронов от восстановителя к окислителю. Примеры классификации по результату реакции включают реакции разложения, полимеризации, замещения, отщепления и присоединения. Цепные реакции и реакции фотолиза являются примерами классификации по механизму реакции, которая дает подробную информацию о том, как атомы перетасовываются и повторно собираются при образовании продуктов.
Часто данную реакцию можно отнести к двум или даже трем категориям, включая реакции газообразования и реакции осаждения. Многие реакции производят газ, такой как двуокись углерода, сероводород, аммиак или двуокись серы. Подъем теста для торта вызван газообразующей реакцией между кислотой и пищевой содой (гидрокарбонатом натрия). Классификация по типам реагентов включает кислотно-основные реакции и окислительно-восстановительные реакции, которые включают перенос одного или нескольких электронов от восстановителя к окислителю. Примеры классификации по результату реакции включают реакции разложения, полимеризации, замещения, отщепления и присоединения. Цепные реакции и реакции фотолиза являются примерами классификации по механизму реакции, которая дает подробную информацию о том, как атомы перетасовываются и повторно собираются при образовании продуктов.
Подробнее читайте ниже: Классификация химических реакций
кислотно-щелочные реакции
Узнайте о кислотно-щелочных реакциях.
окислительно-восстановительная реакция
Узнайте об окислительно-восстановительных или окислительно-восстановительных реакциях.цепная реакция
Узнайте о цепных или самоподдерживающихся реакциях.Сводка
Прочтите краткий обзор этой темы
химическая реакция , процесс, в котором одно или несколько веществ, реагентов, превращаются в одно или несколько различных веществ, продуктов. Вещества – это либо химические элементы, либо соединения. Химическая реакция перестраивает составляющие атомы реагентов для создания различных веществ в качестве продуктов.
Химические реакции являются неотъемлемой частью технологии, культуры и самой жизни. Сжигание топлива, плавка железа, изготовление стекла и гончарных изделий, пивоварение, производство вина и сыра — вот лишь некоторые примеры деятельности, включающей химические реакции, которые были известны и использовались на протяжении тысячелетий. Химические реакции изобилуют в геологии Земли, в атмосфере и океанах, а также в огромном количестве сложных процессов, происходящих во всех живых системах.
Химические реакции следует отличать от физических изменений. Физические изменения включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если произойдет физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней. В любом физическом состоянии вода (H 2 O) — одно и то же соединение, каждая молекула которого состоит из двух атомов водорода и одного атома кислорода. Однако если вода в виде льда, жидкости или пара встречается с металлическим натрием (Na), атомы перераспределяются с образованием новых веществ: молекулярного водорода (H 2 ) и гидроксида натрия (NaOH). Таким образом, мы знаем, что произошло химическое изменение или реакция.
Исторический обзор
Концепция химической реакции насчитывает около 250 лет. Он берет свое начало в ранних экспериментах, которые классифицировали вещества как элементы и соединения, а также в теориях, объясняющих эти процессы. Развитие концепции химической реакции сыграло главную роль в определении науки химии, какой она известна сегодня.
Развитие концепции химической реакции сыграло главную роль в определении науки химии, какой она известна сегодня.
Britannica Quiz
13 верных или неверных вопросов из самых простых научных викторин Britannica
Иногда мы в Britannica слышим, что наши викторины слишком сложные. Не правда! Вот 13 правильных и неверных вопросов из наших самых простых вопросов о науке. Вы справитесь с этим.
Первые серьезные исследования в этой области были посвящены газам. Особое значение имело определение кислорода в 18 веке шведским химиком Карлом Вильгельмом Шееле и английским священником Джозефом Пристли. Влияние французского химика Антуана-Лорана Лавуазье было особенно заметным, поскольку его идеи подтвердили важность количественных измерений химических процессов. В своей книге Traité élémentaire de chimie (1789; Elementary Treatise on Chemistry ), Лавуазье определил 33 «элемента» — вещества, не разложенные на более простые сущности. Среди своих многочисленных открытий Лавуазье точно измерил вес, прибавляемый при окислении элементов, и приписал результат соединению элемента с кислородом. Концепция химических реакций с участием комбинации элементов ясно возникла из его работ, и его подход побудил других заняться экспериментальной химией как количественной наукой.
Концепция химических реакций с участием комбинации элементов ясно возникла из его работ, и его подход побудил других заняться экспериментальной химией как количественной наукой.
Другим событием исторического значения, касающимся химических реакций, было развитие атомной теории. Большая заслуга в этом принадлежит английскому химику Джону Дальтону, постулировавшему свою атомную теорию в начале XIX века. Дальтон утверждал, что материя состоит из маленьких неделимых частиц, что частицы или атомы каждого элемента уникальны и что химические реакции связаны с перестройкой атомов с образованием новых веществ. Этот взгляд на химические реакции точно определяет текущий предмет. Теория Дальтона послужила основой для понимания результатов более ранних экспериментаторов, в том числе закона сохранения материи (материя не создается и не разрушается) и закона постоянного состава (все образцы вещества имеют одинаковый элементный состав).
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Подпишитесь сейчас
Таким образом, эксперимент и теория, два краеугольных камня химической науки в современном мире, вместе определили концепцию химических реакций. Сегодня экспериментальная химия дает бесчисленное множество примеров, а теоретическая химия позволяет понять их значение.
Основные понятия о химических реакциях
Создавая новое вещество из других веществ, химики говорят, что либо проводят синтез, либо синтезируют новый материал. Реагенты превращаются в продукты, и процесс символизируется химическим уравнением. Например, железо (Fe) и сера (S) объединяются, образуя сульфид железа (FeS). Fe(s) + S(s) → FeS(s) Знак плюс указывает на то, что железо реагирует с серой. Стрелка означает, что реакция «образует» или «дает» сульфид железа, продукт. Вещественное состояние реагентов и продуктов обозначается символами (s) для твердых тел, (l) для жидкостей и (g) для газов.
Лабораторная процедура
ЗАМЕЧАНИЯ ПО БЕЗОПАСНОСТИ: Соляная кислота (HCl), используемая в этой лаборатории, очень концентрирована и может вызвать серьезные ожоги. Если кислота попала на кожу, немедленно промойте пораженный участок большим количеством воды.
Если кислота попала на кожу, немедленно промойте пораженный участок большим количеством воды.
ОБЩИЕ ИНСТРУКЦИИ: Каждый учащийся будет работать в этой лаборатории индивидуально.
| Часть I. Приготовление раствора сульфата меди | |
| Вам нужно будет создать 25 мл 0,25 М раствора CuSO 4 в 3 М HCl. С помощью градуированного цилиндра на 100 мл соберите ~ 25 мл 3,0 М HCl с переднего счетчика и поместите его в химический стакан. Будь осторожен! | |
Используя предоставленные весы, взвесьте правильное количество CuSO 4 , которое вы рассчитали в своем предварительном лабораторном задании. Обязательно используйте правильную технику взвешивания. | |
| Заполните мерную колбу примерно на 1/3 3,0 М HCl. Добавьте небольшое количество HCl в весы, содержащие CuSO 4 . Медленно влейте суспензию HCl/CuSO 4 в мерную колбу. Добавьте HCl к CuSO 4 в мерной колбе, пока объем не станет равным 25 мл, как указано белой линией на колбе. Дайте раствору вернуться к комнатной температуре. Убедитесь, что громкость по-прежнему правильная. При необходимости добавьте еще немного HCl. | |
| Часть II: Осаждение Cu 2+ Ионы в виде металлической меди | |
Соберите и взвесьте все перечисленные ниже предметы и запишите массу в тетради с точностью до 0,0001 г.
| |
| Поместите 25 мл раствора сульфата меди в боковую колбу и повторно взвесьте. Запишите массу в лабораторную тетрадь с точностью до 0,0001 г. | |
| Возьмите воздушный шар с передней стойки и поместите его на боковое плечо колбы для предварительного взвешивания. Используя резиновую ленту или парафильм, убедитесь, что баллон герметично прилегает к пистолету. | |
Возьмите стопор с передней стойки. Вы можете добавить парафильм в колбу перед установкой пробки, чтобы гарантировать хорошую герметизацию. | |
| Теперь вы готовы начать реакцию. Быстро поместите предварительно взвешенные кусочки металлического цинка в раствор и закройте пробкой. Вы должны увидеть, как сразу же образуются пузырьки. Это газообразный водород. | |
| Понаблюдайте за тем, как меняется внешний вид раствора по мере протекания реакции, отмечая изменения цвета. Убедитесь, что баллон остается на боковом отверстии колбы, так как повышенное давление газа может его оттолкнуть. | |
Когда реакция завершится (пузырьков больше не будет, а раствор станет прозрачным), вам нужно будет тщательно измерить баллон. г.
Мы рассчитаем массу газообразного водорода, используя следующее уравнение (это часть так называемого закона идеального газа). Предполагая, что температура газа приблизительно равна комнатной температуре, 298 К (или 25 o C) и что атмосферное давление составляет 1000 атмосфер, вы можете рассчитать массу газообразного водорода, подставив объем газообразного водорода в л в следующее уравнение: Масса выделившегося газа H 2 (в г) = 8,244 X 10 -2 x (объем в л) [ Напоминание: 1 см 3 = 1 мл = 0,001 л] | |
Теперь нам нужно измерить как металлы, так и раствор, оставшиеся в колбе. Сначала вам нужно будет удалить все металлические детали из раствора. Сделайте это с помощью щипцов/пинцета в вашем ящике. |

 Основные стадии процесса:
Основные стадии процесса: