что, как сбалансировать и часто задаваемые вопросы —
By Адити Рой
HCl — сильная кислота, и она реагирует с железными опилками с выделением газообразного вещества. Давайте рассмотрим различные важные факты о реакции между Fe и HCl.
Fe растворяется в соляной кислоте (HCl) и образует газообразный H2 и железо (FeCl2) хлорид. Fe — переходный металл, а HCl — сильная кислота. В этой реакции тепло выделяется на стороне продукта, так как это экзотермическая реакция. Выделяющийся газ горит со звуком, который доказывает, что это газообразный водород.
В этой статье подробно обсуждаются энтальпия, метод балансировки, тип, процедура титрования, ионное уравнение этой реакции между Fe и HCl.
Что является продуктом HCl и Fe?Когда железные наполнители (Fe) реагируют с соляной кислотой (HCl), водород заменяется из HCl на Fe и образует хлорид железа (FeCl2). Газообразный водород также выделялся из реакционной среды в виде пузырьков.
Газообразный водород также выделялся из реакционной среды в виде пузырьков.
Fe (т) + 2HCl (водн.) = FeCl2 (вод) + H2 (Г)
Какой тип реакции HCl + Fe?Реакция между HCl + Fe является примером экзотермической реакции (изменение энтальпии отрицательно). Это также считается окислительно-восстановительной реакцией и реакцией с одним замещением. Но это не реакция нейтрализации или кислотно-щелочная реакция.
Как сбалансировать HCl + Fe?Следующие шаги должны быть выполнены, чтобы сбалансировать любую химическую реакцию:
- Неуравновешенное химическое уравнение реакции должно быть написано первым со знаком правой стрелки. Fe (т) + HCl (водн.) → FeCl2 (вод) + H2 (Г)
- Определите число молей каждого из химических соединений на стороне реагента и продукта.
| Elements | Количество молей на стороне реагента | Количество родинок на стороне продукта |
| Fe | 1 | 1 |
| H | 1 | 2 |
| Cl | 1 | 2 |
- Чтобы сбалансировать обе стороны (реагент и продукт), мы должны умножить 2 на HCl, чтобы сбалансировать количество молей водорода и хлора, потому что числа молей остальных компонентов химические элементы уже уравновешены.

- Следовательно, сбалансированное уравнение будет – Fe (т) + 2HCl (водн.) = FeCl2 (вод) + H2 (грамм).
Компания титрование между HCl + Fe не может быть выполнено, потому что титрование проводится для определения концентрации аналита. Но в этом случае в качестве аналита используется один атом металла (Fe). Кроме того, это не кислотно-щелочная реакция.
HCl + Fe Суммарное ионное уравнениеСуммарное ионное уравнение химической реакции HCl + Fe имеет вид:
Fe(с) + 2H+ (водн.) + 2Cl– (водн.) = Fe2+ (водн.) + 2Cl– (вод) + H2 (Г)
Сопряженные пары HCL + FeМы не можем написать сопряженное парное уравнение химическая реакция HCl + Fe потому что это не кислотно-щелочная реакция. Мы можем написать только сопряженную пару HCl, которая представляет собой Cl–. FeCl2 или Fe не может принимать или отдавать H+ ионов. Следовательно, не существует сопряженной пары Fe или FeCl.2.
Мы можем написать только сопряженную пару HCl, которая представляет собой Cl–. FeCl2 или Fe не может принимать или отдавать H+ ионов. Следовательно, не существует сопряженной пары Fe или FeCl.2.
Компания межмолекулярные силы действуют на HCl и Fe:
- Будучи полярным ковалентным соединением, между HCl действуют диполь-дипольное взаимодействие, дисперсионные силы Лондона и водородные связи.
- Fe представляет собой один атом металла. Следовательно, в нем нет ни межмолекулярных, ни внутримолекулярных сил. В зависимости от природы соединений, образованных Fe, будут определяться межмолекулярные силы.
Компания энтальпия изменения химическая реакция HCl + Fe составляет -89.12 кДж/моль, и это получено из приведенного ниже математического расчета.
- Энтальпия стороны реагента составляет 0 кДж/моль (для Fe) и -167.15 кДж/моль (для HCl). Значения энтальпии продуктов составляют -423.42 (для FeCl2) и 0 (H2) кДж/моль.
- Изменение энтальпии = {Энтальпия (продуктов) – Энтальпия (реагентов)} = [-423.42 + 0 – {0 + 2× (-167.15)}] кДж/моль. = -89.12 кДж/моль.
HCl + Fe не может быть буферный раствор потому что буферный раствор готовят между слабой кислотой и сопряженным с ней основанием или слабым основанием и сопряженной с ним кислотой. В этой смеси HCl представляет собой сильную кислоту, а Fe представляет собой атом металла, который просто действует как восстановитель и окислитель соответственно.
Является ли HCl + Fe полной реакцией?HCl + Fe может быть полной реакцией только в том случае, если она записана с ожидаемыми продуктами этой реакции, которыми являются хлорид железа и газообразный водород.
Fe (т) + HCl (водн.) = FeCl2 (вод) + H2 (Г)
Реакция HCl + Fe экзотермическая или эндотермическая?HCl + Fe представляет собой экзотермическая реакция потому что изменение энтальпии в этой реакции является отрицательным, что составляет -89.12 кДж/моль, и тепло выделяется на стороне продукта. Это указывает на то, что продукты более стабильны, чем реагенты.
Является ли HCl + Fe окислительно-восстановительной реакцией?- HCl + Fe является примером окислительно-восстановительная реакция. В этой реакции Fe действует как восстановитель, а HCl действует как окислитель. Fe находится в 0 (Fe) и +2 (FeCl2) степень окисления на стороне реагента и продукта соответственно.
- Точно так же водород находится в +1 (HCl) и 0 (H2) степени окисления на стороне реагента и продукта соответственно.
- Следовательно, в этой реакции Fe восстанавливается, а водород окисляется.

HCl + Fe не является реакцией осаждения, так как в реакционной среде не образуются осадки. Хлорид железа (FeCl2) полностью растворим и H2 выделяется в виде пузырьков из реакционной среды.
Является ли реакция HCl + Fe обратимой или необратимой?- HCl + Fe не является примером обратимой реакции, потому что газ ( H2) получается на стороне продукта, а молекулы газа имеют большую величину энтропии, чем жидкость и твердое тело. Благодаря этому сторона продукта более стабильна, чем сторона реагента, и равновесие реакции смещается в сторону продукта в соответствии с Принцип Ле-Шателье.
- Реакция является экзотермической реакцией, что также указывает на выделение тепла на стороне продукта. Следовательно, продукты более стабильны, чем реагенты.
 и рассматривается как необратимая реакция.
и рассматривается как необратимая реакция.
HCl + Fe представляет собой реакция одиночного смещения потому что в этой реакции Fe вытесняет водород из HCl и образует хлорид железа ( FeCl2) и газообразный водород.
ЗаключениеСмесь Fe-HCl является очень важным реагентом для снятия защиты с оксимов и селективного окислительного гидролиза нитроалкана или нитроалкена до соответствующего кетона. Эта смесь также помогает уменьшить количество ароматических первичных аминов.
Стехиометрия — уровень AP
Стехиометрия — уровень APСтехиометрия — уровень AP
Задачи №11-25
Десять примеров
Проблемы №1-10
Задачи №26-50
Все примеры и проблемы (без решений)
Вернуться в меню стехиометрии
Задача №11: Гидроксиламмоний хлорид реагирует с хлоридом железа(III) FeCl 3 в растворе с образованием хлорида железа(II) HCl, H 2 O и соединения азота. Оказалось, что таким образом 2,00 г хлорида железа(III) реагировали с 31,0 мл 0,200 М хлорида гидроксиламмония. Предложите возможную формулу полученного соединения азота.
Оказалось, что таким образом 2,00 г хлорида железа(III) реагировали с 31,0 мл 0,200 М хлорида гидроксиламмония. Предложите возможную формулу полученного соединения азота.
Решение:
1) Определить количество молей хлорида гидроксиламмония (NH 3 OH + Cl¯) и хлорида железа(III):
(0,0310 л) (0,200 моль/л) = 0,0062 моль NH 3 OH + Cl¯2,00 г / 162,204 г/моль = 0,01233 моль FeCl
3 Ключевым моментом является то, что количество молей FeCl 3 в два раза больше, чем у хлорида гидроксиламмония.
2) Определить степень окисления N в хлориде гидроксиламмония:
Н = -1Решение об этом предоставляется читателю.
Кстати, мы знаем, что железо восстанавливается, поэтому азот ДОЛЖЕН окисляться.
3) Позвольте 0,0062 молям атомов азота перейти из степени окисления -1 в нулевую:
при этом высвобождается 0,0062 моль электронов, которые идут на восстановление 0,0062 моль ионов Fe 3+ (что составляет только половину доступных ионов)
4) Позвольте 0,0062 моль атомов N (из-за шага 3 чуть выше, теперь в нулевой степени окисления) перейти от нуля в степень окисления +1:
при этом высвобождается еще 0,0062 моль электронов, которые идут на восстановление 0,0062 моль ионов Fe 3+ (что составляет вторую половину доступных ионов)
5) Нам нужен азот в степени окисления +1 в нашем соединении:
Н 2 О
Задача № 12: Сколько ионов фосфата содержится в образце гидроксиапатита [Ca 5 (PO 4 ) 3 OH], содержащем 5,50 x 10 -3 грамма кислорода?
Решение:
1) Определите количество молей кислорода:
5,50 x 10 -3 г разделить на 16,00 г/моль = 3,4375 x 10 -4 моль
2) Определить количество молей гидроксиапатита:
молярное соотношение между гидроксиапатитом и кислородом составляет 1:13.3,4375 x 10 -4 моль разделить на 13 = 2,64423 x 10 -5 моль гидроксиапатита
3) Определить моль ионов фосфата:
молярное соотношение между гидроксиапатитом и фосфатом составляет 1:3(2,64423 x 10 -5 моль) (3) = 7,9326923 x 10 -5 моль ионов фосфата
4) Определить количество ионов:
(7,9326923 х 10 -5 моль) (6,022 х 10 23 моль¯ 1 ) = 4,78 х 10 19
Задача №13: Смесь, состоящая только из хлорида натрия (NaCl) и хлорида калия (KCl), весит 1,0000 г. Когда смесь растворяют в воде и добавляют избыток нитрата серебра, все ионы хлорида, связанные с исходной смесью, осаждаются в виде нерастворимого хлорида серебра (AgCl). Масса хлорида серебра равна 2,1476 г. Рассчитайте массовые проценты хлоридов натрия и хлоридов калия в исходной смеси.
Решение №1:
1) Настройте это уравнение:
(x) (граммы Cl из NaCl) + (1 − x) (граммы Cl из KCl) = общее количество хлоридов в граммахx = граммы NaCl в исходной смеси
1 − x = граммы KCl в исходной смесиграмм Cl из NaCl = 35,5/58,4
грамма Cl из KCl = 35,5/74,6
грамма общего количества хлорида = (2,1476 г) (35,5/143,3)Числа в знаменателях представляют собой молярные массы NaCl, KCl и AgCl.
Эти три соотношения называются «гравиметрическими факторами».
(х) (35,5/58,4) + (1 − х) (35,5/74,6) = (2,1476 г) (35,5/143,3)
2) Решить:
(x) (35,5/58,4) + (1 − x) (35,5/74,6) = (2,1476 г) (35,5/143,3)0,6079х + 0,4759 — 0,4759х = 0,532
0,132х = 0,0561
х = 0,425 г
Масса NaCl в исходной смеси. Это составляет 43% исходной смеси.
Решение №2:
1) Настройте это уравнение:
масса NaCl + масса KCl = 1,000 гx = граммы NaCl в исходной смеси
1 − x = граммы KCl в исходной смесиПоэтому:
(х) + (1 — х) = 1,000 г
2) Преобразуйте x и 1 − x следующим образом:
(x / 58,442 г/моль) (143,321 г/моль) = 2,452x((1 − x) / 74,551 г/моль) (143,321 г/моль) = 1,992(1 − x)
Комментарий: используя NaCl в качестве примера, преобразование делает следующее:
а) Сначала вычисляем количество молей NaCl.
b) Поскольку молярное соотношение NCl и AgCl составляет 1:1, это также количество молей полученного AgCl.
c) Умножьте на молярную массу AgCl, чтобы получить граммы AgCl, полученные из x граммов NaCl.
3) Напишите (затем решите) это уравнение:
2,452 х + 1,992 (1 — х) = 2,14762,452х + 1,922 — 1,922х = 2,1476
0,53х = 0,2256
х = 0,426 г
Решение №3:
Нарисуйте график теоретического выхода AgCl от одного грамма 100% KCl до одного грамма 100% NaCl с несколькими промежуточными смесями, чтобы продемонстрировать линейность (или нет), и интерполируйте свой ответ.
Комментарий: Было бы забавно когда-нибудь сделать это в электронной таблице.
Проблема № 14: Аммиак производится промышленным способом путем реакции:
N 2 + 3H 2 —> 2NH 3
При условии выхода 100%, какая масса аммиака будет получена из смеси с молярным соотношением 1:1 в реакторе объемом 8,75 x 10 3 л при общем давлении 2,75 x 10 7 Па при 455 °С.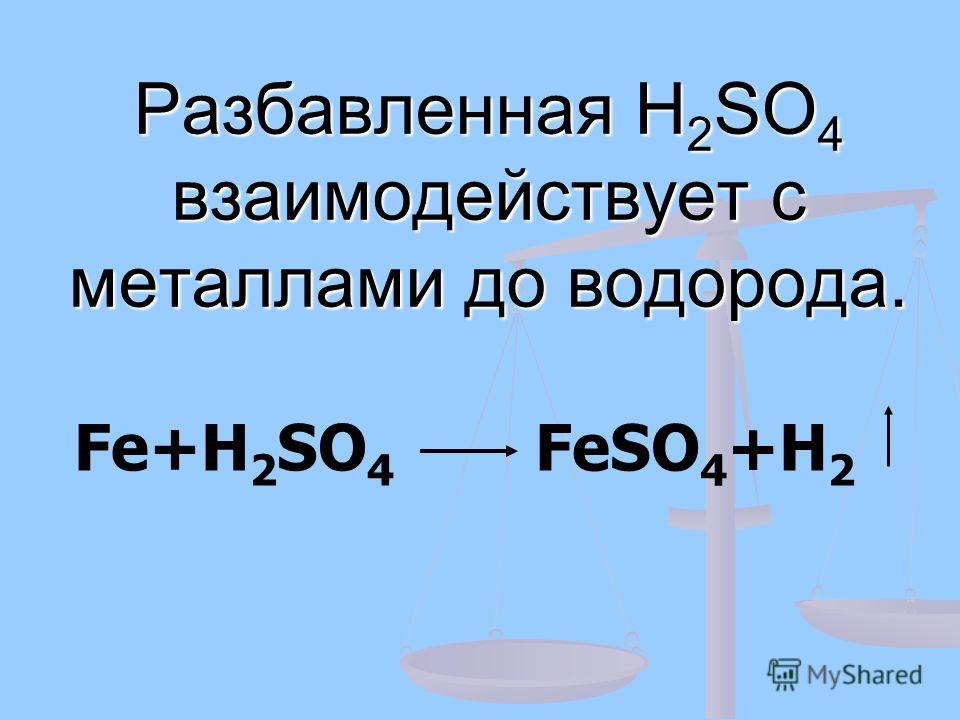
Решение:
1) Молярное соотношение 1:1 означает, что ограничивающим реагентом является водород. Это связано с тем, что для полной реакции всего азота требуется соотношение азота и водорода 1:3.
2) Определить начальное давление водорода:
2,75 x 10 7 Па = 2,75 x 10 4 кПа2,75 x 10 4 кПа / 101,325 кПа/атм = 271,404 атм
271,404 атм / 2 = 135,702 атм
Деление на два сделано потому, что водород составляет 50% реагирующей смеси.
3) Используйте PV = nRT:
(135,702 атм) (8,75 x 10 3 л) = (x) (0,08206) (728 К)х = 19876,111 моль водорода
4) Перевести в количество аммиака:
Молярное соотношение 3:2 для H 2 : NH 3моль NH 3 = (19876,111 x 2) / 3 = 13250,74 моль
13250,74 моль x 17,0307 г/моль = 225669,4 г = 2,26 x 10 5 г
Проблема №15: При нагревании образец весом 4,250 г теряет 0,314 г.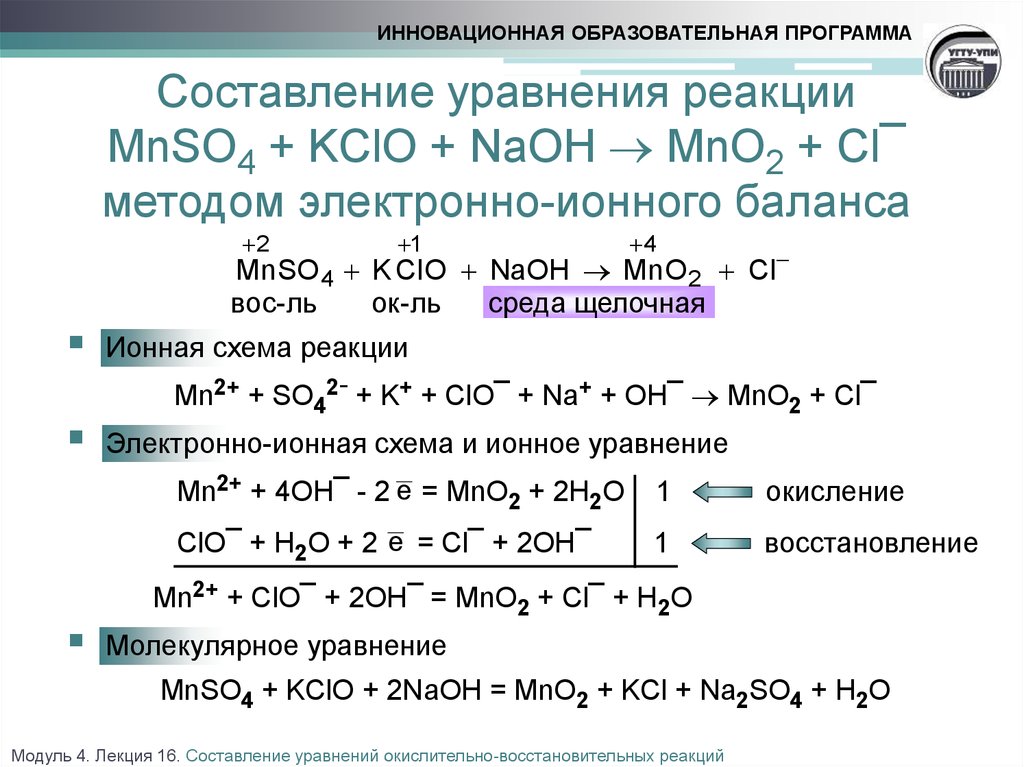
Решение:
1) При нагреве теряется только вода. Определить моль потерянной воды:
0,314 г / 18,015 г/моль = 0,01743 моль воды
2) Из формулы BaCl 2 · 2H 2 O мы знаем:
2 моля воды на один моль BaCl 2следовательно, 0,008715 моль BaCl 2
3) Определить граммы, а затем процентное содержание хлорида бария:
0,008715 моль x 244,2656 г/моль = 2,128775 г BaCl 2 · 2H 2 O2,128775 / 4,250 = 50,09%
Задача № 16: Образец массой 0,6118 г, содержащий только MgCl 2 и NaCl, был проанализирован путем добавления 145,0 мл 0,1006 М AgNO  Рассчитайте массу каждого компонента (MgCl 2 и NaCl) в исходном образце.
Рассчитайте массу каждого компонента (MgCl 2 и NaCl) в исходном образце.
Решение:
1) Используя гравиметрический коэффициент, определите количество иона хлорида, которое выпало в осадок:
(1,7272 г) (35,453 / 143,321) = 0,42725366 г
2) Определить относительную долю хлорида по MgCl 2 и NaCl:
для каждых трех Cl¯, реагирующих с Ag + :два из MgCl 2
один из NaClПоэтому:
доля хлорида магния составляет 2/3 Вклад
хлорида натрия составляет 1/3Обратите внимание, что этот вклад выражен в молях. Так . . . .
3) Преобразовать граммы хлорида в моли:
0,42725366 г / 35,453 г/моль = 0,01205127 моль
4) Определите количество молей NaCl в образце:
(0,01205127 моль) (1/3) = 0,00401709 моль
5) Определить граммы NaCl в образце:
(0,00401709 моль) (58,443 г/моль) = 0,23477 г 9инжир от 0005 до четырех знаков: 0,2348 г
Масса MgCl 2 может быть получена вычитанием.
Задача № 17: Нитрат аммония и хлорат калия выделяют газообразный кислород при разложении при нагревании. Не делая подробных расчетов, определите, какой из двух дает больший
(a) количество молей O 2 на моль твердого вещества и
(b) количество граммов O 2 на грамм твердого вещества.
Неуравновешенные уравнения:
NH 4NO 3 (s) —> N 2 (g) + O 2 (g) + H 2 O
KClO 3 (т) —> KCl(т) + O 2 (г)
Решение:
1) Сбалансируйте оба уравнения:
2NH 4 NO 3 (s) —> 2N 2 (g) + O 2 (g) + 4H 2 O
2KClO 3 (т) —> 2KCl(т) + 3O 2 (г)
2) Напишите молярные соотношения:
NH 4 NO 3 до O 2 2:1
KClO 3 до O 2 2:3
3) Пусть молярные отношения выражены в пересчете на один моль твердого вещества:
NH 4 NO 3 до O 2 составляет 1:0,5
KClO 3 до O 2 1:1,5
4) Ответ на (а):
В молях KClO 3 производит больше O 2 , чем NH 4 NO 3 .На самом деле, KClO 3 производит в три раза больше кислорода (сравните 1,5 с 0,5).
5) Преобразуйте моли каждого молярного соотношения в граммы:
NH 4 NO 3 до O 2 с 80.04 до 16.00
KClO 3 до O 2 от 122,55 до 48,0
6) Пусть граммовые отношения выражены в пересчете на один грамм вещества:
NH 4 NO 3 до O 2 от 1 до 0,20
KClO 3 до O 2 от 1 до 0,39
4) Ответ на (б):
В граммах KClO 3 производит кислород примерно в два раза быстрее (от 0,30 до 0,20), чем NH 4 NO 3 .
Задача №18: Элемент X образует как дихлорид (XCl 2 ), так и тетрахлорид (XCl 4 ). Вычислите атомную массу X и определите X.
Решение:
1) Напишите сбалансированное уравнение реакции:
XCl 2 + Cl 2 —> XCl 4
2) Определить граммы, а затем моли Cl 2 , которые реагируют:
12,55 г минус 10,00 г = 2,55 г2,55 г / 70,906 г/моль = 0,035963 моль
3) Определить количество молей XCl 2 в наличии:
Из-за молярного соотношения 1:1 между XCl 2 и Cl 2 количество молей XCl 2 равно 0,035963 моль
4) Определите молекулярную массу XCl 2 :
10,00 г / 0,035963 моль = 278,06 г/моль
5) Определите атомный вес и идентичность X:
278,06 г/моль минус 70,906 г/моль = 207,2 г/моль (округлить до 0,1 знака)X — это свинец.
Задача №19: К 4,267 г UF 6 добавляется вода. Единственными продуктами реакции являются 3,730 г твердого вещества, содержащего только уран, кислород и фтор, и 0,970 г газа. Газ на 95,0% состоит из фтора, а остальное — из водорода.
а) Какая часть фтора исходного вещества находится в твердом состоянии и какая часть в газе после реакции?
б) Какова формула твердого продукта?
Решение:
1) Расчет молей UF 6 присутствует:
4,267 г / 352,018 г/моль = 0,01212154 моль
2) Рассчитайте граммы фтора в UF 6 :
(0,01212154 моль) (113,988 г/моль) = 1,38171 г113.988 происходит от того факта, что 6 F находятся в UF 6
3) Рассчитайте массу фтора в газе
(0,970 г) (0,950) = 0,9215 г
4) Рассчитайте массу фтора в твердом состоянии:
1,38171 г − 0,9215 г = 0,46021 г
5) Рассчитайте процентное содержание фтора в твердом состоянии:
0,46021 г/ 1,38171 г = 33,307%
6) Рассчитайте процентное содержание фтора в газе:
100 % − 33,307 % = 66,693 %
Решение задачи б:
1) Рассчитайте массу прореагировавшего H 2 O:
(3,730 г + 0,970 г) − 4,267 г = 0,433 г
2) Рассчитайте массу кислорода в твердом продукте:
(0,433 г/18,015 г/моль)(15,999 г/моль) = 0,38454438 г
3) Рассчитайте массу урана в твердом продукте:
3,730 г — (0,38454438 г + 0,46021 г) = 2,88524562 г
4) Рассчитайте количество молей U, F и O в твердом продукте:
U: 2,88524562 г / 238,029г/моль = 0,01212 мольF: 0,4604 г/18,998 г/моль = 0,02423 моль
O: 0,38454438 г/15,999 г/моль = 0,02403 моль
5) Чтобы более четко увидеть соотношение 1:2:2, просто разделите на наименьшее число:
U: 0,01212/0,01212 = 1
F: 0,02423/0,01212 = 1,999
О: 0,02403/0,01212 = 1,98
Формула неизвестного UF 2 O 2 и общая реакция:
UF 6 + 2H 2 O —> UF 2 O 2 + 4HF
Задача № 20: Соединение, содержащее титан и хлор, анализируется путем превращения всего титана в 1,20 г диоксида титана и всего хлора в 6,45 г AgCl. Какова простейшая (эмпирическая) формула исходного соединения?
Какова простейшая (эмпирическая) формула исходного соединения?
Решение:
Кстати, обратите внимание на использование миллимолей, а не молей. Помните, что 1 моль равен 1000 ммоль.
1) Такая реакция происходит:
Ti x Cl y —-> x TiO 2 + y AgCl
2) Определите количество молей TiO 2 образовавшихся:
1,20 г / 79,90 г моль¯ 1 = 15,02 ммоль
3) Определить количество молей образовавшегося AgCl:
6,45 г / 143,32 г моль¯ 1 = 45,00 ммоль
4) Определить миллимоли Ti и Cl в исходном соединении:
молярное соотношение Ti : TiO 2 составляет 1:1, поэтому 15,02 ммоль Ti
Молярное соотношение Cl : AgCl составляет 1:1, поэтому 45,00 ммоль Cl
5) Молярное отношение Ti к Cl в соединении составляет 15:45 или 1:3. Следовательно:
формула соединения TiCl 3
Задача №21: Неизвестный элемент X обнаружен в двух соединениях: XCl 2 и XBr 2 . В следующей реакции:
В следующей реакции:
XBr 2 + Cl 2 —> XCl 2 + Br 2
при использовании 1,5000 г XBr 2 образуется 0,8897 г XCl 2 . Определите элемент X.
Решение:
моль XBr 2 = моль XCl 21,500 / (x + 159,808) = 0,8897 / (x + 70,906)
(0,8897) (х + 159,808) = (1,500) (х + 70,906)
0,8897x + 142,1811776 = 1,5x + 106,359
0,6103x = 35,8221776
х = 58,70
Элемент X представляет собой Ni.
Кстати, будьте осторожны. Взгляните на Co, и вы увидите 58,93 и думаете, что это достаточно близко. Никель 58,69. Пара Co/Ni является одной из трех, атомный вес которых уменьшается по мере перехода от элемента к элементу. Ar/K и Te/I — два других.
Задача № 22: Когда подача кислорода ограничена, металлическое железо реагирует с кислородом с образованием смеси FeO и Fe 2 O 3 . В одном эксперименте 20,00 г металлического железа реагировали с 11,20 г газообразного кислорода. После эксперимента железо было полностью израсходовано и осталось 3,24 г газообразного кислорода. Рассчитайте количество FeO и Fe 2 O 3 , образовавшихся в этом опыте.
В одном эксперименте 20,00 г металлического железа реагировали с 11,20 г газообразного кислорода. После эксперимента железо было полностью израсходовано и осталось 3,24 г газообразного кислорода. Рассчитайте количество FeO и Fe 2 O 3 , образовавшихся в этом опыте.
Решение:
1) Определить количество молей O 2 который отреагировал:
11,20 г — 3,24 г = 7,96 г7,96 г / 31,99886 г/моль = 0,248759 моль
2) Одновременно протекают две независимые реакции:
2Fe + O 2 —> 2FeO
4Fe + 3O 2 —> 2Fe 2 O 3Кстати, у вас может возникнуть соблазн написать одно уравнение:
3Fe + 2O 2 —> FeO + Fe 2 O 3
Это было бы неверно, поскольку оно маскирует тот факт, что молярные отношения двух кислорода к оксиду железа различны. Поскольку соотношения разные, расчет для FeO и Fe 2 O 3 должен быть отдельным.
3) Пусть z – массовая доля железа, из которого образовался FeO. Тогда 1-z представляет собой массовую долю Fe, которая произвела Fe 2 O 3 Определите количество потребленного кислорода, поскольку (a) часть Fe превращается в FeO и (b) часть Fe превращается в Fe 2 O 3 :
(а) расчет FeO:
1 моль Fe 1 моль О 2 (20,00 г Fe) (z) х –––––––––– х ––––––– = 0,179067z (моль O 2 израсходовано на производство FeO) 55,8450 г Fe 2 моль Fe (б) Fe 2 O 3 расчет
1 моль Fe 3 моль О 2 (20,00 г Fe) (1-z) х –––––––––– х ––––––– = (0,268601 − 0,268601z) (моль O 2 израсходовано на производство Fe 2 O 3 ) 55,8450 г Fe 4 моль Fe Обратите внимание, что количество потребленного кислорода выражается в виде (неизвестной) массовой доли «z».
Следующий шаг определит значение z.
4) Добавьте два потребленных количества O 2 и установите их равными общему количеству молей прореагировавшего O 2 . Решите для ‘z’:
(0,179067z) + (0,268601 — 0,268601z) = 0,248759-0,089534z = -0,019842
г = 0,221614
5) Определите (a) количество произведенного FeO и (b) количество произведенного Fe 2 O 3 :
(а) расчет FeO:
1 моль Fe 2 моль FeO 71,8444 г Fe (20,00 г Fe) (0,221614) х –––––––––– х ––––––––– х ––––––––––– = произведено 5,702 г FeO 55,8450 г Fe 2 моль Fe 1 моль Fe (b) Fe 2 O 3 Расчет:
1 моль Fe 2 моль Fe 2 O 3 159,6882 г Fe 2 O 3 (20,00 г Fe) (0,778386) х –––––––––– х ––––––––– х ––––––––––– = 22,258 г Fe 2 O 3 произведено 55,8450 г Fe 4 моль Fe 1 моль Fe
6) Посмотрим, работает ли закон сохранения массы:
20,00 г + 11,2 г — 3,24 г = 27,96 г
22,258 г + 5,702 г = 27,96 гУра!
7) Вот неверное решение этой проблемы.
Задача №23: Лист железа площадью 525 см 2 покрыт слоем ржавчины, средняя толщина которого составляет 0,0021 см. Какой минимальный объем раствора HCl, мл, плотностью 1,07 г/мл и состоящего из 14 % HCl по массе, требуется для очистки поверхности металла путем взаимодействия с ржавчиной? Предположим, что ржавчина представляет собой Fe 2 O 3 (s), имеет плотность 5,2 г/см 3 и что реакция следующая:
Fe 2 O 3 (тв) + 6HCl(водн.) —> 2FeCl 3 (водн.) + 3H 2 O(л)
Решение:
1) Объем ржавчины:
525 см 2 x 0,0021 см = 1,1025 см 3
2) Масса ржавчины:
1,1025 см 3 x 5,2 г/см 3 = 5,733 г
3) Родинки ржавчины:
5,733 г / 159,687 г/моль = 0,035
моль
4) Необходимые моли HCl:
Из сбалансированного уравнения Fe 2 O 3 молярное соотношение к HCl 1:61 к 6 как 0,035
моль к хх = 0,21540888 моль
5) Необходимая масса HCl:
0,21540888 моль x 36,4609 г/моль = 7,854 г
6) Требуемая масса 14% раствора:
14 соответствует 100, как 7,854 соответствует хх = 56,1 г
7) Необходимый объем раствора:
56,1 г / 1,07 г/мл = 52,43 мл
Комментарий: есть такие учителя, которые настаивают на том, чтобы задачу, подобную приведенной выше, записывать в «стиле размерного анализа». Это означает объединить все вычисления в одну строку. Вот это делается двумя разными способами:
Это означает объединить все вычисления в одну строку. Вот это делается двумя разными способами:
(525 см 2 x 0,0021 см) (5,2 г/см 3 ) (1 моль / 159,687 г) (6 моль HCl / 1 моль Fe 2 O 3 ) (36,46 моль ) (100/14) (1 мл/1,07 г)
5,2 г 1 моль 6 36,4609 г 100 1 мл (525 см 2 x 0,0021 см) ––––– х –––––– х –––– х ––––––––– х –––– х ––––– = 52,43 мл 1 см 3 159,687 г 1 1 моль 14 1,07 г
Убедитесь, что 159. 687 используется в подразделении. Также обратите внимание на 100/14. Вы должны умножить на 100, затем разделить на 14, прежде чем двигаться дальше.
687 используется в подразделении. Также обратите внимание на 100/14. Вы должны умножить на 100, затем разделить на 14, прежде чем двигаться дальше.
Есть те, кто настаивает на том, что стиль DA более четкий, что делает его более педагогически обоснованным для преподавания. ChemTeam не входит в эту группу.
Задача № 24: Образец 1,42 г чистого соединения формулы M 2 SO 4 растворяли в воде и обрабатывали избытком водного раствора хлорида кальция, что приводило к осаждению всех сульфат-ионы в виде сульфата кальция. Осадок собирают, сушат, его масса составляет 1,36 г. Определите атомную массу M. Какой это элемент?
Решение:
Заряд -2 сульфат-иона игнорируется.
1) Моли осажденного сульфата:
(1,36 г CASO 4 ) / (136,1406 G CASO 4 / моль) x (1 моль СОС 4 /1 Мол CASO 4 ) = 0,0099897 моль, 4(1,36 G CASO 7 моль 4
(1,36 G CASO 7 моль.
4 ) / (136,1406 г CaSO 4 /моль) —> переводит граммы в моли
(1 моль SO 4 / 1 моль CaSO 4 ) —> на каждый моль полученного сульфата кальция использовался один моль сульфат-иона
2) Моли M 2 SO 4 содержащие такое количество молей сульфата:
(0,0099897 моль SO 4 ) x (1 моль M 2 SO 4 / 1 моль SO 4 ) = 0,0099897 моль M19 219 23) Молярная масса M 2 SO 4 :
1,42 г / 0,0099897 моль = 142,1 г/моль4) Молярная масса М:
SO 4 = 96,0626 г/моль142,1 г/моль М 2 SO 4 − 96,0626 г/моль SO 4 = 46,0 г/моль M 2
(46,0 г/моль M 2 ) / 2 = 23,0 г/моль M
натрий.
Задача №25: Рассчитайте изменение объема при окислении железа до Fe 2 O 3 (d = 5,24 г/см 3 ).
Плотность Fe 7,787 г/см 3 .
Решение:
1) Напишите сбалансированное химическое уравнение реакции:
2Fe + 3 / 2 O 2 —> Fe 2 O 3молярное соотношение 2:1. Если бы я уравновешивал уравнение целыми числами, соотношение, которое я использовал бы, было бы 4:2. Это не повлияет на ответ, мой балансирующий выбор был чисто стилистическим.
2) Начнем с 7,787 г (это 1,00 см 3 железа). Преобразуйте его в моли:
7,787 г / 55,845 г/моль = 0,13944 моль3) Используйте молярное соотношение 2:1:
2 0,13944 моль ––– = –––––––––– 1 х x = 0,06972 моль (из Fe 2 O 3 произведено)
4) Преобразовать моли Fe 2 O 3 в граммы:
(0,06972 моль) (1590,687 г/моль) = 11,1334 г5) Преобразование в см 3 :
11,1334 г / 5,24 г/см 3 = 2,12 см 3Объем изменяется с 1,00 см 3 на 2,12 см 3 .
Десять примеров
Проблемы №1-10
Задачи №26-50
Все примеры и проблемы (без решений)
Вернуться в меню стехиометрии
Без названия
Без названия
Эксперимент 19: Ле Принцип Штелье:
Напряжения, приложенные к равновесным системам
Обзор
В этом эксперименте вы исследовали Принцип применительно к шести равновесным системам. Принцип Ле Штелье гласит, что при изменении система это уже находится в равновесии , система реагирует на таким образом, что вернуть в равновесие. Для система химических реакций, когда система «реагирует так, чтобы вернуться к равновесия», это означает, что система будет реагировать либо в прямом направлении , либо в направлении (чтобы произвести дополнительный продукт) или в обратном направлении (чтобы потреблять некоторое количество продукта).
Принцип Ле Ле Штелье очень важен в химическом и химическом машиностроении. отрасли. Целью в этих отраслях является получение как можно большего количества продукта (что может быть затем проданы) для заданного количества исходных материалов. Химики и инженеры-химики при разработке новых процессов широко используется принцип Ле Ле Штелье при разработке их системы
Результаты, пояснения и обсуждение
Поскольку это был «качественный» эксперимент, очевидно, расчеты для вашего отчета..
Вместо этого давайте попробуем понять каждый шаг процедуры (что вы сделали и наблюдалось в лаборатории) и попытайтесь связать это с принципом Ле Штелье. Иногда при длительном процедуры, студентам было трудно понять, где именно Ле Ле Штелье Принцип вступает в дискуссию в некоторых реакциях. Вы должны были подготовить оба ваши страницы данных (страницы 157-161), а также страницы процедур (страницы 149-155) для этого.
Будьте осторожны! В вашем отчете вас просят рассказать, что такое стресс была применена к равновесной реакции. Ударение , а не добавленное вами химическое вещество, вызвавшее изменение. Стресс может только быть изменением концентрации одного из видов, что записано в уравнение равновесной реакции. Так, например, если вы добавите в систему HCl, и это вызывает изменение, стресс равен вместо «добавление HCl»: стресс следует интерпретировать с точки зрения видов компонентов только равновесие.
A. Хроматно-дихроматное равновесие
стр. 149-150 и стр. 157.
Равновесие между хромат-ионом (CrO 4 2-) и дихромат-ионом (Cr 2 O 7 2-). Указание, по какому пути реакция сдвигов при внесении изменений в систему основана на цвет из них два иона в растворе: ион хромата яркий желтый в растворе, тогда как ион дихромата яркий оранжевый .
Итак, если раствор стал оранжевым, когда вы что-то добавили в него, равновесие сместилось вправо; если раствор стал желтым, равновесие было смещено влево.
CrO 4 2- (желтый) + 2H + = Cr 2 O 7 2- (оранжевый) + H 2 O
- На этапе A1 на стр. 150 вы добавили серную кислоту (H 2 SO 4 ) в образец хромата калия, K 2 CrO 4 . Что случилось с цветом K 2 CrO 4 когда вы это сделали? (см. ваше наблюдение на стр. 157). Судя по увиденному вами изменению цвета, в какую сторону сместилось равновесие, вправо или влево? Серная кислота является источником H + : любой источник H + имел бы вызвало такой же сдвиг в этом равновесии. «Стресс» применяется к система не добавление серной кислоты! «стресс» должен объясняться только с точки зрения вида присутствует в уравнении равновесной реакции: серная кислота является источником водорода ионов и увеличение концентрации ионов водорода , что приводит к смещению равновесия.
- Это пример того, как учащимся трудно интерпретировать то, что они сделали, и как на равновесие влияет то, что было сделано с системой. Во-первых, это NaOH. ясно, что , а не один из видов, участвующих в описанном выше равновесии. Тем не менее, когда вы добавили несколько капель NaOH в смесь из шага A1, вы должны были увидеть изменения. Хотя NaOH не является частью равновесия над собой, NaOH реагирует с одним из компоненты равновесия, эффективно удаляя этот вид из равновесия. NaOH представляет собой сильное основание и реагирует с кислотами : NaOH реагирует с водородом ион в равновесной системе и удаляет его. Если H + удалены из равновесной системы, система должна будет реагировать в том направлении, которое заменяет некоторые из H + для восстановления равновесия. Это согласуется с изменением цвета, которое вы наблюдаемый?
H + (из равновесия) + OH — (из NaOH) H 2 О
Изменение в системе произошло при добавлении NaOH, но «напряжение» в системе должно быть описано с помощью уравнения для равновесия
CrO 4 2- (желтый) + 2H + = Cr 2 O 7 2- (оранжевый) + H 2 O
Итак, поскольку NaOH эффективно удаляет ион водорода из системе путем преобразования ее в воду, «стресс» от с точки зрения равновесия будет уменьшение иона водорода концентрация.

B. Равновесие железо(III)-тиоцианат
стр. 150-151 и стр. 158
Как вы видели в предыдущем эксперименте, ион Fe 3+ и SCN — реагируют друг с другом с образованием красного комплексного иона [FeSCN] 2+ . В предыдущем Эксперимент, вы использовали очень разбавленные (0,00200 M ) растворы Fe 3+ и SCN — поэтому цвет продукта был бледно-красновато-оранжевым. В этом эксперименте вы используете гораздо более концентрированные растворы (0,1 M ), поэтому раствор продукта темно-красный. (почти цвет крови).
Fe 3+ (бесцветный) + SCN — (бесцветный) = [FeSCN] 2+ (кроваво-красный)
В этой системе мы можем сказать, в каком направлении смещается равновесие при изменении сделано путем мониторинга интенсивности цвета системы. Если система становится темнее красного цвета, то равновесие должно сместиться вправо (в сторону производства большего количества цветной продукт).
Если цвет системы становится тусклее (или вообще исчезает), равновесие должно смещаться влево (в сторону бесцветных компонентов). Тебе должно было быть очень наблюдателен в этой части, чтобы увидеть изменения в интенсивность красного цвета при добавлении капли реагента: если вы слишком ждали долго, локализованное изменение цвета, когда капля входит в равновесие реакция угаснет.
- Этот шаг процедуры просто установка системы равновесия: вы смешали немного Fe(NO 3 ) 3 и немного KSCN для создания системы в уравнении выше. Ионные реакции протекают очень быстро, и система приходит в равновесие в течение нескольких секунд. секунд, о чем свидетельствовало появление темно-красного цвета. Так как этот цвет настолько глубоко, что вам сказали разделить смесь на несколько лунок и добавить в нее воды пока он не будет разбавлен настолько, что вы сможете увидеть изменения цвета в система.
- На этом этапе вы добавили дополнительное количество Fe(NO 3 ) 3 по каплям в один из лунки с окрашенной равновесной смесью. Если было добавлено дополнительное Fe 3+ системе , которая уже находилась в равновесии , это было бы слишком Fe 3+ присутствует в системе. Система должна была бы реагировать (либо налево, или вправо), чтобы удалить часть дополнительного Fe 3+ из смеси. В в каком направлении будет реагировать система на удаление Fe 3+ ? Если система отреагировала на удалить избыток Fe 3+ , будет ли чистый результат более или менее окрашенным продукт? Основываясь на ваших наблюдениях (стр. 158) относительно того, стала ли смесь темнее или легче, когда было добавлено дополнительное Fe 3+ , как изменилось равновесие сдвиг? Соответствовало ли ваше наблюдение за цветом идее о том, что система должна будет удалить часть дополнительного Fe 3+ ? Вы должны понимать, что изменение система была бы взята с первой каплей дополнительной Fe 3+ добавлено: если бы вы не были наблюдательны, вы могли бы пропустить изменение цвета!
- На этом этапе вы по каплям добавили дополнительный KSCN в одну из лунок, содержащих окрашенная равновесная смесь.
Если в систему были добавлены дополнительные SCN — , которые уже был в равновесии , это было бы слишком много SCN — присутствует в системе. Система должна была бы отреагировать на удаление некоторых дополнительных SCN — . из системы. Основываясь на этом обсуждении и ваших наблюдениях за системой со страницы 158, в какую сторону сместилось равновесие: вправо (больше продукта, больше цвета) или влево (меньше продукта, меньше цвета).
- Вот ситуация, похожая на описанную выше в разделе A2: NaOH равен 9.1508, а не часть равновесной реакции. Однако процедура (стр. 151) имеет обратите внимание, напоминая вам, что Fe(OH) 3 нерастворим в воде . Если Fe(OH) 3 нерастворим в воде, то добавление NaOH к равновесной системе должно вызвать реакция ниже: при добавлении NaOH осаждается Fe 3+ в виде Fe(OH) 3 из равновесной системы.
Если Fe 3+ удалено от равновесия системы, то система перестанет находиться в равновесии и должна будет реагировать в направление, которое восстанавливает некоторые Fe 3+ . На основании ваших наблюдений (стр. 158) и этого обсуждения, в какую сторону сместится равновесие, если Fe 3+ будет удалено из система? Увеличится или уменьшится количество окрашенного комплекса?
Fe 3+ (из равновесия) + 3OH — (из NaOH) Fe(ОН) 3 (твердый осадок)
C. Равновесие кобальт(II)-хлорид-ион
Мы пропустили эту часть эксперимента!
D. Равновесие в насыщенном растворе NaCl
стр. 152 и стр. 159
В частях A и B выше мы рассмотрели равновесные системы, основанные на истинном химическом анализе. реакции. В этой части мы рассматриваем физическое равновесие на основе растворимость.
Когда кристаллическое ионное твердое вещество растворяется в воде, твердые частицы попадают в растворитель для получения раствора. Но это происходит только до определенного момента. Так как концентрация ионов в растворе увеличивается, вероятность того, что ионы будут притягиваться оставшимися ионов в кристалле увеличивается, и ионы, которые были растворены, начинают вновь поступать в кристаллы твердого тела. В конце концов, скорость, с которой ионы снова входят в кристаллы, становится равной скорости, с которой ионы покидают кристаллы, а «стационарное состояние» учредил. Как только это стационарное состояние достигнуто, чистые концентрации ионов в раствор больше не увеличивается, и говорят, что раствор «насыщен». С у нас есть два противоположных процесса, протекающих с одинаковой скоростью, существует равновесие между нерастворенное растворенное вещество и насыщенный раствор.
Na + (в растворе) + Cl — (в растворе) = NaCl (нерастворенное твердое вещество)
- Это всего лишь подготовка 24-луночного планшета для последующих тестов.
Возможно, вы заметили что на дне бутылки с насыщенным раствором NaCl было несколько кристаллов, как Вы взяли свои образцы. Это должно было гарантировать, что раствор будет насыщен NaCl. когда вы взяли некоторые. Насыщенный NaCl содержит Na + и Cl — ионов каждый при концентрация 5,4 М (моль/л).
- На этом этапе вы добавили несколько капель концентрированной соляной кислоты (HCl) в один из ваши насыщенные образцы NaCl. Концентрированная HCl содержит H + и Cl — . ионов каждый в концентрации 12,0 моль/л. Другими словами, когда вы добавили концентрированный HCl к насыщенному раствору NaCl вы добавляли большое количество иона хлорида, Cl — , к решению. Равновесие растворимости должно было сместиться в направлении, которое удалит часть избыточного иона хлорида из раствора. Что Вы заметили (стр. 159) в своем растворе, что указывало на то, что избыток ионов хлора был удалить из решения?
- В этой части эксперимента вы добавили 3 M HCl во второй образец насыщенного NaCl.
Обратите внимание, что 3 M HCl содержит ион Cl — при ниже концентрации, чем в насыщенном растворе NaCl (5,4 M ), в который вы его добавили. Когда вы добавили 3 M HCl к насыщенному раствору NaCl, вы, вероятно, , а не наблюдали какие-либо изменения (стр. 159). Добавление 3 M HCl к насыщенному раствору хлорида натрия фактически снижает концентрацию хлорид-иона в растворе.
E. Равновесие насыщенного хромата бария
Это еще один пример равновесия растворимости с небольшим «изюминкой». появится на шаге 2.
Ba 2+ (в растворе) + CrO 4 2- (в растворе) решение; желтый) = BaCrO 4 (желтое твердое вещество)
- На этом этапе вы просто создаете равновесие, смешивая BaCl 2 и K 2 CrO 4 решения. Должно выпасть желтое твердое вещество с прозрачным желтым раствором над ним.
Прозрачный желтый раствор представляет собой насыщенный раствор BaCrO 4 (см. ваши наблюдения на странице 159).
- На этом этапе вы добавили несколько капель концентрированной соляной кислоты HCl в смесь, приготовленная на шаге 1. Что произошло с осадком BaCrO 4 (см. ваши наблюдения на странице 159), полученные на шаге 1, когда вы это сделали? На странице 159, Вы задал вопрос о том, почему HCl влияет на равновесие BaCrO 4 , хотя HCl не появляется как часть равновесной реакции выше для BaCrO 4 . Оглядываться в части A этого эксперимента и посмотрите, сможете ли вы понять, почему кислота , такая как HCl, влияет на равновесие BaCrO 4 . Что делает добавление кислоты к CrO 4 2- ион в растворе, и как это повлияет на BaCrO 4 равновесие?
F. Равновесие насыщенного гидроксида железа
В этой части вы действительно изучаете два равновесия с участием иона Fe 3+ и гидроксид-ион, ОН —.
Fe 3+ (в растворе) + 3OH — (в растворе) = Fe(OH) 3 (красноватый осадок)
и
Fe 3+ (в растворе) + 4OH — (в растворе) = Fe(OH) 4 — (в растворе)
, что также можно записать как
.Fe(OH) 3 (красноватое твердое вещество) + OH — (в растворе) = Fe(OH) 4 — (в растворе)
- На этом шаге вы просто создаете первое равновесие, описанное выше. Когда ты при добавлении раствора гидроксида натрия к раствору нитрата железа(III) выпадает красноватый осадок Fe(ОН) 3 формы (см. ваши наблюдения на стр. 160).
- Когда вы добавляете HCl (сильную кислоту) в смесь из шага 1, кислота реагирует с гидроксид-ион по реакции
H + + OH — H 2 O.
- Как указано во введении к Части F, кислота эффективно удаляет OH – из равновесная система. Что произошло с осадком из шага 1, когда вы добавили HCl (см. ваши наблюдения на стр. 160) и как это согласуется с равновесием?
3. В этой части вы добавляете дополнительных NaOH во вторую лунку, содержащую Fe(OH) 3 вы получили на шаге 1. Добавление дополнительного количества NaOH приводит к второму равновесию. Как ваши наблюдения о том, что произошло с осадком Fe(OH) 3 при добавлении дополнительного NaOH в соответствии со второй (и третьей) реакциями выше?
G. Равновесие аммиака в воде
Мы пропустили эту часть эксперимента!
H. Равновесие насыщенного AgCl
В этой части вы изучаете два связанных равновесия с участием хлорида серебра. У вас будет обратить пристальное внимание в последующем обсуждении, чтобы сохранить прямое равновесие мы говорим о, так как процедура весьма вовлечена.
При объединении иона серебра (Ag + ) и иона хлорида (Cl — ) образуется образуется осадок хлорида серебра, а над температурой остается насыщенный раствор AgCl. твердый. Ионы серебра и ионы хлора, оставшиеся в растворе, находятся в равновесии с осадок
AgCl (твердый) = Ag + (в растворе) + Cl — (в решение)
Обратите внимание, что это равновесие растворимости было записано в противоположном смысле. равновесия растворимости в частях D и E выше: это не имеет большого значения, поскольку равновесная реакция «идет в обе стороны». Просто держите прямо, что ваш объяснения должны быть в терминах того, как уравнение реакции дается в этой части.
Ион серебра также образует равновесие с аммиаком
Ag + (в растворе) + 2NH 3 (в растворе) = Ag(NH 3 ) 2 + (в растворе)
- На этом шаге вы просто создаете первое вышеприведенное равновесие (растворимость равновесие для AgCl).
Когда вы добавляли HCl (концентрированный раствор ионов Cl — ) к AgNO 3 образовался белый осадок AgCl. Раствор над осадком представлял собой насыщенный раствор Ag + и ионы Cl — .
- На этом шаге вы удаляете большую часть насыщенного раствора из осадок на шаге 1. Однако помните, что осадок на шаге 1 все еще влажный. насыщенный раствор AgCl после удаления из него основной массы жидкости. Решение, которое вы удалить – насыщенный раствор AgCl. Смесь, оставшаяся в лунке с шага 1, твердая. AgCl все еще находится в равновесии с оставшимся покрытием из насыщенного раствора AgCl.
- На этом шаге вы играете с и из равновесий выше. Когда вы добавляете доп. AgNO 3 жидкости, удаленной на шаге 2, это увеличение концентрация иона Ag + . В каком направлении будет первое равновесие выше сдвиг при добавлении дополнительных ионов Ag + ? Как это отражается на вашем наблюдение на странице 161? Какой осадок образовался при добавлении AgNO 3 жидкости из шага 2? Затем вы добавили в смесь концентрированный аммиак.



 и рассматривается как необратимая реакция.
и рассматривается как необратимая реакция.
 Эти три соотношения называются «гравиметрическими факторами».
Эти три соотношения называются «гравиметрическими факторами».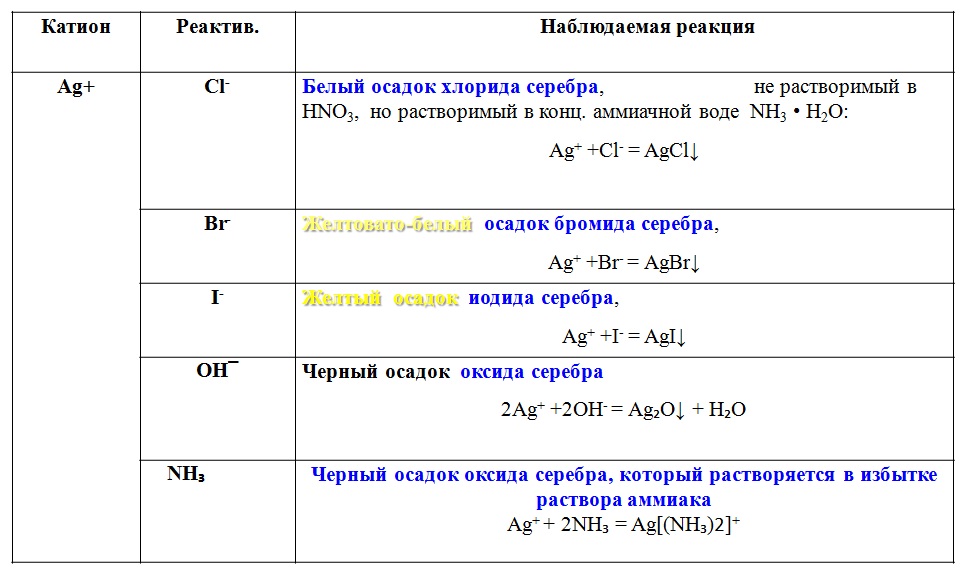
 На самом деле, KClO 3 производит в три раза больше кислорода (сравните 1,5 с 0,5).
На самом деле, KClO 3 производит в три раза больше кислорода (сравните 1,5 с 0,5).

 Следующий шаг определит значение z.
Следующий шаг определит значение z. 4 ) / (136,1406 г CaSO 4 /моль) —> переводит граммы в моли
4 ) / (136,1406 г CaSO 4 /моль) —> переводит граммы в моли  Плотность Fe 7,787 г/см 3 .
Плотность Fe 7,787 г/см 3 .


 Итак, если раствор стал оранжевым, когда вы что-то добавили в него,
равновесие сместилось вправо; если раствор стал желтым, равновесие было
смещено влево.
Итак, если раствор стал оранжевым, когда вы что-то добавили в него,
равновесие сместилось вправо; если раствор стал желтым, равновесие было
смещено влево.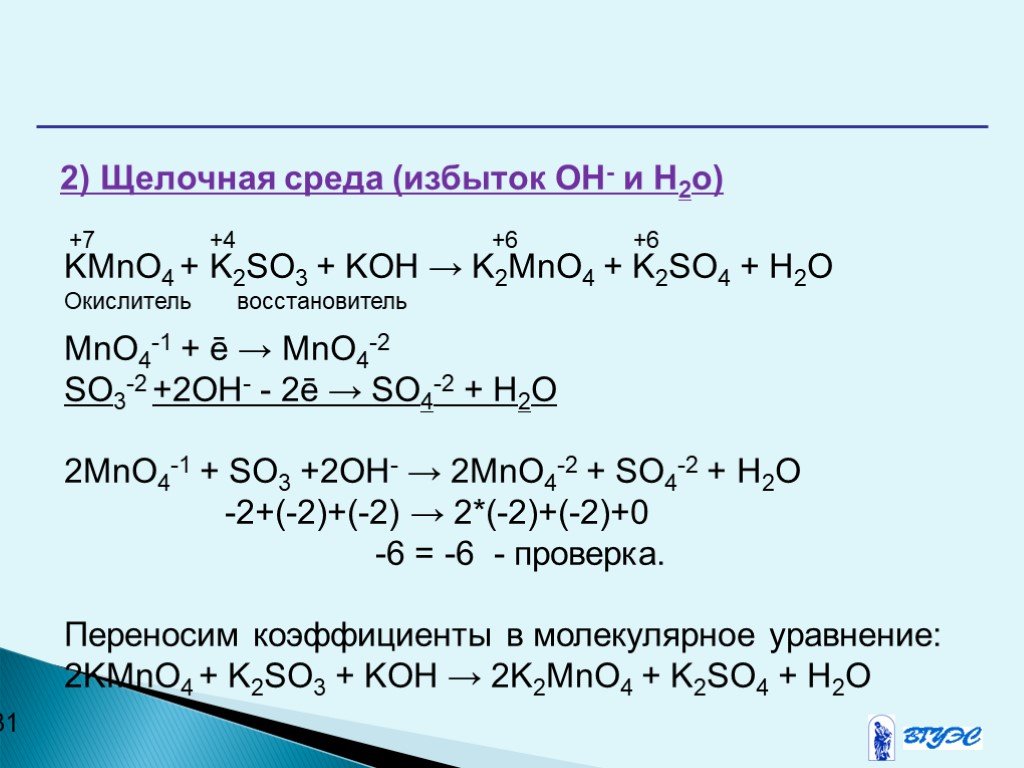

 Если цвет системы становится тусклее (или вообще исчезает),
равновесие должно смещаться влево (в сторону бесцветных компонентов).
Тебе должно было быть очень наблюдателен в этой части, чтобы увидеть изменения в
интенсивность красного цвета при добавлении капли реагента: если вы слишком ждали
долго, локализованное изменение цвета, когда капля входит в равновесие
реакция угаснет.
Если цвет системы становится тусклее (или вообще исчезает),
равновесие должно смещаться влево (в сторону бесцветных компонентов).
Тебе должно было быть очень наблюдателен в этой части, чтобы увидеть изменения в
интенсивность красного цвета при добавлении капли реагента: если вы слишком ждали
долго, локализованное изменение цвета, когда капля входит в равновесие
реакция угаснет.
 Если в систему были добавлены дополнительные SCN — , которые
уже был в равновесии , это было бы слишком много SCN — присутствует в системе. Система должна была бы отреагировать на удаление некоторых дополнительных SCN — .
из системы. Основываясь на этом обсуждении и ваших наблюдениях за системой со страницы
158, в какую сторону сместилось равновесие: вправо (больше продукта, больше цвета) или
влево (меньше продукта, меньше цвета).
Если в систему были добавлены дополнительные SCN — , которые
уже был в равновесии , это было бы слишком много SCN — присутствует в системе. Система должна была бы отреагировать на удаление некоторых дополнительных SCN — .
из системы. Основываясь на этом обсуждении и ваших наблюдениях за системой со страницы
158, в какую сторону сместилось равновесие: вправо (больше продукта, больше цвета) или
влево (меньше продукта, меньше цвета). Если Fe 3+ удалено от равновесия
системы, то система перестанет находиться в равновесии и должна будет реагировать в
направление, которое восстанавливает некоторые Fe 3+ . На основании ваших наблюдений (стр. 158) и
этого обсуждения, в какую сторону сместится равновесие, если Fe 3+ будет удалено из
система? Увеличится или уменьшится количество окрашенного комплекса?
Если Fe 3+ удалено от равновесия
системы, то система перестанет находиться в равновесии и должна будет реагировать в
направление, которое восстанавливает некоторые Fe 3+ . На основании ваших наблюдений (стр. 158) и
этого обсуждения, в какую сторону сместится равновесие, если Fe 3+ будет удалено из
система? Увеличится или уменьшится количество окрашенного комплекса?
 Возможно, вы заметили
что на дне бутылки с насыщенным раствором NaCl было несколько кристаллов, как
Вы взяли свои образцы. Это должно было гарантировать, что раствор будет насыщен NaCl.
когда вы взяли некоторые. Насыщенный NaCl содержит Na + и Cl — ионов каждый при
концентрация 5,4 М (моль/л).
Возможно, вы заметили
что на дне бутылки с насыщенным раствором NaCl было несколько кристаллов, как
Вы взяли свои образцы. Это должно было гарантировать, что раствор будет насыщен NaCl.
когда вы взяли некоторые. Насыщенный NaCl содержит Na + и Cl — ионов каждый при
концентрация 5,4 М (моль/л). Обратите внимание, что 3 M HCl содержит ион Cl — при ниже концентрации, чем в насыщенном растворе NaCl (5,4 M ), в который вы его добавили. Когда вы добавили 3 M HCl к насыщенному раствору NaCl, вы, вероятно, , а не наблюдали какие-либо изменения (стр.
159). Добавление 3 M HCl к насыщенному раствору хлорида натрия
фактически снижает концентрацию хлорид-иона в растворе.
Обратите внимание, что 3 M HCl содержит ион Cl — при ниже концентрации, чем в насыщенном растворе NaCl (5,4 M ), в который вы его добавили. Когда вы добавили 3 M HCl к насыщенному раствору NaCl, вы, вероятно, , а не наблюдали какие-либо изменения (стр.
159). Добавление 3 M HCl к насыщенному раствору хлорида натрия
фактически снижает концентрацию хлорид-иона в растворе. Прозрачный желтый раствор представляет собой насыщенный раствор BaCrO 4 (см. ваши наблюдения
на странице 159).
Прозрачный желтый раствор представляет собой насыщенный раствор BaCrO 4 (см. ваши наблюдения
на странице 159).


 Когда вы добавляли HCl (концентрированный раствор ионов Cl — ) к
AgNO 3 образовался белый осадок AgCl. Раствор над осадком
представлял собой насыщенный раствор Ag + и ионы Cl — .
Когда вы добавляли HCl (концентрированный раствор ионов Cl — ) к
AgNO 3 образовался белый осадок AgCl. Раствор над осадком
представлял собой насыщенный раствор Ag + и ионы Cl — .