5 фактов, которые вы должны знать
FeO — это химическая формула оксида железа. Он имеет такие синонимы, как оксид железа (ii) или оксо-железо. Здесь мы обсуждаем структуру FeO, ее характеристики и некоторые факты.
FeO (оксид железа) или оксид железа (ii) состоит из двух элементов, т.е. атомов железа и кислорода. В структуре FeO ион Fe находится в степени окисления +2. Он полностью отличается от иона Fe2O3 по структуре и характеристикам. FeO представляет собой минеральную форму, известную как вюстит. Это соединение имеет черный цвет. По структуре напоминает NaCl.
Симметрия структуры меняется на ромбоэдрическую, и соединение FeO становится антиферромагнитным. Следовательно, антиферромагнитное расположение находится в направлении [1, 1, 1], что требует выбора ячейки, которая содержит по крайней мере два различных атома Fe в этом направлении.
Шестиугольный участок или ячейка с ромбоэдрическим центром является самой нижней или наименьшей ячейкой, которая удовлетворяет этому условию. Решетка FeO в этом состоянии имеет параметры a = b = c = 5 и углы α = β = γ = 260. Таким образом, атомы железа (Fe) расположены в дробных координатах (33, 557, 0) и (0, 0, 0.5), а атом кислорода (О) расположен в (0.5, 0.5, 0.25) и (0.25, 0.25, 0.75).
Решетка FeO в этом состоянии имеет параметры a = b = c = 5 и углы α = β = γ = 260. Таким образом, атомы железа (Fe) расположены в дробных координатах (33, 557, 0) и (0, 0, 0.5), а атом кислорода (О) расположен в (0.5, 0.5, 0.25) и (0.25, 0.25, 0.75).
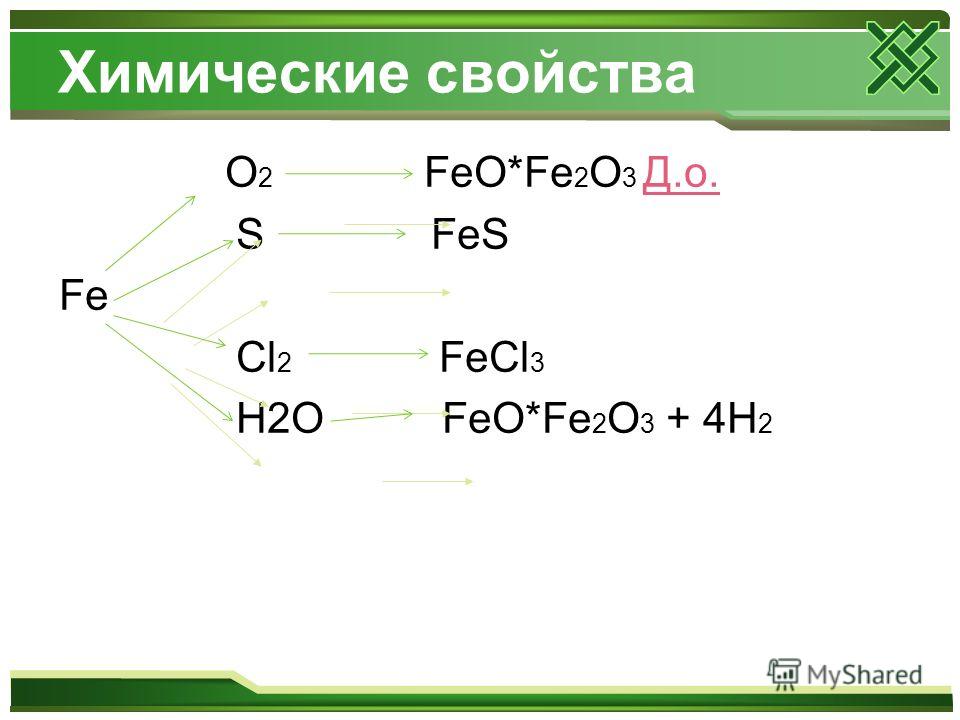
Оксид железа FeO или оксид железа (ii) получают термическим разложением оксалата железа (ii).
FeC2O4 → FeO + CO2 + CO
Когда происходит термическое разложение оксалата железа (ii) (FeC2O4), возможно образование оксида железа (ii) (FeO) с выделением диоксида углерода (CO2) и монооксида углерода (CO). Реакция термического разложения выполняется в инертном состоянии, чтобы избежать образования оксида железа (Fe2O3).
Здесь оксид железа или оксид железа (ii) относится к группе нестехиометрических соединений, которые особенно бедны железом в составе от Fe0.84O до Fe0. 95O. FeO (оксид железа (ii)) имеют аналогичные структура похожа на NaCl (каменная соль). В кристаллической структуре FeO кристаллы FeO бедны железом и всегда нестехиометричны.
95O. FeO (оксид железа (ii)) имеют аналогичные структура похожа на NaCl (каменная соль). В кристаллической структуре FeO кристаллы FeO бедны железом и всегда нестехиометричны.
В нем есть несколько вакантных катионных позиций, а некоторые позиции содержат ионы Fe3+, но их сочетание делает структуру достаточно электрически нейтральной. Примерная формула FeO: Fe0.95O. Молекула FeO имеет структуру каменной соли и также имеет плотность 5.073 г/см3.
Какова структура FeO?Структура FeO похожа на структуру каменной соли (NaCl). Это нестехиометрическая структура, так как в структуре есть некоторые вакантные места или дырки, или некоторые из ионов Fe3+ присутствуют в структуре вместо ионов Fe2+. Здесь каждый ион железа (Fe2+) окружен шестью соседними ионами кислорода (O2-) или каждый ион кислорода (O2-) окружен шестью соседними ионами железа (Fe2+), т.е. наоборот.
FeO (оксид железа (ii)) имеет кубическую структуру или гранецентрированную кубическую (FCC) структуру каменной соли, и каждый край элементарной ячейки FeO составляет 5. 0 А.0. Следовательно, на каждом ребре элементарной ячейки кристаллической структуры присутствуют четыре иона Fe2+ и четыре иона O2-. В этой структуре атом железа координируется с атомами кислорода октаэдрически и аналогичным образом атомы кислорода координируются с атомами железа октаэдрически (наоборот).
0 А.0. Следовательно, на каждом ребре элементарной ячейки кристаллической структуры присутствуют четыре иона Fe2+ и четыре иона O2-. В этой структуре атом железа координируется с атомами кислорода октаэдрически и аналогичным образом атомы кислорода координируются с атомами железа октаэдрически (наоборот).
Структура нестехиометрическая, так как окисление Fe2 в ион Fe3 нарушается заменой небольшой части ионов Fe2+ двумя 3rd число ионов Fe3+, занимающих тетраэдрическое положение в закрытоупакованной решетке структуры FeO. По сравнению с кристаллическим твердым телом в расплавленном состоянии атомы железа координированы преимущественно четырьмя или пятью атомами кислорода. Ниже температуры 200 кельвинов в структуре происходит довольно небольшое превращение.
Структура FeO FCC (гранецентрированная кубическая структура)Является ли FeO ионным или ковалентным?Да, FeO — полярное ковалентное соединение. В структуре FeO атом железа имеет электроотрицательность 1. 83, а атом кислорода имеет электроотрицательность 3.44. Разница между обеими электроотрицательностями составляет 3.44 (O) – 1.83 (Fe) = 1.61. Природа связи в FeO полярно-ковалентная, поэтому разница очень близка к ионной связи. Итак, железо (ii) оксид представляет собой полярную ковалентную соединение с ионными характеристиками.
83, а атом кислорода имеет электроотрицательность 3.44. Разница между обеими электроотрицательностями составляет 3.44 (O) – 1.83 (Fe) = 1.61. Природа связи в FeO полярно-ковалентная, поэтому разница очень близка к ионной связи. Итак, железо (ii) оксид представляет собой полярную ковалентную соединение с ионными характеристиками.
В молекуле FeO присутствуют атомы железа (Fe) и кислорода (O), имеющие разность электроотрицательностей 1.61. Эта разница электроотрицательности ниже заданного стандартного значения 1.71. Из-за низкого значения по сравнению с 1.7 молекула FeO является полярной ковалентной молекулой.
Если значение электроотрицательности выше 1.7, то любое соединение будет ионным соединением. Но все же в молекуле FeO преобладает ионный характер из-за присутствия двух противоположно заряженных ионов Fe2+ и O2-.
Насколько FeO является ионным?Согласно правилу Фузана, соединение с большим размером катиона и меньшим размером аниона благоприятствует ионным характеристикам при образовании связи между катионом и анионом. Таким образом, FeO более ионный, но может проявлять и ковалентный характер.
Таким образом, FeO более ионный, но может проявлять и ковалентный характер.
Обычно ионные связи могут образовываться между двумя противоположно заряженными ионами, то есть положительно заряженными и отрицательно заряженными ионами. Следовательно, ионные связи образуются за счет электростатического притяжения внутри противоположно заряженных ионов. Анион получает электроны, а катион отдает электроны.
Растворяется ли FeO в воде?FeO (оксид железа (ii)) или оксид железа не растворяется в воде. Оксиды железа, встречающиеся в природе, в основном нерастворимы в воде. Таким образом, оксид железа FeO также нерастворим в воде, поскольку это природное соединение. Кроме того, он ионный по своей природе, поэтому он не может образовывать ионы в воде, когда реагирует с водой.
Почему FeO нерастворим в воде?FeO является ионным соединением, так как состоит из двух противоположно заряженных ионов. Молекула FeO имеет ион Fe2+ (катион) и ион O2- (анион). Следовательно, когда FeO (оксид железа) при смешивании или реакции с водой не может образовывать ионы в воде. Таким образом, FeO не может диссоциировать или совсем не диссоциирует в воде. Следовательно, FeO (оксид железа (ii)) не растворяется или не растворяется в воде..
Следовательно, когда FeO (оксид железа) при смешивании или реакции с водой не может образовывать ионы в воде. Таким образом, FeO не может диссоциировать или совсем не диссоциирует в воде. Следовательно, FeO (оксид железа (ii)) не растворяется или не растворяется в воде..
Обычно железо в элементарной форме (элементарное железо) растворимо в воде при нормальных комнатных условиях. Но по правилу растворимости оксиды железа не растворяются в воде. Растворимость железосодержащих молекул или соединений увеличивается с более низким значением рН.
Растворимость соединений железа может быть увеличена за счет соединений с меньшим положительным зарядом. Поскольку ион Fe2+ имеет меньший заряд, чем ион Fe3+, соединения, содержащие Fe2+, более растворимы, чем другие соединения, но не могут диссоциировать в воде, поэтому они считаются нерастворимыми соединениями. Следовательно, FeO нерастворим в воде.
Является ли FeO твердым телом?Да, FeO является твердым соединением, так как имеет кристаллическую структуру каменной соли, подобную NaCl. Даже порошок FeO представляет собой соединение в виде черного твердого порошка. Кристаллическая структура иона FeO нестехиометрична.
Даже порошок FeO представляет собой соединение в виде черного твердого порошка. Кристаллическая структура иона FeO нестехиометрична.
FeO (оксид железа) представляет собой твердое соединение, так как имеет кристаллическую структуру каменной соли, как NaCl. Также кристаллическая структура FeO имеет гранецентрированную кубическую структуру (ГЦК), в которой каждый атом Fe2+ окружен соседними ионами O2-. Таким образом, ионы структуры плотно упакованы в куб, и, следовательно, это твердое соединение.
Насколько FeO твердый?В кристаллической структуре FeO все ионы Fe2+ и O2- плотно упакованы в гранецентрированную кубическую структуру. В любом твердом соединении атомы или ионы плотно упакованы и имеют определенную форму. Таким образом, ион FeO имеет гранецентрированную кубическую форму, а ионы плотно упакованы. Таким образом, это твердое соединение.
Вывод:FeO известен как оксид железа или оксид железа (ii). В структуре FeO ион Fe находится в степени окисления +2, а атом O находится в степени окисления -2. Это нестехиометрическая структура, так как в структуре FeO есть несколько вакантных мест или некоторые ионы Fe2+ замещены ионами Fe3+. Структура FeO представляет собой гранецентрированную кубическую структуру. Он имеет полярную ковалентную связь, но показывает ионные характеры. Это ионное, нерастворимое в воде и твердое соединение.
В структуре FeO ион Fe находится в степени окисления +2, а атом O находится в степени окисления -2. Это нестехиометрическая структура, так как в структуре FeO есть несколько вакантных мест или некоторые ионы Fe2+ замещены ионами Fe3+. Структура FeO представляет собой гранецентрированную кубическую структуру. Он имеет полярную ковалентную связь, но показывает ионные характеры. Это ионное, нерастворимое в воде и твердое соединение.
Узнайте больше о следующих структурах и характеристиках
| ZnO ZnS Fe3O4 NaClO2 Литий Криптон неон Пептидная связь NaHSO4 KMnO4 | Nah3PO4 Fe2S3 Гиалуроновая кислота Дисульфидная связь Аланиновая аминокислота Гликолевая кислота Гептан Глицин Золото ZnSO4 | перенасыщениеаминовая кислота Графит гексановая кислота |
Fe+O2=FeO составить уравнение окислительно-восстановитель… -reshimne.ru
Новые вопросы
Ответы
Похожие вопросы
Помогите плиз срочно. ..
..
Помогите решить задачу по химии, 10 кл…
Напишите молекулярные формулы известняка, серы, иода и кислорода, определите типы их химической связи и охарактеризуйте свойства….
Составить 3 задачи по химии с решениями и уравнениями ( можно простые) ДАЮ 30 БАЛЛОВ…
Расставьте коэффициенты,укажите типы реакций.
AL + CL2 → AL CL3
Zu + HCL → Zu CL2 + h3…
Объясните циркуляцию кислорода в природе…
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский языкХимия
Физика
Биология
Другие предметы
История
Обществознание
География
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
Музыка
Право
Французский язык
Немецкий язык
МХК
ОБЖ
Психология
Функциональное исследование плотности FeO2, FeO и FeO
- DOI:10.
 1002/1097-461X(2000)80:3<307::AID-QUA4>3.0.CO;2-8
1002/1097-461X(2000)80:3<307::AID-QUA4>3.0.CO;2-8 - ID корпуса: 93865785
@article{GarcaSosa2000DensityFS,
title={Исследование функционала плотности FeO2, FeO и FeO},
автор={Альфонсо Т. Гарка-Соса и Мигель Кастро},
journal={Международный журнал квантовой химии},
год = {2000},
объем = {80},
страницы={307-319}
} - Альфонсо Т. Гарка-Соса, М. Кастро
- Опубликовано в 2000 г.
- Chemistry
- International Journal of Quantum Chemistry
Низкоэнергетические структуры FeO2 были определены с помощью методов теории функционала плотности, реализованных в программе DGauss 3.0.1. Выполнены расчеты полноэлектронного типа с использованием двух уровней теории, а именно приближения локальной спиновой плотности с использованием функционала Воско–Уилка–Нюсаира (ВВН) и приближения обобщенного градиента (ОПГ) в виде уравнения Бекке. (1988) обменный и Perdew (1986) корреляционные функционалы.
Просмотр через Publisher
Об электронном и геометрическом строении FeO2(-/0) и присвоении фотоэлектронного спектра аниона.
Высокоточные одноточечные расчеты RASPT2 и RCCSD(T) с одним эталоном поддерживают (2)Δg в качестве основного состояния аниона, несмотря на то, что разница энергий между (4)Πg и (6)Σg(+ ) состояния меньше 0,2 эВ.
Структура и магнитные свойства кластеров (Fe2O3)(n) (n = 1-5).
Определены глобальные минимальные структуры нейтральных кластеров (Fe2O3)n с n = 1-5 с использованием генетического алгоритма в сочетании с ab initio параметризованными межатомными потенциалами и последующим…
Определение структуры (Fe3O4)n+(n = 1 — 3) ) кластеры через DFT
- Yanhua Li, C. Cai, Chengjun Zhao, Yonghong Gu
Химия
- 2016
Благодаря алгоритму оптимизации роя частиц (PSO) глобальные минимальные структуры-кандидаты с наименьшей энергией для кластеров (Fe3O4)n(n = 1 − 3) были получены из первых принципов…
Исследование функционала плотности на каркасе и некаркасные кластеры (Fe2O3)n.

Результаты показывают, что окисление кластеров Fe(4)O(n) (n<6) под действием O(2) при комнатной температуре является экзотермическим, тогда как окисление кластеров с n > или = 6 является эндотермическим.
Термохимические параметры и константы скоростей реакций Fe + O2 + M ↔ FeO2 + M и FeO + O2 ↔ FeO2 + O
Термохимические и кинетические характеристики реакций Fe + O2 + M ↔ FeO2 + M (I) и FeO + O2 ↔ FeO2 + O (II) определены на основе анализа экспериментальных данных в рамках модели…
Константы скорости реакции Fe + O2 + M ↔ FeO2 + M в пределах низких и высоких давлений
Термохимические и кинетические характеристики реакции Fe + O2 + M ↔ FeO2 + M получены на основе анализа в рамках модель РРКМ с учетом возбужденных электронных…
Эволюция структуры наночастиц Fe2O3.
- A. Erlebach, Heinz-Dieter Kurland, J. Grabow, F. Müller, M. Sierka
Материаловые науки, химия
Nanoscale
- 2015
Смоделировали кристаллизацию более крупных нанопартал с диаметром 50004
. нм демонстрирует выраженное понижение температуры плавления и приводит к образованию монокристаллов ε-Fe2O3 с гексагональной морфологией, что дает первое прямое указание на то, что δ-Fe2O3 может быть термодинамически наиболее стабильной фазой в этом размерном режиме.
нм демонстрирует выраженное понижение температуры плавления и приводит к образованию монокристаллов ε-Fe2O3 с гексагональной морфологией, что дает первое прямое указание на то, что δ-Fe2O3 может быть термодинамически наиболее стабильной фазой в этом размерном режиме.
Сечения ионизации оксидов железа электронным ударом
- S. Huber, A. Mauracher, Ivan Sukuba, J. Urban, T. Maihom, M. Probst
Physics
- 2017
- Obed Martinez, A. Vivoni, Z. Qiao, U. Udeochu, C. Hosten
Химия
- 2006
- Z. CAO, M. Duran, M. Solà
Химия
- 1997 1997
- 4. реакции Fe + O2+ N2→ FeO2+ N2
- M. Helmer, J. Plane
Химия
- 1994
3,3 нм паров ферроцена для получения атомов Fe в избытке газовой ванны O2 и N2 с последующим…
Структура и свойства кластеров кобальта вплоть до тетрамера: исследование функционала плотности
- C. Jamorski, Ana Martinez, M. Castro, D. Salahub
Physics
- 1997
Всеэлектронные расчеты были выполнены на кластерах кобальта вплоть до тетрамера с использованием формализмов локальной и обобщенной градиентной коррекции спиновой плотности.
 Эти кластеры представляют собой обилие…
Эти кластеры представляют собой обилие…Реакции атомов железа, подвергнутых лазерной абляции, с молекулами кислорода: матричные инфракрасные спектры и расчеты функционала плотности OFeO, FeOO и Fe(O2)
- L. Andrews, G. V. Chertihin, A. Ricca, C. W. Bauschlicher
- 900 Chemistry
- 1996
Реакции аблированных лазером атомов Fe и молекул O2 в аргоне, конденсирующихся на поверхности 10 K, привели к резкому поглощению инфракрасного излучения при 1204,5, 945,6 и 797,1 см-1, которое идентифицируется как FeOO и…
Преобразование формулы корреляционной энергии Колле-Сальветти в функционал электронной плотности.
- Ли, Ян, Парр
Физика
Физический обзор. B, Конденсированное вещество
- 1988
Численные расчеты ряда атомов, положительных ионов и молекул как с открытой, так и с закрытой оболочкой показывают, что формулы функционала плотности для корреляционной энергии и корреляционного потенциала дают корреляцию энергии в пределах нескольких процентов.

Молекулярный орбитальный анализ промежуточных продуктов и продуктов, полученных в результате фотоокисления железного пентакарбонила
- P. Lyne, D. Mingos, T. Ziegler, A. J. Downs
Chemistry
- 1993
02020202020202020202020202020202020202020202020. с помощью диоксигона в матрице аргона дает ряд промежуточных продуктов на пути к получению конечного продукта, триоксида железа. В этой статье мы представляем…
Приближение функционала плотности для корреляционной энергии неоднородного электронного газа.
- Пердью
Физика
Физический обзор. B, Конденсированное вещество
- 1986
Численные результаты для атомов, положительных ионов и поверхностей близки к точным корреляционным энергиям со значительными улучшениями по сравнению с исходным приближением LM для ионов и поверхностей.
Результаты, полученные с помощью корреляционных функционалов плотности энергии Беке и Ли, Янга и Парра
- Б.
 Милих, А. Савин, Х. Столл, Х. Прейс
Милих, А. Савин, Х. Столл, Х. Прейс Chemistry, Physics
- 1989
Accurate spin-dependent electron liquid correlation energies for local spin density calculations: a critical analysis
- S. H. Vosko, L. Wilk, M. Nusair
Physics
- 1980
Мы оцениваем различные приближенные формы корреляционной энергии на одну частицу спин-поляризованного однородного электронного газа, которые часто использовались в приложениях локальной плотности спинов…
Структура ядра алмаза Fe2IVO2 для ключевого интермедиата Q метанмонооксигеназы
- Lijin Shu, J.C. Nesheim, K. Kauffmann, E. Münck, J. Lipscomb, L. Que
Chemistry
1 17 Science
Спектроскопические данные свидетельствуют о том, что дижелезный центр в Q имеет алмазное ядро Fe2IVO2, которое было предложено в качестве ключевых окислителей для ММО и других негемовых дижелезных ферментов, таких как рибонуклеотидредуктаза и десатураза жирных кислот.

Дано, \\[Fe{\\text{ }} + {\\text{ }}{O_2} \\к FeO\\] ? Сбалансируйте уравнение.
Ответить
Проверено
165 тыс.+ просмотров
Подсказка: Как мы знаем, в химии уравнения играют важную роль. В реакции главные три вещи. Существуют реагенты, продукты и условия реакции. Реагенты всегда находятся в левой части уравнения. Если в уравнении используется более одного реагента, это означает использование знака плюс. Продукты всегда находятся на правой стороне реакции. Кое-что здесь также следует. Более одного продукта с использованием знака плюс. Между продуктами реагентов используются стрелки, чтобы найти направление реакции в уравнении.
Полный ответ:
Следовательно, мы увеличиваем количество молей оксида железа в продукте с одного до двух и количество молей железа на стороне реагента также увеличиваем с одного до двух.
Сбалансированное химическое уравнение позволяет предсказать неизвестные продукты химической реакции.
В химии уравновешивает химическое уравнение означает,
Мы корректируем количество молей реагента и продукта, используемых для достижения равного количества одного и того же атома в реагенте и продукте в данной химической реакции.
Данная химическая реакция:
\[Fe{\text{ }} + {\text{ }}{O_2} \to FeO\]
Исходное количество атомов железа на стороне продукта и на стороне реагента одинаково. Но количество атомов кислорода на стороне продукта и на стороне реагента одинаково.
Согласно приведенному выше обсуждению, сбалансированное химическое уравнение ниже:
\[2Fe{\text{}} + {\text{}}{O_2} \to 2FeO\]Примечание:
что в сбалансированной химической реакции мы предсказываем побочный продукт реакции. В некоторых случаях мы не можем достичь баланса, меняя родинку. В этом случае мы используем количество исчисляемых ионов в продукте и реагенте на стороне химической реакции. В химии окислительно-восстановительная реакция является одним из видов основных реакций. В этой окислительно-восстановительной реакции используются два метода для достижения сбалансированной химической реакции.
7 Abstract Приведены сечения ионизации электронным ударом (EICS) молекул оксида железа, FexOx и FexOx+1 с x = 1, 2, 3, от порога ионизации до 10 кэВ, полученные с помощью…
Энергетические расчеты 6-меркаптопуринрибозида адсорбировано на поверхности серебряного электрода с использованием теории функционала плотности
Исследование реакций малых кластеров оксида железа с нейтральным оксидом железа.
Результаты расчетов хорошо согласуются с экспериментальными наблюдениями и раскрывают механизмы реакции для нейтральных кластеров оксида железа, превращающих метанол в формальдегид через различные промежуточные продукты.
ПОКАЗАНЫ 1-10 ИЗ 13 ССЫЛОК
Sort Byrelevancemost повлияла на PapersRecency

 1002/1097-461X(2000)80:3<307::AID-QUA4>3.0.CO;2-8
1002/1097-461X(2000)80:3<307::AID-QUA4>3.0.CO;2-8 Эти кластеры представляют собой обилие…
Эти кластеры представляют собой обилие…
 Милих, А. Савин, Х. Столл, Х. Прейс
Милих, А. Савин, Х. Столл, Х. Прейс

