Структура и характеристики Fe3O4 (15 полезных фактов) —
Fe3O4 или оксид железа представляет собой основной оксид с молекулярной массой 231.533 г/моль, где Fe имеет переменную валентность. Давайте узнаем больше о Fe3O4 в деталях.
Fe3O4 представляет собой соединение смешанной валентности Fe. Здесь Fe существует в степенях окисления +2 и +3. В реакции с водой он дает гидроксид железа, который является сильным основанием, поэтому он является основным оксидом. В этой молекуле отсутствует связь металл-металл, все Fe связано с атомами O только d-орбиталями.
Таким образом, при гибридизации он образовал внутренний орбитальный комплекс, включающий d-орбитали Fe и s и p-орбитали атома O. Теперь мы можем объяснить структуру Льюиса, гибридизацию, валентный угол и другие важные факты о Fe.3O4 с надлежащим объяснением в следующей части статьи.
1. Как нарисовать Фе
3O4 состав?Структура Льюиса молекулы дает нам четкое представление о ковалентных характеристиках молекулы. Попробуем изобразить структуру Льюиса Fe3O4 в несколько шагов.
Попробуем изобразить структуру Льюиса Fe3O4 в несколько шагов.
Подсчет валентных электронов
1-й шаг рисования структуры Льюиса молекулы — это подсчет общего количества валентных электронов молекулы путем подсчета атомов заместителей. Общее количество валентных электронов для Fe3O4 равны 40, что является вкладом трех валентных электронов Fe и четырех валентных электронов O. Здесь один Fe находится в степени окисления +2, а два других +3.
Выбор центрального атома
После подсчета валентных электронов мы должны выбрать центральный атом для структуры Льюиса, чтобы мы могли расположить другие атомы в соответствии с требованиями. Основываясь на размере и электроположительности, Fe выбрано здесь в качестве центрального атома, поэтому три Fe являются центральными атомами, а четыре O — окружающими атомами.
Удовлетворение октета
Для каждой ковалентной молекулы после образования связи они пытаются выполнить свой октет, чтобы обрести стабильность, завершая свои валентные орбитали. Для трех атомов Fe и четырех атомов O электроны потребуются в соответствии с октетом 7 * 8 = 56, но валентных электронов для молекулы 40, поэтому оставшиеся электроны заполнены.
Для трех атомов Fe и четырех атомов O электроны потребуются в соответствии с октетом 7 * 8 = 56, но валентных электронов для молекулы 40, поэтому оставшиеся электроны заполнены.
Удовлетворение валентности
Каждый атом в молекуле удовлетворяется своей стабильной валентностью в течение октета. Требуемые 56-40 = 16 электронов должны быть заполнены связями 16/2 = 8, и здесь каждому Fe и каждому O удовлетворяет их стабильная валентность. Здесь Fe показывает два типа валентности, 2 и 3, а O показывает только двухвалентность, чтобы конкурировать за связи.
Назначьте одинокие пары
Несвязанные электроны после образования связи существуют в виде неподеленных пар над соответствующими атомами. Здесь O и Fe содержат неподеленные пары на своих соответствующих валентных орбиталях. Чтобы подсчитать общее количество неподеленных пар, мы просто складываем вместе неподеленные пары атомов Fe и O. Общее количество одиноких пар равно 12.
2.
 Fe3O4 валентные электроны
Fe3O4 валентные электроныВалентные электроны присутствуют на самой внешней оболочке каждого атома, участвующего в образовании связи. Подсчитаем общее количество валентных электронов для Fe3O4 Молекула.
Общее количество валентных электронов для Fe3O4 молекуле 40, включая валентные электроны для трех атомов Fe и четырех атомов O отдельно. Валентные электроны Fe здесь равны 5 и 6 соответственно. O имеет шесть валентных электронов, так как это элемент группы VIA. Fe является элементом d-блока, поэтому подсчитываются электроны, присутствующие на этих орбиталях.
- Валентных электронов, присутствующих в атомах O, 6 (электронная конфигурация [He]2s22p4)
- Валентные электроны для Fe показывают степень окисления +3 5 (3d5)
- Валентные электроны для Fe показывают степень окисления +2 6 (3d6)
- Таким образом, общее количество валентных электронов для Fe3O4 молекула будет 6+(5*2) + (4*6) = 40
3.
 Fe3O4 структурировать одинокие пары
Fe3O4 структурировать одинокие парыНесвязанные электроны, присутствующие на самой внешней орбитали после образования связи, известны как неподеленные пары. Теперь посчитаем неподеленные пары Fe3O4.
Всего неподеленных пар в Fe3O4 молекула будет иметь 12 пар, что означает 24 неподеленных пары электронов. Где присутствуют три атома Fe и четыре неподеленные пары атомов O. Один из Fe вносит две пары неподеленных пар, а два других вносят по одной паре неподеленных пар каждый. Каждый O содержит для одиноких пар отдельно.
- Формула для расчета общего числа неподеленных пар на Fe3O4 молекула, неподеленные пары = валентные электроны – связанные электроны.
- Неподеленные пары над каждым атомом O: 6-2 = 4
- Неподеленные пары над Fe, имеющие 2 валентности, 6-2 = 4
- Неподеленные пары над Fe, имеющие 3 валентности, 5-3 = 2
- Таким образом, общее количество неподеленных пар над Fe3O4 молекула будет (4 * 4) + 4 + (2 * 2) = 24 неподеленных пар электронов.

4. Fe
3O4 форма структурыМолекулярная форма принимается центральной молекулой в соответствии с окружающей средой других атомов. Предскажем форму Fe3O4.
Молекулярная форма Fe3O4 является тетраэдрическим вокруг трех центров Fe, что можно доказать из следующей таблицы.
| Молекулярный Формула | Количество пары связей | Количество одинокие пары | Форма | Геометрия |
| AX | 1 | 0 | Линейные приводы | Линейные приводы |
| AX2 | 2 | 0 | Линейные приводы | Линейные приводы |
| AX | 1 | 1 | Линейные приводы | Линейные приводы |
| AX3 | 3 | 0 | треугольный плоскостной | треугольный Planar |
| AX2E | 2 | 1 | изогнутый | треугольный Planar |
| AX2 | 1 | 2 | Линейные приводы | треугольный Planar |
| AX4 | 4 | 0 | четырехгранный | четырехгранный |
| AX3E | 3 | 1 | треугольный пирамидальный | четырехгранный |
| AX2E2 | 2 | 2 | изогнутый | четырехгранный |
| AX3 | 1 | 3 | Линейные приводы | четырехгранный |
| AX5 | 5 | 0 | треугольный бипирамидальный | треугольный бипирамидальный |
| AX4E | 4 | 1 | неустойчиво | треугольный бипирамидальный |
| AX3E2 | 3 | 2 | Т-образный | треугольный бипирамидальный |
| AX2E3 | 2 | 3 | линейный | треугольный бипирамидальный |
| AX6 | 6 | 0 | восьмигранный | восьмигранный |
| AX5E | 5 | 1 | площадь пирамидальный | восьмигранный |
| AX4E2 | 4 | 2 | площадь пирамидальный | восьмигранный |
Согласно VSEPR (теория электронных пар валентной оболочки), молекула AX3E принял треугольную пирамидальную форму, хотя геометрия будет тетраэдрической, а AX2E2 тип принимает изогнутую форму вместо четырехгранной. Здесь присутствуют два типа атомов Fe из-за разных степеней окисления, и они принимают обе геометрии вокруг себя.
Здесь присутствуют два типа атомов Fe из-за разных степеней окисления, и они принимают обе геометрии вокруг себя.
5. Fe
3O4 угол конструкцииВалентный угол — это угол после принятия идеальной геометрии, а затем создания угла для правильной ориентации атома. рассчитаем валентный угол для Fe3O4.
Валентный угол для Fe-O-Fe составляет 109.5.0 и O-Fe-O равно 1040. Эти два типа валентных углов показаны в этой молекуле, потому что присутствуют два типа Fe-центров, и геометрия вокруг них другая, тригонально-пирамидальная, а другая изогнутая. Итак, наблюдались два типа валентных углов.
Fe3O4 Бонд Угол- Рассчитаем валентный угол по величине гибридизации центрального атома.
- Используя правило Бента, COSθ = (p-1)/p позволяет предсказать валентный угол
- Для сд3 гибридизация, символ s равен 1/4th
- Тогда валентный угол будет равен COSθ = [(1/4)-1]/(1/4)
- COSθ = -(1/3)
- Θ = COS-1— (1/3)
- Θ = 109.
 50
50 - Таким образом, валентный угол будет равен 109.5.0 но в согнутом состоянии геометрия подобна воде, а валентный угол уменьшается до 1040.
Смешение двух атомных орбиталей с образованием равного числа новых гибридных орбиталей с эквивалентной энергией называется гибридизацией. Давайте исследуем гибридизацию Fe3O4.
Центральное Fe в Fe3O4 это сд3 гибридизованы здесь, что может быть подтверждено следующей таблицей.
| Структура | Гибридизация ценностное | Государство гибридизация центрального атома | Бондовый угол |
| 1.Линейный | 2 | сп/сд/пд | 1800 |
2. Планировщик Планировщиктреугольный | 3 | sp2 | 1200 |
| 3. Тетраэдрический | 4 | sd3/сп3 | 109.50 |
| 4.Тригональный бипирамидальный | 5 | sp3д/дсп3 | 900 (осевой), 1200(экваториальный) |
| 5.Восьмигранный | 6 | sp3d2/ д2sp3 | 900 |
| 6.Пятиугольный бипирамидальный | 7 | sp3d3/d3sp3 | 900, 720 |
- Мы можем рассчитать гибридизацию по общепринятой формуле H = 0.
 5 (V + M-C + A),
5 (V + M-C + A), - Таким образом, гибридизация центрального Fe(III) составляет ½(5+3+0+0) = 8 (sd3)
- Опять же, гибридизация другого Fe (II) такова: ½ (6 + 2 + 0 + 0) = 8 (sd3)
- В гибридизации участвуют одна 4s-орбиталь и три 3d-орбитали Fe.
- Неподеленные пары Fe также включены в sd3 гибридизация.
7. Является ли Fe
3O4 твердое или газообразное?Молекула является твердой или газообразной в зависимости от температуры и состояния этой конкретной молекулы. Посмотрим, будет ли Fe3O4 твердое или газообразное.
Fe3O4 представляет собой твердый и встречающийся в природе черный пигмент или черную силу. Основная причина оставаться твердой заключается в том, что в молекуле присутствует много связей между атомами Fe и O, поэтому кристаллическая структура молекулы становится твердой и существует как твердая. Оба Fe2+ и Fe3+ присутствуют в твердой части.
Его извлекают из минерала гематита, и в нем присутствуют различные примеси, поэтому в твердом виде он имеет черный цвет.
8. Является ли Fe
3O4 растворим в воде?Растворимость в воде зависит от характера Н-связи и диссоциирует в водном растворе при температуре. Посмотрим, будет ли Fe3O4 растворяется в воде или нет.
Fe3O4 нерастворим в воде при комнатной температуре. Он также нерастворим в горячей и холодной воде, и причина в том, что внутри молекулы присутствует прочная связь, а энергия гидратации молекулы очень ниже, чем ее энтальпия связи, поэтому требуется больше энергии для разрыва связи и растворимости в воде. .
Хотя это основной оксид, поэтому он реагирует с водой, но растворяется в ней.
9. Является ли Fe
3O4 полярный или неполярныйПолярность молекулы зависит от отличного от нуля результирующего дипольного момента t и ее асимметричной формы.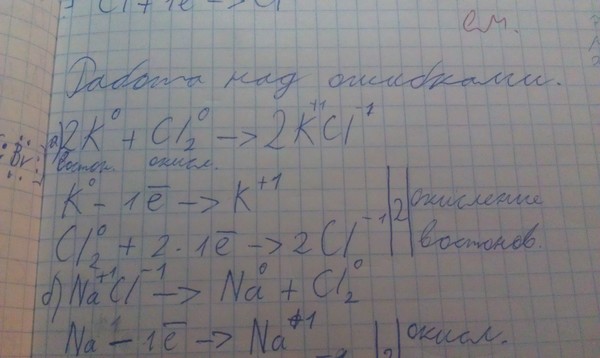 Проверим, является ли Fe3O4 полярный или нет.
Проверим, является ли Fe3O4 полярный или нет.
Fe3O4 — это полярный молекулы и основной причиной является асимметричная форма молекулы. Молекула имеет изогнутую и треугольно-пирамидальную форму вокруг двух центров Fe, и обе формы несимметричны, так как нет возможности аннулировать значение дипольного момента между атомами Fe и O и сделать молекулу полярной.
Хотя это полярная молекула, но она не растворяется в полярном растворителе, таком как вода, поэтому полярность и растворимость не имеют прямого отношения.
10. Является ли Fe
3O4 молекулярное соединение?Молекулярные соединения — это вещества, состоящие из правильного стехиометрического соотношения атомов и валентности. Проверим, является ли Fe3O4 является молекулярным соединением или нет.
Fe3O4 является молекулярным соединением, поскольку состоит из трех частей Fe и четырех частей O, поэтому стехиометрическое соотношение всегда фиксировано для молекулы. Кроме того, их O сохраняет свою двухвалентность, а Fe сохраняет свою переменную валентность, как 2 и 3, и между составляющими атомами образуется надлежащая связь.
Кроме того, их O сохраняет свою двухвалентность, а Fe сохраняет свою переменную валентность, как 2 и 3, и между составляющими атомами образуется надлежащая связь.
Если соотношение Fe и O изменить, то он превратится в другой оксид железа и больше не будет Fe.3O4.
11. Является ли Fe
3O4 кислота или основание?Кислотность или основность зависит от высвобождения H+ и ОН– в водном растворе – теория Аррениуса. Посмотрим, будет ли Fe3O4 является кислотой или основанием.
Fe3O4 не является ни кислотой, ни основанием, потому что не может высвобождать H+ или ОН– ионов, так как эти ионы отсутствуют в этой молекуле. Но он может вести себя как основной оксид, когда реагирует с водой, он может образовывать сильное основание, но сам не может вести себя как основание. Таким образом, он обладает свойством оксида, а не кислотой или основанием.
12. Является ли Fe
3O4 электролит?Вещество диссоциирует в воде, распадаясь на два иона и проводя электричество через раствор, называется электролитом. Посмотрим, будет ли Fe3O4 электролит или нет.
Fe3O4 является электролитом, потому что он может распадаться на Fe2+Fe3+и O2-ионы, эти ионы являются сильно электрически заряженными частицами и переносят электричество через раствор очень быстро. Железо представляет собой металл d-блока, поэтому он очень электроположителен, а О является сильно электроотрицательным атомом. Эти ионы могут сделать раствор заряженным своим ионным потенциалом.
13. Является ли Fe
3O4 поваренная соль?Соли — это то вещество, которое может образовывать кроме H+ и кроме ОН– а также образуются за счет ионного взаимодействия между ними. Посмотрим, будет ли Fe3O4 соль или нет.
Посмотрим, будет ли Fe3O4 соль или нет.
Fe3O4 является солью, потому что она имеет катион Fe2+/ Fe3+ и анион О2- которые отличаются от H+ и ОН–. Кроме того, в некоторой степени присутствует ионное взаимодействие, потому что Fe3+ является сильно электроположительным. Но он не может быть растворим в воде, хотя он действует как основной оксид в большей степени, чем соль, и из-за соли он имеет большую энергию диссоциации связи.
14. Является ли Fe
3O4 ионный или ковалентный?Ни одна молекула не является чисто ковалентной или ионной, а наоборот, в зависимости от степени их поляризуемости – правило Фаяна. Проверим, является ли Fe3O4 является ионным или ковалентным.
Fe3O4 является ковалентной молекулой, потому что связь, присутствующая в молекуле Fe и O, имеет одинаковое количество электронов в этих связях. Кроме того, полярность связи не настолько высока, чтобы иметь ионный характер. Хотя их гибридизация происходила в центральном атоме подобно ковалентной молекуле.
Кроме того, полярность связи не настолько высока, чтобы иметь ионный характер. Хотя их гибридизация происходила в центральном атоме подобно ковалентной молекуле.
Поляризующая способность Fe2+ или Fe3+ не настолько высока, чтобы они могли поляризовать анион. Опять же, поляризуемость оксидного аниона очень плохая, поскольку он имеет меньший размер, поэтому он проявляет слабый ионный характер и более ковалентный характер.
15. Является ли Fe
3O4 магнитный?Магнитная природа молекулы зависит от наличия неспаренных электронов на валентной оболочке металла. Посмотрим, если Fe3O4 магнитный он или нет.
Fe3O4 является магнитной молекулой, точнее, она существует как парамагнитная по своей природе, потому что в центрах Fe (III) и Fe (II) присутствуют неспаренные электроны. Поскольку оксид является лигандом со слабым полем, поэтому для спина не возникает пары, поэтому весь спин электронов является синглетным. Итак, существуют как парамагнетики в природе.
Итак, существуют как парамагнетики в природе.
- Для Fe2+ присутствуют четыре неспаренных электрона, а для Fe3+ присутствуют пять неспаренных электронов,
- Итак, для Fe3+ центр, парамагнитный характер молекулы увеличивается.
- Мы можем рассчитать величину магнитной природы по формуле [n(n+1]1/2, где n — количество неспаренных электронов.
- Итак, величина Fe2+ равно [4(4+1]1/2 = 4.47 БМ
- Величина для Fe3+ равно [5(5+1]1/2 = 5.47 БМ
Заключение
Fe3O4 представляет собой молекулу Fe со смешанной валентностью, а также основной оксид, который может реагировать с водой. Это нормальное спинальное соединение, в котором один металлический центр принимает тетраэдрическую геометрию, а другой принимает октаэдрическую геометрию в структуре решетки.
Узнайте больше о следующих структурах и характеристиках
Железо (III) оксид для ферритов
Предлагаем нашу продукцию – оксид железа III, с доставкой в любое место на карте России, где бы не находилось Ваше производственное предприятие — в Калуге, Самаре, Ростове или Хабаровске. Мы обеспечим отправку любых партий, в мешках от 1 т. до нескольких вагонов.
Мы обеспечим отправку любых партий, в мешках от 1 т. до нескольких вагонов.
Это соединение — мелкодисперсная трехвалентная окись, представляющая собой однородный красный или красно-коричневый порошок. Используется в производстве ферритов для электроники и радиотехники и ферритов особо высокой чистоты.
Квалификационная маркировка – «ч», наносится на упаковку и этикетку.
Характеризуется высоким содержанием оксида железа. Дополнительные компоненты составляют сотые и тысячные доли процента от общей массы.
На сверхчистый химический материал даем гарантию до 2 лет при условии соблюдения правил хранения – в сухом помещении в заводских упаковках, предохраняющих оксид железа от потери свойств. При тщательном соблюдении правил хранения срок пригодности продукта неограничен.
Ферриты – это сочетание оксида железа с другими металлами, которые также используются в виде окисей. Используются в радиотехнике, электронике, в работе с высокими частотами.
Из них изготавливаются:
- сердечники
- антенны
- элементы памяти для компьютерной техники
- поглотители электромагнитных волн
- магниты
- другие компоненты.

Соединение вырабатывается в полном соответствии со стандартами оксидов железа, используемых как катализаторы и для производства ферритов. Производство ведется под строгим контролем на всех этапах и с приемкой продукции, представляющей собой забор проб с каждой партии. Каждая порция контрольного сырья проверяется в лабораторных условиях на чистоту.
Наш завод производит химические соединения по установленным нормативам на современном оборудовании. Наши заказчики выбирают готовое ТУ, а также при необходимости заказывают персональное под определенные условия своего производства, мы готовы и к той и к той ситуации.
Посмотрите это коротное научно-популярное видео о свойствах оксида железа.
При обычной температуре это черные кристаллы, полупроводники, обладающие слабой электропроводностью, зависящей от температуры окружающего воздуха.
При определенной температуре меняют структуру, что приводит к снижению электропроводности. При этом внутри вещества нет постоянных показателей, они колеблются в очень большом диапазоне.
Сернокислое железо является токсином, поэтому при работе с соединением необходимо создавать безопасные условия для персонала:
поддерживать концентрацию в воздухе не выше нормы (1 мг/м3)
работать с веществом только с применением средств индивидуальной защиты (очками, респиратором и перчатками)
оборудовать помещение для работы с оксидом железа приточно-вытяжной вентиляцией, выделить зоны повышенной концентрации и оборудовать их дополнительно.
Вещество сохраняет свойства при хранении в заводских упаковках в сухих помещениях.
Поступает в продажу с этикетками, на которых указана квалификация сырья и назначение.
Разлагается при нагревании.
Вступает в реакцию с кислотными растворами.
При контакте с концентрированными окисляющими кислотами начинается реакция.
На щелочи реагирует при сплавлении.
На открытом воздухе идет процесс окисления.
Восстановление с водородом, а также монооксидом углерода.
Спекается с железом, одновременно восстанавливаясь и окисляясь.
| Показатели качества | |||
| Наименование показателя | Требование ТУ для марки | ||
| А | В | С | |
| 1. Массовая доля оксида железа (Fe2O3), %, не менее | 99,2 | 98,5 | 98 |
| 2. Массовая доля потерь при прокаливании, %, не более | 0,65 | 1,0 | 1,0 |
3. | 0,20 | 0,30 | − |
| 4. Массовая доля сульфатов (SO4), %, не более | 0,20 | 0,30 | 1,0 |
| 5. Массовая доля алюминия (Al), %, не более | 0,02 | 0,02 | − |
| 6. Массовая доля кремния (Si), % | 0,008-0,02 | 0,08 | |
| 7. Массовая доля (Mg), %, не более | 0,02 | 0,02 | 0,05 |
| 8. Массовая доля марганца (Mn), % | 0,01-0,04 | 0,3 | |
| 9. Массовая доля меди (Cu), %, не более | 0,02 | 0,02 | − |
| 10. Массовая доля хрома (Cr), %, не более | 0,02 | 0,02 | − |
| 11. Массовая доля кальция (Са), % | 0,008-0,02 | 0,03 | |
| 12. Массовая доля суммы калия и натрия (К+Na), %, не более | 0,02 | 0,02 | 0,02 |
13. Насыпная (утрясенная) масса, г/см3 Насыпная (утрясенная) масса, г/см3 | 1,2-1,8 | − | |
| 14. Коэффициент усадки при температуре 1000оС в пределах | 1,15-1,20 | 1,08-1,15 | |
| 15. Массовая доля Fe2+ в пересчете на FeO, %, не более | − | − | 0,4 |
| 16. Массовая доля остатка на сите с сеткой 004К (ГОСТ 6613), %, не более с сеткой № 02, %, не более | 1,0 − | 1,0 − | − 1,0 |
| 17. Массовая доля кобальта (Со), %, не более | − | − | 0,02 |
Наш завод предоставляет два года гарантии на соответствие требованиям предъявляемым при хранении вещества в рекомендуемых условиях, при правильной транспортировке и хранении.
Так как Железо (III) оксид требует к себе особого внимания при транспортировке, то нужно отнестись к его упаковке с особой тщательностью. Вообще, разработаны ГОСТы по его упаковке, и мы конечно, стараемся их соблюдать.
Широко используется во многих отраслях, информацию о некоторых из них, смотрите ниже.
МеталлургияВсе виды оксидов применяются в доменных и других технологиях выплавки, являясь основным сырьем и промежуточными продуктами. Крокус (производное оксида железа) используется в полировке стали.
Химическая промышленность, строительствоПроизводство красок – железного сурика, охры, умбры и других.
Термостойкие эмали в своем составе имеют это вещество.
Керамика производится с добавлением оксидов.
Используется в производстве цемента и цветных смесей.
Используется для очистки газов в виде массы.

Из него делают электроды для электролиза соединений щелочных металлов.
Является промежуточным продуктом при получении оксидов железа.
Оксид железа – это слой магнитных лент, которые являются хранилищем информации.
Входит в состав смеси емких аккумуляторов.
Фармацевтическая и пищевая промышленностьРакетостроениеТопливо будущего, которое обладает КПД, многократно превосходящим все современные виды.
Мы продаем оптом и крупными партиями. Будем рады долгосрочному сотрудничеству.
Среди негативных воздействий на человека — это общее токсическое воздействие при контакте с веществом без средств защиты, при попадании на кожу может вызвать сильное раздражение, тот же эффект ждет в случае попадания на слизистую оболочку. Предельно допустимая концентрация внутри рабочей зоны не должна превышать — 1 мг/м.
Во время работы с веществом нужно обязательно использовать индивидуальные средства защиты, например такие как: респираторами, резиновыми перчатками, защитными очками.
В помещениях где проводятся работы, необходимо обеспечить наличие общей приточно-вытяжной вентиляции. А места наибольшей концентрации вещества должны быть отдельны от общего пространства помещения и так же должны быть с локальной вытяжной вентиляцией. Проводить исследование вещества следует в вытяжном шкафу, в специально оборудованной для этого, лаборатории.
Быть нашим постоянным покупателем означает выгодное вложение денег в химически чистые элементы, необходимые для вашего бизнеса. Заказы принимаются в любое время суток.
Если у вас есть особые запросы по технологии изготовления или составу продукции, готовы разработать индивидуальное ТУ.
Без ограничений или дополнительных условий мы оформим заказ и доставим товар точно к указанному времени по адресу вашего предприятия. Используем железнодорожные перевозки, имеем парк грузовых автомобилей.
Организовываем доставку, в стандартные сроки и срочно:
собственным автотранспортом
железнодорожными составами
с помощью транспортных компаний.

В любой момент вы сможете получать актуальную информацию о передвижении груза.
Мы также предоставляем возможность самовывоза с нашего склада.
При заключении контракта на регулярные поставки предложим особые условия сотрудничества и оплаты. Заказ оксида железа (III) крупной партией может быть рассчитан для Вас со значительной скидкой.
Что за вещество Fe3O4?
Что за вещество Fe3O4?
Оксид ферроферра – это неорганическое вещество с химической формулой Fe3O4. Это магнитный черный кристалл, поэтому его также называют магнитным оксидом железа. Его нельзя рассматривать как «железистый феррит» [Fe(FeO2)2] и нельзя рассматривать как смесь оксида железа (FeO) и оксида железа (Fe2O3), но его можно рассматривать как субоксид Соединение, состоящее из железа и оксид железа (FeO·Fe2O3). Это вещество нерастворимо в воде, растворах щелочей, этаноле, эфире и других органических растворителях. Природный оксид железа нерастворим в растворах кислот и легко окисляется до оксида железа (Fe2O3) на воздухе во влажном состоянии.
Каковы физические и химические свойства ферроферрооксида?
Черный Fe3O4 представляет собой оксид железа смешанной валентности. Он имеет температуру плавления 1597°C и плотность 5,18 г/см3. Он нерастворим в воде и растворим в растворах кислот. В природе встречается в виде магнетита. Сильный субмагнетизм и высокая проводимость.
Ферромагнитные и ферримагнитные материалы претерпевают второй фазовый переход выше температуры Кюри, превращаясь в парамагнитные материалы. Температура Кюри Fe3O4 составляет 585 ℃.
Fe3O4 обладает высокой электропроводностью, а необычные электрохимические свойства Fe3O4 можно объяснить переносом электронов между Fe2+ и Fe3+.
При сжигании железной проволоки в кислороде образуется окись железа. Сравнивая свободную энергию Гиббса, генерируемую стандартным молем оксида железа, делают вывод, что наибольшей термодинамической устойчивостью обладает Fe3O4, поэтому продуктом является Fe3O4.

Железо и воздух образуют на своей поверхности оксиды. В это время химический состав самой оксидной пленки неоднороден. Например, кусок малоуглеродистой стали может быть покрыт тремя видами оксидных пленок: FeO соприкасается с металлом, Fe2O3 со стороны, контактирующей с воздухом, и Fe3O4 посередине. Точнее, возможно, смесь насыщенных твердых растворов трех оксидов образует оксидную пленку на поверхности стали.
В то же время толщина оксидной пленки также меняется в зависимости от различных условий окружающей среды при окислении. При комнатной температуре толщина оксида на относительно чистом железе в сухом воздухе не превышает 20 ангстрем (1 ангстрем = 0,1 нанометра), но во влажном воздухе толщина оксидной пленки значительно увеличивается, и на поверхности могут появиться пятна ржавчины. быть увиденным. В это время напыление оксида носит слоистый характер, сторона, близкая к металлу, представляет собой плотный аморфный безводный слой, а сторона, близкая к воздуху, представляет собой толстый пористый слой гидратации.
Железо реагирует с водяным паром с образованием Fe3O4 и водорода.
Fe3O4 обладает антикоррозионным действием. Например, воронение стальных деталей (также известное как синее обжигающее и обжигающее синее) заключается в использовании окислительного эффекта щелочного окислительного раствора для образования сине-черной или темно-синей пленки Fe3O4 на поверхности стальных деталей. Используется для повышения коррозионной стойкости, блеска и эстетики.
Как производить Fe3O4?
Существует множество способов получения ферроферрооксида.
Метод медленного окисления гидроксида железа: нагревание водного раствора, содержащего осадок гидроксида железа, до температуры выше 70°C и проведение медленного окисления для получения достаточно однородных правильных октаэдрических или кубических монокристаллических частиц с длиной ребра около 0,2 мкм порошка оксида железа. Пузырьки воздуха также можно использовать в качестве средства окисления. Также можно использовать окислитель, такой как KNO3.
Метод Харбера: Если вы умеете работать, вы можете получить оксид железа со стехиометрическим составом Fe3,00O4,00. По методу Харбера к 2,2 л водного раствора FeSO4·7h3O добавляют 220 г 20%-ной аммиачной воды и кипятят при условии отключения воздуха. в круглодонную колбу с капилляром) доводят до кипения концентрированный водный раствор, содержащий 25,5 г KNO3.
Метод добавления щелочи: раствор сульфата железа окисляют добавлением щелочи или раствор соли железа и соли железа смешивают в определенной пропорции, а затем добавляют щелочной осадок.
Какая польза от Fe3O4?
Оксид ферроферра является широко используемым химическим материалом. Он широко используется в строительных материалах, автомобильных тормозах, сварке и других областях, и перспективы рынка очень широки. Кроме того, поскольку Fe3O4 имеет характеристики высокого удельного веса и сильного магнетизма, он хорошо зарекомендовал себя при очистке сточных вод. Кроме того, окись железа также может использоваться в качестве пигмента и полирующего агента. Он также может реагировать с некоторыми химическими веществами для достижения антиокислительного и антикоррозионного действия. Например, при взаимодействии оксида железа с нитритом натрия на поверхности стали может образоваться плотный слой оксида железа и железа, предотвращающий или замедляющий коррозию стали.
Он также может реагировать с некоторыми химическими веществами для достижения антиокислительного и антикоррозионного действия. Например, при взаимодействии оксида железа с нитритом натрия на поверхности стали может образоваться плотный слой оксида железа и железа, предотвращающий или замедляющий коррозию стали.
Поставщик ферроферрооксида
TRUNNANO (также известная как Luoyang Tongrun Nano Technology Co. Ltd.) является надежным мировым поставщиком и производителем химических материалов с более чем 12-летним опытом в области производства высококачественных химикатов и наноматериалов. В настоящее время наша компания успешно разработала серию материалов. Оксид железа , производимый нашей компанией, отличается высокой чистотой, мелким размером частиц и содержанием примесей. Чтобы узнать последнюю цену на оксид ферроферра, отправьте нам электронное письмо или нажмите на необходимые продукты, чтобы отправить запрос.
Новая полиморфная модификация Fe3O4, стабильная на границе ядра и мантии
NASA/ADS
Новая полиморфная форма Fe
3 O 4 Стабильная в условиях границы ядро-мантия- Гринберг, Э.
 ;
; - Прокопенко В.Б.
Аннотация
Магнетит Fe3O4 (и его высокобарические полиморфы) является одним из наиболее изученных железосодержащих минералов. Одна из причин интереса к магнетиту заключается в том, что он содержит как Fe2+, так и Fe3+, что особенно важно для понимания физических и химических свойств недр Земли. Ранние исследования магнетита обсуждали природу структурного фазового перехода при 35 ГПа [1-4]. Было показано, что эта структура высокого давления относится к типу CaTi2O4 [5], но с Fe3+, занимающим несколько позиций. Кроме того, показано, что при давлениях выше 65 ГПа происходит второй структурный переход в пространственную группу Pmma [5], аналогичный переходу в твердом растворе Fe3-xTixO4 [6]. Другие исследования были сосредоточены на P-T стабильности Fe3O4. Ранние исследования Lazor et al. [7] предсказали, что Fe3O4 может диспропорционировать в FeO и h-Fe2O3 при 50 ГПа. В других исследованиях предполагалось, что фаза высокого давления должна быть стабильной до 100 ГПа [3]. Более поздние экспериментальные исследования Риколло и Фея [8] показали, что Fe3O4 стабилен по крайней мере до 103 ГПа. До сих пор структурные исследования Fe3O4 ограничивались давлениями ниже 105 ГПа. Мы исследовали Fe3O4 при давлении до 175 ГПа и температуре выше 4000K, используя ячейки с алмазными наковальнями в сочетании с синхротронной рентгеновской дифракцией и системой импульсного лазерного нагрева в режиме реального времени для изучения стабильности Fe3O4 при соответствующих условиях давление-температура. Наши результаты показывают, что Fe3O4 стабилен как минимум до 176 ГПа и 4200 К. Мы обнаружили новую полиморфную модификацию Fe3O4 при таких высоких P-T условиях. Эта новая фаза стабильна в диапазоне давлений не менее 100
Ранние исследования Lazor et al. [7] предсказали, что Fe3O4 может диспропорционировать в FeO и h-Fe2O3 при 50 ГПа. В других исследованиях предполагалось, что фаза высокого давления должна быть стабильной до 100 ГПа [3]. Более поздние экспериментальные исследования Риколло и Фея [8] показали, что Fe3O4 стабилен по крайней мере до 103 ГПа. До сих пор структурные исследования Fe3O4 ограничивались давлениями ниже 105 ГПа. Мы исследовали Fe3O4 при давлении до 175 ГПа и температуре выше 4000K, используя ячейки с алмазными наковальнями в сочетании с синхротронной рентгеновской дифракцией и системой импульсного лазерного нагрева в режиме реального времени для изучения стабильности Fe3O4 при соответствующих условиях давление-температура. Наши результаты показывают, что Fe3O4 стабилен как минимум до 176 ГПа и 4200 К. Мы обнаружили новую полиморфную модификацию Fe3O4 при таких высоких P-T условиях. Эта новая фаза стабильна в диапазоне давлений не менее 100
- Публикация:
Тезисы осенней встречи AGU
- Дата публикации:
- Декабрь 2017 г.
- Биб-код:
- 2017AGUFMMR43C0480G


 50
50 5 (V + M-C + A),
5 (V + M-C + A),

