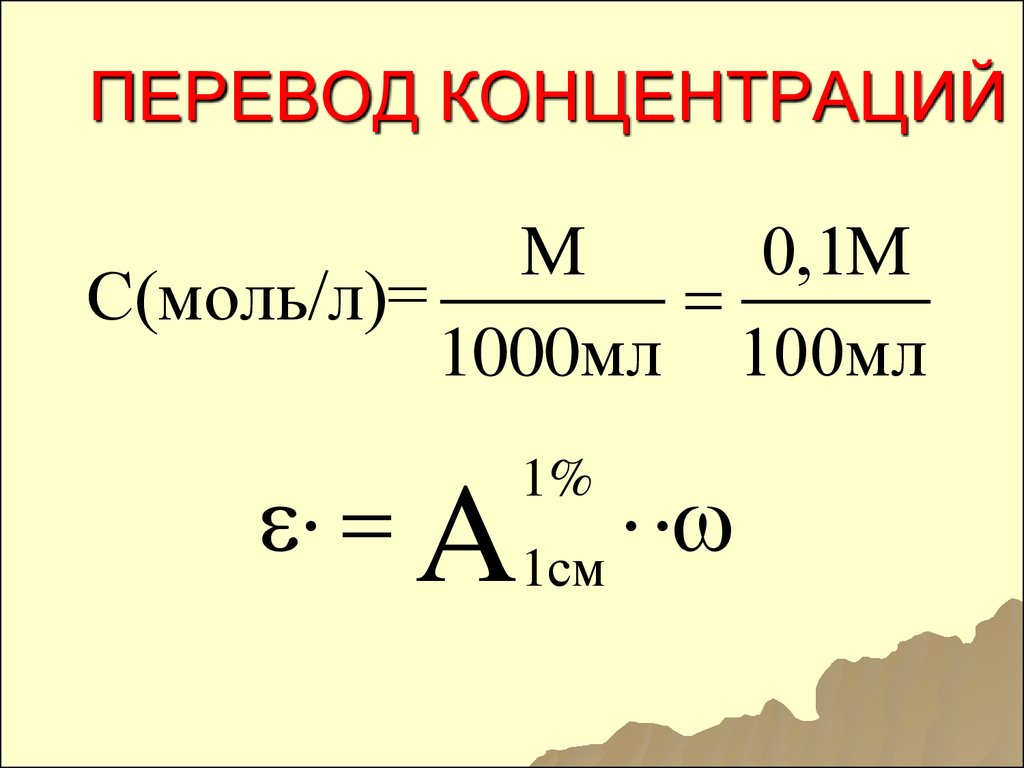
Способы выражения концентраций
1 Что такое раствор
2 Способы выражения концентрации растворов
2.1 Молярная концентрация растворов (молярность)
2.2 Молярная концентрация эквивалента или нормальная концентрация растворов (нормальность).
2.3 Процентная концентрация раствора или массовая доля
2.4 Моляльная концентрация раствора
2.5 Титр раствора
2.6 Мольная или молярная доля
2.7 Пример перевода процентной концентрации в молярную, нормальную концентрацию, моляльность, титр
Существует множество способов измерить концентрацию раствора. Это так называемые способы выражения концентрации раствора.
Концентрация раствора — это количество вещества, находящегося в единице объема или массы раствора.
Что такое раствор
Среди окружающих нас веществ, лишь немногие представляют собой чистые вещества. Большинство являются смесями, состоящими из нескольких компонентов, которые могут находиться в одном или различных фазовых состояниях.
Большинство являются смесями, состоящими из нескольких компонентов, которые могут находиться в одном или различных фазовых состояниях.
Смеси, имеющие однородный состав являются гомогенными, неоднородный состав – гетерогенными.
Иначе, гомогенные смеси, называют растворами, в которых одно вещество полностью растворяется в другом (растворителе). Растворитель – это тот компонент раствора, который при образовании раствора сохраняет свое фазовое состояние. Он обычно находится в наибольшем количестве.
Существуют растворы газовые, жидкие и твердые. Но более всего распространены жидкие растворы, поэтому, в данном разделе, именно на них мы сосредоточим свое внимание.
Концентрацию раствора можно охарактеризовать как:
- качественную
- количественную.
Качественная концентрация характеризуется такими понятиями, как разбавленный и концентрированный раствор.
С этой точки зрения растворы можно классифицировать на:
- Насыщенные – растворы с максимально возможным количеством растворенного вещества. Количество растворяемого вещества, необходимое для получения насыщенного раствора определяет растворимость этого вещества.
- Ненасыщенные – любые растворы, которые все еще могут растворять введенное вещество.
- Пересыщенные – растворы, в которых растворено больше вещества, чем максимально возможное. Такие растворы очень нестабильны и в определенных условиях растворенное вещество будет выкристаллизовываться из него, до тех пор, пока не образуется насыщенный раствор.
Количественная концентрация выражается через молярную, нормальную (молярную концентрацию эквивалента), процентную, моляльную концентрации, титр и мольную долю.
Способы выражения концентрации растворов
Молярная концентрация растворов (молярность)
Наиболее распространенный способ выражения концентрации растворов – молярная концентрация или молярность. Она определяется как количество молей n растворенного вещества в одном литре раствора V. Единица измерения молярной концентрации моль/л или моль ·л-1:
Она определяется как количество молей n растворенного вещества в одном литре раствора V. Единица измерения молярной концентрации моль/л или моль ·л-1:
См = n/V
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным — растворено 0,01 моля вещества, миллимолярным — растворено 0,001 моля вещества.
Термин «молярная концентрация» распространяется на любой вид частиц.
Вместо обозначения единицы измерения — моль/л, возможно такое ее обозначение – М, например, 0,2 М HCl.
Молярная концентрация эквивалента или нормальная концентрация растворов (нормальность).
Понятие эквивалентности мы уже вводили. Напомним, что эквивалент – это условная частица, которая равноценна по химическому действию одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Например, эквивалент KMnO4 в окислительно – восстановительной реакции в кислой среде равен 1/5 (KMnO4).
Еще одно необходимое понятие — фактор эквивалентности – это число, обозначающее, какая доля условной частицы реагирует с 1 ионом водорода в данной кислотоно-основной реакции или с одним электроном в данной окислительно – восстановительной реакции.
Он может быть равен 1 или быть меньше 1. Фактор эквивалентности, например, для KMnO4 в окислительно – восстановительной реакции в кислой среде составляет fэкв(KMnO4) = 1/5.
Следующее понятие – молярная масса эквивалента вещества х. Это масса 1 моля эквивалента этого вещества, равная произведению фактора эквивалентности на молярную массу вещества х:
Мэ = fэкв· М(х)
Молярная концентрация эквивалента (нормальность) определяется числом молярных масс эквивалентов на 1 литр раствора.
Эквивалент определяется в соответствии с типом рассматриваемой реакции. Единица измерения нормальной концентрации такая же как и у молярной концентрации — моль/л или моль·л-1
Сн = nэ/V
Для обозначения нормальной концентрации допускается сокращение «н» вместо «моль/л».
Процентная концентрация раствора или массовая доля
Массовая концентрация показывает сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора.
Это отношение массы m(х) вещества x к общей массе m раствора или смеси веществ:
ω(х) = m(х)/m
Массовую долю выражают в долях от единицы или процентах.
Моляльная концентрация раствора
Моляльная концентрация раствора b(x) показывает количество молей n растворенного вещества х в 1 кг. растворителя m. Единица измерения моляльной концентрации — моль/кг :
b(x) = n(x)/m
Титр раствора
Титр раствора показывает массу растворенного вещества х, содержащуюся в 1 мл. раствора. Единица измерения титра — г/мл:
раствора. Единица измерения титра — г/мл:
Т(х) = m(х)/V,
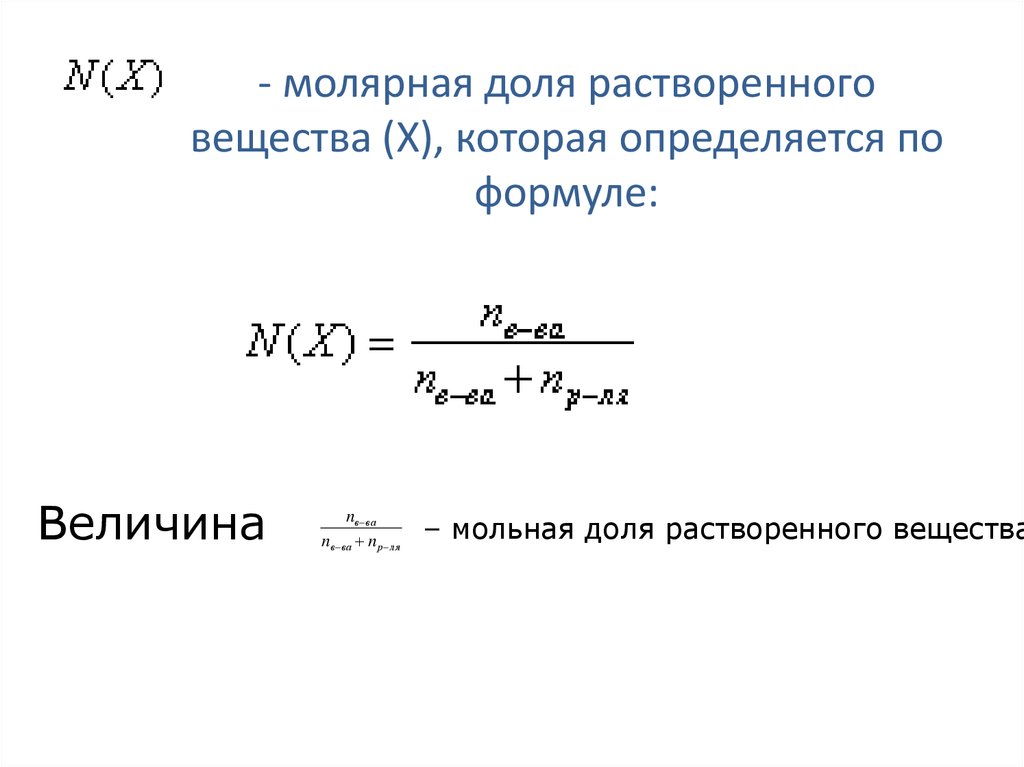
Мольная или молярная доля
Мольная или молярная доля α(х) вещества х в растворе равна отношению количества данного вещества n(х) к общему количеству всех веществ, содержащихся в растворе Σn:
α(х) = n(х)/Σn
Между приведенными способами выражения концентраций существует взаимосвязь, которая позволяет, зная одну единицу измерения концентрации найти (пересчитать) ее в другие единицы. Существуют формулы, позволяющие провести такой пересчет, которые, в случае необходимости, вы сможете найти в сети. В разделе задач показано, как произвести такой пересчет, не зная формул.
Пример перевода процентной концентрации в молярную, нормальную концентрацию, моляльность, титр
Дан раствор объемом 2 л с массовой долей FeSO4 2% и плотностью 1029 кг/м3. Определить молярность, нормальность, моляльность и титр этого раствора раствора.
Решение.
1. Рассчитать молярную массу FeSO4:
M (FeSO4) = 56+32+16·4 = 152 г/моль
2. Рассчитать молярную массу эквивалента:
Мэ = fэкв· М(FeSO4) = 1/2·152 = 76 г/моль
3. Найдем m раствора объемом 2 л
m = V·ρ = 2·10-3 ·1029 = 2,06 кг
4. Найдем массу 2 % раствора по формуле:
m(FeSO4) = ω(FeSO4) · mр-ра
m(FeSO4) = 0,02·2,06 = 0,0412 кг = 41,2 г
5.
n = m/М
n = 41,2/152 = 0,27 моль
См = n/V
См = 0,27/2 = 0,135 моль/л
6. Найдем нормальность:
Найдем нормальность:
nэ = m/Мэ
nэ = 41,2/76 = 0,54 моль
Сн = nэ/V
Сн = 0,54/2 = 0,27 моль/л
7. Найдем моляльность раствора. Моляльная концентрация равна:
b (x) = n(x)/m
Масса растворителя, т.е. воды в растворе равна:
mh3O = 2,06-0,0412 = 2,02 кг
b (FeSO4) = n(FeSO4)/m = 0,27/2,02 = 0,13 моль/кг
8. Найдем титр раствора, который показывает какая масса вещества содержится в 1 мл раствора:
Т(х) = m (х)/V
Т(FeSO4) = m (FeSO4)/V = 41,2/2000 = 0,0021 г/мл
Еще больше задач приведены в разделе Задачи: Концентрация растворов, Правило креста
Категории ОБЩАЯ ХИМИЯ, РастворыЧто такое концентрация раствора и как ее найти? / Справочник :: Бингоскул
Что такое концентрация раствора и как ее найти?добавить в закладки удалить из закладок
Содержание:
Раствор – это однородная смесь, которая состоит из растворителя и растворенного вещества. В растворах может раствориться неодинаковое количество вещества, что отражает различную концентрацию. Она указывает на соотношение, в котором находятся вещества и растворитель.
В растворах может раствориться неодинаковое количество вещества, что отражает различную концентрацию. Она указывает на соотношение, в котором находятся вещества и растворитель.
Массовая концентрация или массовая доля w
Массовая доля w отражает соотношение массы вещества к массе растворителя. Формула массовой концентрации:
w=mв-ва/mр-ра или w=(mв-ва/mр-ра)*100 %
В первом случае единиц измерения нет, а во втором случае выражается в процентах %.
Задача. В 100 г воды Н2О растворили 36 г хлорида натрия NaCl. Найти массовую концентрацию вещества.
Дано: m(NaCl)=36 г m(Н2О)=100 г | Решение: w(NaCl)=m(NaCl)/mр-ра mр-ра= m(NaCl)+m(H2O) mр-ра=36 г+100 г=136 г w(NaCl)=36 г/136 г=0,265 или 26,5 % Ответ: w(NaCl)=0,265 или 26,5 % |
Найти: w(NaCl)-? |
Молярная концентрация СМ
Молярная концентрация СМ в химии используется в том случае, если необходимо отразить зависимость концентрации скорости химической реакции, состояния равновесия и др. Молярная концентрация СМ выражает количество моль растворенного вещества в одном литре раствора. Концентрация вещества измеряется в моль/л (М).
Молярная концентрация СМ выражает количество моль растворенного вещества в одном литре раствора. Концентрация вещества измеряется в моль/л (М).
СМ=nв-ва/Vр-ра
Если учитывать то, что количество вещества n имеет следующую формулу:
n=m/M
то, формула молярной концентрации СМ имеет следующий вид:
СМ=m/(Vр-ра*M)
В данной формуле объем V выражается в литрах.
Задача. Приготовили раствор поваренной соли объемом 0,07 л из 7 г соли. Найдите молярную концентрацию раствора.
Дано: Vр-ра=0,07 л m(NaCl)=7 г | Решение: СМ=m/(Vр-ра*M) СМ=m(NaCl)/(Vр-ра*M(NaCl)) М(NaCl)=23+35,5=58,5 г/моль СМ=7 г/(0,07 л*58,5 г/моль)=1,7 моль/л Ответ: СМ=1,7 моль/л |
Найти: См-? |
Нормальная концентрация С
Н Нормальную концентрацию СН применяют вместе с законом эквивалентов. Она указывает на число эквивалентов вещества в литре раствора.
Она указывает на число эквивалентов вещества в литре раствора.
СН=nэ/Vр-ра
В этой формуле объем раствора также должен измеряться в литрах.
Задача. Дан раствор хлорида калия KCl объемом 2 л, в котором находится 2 эквивалента вещества. Найдите нормальную концентрацию.
Дано: Vр-ра=2 л nэ=2 экв | Решение: СН=nэ/Vр-ра СН=2 экв/2 л=1 моль/л Ответ: СН=1 моль/л |
Найти: СН-? |
Моляльная концентрация C
m Моляльную концентрацию Сm используют при выявлении влияния концентрации на изменение температуры замерзания или кипения раствора по сравнению с чистым растворителем. Она указывает на количество моль растворенного вещества в 1000 г растворителя.
Она указывает на количество моль растворенного вещества в 1000 г растворителя.
Сm=(mв-ва*1000)/(Мв-ва*mр-ля)
Задача. Определите моляльную концентрацию раствора нитрата натрия NaNO3, в котором массовая доля соли равна 10 %.
Дано: w(NaNO3)=10 % | Решение: Сm=(m(NaNO3)*1000)/(М(NaNO3)*m(Н2О)) М(NaNO3)=85 г/моль Т.к. w(NaNO3)=10 %, то в 100 г раствора находится 10 г нитрата натрия NaNO3 и 90 г воды Н2О Сm=(10 г*1000)/( 85 г/моль *90 г)=0,13 моль/кг Ответ: Сm=0,13 моль/кг |
Найти: Сm-? |
Как определить концентрацию раствора на практике
Существует несколько методов определения концентрации.
- Метод сравнения
- Данный метод основан на сравнении исследуемого и стандартного раствора. Готовят исследуемый и стандартный растворы и определяют их оптические плотности при одних и тех же условиях.
- Метод градуировочного графика
- Готовят 4-5 стандартных растворов в интервале ожидаемых концентраций анализируемых растворов и определяют их оптические плотности. По средним значениям полученных данных строят градуировочный график зависимости, с помощью которого и определяют неизвестную концентрацию аналита в анализируемом растворе.
Таким образом, существует несколько видов концентрации, формулы нахождения которых различны. Есть множество практических методов определения концентрации.
Поделитесь в социальных сетях:
12 ноября 2021, 10:55
Could not load xLike class!
Приготовление титрованных растворов — Национальная сборная Worldskills Россия
“
Один из самых простых в исполнении и наиболее распространенный метод количественного химического анализа — титриметрический. Он основан на измерении объема раствора с точно известной концентрацией реактива — титрованного раствора, расходуемого для реакции с определяемым веществом. О том, как приготовить титрованный раствор, поговорим в этом уроке.
Он основан на измерении объема раствора с точно известной концентрацией реактива — титрованного раствора, расходуемого для реакции с определяемым веществом. О том, как приготовить титрованный раствор, поговорим в этом уроке.
Глоссарий
Для успешного освоения материала рекомендуем вам изучить следующие понятия:
Точно измеренный объем раствора, взятый для анализа, который сохраняет свойства основного образца
Лабораторный сосуд для точного определения небольших объемов жидкостей, тонкая градуированная стеклянная трубка, открытая на одном конце и снабженная краном (стеклянным или тефлоновым) или зажимом на другом
Соединение, позволяющее визуализировать изменение концентрации какого-либо вещества или компонента, например, в растворе при титровании, или быстро определить pH
Метод определения кислот, оснований, солей, основанный на реакции взаимодействия между кислотой и основанием
Перенос точного количества сухого вещества или жидкости, сопровождающийся многократным ополаскиванием исходной тары
Раздел аналитической химии, в задачу которого входит определение количества элементов, функциональных групп, соединений в анализируемом объекте
Коническая колба, которую применяют при аналитических работах, в частности при титровании
Число, выражающее отношение действительной (практической) концентрации раствора к заданной (теоретической)
Нанесение условных знаков, букв, цифр, графических знаков или надписей на объект с целью его дальнейшей идентификации (узнавания), указания его свойств и характеристик
Число молей растворенного вещества в 1 литре раствора
Точно отведенное количество вещества
Метод определения окислителей или восстановителей, основанный на использовании окислительно-восстановительных реакций, протекающих между определяемым веществом и титрантом
Основано на определении конечной точки титрования (КТТ) по результатам измерения потенциала индикаторного электрода, реагирующего на изменение активности одного из участвующих в реакции веществ или продукта реакции
Соответствие техническим требованиям
Характеристика близости результатов, полученных для одного и того же образца одним и тем же методом в одних и тех же условиях (оператор, аппаратура, лаборатория) в течение короткого промежутка времени
Вещество, участвующее в химической реакции
Одна из наиболее распространенных мер центральной тенденции, представляющая собой сумму всех зафиксированных значений, деленную на их количество
Наборы химических реактивов, выпускаемые промышленностью в запаянных ампулах. Ампулы содержат точно известное количество вещества
Ампулы содержат точно известное количество вещества
Определение точной концентрации раствора
Образец вещества или материала с установленными по результатам испытаний значениями одной или более величин, характеризующих свойство или состав этого вещества или материала
Масса вещества в граммах / миллиграммах в 1 мл раствора (г/мл или мг/мл)
Отношение массы определяемого вещества к объему раствора, пошедшего на титрование данной массы, показывает массу вещества, титруемую 1 мл раствора
Метод количественного / массового анализа, который часто используется в аналитической химии, основанный на измерении объема раствора реактива точно известной концентрации, расходуемого для реакции с определяемым веществом
Раствор точно известной концентрации, предназначенный для целей титриметрического анализа
Высшая степень чистоты реактива. Содержание основного компонента более 99%
Вид мерной химической посуды, предназначенной для измерения объемов жидкостей как на налив, так и для последующего выливания в другую посуду
Видеолекция
Конспект
Выражения для концентрации титрованного раствора
Молярная концентрация — количество моль растворенного вещества, содержащееся в 1 л раствора.
Титр — выраженная в миллиграммах масса растворенного вещества, содержащаяся в 1 мл раствора.
Титр по определяемому веществу — масса определяемого вещества, эквивалентная 1 мл данного титранта.
Эквивалент вещества — такое количество вещества, которое может присоединять или высвобождать один катион водорода в кислотно-основных (ионообменных) реакциях или один электрон в окислительно-восстановительных реакциях. Он определяется исходя из его химической формулы, принадлежности к тому или иному классу химических соединений, а также химической реакции протекающей между определяемым веществом и титрованным раствором.
Стандартизация титранта
Растворы стандартизируют двумя способами:
1. По стандартному титрованному раствору
2. По точной навеске соответствующего стандартного образца.
Формула расчета концентрации по стандартному титрованному раствору:
— молярная концентрация эквивалента стандартного раствора, моль/л
— молярная концентрация эквивалента титранта, моль/л
— аликвотная часть стандартного раствора, взятого на анализ, мл
— объем титранта, израсходованный на титрование, мл
Формула расчета концентрации по навеске:
— молярная концентрация эквивалента титранта, моль/л
— масса навески установочного вещества, г
— молярная масса эквивалента определяемого вещества, г/моль
— объем титранта, израсходованный на титрование, мл
Установление коэффициента поправки
- Использовать не менее 3 навесок установочного вещества или разных объемов раствора установочного вещества.

- Устанавливать коэффициент тем методом, которым будет проводиться количественный анализ.
- Состав среды, в которой стандартизируется титрованный раствор, должен быть таким же, как и тот, в котором он будет использован.
- Перед стандартизацией титрованный раствор необходимо тщательно перемешать.
- По итогам как минимум 3 титрований должны получиться коэффициенты поправки с относительным расхождением не более 0,2% и средний арифметический результат в промежутке от 0,98 до 1,02.
Приготовление 1М раствора соляной кислоты
Что нам понадобится
Инструменты и посуда
Мерная колба
Воронка
Пипетка Мора
Капельная пипетка
Мерный стакан
Резиновая груша
Стакан для слива
Реактивы
Концентрированная соляная кислота
Очищенная вода
Концентрированная соляная кислота
Очищенная вода
Этапы работы
1. Заполнить колбу на ⅓ объема водой.
Заполнить колбу на ⅓ объема водой.
2. Промыть пипетку, используя промежуточный промаркированный стакан с концентрированной кислотой и слив.
3. Отобрать 8,7 мл концентрированной соляной кислоты и перенести аликвоту в мерную колбу.
4. Перемешать раствор.
5. Проверить температуру.
6. Раствор комнатной температуры довести водой до метки.
7. Перемешать еще раз раствор.
Установка приготовленного раствора по карбонату натрия
Что нам понадобится
Инструменты и посуда
3 конические колбы на 250 мл
Цилиндр на 50 мл
Бюретка на 25 мл
Штатив с лапкой
Нагреватель
Стакан для слива
3 бюкса
Реактивы
Раствор индикатора метилового оранжевого
3 навески карбоната натрия
Очищенная вода
Этапы работы
1. Перенести и растворить навеску карбоната натрия в 50 мл воды очищенной.
Перенести и растворить навеску карбоната натрия в 50 мл воды очищенной.
2. Добавить 2−3 капли раствора индикатора.
3. Титровать до красно-желтого оттенка раствора.
4. Зафиксировать объем титрованного раствора, который пошел на титрование. Повторить определение еще 2 раза.
5. Рассчитать коэффициент поправки по формуле:
6. Проверить приемлемость каждого из коэффициентов.
Сходимость:
Среднее арифметическое:
Маркировка растворов
На емкости с титрованным раствором должна содержаться следующая информация:
- Формула растворенного вещества
- Концентрация растворенного вещества
- Установленный коэффициент поправки
- Дата приготовления и установки коэффициента
- Индикатор, с которым устанавливался коэффициент
- Температура приготовления раствора
- ФИО готовившего
“
Вы узнали, как приготовить титрованный раствор. Закрепите новые знания с помощью тестов и интерактивных заданий.
Закрепите новые знания с помощью тестов и интерактивных заданий.
Интерактивное задание
Для закрепления полученных знаний пройдите тест
| Стартуем! |
Титр раствора
Титр раствора по определяемому веществу
Массовая доля
Молярная концентрация эквивалента
| Дальше |
| Проверить |
| Узнать результат |
0,98–1,03
0,96–1,02
0,97–1,05
0,98–1,02
| Дальше |
| Проверить |
| Узнать результат |
Молярная концентрация
Титр по определяемому веществу
Эквивалент вещества
Аликвота
| Дальше |
| Проверить |
| Узнать результат |
К сожалению, вы ответили неправильно
Прочитайте лекцию и посмотрите видео еще раз
| Пройти еще раз |
Неплохо!
Но можно лучше. Прочитайте лекцию и посмотрите видео еще раз
Прочитайте лекцию и посмотрите видео еще раз
| Пройти еще раз |
Отлично!
Вы отлично справились. Теперь можете ознакомиться с другими компетенциями
| Пройти еще раз |
расчет концентрации эмульсии и формула разбавления
Главная » Блог » Расчет концентрации эмульсии и формула разбавления
Если в ходе мониторинга было установлено, что концентрация эмульсии не соответствует установленным требованиям, потребуется провести коррекцию ее состава. Если этот показатель ниже установленной границы, нужно добавить в эмульсию концентрат. Если же состав, наоборот, слишком концентрированный, нужно влить в него дистиллированной воды или, что предпочтительнее, слабый раствор СОЖ.
При этом важно точно определить, какое количество концентрата или разбавочной жидкости нужно влить в эксплуатируемый состав. В этом случае нужно воспользоваться двумя основными формулами определения уровня концентрации эмульсии.
В этом случае нужно воспользоваться двумя основными формулами определения уровня концентрации эмульсии.
Закон разбавления
Этот способ применим в случае, когда необходимо снизить концентрацию состава. В других случаях эта методика отличается сложностями в применении. Соотношение выглядит так:
С1V1 = C2V2, где C1 – начальная концентрация, C2 – требуемая концентрация, V1 – первоначальный объем СОЖ, V2 – конечный объем эмульсии.
Например, на предприятии есть станок с баком для эмульсии 1 м³. В него залита СОЖ концентрацией 10%. Это оборудование должно работать при использовании смазочного материала с концентрацией 7%. Нужно рассчитать количество воды, которое нужно влить в бак.
Согласно приведенной выше формуле, имеются следующие данные:
С1 = 10%
C2 = 7%
V1 = 1000 л
V2 = 10 * 1000/7 = 1429 л
Соответственно, в бак потребуется влить 429 л воды.
Правило креста
Второй метод определения правильной концентрации состава и количества его элементов позволяет узнать пропорцию при смешении двух растворов с целью получения третьего состава.
В этом случае С1>С2, нужно найти Сх. При этом V1 и V2 являются условными показателями объемов каждого вещества, которые нужно будет смешать. Правило креста имеет ряд особенностей.
- Есть два раствора. В первом концентрация больше (С1), а во втором – меньше (С2). Требуется получить эмульсию с составом С3.
- Нужно записать концентрацию первого состава в верхнем углу, а второго вещества – в нижнем углу листа. Требуемая концентрация должна быть на уровне между ними.
- Нужно вычесть из показателя С1 концентрацию Сх. Этот результат будет соответствовать объему V2.
- После этого из показателя Сх вычитают концентрацию С2. Получается результат V1.
- Нужно составить пропорцию, в которой в числителе будет V1, а в знаменателе V2. Так определяется соотношение между объемами эмульсий для смешения.
Например, есть раствор с концентрацией 11%. Его разбавляют раствором с концентрацией 1%. При этом требуется получить эмульсию с показателем 7%. Сначала нужно записать все данные для расчетов:
С1 = 11%
С2 = 1%
С3 = 7%
Далее проводится расчет:
V2 = C1 – C3 = 11- 7 = 4
V1 = C3 – C1 = 7 – 1 = 6
Чтобы получить состав с требуемой концентрацией, потребуется смешать 6 частей эмульсии с концентрацией 11% с 4 частями однопроцентного состава.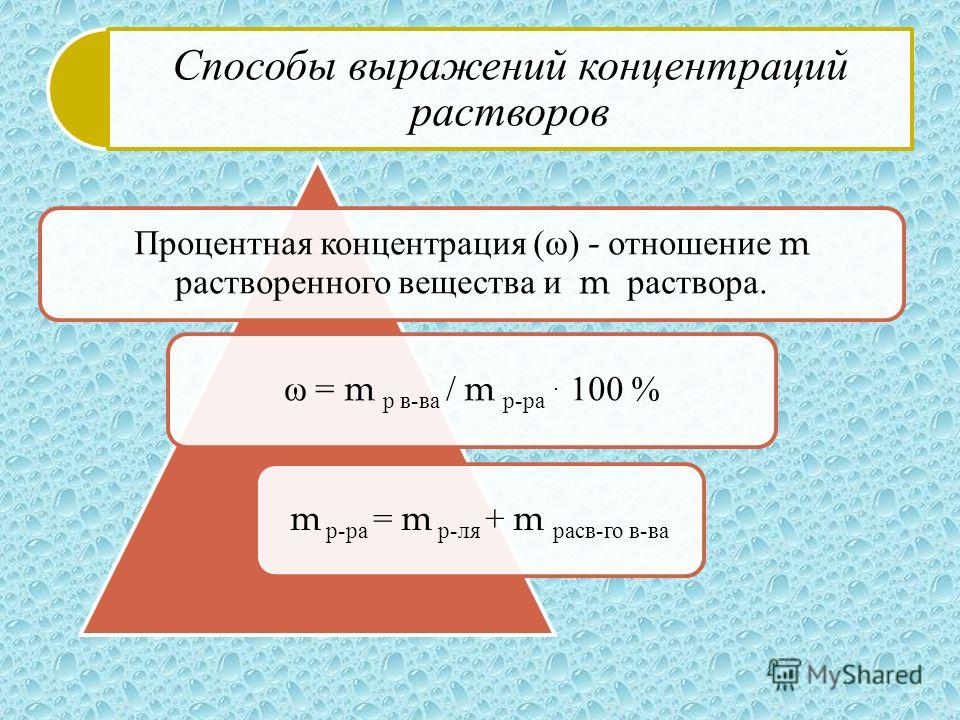
Это же правило можно применять для увеличения концентрации. В этом случае С1 должно равняться 100% (это чистый концентрат). Например, для повышения концентрации эмульсии 3% применяется чистый концентрат. При этом нужно создать смазочный состав с показателем 14%. Расчет будет следующим:
С1 = 100%
С2 = 3%
С3 = 14%
Получаем объем каждой жидкости:
V1 = 11
V2 = 86
Нужно смешать 11 частей концентрата с 86 частями эмульсии.
Вас заинтересуют
Ваш вопрос успешно отправлен. Спасибо!
Если в ходе мониторинга было установлено, что концентрация эмульсии не соответствует установленным требованиям, потребуется провести коррекцию ее состава. Если этот показатель ниже установленной границы, нужно добавить в эмульсию концентрат.
При этом важно точно определить, какое количество концентрата или разбавочной жидкости нужно влить в эксплуатируемый состав. В этом случае нужно воспользоваться двумя основными формулами определения уровня концентрации эмульсии.
Закон разбавления
Этот способ применим в случае, когда необходимо снизить концентрацию состава. В других случаях эта методика отличается сложностями в применении. Соотношение выглядит так:
С1V1 = C2V2, где C1 – начальная концентрация, C2 – требуемая концентрация, V1 – первоначальный объем СОЖ, V2 – конечный объем эмульсии.
Например, на предприятии есть станок с баком для эмульсии 1 м³. В него залита СОЖ концентрацией 10%. Это оборудование должно работать при использовании смазочного материала с концентрацией 7%. Нужно рассчитать количество воды, которое нужно влить в бак.
Согласно приведенной выше формуле, имеются следующие данные:
С1 = 10%
C2 = 7%
V1 = 1000 л
V2 = 10 * 1000/7 = 1429 л
Соответственно, в бак потребуется влить 429 л воды.
Правило креста
Второй метод определения правильной концентрации состава и количества его элементов позволяет узнать пропорцию при смешении двух растворов с целью получения третьего состава.
В этом случае С1>С2, нужно найти Сх. При этом V1 и V2 являются условными показателями объемов каждого вещества, которые нужно будет смешать. Правило креста имеет ряд особенностей.
- Есть два раствора. В первом концентрация больше (С1), а во втором – меньше (С2). Требуется получить эмульсию с составом С3.
- Нужно записать концентрацию первого состава в верхнем углу, а второго вещества – в нижнем углу листа. Требуемая концентрация должна быть на уровне между ними.
- Нужно вычесть из показателя С1 концентрацию Сх. Этот результат будет соответствовать объему V2.
- После этого из показателя Сх вычитают концентрацию С2. Получается результат V1.
- Нужно составить пропорцию, в которой в числителе будет V1, а в знаменателе V2. Так определяется соотношение между объемами эмульсий для смешения.

Например, есть раствор с концентрацией 11%. Его разбавляют раствором с концентрацией 1%. При этом требуется получить эмульсию с показателем 7%. Сначала нужно записать все данные для расчетов:
С1 = 11%
С2 = 1%
С3 = 7%
Далее проводится расчет:
V2 = C1 – C3 = 11- 7 = 4
V1 = C3 – C1 = 7 – 1 = 6
Чтобы получить состав с требуемой концентрацией, потребуется смешать 6 частей эмульсии с концентрацией 11% с 4 частями однопроцентного состава. Если представить это соотношение в виде дроби 6/4 можно произвести сокращение. Получается пропорция 3/2. В таком количестве можно смешивать заданные составы.
Это же правило можно применять для увеличения концентрации. В этом случае С1 должно равняться 100% (это чистый концентрат). Например, для повышения концентрации эмульсии 3% применяется чистый концентрат. При этом нужно создать смазочный состав с показателем 14%. Расчет будет следующим:
С1 = 100%
С2 = 3%
С3 = 14%
Получаем объем каждой жидкости:
V1 = 11
V2 = 86
Нужно смешать 11 частей концентрата с 86 частями эмульсии.
как решать с процентным содержанием
Смесь, состоящая из частиц растворителя, растворяемого вещества и продуктов их взаимодействия, называется раствором. Это гомогенные структуры однородной консистенции, состоящие из двух либо нескольких компонентов. Решение задач на растворы – определение их концентрации, степени растворимости веществ, условий протекания растворообразующих процессов.
Задачи на растворы по химии
Чистое вещество либо смесь нескольких компонентов, попадая в растворитель, могут проявлять свойства:
- хорошей растворимости;
- малой растворимости;
- быть нерастворимыми.
При растворении в воде образуются многочисленные атомно-молекулярные связи. Их количество зависит от коэффициента растворимости – химической величины, которая рассчитывается путем деления массы растворяемого вещества на массу растворителя.
Кроме этого, в задачах могут присутствовать массовая доля вещества, растворенного в соответствующем растворителе.
Как решать задачи с процентными растворами
Растворы с выраженной концентрацией активного (растворенного) вещества носят название процентных. В задачах по химии ставятся цели определить содержание массы растворенного вещества, массы образовавшегося либо первоначального раствора, процентного содержания вещества до или после растворения.
Растворы, о которых идет речь в задачах по химии, обладают общими свойствами:
- они однородны;
- смешивание компонентов происходит за малый отрезок времени, как и изменение их концентрации;
- в результате смешивания двух (или более) растворов с различной концентрацией, происходит не только увеличение общей массы и объема раствора, но и усреднение процентного содержания растворенного вещества.
Поэтому существуют общие принципы их решения. Так, увеличение концентрации происходит в результате упаривания (испарения растворителя), а уменьшение – разбавления. В результате смешения может наблюдаться как увеличение, так и уменьшение, в зависимости от конкретных условий задачи.
В любом случае характеристики начального и конечного продуктов будут различаться, поэтому важно, данные в условии сведения не перепутать. Для этого применяется их нумерация.
Чтобы грамотно составить алгоритм решения, часто бывает полезно использовать уравнение химической реакции относительно активного вещества либо кислоты.
Концентрация растворов и способы ее выражения
Источник: thepresentation.ruНа бытовом уровне понятие концентрации раствора выражается в отношении массы растворенного вещества к массе раствора, выраженном в процентах. Однако правомерно более широкое определение, охватывающее различные способы выражения концентрации.
Концентрация раствора – количественный показатель состава активного вещества в растворе, выраженное в определенных единицах и заключенное в единице массы или объема. Выражается в долях, процентах, массовых долях, молярности, мольных долях, титрах. Из них чаще применяются молярность и мольная доля.
Выражается в долях, процентах, массовых долях, молярности, мольных долях, титрах. Из них чаще применяются молярность и мольная доля.
1. О массовой доле (\(\omega\)) идет речь в задачах, когда можно составить соотношение масс растворенного компонента и всего раствора. Для ее выражения существует формула:
\(\omega=M_{в-ва}\div M_{р-ра}\)
Выражается она в процентах либо долевых частях единицы.
2. Молярность (по-другому – молярная концентрация) или \(С\) показывает сколько молей растворяемого компонента содержится в литре раствора. Ее формула имеет вид:
\(С=n\div V\)
где \(n\) – это растворенное вещество в молях. Исходя из его значения, раствор может быть одномолярным (содержит 1 моль в 1 литре), децимолярным (0,1 моля в 1 л), сантимолярным (0,01 моль) и т.д.
3. Концентрация моляльная (обозначается \(С_х\)) – моляльность – показатель количества (n) молей растворенного компонента в 1 кг растворителя (\(M_{р-ля}\)).
\(C_x=n\div M_{р-ля}\)
4. Для определения содержания (в граммах) вещества в 1 л раствора применяется понятие «титр» (\(Т\)).
Для определения содержания (в граммах) вещества в 1 л раствора применяется понятие «титр» (\(Т\)).
\(T=M_{в-ва}\div V_{р-ра}\)
5. Под растворимостью (\(S\)) понимают максимальную массу растворяемого вещества, способного раствориться в 100 г растворителя:
\(S=(M_{в-ва}\div M_{р-ля})\times100 {}\)
6. Коэффициент растворимости (\(K_s\)) – показатель, который определяется отношением массы вещества к массе растворителя при условии получения насыщенного раствора при обозначенной температуре:
\(K_s=M_{в-ва}\div M_{р-ля}\)
Решение задач на упаривание растворов
Выпаривание раствора происходит в результате испарения воды, что ведет за собой уменьшение общего объема и массы. В то же время масса растворенного вещества остается без изменений. Существуют случаи, когда, кроме растворителя, испаряется растворенное вещество, если оно обладает повышенной летучестью.
Пример. Водный раствор аммиака
Рассмотрим пример решения задачи на упаривание.
Условие: В наличии 800 г раствора с 15%-ной концентрацией определенного вещества. Нужно увеличить его массовую долю на 5%. Сколько г воды должно испариться?
Этапы решения:
- Какова масса вещества в первичном растворе?
\(M_в=\omega_в\times M_р=0,15×800=120\)г, где \(M_в\) — масса вещества, \(M_р\) — масса раствора
Найденное значение останется постоянным, поскольку при выпаривании изменения массы растворенного вещества не происходит. Значит M’=120г
2. \(M_р=M_в\div\omega_в= 120÷0.2=600\)г
3. Теперь можно найти массу испаренной воды:
\(M{исп\;в}=M_р-M’=800-600=200\)г
Решение задач на разбавление растворов
В результате процесса разбавления масса того вещества, которое растворено, не меняется в отличие от массы всего раствора и растворителя.
Задача
Масса имеющегося раствора NaCl 200г, его концентрация – 15%. К раствору добавлено 40г воды. Определить массовую долю NaCl в конце реакции.
Решение
1. Определение массы раствора в конце процесса:
\(M’=M_{р-ра}+M_{добh3O}=240\)г
2. Определение массы NaCl в начале процесса:
\(M_{NaCl}=(\omega_{NaCl}\times M_р)\div100\%=15\%\times200г\div100\%=30 {}\)г
В конечном растворе \(M’_ {NaCl}=M_{NaCl}\)
3. Определение массовой доли NaCl в конце процесса:
\(\omega’_{NaCl}=M_{NaCl}\div M’_р\times100\%=12,5\%\)
Решение задач на концентрирование растворов
Повышение концентрации происходит при добавлении вещества в раствор. При этом конечная масса растворенного вещества равна сумме первоначального содержимого и того, который добавлен.
Задача. Имеется 180 г раствора с 8%-ной концентрацией соли (формула NaCl). В этот раствор всыпали еще 20 г поваренной соли. Какая массовая доля NaCl получилась в конце реакции?
Источник: cf2.ppt-online.orgРешение
1. Определение окончательной массы раствора:
\(M’_р=M_р+M_{доб}=200\)г
2. Определение конечной массы NaCl:
Определение конечной массы NaCl:
M’=M+Mдоб
Следовательно, нужно найти \(M\) – массу в начале процесса.
\(M=(\omega_{NaCl}\times M_р)÷100%=14,4\)г
Тогда \(M’=14,4г+20г=34,4\)г
3. Определение массовой доли NaCl в конечном продукте:
\(\omega’=M’_{NaCl}\div M’_р\times100\%=17,2%\)
Решение задач на смешение растворов
Источник: image.slidesharecdn.comСмешение растворов с различной концентрацией растворенного вещества происходит с соблюдением «конверта Пирсона». Это – диагональная модель, при которой нельзя складывать массовые доли, а можно – лишь массы растворенных компонентов и растворов.
Задача
Дано два раствора с массами \(M\) и \(M_1\). Массовые доли растворенного вещества обозначим соответственно \(ω\) и \(ω_1\). В конечном продукте аналогичная величина – \(ω_3\). Необходимо приготовить третий раствор с отличной от имеющихся концентраций.
Решение
1. Определение общей массы растворенного вещества:
Определение общей массы растворенного вещества:
\(M_1\omega_1+M_2\omega_2=\omega_3(M_1+M_2)\)
2. Математические действия:
\(M_1(\omega_1-\omega_3)=M_2=(\omega_3-\omega_2)\)
\(M_1\div M_2=(\omega_3-\omega_2)\div(\omega_1-\omega_3)\)
Следовательно, согласно этому математическому выражению, и нужно взять соотношение растворов.
Задачи на определение процентной концентрации раствора
Источник: lh4.googleusercontent.comЗадача 1
Какая процентная концентрация раствора \(KNO_3\), если нормальная равна \(0,2\) моль/л. Плотность равна \(1\) г/мл.
Решение:
1. Определение массы раствора объемом \(1000\) мл:
\(M=\rho\times V=1\times1000=1000\)г
2. Составление и решение следующей пропорции:
\(20,0\)г \(KNO_3\) — \(1000\) г раствора
\(Х_г\) — \(100\) г раствора
\(Х=2,02\) г или \(ω=2,02%\)
Задача 2
Нужно приготовить \(300\) г 25%-ного раствора соли, имея 60%-ный и 10%-ный. Сколько нужно взять таких компонентов (m1 и m2)?
Сколько нужно взять таких компонентов (m1 и m2)?
Для решения применим правило Креста:
Источник: him.1sept.ru1. Определение веса одной из 50-ти частей образуемого раствора:
\(300\div5=6\)
2. Определение массы каждой части \(m_1\) и \(m_2\):
\(m_1=6\times15=90\)
\(m_2=6\times35=210\)
Задача 3
Используя 250г 45%-ного раствора соли, нужно понизить его концентрацию до 10%. Сколько воды необходимо использовать?
Концентрация соли в воде, используемой в качестве добавки, равна 0.
По методу креста образуется 45 частей раствора:
Источник: him.1sept.ruРешение
1. Масса одной части первичного раствора равна: \(250\div10=25\)г
2. Определение массы воды, что необходима: \(25\times35=875\)г
С целью проверки можно выполнить следующие действия:
1. Определение массы конечного продукта-раствора:
\(875+25=1125г\)
2. Для исходного раствора действует пропорция:
В 250г 40%-ного р-ра содержится Хг соли
в 100 г – 45г
Отсюда Х=112,5 г соли
3. Определение конечной концентрации раствора:
Определение конечной концентрации раствора:
1125 г раствора – 112,5 соли
100г – Х
Х=10г или 10%
Следовательно, нужно взять 875 г воды.
Решать задачи на растворы – интересное занятие! Знание основных закономерностей будет полезно с теоретической и практической точек зрения. Однако бывают случаи, когда нужно быстро сдать контрольную либо перепроверить собственные решения. Тогда можно обратиться на сайт ФениксХелп.
Объяснение урока: Молярные концентрации | Nagwa
В этом объяснителе мы узнаем, как рассчитать молярную концентрацию раствора от объема и массы растворителя или моль растворенного растворенный.
Растворы часто используются в химической лаборатории. Решение — это гомогенная смесь, состоящая из одного или нескольких растворенных веществ, растворенных в растворителе. На рисунке ниже показаны четыре раствора красного красителя в воде.
При визуальном осмотре растворов мы можем сказать, что наибольшее количество
красителя было растворено в крайнем левом растворе, и наименьшее количество красителя было
растворяется в крайнем правом растворе. Можно сказать, что самое левое решение
концентрированный, содержащий большое количество растворенного вещества, и самый правый раствор
разбавленный, содержащий небольшое количество растворенного вещества. Условия концентрированный и разбавленный являются качественными и не указывают фактическое количество растворенного вещества, присутствующего в
решение.
Можно сказать, что самое левое решение
концентрированный, содержащий большое количество растворенного вещества, и самый правый раствор
разбавленный, содержащий небольшое количество растворенного вещества. Условия концентрированный и разбавленный являются качественными и не указывают фактическое количество растворенного вещества, присутствующего в
решение.
Существует множество способов выразить количественное количество растворенного вещества в решение. Концентрация раствора показывает количество химического вещества. составляющая (растворенное вещество, ионы или частицы) по отношению к количеству решение. Количество компонента может быть указано в виде массы, количества в моли, объем или количество объектов. Очень часто для суммы раствор выражается в виде массы или объема.
Одним из часто рассчитываемых типов концентрации является
молярная концентрация, также называемая молярностью или количественной концентрацией. Молярность
раствор представляет собой отношение
моль растворенного вещества на
литр раствора. Моляр
концентрацию иногда называют просто концентрацией, хотя
термин концентрация может относиться к другим величинам.
Молярность
раствор представляет собой отношение
моль растворенного вещества на
литр раствора. Моляр
концентрацию иногда называют просто концентрацией, хотя
термин концентрация может относиться к другим величинам.
Определение: Молярность
Молярность – это число моли растворенного вещества на литр раствора. Молярность также называется молярной концентрацией.
Молярность можно рассчитать по уравнению 𝑐=𝑛𝑉 или же 𝑛=𝑐𝑉, где 𝑐 — молярная концентрация, 𝑛 – количество молей растворенного вещества, а 𝑉 — общий объем раствора. единицей 𝑛 должны быть моли, а единицей 𝑉 обычно литров. Единица поэтому молярность будет Молл, моль⋅л -1 , или просто М, читай как «молярный».
Уравнение: Молярность (c)
Для определения молярности раствора можно использовать следующее уравнение:
𝑛=𝑐𝑉,
где 𝑛 — количество растворенного вещества в
родинки,
𝑐 — молярная концентрация обычно в
моль на литр
(моль/л) и
𝑉 — объем раствора, обычно
литров.
Пример 1: расчет молярной концентрации из Родинки и Объем
0,80-литровый раствор содержит 0,40 моль уксусной кислоты. Что это моляр концентрация уксусной кислоты в этом растворе?
Ответ
Молярная концентрация – это особый тип концентрации, определяемый как количество молей растворенного вещества на литр раствора. Его можно рассчитать используя уравнение молярности 𝑛=𝑐𝑉, где 𝑛 — количество растворенного вещества в родинки, 𝑐 это молярная концентрация в моль на литр, 𝑉 — объем раствора в литров.
Мы можем заменить количество уксусной кислоты в родинки и объем решение в литров в уравнение, 0,40=𝑐⋅0,80,мольл и переставить, чтобы решить для молярная концентрация: 0,400,80=𝑐0,5/=𝑐.моль/моль/л
Единицы моль/л и
M может использоваться взаимозаменяемо при сообщении
молярная концентрация. Молярная концентрация уксусной кислоты в
раствор 0,5 моль/л или
0,5 М.
Молярная концентрация уксусной кислоты в
раствор 0,5 моль/л или
0,5 М.
При использовании уравнения молярности может потребоваться преобразование между массой и моли или между различными единицами объема. Мы можем преобразовать между массой и родинки используя следующее уравнение: 𝑛=𝑚𝑀, где 𝑛 количество в молях, 𝑚 масса в грамм, а 𝑀 — это моляр масса в граммах на моль.
Для преобразования между различными единицами объема важно распознавать следующие отношения: 1000=1=1=1000.mLLdmcm
Пример 2: Расчет концентрации в Грамм на кубический дециметр из массы и объема
Студент растворяет 25 г MgCl2 в воду, чтобы получить раствор объемом 500 см 3 . Какова концентрация раствора в моль на кубический дециметр? Дайте ответ с точностью до 2 знаков после запятой. [Mg = 24 г/моль, Cl = 35,5 г/моль]
Ответ
Концентрация раствора или молярная концентрация представляет собой отношение
количество растворенного вещества в
моль на объем
раствора, и его можно рассчитать по следующему уравнению:
𝑐=𝑛𝑉,
где 𝑐 — молярная концентрация, 𝑛
это количество растворенного вещества в
родинки и
𝑉 – объем раствора.
Количество MgCl2, растворенного вещества, указано в грамм, но должен превратиться в моли. Мы можем выполнить это преобразование, используя следующее уравнение: 𝑛=𝑚𝑀, где 𝑛 — количество в родинки, 𝑚 — масса в граммах, а 𝑀 это молярная масса в грамм на моль.
Молярная масса MgCl2 можно рассчитать, просуммировав среднее молярные массы составляющих атомов: 𝑀=𝑀+(2×𝑀)𝑀=24/+(2×35,5/)𝑀=95/.(MgCl)(Mg)Cl(MgCl)(MgCl)222gmolgmolgmol
Масса, указанная в вопросе и молярную массу можно подставить в уравнение 𝑛=2595/гмоль определить количество MgCl2 в родинки быть 𝑛=0,26316….моль
Объем указан в кубических сантиметрах, но вопрос требует
концентрация в
моль на кубический дециметр. Это означает, что объем в кубических сантиметрах необходимо перевести в
кубических дециметров. Есть
1 000 кубических сантиметров на кубический дециметр.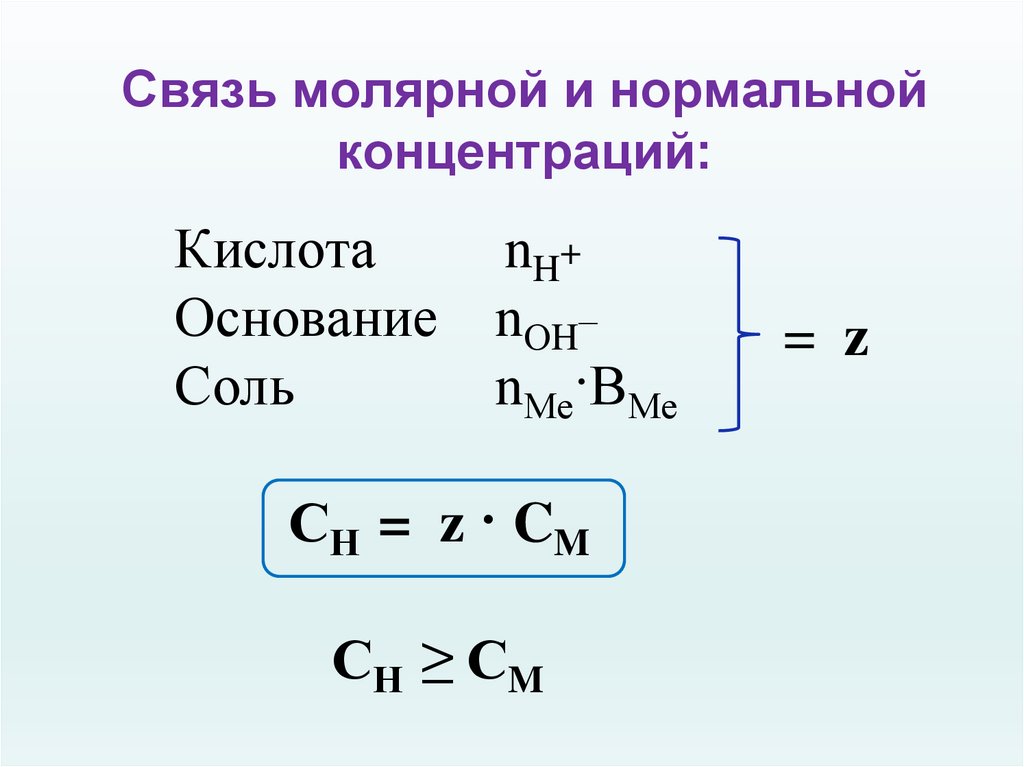 Мы можем умножить объем в кубических сантиметрах на
один кубический дециметр
за 1 см3,
500×11000, смдмсм
определить объем в кубических дециметрах
0,5 дм
Мы можем умножить объем в кубических сантиметрах на
один кубический дециметр
за 1 см3,
500×11000, смдмсм
определить объем в кубических дециметрах
0,5 дм
Затем мы можем подставить количество MgCl2 в родинки и объем раствора в кубических дециметрах в уравнение молярности, 𝑐=0,263160,5, молдм и рассчитать концентрацию раствора 0,52632… моль/дм 3 . Округление нашего ответа до 2 знаков после запятой дает нам концентрацию 0,53 моль/дм 3 .
Пример 3. Расчет массы растворенного вещества, необходимого для приготовления раствора желаемой концентрации и объема
Студент хочет подготовить 0,1 М раствор нитрат серебра (AgNO3) в объемном колба, вмещающая 100 мл воды. Сколько нитрата серебра нужно растворить студенту? Дайте ответ с точностью до 1 знака после запятой. [N = 14 г/моль, О = 16 г/моль, Ag = 108 г/моль]
Ответ
Моляр
(М) — единица молярной
концентрации и может использоваться вместо
моль на литр
(Молл). Уравнение для молярной концентрации:
𝑛=𝑐𝑉,
где 𝑛 — количество растворенного вещества в
родинки,
𝑐 — молярная концентрация обычно в
моль на литр,
а 𝑉 — объем раствора, обычно
литров.
Уравнение для молярной концентрации:
𝑛=𝑐𝑉,
где 𝑛 — количество растворенного вещества в
родинки,
𝑐 — молярная концентрация обычно в
моль на литр,
а 𝑉 — объем раствора, обычно
литров.
Этот вопрос требует от нас определить количество (𝑛) нитрата серебра, растворенное вещество. Указаны молярная концентрация и объем раствора. Тем не менее, объем должен быть преобразован в литров, прежде чем это может быть подставить в уравнение.
В одном 1 000 миллилитров литр. Мы можем умножить объем в миллилитрах на единицу. литр на 1 000 миллилитров, 100×11000=𝑉, млLмл определить объем в литрах 0,1 л
Затем мы можем заменить концентрацию раствора и объем решение в литров в уравнение концентрации, 𝑛=0,1/⋅0,1,мольLL определить необходимое количество азотнокислого серебра. 𝑛=0,01.моль
Студент не может измерить
моль вещества в
лаборатория. Таким образом, нам нужно будет преобразовать количество серебра
нитрат в
родинки
грамм. Можно использовать следующее уравнение:
𝑛=𝑚𝑀,
где 𝑛 — количество в молях,
𝑚 — масса в граммах,
и 𝑀 это
молярная масса в
грамм на моль.
Таким образом, нам нужно будет преобразовать количество серебра
нитрат в
родинки
грамм. Можно использовать следующее уравнение:
𝑛=𝑚𝑀,
где 𝑛 — количество в молях,
𝑚 — масса в граммах,
и 𝑀 это
молярная масса в
грамм на моль.
Молярная масса нитрата серебра может быть рассчитывается путем суммирования среднего молярные массы составляющих атомов: 𝑀=𝑀+𝑀+(3×𝑀)𝑀=108/+14/+(3×16/)𝑀=170/.(AgNO)(Ag)(N)(O)(AgNO)(AgNO)333гмолгмолгмолгмоль
Затем мы можем подставить сумму в родинки и молярную массу в уравнение 0,01=𝑚170/мольгмоль и переставить, чтобы найти массу нитрата серебра в грамм: 170/×0,01=𝑚1,7=𝑚.gmolmolg
Студент должен будет раствориться 1,7 грамма нитрат серебра для производства 100 мл 0,1 М раствор нитрат серебра.
Как и молярная концентрация, мы также можем выразить состав раствора
как массовая концентрация, где 𝑛 в уравнениях
𝑐=𝑛𝑉
а также
𝑛=𝑐𝑉
представляет количество растворенного вещества в
грамм вместо
родинки.
Пример 4: Расчет массы на объем из Моли на объем
Какова массовая концентрация хлороводорода в 2,0 М соляная кислота? Дайте ответ до ближайшего целого числа. [H = 1 г/моль, Cl = 35,5 г/моль]
Ответ
Молярный (М) — единица молярной концентрации и может использоваться вместо моль на литр (Молл). Уравнение для молярная концентрация может быть выражена как 𝑐=𝑛𝑉, где 𝑛 — количество растворенного вещества в родинки, 𝑐 – молярная концентрация в моль на литр, 𝑉 — объем раствора в литров.
Если молярная концентрация раствора 2,0 моль/л, мы можем выразить эту концентрацию в виде следующей дроби: 𝑐=2.01.molL
Это говорит нам о том, что мы можем считать 𝑛 равным 2,0 моля и 𝑉 будет 1 литр.
Вопрос просит нас определить массовую концентрацию водорода
хлорида (HCl) в этом растворе. Уравнение для массовой концентрации
то же, что и уравнение для молярной концентрации, за исключением 𝑛
должно быть в граммах.
Уравнение для массовой концентрации
то же, что и уравнение для молярной концентрации, за исключением 𝑛
должно быть в граммах.
Мы можем преобразовать 2,0 моля хлороводорода в грамм водорода хлорида по следующему уравнению: 𝑛=𝑚𝑀, где 𝑛 — количество в родинки, 𝑚 — масса в граммах, а 𝑀 – молярная масса в грамм на моль.
Молярная масса водорода хлорид может быть рассчитан путем суммирования среднего молярные массы составляющих атомов: 𝑀=𝑀+𝑀𝑀=1/+35,5/𝑀=36,5/.(HCl)(H)(Cl)(HCl)(HCl)гмольгмольгмоль
Затем мы можем подставить количество хлористого водорода в родинки и молярную массу в уравнение 2,0=𝑚36,5/мольгмоль и переставить, чтобы найти массу хлористого водорода: 36,5/×2,0=𝑚73=𝑚.гмольмольг
Масса хлористого водорода в каждом
литр раствора это
73 грамма. Мы можем
подставьте количество в граммах и объем
1 литр
в уравнение концентрации,
𝑐=731,гЛ
определить массовую концентрацию раствора,
𝑐=73/. gL
gL
Массовая концентрация хлороводорода в 2,0 М соляная кислота 73 г/л.
Изменение количества растворенного вещества, объема растворителя или общего объема раствора изменит концентрацию. Рассмотрим раствор глюкозы (CHO6126) в воде.
Если к этому раствору добавить больше глюкозы, но общий объем останется постоянным, растворенного вещества будет больше в том же объеме, что и исходный решение. Таким образом, концентрация увеличится.
Мы также можем увидеть этот эффект, взглянув на уравнение концентрации: 𝑐=𝑛𝑉.
Добавление большего количества растворенного вещества увеличит значение 𝑛. В уравнение, увеличение значения числителя увеличит результирующее отвечать. Таким образом, увеличение количества растворенного вещества в растворе приведет к увеличению концентрация.
Теперь давайте рассмотрим, что произойдет, если к исходному раствору добавить больше воды.
решение. Количество молекул глюкозы останется прежним, но
молекулы будут распределяться по большему общему объему. Таким образом, концентрация
уменьшится.
Таким образом, концентрация
уменьшится.
Мы также можем увидеть этот эффект, взглянув на уравнение концентрации: 𝑐=𝑛𝑉.
Добавление большего количества растворителя увеличит общий объем раствора, 𝑉. В уравнения, увеличение значения знаменателя приведет к уменьшению результирующего отвечать. Таким образом, увеличение количества растворителя в растворе приведет к уменьшению концентрация.
Пример 5. Определение влияния увеличения концентрации растворенного вещества и растворителя на концентрацию раствора
1 М раствор CuSO4 получают растворением 159,5 г CuSO4 в воде для получения 1 литр решения. [O = 16 г/моль, S = 32 г/моль, Cu = 63,5 г/моль]
- Что произойдет с концентрацией, если количество воды
увеличился настолько, что общий объем раствора увеличился вдвое?
- Концентрация останется прежней.

- Концентрация удвоится.
- Концентрация уменьшится вдвое.
- Концентрация останется прежней.
- Что произойдет с концентрацией, если количество
CuSO4 используется для
приготовление раствора было удвоено?
- Концентрация останется прежней.
- Концентрация уменьшится вдвое.
- Концентрация удвоится.
Ответ
Часть 1
В этом растворе растворителем является вода. При увеличении количества растворителя частицы растворенного вещества смогут распространяться дальше. Меньше растворенных частиц в том же объеме указывает на то, что концентрация уменьшится. Мы можем количественно подтверждают это предположение.
Коренной зуб
(М) — единица молярной
концентрации и может использоваться вместо
моль на литр
(Молл). Уравнение для молярной концентрации может быть выражено как
𝑐=𝑛𝑉,
где 𝑐 — молярная концентрация обычно в
моль на литр,
𝑛 — количество растворенного вещества в молях, а 𝑉 —
объем раствора обычно в
литров. Количество
растворенное вещество CuSO4 указывается в граммах, но его необходимо преобразовать в
родинки.
Количество
растворенное вещество CuSO4 указывается в граммах, но его необходимо преобразовать в
родинки.
Мы можем превратить 159,5 г сульфата меди(II) в родинки через следующие уравнение: 𝑛=𝑚𝑀, где 𝑛 — количество в молях, 𝑚 — масса в граммах, и 𝑀 это молярная масса в граммах на моль.
Молярная масса сульфата меди(II) может быть рассчитана путем суммирования среднего молярные массы составляющих атомов: 𝑀=𝑀+𝑀+(4×𝑀)𝑀=63,5/+32/+(4×16/)𝑀=159,5/.(CuSO)(Cu)(S)(O)(CuSO)(CuSO)444гмольгмолгмолгмоль
Тогда мы можем подставить массу сульфата меди(II) и молярная масса в уравнение 𝑛=159,5159,5/ггмоль и найти количество сульфата меди(II) в родинки: 𝑛=1.mol
Общий объем раствора удвоился по сравнению с от 1 литра до 2 литра. Мы можем заменить количество растворенного вещества в родинки и новый объем раствора в уравнение концентрации, 𝑐=12,мольл определить новую концентрацию раствора, 𝑐=0,5/моль
Исходная концентрация была
1 М. Добавляя
добавление воды и удвоение общего объема раствора,
концентрация уменьшилась вдвое до 0,5 М. Правильный ответ ответ
выбор C.
Добавляя
добавление воды и удвоение общего объема раствора,
концентрация уменьшилась вдвое до 0,5 М. Правильный ответ ответ
выбор C.
Часть 2
CuSO4 является растворенным веществом в этом растворе. Удвоив растворенное вещество, в новом растворе будет в два раза больше растворенных частиц как было в исходном решении. Это соответствует увеличение концентрации. Мы можем количественно подтвердить это предположение.
Мы снова воспользуемся уравнением 𝑐=𝑛𝑉.
Общий объем раствора все равно будет
1 литр. Однако,
масса растворенного в растворе сульфата меди(II) равна
удвоился до 319 граммов. Мы можем превратить 319 граммов сульфата меди(II) в
родинки через
следующее уравнение:
𝑛=𝑚𝑀,
где 𝑛 — количество в
родинки,
𝑚 — масса в граммах, а
𝑀 это
молярная масса в
грамм на моль. Молярная масса сульфата меди (II) равна
1590,5 г/моль в виде
рассчитано в части 1.
Молярная масса сульфата меди (II) равна
1590,5 г/моль в виде
рассчитано в части 1.
Можно заменить массу сульфата меди(II) и молярная масса в уравнение 𝑛=319159,5/ггмоль и найти количество сульфата меди(II) в родинки: 𝑛=2.mol
Затем мы можем подставить новое количество растворенного вещества в родинки и объем раствора в уравнение концентрации, 𝑐=21,мольл определить новую концентрацию раствора, 𝑐=2/.моль
Исходная концентрация составляла 1 М. При удвоении растворенного вещества концентрация удваивалась до 2 M. Правильный ответ – вариант ответа C.
Молярная концентрация чаще всего используется в химии
лаборатория. Однако, когда мы хотим узнать состав
решение, в котором задействованы изменения температуры, мы не можем использовать
молярность. Вместо этого мы сообщаем состав, используя моляльность (𝑚). Моляльность раствора – это отношение
родинки
растворенного вещества на килограмм растворителя.
Определение: моляльность (𝑚)
моляльность – это число родинки растворенного вещества на килограмм растворителя.
Уравнение: моляльность (𝑚)
Для определения моляльности раствора можно использовать следующее уравнение: 𝑚=𝑛,м где 𝑚 — моляльность, 𝑛 — количество растворенного вещества в родинки, m – масса растворителя в килограммы.
Поскольку моляльность рассчитывается путем деления количества растворенного вещества на родинки масса растворителя в килограммах, поэтому единица моляльности будет моль/кг, моль⋅кг −1 , или просто 𝑚, читается как «моляль».
Мы можем рассчитать моляльность раствора, полученного путем растворения
28 г калия
гидроксид (KOH) в
250 г воды. Моляльность раствора можно рассчитать, используя
𝑚=𝑛,м
где 𝑚 — моляльность, 𝑛 — количество растворенного вещества в
родинки,
m – масса растворителя в
килограммы.
Сначала нам нужно рассчитать количество молей гидроксида калия, используя уравнение 𝑛=𝑚𝑀, где 𝑛 — количество в родинки, 𝑚 — масса в граммах, а 𝑀 это молярная масса в грамм на моль.
Молярная масса гидроксида калия может быть рассчитана путем суммирования средние молярные массы составляющих атомов: 𝑀=𝑀+𝑀+𝑀𝑀=39/+16/+1/𝑀=56/.(KOH)(K)(O)(H)(KOH)(KOH)gmolgmolgmolgmol
Затем мы можем заменить массу калия гидроксид и молярная масса в уравнение 𝑛=2856/гмоль и найти количество гидроксида калия в родинки: 𝑛=0.5.mol
Далее нам нужна масса растворителя, не забывая переводить единицы измерения в килограммы: 250×11000=0,25.гкгггкг
Теперь мы можем рассчитать моляльность раствора: 𝑚=𝑛𝑚=0,50,25 ммолькг
Таким образом, моляльность раствора равна 2 моль/кг.
Ключевые моменты
- Концентрация раствора – это отношение количества
компонента на количество раствора.

- Молярная концентрация – это отношение количества растворенного вещества в родинки на объем раствора в литрах.
- Уравнение для молярной концентрации: 𝑛=𝑐𝑉, где 𝑛 — количество растворенного вещества в моли, 𝑐 — молярная концентрация, а 𝑉 — объем раствора в литрах.
- Мы можем преобразовать единицы объема, используя следующие отношения: 1000=1=1=1000.mLLdmcm
- Увеличение количества растворенного вещества увеличивает концентрацию, при увеличении количества растворителя снижается концентрация.
- Моляльность (𝑚) определяется как количество родинки растворенного вещества на килограмм растворителя, и он используется для представления состав раствора при изменении температуры.
Как рассчитать молярную концентрацию раствора | Часто задаваемые вопросы
Единица молярной концентрации [моль/л (М)] традиционно широко используется в качестве метода концентрации. Это количество молей целевого вещества (растворенного вещества), растворенного в 1 л раствора. Вот как рассчитать концентрацию.
Это количество молей целевого вещества (растворенного вещества), растворенного в 1 л раствора. Вот как рассчитать концентрацию.
(Масса 1 л раствора) x (чистота) ÷ молекулярная масса
[Удельная плотность раствора (г/мл) x 1000 (мл) x чистота (вес/вес %) /100 ÷ молекулярная масса]
Например, рассчитаем молярную концентрацию 2-меркаптоэтанола (HSCH 2 CH 2 OH). Необходимая информация следующая.
- Удельный вес (или плотность) = 1,114 г/мл
- Чистота (или содержание) = 100 мас.% (предполагаемая)
- Молекулярная масса = 78,13
Рассчитав это значение, применив это значение к приведенному выше уравнению, вы можете узнать молярную концентрацию.
1,114 г/мл x 1000 мл x 100 мас./мас.%/100 ÷ 78,13 = 14,26 моль/л
Чтобы рассчитать концентрацию, как указано выше, необходимо знать три точки «удельный вес (или плотность)», «чистота (или содержание)» и «молекулярный вес». В таблице ниже приведена краткая справочная таблица общих концентраций кислот и оснований. В кислоте и щелочи используется «нейтрализационное титрование», часто используется «нормальность (N)».
В кислоте и щелочи используется «нейтрализационное титрование», часто используется «нормальность (N)».
【Краткая справочная таблица общих концентраций кислот и оснований】
| Соединение | Молекулярная формула | Молекулярная масса | Чистота (мас./мас.%) | Удельный вес (20℃) | Концентрация (моль/л) | Эквивалент | Нормальный (N) |
|---|---|---|---|---|---|---|---|
| Соляная кислота | HCl | 36,46 | 20% | 1,10 | 6,0 | 1 | 6,0 |
| 35% | 1,17 | 11,2 | 11,2 | ||||
| Азотная кислота | HNO 3 | 63.01 | 60% | 1,37 | 13,0 | 1 | 13,0 |
| 65% | 1,39 | 14,3 | 14,3 | ||||
| 70% | 1,41 | 15,7 | 15,7 | ||||
| Сульфат | H 2 SO 4 | 98. 08 08 | 100% | 1,83 | 18,7 | 2 | 37,3 |
| Фосфорная кислота | H 3 Заказ на покупку 4 | 98.00 | 85% | 1,69 | 14,7 | 3 | 44,0 |
| 90% | 1,75 | 16,1 | 48,2 | ||||
| Ацетат | СН 3 СООН | 60,05 | 100% | 1,05 | 17,5 | 1 | 17,5 |
| Хлорная кислота | HClO 4 | 100,46 | 60% | 1,54 | 9,2 | 1 | 9,2 |
| 70% | 1,67 | 11,6 | 11,6 | ||||
| Вода с перекисью водорода | Н 2 О 2 | 34. 01 01 | 30% | 1.11 | 9,8 | — | |
| 35% | 1,13 | 11,6 | |||||
| Аммиачная вода | НХ 3 | 17.03 | 25% | 0,91 | 13,4 | 1 | 13,4 |
| 28% | 0,90 | 14,8 | 14,8 | ||||
【Краткий справочник по концентрации и единицам】
●Как выразить концентрацию раствора
| Выражение | Комментарий |
|---|---|
| Массовая концентрация | «г числа» растворенного вещества в 100 г раствора. Во многих случаях выражается как мас./мас.%, мас.% и % для плотности. |
| Объемная концентрация в процентах | «число m» растворенного вещества в 100 m раствора. Выражается как об./об.%, когда смесь или растворенное вещество являются жидкими. |
| Масса по сравнению с объемной процентной концентрацией | «г количество растворенного вещества в 100м раствора. Выражено в мас./об.%. |
| Нормальность | г эквивалентного количества растворенного вещества в 1 л раствора. Выражается как N для анализа емкости. |
| Объемная удельная концентрация | Концентрация косвенно выражается объемной долей разбавляемого жидкого реагента. Он используется в JIS и других. Пример: Серная кислота (1 + 2) → Серная кислота показана разбавленной 2 объемами воды. |
| Массовое соотношение концентрации | Концентрация, косвенно выраженная весовым соотношением, при котором растворяется твердый реагент. Он используется в JIS и других. Пример: хлорид натрия (1 + 19) → Растворяют в 19 весовых частях воды по отношению к 1 NaCl. |
| Молярность | Молярное число целевого вещества (растворенного вещества) в 1 л раствора. Выражается в моль/или М. Выражается в моль/или М. |
● Префикс, представляющий несколько
| Экспресс-величина | Экспресс малость | |||
|---|---|---|---|---|
| 100 =10 2 | ч (гекто) | 1/100 =10 -2 | с (Сенти) | %(Проценты) |
| 1000 =10 3 | к(Килограмм) | 1/1000 =10 -3 | м (Милли) | ‰(Пермили) |
| 100 дюймов =10 6 | М (Мега) | 1/100″ =10 -6 | мк(Микро) | частей на миллион |
| 1 миллиард =10 9 | Г(Гига) | 1/10 миллиардов =10 -9 | н (нано) | частей на миллиард |
| 1 триллион =10 12 | Т (Тера) | 1/1 триллион =10 -12 | р(Пико) | п. п. п. |
| 1000 трлн = 10 15 | стр (Петта) | 1/1000 трлн =10 -15 | ф (фемто) | мг/кг |
●ppmТаблица преобразования
| ppb | частей на миллион | % | мг/г | мг/л |
|---|---|---|---|---|
| 1000 | 1 | 0,0001 | 0,001 | 1 |
| 10 000 | 10 | 0,001 | 0,01 | 10 |
| 100 000 | 100 | 0,01 | 0,1 | 100 |
| 1 000 000 | 1000 | 0,1 | 1 | 1000 |
| 10 000 000 | 10 000 | 1 | 10 | 10 000 |
Расчет молярности растворов Учебник по химии
Расчет молярности растворов Учебник по химииКлючевые понятия
⚛ Концентрация раствора относится к количеству растворенного вещества, растворенного в данном растворителе для приготовления раствора.
Когда вода является растворителем, за формулой растворенного вещества сразу следует буква aq, заключенная в круглые скобки (aq).
| term | description | example |
|---|---|---|
| solute | substance that dissolves | solid sodium chloride, NaCl(s) |
| solvent | substance that enables solute to dissolve | liquid water, H 2 O(l) |
| раствор | гомогенная смесь растворенного вещества, растворенного в растворителе | хлорид натрия, растворенный в воде, NaCl(aq) |
⚛ Концентрация раствора может быть указана в молях растворенного вещества на литр раствора (моль л -1 или моль/л или M) или в молях растворенного вещества на кубический дециметр раствора (моль дм -3 или моль/дм 3 ) (1)
| растворенное вещество | раствор | ||
|---|---|---|---|
| единицы измерения (символ) | моль (моль) | моль на литр (моль л -1 или моль/л или М) | |
| единиц измерения (символ) | моль (моль) | моль на кубический дециметр (02 | моль на кубический дециметр 3 или моль/дм 3 ) |
⚛ Молярность – это термин, используемый для описания концентрации, выраженной в молях на литр.
Альтернативные названия молярности:
· величина концентрации вещества (предпочтительный термин ИЮПАК)
· концентрация количества
· молярная концентрация
⚛ Величина концентрации вещества, молярность, выражена в единицах моль л -1 (или моль/л или М) или эквивалентных единицах СИ моль дм -3 (моль/дм 3 )
⚛ Величина концентрации вещества, молярность, концентрация раствора в моль/л, моль л -1 , моль дм -3 или моль/дм 3 , обозначается символом c (иногда М ).
Для 0,01 моль л раствора -1 HCl (водн.) можно написать:
(i) [HCl (водн.) ] = 0,01 моль л -1 = 0,01 моль дм -3 = 0,01 М
(сумма концентрации, заключенная в квадратных скобках вокруг формулы сольватированного растворенного вещества)
(ii) c (HCl (водн.) ) = 0,01 моль л -1 = 0,01 моль дм -3 = 0,01 М
( c означает концентрацию количества, формула сольватированного растворенного вещества указана в круглых скобках или скобках)
⚛ Математическое уравнение (формула или выражение) для расчета молярности раствора (концентрация в моль л -1 ) составляет
в = n ÷ В
c = концентрация раствора в моль л -1 (моль/л или M)
n = количество растворяемого вещества (моль растворенного вещества)
V = объем раствора в литрах (л) или кубических дециметрах (дм 3 )
⚛ Это уравнение (формула или выражение) можно изменить, чтобы найти:
(i) моль растворенного вещества с учетом молярности и объема раствора:
n = c × В
(ii) объем раствора с учетом молей растворенного вещества и молярности:
В = п ÷ в
Пожалуйста, не блокируйте рекламу на этом сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Молярность, величина концентрации вещества, Понятия
Величина концентрации вещества, молярность, – это термин, обозначающий концентрации растворов, выраженные в единицах моль на литр (моль л -1 или моль/л или М) или в единицах СИ, молях на кубический дециметр ( моль дм -3 или моль/дм 3 ).
| Рассмотрим схему справа. Черный ящик представляет собой контейнер объемом 1 литр или контейнер объемом 1 кубический дециметр . Белое пространство в рамке представляет собой объем, занимаемый растворителем. Каждый синий X представляет собой 1 моль молекул сахара. Сколько молей молекул сахара находится в этом сосуде? 1 моль Величина концентрации вещества или молярность, концентрация раствора в единицах моль л -1 или моль дм -3 говорит нам о количестве растворенного вещества (моль растворенного вещества), присутствующего в 1 л или 1 дм 3 р-ра. Какова концентрация молекул сахара в растворе? концентрация раствора сахара = моли сахара ÷ объем раствора (в л или дм 3 ) |
| Рассмотрим схему справа. Красная коробка представляет собой контейнер объемом 0,5 литра или контейнер объемом 0,5 кубических дециметра . Белое пространство в рамке представляет собой объем, занимаемый растворителем. Каждый синий X представляет собой 1 моль молекул сахара. Сколько молей молекул сахара находится в этом сосуде? 1 моль Какова концентрация молекул сахара в растворе? Величина концентрации вещества или молярность, концентрация раствора в единицах моль л -1 или моль дм -3 , говорит нам, сколько молей растворенного вещества содержится в 1 л раствора или в 1 дм 3 раствора. количество концентрация раствора сахара = моль сахара ÷ объем раствора (в л или дм 3 ) Мы можем проверить это уравнение для нашего примера: |
↪ Наверх
Уравнение молярности (уравнение концентрации вещества)
Величина концентрации вещества или молярность раствора определяется уравнением:
| с | = | н В |
c = количество концентрация (молярность) в моль л -1 (или моль дм -3 )
n = количество растворенного вещества в молях
В = объем раствора в л (или дм 3 )
Обратите внимание, что мы часто используем квадратные скобки вокруг формул сольватированных частиц, чтобы указать молярность раствора (концентрация раствора в моль л -1 ):
например, водный раствор хлорида натрия NaCl (водн. ) с молярностью 0,154 моль л -1 (или 0,154 моль дм -3 ) может быть представлен как
) с молярностью 0,154 моль л -1 (или 0,154 моль дм -3 ) может быть представлен как
c (NaCl (водн.) ) = 0,154 моль л -1 = 0,154 моль дм -3
[NaCl (водн.) ] = 0,154 моль л -1 = 0,154 моль дм -3
Если известно количество молей растворенного вещества в растворе и известен объем раствора, можно рассчитать концентрацию раствора в моль л -1 (или моль дм -3 ) используя математическое уравнение c = n ÷ В
Но что, если вы знаете концентрацию раствора в моль л -1 (или моль дм -3 ) и объем раствора в л (или дм 3 ), вы можете вычислить, сколько молей растворенные вещества присутствуют в растворе?
Да! Вам просто нужно изменить уравнение, умножив обе части уравнения на V (объем раствора):
| с × V | = | n × |
| с × В | = | п |
Вы даже можете рассчитать объем раствора, если знаете количество молей растворенного вещества и его концентрацию в моль л -1 (или моль дм -3 ).
Просто переформулируйте приведенное выше уравнение, разделив обе его части на c (концентрация количества или молярность раствора в моль л -1 или в моль дм -3 )
| | = | н в |
| В | = | н в |
В общем, для расчета
(а) величина концентрации вещества (молярность) в моль л -1 (или моль дм -3 ):
в = n ÷ В
(b) количество растворенного вещества в молях:
n = c × В
(c) объем раствора в л (или дм 3 ):
В = n ÷ c
↪ Наверх
Примеры расчета молярности рабочих растворов
Примените следующие 5 шагов, чтобы решить проблемы молярности ниже:
- Шаг 1: Какой вопрос задает вам расчет? (обратите внимание на единицы измерения!)
- Шаг 2.
 Какая информация содержится в вопросе? (извлечь данные из вопроса, включая единицы измерения, и при необходимости преобразовать)
Какая информация содержится в вопросе? (извлечь данные из вопроса, включая единицы измерения, и при необходимости преобразовать) - Шаг 3: Какая связь между тем, что вы знаете, и тем, что вам нужно найти? (напишите математическое уравнение)
- Шаг 4: Подставьте значения в уравнение и решите (проверьте количество значащих цифр)
- Шаг 5: Напишите ответ (укажите единицы измерения!)
(1) Расчет количества концентрации вещества, молярность (
c = n ÷ V )Вопрос: Рассчитайте величину концентрации вещества в моль л -1 (молярность) водного раствора хлорида натрия, содержащего 0,125 моль хлорида натрия в 0,50 л раствора.
Решение:
Шаг 1: Какой вопрос задает вам расчет?
c (NaCl (водн.) ) = молярность (концентрация в моль л -1 ) раствора = ? моль л -1
Шаг 2: Какая информация была дана в вопросе?
Извлечь данные из вопроса
n (NaCl) = моль растворенного вещества = 0,125 моль
V (NaCl (водный) ) = объем раствора = 0,50 л
Шаг 3: Какова связь между тем, что вы знаете, и тем, что вам нужно найти?
Напишите уравнение:
с (NaCl (водн. ) ) = n (NaCl) ÷ V (NaCl (водн.) )
) ) = n (NaCl) ÷ V (NaCl (водн.) )
Шаг 4: Подставьте значения в уравнение молярности и решите:
[NaCl (водн.) ] = c (NaCl (водн.) ) = 0,125 моль ÷ 0,50 л = 0,25 моль л -1 (или 0,25 моль/л или 0,20 М)
4
(Примечание: оправданы только 2 значащие цифры)
Шаг 6: Напишите ответ:
[NaCl (водный) ] = 0,25 моль л -1
(2) Расчет количества растворенного вещества (
n = c × V )Вопрос: Рассчитайте количество молей сульфата меди в 250,00 мл 0,020 моль L -1 раствора сульфата меди, CuSO 4(aq) .
Решение:
Шаг 1: Какой вопрос задает вам расчет?
n (CuSO 4 ) = моли растворенного вещества = ? моль
Шаг 2: Какая информация была дана в вопросе?
Извлечь данные из вопроса:
c (CuSO 4(водн. ) ) = количество концентрация (молярность) раствора = 0,020 моль л -1
) ) = количество концентрация (молярность) раствора = 0,020 моль л -1
V (CuSO 4(водн.) ) = объем раствора.0 = 2
Преобразование объема в мл в объем в л (в 1 л 1000 мл)
В (CuSO 4(водн.) ) = 250,00 мл ÷ 1000 мл /л = 250,00 × 10 -3 л = 0,25000 л
Шаг 3: Какова связь между тем, что вы знаете, и тем, что вам нужно найти?
Напишите уравнение:
n (CuSO 4 ) = c (CuSO 4 (водн.) ) × В (CuSO 4 (водн.) )
Шаг 4: Подставьте значения в уравнение молярности и решите:
n (CuSO 4 ) = 0,020 моль л -1 × 0,25000 л = 0,005000 моль = 0,0050 моль
(Примечание: оправданы только 2 значащие цифры)
Шаг 5: Запишите ответ:
n (CuSO 4 (водн.) ) = 0,0050 моль
(3) Расчет объема раствора (
V = n ÷ c ) Вопрос: Рассчитайте объем в литрах 0,80 моль L -1 водного раствора бромида калия, содержащего 1,60 моль бромида калия.
Решение:
Шаг 1: Какой вопрос задает вам расчет?
V (KBr (водный) ) = объем раствора в литрах = ? Л
Шаг 2: Какая информация была дана в вопросе?
Извлечь данные из вопроса:
n (KBr) = моль растворенного вещества = 1,60 моль
c (KBr (водн.) ) = молярность (концентрация в моль л -1 ) раствора = 0,80 моль л -1
Шаг 3: Какова связь между тем, что вы знаете, и тем, что вам нужно найти?
Напишите уравнение:
V (KBr (водн.) ) = n (KBr) ÷ c (KBr (водн.) )
Шаг 4: Подставьте значения в уравнение и решите:
V (KBr (водн.) ) = 1,60 моль ÷ 0,80 моль л -1 = 2,00 л = 2,0 л
(Примечание: оправданы только 2 значащие цифры)
Шаг 5: Запишите ответ:
В (KBr (водный) ) = 2,0 л
↪ Наверх
Решение задач: Величина концентрации вещества (молярность)
Проблема: Крису Химику дали мерную колбу на 250,00 мл и попросили использовать ее для приготовления водного раствора хлорида натрия, NaCl, с концентрацией 0,100 моль л -1 для эксперимента по коррозии. Хлорид натрия, NaCl, доступен в качестве аналитического реагента, состоящего из белых кристаллов.
Определите массу хлорида натрия в граммах, которую химик Крис должен будет взвесить.
Хлорид натрия, NaCl, доступен в качестве аналитического реагента, состоящего из белых кристаллов.
Определите массу хлорида натрия в граммах, которую химик Крис должен будет взвесить.
Решение проблемы Использование модели StoPGoPS для решения проблемы:
| Сформулируйте вопрос. | Какой вопрос просит вас сделать? Определить (вычислить) массу хлорида натрия в граммах. m (NaCl (s) ) = масса хлорида натрия = ? г | |
| Пауза для планирования. | Какую информацию (данные) вам предоставили?
Каков ваш план решения этой проблемы? Этап 1: Расчет молей NaCl в растворе c (NaCl (водн.) ) = 0,100 моль л -1 Этап 2: Расчет массы NaCl для использования Используйте периодическую таблицу, чтобы найти относительные атомные массы (атомные веса) для Найдите молярную массу M NaCl: Предположим, что используемый NaCl имеет 100% чистоту (без примесей) (4) m (NaCl) = n (NaCl) × M (NaCl) | |
Следуйте плану. | Шаг 1: Рассчитайте количество молей NaCl в растворе c (NaCl (водн.) ) = 0,100 моль л -1 Преобразование объема в мл в объем в л: В (л) = В (мл) ÷ 1000 (мл/л) Предположим, что температура в лаборатории такая же, как температура, необходимая для мерной колбы (например, 25 o C). n (NaCl (s) ) = c (NaCl (водн.) ) × V (NaCl (водн.) ) (Примечание: оправданы 3 значащие цифры) Этап 2: Расчет массы NaCl для использования Используйте периодическую таблицу, чтобы найти относительные атомные массы для М r (Na) = 22,99 Найдите молярную массу, M , NaCl: М (NaCl) = М r (Na) + М r (Cl) Предположим, что NaCl, который будет использоваться, имеет 100% чистоту (без примесей) m (NaCl) = n (NaCl) × M (NaCl) (Примечание: оправданы 3 значащие цифры) | |
Подумайте о правдоподобии. | Вы ответили на заданный вопрос? Да, мы рассчитали массу NaCl (s) , которую необходимо использовать для приготовления раствора. Разумно ли ваше решение вопроса? Давайте проверим, даст ли рассчитанная нами масса NaCl правильную концентрацию: м (NaCl) = 1,46 г n (NaCl) = m (NaCl) ÷ M (NaCl) c (NaCl) = n (NaCl) ÷ V (NaCl (водный) ) 1,46 г NaCl в объеме 250,00 мл составляют 0,100 моль л -1 , поэтому мы уверены, что наше решение верное. | |
Укажите решение. | Какова масса NaCl (s) Химику Крису нужно взвесить? м (NaCl (с) ) = 1,46 г |
↪ Наверх
Образец вопроса: массовая концентрация
Аликвоту 25,00 мл 0,0264 моль л -1 AgNO 3(водн.) добавляют в мерную колбу на 150,00 мл и добавляют дистиллированную воду до тех пор, пока мениск не окажется на отметке, если смотреть на уровне глаз.
Определите массу в граммах AgNO 3 в полученном растворе.
м (AgNO 3 ) = г
↪ Наверх
Сноски:
(1) В химии существует множество других способов измерения концентрации растворов. Некоторые распространенные из них перечислены во вводном руководстве по решениям.
(2) Это важное допущение, поскольку мерная колба откалибрована для удержания указанного объема при заданной температуре. Объем зависит от температуры.
(3) Это важное предположение, потому что, если вода, используемая для приготовления раствора, уже содержит растворенный хлорид натрия, мы не знаем, сколько хлорида натрия уже присутствует.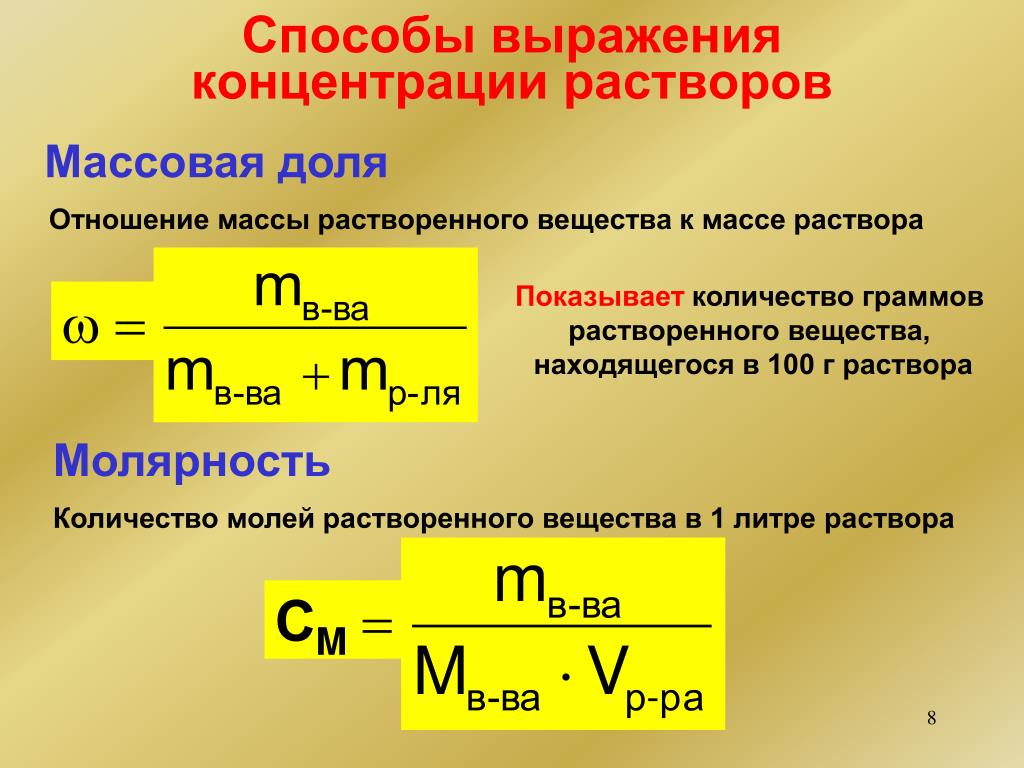 Любой растворенный хлорид натрия в воде увеличит концентрацию хлорида натрия в конечном растворе.
Любой растворенный хлорид натрия в воде увеличит концентрацию хлорида натрия в конечном растворе.
(4) Это важное допущение, потому что, если реагент содержит примеси, часть массы, которую мы взвешиваем, НЕ будет связана с NaCl, и концентрация NaCl на самом деле будет меньше, чем мы думаем.
↪ Наверх
©AUS-e-TUTEwww.ausetute.com.au
6.1: Расчет молярности — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 98778
Навыки разработки
- Описать основные свойства решений
- Расчет концентрации раствора с использованием молярности
- Выполнение расчетов разбавления с использованием уравнения разбавления
В предыдущих разделах мы сосредоточились на составе веществ: образцы вещества, которые содержат только один тип элемента или соединения. Однако смеси — образцы вещества, содержащие физически соединенные два или более вещества, — встречаются в природе чаще, чем чистые вещества. Подобно чистому веществу, относительный состав смеси играет важную роль в определении ее свойств. Относительное количество кислорода в атмосфере планеты определяет ее способность поддерживать аэробную жизнь. Относительное количество железа, углерода, никеля и других элементов в стали (смесь, известная как «сплав») определяет ее физическую прочность и устойчивость к коррозии. Относительное количество активного ингредиента в лекарстве определяет его эффективность в достижении желаемого фармакологического эффекта. Относительное количество сахара в напитке определяет его сладость (рис. \(\PageIndex{1}\)). В этом разделе мы опишем один из наиболее распространенных способов количественной оценки относительного состава смесей.
Однако смеси — образцы вещества, содержащие физически соединенные два или более вещества, — встречаются в природе чаще, чем чистые вещества. Подобно чистому веществу, относительный состав смеси играет важную роль в определении ее свойств. Относительное количество кислорода в атмосфере планеты определяет ее способность поддерживать аэробную жизнь. Относительное количество железа, углерода, никеля и других элементов в стали (смесь, известная как «сплав») определяет ее физическую прочность и устойчивость к коррозии. Относительное количество активного ингредиента в лекарстве определяет его эффективность в достижении желаемого фармакологического эффекта. Относительное количество сахара в напитке определяет его сладость (рис. \(\PageIndex{1}\)). В этом разделе мы опишем один из наиболее распространенных способов количественной оценки относительного состава смесей.
Рисунок \(\PageIndex{1}\): Сахар является одним из многих компонентов сложной смеси, известной как кофе. Количество сахара в данном количестве кофе является важным фактором, определяющим сладость напитка. (кредит: Джейн Уитни)
Количество сахара в данном количестве кофе является важным фактором, определяющим сладость напитка. (кредит: Джейн Уитни)
Решения
Видео \(\PageIndex{1}\): Введение в решения из Crash Course Chemistry.
Ранее мы определили растворы как однородные смеси, что означает, что состав смеси (и, следовательно, ее свойства) однородны по всему ее объему. Решения часто встречаются в природе и также были реализованы во многих формах искусственных технологий. Мы рассмотрим более подробно свойства растворов в главе о растворах и коллоидах, а здесь мы представим некоторые основные свойства растворов.
Относительное количество данного компонента раствора известно как его концентрация. Часто, хотя и не всегда, раствор содержит один компонент с концентрацией, значительно превышающей концентрацию всех остальных компонентов. Этот компонент называется растворителем и может рассматриваться как среда, в которой другие компоненты диспергированы или растворены. Растворы, в которых вода является растворителем, конечно, очень распространены на нашей планете. Раствор, в котором вода является растворителем, называется водным раствором.
Этот компонент называется растворителем и может рассматриваться как среда, в которой другие компоненты диспергированы или растворены. Растворы, в которых вода является растворителем, конечно, очень распространены на нашей планете. Раствор, в котором вода является растворителем, называется водным раствором.
Растворенное вещество представляет собой компонент раствора, который обычно присутствует в гораздо более низкой концентрации, чем растворитель. Концентрации растворенных веществ часто описываются качественными терминами, такими как разбавленный (относительно низкой концентрации) и концентрированный (относительно высокой концентрации).
Видео \(\PageIndex{2}\): Введение в молярность из Crash Course Chemistry.
Концентрации могут быть количественно оценены с использованием широкого набора единиц измерения, каждая из которых удобна для конкретного применения. Молярность ( M ) является полезной единицей концентрации для многих применений в химии. Молярность определяется как количество молей растворенного вещества ровно в 1 литре (1 л) раствора:
Молярность ( M ) является полезной единицей концентрации для многих применений в химии. Молярность определяется как количество молей растворенного вещества ровно в 1 литре (1 л) раствора:
\[M=\mathrm{\dfrac{mol\: растворенное вещество}{L\: раствор}} \label{3.4 .2}\]
Пример \(\PageIndex{1}\): расчет молярных концентраций
Образец безалкогольного напитка объемом 355 мл содержит 0,133 моль сахарозы (столовый сахар). Какова молярная концентрация сахарозы в напитке?
Решение
Поскольку даны молярное количество растворенного вещества и объем раствора, молярность можно рассчитать, используя определение молярности. В соответствии с этим определением объем раствора необходимо преобразовать из мл в л:
.\[\begin{align*} M &=\dfrac{моль\: раствор}}{L\: раствор} \\[5pt] &=\dfrac{0,133\:моль}{355\:мл\times \dfrac {1\:L}{1000\:mL}} \\[5pt] &= 0,375\:M \label{3.4.1} \end{align*}\]
Упражнение \(\PageIndex{1}\)
Чайная ложка столового сахара содержит около 0,01 моль сахарозы. Какова молярность сахарозы, если чайная ложка сахара растворена в чашке чая объемом 200 мл?
Какова молярность сахарозы, если чайная ложка сахара растворена в чашке чая объемом 200 мл?
- Ответить
0,05 М
Пример \(\PageIndex{2}\): получение молей и объемов из молярных концентраций
Сколько сахара (моль) содержится в скромном глотке (~10 мл) безалкогольного напитка из примера \(\PageIndex{1}\)?
Раствор
В этом случае мы можем изменить определение молярности, чтобы выделить искомое количество молей сахара. Затем мы подставляем значение молярности, которое мы получили в примере 3.4.2, 0,375 М :
\[M=\mathrm{\dfrac{mol\: растворенное вещество}{L\: раствор}} \label{3.4.3} \nonumber\]
\[ \begin{align*} \mathrm{mol\: раствор} &= \mathrm{ M\times L\: раствор} \label{3.4.4} \\[5pt] \mathrm{mol\: раствор} &= \mathrm{0,375\:\dfrac{моль\:сахар}}{L}\times\left(10\:mL\times\dfrac{1\:L}{1000\:mL}\right)} &= \mathrm{0,004\:моль\: сахар} \label{3. 4.5} \end{align*} \]
4.5} \end{align*} \]
Упражнение \(\PageIndex{2}\)
Какой объем (мл) подслащенного чая, описанного в примере \(\PageIndex{1}\), содержит такое же количество сахара (моль), что и 10 мл безалкогольного напитка в этом примере?
- Ответить
80 мл
Пример \(\PageIndex{3}\): расчет молярных концентраций по массе растворенного вещества
Дистиллированный белый уксус (Рисунок \(\PageIndex{2}\)) представляет собой раствор уксусной кислоты \(CH_3CO_2H\) в воде. В 0,500 л раствора уксуса содержится 25,2 г уксусной кислоты. Какова концентрация раствора уксусной кислоты в молярных единицах?
Рисунок \(\PageIndex{3}\): Дистиллированный белый уксус представляет собой раствор уксусной кислоты в воде.
Раствор
Как и в предыдущих примерах, определение молярности является основным уравнением, используемым для расчета искомого количества. В этом случае масса растворенного вещества предоставляется вместо его молярного количества, поэтому мы должны использовать молярную массу растворенного вещества, чтобы получить количество растворенного вещества в молях:
В этом случае масса растворенного вещества предоставляется вместо его молярного количества, поэтому мы должны использовать молярную массу растворенного вещества, чтобы получить количество растворенного вещества в молях:
\[\ mathrm {\ mathit M = \ dfrac {моль \: растворенное вещество} {L \: раствор} = \ dfrac {25,2 \: g \: \ ce {Ch4CO2H} \ times \ dfrac {1 \: моль \: \ce{Ch4CO2H}}{60,052\: г\: \ce{Ch4CO2H}}}{0,500\: л\: раствор}=0,839\: \mathit M} \label{3.4.6}\]
\[\mathrm{\mathit M=\dfrac{mol\: растворенное вещество}{L\: раствор}=0,839\:\mathit M} \label{3.4.7}\]
\[M=\mathrm{\dfrac{0,839\:моль\: растворенное вещество}{1,00\:L\: раствор}} \label{3.4.8}\]
Упражнение \(\PageIndex{3}\)
Рассчитайте молярность 6,52 г \(CoCl_2\) (128,9 г/моль), растворенного в водном растворе общим объемом 75,0 мл.
- Ответ
0,674 М
Пример \(\PageIndex{4}\): Определение массы растворенного вещества в заданном объеме раствора
Сколько граммов NaCl содержится в 0,250 л раствора 5,30- М ?
Раствор
Указаны объем и молярность раствора, поэтому количество (моль) растворенного вещества легко вычисляется, как показано в примере \(\PageIndex{3}\):
\[M=\mathrm {\dfrac{моль\: растворенное вещество}{L\: раствор}} \label{3. 4.9}\]
4.9}\]
\[\mathrm{моль\: растворенное вещество = \mathit M\times L\: решение} \label{ 3.4.10}\]
\[\mathrm{моль\: растворенное вещество=5,30\:\dfrac{моль\: NaCl}{L}\times 0,250\:L=1,325\:моль\: NaCl} \label{3.4.11}\]
Наконец, это молярное количество используется для получения массы NaCl: 77,4\:г\: NaCl} \метка{3.4.12}\]
Упражнение \(\PageIndex{4}\)
Сколько граммов \(CaCl_2\) (110,98 г/моль) содержится в 250,0 мл 0,200 М раствора хлорида кальция?
- Ответ
5,55 г \(CaCl_2\)
При пошаговом выполнении вычислений, как в примере \(\PageIndex{3}\), важно не округлять любые промежуточные результаты вычислений, что может привести к ошибкам округления в конечном результате. В примере \(\PageIndex{4}\) молярное количество NaCl, вычисленное на первом шаге, 1,325 моль, было бы должным образом округлено до 1,32 моль, если бы его нужно было сообщить; однако, несмотря на то, что последняя цифра (5) не имеет значения, ее необходимо сохранить в качестве защитной цифры в промежуточных вычислениях. Если бы мы не сохранили эту защитную цифру, окончательный расчет массы NaCl составил бы 77,1 г, т. е. разница в 0,3 г.
Если бы мы не сохранили эту защитную цифру, окончательный расчет массы NaCl составил бы 77,1 г, т. е. разница в 0,3 г.
Помимо сохранения защитной цифры для промежуточных вычислений, мы также можем избежать ошибок округления, выполняя вычисления за один шаг (пример \(\PageIndex{5}\)). Это устраняет промежуточные шаги, так что округляется только окончательный результат.
Пример \(\PageIndex{5}\): определение объема раствора
В примере \(\PageIndex{3}\) мы обнаружили, что типичная концентрация уксуса составляет 0,839 M . В каком объеме уксуса содержится 75,6 г уксусной кислоты?
Раствор
Сначала используйте молярную массу для расчета количества молей уксусной кислоты по заданной массе: }=mol\: растворенное вещество} \label{3.4.13}\]
Затем используйте молярность раствора для расчета объема раствора, содержащего это молярное количество растворенного вещества:
\[\mathrm{mol\: растворенное вещество \times \dfrac{L\: раствор}{моль\: растворенное вещество}=L\: раствор} \label{3. 4.14}\]
4.14}\]
Объединение этих двух шагов в один дает:
\[\mathrm{г\: растворенное вещество\раз \dfrac{моль\: растворенное вещество}{г\: растворенное вещество}\раз \dfrac{L\: раствор}{моль\: растворенное вещество}=L\: раствор} \ label{3.4.15}\]
\[\mathrm{75.6\:g\:\ce{Ch4CO2H}\left(\dfrac{mol\:\ce{Ch4CO2H}}{60.05\:g}\right) \left(\dfrac{L\: раствор}{0,839\:моль\:\ce{Ch4CO2H}}\right)=1,50\:L\: раствор} \label{3.4.16}\]
Упражнение \(\PageIndex{5}\):
Какой объем 1,50 М раствора KBr содержит 66,0 г KBr?
- Ответить
0,370 л
Разведение растворов
Видео \(\PageIndex{3}\): Введение в разведения из Crash Course Chemistry.
Разбавление – это процесс, при котором концентрация раствора уменьшается путем добавления растворителя. Например, можно сказать, что стакан чая со льдом становится все более разбавленным по мере таяния льда. Вода из тающего льда увеличивает объем растворителя (воды) и общий объем раствора (чая со льдом), тем самым снижая относительную концентрацию растворенных веществ, придающих напитку его вкус (рис. \(\PageIndex{2} \)).
Например, можно сказать, что стакан чая со льдом становится все более разбавленным по мере таяния льда. Вода из тающего льда увеличивает объем растворителя (воды) и общий объем раствора (чая со льдом), тем самым снижая относительную концентрацию растворенных веществ, придающих напитку его вкус (рис. \(\PageIndex{2} \)).
Рисунок \(\PageIndex{2}\): Оба раствора содержат одинаковую массу нитрата меди. Раствор справа более разбавлен, потому что нитрат меди растворен в большем количестве растворителя. (кредит: Марк Отт).
Разбавление также является распространенным способом приготовления растворов желаемой концентрации. Добавляя растворитель к отмеренной порции более концентрированного маточного раствора , мы можем добиться определенной концентрации. Например, коммерческие пестициды обычно продаются в виде растворов, в которых концентрация активных ингредиентов намного выше, чем это необходимо для их применения. Прежде чем их можно будет использовать на сельскохозяйственных культурах, пестициды должны быть разбавлены. Это также очень распространенная практика приготовления ряда обычных лабораторных реагентов.
Это также очень распространенная практика приготовления ряда обычных лабораторных реагентов.
Можно использовать простое математическое соотношение для соотношения объемов и концентраций раствора до и после процесса разбавления. Согласно определению молярности, молярное количество растворенного вещества в растворе равно произведению молярности раствора на его объем в литрах:
\[n=ML\]
Подобные выражения можно записать для раствора до и после разведения:
\[n_1=M_1L_1\]
\[n_2=M_2L_2\]
, где индексы «1» и «2» относятся к раствору до и после разбавления соответственно. Поскольку процесс разбавления не изменяет количество растворенного вещества в растворе, n 1 = n 2 . Таким образом, эти два уравнения можно приравнять друг к другу:
\[M_1L_1=M_2L_2\]
Это соотношение обычно называют уравнением разбавления. Хотя мы получили это уравнение, используя молярность в качестве единицы концентрации и литры в качестве единицы объема, другие единицы концентрации и объема могут использоваться, если единицы должным образом сокращаются в соответствии с методом метки фактора. Отражая эту универсальность, уравнение разбавления часто записывают в более общей форме:
Отражая эту универсальность, уравнение разбавления часто записывают в более общей форме:
\[C_1V_1=C_2V_2\]
где \(C\) и \(V\) — концентрация и объем соответственно.
Phet Simulation
Пример \(\PageIndex{6}\): определение концентрации разбавленного раствора
Если 0,850 л 5,00- М раствора нитрата меди Cu(NO 3 ) 2 разбавляют до объема 1,80 л добавлением воды, какова молярность разбавленного раствора?
Раствор
Даны объем и концентрация маточного раствора, V 1 и C 1 , а объем полученного разбавленного раствора V 2 . Нам нужно найти концентрацию разбавленного раствора, C 2 . Таким образом, мы перестраиваем уравнение разбавления, чтобы выделить C 2 :
\[C_1V_1=C_2V_2\]
\[C_2=\dfrac{C_1V_1}{V_2}\]
Поскольку исходный раствор разбавляется более чем в два раза (объем увеличивается с 0,85 л до 1,80 л), можно ожидать, что концентрация разбавленного раствора будет меньше половины 5 М . Мы сравним эту приблизительную оценку с расчетным результатом, чтобы проверить наличие грубых ошибок в вычислениях (например, таких как неправильная замена заданных величин). Подстановка данных значений для членов в правой части этого уравнения дает:
Мы сравним эту приблизительную оценку с расчетным результатом, чтобы проверить наличие грубых ошибок в вычислениях (например, таких как неправильная замена заданных величин). Подстановка данных значений для членов в правой части этого уравнения дает:
\[C_2=\mathrm{\dfrac{0,850\:L\times 5,00\:\dfrac{mol}{L}}{1,80\: L}}=2,36\:M\]
Этот результат хорошо согласуется с нашей приблизительной оценкой (это чуть меньше половины концентрации запасов, 5 М ).
Упражнение \(\PageIndex{6}\)
Какова концентрация раствора, полученного при разбавлении 25,0 мл 2,04-М раствора Ch4OH до 500,0 мл?
- Ответ
0,102 М \(CH_3OH\)
Пример \(\PageIndex{7}\): объем разбавленного раствора
Какой объем 0,12 М HBr можно получить из 11 мл (0,011 л) 0,45 М HBr?
Раствор
Даны объем и концентрация маточного раствора V 1 и C 1 , а также концентрация полученного разбавленного раствора C 2 . Нам нужно найти объем разбавленного раствора, V 2 . Таким образом, мы перестраиваем уравнение разбавления, чтобы выделить V 2 :
Нам нужно найти объем разбавленного раствора, V 2 . Таким образом, мы перестраиваем уравнение разбавления, чтобы выделить V 2 :
\[C_1V_1=C_2V_2\]
\[V_2=\dfrac{C_1V_1}{C_2}\]
Поскольку разбавленная концентрация (0,12 М ) составляет чуть более одной четверти исходной концентрации (0,45 М ), мы ожидаем, что объем разбавленного раствора будет примерно в четыре раза больше исходного объема, или около 44 мл. . Подстановка данных значений и решение неизвестного объема дает:
\[V_2=\dfrac{(0,45\:M)(0,011\: \ce L)}{(0,12\:M)}\]
\[V_2=\mathrm{0,041\:L}\]
Объем 0,12- М раствора составляет 0,041 л (41 мл). Результат разумный и хорошо сравним с нашей приблизительной оценкой.
Упражнение \(\PageIndex{7}\)
Лабораторный эксперимент требует 0,125 М \(HNO_3\). Какой объем 0,125 М \(HNO_3\) можно получить из 0,250 л 1,88 М \(HNO_3\)?
- Ответить
3,76 л
Пример \(\PageIndex{8}\): Объем концентрированного раствора, необходимый для разбавления
Какой объем 1,59 М КОН требуется для приготовления 5,00 л 0,100 М КОН?
Раствор
Дана концентрация маточного раствора, C 1 , а также объем и концентрация полученного разбавленного раствора, V 2 и C 2. Нам нужно найти объем исходного раствора, V 1 . Таким образом, мы перестраиваем уравнение разбавления, чтобы выделить V 1 :
Нам нужно найти объем исходного раствора, V 1 . Таким образом, мы перестраиваем уравнение разбавления, чтобы выделить V 1 :
\[C_1V_1=C_2V_2\]
\[V_1=\dfrac{C_2V_2}{C_1}\]
Поскольку концентрация разбавленного раствора 0,100 М составляет примерно одну шестнадцатую от исходного раствора (1,59 М ), мы ожидаем, что объем исходного раствора будет примерно в одну шестнадцатую объема разбавленного раствора. или около 0,3 л. Подстановка данных значений и решение для неизвестного объема дает:
\[V_1=\dfrac{(0,100\:M)(5,00\:\ce L)}{1,59\:M}\]
\[ V_1=0,314\:\ce L\]
Таким образом, нам потребуется 0,314 л из 1,59- М раствор для приготовления нужного раствора. Этот результат согласуется с нашей грубой оценкой.
Упражнение \(\PageIndex{8}\)
Какой объем 0,575 М раствора глюкозы C 6 H 12 O 6 можно приготовить из 50,00 мл 3,00 М раствора глюкозы ?
- Ответить
0,261 л
Сводка
youtube.com/embed/6Vh2Joe64b8?vq=hd1080″ frameborder=»0″ allowfullscreen=»true»>Видео \(\PageIndex{4}\): Обзор расчета молярности.
Видео \(\PageIndex{5}\): Обзор расчета разведений. Кроме того, апельсиновый сквош является напитком в Англии.
Растворы представляют собой гомогенные смеси. Многие растворы содержат один компонент, называемый растворителем, в котором растворены другие компоненты, называемые растворенными веществами. Водный раствор – это раствор, для которого растворителем является вода. Концентрация раствора является мерой относительного количества растворенного вещества в данном количестве раствора. Концентрации могут быть измерены с использованием различных единиц, одной из очень полезных единиц является молярность, определяемая как количество молей растворенного вещества на литр раствора. Концентрация растворенного вещества в растворе может быть уменьшена путем добавления растворителя, процесс, называемый разбавлением. Уравнение разбавления представляет собой простое соотношение между концентрациями и объемами раствора до и после разбавления.
Концентрация растворенного вещества в растворе может быть уменьшена путем добавления растворителя, процесс, называемый разбавлением. Уравнение разбавления представляет собой простое соотношение между концентрациями и объемами раствора до и после разбавления.
Ключевые уравнения
- \(M=\mathrm{\dfrac{mol\: растворенное вещество}{L\: раствор}}\)
- С 1 В 1 = С 2 В 2
Глоссарий
- водный раствор
- раствор, для которого вода является растворителем
- концентрированный
- качественный термин для раствора, содержащего растворенное вещество в относительно высокой концентрации
- концентрация
- количественная мера относительных количеств растворенного вещества и растворителя, присутствующих в растворе
- разбавленный
- качественный термин для раствора, содержащего растворенное вещество в относительно низкой концентрации
- разбавление
- процесс добавления растворителя в раствор для снижения концентрации растворенных веществ
- распущен
- описывает процесс диспергирования растворенных компонентов в растворителе 9.
 2080
2080
- молярность ( M )
- единица концентрации, определяемая как количество молей растворенного вещества, растворенного в 1 л раствора
- растворенное вещество
- компонент раствора, присутствующий в концентрации меньше концентрации растворителя
- растворитель
- компонент раствора присутствует в более высокой концентрации по сравнению с другими компонентами
Авторы
Пол Флауэрс (Университет Северной Каролины, Пембрук), Клаус Теопольд (Университет Делавэра) и Ричард Лэнгли (Государственный университет Стивена Ф. Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Скачать бесплатно на http://cnx.org/contents/85abf193-2бд…[email protected]).
- Аделаида Кларк, Орегонский технологический институт
- Fuse School, открытый бесплатный образовательный ресурс, в соответствии с лицензией Creative Commons: Attribution-NonCommercial CC BY-NC (см.
 лицензионный договор: https://creativecommons.org/licenses/by-nc/4.0/)
лицензионный договор: https://creativecommons.org/licenses/by-nc/4.0/)
Обратная связь
Хотите оставить отзыв об этом тексте? Кликните сюда.
Нашли опечатку и хотите получить дополнительные баллы? Кликните сюда.
6.1: Расчет молярности распространяется по незаявленной лицензии и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Показать страницу TOC
- нет на странице
- Теги

4.5: Концентрация растворов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 21718
Цели обучения
- Количественное описание концентрации растворов
Многие люди имеют качественное представление о том, что подразумевается под концентрацией . Любой, кто готовил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматизированный, высококонцентрированный напиток, тогда как слишком мало дает разбавленный раствор, который трудно отличить от воды. В химии концентрация раствора равна количеству растворенное вещество , которое содержится в определенном количестве растворителя или раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для растворных реакций. Химики используют множество различных методов для определения концентрации, некоторые из которых описаны в этом разделе.
Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для растворных реакций. Химики используют множество различных методов для определения концентрации, некоторые из которых описаны в этом разделе.
Молярность
Наиболее распространенной единицей концентрации является молярность , которая также наиболее полезна для расчетов, связанных со стехиометрией реакций в растворе. Молярность (М) определяется как количество молей растворенного вещества, присутствующего ровно в 1 л раствора. Это эквивалентно количеству миллимолей растворенного вещества, присутствующего ровно в 1 мл раствора:
\[ молярность = \dfrac{моли\: из\: растворенного вещества}{литры\: из\: раствора} = \dfrac{ммоль\: из\: растворенного вещества} {миллилитры\: из\: раствора} \label{ 4.5.1} \]
Таким образом, единицами молярности являются моли на литр раствора (моль/л), сокращенно \(М\). Водный раствор, содержащий 1 моль (342 г) сахарозы в количестве воды, достаточном для получения конечного объема 1,00 л, имеет концентрацию сахарозы 1,00 моль/л или 1,00 М. В химических обозначениях квадратные скобки вокруг названия или формулы растворенное вещество представляет собой молярную концентрацию растворенного вещества. Следовательно,
В химических обозначениях квадратные скобки вокруг названия или формулы растворенное вещество представляет собой молярную концентрацию растворенного вещества. Следовательно,
\[[\rm{сахароза}] = 1,00\: M \номер\]
читается как «концентрация сахарозы 1,00 молярная». Отношения между объемом, молярностью и молями могут быть выражены как
\[ V_L M_{моль/л} = \cancel{L} \left( \dfrac{mol}{\cancel{L}} \right) = моли \label{4.5.2} \]
или
\[ V_{мл} M_{ммоль/мл} = \cancel{мл} \left( \dfrac{ммоль} {\cancel{мл}} \right ) = ммоль \label{4.5.3} \]
Рисунок \(\PageIndex{1}\) иллюстрирует использование уравнений \(\ref{4.5.2}\) и \(\ref{4.5.3} \).
Рисунок \(\PageIndex{1}\): Приготовление раствора известной концентрации с использованием твердого растворенного веществаПример \(\PageIndex{1}\): Расчет молей по концентрации NaOH
Рассчитайте количество молей натрия гидроксида (NaOH) в 2,50 л 0,100 М NaOH.
Дано: идентичность растворенного вещества, объем и молярность раствора
Запрошено: количество растворенного вещества в молях
Стратегия:
Используйте либо уравнение \ref{4. 5.2}, либо уравнение \ref{4.5. 3}, в зависимости от единиц измерения, указанных в задаче.
5.2}, либо уравнение \ref{4.5. 3}, в зависимости от единиц измерения, указанных в задаче.
Решение:
Поскольку нам дан объем раствора в литрах и задано число молей вещества, уравнение \ref{4.5.2} более полезно:
\( моль\: NaOH = V_L M_{моль/л} = (2,50\: \отменить{L}) \влево(\dfrac{0,100\: моль} {\отменить{L}} \вправо) = 0,250\: моль\: NaOH \)
Упражнение \(\PageIndex{1}\): Расчет молей по концентрации аланина
Рассчитайте количество миллимолей аланина, биологически важной молекулы, в 27,2 мл 1,53 М аланина.
- Ответить
41,6 ммоль
Расчеты с использованием молярности (M): Расчеты с использованием молярности (M), YouTube (opens in new window) [youtu.be]
Концентрации также часто указываются в пересчете на массу (m/m) или на основе отношения массы к объему (m/v), особенно в клинических лабораториях и инженерных приложениях. Концентрация, выраженная в м/м, равна количеству граммов растворенного вещества на грамм раствора; концентрация на основе m/v представляет собой количество граммов растворенного вещества на миллилитр раствора. Каждое измерение можно выразить в процентах, умножив отношение на 100; результат сообщается как процент масс./масс. или процент масс./об. Концентрации очень разбавленных растворов часто выражаются в частей на миллион ( частей на миллион ), что составляет граммы растворенного вещества на 10 6 г раствора, или частей на миллиард ( частей на миллиард ), что составляет граммов растворенного вещества на 10 9 г раствора. решение. Для водных растворов при 20°C 1 ppm соответствует 1 мкг на миллилитр, а 1 ppb соответствует 1 нг на миллилитр. Эти концентрации и их единицы приведены в таблице \(\PageIndex{1}\).
Концентрация, выраженная в м/м, равна количеству граммов растворенного вещества на грамм раствора; концентрация на основе m/v представляет собой количество граммов растворенного вещества на миллилитр раствора. Каждое измерение можно выразить в процентах, умножив отношение на 100; результат сообщается как процент масс./масс. или процент масс./об. Концентрации очень разбавленных растворов часто выражаются в частей на миллион ( частей на миллион ), что составляет граммы растворенного вещества на 10 6 г раствора, или частей на миллиард ( частей на миллиард ), что составляет граммов растворенного вещества на 10 9 г раствора. решение. Для водных растворов при 20°C 1 ppm соответствует 1 мкг на миллилитр, а 1 ppb соответствует 1 нг на миллилитр. Эти концентрации и их единицы приведены в таблице \(\PageIndex{1}\).
| Концентрация | Единицы |
|---|---|
| м/м | г растворенного вещества/г раствора |
| т/х | г растворенного вещества/мл раствора |
| частей на миллион | г растворенного вещества/10 6 г раствора |
| мкг/мл | |
| частей на миллиард | г растворенного вещества/10 9 г раствора |
| нг/мл |
Приготовление растворов
Для приготовления раствора, содержащего определенную концентрацию вещества, необходимо растворить желаемое количество молей растворенного вещества в достаточном количестве растворителя, чтобы получить желаемый конечный объем раствора. На рисунке \(\PageIndex{1}\) показана эта процедура для раствора дигидрата хлорида кобальта (II) в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, необходимый объем растворителя почти всегда на 90 985 меньше, чем на 90 986 желаемого объема раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рисунке \(\PageIndex{2}\), для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
На рисунке \(\PageIndex{1}\) показана эта процедура для раствора дигидрата хлорида кобальта (II) в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, необходимый объем растворителя почти всегда на 90 985 меньше, чем на 90 986 желаемого объема раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рисунке \(\PageIndex{2}\), для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
Пример \(\PageIndex{2}\)
Раствор содержит 10,0 г дигидрата хлорида кобальта(II), CoCl 2 • 2H 2 O, в этаноле, достаточном для получения ровно 500 мл раствора. Какова молярная концентрация \(\ce{CoCl2•2h3O}\)?
Какова молярная концентрация \(\ce{CoCl2•2h3O}\)?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (M)
Стратегия:
Чтобы найти количество молей \(\ce{CoCl2•2h3O}\), разделите масса соединения по его молярной массе. Рассчитайте молярность раствора, разделив количество молей растворенного вещества на объем раствора в литрах.
Решение:
Молярная масса CoCl 2 •2H 2 O составляет 165,87 г/моль. Следовательно,
\[ моль\: CoCl_2 \cdot 2H_2O = \left( \dfrac{10,0 \: \cancel{g}} {165,87\: \cancel{g} /mol} \right) = 0,0603\: моль \номер \]
Объем раствора в литрах равен
\[ объем = 500\: \cancel{мл} \left( \dfrac{1\: L} {1000\: \cancel{мл}} \right) = 0 .500\: L \nonumber \]
Молярность — это количество молей растворенного вещества на литр раствора, поэтому молярность раствора равна
\[ молярность = \dfrac{0,0603\: моль} {0,500\: L} = 0,121\: M = CoCl_2 \cdot H_2O \номер\]
Упражнение \(\PageIndex{2}\)
Раствор, показанный на рисунке \(\PageIndex{2}\), содержит 90,0 г (NH 4 ) 2 Cr 2 O 7 в достаточное количество воды, чтобы получить окончательный объем ровно 250 мл. Какова молярная концентрация дихромата аммония?
Какова молярная концентрация дихромата аммония?
- Ответить
\[(NH_4)_2Cr_2O_7 = 1,43\: М \номер\]
Чтобы приготовить определенный объем раствора, который содержит определенную концентрацию растворенного вещества, сначала необходимо рассчитать количество молей растворенного вещества в желаемом объеме раствора, используя соотношение, показанное в уравнении \(\ref{4.5.2 }\). Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере \(\PageIndex{3}\).
Пример \(\PageIndex{3}\): Раствор D5W
Так называемый раствор D5W, используемый для внутривенного замещения жидкостей организма, содержит 0,310 М глюкозы. (D5W представляет собой примерно 5% раствор декстрозы [медицинское название глюкозы] в воде.) Рассчитайте массу глюкозы, необходимую для приготовления пакета D5W объемом 500 мл. Глюкоза имеет молярную массу 180,16 г/моль.
Дано: молярность, объем и молярная масса растворенного вещества
Запрошено: масса растворенного вещества
Стратегия:
- Рассчитайте количество молей глюкозы, содержащихся в заданном объеме раствора, умножив объем раствора на его молярность.
- Получите необходимую массу глюкозы, умножив количество молей соединения на его молярную массу.
Решение:
A Сначала нужно вычислить количество молей глюкозы, содержащихся в 500 мл 0,310 М раствора:
\(V_L M_{моль/л} = моль \)
\( 500\: \cancel{mL} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{mL}} \right) \left( \dfrac{0.310\ : моль\: глюкоза} {1\: \cancel{L}} \right) = 0,155\: моль\: глюкоза \)
B Затем мы преобразуем количество молей глюкозы в требуемую массу глюкоза:
\( масса \: of \: глюкоза = 0,155 \: \cancel{mol\: глюкоза} \left( \dfrac{180,16 \: g\: глюкоза} {1\: \cancel{mol\: глюкоза }} \right) = 27,9 \: g \: глюкоза \)
Упражнение \(\PageIndex{3}\)
Другим раствором, обычно используемым для внутривенных инъекций, является физиологический раствор, 0,16 М раствор хлорида натрия в воде. Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
- Ответить
2,3 г NaCl
Раствор нужной концентрации также можно приготовить путем разбавления небольшого объема более концентрированного раствора дополнительным растворителем. Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод, взвешивающий крошечные количества растворенного вещества, трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из маточного раствора показана на рисунке \(\PageIndex{3}\). Это требует расчета количества молей растворенного вещества, желаемого в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, содержащего это количество растворенного вещества. Помните, что разбавление заданного количества маточного раствора растворителем , а не изменяет число молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0003
Помните, что разбавление заданного количества маточного раствора растворителем , а не изменяет число молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0003
\[(V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d)\метка{4.5.4} \]
, где индексы s и d указывают запас и разбавленные растворы соответственно. Пример \(\PageIndex{4}\) демонстрирует расчеты, связанные с разбавлением концентрированного маточного раствора.
Рисунок \(\PageIndex{3}\): Приготовление раствора известной концентрации путем разбавления маточного раствора. (a) Объем ( V s ), содержащий требуемые моли растворенного вещества (M s ) измеряется в исходном растворе известной концентрации. (b) Измеренный объем маточного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляют растворителем до объемной метки ].
Пример \(\PageIndex{4}\)
Какой объем исходного раствора глюкозы 3,00 М необходим для приготовления 2500 мл раствора D5W в примере \(\PageIndex{3}\)?
Дано: объем и молярность разбавленного раствора
Запрошено: объем маточного раствора раствор по его молярности.
Решение:
A Раствор D5W в примере 4.5.3 представлял собой 0,310 М глюкозу. Начнем с использования уравнения 4.5.4 для расчета количества молей глюкозы, содержащихся в 2500 мл раствора:
\[ моль\: глюкоза = 2500\: \cancel{мл} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{мл}} \right) \left( \dfrac{0,310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0 .775\: моль\: глюкоза \номер\]
B Теперь мы должны определить объем 3,00 М маточного раствора, содержащего такое количество глюкозы:
\[ объем\: из\: сток\: раствор = 0,775\: \отменить{моль\: глюкоза} \влево( \dfrac{1\: л} {3,00\: \отменить{моль\ : глюкоза}} \справа) = 0,258\: л\: или\: 258\: мл \нечисло \]
При определении необходимого объема исходного раствора мы должны были разделить желаемое число молей глюкозы по концентрации исходного раствора для получения соответствующих единиц. Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Мы также могли бы решить эту задачу за один шаг, решив уравнение 4.5.4 для V s и подставив соответствующие значения:
\[ V_s = \dfrac{( V_d )(M_d )}{M_s } = \dfrac{(2.500\: L)(0.310\: \cancel{M})} {3.00\: \cancel{M}} = 0.258\: L \nonumber \]
Как мы уже отмечали, часто существует более одного правильного способа решения проблемы.
Упражнение \(\PageIndex{4}\)
Какой объем исходного раствора 5,0 М NaCl необходим для приготовления 500 мл физиологического раствора (0,16 М NaCl)?
- Ответить
16 мл
Концентрация ионов в растворе
В примере \(\PageIndex{2}\) концентрация раствора, содержащего 90,00 г дихромата аммония в конечном объеме 250 мл, рассчитана как 1,43 М. Рассмотрим подробнее именно то, что это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\label{4.5.5} \]
Рассмотрим подробнее именно то, что это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (aq)\label{4.5.5} \]
Таким образом, 1 моль формульных единиц дихромата аммония растворяется в воде с образованием 1 моля Cr 2 O 7 2 − анионов и 2 моль катионов NH 4 + (см. рисунок \(\PageIndex{4}\)).
Рисунок \(\PageIndex{4}\): Растворение 1 моль ионного соединения. В этом случае растворение 1 моля (NH 4 ) 2 Cr 2 O 7 дает раствор, содержащий 1 моль Cr 2 O 7 2 − ионов и 2 моль NH 4 + ионов. (Молекулы воды для ясности не показаны на молекулярном изображении раствора.) 1 моль дихромата аммония показан в мерной колбе объемом 1 л. Полученная мерная колба справа содержит 1 литр раствора после растворения в воде. Порошкообразная форма бихромата аммония также включена в схему.
При проведении химической реакции с использованием раствора соли, такой как дихромат аммония, важно знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 М (NH 4 ) 2 CR 2 O 7 , затем концентрация CR 2 O 7 2 — также должен быть 1,43 M, потому что есть один CR
646464646464646464646464646464646464646464646464646464646. 2 − ион на формульную единицу. Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 М = 2,86 М. Поскольку каждая формульная единица (NH 4 ) 2 CR 2 O 7 Производит Три ионы при растворенных воде (2NH 4 + + 1CR 2 O 7 2 6. . of of . of . . or . . or . . . or . в растворе 3 × 1,43 M = 4,29 M.
. or . . or . . . or . в растворе 3 × 1,43 M = 4,29 M. Концентрация ионов в растворе из растворимой соли: концентрация ионов в растворе из растворимой соли, YouTube (opens in new window) [youtu.be]
Пример \(\PageIndex{5}\)
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,21 М NaOH
- 3,7 М (СН 3 ) 2 СНОН
- 0,032 М In(NO 3 ) 3
Дано: молярность
Запрошено: концентрации
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или неэлектролит.
B Если соединение является неэлектролитом, его концентрация равна молярности раствора. — (водн.) \)
— (водн.) \)
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0,21 М и [ ОН — ] = 0,21 М.
B Одна формула единицы в IN (№ 3 ) 3 производит один в 3 + Ион и три № 3 — ионы, а также 0,032 M in (na 3 — , SO A 0,032 M in (n. 3 ). 3 раствор содержит 0,032 м в 3 + и 3 × 0,032 м = 0,096 м № 3 — — это, [в 3 + ] = 0,032 М. − ] = 0,096 М.
− ] = 0,096 М.
Упражнение \(\PageIndex{5}\)
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,0012 М Ba(OH) 2
- 0,17 М Na 2 SO 4
- 0,50 М (CH 3 ) 2 CO, обычно известный как ацетон
Резюме
Концентрации растворов обычно выражаются в молях и могут быть приготовлены путем растворения известной массы растворенного вещества в растворителе или разбавления маточного раствора.
- определение молярности: \[ молярность = \dfrac{моль\: из\: растворенного вещества}{литры\: из\: раствора} = \dfrac{ммоль\: из\: растворенного вещества} {миллилитров\: из \: решение} \номер\]
- связь между объемом, молярностью и молями : \[ V_L M_{моль/л} = \cancel{L} \left( \dfrac{mol}{\cancel{L}} \right) = моли \nonumber \ ]
- связь между объемом и концентрацией основного и разбавленного растворов : \[(V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d) \номер\]
Концентрация вещества представляет собой количество растворенного вещества, присутствующего в данном количестве раствора. Концентрации обычно выражают в терминах молярности , определяемой как количество молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора (исходный раствор 9).2112 ) до желаемого конечного объема.
Концентрации обычно выражают в терминах молярности , определяемой как количество молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора (исходный раствор 9).2112 ) до желаемого конечного объема.
Авторы и авторство
4.5: Concentration of Solutions распространяется под лицензией CC BY-NC-SA 3.0 и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- нет на странице
- Теги
- концентрация
- молярность
- частей на миллиард
- Частей на миллион
- базовый раствор
Калькулятор молярности | Technology Networks
Что такое молярность?
Молярность – это концентрация раствора в пересчете на число молей растворенного вещества в 1 дм 3 (1 л) раствора.
Каковы единицы молярности?
Единицы молярности M или моль/л. Раствор 1 M называется «одномолярным».
Что такое родинка?
Моль — это количество всего, что имеет такое же количество частиц, как 12 г углерода-12. Это соответствует примерно 6,02×10 23 , также называемому числом Авогадро. Так, 1 моль газообразного водорода (H 2 ) содержит 6,02×10 23 молекул, а 1 моль глюкозы (C 6 H 12 O 6 .) также содержит 6,02×10 23 молекул, но поскольку молекула H 2 намного проще, 1 моль H 2 будет иметь гораздо меньшую массу (молярную массу), чем 1 моль C 6 H 12 O 6 .
Что такое молярная масса?
Молярная масса – это масса в граммах 1 моля конкретной молекулы.
Как найти молярную массу
Один моль натрия (Na) равен 22,99 г, а 1 моль хлора — 35,45 г. Для хлорида натрия (NaCl) они находятся в соотношении 1: 1, поэтому молярная масса NaCl составляет 22,9.9 + 35,45 = 58,44 г/моль.
Для такого соединения, как вода (H 2 O), 1 моль водорода (H) равен 1,008 г/моль, а 1 моль кислорода (O) равен 15,9994 г/моль. Итак, молярная масса H 2 O равна (2 x 1,008) + 15,9994 = 18,0154 г/моль.
Как молярность связана с концентрацией?
Два раствора с одинаковой молярностью будут иметь одинаковое количество молекул химического вещества на литр, но, вероятно, будут содержать разные массы этого химического вещества на литр для достижения этой цели. Принимая во внимание, что два раствора с одинаковой концентрацией будут иметь одинаковую массу химического вещества на литр раствора, но, следовательно, вероятно, будут иметь разное количество молекул этого химического вещества на литр. Если известна дополнительная информация, одно значение можно вывести из другого, используя приведенные ниже уравнения.
Если известна дополнительная информация, одно значение можно вывести из другого, используя приведенные ниже уравнения.
Уравнения молярности
Для расчета молярности или для расчета связанных значений (включая объем, массу, молярную массу и концентрацию) по молярности используются следующие уравнения.
Количество молей (моль) = масса (г) / молярная масса (г/моль)
Концентрация (г/л) = Масса (г) / Объем (л)
Молярность ( M или моль/л) = количество молей (моль) / объем (л)
Пример расчета молярности и концентрации
Сценарий, в котором большинство ученых-лаборантов столкнутся с этим типом расчета, — это при составлении решений в соответствии со стандартной рабочей процедурой (СОП) или научной статьей. Здесь используемый раствор обычно определяется его молярной концентрацией ( M ). Например;
Здесь используемый раствор обычно определяется его молярной концентрацией ( M ). Например;
Вам нужно приготовить 0,5 М раствора NaCl, решив, что вам нужно 2 литра, сколько NaCl нужно добавить?
- Сначала вы должны рассчитать количество молей в этом растворе, переставив уравнение
Количество Моль (моль) = Молярность ( M ) x Объем (л)
= 0,5 х 2
= 1 моль - Для NaCl молярная масса 58,44 г/моль
Теперь мы можем использовать переставленное уравнение
. Масса (г) = количество молей (моль) x молярная масса (г/моль)
= 1 х 58,44
= 58,44 г
Итак, чтобы приготовить 2 литра 0,5 М раствора NaCl, нужно добавить 58,44 г NaCl.
Перестраивать уравнение нет необходимости, так как калькулятор сделает это за вас.
Поскольку вы добавляете 58,44 г NaCl к 2 л воды, вы также можете выразить это значение через его концентрацию
Концентрация (г/л) = Масса (г) / Объем (л)
= 58,44 / 2
= 29,22 г/л
Связанные термины
Атомная масса ( m a ) – масса одного атома этого элемента, которая обычно отражает массу ядра (протоны плюс нейтроны). Например, водород равен 1. Раньше это измерялось в атомных единицах массы (AMU), но теперь обычно выражается в дальтонах (Да).
Молекулярная масса (также называемая молекулярной массой)
— сумма атомных весов всех атомов, входящих в данную молекулярную формулу. Например, глюкоза имеет молекулярную формулу C 6 H 12 O 6 , молекулярная масса С составляет 12 Да, Н составляет 1 Да и О составляет 16 Да. Следовательно, молекулярная масса глюкозы равна
= (6 х 12) + (12 х 1) + (6 х 16)
= 72 + 12 + 96
= 180 Да
Численно это то же самое, что и молярная масса, отличающаяся только единицами, в которых они выражены.
Относительная атомная масса и относительная молекулярная масса ( M R ) – значения атомной и, следовательно, молекулярной массы обычно получают относительно массы изотопа 12 C (углерод-12), однако термин «относительный» обычно не упоминается в заголовке. При правильном написании относительные величины не имеют единиц измерения.
Масса формулы (также называемая массой формулы) — сумма атомных масс всех атомов, входящих в данную эмпирическую формулу. Эмпирическая формула указывает соотношение атомов каждого элемента в молекуле, а не фактическое количество. Например, глюкоза (молекулярная формула C 9Таким образом, 0246 6 H 12 O 6 ) будет иметь эмпирическую формулу CH 2 O, молекулярная масса C равна 12 г, H равна 1 г, а O равна 16 г. Следовательно, формула массы глюкозы равна
.
= (1 х 12) + (2 х 1) + (1 х 16)
= 12 + 2 +16
= 30 г
Для таких молекул, как H 2 O, где формула уже находится в простейшей форме, масса формулы и молекулярная масса совпадают.
Нормальность – аналогична молярности, однако при расчете нормальности используется количество молярных эквивалентов, а не количество молей. Единицы: N или экв/л.
Нормальность обычно используется только тогда, когда вещество имеет более одного подвида, которые могут участвовать в определенной реакции, например, протон для кислотно-основных реакций, электрон для реакций окисления/восстановления или в реакциях осаждения.
Например, серная кислота (H 2 SO 4 ) имеет два ионизируемых протона (H + ), которые могут участвовать в нейтрализации основания, такого как гидроксид натрия (NaOH)
H 2 SO 4 (водн.) + 2 NaOH → 2 Na + (водн.) + 2 H 2 O + SO 4 2+ (водн.)
Если раствор серной кислоты 1 M , то это 2 N , выраженное как нормальность. Раствор 2 N называется «два нормальных».



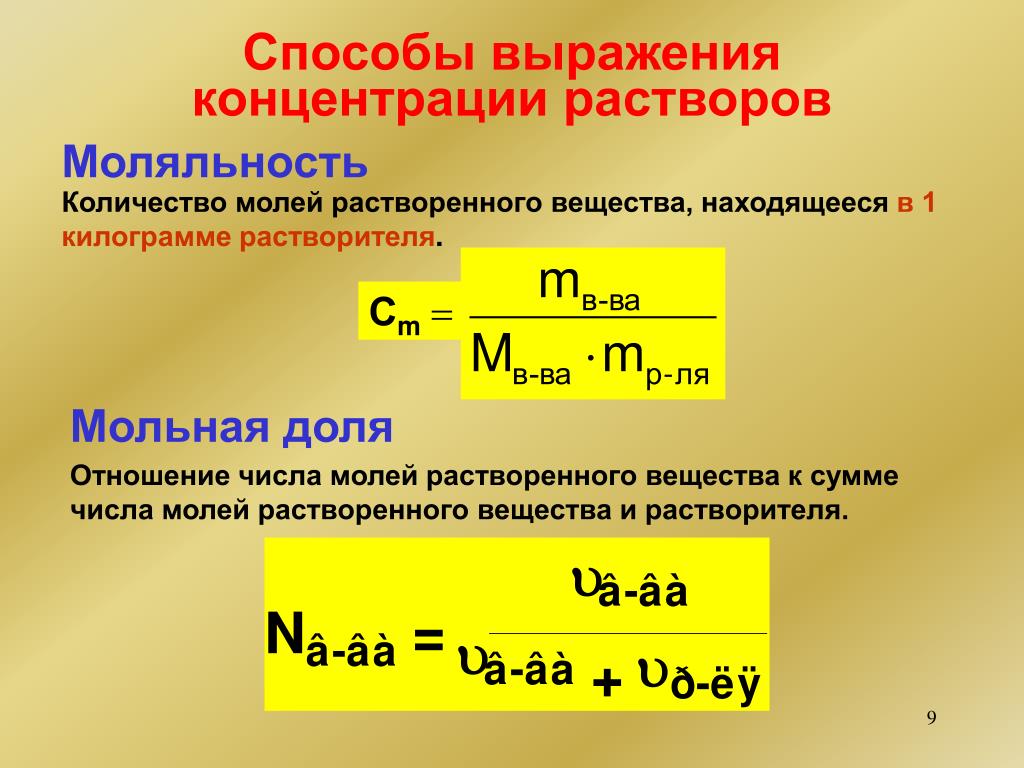

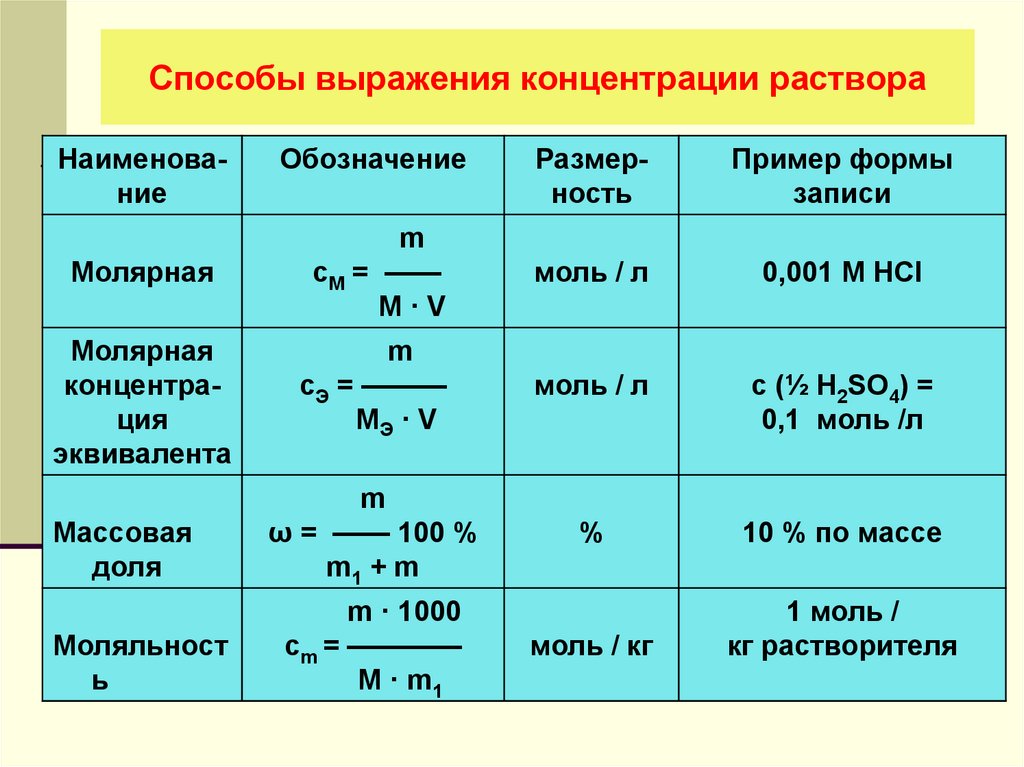

 Какая информация содержится в вопросе? (извлечь данные из вопроса, включая единицы измерения, и при необходимости преобразовать)
Какая информация содержится в вопросе? (извлечь данные из вопроса, включая единицы измерения, и при необходимости преобразовать) ) ) = объем NaCl (водн.) = 250,00 мл
) ) = объем NaCl (водн.) = 250,00 мл