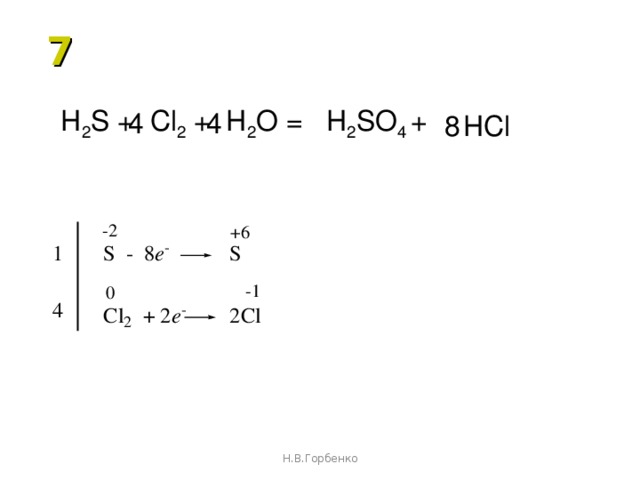Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Помогите написать уравнения реакций с помощью которых можно осуществить следующие превращения: SiO2-Si-Ca2Si-Sih5-SiO2-Si; б).
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
В каком году была сформулирована теория — предшественница кислородной теории горения.
Решено
1) решить цепочку N2—>NO—>NO2—>HNO3—>Nh4 2) HNO3—>NO2 3) HNO3—>Ca(NO3)2 4) N2—>Nh4—>(Nh5)2SO—>Nh4—>N2 5) Nh4—>NO
Структурная формула всех изомеров С7Н16
Пользуйтесь нашим приложением
Спектры Ио в диапазоне 2,5-5,0 микрометров: свидетельство присутствия h3S и h3O, замороженных в SO2
Сравнительное исследование
. 1990 г., январь; 83 (1): 66–82.
doi: 10.1016/0019-1035(90)
-у.
Ф Салама 1 , Л.
Сотрудники, Принадлежности
Соавтор
Л.Дж. Алламандола 2
Принадлежности
- 1 NASA-Ames Research Center, Space Science Division, Moffett Field, California 94035, USA.
- 2 АРК
- PMID: 11538411
- DOI:
10.1016/0019-1035(90)-у
Сравнительное исследование
F Salama et al. Икар.
1990 Январь
Икар.
1990 Январь
. 1990 г., январь; 83 (1): 66–82.
doi: 10.1016/0019-1035(90)
-у.
Авторы
Ф Салама 1 , Л. Дж. Алламандола, ФК Виттеборн, Д. П. Круикшенк, С. А. Сэндфорд, Дж. Д. Брегман
Соавтор
Л.Дж. Алламандола 2
Принадлежности
- 1 Исследовательский центр НАСА-Эймс, Отдел космических исследований, Моффет Филд, Калифорния 94035, США.
- 2 АРК
- PMID: 11538411
- DOI:
10.
 1016/0019-1035(90)
1016/0019-1035(90)-у
Абстрактный
Инфракрасные спектры Ио в районе 2,5-5,0 микрометров, включая новые данные наблюдений, проанализированы с помощью детальных лабораторных исследований возможных поверхностных льдов. Показано, что помимо полос поглощения, связанных с замерзанием диоксида серы, четыре инфракрасных спектральных особенности Ио не идентифицированы. Эти неопознанные особенности показывают пространственные и временные вариации интенсивности полос. Одна пара имеет диаметр около 3,9 мкм (3,85 и 3,91 мкм), а вторая пара — около 3,0 мкм (2,9 мкм).7 и 3,15 мкм). Эти поглощения близки к основным валентным модам в h3S и h3O соответственно. Обсуждаются инфракрасные спектры поглощения обширного набора лабораторных льдов, начиная от чистых материалов и заканчивая бинарными смесями h3S и h3O (смешанными в различных концентрациях или слоистыми) и смесями h3O:h3S:SO2.

Похожие статьи
Лабораторные исследования недавно открытого инфракрасного диапазона 4705,2 см-1 (2,1253 микрометра) в спектре Ио: предварительная идентификация СО2.
Сэндфорд С.А., Салама Ф., Алламандола Л.Дж., Трафтон Л.М., Лестер Д.Ф., Рамсейер Т.Ф. Сэндфорд С.А. и др. Икар. 1991;91:125-44. doi: 10.1016/0019-1035(91)
-д. Икар. 1991. PMID: 11538104
Поведение льдов, содержащих SO2, h3S и CO2, при конденсации и испарении: последствия для Ио.

Сэндфорд С.А., Алламандола Л.Дж. Сэндфорд С.А. и др. Икар. 1993 декабрь; 106 (2): 478-88. doi: 10.1006/icar.1993.1186. Икар. 1993. PMID: 11539120
Присутствует ли h3O на Ио? Обнаружение новой сильной полосы около 3590 см-1 (2,79 мкм).
Салама Ф., Алламандола Л.Дж., Сэндфорд С.А., Брегман Д.Д., Виттеборн Ф.К., Крукшенк Д.П. Салама Ф. и др. Икар. 1994; 107:413-7. doi: 10.1006/icar.1994.1033. Икар. 1994. PMID: 11539181
Межзвездные полициклические ароматические углеводороды: полосы инфракрасного излучения, механизм возбуждения/излучения и астрофизические последствия.
Алламандола Л.Дж., Тиленс АГ, Баркер Дж.Р. Алламандола Л.Дж. и соавт. Astrophys J Suppl Ser. 1989 декабрь; 71: 733-75.
 дои: 10.1086/191396.
Astrophys J Suppl Ser. 1989.
PMID: 11542189
Рассмотрение.
дои: 10.1086/191396.
Astrophys J Suppl Ser. 1989.
PMID: 11542189
Рассмотрение.Эволюция межзвездных льдов.
Алламандола Л.Дж., Бернштейн М.П., Сэндфорд С.А., Уокер Р.Л. Алламандола Л.Дж. и соавт. Space Sci Rev. 1999;90(1-2):219-32. doi: 10.1007/978-94-011-4211-3_20. Космические науки, выпуск 1999. PMID: 11543288 Рассмотрение.
Посмотреть все похожие статьи
Цитируется
Наиболее часто используемые кодоны на аминокислоту и на геном в коде человека по сравнению с другими организмами в соответствии с вращающимся круговым генетическим кодом.
Кастро-Чавес Ф. Кастро-Чавес Ф. Нейроквантология. 2011 Декабрь;9(4):500. doi: 10.14704/nq.
 2011.9.4.500.
Нейроквантология. 2011.
PMID: 22997484
Бесплатная статья ЧВК.
2011.9.4.500.
Нейроквантология. 2011.
PMID: 22997484
Бесплатная статья ЧВК.
Типы публикаций
термины MeSH
вещества
молекул — Почему SO2 имеет больший валентный угол, чем h3O, h3S и Nh4
Вот валентные углы для каждой молекулы (данные из википедии): 9\circ)} \\ \hline \ce{h3S} & 92.1 \\ \hline \ce{h3O} & 104,5 \\ \hline \ce{Nh4} & 107,8 \\ \hлиния \ce{SO2} & 119 \\ \hline \конец{массив}
Итак, $L \propto \frac{1}{BA}$, где $L$ — число неподеленных пар, а $BA$ — валентный угол.
Это верно, но только в очень специфических ситуациях; при работе с молекулами, имеющими центральный атом в одном периоде и внешние атомы одного и того же элемента (например, $\ce{Ch5}$, $\ce{Nh4}$, $\ce{h3O}$). Он разрушается, как только вы начинаете сравнивать молекулы с центральными атомами из разных периодов (например, $\ce{Ph4}$ имеет меньше неподеленных пар, чем $\ce{h3O}$, но меньший валентный угол) или когда вы сравниваете молекулы с разными внешние атомы (например, $\ce{NF3}$ имеет меньше неподеленных пар, чем $\ce{h3O}$, но меньший валентный угол). По причинам, стоящим за этим, я направляю вас к отличному предыдущему ответу от @ron.
По причинам, стоящим за этим, я направляю вас к отличному предыдущему ответу от @ron.
Кроме того, я думаю, вам нужно пересмотреть количество неподеленных пар в $\ce{SO2}$, которые могут быть описаны этими двумя резонансными структурами.
Как видите, есть только одна неподеленная пара, но, к сожалению, это не очень нам поможет, поскольку у нас нет другой молекулы для сравнения.
Также $BA \propto ENC$, где $ENC$ — электроотрицательность центрального атома.
Это неверно. На самом деле верно обратное — что $BA \propto \frac{1}{ENC}$ — но только в тех же ситуациях, что и ранее. В этом случае тенденция действительно выражена только во втором периоде; она очень незначительна в третьем периоде и практически отсутствует в четвертом. На самом деле это «правило» не имеет ничего общего с электроотрицательностью (это просто совпадение) и, по сути, просто результат первого правила.
Также $BA \propto \frac{1}{ENS}$, где $ENS$ — электроотрицательность окружающего атома.

 02.17
02.17 1016/0019-1035(90)
1016/0019-1035(90)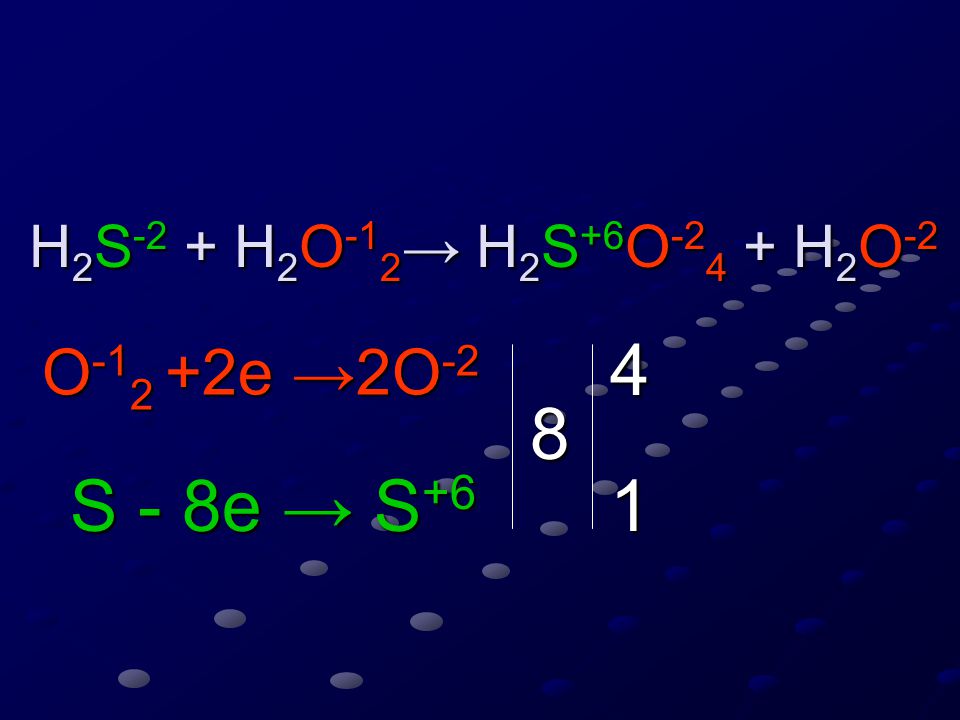
 дои: 10.1086/191396.
Astrophys J Suppl Ser. 1989.
PMID: 11542189
Рассмотрение.
дои: 10.1086/191396.
Astrophys J Suppl Ser. 1989.
PMID: 11542189
Рассмотрение. 2011.9.4.500.
Нейроквантология. 2011.
PMID: 22997484
Бесплатная статья ЧВК.
2011.9.4.500.
Нейроквантология. 2011.
PMID: 22997484
Бесплатная статья ЧВК.