Реакции ионного обмена и условия их протекания
Цели урока: познакомить учащихся с ионными уравнениями реакций, начать формировать навыки составления полных и сокращенных ионных уравнений.
Ход урока
1. Организационный момент.
1. Перечислите сильные и слабые электролиты.
2. Как происходит диссоциация средних солей? кислых? основных?
3. В случае ступенчатой диссоциации электролита, какие ионы образуются в наибольшем количестве, а какие в наименьшем?
2. Правила написания уравнений реакций в ионном виде
1. Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты.
2. Пользуясь таблицей растворимости, записывают в ионном виде формулы веществ (солей, кислот, оснований), обозначенных в таблице растворимости буквой «Р» (хорошо растворимые в воде), исключение – гидроксид кальция, который, хотя и обозначен буквой «М», все же в водном растворе хорошо диссоциирует на ионы.
3. Нужно помнить, что на ионы не разлагаются металлы, оксиды металлов и неметаллов, вода, газообразные вещества, нерастворимые в воде соединения, обозначенные в таблице растворимости буквой «Н». Формулы этих веществ записывают в молекулярном виде. Получают полное ионное уравнение.
4. Сокращают одинаковые ионы до знака «равно» и после него в уравнении. Получают сокращенное ионное уравнение.
5. Помните!
На ионы диссоциируют |
|
Реагенты (исходные вещества) |
Продукты реакции |
Растворимые (P) в воде (см. ТР): 1. Соли 2. Кислоты 3. Основания (Включая Ca(OH)2 – M) |
Растворимые (P) в воде (см. ТР): 1. Соли 2. Кислоты 3. Основания Исключения – неустойчивые вещества не диссоциируют, а разлагаются на газ и воду: h3CO3 ↔ h3O + CO2↑ h3SO3 ↔ h3O + SO2↑ Nh5OH↔ h3O + Nh4↑ h3S↑ (сероводород сам выделяется в виде газа) |
Р — растворимое вещество;
М — малорастворимое вещество;
ТР — таблица растворимости.
3. Алгоритм составления реакций ионного обмена в молекулярном, полном и кратком ионном виде
1). Записываем уравнение РИО в молекулярном виде: |
Взаимодействие серной кислоты и хлорида бария: II II I I h3SO4 + BaCl2 = BaSO4 + 2HCl |
2). Используя ТР указываем растворимость веществ воде: — Если продукт является М или Н – оно выпадает в осадок, справа от химической формулы ставим знак ↓; — Если продукт является газом, справа от химической формулы ставим знак ↑. |
Р Р Н Р h3SO4 + BaCl2 = BaSO4 ↓+ 2HCl Молекулярный вид |
3). Записываем уравнение РИО в полном ионном виде. Какие вещества диссоциируют см. в таблице — ПАМЯТКЕ |
2H+ + SO42- + Ba2+ + 2Cl- = BaSO4 ↓+ 2H+ + 2Cl- Полный ионный вид |
4). |
SO42- + Ba2+ + = BaSO4 ↓ Краткий ионный вид Вывод – данная реакция необратима, т. е. идёт до конца, т. к. образовался осадок BaSO4 ↓ |
4. Примеры составления реакций ионного обмена
1. Если в результате реакции выделяется малодиссоциирующее (мд) вещество – вода.
а) Молекулярное уравнение реакции щелочи с кислотой:
KOH (р) + HCl (р) = KCl(р) + h3O (мд)
Полное ионное уравнение реакции:
K+ + OH– + H+ + Cl– = K+ + Cl– + h3O
Cокращенное ионное уравнение реакции:
H+ + OH– = h3O
б) Молекулярное уравнение реакции основного оксида с кислотой:
CaO (оксид) + 2HNO3 (р) = Ca(NO3)2 (р) + h3O (мд)
Полное ионное уравнение реакции:
CaO + 2H+ + 2NO3- = Ca2+ + 2NO3- + h3O
Cокращенное ионное уравнение реакции:
CaO + 2H+ = Ca2+ + h3O.
в) Молекулярное уравнение реакции нерастворимого основания с кислотой:
3Mg(OH)2 (н) + 2h4PO4 (р) = Mg3(PO4)2↓ + 6h3O (мд)
Полное ионное уравнение реакции:
3Mg(OH)2 + 6H+ + 2PO43- = Mg3(PO4)2↓ + 6h3O
В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.
2. Если в результате реакции выделяется нерастворимое в воде вещество.
а) Молекулярное уравнение реакции растворимой соли со щелочью:
CuCl2 (р) + 2KOH (р) = 2KCl(р) + Cu(OH)2↓
Полное ионное уравнение реакции:
Cu2+ + 2Cl– + 2K+ + 2OH– = 2K+ + 2Cl– + Cu(OH)2↓.
Cокращенное ионное уравнение реакции:
Cu2+ + 2OH– = Cu(OH)2↓.
б) Молекулярное уравнение реакции двух растворимых солей:
Al2(SO4)3 (р) + 3BaCl2 (р) = 3BaSO4↓ + 2AlCl3(р)
Полное ионное уравнение реакции:
2Al3+ + 3SO42- + 3Ba2+ + 6Cl- = 3BaSO4↓ + 2Al3+ + 6Cl-
Cокращенное ионное уравнение реакции:
SO42- + Ba2+ = BaSO4↓
в) Молекулярное уравнение реакции нерастворимого основания с кислотой:
Fe(OH)3 (н) + h4PO4 (р) = FePO4↓ + 3h3O.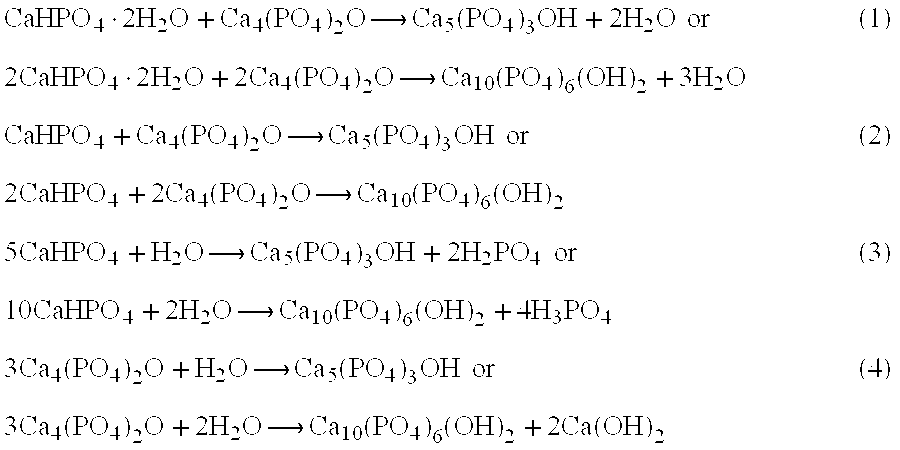
Полное ионное уравнение реакции:
Fe(OH)3 + 3H+ + PO43- = FePO4↓ + 3h3O.
В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
3. Если в результате реакции выделяется газообразное вещество.
а) Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой:
K2S + 2HCl = 2KCl + h3S↑.
Полное ионное уравнение реакции:
2K+ + S2– + 2H+ + 2Cl– = 2K+ + 2Cl– + h3S↑.
Cокращенное ионное уравнение реакции:
S2– + 2H+ = h3S↑.
б) Молекулярное уравнение реакции растворимой соли (карбоната) с кислотой:
Na2CO3 + 2HNO3 = 2NaNO3 + h3O + CO2↑
Полное ионное уравнение реакции:
2Na+ + CO32- + 2H+ + 2NO3- = 2Na+ + CO2↑ + h3O + 2NO3-
Cокращенное ионное уравнение реакции:
CO32- + 2H+ = CO2↑ + h3O
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода(IV).
в) Молекулярное уравнение реакции нерастворимой соли (карбоната) с кислотой:
3СaCO3 + 2h4РO4 = Са3(PO4)2↓ + 3h3O + 3CO2↑
Полное ионное уравнение реакции:
3СaCO3 + 6H+ + 2 РO43- = Са3(PO4)2↓ + 3h3O + 3CO2↑
В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.
5. Домашнее задание
П. 4, упр. 1-3, задача 1 на стр. 22
Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука
| Похожие вопросы |
У Ани было две ленты:зеленая и желтая. Зелёная на 3 дм.длиннее желтой. Аня отрезала от зелёной 6дм.,а от желтой 2дм.Какая лента стала длиннее? На сколько см?
Зелёная на 3 дм.длиннее желтой. Аня отрезала от зелёной 6дм.,а от желтой 2дм.Какая лента стала длиннее? На сколько см?
Решено
В идеальном колебательном контуре амплитуда колебаний силы тока в катушке индуктивности Im = 5 мА, а амплитуда напряжения на конденсаторе Um = 2,0 В. В момент времени t сила тока в катушке 3
Решено
Постройте график функции у=cos (x-пи/6) б) укажите промежутки возрастания и убывания функции; в) определите нули функции.
Решено
Сирена пожарной машины включается каждые две секунды. С какой скоростью (км/ч) мчится эта машина, если наблюдатель, к которому она приближается, слышит звуки сирены с интервалом 1,8 с?
Подберите публикации из СМИ и Интернета о хозяйственном использовании вод суши человеком и охране водных ресурсов . На основе этих материалов напишите реферат или сделайте сообщение в классе Помогите
Пользуйтесь нашим приложением
Задания №8 с решениями
Главная \ Подготовка к ОГЭ \ Химия \ Задания №8 с решениями
Задания №8 с решениями.
Рассмотрим задания №8 из вариантов ОГЭ за 2016 год.
Перед решением советуем повторить тему «Полные и сокращенные ионные уравнения химических реакций».
Задания с решением.
Задание №1.
Уравнению реакции
Zn(OH)2 + h3SO4 → ZnSO4 + 2h3O
соответствует сокращенное ионное уравнение:
1. H+ + OH‾ → h3O
2. Zn(OH)2 + 2H+ → Zn2+ + 2h3O
3. Zn2+ + SO4²‾ → ZnSO4
4. Zn2+ + h3SO4 → Zn2+ SO4²‾ + 2H+
Объяснение: запишем полное ионное уравнение реакции
Zn2+ + 2OH‾ + 2H+ + SO4²‾ → Zn2+ + SO4²‾ + 2h3O
сократим одинаковые ионы (несокращаемые выделены) в правой и левой частях, разделим все на два и запишем сокращенное ионное уравнение
H+ + OH‾ → h3O
Правильный ответ — 1.
Задание №2.
В соответствии с сокращенным ионным уравнением
Al3+ + 3OH‾ → Al(OH)3
взаимодействуют:
1. Сульфат алюминия и гидроксид бария
Сульфат алюминия и гидроксид бария
2. Нитрат алюминия и гидроксид калия
3. Оксид алюминия и гидроксид натрия
4. Фосфат алюминия и гидроксид кальция
Объяснение: гидроксид алюминия нерастворим, поэтому все другие вещества, которые присутствуют в полном ионном уравнении должны быть растворимы. Первый вариант не подходит, потому что образуется сульфат бария — нерастворимая соль. №3 с оксидом алюминия не подходит тоже, так как оксиды в растворе не диссоциируют. №4 с продуктом фосфатом кальция тоже не подходит — это нерастворимая соль. Остается один вариант — №2.
Проверим:
Al(NO3)3 + 3KOH → Al(OH)3↓ + 3KNO3
Al3+ + 3NO3‾ + 3K+ + 3OH‾ → Al(OH)3↓ + 3K+ + 3NO3‾
Al3+ + 3OH‾ → Al(OH)3↓
Правильный ответ — 2.
Задание №3.
Нерастворимая соль образуется при взаимодействии веществ, формулы которых
1. NaOH(р-р) и h4PO4(р-р)
NaOH(р-р) и h4PO4(р-р)
2. HNO3(р-р) и Al2O3
3. Ca(OH)2(р-р) и K3PO4(р-р)
4. CuCl2(р-р) и Ca(OH)2(р-р)
Объяснение: все соли натрия, калия и все нитраты растворимы. А также растворим хлорид кальция. Остается №3:
3Ca(OH)2 + 2K3PO4 → Ca3(PO4)2↓ + 6KOH
Правильный ответ — 3.
Задание №4.
Осадок образуется при взаимодействии
1. CaCO3 и h3SO4
2. Ca(OH)2 и CO2(изб)
3. Na2CO3 и HNO3
4. Ca(OH)2 и CO2(недост)
Объяснение: рассмотрим продукты реакций:
1. CaSO4 — малорастворим, но растворим
2. Ca(HCO3)2 — растворим
3. NaNO3 — растворим
4. CaCO3 — нерастворим
Правильный ответ — 4.
Задание №5.
Сокращенное ионное уравнение
2H+ + SiO3²‾ → h3SiO3
Соответствует взаимодействию веществ, формулы которых:
1. K2O и SiO2
K2O и SiO2
2. Na3PO4 и K2SiO3
3. K2SiO3 и HNO3
4. Li2SiO3 и KOH
Объяснение: №1 содержит K2O — недиссоциирующее вещество, №2 не подходит, потому что это реакция обмена между двумя солями, в ходе которой образуются две соли другого состава (реакция обмена не идет, если не выпадает осадок или не выделяется газ).
№4 очень похож на №2.
Проверим правильность №3
K2SiO3 + 2HNO3 → 2KNO3 + h3O + SiO2
2K+ + SiO3²‾ + 2H+ + 2NO3‾ → 2K+ + 2NO3‾ + h3O + SiO2
SiO3²‾ + 2H+ → h3O + SiO2
Правильный ответ — 3.
Задание №6.
В соответствии с сокращенным ионным уравнением
Al3+ + PO4³‾ → AlPO4
взаимодействуют вещества, формулы которых:
1. AlCl3 и Na3PO4
2. Al2O3 и h4PO4
3. Al(OH)3 и Na3PO4
4. Al2(SO4)3 и Ca3(PO4)2
Объяснение: среди перечисленных нерастворимыми являются: Al2O3, Al(OH)3, Ca3(PO4)2, следовательно, они останутся в растворе. Тогда нам нужно выбрать такой вариант, в котором оба вещества, вступающих в реакцию, будут растворимы — это AlCl3 + Na3PO4.
Тогда нам нужно выбрать такой вариант, в котором оба вещества, вступающих в реакцию, будут растворимы — это AlCl3 + Na3PO4.
Правильный ответ — 1.
Задание №7.
Необратимая реакция протекает при сливании растворов веществ, формулы которых
1. CaCl2 и HNO3
2. Fe(NO3)2 и KOH
3. NaOH и LiCl
4. Fe2(SO4)3 и Cu(NO3)2
Объяснение: во всех вариантах ответа проходит реакция обмена, а, как известно, реакция обмена идет только в том случае, если образуется осадок или газ.
В данном случае в варианте 2 образуется осадок Fe(OH)2.
Правильный ответ — 2.
Задание №8.
Нерастворимое основание образуется при взаимодействии растворов веществ, формулы которых:
1. NaOH и h3SO4
2. HNO3 и Fe(OH)3
3. Ba(OH)2 и Na2CO3
4. Fe2(SO4)3 и KOH
Объяснение: в первых двух вариантах, помимо солей, образуется вода. В варианте 3 образуется NaOH — растворимое основание, а в варианте 4 образуется Fe(OH)3 — нерастворимое основание. Правильный ответ — 4.
В варианте 3 образуется NaOH — растворимое основание, а в варианте 4 образуется Fe(OH)3 — нерастворимое основание. Правильный ответ — 4.
Задание №9.
Нерастворимое вещество образуется при взаимодействии растворов:
1. Гидроксида натрия и серной кислоты
2. Нитрата цинка и соляной кислоты
3. Сульфата калия и хлорида меди (II)
4. Гидроксида бария и хлорида меди (II)
Объяснение: среди веществ, которые получаются в данных реакциях, нерастворимым является только Cu(OH)2 — гидроксид меди (II).
Ba(OH)2 + CuCl2 → BaCl2 + Cu(OH)2↓
Правильный ответ — 4.
Задание №10.
В соответствии с сокращенным ионным уравнением
Fe3+ + 3OH‾ → Fe(OH)3
могут взаимодействовать растворы веществ, формулы которых:
1. Fe2(SO4)3 и KOH
2. FeCl2 и Ca(OH)2
3. Ba(OH)2 и FeSO4
Ba(OH)2 и FeSO4
4. Fe(NO3)2 и Ba(OH)2
Объяснение: запишем первую реакцию
Fe2(SO4)3 + 6KOH → 2Fe(OH)3↓ + 3K2SO4
2Fe3+ + 3SO4²‾ + 6K+ + 6OH‾ → 2Fe(OH)3↓ + 6K+ + 3SO4²‾
(делим на два)
Fe3+ + 3OH‾ → Fe(OH)3
Правильный ответ — 1.
Автор решения: Лунькова Е.Ю.
Задания для самостоятельного решения.
1. Гидроксид бария вступает в реакцию ионного обмена:
1. С оксидом углерода (II)
2. С карбонатом кальция
3. С сульфатом алюминия
4. С хлоридом лития
2. В соответствии с сокращенным ионным уравнением
2H+ + SiO3²‾ → h3SiO3
могут взаимодействовать вещества, формулы которых:
1. K3PO4 и Na2SiO3
2. Na2O и SiO2
3. Li2SiO3 и NaOH
4. h3SO4 и Na2SiO3
3. Сокращенное ионное уравнение
Н+ + ОН‾ → Н2О
соответствует взаимодействию
1. Гидроксида натрия и кремниевой кислоты
Гидроксида натрия и кремниевой кислоты
2. Гидроксида калия и серной кислоты
3. Гидроксида меди (II) и серной кислоты
4. Гидроксида бария и серной кислоты
4. Верны ли следующие суждения о реакциях ионного обмена?
А. Реакция между растворами сульфата натрия и хлорида бария протекает необратимо
Б. Реакция между соляной кислотой и раствором фосфата магния протекает необратимо
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
5. Верны ли следующие суждения о реакциях ионного обмена?
А. Реакции между растворами нитрата свинца и серной кислотой протекает необратимо
Б. Реакция между растворами гидроксида калия и сульфата аммония протекает необратимо
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
6. Сокращенное ионное уравнение
2Н+ + СО3²‾ → Н2О + СО2
соответствует взаимодействию:
1. Карбоната кальция и соляной кислоты
Карбоната кальция и соляной кислоты
2. Карбоната натрия и соляной кислоты
3. Карбоната калия и кремниевой кислоты
4. Гидрокарбоната натрия и соляной кислоты
7. Сокращенное ионное уравнение
Н+ + ОН‾ → Н2О
соответствует взаимодействию
1. Гидроксида бария и соляной кислоты
2. Гидроксида магния и серной кислоты
3. Гидроксида алюминия и соляной кислот
4. Гидроксида меди (II) и серной кислоты
8. Верны ли следующие суждения о реакциях ионного обмена?
А. Реакции ионного обмена протекают в случае образования осадка, газа или слабого электролита
Б. Реакция между растворами хлорида кальция и фосфата натрия протекает практически необратимо
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
9. Практически необратимо протекает реакция между растворами
1. Гидроксида калия и фосфата калия
2. Гидроксида калия и хлорида натрия
3. Гидроксида калия и нитрата аммония
Гидроксида калия и нитрата аммония
4. Гидроксида калия и нитрата бария
10. Практически необратимо протекает реакция между растворами
1. Гидроксида натрия и хлорида бария
2. Гидроксида натрия и сульфата меди(II)
3. Гидроксида натрия и фосфата бария
4. Гидроксида кальция и хлорида калия
Предоставленные задания были взяты из сборника для подготовки к ОГЭ по химии авторов: Корощенко А.С. и Купцовой А.А.
Ионные уравнения реакций — презентация онлайн
Похожие презентации:
Ионные уравнения реакции
Ионные уравнения
Реакции ионного обмена
Электролитическая диссоциация. Ионные реакции
Реакции ионного обмена
Растворы. Теория электролитической диссоциации
Электролитическая диссоциация. Реакции ионного обмена
Реакции ионного обмена
Реакции ионного обмена
Соли и реакции ионного обмена
1. Три пути ведут к знанию: путь размышления – самый благородный, путь подражания – самый легкий, и путь опыта – это самый
горький.
6. Ионные уравнения реакций.
Цель: Познакомиться с понятием ионныеуравнения и рассмотреть случаи, при
которых реакции ионного обмена
протекают до конца.
7. ВОПРОСЫ
. Какиевещества называются
Что
называется
электролитической
Что
называется
солью
в свете
ТЭД?
Какие
Что
Что
Что
называется
называется
вещества
называется
называются
основанием
кислотой
ионом?
в
электролитами?
в
свете
свете
ТЭД?
ТЭД?
неэлектролитами?
диссоциацией?
8. Ионы
Большинство химических реакций протекает врастворах. Растворы электролитов содержат
ионы.
НСl + AgNO3 → AgCl + НNO3
Реакции ионного обмена записывают
тремя уравнениями:
молекулярное
полное ионно-молекулярное
сокращенное ионно-молекулярное
Ионные реакции – это реакции между ионами.
Ионные уравнения – это уравнения ионных реакций.
Например:
2Na+ + CO32- + 2H+ + 2Cl- = 2Na+ +2 Cl- + h3O + CO2
2K+ + CO32-+ 2H+ + 2NO3- =2K+ + 2NO3- + h3O + CO2
12.
 Практическое исследованиеПомните, что любое
Практическое исследованиеПомните, что любоевещество может быть
опасным, если
обращаться
с ним неправильно!
Без указания учителя не смешивайте
неизвестные вам вещества!
Никогда не пробуйте химические вещества
на вкус!
15. Реакции ионного обмена, идущие с выделением осадка
Выпадает осадок (↓)CuSO4 + 2NaOH= Cu(OH) 2 ↓ + Na2SO4
Cu2+ +SO42- +2Na++2OH — = Cu(OH) 2 ↓+2Na++ SO4
Ca2++ 2OH -= Ca(OH) 2 ↓
2-
Взаимодействие ионов в растворе
Na+
SO42SO4
SO42-
2-
Na+
Cu2+
OH-
↓
Na+
SO42Na+
17. Реакции ионного обмена, идущие с выделением газа
Выделяется газ (↑)2HCl + Na2CO3 = h3CO3 + 2 NaCl
h3O + CO2 ↑
2H+ +2Cl-+2Na++CO32- = h3O+CO2↑+2Na++2Cl 2H+ + CO32- = h3O + CO2 ↑
Взаимодействие ионов в растворе
Cl-
Na+
H+
Cl-
2-
CO3
ClNa+
H+
h3O
CO2
Na+
Cl-
Na+
19. Реакции ионного обмена, идущие с образованием слабого электролита
Образуется водаHCl + NaOH = NaCl + h3O
H+ +Cl- +Na++ OH- = h3O + Na++ ClH++ OH- = h3O
Взаимодействие ионов в растворе
ClNa+
OH-
H+
h3O
Na+
Cl-
21.
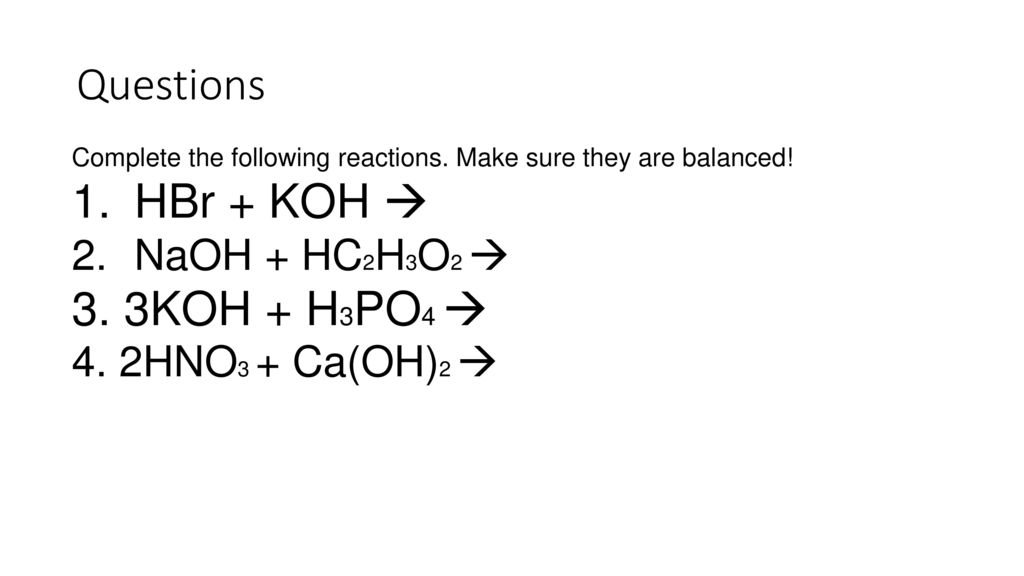 Обратимые реакцииNa2SO4 + KI
Обратимые реакцииNa2SO4 + KI1.Нет осадка
2.Не выделяется газ
3.Не образуется
слабый электролит
K+
Na+
I-
SO42-
В соответствии с правилом Бертолле ионные
реакции протекают практически необратимо:
I случай
III случай
II случай
В остальных случаях реакции обратимы!
23. Реакции ионного обмена
h3SИдут до конца:
CuSO4 + NaOH
2-
—
SO4 OH
Cu2+ Na+
Сu(OH)2
Na2S + HCl
Na
H+
+
S2-
HNO3 + KOH
K+
H+
h3O
Cl-
NO3- OH-
Выпадает
осадок
Выделяется газ
Образуется
слабый
электролит
Уравнение
реакции
Уравнение
реакции
Уравнение реакции
Очистка воды
1. Для уменьшения жёсткости воды
путём замены обусловливающих её
ионов кальция и магния на другие,
например, натрия.
2. Для обессоливания воды, при этом
удаляются и катионы, и анионы
путём
последовательного
прохождения воды через катионит и
анионит.

3. Для обезжелезивания воды особую
роль играет возможность катионов
удалять двухвалентное железо.
4. Очистка
сточных
вод
промышленных предприятий.
В пищевой промышленности:
1.Очистка соков в производстве сахара.
2.В производстве дрожжей, фруктовых соков,
глицерина, глюкозы, сгущенного молока, какао,
кофе со сгущенным молоком.
26. Применение ионитов
В медицине:1.Для увеличения сроков хранения крови.
2.Для производства, выделения и очистки
антибиотиков.
3.Использование ионитов, селективно извлекающих
токсические вещества из крови человека.
Сокращенному ионному уравнению
Bа2+ + SО42BаSО4
соответствуют схемы уравнений
химических реакций
1. BаСl2 + K2SO4
2. BaO + h3SO4
3. Ba + h3SO4
4. Ba(OH)2 + Na2SO4
Сокращенному ионному уравнению
Н+ + ОНh3O
соответствуют схемы уравнений
химических реакций
1. HСl + Fe(OH)2
2. Zn(OH)2 + h3SO4
3. NaOH + h4PO4
4. HNO3 + Ca(OH)2
29.
 Сокращенное ионное уравнение реакции соответствует взаимодействию:+
Сокращенное ионное уравнение реакции соответствует взаимодействию:+Al2O3 + 6H = 2Al
3+
+ 6h3O
1.Al2O3 + 3CO2 = Al2(CO3)3
2.Al(NO3)3 + 3KOH = 3KNO3 + Al(OH)3
3.Al2O3 + 3h3SO4 = Al2(SO4)3 + 6h3O
4.AlCL3 + h3O = AlOHCl2+ + HCl
Правильно
Ошибка
Установи соответствие
между продуктами реакций ионного обмена
и схемами реакций
осадок
НСl + K2S =>
Ca(OH)2 + НСl =>
газ
NaOH + НРO3 =>
FeCl2 + KOH =>
вода
CaCO3 + Н2SO4 =>
31. Укажите ряд, в котором ионы каждой пары взаимодействуют в растворах с образованием :
21.SO4 и+
+
2.Cl и Fe
2+
2+
—
2+
—
H ; Ag и Cl
2+
4.Ba
и OH
+
; Na и
2-
и SO4
AgCl
—
; Fe
3.OH и Cu
Fe(OH)2
—
2+
; Cu
2SiO3
—
и OH
BaSO4
Cu(OH)2
Cu(OH)2
33. Домашнее задание
§ 37, упр. 4, 5.В сточных водах гальванического цеха
химического завода обнаружены катионы
Fe3+, Fe2+, Ni2+ и анионы Cl-, SO42-.
 Как с
Как спомощью реакций ионного обмена можно
очистить эти стоки?
34. Список источников
1) Габриелян О.С. Химия. 8 класс: учеб. дляобщеобразоват. учрежд. / О.С. Габриелян. – 16 изд.,
стереотип. – М.: Дрофа, 2013.
Использованы фотографии:
http://900igr.net/datai/fizika/Tok-vrastvorakh/0011-001-Skhema-elektroliticheskojdissotsiatsii.gif
ионы хлорид натрия
http://pochit.ru/matematika/71334/index.html
образование малорастворимого вещества
образование газообразного вещества
образование слабого электролита — воды
English Русский Правила
Конспект урока и презентация. Ионные уравнения.
#8 класс #Химия #Учебно-методические материалы #Презентация #Учитель-предметник #Школьное образование
Три пути ведут к знанию: путь размышления – самый благородный, путь подражания – самый легкий, и путь опыта – это самый горький.
Возвращенные шедевры
Джорджоне.Юдифь.
И.И. Левитан. У омута.
И. К.Айвазовский.Радуга.
К.Айвазовский.Радуга.
Ионные уравнения реакций. Цель: Познакомиться с понятием ионные уравнения и рассмотреть случаи, при которых реакции ионного обмена протекают до конца.
ВОПРОСЫ Какие вещества называются электролитами? . Какие вещества называются неэлектролитами? Что называется ионом? Что называется электролитической диссоциацией? Что называется кислотой в свете ТЭД? Что называется солью в свете ТЭД? Что называется основанием в свете ТЭД?
Ионы Большинство химических реакций протекает в растворах. Растворы электролитов содержат ионы.
НСl + AgNO3 → AgCl + НNO3
. Реакции ионного обмена записывают тремя уравнениями: молекулярное полное ионно-молекулярное сокращенное ионно-молекулярное
.
Ионные реакции – это реакции между ионами. Ионные уравнения – это уравнения ионных реакций.
Например:
2Na+ + CO32- + 2H+ + 2Cl- = 2Na+ +2 Cl- + h3O + CO2
2K+ + CO32-+ 2H+ + 2NO3- =2K+ + 2NO3- + h3O + CO2
Ионные уравнения – это уравнения ионных реакций.
Например:
2Na+ + CO32- + 2H+ + 2Cl- = 2Na+ +2 Cl- + h3O + CO2
2K+ + CO32-+ 2H+ + 2NO3- =2K+ + 2NO3- + h3O + CO2
Практическое исследование
Помните, что любое вещество может быть опасным, если обращаться с ним неправильно! Без указания учителя не смешивайте неизвестные вам вещества!
Никогда не пробуйте химические вещества на вкус!
Реакции ионного обмена, идущие с выделением осадка
CuSO4 + 2NaOH= Cu(OH) 2 ↓ + Na2SO4 Выпадает осадок (↓) CuSO4 + 2NaOH= Cu(OH) 2 ↓ + Na2SO4 Cu2+ +SO42- +2Na++2OH — = Cu(OH) 2 ↓+2Na++ SO4 2- Ca2++ 2OH -= Ca(OH) 2 ↓ SO42- Na+ Cu2+ OH- SO42- Взаимодействие ионов в растворе Na+ Na+ Na+ ↓ SO42- SO42-
Реакции ионного обмена, идущие с выделением газа
2HCl + Na2CO3 = h3CO3 + 2 NaCl Выделяется газ (↑) 2HCl + Na2CO3 = h3CO3 + 2 NaCl h3O + CO2 ↑ 2H+ +2Cl-+2Na++CO32- = h3O+CO2↑+2Na++2Cl — 2H+ + CO32- = h3O + CO2 ↑ Cl- Cl- H+ CO32- Cl- Cl- Взаимодействие ионов в растворе H+ CO2 h3O Na+ Na+ Na+ Na+
Реакции ионного обмена, идущие с образованием слабого электролита
HCl + NaOH = NaCl + h3O Образуется вода HCl + NaOH = NaCl + h3O H+ +Cl- +Na++ OH- = h3O + Na++ Cl- H++ OH- = h3O Cl- Na+ H+ OH- Cl- Взаимодействие ионов в растворе Na+ h3O
Обратимые реакции
Na2SO4 + KI
Na+
SO42-
K+
I-
1. Нет осадка
2.Не выделяется газ
3.Не образуется
слабый электролит
Нет осадка
2.Не выделяется газ
3.Не образуется
слабый электролит
В соответствии с правилом Бертолле ионные реакции протекают практически необратимо: I случай II случай III случай В остальных случаях реакции обратимы!
Идут до конца: CuSO4 + NaOH Na2S + HCl HNO3 + KOH Cu2+ SO42- Na+ OH- Na+ S2- H+ Cl- H+ NO3- K+ OH- Сu(OH)2 h3S h3O Выпадает осадок Выделяется газ Образуется слабый электролит Уравнение реакции Уравнение реакции Уравнение реакции
Для уменьшения жёсткости воды путём замены обусловливающих её ионов кальция и магния на другие, например, натрия. Для обессоливания воды, при этом удаляются и катионы, и анионы путём последовательного прохождения воды через катионит и анионит.
Для обезжелезивания воды особую роль играет возможность катионов удалять двухвалентное железо.
Очистка сточных вод промышленных предприятий.
Очистка воды
Для обессоливания воды, при этом удаляются и катионы, и анионы путём последовательного прохождения воды через катионит и анионит.
Для обезжелезивания воды особую роль играет возможность катионов удалять двухвалентное железо.
Очистка сточных вод промышленных предприятий.
Очистка воды
В пищевой промышленности: 1.Очистка соков в производстве сахара. 2.В производстве дрожжей, фруктовых соков, глицерина, глюкозы, сгущенного молока, какао, кофе со сгущенным молоком.
Применение ионитов В медицине: 1.Для увеличения сроков хранения крови. 2.Для производства, выделения и очистки антибиотиков. 3.Использование ионитов, селективно извлекающих токсические вещества из крови человека.
Сокращенному ионному уравнению
Сокращенному ионному уравнению
Bа2+ + SО42- BаSО4
соответствуют схемы уравнений химических реакций
1. BаСl2 + K2SO4
2. BaO + h3SO4
3. Ba + h3SO4
4. Ba(OH)2 + Na2SO4
BaO + h3SO4
3. Ba + h3SO4
4. Ba(OH)2 + Na2SO4
Сокращенному ионному уравнению Сокращенному ионному уравнению Н+ + ОН- h3O соответствуют схемы уравнений химических реакций 1. HСl + Fe(OH)2 2. Zn(OH)2 + h3SO4 3. NaOH + h4PO4 4. HNO3 + Ca(OH)2
Сокращенное ионное уравнение реакции соответствует взаимодействию: Al2O3 + 6H+ = 2Al3+ + 6h3O 1.Al2O3 + 3CO2 = Al2(CO3)3 2.Al(NO3)3 + 3KOH = 3KNO3 + Al(OH)3 3.Al2O3 + 3h3SO4 = Al2(SO4)3 + 6h3O 4.AlCL3 + h3O = AlOHCl2+ + HCl Правильно Ошибка
Установи соответствие между продуктами реакций ионного обмена и схемами реакций газ Ca(OH)2 + НСl => NaOH + НРO3 => CaCO3 + Н2SO4 => НСl + K2S => осадок вода FeCl2 + KOH =>
Укажите ряд, в котором ионы каждой пары взаимодействуют в растворах с образованием :
1. SO42-и H+ ; Ag+ и Cl-
2.Cl- и Fe 2+ ; Fe2+ и OH-
3.OH- и Cu2+ ; Na+ и SiO32-
4.Ba2+ и SO42- ; Cu2+ и OH-
AgCl
Fe(OH)2
Cu(OH)2
BaSO4
Cu(OH)2
SO42-и H+ ; Ag+ и Cl-
2.Cl- и Fe 2+ ; Fe2+ и OH-
3.OH- и Cu2+ ; Na+ и SiO32-
4.Ba2+ и SO42- ; Cu2+ и OH-
AgCl
Fe(OH)2
Cu(OH)2
BaSO4
Cu(OH)2
Домашнее задание § 37, упр. 4, 5. В сточных водах гальванического цеха химического завода обнаружены катионы Fe3+, Fe2+, Ni2+ и анионы Cl-, SO42-. Как с помощью реакций ионного обмена можно очистить эти стоки?
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения.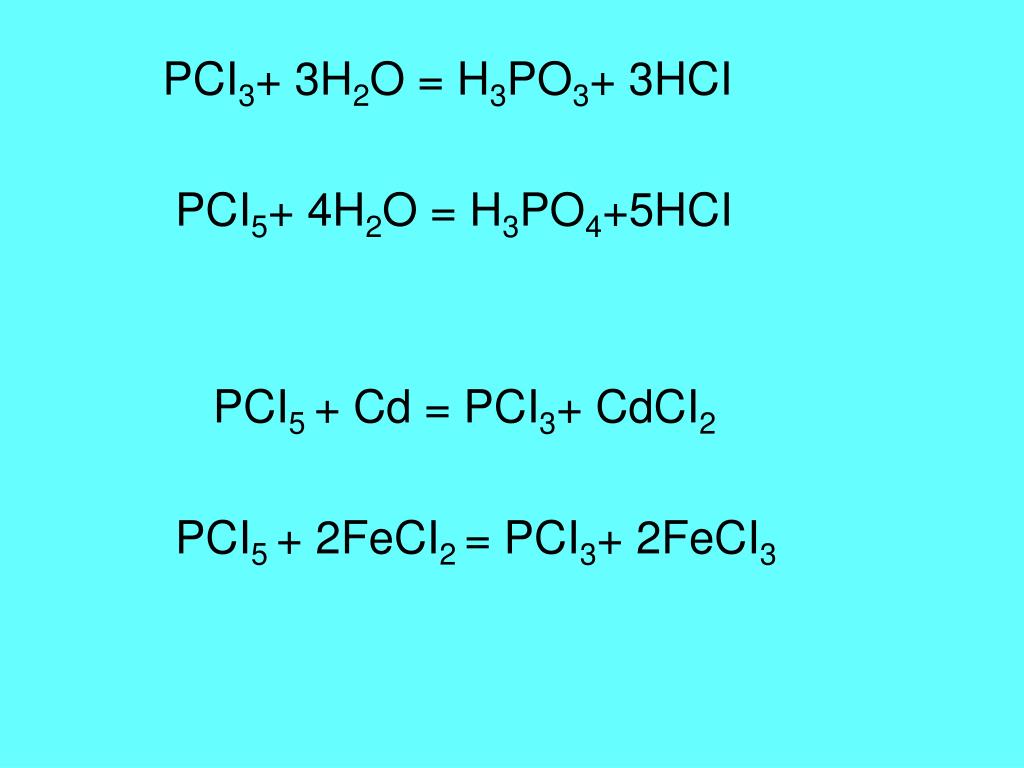 На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/NXwmZ4aXXsQ» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/WIbBf3NZEZI» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/dihxr1liTvQ» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
Молекулярные, ионные и суммарные ионные уравнения
Дополнительные химические уравнения
Физические состояния реагентов и продуктов в химических уравнениях очень часто обозначаются аббревиатурой в скобках после формул. Общие сокращения включают s для твердых веществ, l для жидкостей, g для газов и aq для веществ, растворенных в воде ( водные растворы , как было введено в предыдущей главе). Эти обозначения проиллюстрированы в примере уравнения здесь:
Общие сокращения включают s для твердых веществ, l для жидкостей, g для газов и aq для веществ, растворенных в воде ( водные растворы , как было введено в предыдущей главе). Эти обозначения проиллюстрированы в примере уравнения здесь:
[латекс] 2 \ текст {Na (} с \ текст {)} + 2 {\ текст {H}} _ {2} \ текст {O (} л \ текст {)} \ стрелка вправо 2 \ текст {NaOH (}aq\text{)}+{\text{H}}_{2}\text{(}g\text{)}[/latex]
Это уравнение представляет собой реакцию, которая происходит при помещении металлического натрия в воде. Твердый натрий реагирует с жидкой водой с образованием газообразного молекулярного водорода и ионного соединения гидроксида натрия (твердое вещество в чистом виде, но легко растворяется в воде).
Особые условия, необходимые для реакции, иногда обозначаются написанием слова или символа над или под стрелкой уравнения. Например, реакция, проводимая при нагревании, может быть обозначена заглавной греческой буквой дельта (Δ) над стрелкой.
[латекс] {\ текст {CaCO}} _ {3} \ текст {(} s \ текст {)} \ stackrel {\ Delta} {\ стрелка вправо} \ текст {CaO (} s \ текст {)} + {\text{CO}}_{2}\text{(}g\text{)}[/latex]
Другие примеры этих особых условий будут рассмотрены более подробно в следующих главах.
Уравнения для ионных реакций
Учитывая обилие воды на Земле, само собой разумеется, что в водной среде происходит очень много химических реакций. Когда в этих реакциях участвуют ионы, химические уравнения могут быть написаны с различным уровнем детализации, соответствующим их предполагаемому использованию. Чтобы проиллюстрировать это, рассмотрим реакцию между ионными соединениями, протекающую в водном растворе. Когда водные растворы CaCl 2 и AgNO 3 смешивают, происходит реакция с образованием водного Ca(NO 3 ) 2 и твердого AgCl:
[латекс]{\text{CaCl}}_{2}\text{ (}водн.\текст{)}+2{\текст{AgNO}}_{3}\текст{(}водн.текст{)}\стрелка вправо\текст{Ca}{\текст{(}{\текст{НЕТ }}_{3}\text{)}}_{2}\text{(}aq\text{)}+2\text{AgCl(}s\text{)}[/latex]
Это сбалансированное уравнение , полученное обычным способом, называется молекулярным уравнением , потому что оно явно не представляет ионные частицы, присутствующие в растворе. Когда ионные соединения растворяются в воде, они могут 9{+}\text{(}aq\text{)}\rightarrow\text{AgCl(}s\text{)}[/latex]
Когда ионные соединения растворяются в воде, они могут 9{+}\text{(}aq\text{)}\rightarrow\text{AgCl(}s\text{)}[/latex]
Это суммарное ионное уравнение показывает, что твердый хлорид серебра может быть получен из растворенного хлорида и ионы серебра(I) независимо от источника этих ионов. Эти молекулярные и полные ионные уравнения дают дополнительную информацию, а именно, ионные соединения, используемые в качестве источников Cl – и Ag + .
Пример 2:
Молекулярные и ионные уравненияКогда диоксид углерода растворяется в водном растворе гидроксида натрия, смесь реагирует с образованием водного карбоната натрия и жидкой воды. Напишите сбалансированные молекулярные, полные ионные и суммарные ионные уравнения для этого процесса.
Показать ответ
Check Your LearningДвухатомный хлор и гидроксид натрия (щелок) являются товарными химическими веществами, производимыми в больших количествах вместе с двухатомным водородом путем электролиза рассола в соответствии со следующим несбалансированным уравнением:
[латекс]\текст {NaCl (} водный \ текст {)} + {\ текст {H}} _ {2} \ текст {O (} л \ текст {)} \, \, \, {\ xrightarrow {\ текст {электричество}} }\,\,\,\text{NaOH(}водн. \текст{)}+{\text{H}}_{2}\text{(}g\text{)}+{\text{Cl}} _{2}\текст{(}г\текст{)}[/латекс]
\текст{)}+{\text{H}}_{2}\text{(}g\text{)}+{\text{Cl}} _{2}\текст{(}г\текст{)}[/латекс]
Напишите сбалансированное молекулярное, полное ионное и суммарное ионное уравнения для этого процесса.
Показать ответ
Ключевые понятия и резюме
Химические уравнения представляют собой символическое представление химических и физических изменений. Формулы для веществ, претерпевающих изменение (реагентов), и веществ, образующихся при изменении (продуктов), разделены стрелкой, и им предшествуют целые коэффициенты, обозначающие их относительные номера. Сбалансированные уравнения — это те уравнения, коэффициенты которых приводят к равному количеству атомов для каждого элемента в реагентах и продуктах. Химические реакции в водном растворе, в которых участвуют ионные реагенты или продукты, могут быть более реалистично представлены полными ионными уравнениями и, более кратко, сводными ионными уравнениями.
Упражнения
- Что значит сказать, что уравнение сбалансировано? Почему важно, чтобы уравнение было сбалансированным?
- Рассмотрите молекулярные, полные ионные и суммарные ионные уравнения.

- В чем разница между этими типами уравнений?
- В каком случае полное и суммарное ионное уравнения реакции будут идентичными?
- Напишите сбалансированное молекулярное уравнение, описывающее каждую из следующих химических реакций.
- Твердый карбонат кальция нагревается и разлагается на твердый оксид кальция и газообразный диоксид углерода.
- Газообразный бутан, C 4 H 10 , реагирует с газообразным двухатомным кислородом с образованием газообразного диоксида углерода и водяного пара.
- Водные растворы хлорида магния и гидроксида натрия реагируют с образованием твердого гидроксида магния и водного хлорида натрия.
- Водяной пар реагирует с металлическим натрием с образованием твердого гидроксида натрия и газообразного водорода.
- Напишите сбалансированное уравнение, описывающее каждую из следующих химических реакций.
- Твердый хлорат калия, KClO 3 , разлагается с образованием твердого хлорида калия и газообразного двухатомного кислорода.

- Твердый металлический алюминий реагирует с твердым двухатомным йодом с образованием твердого Al 2 I 6 .
- При добавлении твердого хлорида натрия к водному раствору серной кислоты образуются газообразный хлористый водород и водный раствор сульфата натрия.
- Водные растворы фосфорной кислоты и гидроксида калия реагируют с образованием водного дигидрофосфата калия и жидкой воды.
- Твердый хлорат калия, KClO 3 , разлагается с образованием твердого хлорида калия и газообразного двухатомного кислорода.
- Красочные фейерверки часто связаны с разложением нитрата бария и хлората калия и реакцией металлов магния, алюминия и железа с кислородом.
- Напишите формулы нитрата бария и хлората калия.
- Разложение твердого хлората калия приводит к образованию твердого хлорида калия и газообразного двухатомного кислорода. Напишите уравнение реакции.
- Разложение твердого нитрата бария приводит к образованию твердого оксида бария, двухатомного азота и двухатомного кислорода. Напишите уравнение реакции.
- Напишите отдельные уравнения для реакций твердых металлов магния, алюминия и железа с газообразным двухатомным кислородом с образованием соответствующих оксидов металлов.
 (Предположим, что оксид железа содержит ионы Fe + .)
(Предположим, что оксид железа содержит ионы Fe + .)
- Заполните пропуск одной химической формулой ковалентного соединения, которая уравновешивает уравнение:
- Водный фтористый водород (фтористоводородная кислота) используется для травления стекла и анализа минералов на содержание в них кремния. Фторид водорода также будет реагировать с песком (диоксидом кремния).
- Напишите уравнение реакции твердого диоксида кремния с плавиковой кислотой с образованием газообразного тетрафторида кремния и жидкой воды.
- Минерал флюорит (фторид кальция) широко распространен в Иллинойсе. Твердый фторид кальция также может быть получен реакцией водных растворов хлорида кальция и фторида натрия с получением водного хлорида натрия в качестве другого продукта. Напишите полное и краткое ионное уравнения этой реакции.
- Новый способ получения магния из морской воды включает несколько реакций. Напишите сбалансированное химическое уравнение для каждой стадии процесса.

- Первым этапом является разложение твердого карбоната кальция из морских раковин с образованием твердого оксида кальция и газообразного диоксида углерода.
- Второй этап – образование твердого гидроксида кальция как единственного продукта реакции твердого оксида кальция с жидкой водой.
- Затем к морской воде добавляют твердый гидроксид кальция, который реагирует с растворенным хлоридом магния с образованием твердого гидроксида магния и водного хлорида кальция.
- Твердый гидроксид магния добавляют к раствору соляной кислоты с образованием растворенного хлорида магния и жидкой воды.
- Наконец, хлорид магния расплавляют и подвергают электролизу с получением жидкого металлического магния и газообразного двухатомного хлора.
- Из сбалансированных молекулярных уравнений напишите полные ионные и суммарные ионные уравнения для следующего:
- [латекс]{\text{K}}_{2}{\text{C}}_{2}{\text{O}}_{4}\text{(}aq\text{)}+ \text{Ba}{\text{(OH)}}_{2}\text{(}aq\text{)}\rightarrow 2\text{KOH(}aq\text{)}+{\text{BaC }}_{2}{\text{O}}_{2}\text{(}s\text{)}[/latex]
- [латекс] {\ text {Pb (NO}} _ {3} {\ text {)}} _ {2} \ text {(} aq \ text {)} + {\ text {H}} _ {2 }{\text{SO}}_{4}\text{(}aq\text{)}\rightarrow{\text{PbSO}}_{4}\text{(}s\text{)}+2{ \text{HNO}}_{3}\text{(}aq\text{)}[/latex]
- [латекс] {\ text {CaCO}} _ {3} \ text {(} s \ text {)} + {\ text {H}} _ {2} {\ text {SO}} _ {4} \ text{(}aq\text{)}\rightarrow{\text{CaSO}}_{4}\text{(}s\text{)}+{\text{CO}}_{2}\text{( }g\text{)}+{\text{H}}_{2}\text{O(}l\text{)}[/latex]
Показать выбранные ответы
Глоссарий
полное ионное уравнение: химическое уравнение, в котором все растворенные ионные реагенты и продукты, включая ионы-спектаторы, явно представлены формулами для их диссоциированных ионов
молекулярное уравнение: химическое уравнение, в котором все реагенты и продукты представлены в виде нейтральные вещества
результирующее ионное уравнение: химическое уравнение, в котором представлены только те растворенные ионные реагенты и продукты, которые претерпевают химические или физические изменения (исключая ионы-спектаторы)
зрительный ион: ион, который не претерпевает химических или физических изменений во время реакции, но его присутствие необходимо для поддержания нейтральности заряда
Реакции нейтрализации.
 Введение в химию. Уравнения
Введение в химию. Уравнения - Определите кислоту и основание.
- Определите реакцию нейтрализации и предскажите ее продукты.
В разделе «Кислоты» мы определили кислоту как ионное соединение, содержащее H + в качестве катиона. Это немного неверно, но пока не были разработаны дополнительные понятия, нужно было подождать лучшего определения. Теперь мы можем переопределить кислоту: это любое соединение, которое увеличивает количество иона водорода (H + ) в водном растворе. Химической противоположностью кислоты является основание. Эквивалентное определение основания состоит в том, что это соединение, которое увеличивает количество гидроксид-иона (OH — ) в водном растворе. Эти исходные определения были предложены Аррениусом (тот же человек, который предложил диссоциацию ионов) в 1884 году, поэтому они называются определениями кислоты и основания по Аррениусу соответственно.
Вы можете понять, что, основываясь на описании атома водорода, ион H + представляет собой атом водорода, потерявший свой одинокий электрон; то есть H + — это просто протон. Действительно ли у нас есть голые протоны, движущиеся в водном растворе? Нет. Более вероятно, что ион H + присоединился к одной (или нескольким) молекулам воды. Чтобы представить это химически, мы определяем H 3 O + (водн.), молекулу воды с присоединенным к ней дополнительным ионом водорода, как H 3 O + , что представляет собой дополнительный протон, присоединенный к молекуле воды. Мы используем ион гидроксония как более логичный способ появления иона водорода в водном растворе, хотя во многих химических реакциях H + и H 3 O + рассматриваются эквивалентно.
Действительно ли у нас есть голые протоны, движущиеся в водном растворе? Нет. Более вероятно, что ион H + присоединился к одной (или нескольким) молекулам воды. Чтобы представить это химически, мы определяем H 3 O + (водн.), молекулу воды с присоединенным к ней дополнительным ионом водорода, как H 3 O + , что представляет собой дополнительный протон, присоединенный к молекуле воды. Мы используем ион гидроксония как более логичный способ появления иона водорода в водном растворе, хотя во многих химических реакциях H + и H 3 O + рассматриваются эквивалентно.
Реакция кислоты и основания называется . Хотя кислоты и основания имеют свой собственный уникальный химический состав, кислота и основание нейтрализуют химический состав друг друга, образуя довольно безобидное вещество — воду. На самом деле, общая реакция между кислотой и основанием
кислота + основание → вода + соль
, где термин соль обычно используется для определения любого ионного соединения (растворимого или нерастворимого), которое образуется в результате реакции между кислотой и основанием. (В химии слово , соль относится не только к поваренной соли.) Например, сбалансированное химическое уравнение реакции между HCl (водн.) и KOH (водн.) имеет вид
(В химии слово , соль относится не только к поваренной соли.) Например, сбалансированное химическое уравнение реакции между HCl (водн.) и KOH (водн.) имеет вид
HCl(водн.) + KOH(водн.) → H 2 O(л) + KCl(водн.)
, где соль представляет собой KCl. Подсчитав количество атомов каждого элемента, мы находим, что в качестве продукта образуется только одна молекула воды. Однако в реакции между HCl(aq) и Mg(OH) 2 (водный), необходимы дополнительные молекулы HCl и H 2 O, чтобы сбалансировать химическое уравнение:
2HCl(водн.) + Mg(OH) 2 (водн.) → 2H 2 O(л) + MgCl 2 (водн.)
Здесь соль MgCl 2 . (Это одна из нескольких реакций, которые происходят, когда тип антацида — основание — используется для лечения желудочной кислоты.)
Напишите реакции нейтрализации каждой кислоты и основания.
- HNO 3 (водный) и Ba(OH) 2 (водный)
- H 3 PO 4 (водн.
 ) и Ca(OH) 2 (водн.)
) и Ca(OH) 2 (водн.)
Растворы
Сначала мы напишем химическое уравнение с формулами реагентов и ожидаемых продуктов; тогда мы сбалансируем уравнение.
- Ожидаемыми продуктами являются вода и нитрат бария, поэтому начальная химическая реакция представляет собой HNO 3 (водн.) + Ba(OH) 2 (водн.) → H 2 O(ℓ) + Ba(NO 3 ) 2 (водный). Чтобы сбалансировать уравнение, нам нужно понять, что будет два H 2 молекул O, поэтому требуются две молекулы HNO 3 :
2HNO 3 (водн.) + Ba(OH) 2 (водн.) → 2H 2 O(л) + Ba(NO 3 ) 2 (водн.)
Это химическое уравнение теперь сбалансировано.
- Ожидаемыми продуктами являются вода и фосфат кальция, поэтому исходное химическое уравнение имеет вид H 3 PO 4 (водн.) + Ca(OH) 2 (водн.) → H 2 O(ℓ) + Ca 3 (ПО 4 ) 2 (с).
 Согласно правилам растворимости, Ca 3 (PO 4 ) 2 нерастворим, поэтому он имеет метку фазы (s). Чтобы сбалансировать это уравнение, нам нужны два иона фосфата и три иона кальция; мы получаем шесть молекул воды, чтобы сбалансировать уравнение:
Согласно правилам растворимости, Ca 3 (PO 4 ) 2 нерастворим, поэтому он имеет метку фазы (s). Чтобы сбалансировать это уравнение, нам нужны два иона фосфата и три иона кальция; мы получаем шесть молекул воды, чтобы сбалансировать уравнение:2H 3 PO 4 (AQ) + 3CA (OH) 2 (AQ) → 6H 2 O (ℓ) + CA 3 (PO 4 ) 2 (s)
Это химическое уравнение теперь сбалансировано.
Напишите реакцию нейтрализации H 2 SO 4 (водн.) и Sr(OH) 2 (водн.).
Ответ
H 2 SO 4 (водн.) + Sr(OH) 2 (водн.) → 2H 2 O(л) + SrSO 4 1q5 (0водн.)
Реакции нейтрализации — это один из видов химических реакций, которые протекают, даже если один из реагентов не находится в водной фазе. Например, химическая реакция между HCl(aq) и Fe(OH) 3 (s) по-прежнему протекает по уравнению:
3HCl(водн. ) + Fe(OH) 3 (т) → 3H 2 O(л) + FeCl 3 (водн.)
) + Fe(OH) 3 (т) → 3H 2 O(л) + FeCl 3 (водн.)
, хотя Fe(OH) 3 не растворяется. Когда известно, что Fe(OH) 3 (s) является компонентом ржавчины, это объясняет, почему некоторые чистящие растворы для пятен ржавчины содержат кислоты — в результате реакции нейтрализации образуются растворимые и смываемые продукты. (Одним из способов удаления ржавчины и пятен ржавчины является промывка кислотами, такими как HCl, но HCl следует использовать с осторожностью!)
Полные и чистые ионные реакции для реакций нейтрализации будут зависеть от того, растворимы ли реагенты и продукты, даже если кислота и основание реагируют. Например, в реакции HCl(водн.) и NaOH(водн.):
HCl(водн.) + NaOH(водн.) → H 2 O(л) + NaCl(водн.)
Полная ионная реакция:
H + (водн.) + Cl — (водн.) + Na + (водн.) + OH — (водн.) → H 2 O(л) + Na + (водн. ) Cl − (водн.)
) Cl − (водн.)
Ионы Na + (водн.) и Cl — (водн.) являются ионами-спектаторами, поэтому мы можем удалить их, чтобы получить:
H + (водн.) + OH − (водн.) → H 2 O(л)
как результирующее ионное уравнение. Если бы мы хотели записать это в терминах иона гидроксония, H 3 O + (водн.), мы бы написали это как:
H 3 O + (водн.) + OH − (водн.) → 2H 2 O(л)
За исключением введения дополнительной молекулы воды, эти два суммарных ионных уравнения эквивалентны.
Однако для реакции между HCl(aq) и Cr(OH) 2 (s), поскольку гидроксид хрома(II) нерастворим, мы не можем разделить его на ионы для полного ионного уравнения:
2H + (водн.) + 2Cl — (водн.) + Cr(OH) 2 (тв) → 2H 2 O(л) + Cr 2+ (водн.) + 2Cl — (водный)
Ионы хлора являются здесь единственными ионами-наблюдателями, поэтому итоговое ионное уравнение:
2H + (водн. ) + Cr(OH) 2 (т) → 2H 2 O(л) + Cr 2+ (водн.)
) + Cr(OH) 2 (т) → 2H 2 O(л) + Cr 2+ (водн.)
Щавелевая кислота, H 2 C 2 O 4 (с) и Ca(OH) 2 (с) реагируют очень медленно. Каково общее ионное уравнение между этими двумя веществами, если образовавшаяся соль нерастворима? (Анион в щавелевой кислоте представляет собой оксалат-ион, C 2 O 4 2− .)
Раствор
Продуктами реакции нейтрализации будут вода и оксалат кальция:
H 2 C 2 O 4 (с) + Ca(OH) 2 (с) → 2H 2 O(ℓ) + CaC 2 O 0 (с) 0 4 0 Поскольку ничего не растворяется, нет веществ, которые можно разделить на ионы, поэтому суммарное ионное уравнение представляет собой уравнение трех твердых тел и одной жидкости.
Какое суммарное ионное уравнение между HNO 3 (водн.) и Ti(OH) 4 (тв.)?
Ответ
4H + (водн. ) + Ti(OH) 4 (с) → 4H 2 O(ℓ) + Ti 4+ (водн.)
) + Ti(OH) 4 (с) → 4H 2 O(ℓ) + Ti 4+ (водн.)
- Кислота по Аррениусу – это вещество, которое увеличивает количество H + в водном растворе.
- Определение основания по Аррениусу – это вещество, которое увеличивает количество OH − в водном растворе.
- Нейтрализация – это реакция кислоты и основания, в результате которой образуются вода и соль.
- Чистые ионные уравнения для реакций нейтрализации могут включать твердые кислоты, твердые основания, твердые соли и воду.
- Что такое определение кислоты по Аррениусу?
- Что такое определение основания по Аррениусу?
- Предскажите продукты каждой из перечисленных кислотно-основных комбинаций. Предположим, что идет реакция нейтрализации.
- HCl и КОН
- H 2 SO 4 и KOH
- H 3 ПО 4 и Ni(OH) 2
- Предскажите продукты каждой из перечисленных кислотно-основных комбинаций.
 Предположим, что идет реакция нейтрализации.
Предположим, что идет реакция нейтрализации.- HBr и Fe(OH) 3
- HNO 2 и Al(OH) 3
- HClO 3 и Mg(OH) 2
- Напишите сбалансированное химическое уравнение для каждой реакции нейтрализации в упражнении 3.
- Напишите сбалансированное химическое уравнение для каждой реакции нейтрализации в упражнении 4.
- Напишите сбалансированное химическое уравнение для реакции нейтрализации каждой заданной кислоты и основания. Включите правильные метки фазы.
- HI(водн.) + KOH(водн.) → ?
- H 2 SO 4 (водн.) + Ba(OH) 2 (водн.) → ?
- Напишите сбалансированное химическое уравнение для реакции нейтрализации каждой заданной кислоты и основания. Включите правильные метки фазы.
- HNO 3 (водн.) + Fe(OH) 3 (т) → ?
- H 3 PO 4 (водн.
 ) + CsOH (водн.) → ?
) + CsOH (водн.) → ?
- Напишите суммарное ионное уравнение для каждой реакции нейтрализации в упражнении 7.
- Напишите суммарное ионное уравнение для каждой реакции нейтрализации в упражнении 8.
- Напишите полное и сводное ионное уравнения для реакции нейтрализации между HClO 3 (водн.) и Zn(OH) 2 (т). Предположим, что соль растворима.
- Напишите полное и сводное ионное уравнения для реакции нейтрализации H 2 C 2 O 4 (т) и Sr(OH) 2 (водн.). Предположим, что соль нерастворима.
- Объясните, почему результирующее ионное уравнение для реакции нейтрализации между HCl(водным) и KOH(водным) совпадает с результирующим ионным уравнением для реакции нейтрализации между HNO 3 (водн.) и RbOH.
- Объясните, почему результирующее ионное уравнение для реакции нейтрализации между HCl(водным) и KOH(водным) отличается от суммарного ионного уравнения для реакции нейтрализации между HCl(водным) и AgOH.

- Напишите полное и сводное ионное уравнения для реакции нейтрализации между HCl(водн.) и KOH(водн.), используя ион гидроксония вместо H + . Какая разница при использовании иона гидроксония?
- Напишите полное и суммарное ионное уравнения реакции нейтрализации HClO 3 (водн.) и Zn(OH) 2 (тв.) с использованием иона гидроксония вместо H + . Предположим, что соль растворима. Какая разница при использовании иона гидроксония?
- Кислота Аррениуса увеличивает количество ионов Н+ в водном растворе.
- KCl и H 2 O
- K 2 SO 4 и H 2 O
- Ni 3 (PO 4 ) 2 и H 2 О
- HCl + KOH → KCl + H 2 O
- H 2 SO 4 + 2KOH → K 2 SO 4 + 2H 2 O
- 2H 3 PO 4 + 3Ni(OH) 2 → Ni 3 (PO 4 ) 2 + 6H 2 8
- HI(водн.
 ) + KOH(водн.) → KCl(водн.) + H 2 O(л)
) + KOH(водн.) → KCl(водн.) + H 2 O(л) - Н 2 SO 4 (водн.) + Ba(OH) 2 (водн.) → BaSO 4 (тв.) + 2H 2 O(ℓ)
- HI(водн.
- H + (водн.) + OH − (водн.) → H 2 O(ℓ)
- 2H + (водн.) + SO 4 2- (водн.) + Ba 2+ (водн.) + 2OH — (водн.) → BaSO 4 (с) 90 + 2H О(ℓ)
- Полное ионное уравнение:
2H + (водн.) + 2ClO 3 − (водн.) + Zn 2+ (водн.) + 2OH − (водн.) → Zn 2+ (водн.) + 2ClO 3 − 2 (H29059 − ) О(л)
Суммарное ионное уравнение:
2H + (водн.) + 2OH − (водн.) → 2H 2 O(л)
- Поскольку соли растворимы в обоих случаях, чистая ионная реакция будет просто H + (водн.
 ) + OH — (водн.) → H 2 O(л).
) + OH — (водн.) → H 2 O(л).
- Полное ионное уравнение:
H 3 O + (водн.) + Cl — (водн.) + K + (водн.) + OH — (водн.) → 2H 2 O(ℓ) + K (водн.) + Cl – (водн.)
Суммарное ионное уравнение:
H 3 O + (водн.) + OH − (водн.) → 2H 2 O(л)
Разница заключается просто в присутствии дополнительной молекулы воды в качестве продукта.
какое полное ионное уравнение для h4po4(aq)+3koh(aq)—>3h3o(l)+k3po4(aq)
6 819 результатов
Химия
Определите начальную массу каждого реагента, если образуется 46,3 г K3PO4 и 92,8 г h4PO4 остается непрореагировавшим. 3KOH + h4PO4 —-> K3PO4 + 3h3O
Химия
h4PO4 + 3KOH = K3PO4 + 3 h3O Какой процент выхода будет, если вы прореагируете 490,0 г h4PO4 со 112 г гидроксида калия и собрали 25,0 г воды?
химия
Какое химическое уравнение описывает полную нейтрализацию h4PO4 NaOH? A. h4PO4 + 2NaOH Na2HPO4 + 2h3O B. h4PO4 + h3O h3PO4- + h4O+ C. h4PO4 + NaOH Nah3PO4 + h3O D. h4PO4 + 3NaOH Na3PO4 + 3h3O
h4PO4 + 2NaOH Na2HPO4 + 2h3O B. h4PO4 + h3O h3PO4- + h4O+ C. h4PO4 + NaOH Nah3PO4 + h3O D. h4PO4 + 3NaOH Na3PO4 + 3h3O
Madison
Из молекулярного уравнения найдите общую ионную и результирующую ионную: Молекулярная: h4PO4 (водн.) + 3NaOH (водн.) —> Na3PO4 (водн.) + 3h3O (л)
Химия
Заполните и сбалансируйте следующее уравнение. Затем запишите его в виде чистого ионного уравнения. K3PO4(водн.) + MgCl2(водн.) Ммм… помогите
Химия
Образец неизвестного раствора h4PO4 объемом 29,00 мл титруют 0,100 М раствором NaOH. Точка эквивалентности достигается при добавлении 24,63 мл раствора NaOH? Какова концентрация неизвестного раствора h4PO4? Реакция нейтрализации
химия
тип уравнения химической реакции h4PO4+KOH=K3PO4+h3O
Химия
Не могли бы вы проверить мою работу о полных ионных и суммарных ионных уравнениях. Они действительно смущают меня. Мое исходное уравнение после балансировки было следующим: FeCl2(водн.)+Na2S(водн.)=FeS(тв.)+2NaCl(водн.). Для полного Ionic я думаю, что это:
Они действительно смущают меня. Мое исходное уравнение после балансировки было следующим: FeCl2(водн.)+Na2S(водн.)=FeS(тв.)+2NaCl(водн.). Для полного Ionic я думаю, что это:
Химия
что такое сбалансированная формула уравнения, полное ионное уравнение и результирующее ионное уравнение FeSO4(водн.) + KCl(водн.)
Химия
Помощь в написании полных ионных и суммарных ионных уравнений.? Hg2(NO3)2 (водн.) + CuSO4 —> Cu(NO3)2 (водн.) + Hg2SO4 (тв.) K2CO3 (водн.) + MgI2 —> MgCO3 (тв.) + 2KI 3 NaCrO4 (водн.) +2 AlBr3 —> Al2(CrO4)3(s) + 6NaBr я приступил к написанию уравнения формулы но хотелось бы
Химия
При смешивании следующих растворов FeSO4 (водн. ) + Csl (водн.): Какой осадок образуется, если он вообще образуется? Напишите сбалансированное уравнение, напишите полное ионное уравнение и напишите результирующее ионное уравнение?
) + Csl (водн.): Какой осадок образуется, если он вообще образуется? Напишите сбалансированное уравнение, напишите полное ионное уравнение и напишите результирующее ионное уравнение?
Химия
Нитрат железа (III) реагирует с карбонатом натрия с образованием осадка. Обязательно указывают степени окисления и осадок. Скелетное уравнение: Ионное уравнение: NET Ионное уравнение: Сбалансированное уравнение: Зритель Ионы: Я получил скелетное уравнение, но я
Химия
Для реакции между фосфатом натрия и нитратом стронция запишите следующее: a) Сбалансированное молекулярное уравнение b) Ионное уравнение c) Суммарное ионное уравнение a) Кажется, у меня есть это: 2 Na3PO4 (водн.) + 3 Sr(NO3)2 (водн.) —> 6 NaNO3 (водн.) +
химия
Какой объем 0,649 М K3PO4 потребуется для реакции с 26 мл 0,453 М MgCl2 по уравнению 2 K3PO4 + 3 MgCl2 → Mg3(PO4)2 + 6 KCl Ответ в миллилитрах.
Химия
h4PO4(водн.) + 3 KOH(водн.) → K3PO4(водн.) + 3 h3O(л) Сколько граммов гидроксида калия требуется для полной нейтрализации 3,23 граммов фосфорной кислоты?
Химия
что такое 1. химическое уравнение 2. полное ионное уравнение 3. результирующее ионное уравнение включает фазу HCh4COO+NaHCO3 пожалуйста исправьте мои ответы 1. Ch4COOH(водн.)+NaHCO3(водн.)+Ch4COONa(водн.)+h3O( л)+CO2(г) 2. Ch4COOH(водн.)+OH-(водн.)=Ch4COO-(водн.)+h3O(ж) 3. OH(водн.)+CO2(г)
Биохимия DR.BOB
Сколько граммов NaOH (Mr 40) нужно добавить к 100 мл 0,1 М h4PO4 для создания фосфатного буфера с pH 7,0? Я знаю, что использую HH-уравнение. h4PO4, pka1=2,12, pka2=7,21, pka3=12,32. Вот что я получил: pH=Pka+ log HPO4/h4PO4-HPO4 7,0=7,21 + log HPO4/.001-HPO4 равно
Вот что я получил: pH=Pka+ log HPO4/h4PO4-HPO4 7,0=7,21 + log HPO4/.001-HPO4 равно
Химия (репост №6)
!Аликвоту 100,0 мл 0,200 М водного раствора гидроксида кальция смешивают с ! 100,0 мл 0,200 М водного нитрата алюминия. а.)! Напишите полное молекулярное уравнение этой реакции, включая фазы б.)! Напишите суммарное ионное уравнение этой реакции, включив в него
химия
Рассмотрим следующую реакцию: Na2CO3 + NiCl2 �¨ NiCO3 + 2NaCl Используя правила растворимости, определите растворимость всех реагентов и продуктов. Объясните свой ответ Пожалуйста. Какой продукт является осадком в этой реакции? Напишите полный ionic
Химия
Дополните и сбалансируйте следующее молекулярное уравнение. Cu(OH)2(s)+HClO4(aq)→ И напишите для него суммарное ионное уравнение.
Cu(OH)2(s)+HClO4(aq)→ И напишите для него суммарное ионное уравнение.
Химия
Дополните и сбалансируйте следующее молекулярное уравнение. Al(OH)3(s)+HNO3(aq)→ И напишите для него суммарное ионное уравнение.
Химия
Привет! Мне нужна помощь, чтобы начать работу с этими четырьмя проблемами. Есть и другие проблемы, подобные приведенным ниже. Было бы здорово, если бы у меня был пример каждой из четырех проблем. Спасибо! FeSO4(водн.)+ KCL(водн.) (для задач 1 и 2) 1)При следующих
Масса-масса
Сколько граммов газообразного водорода образуется при реакции 50,0 граммов цинка с фосфорной кислотой, h4PO4 ? Уравнение:3 Zn +2 h4PO4 —>3 h3+ Zn3(PO4)2
AP Chem
Раствор фосфата калия смешивают с раствором ацетата кальция. Я должен написать чистое ионное уравнение. Не нужно балансировать. Вот что я сделал: K3PO4(водн.) + Ca(C2h4O2)2 —> KC2h4O2 + Ca3PO4 3K+ + PO4-3 + Ca+2 2(C2h4O2-) —> K+ +
Я должен написать чистое ионное уравнение. Не нужно балансировать. Вот что я сделал: K3PO4(водн.) + Ca(C2h4O2)2 —> KC2h4O2 + Ca3PO4 3K+ + PO4-3 + Ca+2 2(C2h4O2-) —> K+ +
Химия
Какова концентрация полученного раствора при смешивании 250 мл 0,1 М K3PO4 и 300 мл 0,5 М K3PO4?
Chem
Разделите следующее сбалансированное химическое уравнение на полное ионное уравнение. AgNO3(водн.)+NaCl(водн.) —> NaNO3(водн.)+AgCl(тв) (Перечислите ионы в приведенном выше уравнении по порядку.) Напишите суммарное ионное уравнение для приведенной выше реакции. (Убедитесь, что катион
химия
HI(водн.)+KOH(водн.)→h3O(ж)+KI(водн.) выразить это как полное ионное уравнение
химия
Каким будет полное ионное уравнение реакции между Pb(NO3)2 и NaI?
Химия
Какое полное ионное уравнение BaCl2(водн. ) + Na2SO4(водн.) > BaSO4(тв.) + 2NaCl(водн.)
) + Na2SO4(водн.) > BaSO4(тв.) + 2NaCl(водн.)
Наука
Напишите полное ионное уравнение реакции BaCl2(водн.) и Na2SO4(водн.)
Химия( ПОМОГИТЕ ПОЖАЛУЙСТА, Я В ОТЧАЕСТВЕ!!!)
Какое максимальное количество CO2 может образоваться из 13,97 г Ch4OH и 5,45 г O2 для реакции 2Ch4OH + 3O2 → 2CO2+ 4h3O? Рассмотрим реакцию h4PO4 + 3NaOH → Na3PO4 + 3h3O. Сколько Na3PO4 можно получить при взаимодействии 3,43 г
Химия 10-го класса
Как определить, является ли элемент или соединение водным, твердым, жидким или газообразным, просто взглянув на периодическую таблицу. Кроме того, как вы определяете, является ли соединение или элемент нерастворимым или растворимым, глядя только на периодическую таблицу. Что такое чистая ionic
Что такое чистая ionic
химия
Напишите сбалансированное уравнение, ионное уравнение и результирующее ионное уравнение для следующего: A) Li2SO4 + Sr(NO3)3 —> B) h3SO4 + Na2CO3 —>
College Chemistry
Я сбалансировал уравнение: HBr(aq) +Nh4(aq)->Nh5Br Мне нужно найти ионное уравнение и результирующее ионное уравнение
химия
Водный раствор фосфорной кислоты, h4PO4, содержит 285 г h4PO4 в 400 мл раствора и имеет плотность 1,35 г/мл. Рассчитать а. вес. % h4PO4 в этом растворе. б. концентрация в моль/л этого раствора
химия
Завершить и сбалансировать реакции осаждения. Включите физические состояния в свои уравнения. Ba(NO3)2(водн.) + CuSO4 (водн.) —> K3PO4(водн.)+MgCl2 (водн.)—->
Включите физические состояния в свои уравнения. Ba(NO3)2(водн.) + CuSO4 (водн.) —> K3PO4(водн.)+MgCl2 (водн.)—->
Химия
Напишите молекулярное, полное и суммарное ионное уравнения для следующей реакции в водных растворах. Все уравнения должны быть сбалансированы. д. HBr(водн.) и K2SO3(водн.)
химические:ионные уравнения
ниже напишите полное ионное уравнение реакции фосфата магния с нитратом свинца(II). Включите, какие ионы будут водными, а какое соединение выпадет в осадок. Я понимаю, как сбалансировать уравнение, но мне приводят пример
.химия
Диоксид хлора, ClO2, использовался в качестве дезинфицирующего средства в системах кондиционирования воздуха. Он реагирует с водой в соответствии со следующим уравнением. 6ClO2 + 3h3O —> 5HClO3 + HCl Если 142,0 г ClO2 смешать с 33,0 г h3O, сколько граммов реагента получится
Он реагирует с водой в соответствии со следующим уравнением. 6ClO2 + 3h3O —> 5HClO3 + HCl Если 142,0 г ClO2 смешать с 33,0 г h3O, сколько граммов реагента получится
химия
Какие ионы-спектаторы в следующем полном ионном уравнении: Ba2+(водн.)+2I-(водн.)+2Na+(водн.)+SO2-4(водн.)→BaSO4(s)+2I-(водн.)+ 2Na+(водн.). Большое спасибо!!! 93-
Химические формулы и реакции
Когда водный раствор хлорида меди (II) реагирует с водным раствором фосфата аммония, образуется растворимый хлорид аммония, а фосфат меди (II) выпадает из раствора в осадок. 1. Напишите сбалансированное молекулярное уравнение этой реакции. 2. Написать сбалансированный комплект ionic
Химия
Классифицируйте следующие реакции как реакции осаждения, окислительно-восстановительные реакции или кислотно-основные реакции. 23 9-3M Раствор h4PO4 имеет pH=2,30. что такое Ка для h4PO4? Не знаю, как решить эту проблему
23 9-3M Раствор h4PO4 имеет pH=2,30. что такое Ка для h4PO4? Не знаю, как решить эту проблему
Химия
1. Суммарное ионное уравнение реакции нитрата серебра с арсенат-ионом Получил: 3Ag(+) + AsO4 —> Ag3AsO4 2. Суммарное ионное уравнение реакции осаждения гексацианоферрата меди (II). У меня получилось: 2Cu (2+) + [Fe(CN)6] —> Cu2 [Fe(CN6)] Может кто
Химия
Раствор фосфатного буфера содержит 0,08 М K2HPO4 и 0,12 М Kh3PO4. Значения pKa для h4PO4 составляют 2, 6,8 и 12,2. Рассчитайте концентрации a) h4PO4 b) h3PO4- c) HPO42- d) H+ e) OH- f) K+
химия 9-
ipc
Как сбалансировать это уравнение Ca(C2h4O2)2+K3PO4 —>Ca3(PO4)2+KC2h4O2
Химия
объем 42,5 мл 0,125 М KOH необходим для полной нейтрализации 37,2 мл раствора h4PO4. Найдите молярную концентрацию h4PO4?
Найдите молярную концентрацию h4PO4?
наука
а) Рассчитайте массовый процент углерода в гидратированной форме твердого вещества, имеющего формулу BeC2O4, слабо связанного с 3h3O. b) При нагревании до 220°C BeC2O4, слабо связанный с 3h3O(s), полностью дегидратируется, как показано ниже: BeC2O4, слабо связанный с
Наука (химия)
HCL+Al=AlCl3+h3 Что такое ионное уравнение, ионы-спектаторы и общее или результирующее ионное уравнение?
химия
Ba(NO3)2(водн.) Na3PO4(водн.) нужно найти молекулярное, ионное и результирующее ионное уравнение
химия
при смешивании водных растворов карбоната натрия и хлорида марганца(V) образуется осадок. Осадок представляет собой соединение, содержащее марганец. Я должен написать для него химическое, полное ионное и суммарное ионное уравнения.
Осадок представляет собой соединение, содержащее марганец. Я должен написать для него химическое, полное ионное и суммарное ионное уравнения.
chem
напишите ионное уравнение и суммарные ионные уравнения. 1.AgNO3 и K2S 2.ZnCl2 и Na2SO4 3.CuCl2 и Li3PO4
химия.
Сколько граммов h4PO4 содержится в 175 мл 3,5 М раствора h4PO4?
химия
Завершите и сбалансируйте молекулярное уравнение, включая фазы, для реакции водного раствора бромида аммония, Nh5Br, и водного раствора ацетата свинца(II), Pb(C2h4O2). Введите сбалансированное чистое ионное уравнение, включая фазы, для этой реакции.
Химия
Напишите молекулярное, полное и суммарное ионное уравнения для следующих реакций в водных растворах. = + 2h3O Теперь отмените те ионы, которые появляются на 92-(водн.) => h3O(ж) + CO2(г) + 2KCl(водн.)? Спасибо
= + 2h3O Теперь отмените те ионы, которые появляются на 92-(водн.) => h3O(ж) + CO2(г) + 2KCl(водн.)? Спасибо
химия
Пентахлорид фосфора, PCl5, реагирует с водой с образованием фосфорной кислоты, h4PO4, и соляной кислоты, HCl. PCl5(s) + 4h3O(�) → h4PO4(aq) + 5HCl(aq) (a) Какая масса PCl5 необходима для реакции с избыточным количеством h3O с образованием 23,5 г h4PO4? (б)
Химия
Если 3,21 г BeC2O4 * 3h3O нагреть до 220°С, рассчитайте объем выделившейся h3O(г), измеренный при 220°С и 735 мм рт.ст.? Помогите, пожалуйста, перевести г BeC2O4*3h3O в моль BeC2O4*3h3O. Перевести моль BeC2O4*3h3O в моль h3O. Используйте PV = nRT для расчета объема
chem — пожалуйста, помогите мне проверить мой ответ!!
напишите ионное уравнение и суммарное ионное уравнение для следующей реакции между Fe3+ и Nh5OH. Пожалуйста, проверьте мой ответ!! Спасибо. Мой ответ: ионный: Fe3+(водн.) + Nh5OH—> Fe(OH)3 + Nh5+ чистый ионный: Fe3+ +OH- —> Fe(OH)3
Пожалуйста, проверьте мой ответ!! Спасибо. Мой ответ: ионный: Fe3+(водн.) + Nh5OH—> Fe(OH)3 + Nh5+ чистый ионный: Fe3+ +OH- —> Fe(OH)3
Химия
Рассчитайте объем концентрированного реагента, необходимого для приготовления разбавленного раствора 17 М h4PO4 для приготовления 939 мл 6,7 М h4PO4
Химия
Реакция водного раствора гидроксида бария и водного раствора сульфата натрия представлена сбалансированным чистым ионным уравнением. Ba2+(водн.) + SO42-(водн.) → BaSO4(тв) Приведите сбалансированное ионное уравнение реакции. Включите штаты.
Химия
Реакция водного раствора бромида натрия и водного раствора нитрата свинца(II) представлена сбалансированным чистым ионным уравнением. 2Br-(водн.) + Pb2+(водн.) → PbBr2(т) Приведите сбалансированное ионное уравнение реакции. Включите штаты.
2Br-(водн.) + Pb2+(водн.) → PbBr2(т) Приведите сбалансированное ионное уравнение реакции. Включите штаты.
хим hwk помогите!
При следующей реакции: 3 CaCl2 + 2 h4PO4 Ca3(PO4)2 + 6 HCl Сколько граммов h4PO4 необходимо для полной реакции с 1,837 г CaCl2? совсем не понимаю
Химия
CaCl2(водн.)+ Cs3PO4(водн.) —> Завершить реакцию и классифицировать как осаждение или кислотно-основное. Чистое ионное уравнение, а также. Я полагаю, что это реакция осаждения, так как нет H. Верите ли, что продукты могут быть CaPO4 и Cs3Cl2? Может кто-нибудь помочь объяснить
химия
a 8,6 *10 в -3 степени М раствор h4PO4 имеет рН 2,30 что такое Ka для h4PO4?
ХИМИЯ.
 .
.1. Образуется ли осадок при соединении растворов сульфата калия и нитрата бария? Если да, напишите суммарное ионное уравнение реакции. 2. Будет ли образовываться осадок, если соединить растворы нитрата калия и сульфата магния? Если да, то
Химия
Заполните таблицу, заполнив формулу ионного соединения, образованного каждой парой катионов и анионов, как показано для первой пары. Ион K+ NH+4 Mg2+ Fe3+ Cl- OH- CO3 2- PO3- 4 Заполните четвертую строку таблицы.
химия
Напишите сбалансированное результирующее ионное уравнение для следующей реакции и определите сопряженные кислотно-основные пары. HNO3(водн.)+Li2CO3(водн.)LiNo3(водн.)+LiHCO3(водн.) Какой компонент в общем ионном уравнении является кислотой, основанием, сопряженным основанием и сопряженным
химия
Какой объем 0,123 М K3PO4 потребуется для реакции с 60 мл 0,862 М MgCl2 по уравнению 2K3PO4+3MgCl2—> Mg3(PO4)2+6KCl Ответ в миллилитрах.
химия
Каково уравнение получения K3[Al(C2O4)3].3h3O с использованием Al2(SO4)3?
Химия
Уравнение баланса Al2C3O3 + h4PO4 —> AlPO4 + CO2 + h3O
Химия
Какое суммарное иконическое уравнение реакции нитрата бария с оксалатом аммония Ba(NO3)2 + (Nh5)2C2O4 → Ba(C2O4) + 2Nh5(NO3) Что такое полное иконическое уравнение и результирующее ионное уравнение реакции между кальцием
Химия(Пожалуйста, помогите, спасибо!!!)
Напишите сбалансированное, полное и суммарное ионные уравнения для каждой реакции осаждения. 1) AgNO_3 + CoCl_2 —> BE: AgNO_3(водн. ) + CoCl_2(водн.) —> AgCl_2 (водн.) + Co(NO_3)(водн.) CIE: Поскольку сбалансированное уравнение все (водн.), нет реакция так не полная или
) + CoCl_2(водн.) —> AgCl_2 (водн.) + Co(NO_3)(водн.) CIE: Поскольку сбалансированное уравнение все (водн.), нет реакция так не полная или
проверка химии
A) Напишите сбалансированное химическое уравнение реакции между серной кислотой и гидроксидом калия. У меня получилось h3SO4 + KOH —> h3OH + KSO4 B) Напишите ионное уравнение реакции. h3 + S2O4-2 + K + OH- —> h3 + OH + K2SO4-2 C) Напишите результирующую ионную
Химия
Re: Качественный анализ — лаборатория катионов группы 1 Какой отдельный реагент вы могли бы добавить, который позволил бы вам различать члены каждой пары твердых соединений ниже? Расскажите, что происходит с каждым веществом при добавлении реагента, и покажите число
.Химия
-Рассмотрите реакцию при соединении водных растворов нитрата серебра(I) и хлорида марганца(II). Чистое ионное уравнение этой реакции имеет вид? -Рассмотрите реакцию при соединении водных растворов сульфата кобальта(II) и нитрата свинца(II).
Чистое ионное уравнение этой реакции имеет вид? -Рассмотрите реакцию при соединении водных растворов сульфата кобальта(II) и нитрата свинца(II).
химия
Напишите уравнение реакции нейтрализации между h4PO4 и NaOH в водном растворе. Фазы являются необязательными.
Химия
Количество сурьмы в руде можно определить окислительно-восстановительным титрованием окислителем. Руду растворяют в горячей концентрированной кислоте и пропускают через восстановитель, так что вся сурьма находится в форме Sb3 (водн.). Sb3 (aq)
Химия
Закончите следующую кислотно-щелочную реакцию со сбалансированными молекулярными, полными ионными и суммарными ионными уравнениями: гидроксид кальция (водн. ) + уксусная кислота (водн.) —-> ? Я знаю, что гидроксид кальция — это ca(OH)2, а уксусная кислота — это Ch4COOH. Я также знаю, что один из
) + уксусная кислота (водн.) —-> ? Я знаю, что гидроксид кальция — это ca(OH)2, а уксусная кислота — это Ch4COOH. Я также знаю, что один из
ап химия
92- в буферном растворе с рН 13,16? Какую массу K3PO4 необходимо добавить к 1 л 0,1 М K2HPO4(водн.), чтобы приготовить буферный раствор с рН 13,16? Ответ в единицах г Какая массаОбщая химия
При смешивании раствора хлорида никеля (II) со стехиометрическим количеством бесцветного раствора гидроксида натрия образуется зеленый желеобразный осадок. а) Напишите сбалансированное молекулярное уравнение и суммарное ионное уравнение для этой реакции. молекулярный:
Химия
Какое полное ионное уравнение для NaOH(водн. ) + Fe(NO3)3(водн.)? Я размещаю это на веб-сайте, но он говорит мне: «Похоже, один или несколько ваших реагентов имеют неправильную степень окисления. Один или несколько ваших продуктов содержат неправильную степень окисления
) + Fe(NO3)3(водн.)? Я размещаю это на веб-сайте, но он говорит мне: «Похоже, один или несколько ваших реагентов имеют неправильную степень окисления. Один или несколько ваших продуктов содержат неправильную степень окисления
Химия
1. HCl(водн.)+KOH(водн.)→KCl(водн.)+h3O(ж) Ответ представь в виде результирующего ионного уравнения. Определите все этапы в своем ответе. 2. 2HC2h4O2(водн.)+Ca(OH)2(водн.)→Ca(C2h4O2)2(водн.)+2h3O(ж) Представьте ответ в виде результирующего ионного уравнения. Определите все фазы в
Химия
Какое ионное и результирующее ионное уравнение для Na2CO3 + 2 HNO3 -> 2 NaNO3 + h3O + CO2 (г) Вот что у меня есть на данный момент… Na2(aq)+CO3+H+NO3 -> Na+ NO3+ h3O(ж)+CO2(г)… не знаю что делать!!!
наука
Ch5 + 2O2 → CO2 + 2h3O Если вы замените 2 перед 2O2 на 3, как изменится результат в правой части уравнения? Теперь есть молекулы 3h3O.
Химия
Из перечисленных ниже соединений _____ имеет наименьшее ионное разделение и почему? A.RbF B.K2S C.SrBr2 D.KF E.RbCl —> Как определить, имеет ли соединение высокое или низкое ионное разделение, и что такое ионное разделение?
химия
Напишите суммарное ионное уравнение для следующего молекулярного уравнения. CoI2(водн.) + K2CO3(водн.) CoCO3(т) + 2KI(водн.)
Химия
Сбалансируйте уравнение и напишите итоговое ионное уравнение a. (Nh5)2 CO3(водн.) + Cu(NO3)2(водн.) в CuCO3(тв.) + Nh5NO3(водн.)
химия
напишите ионное уравнение и сбалансированное результирующее ионное уравнение для следующих уравнений: Al2O3(s) + 6 HCl(aq) = 2 AlCl3(aq) + 3 h3O(l) и h3SO3(aq) + 2 KOH (водн. ) = K2SO3(водн.) + 2 h3O и 2 HC2h4O2(водн.) + Ca(OH)2(водн.) = Ca(C2h4O2)2(водн.) + 2 h3O и окончательное
) = K2SO3(водн.) + 2 h3O и 2 HC2h4O2(водн.) + Ca(OH)2(водн.) = Ca(C2h4O2)2(водн.) + 2 h3O и окончательное
AP Chem
Заполните и сбалансируйте каждое из следующих молекулярных уравнений, включая метки фаз, если происходит реакция. Затем напишите суммарное ионное уравнение. Если реакции не происходит, напишите NR после стрелки. h3CO3(aq)+Sr(OH)2(aq) -> это то, что я поставил, но я думаю, что это
химия
Чтобы растворить ионное твердое вещество в воде, вы должны сначала разрушить ионные связи, удерживающие ионную решетку вместе. Это эндотермический процесс, однако многие ионные твердые вещества обладают экзотермической теплотой растворения. (Тепло выделяется, когда твердое ионное тело равно
Лучший Лучший Доктор Химии!
это ответ на B ) C2H5OH(ж)+ 3O2(г) —> 2CO2(г) +3h3O(ж) В виноделии сахар в винограде подвергается ферментации дрожжами с образованием Ch4Ch3OH и CO2. При клеточном дыхании сахар и этанол «сгорают» до водяного пара и СО2. Напишите
При клеточном дыхании сахар и этанол «сгорают» до водяного пара и СО2. Напишите
= | Уравнение сбалансированной химической реакции
| Поиск |
Результаты поиска по химическому уравнению
Новости Только 5% НАСЕЛЕНИЯ знают
Рекламное объявление
1 результатов найдено
Отображение уравнения от 1 до 1 Страница 1 — Пожалуйста, прокрутите до конца, чтобы увидеть больше результатов
Уравнение Результат #1
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
| Ca(OH) 2 | + | png» substance-weight=»97.9952″> 2H 3 PO 4 | → | Ca(H 2 PO 4 ) 2 | + | 2H 2 O | |
| гидроксид кальция | Сонак; Фосфорная кислота; ортофосфорная кислота; Фосфорная кислота водород | water | |||||
| (rắn (bột)) | (rắn) | (bột) | (lỏng) | ||||
| (không màu (màu trắng)) | (không màu) | (xám trắng hoặc sẫm) | (không màu) | ||||
| 1 | 2 | 1 | 2 | Hệ số | |||
| Nguyên — Phân tử khối (g/mol) | |||||||
| Số mol | |||||||
| Хой лунг (г) |
Рекламное объявление
Дополнительная информация об уравнении Ca(OH)
2 + 2H 3 PO 4 → Ca(H 2 PO 4 ) 2 + 2H 2 O 9008 2 + 2H 2 O 9008 с h4PO4 (Sonac; фосфорная кислота; ортофосфорная кислота; водород фосфорной кислоты) ?Не найдено информации для этого химического уравнения
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции с образованием Ca(h3PO4)2 () и h3O (вода) ?
Ca(OH)2 реагирует с h4PO4
Явление после реакции Ca(OH)2 (гидроксид кальция) с h4PO4 (Sonac; фосфорная кислота; ортофосфорная кислота; водород фосфорной кислоты)
Нажмите, чтобы увидеть явление уравнения
Какую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Категории уравнения
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Дальнейшие вопросы, связанные с химическими реакциями CA (OH)
2 + 2H 3 PO 4 → CA (H 2 PO 4 ) 2 + 2H 2 O . реагент Ca(OH)2 (гидроксид кальция)
реагент Ca(OH)2 (гидроксид кальция)Каковы химические и физические характеристики Ca(OH)2 (гидроксид кальция)? В каких химических реакциях используется Ca(OH)2 (гидроксид кальция) в качестве реагента?
Вопросы, связанные с реагентом h4PO4 (Sonac; фосфорная кислота; ортофосфорная кислота; водород фосфорной кислоты)
Каковы химические и физические характеристики h4PO4 (Sonac; фосфорная кислота; ортофосфорная кислота; водород фосфорной кислоты)? Каковы химические реакции которые содержат h4PO4 (Sonac; фосфорная кислота; ортофосфорная кислота; водород фосфорной кислоты) в качестве реагента?
Вопросы, связанные с продуктом Ca(h3PO4)2 ()
Каковы химические и физические характеристики Ca(h3PO4)2 (Sonac; фосфорная кислота; ортофосфорная кислота; водород фосфорной кислоты)? (h3PO4)2 () как продукт?
Вопросы, связанные с продуктом h3O (вода)
Каковы химические и физические характеристики h3O (Sonac; фосфорная кислота; ортофосфорная кислота; водород фосфорной кислоты)? Каковы химические реакции, в результате которых образуется h3O (вода)?
Рекламное объявление
1 результатов найдено
Отображение уравнения от 1 до 1 Страница 1
Дополнительная информация о веществах, которые используют уравнение
Реакция Ca(OH)2 (canxi hidroxit hoặc tôi vôi) реагировать с h4PO4 (axit photphoric) с образованием Ca(h3PO4)2 (canxi dihirophotphat)
Реакция с образованием вещества Ca(OH)2 (canxi hidroxit hoặc tôi vôi) (гидроксид кальция)
CaO + H 2 O → Ca(OH) 2 2H 2 O + CaI 2 → CaO(OH) 20 CaO(OH) 290 + 2HI 2H 2 O + CaCl 2 → Ca(OH) 2 + Cl 2 + 2H 2
Реакция, в результате которой образуется вещество h4PO4 (axit photphoric) (Sonac; Phosphoric acid; Orthophosphoric acid; Phosphoric acid hydrogen)
3H 2 O + P 2 O 5 → 2H 3 PO 4 3HCl + Ag 3 PO 4 → 3AGCL + H 3 PO 4 5HNO 3 + P → H 2 O + 5NO 2 + H 3 PO 4
Реакция, которая производит вечность.


 Записываем уравнение реакции в кратком ионном виде. Сокращаем одинаковые ионы, вычёркивая их из уравнения реакции.
Записываем уравнение реакции в кратком ионном виде. Сокращаем одинаковые ионы, вычёркивая их из уравнения реакции. 11.18
11.18

 (Предположим, что оксид железа содержит ионы Fe + .)
(Предположим, что оксид железа содержит ионы Fe + .)
 ) и Ca(OH) 2 (водн.)
) и Ca(OH) 2 (водн.) Согласно правилам растворимости, Ca 3 (PO 4 ) 2 нерастворим, поэтому он имеет метку фазы (s). Чтобы сбалансировать это уравнение, нам нужны два иона фосфата и три иона кальция; мы получаем шесть молекул воды, чтобы сбалансировать уравнение:
Согласно правилам растворимости, Ca 3 (PO 4 ) 2 нерастворим, поэтому он имеет метку фазы (s). Чтобы сбалансировать это уравнение, нам нужны два иона фосфата и три иона кальция; мы получаем шесть молекул воды, чтобы сбалансировать уравнение: Предположим, что идет реакция нейтрализации.
Предположим, что идет реакция нейтрализации. ) + CsOH (водн.) → ?
) + CsOH (водн.) → ?
 ) + KOH(водн.) → KCl(водн.) + H 2 O(л)
) + KOH(водн.) → KCl(водн.) + H 2 O(л)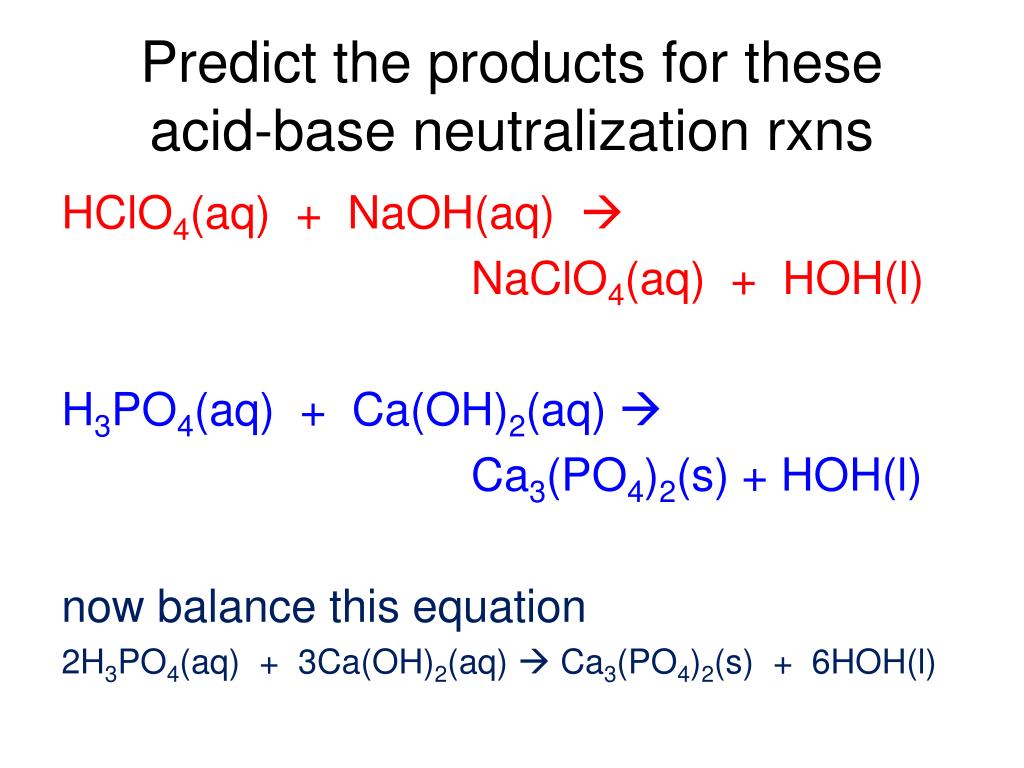 ) + OH — (водн.) → H 2 O(л).
) + OH — (водн.) → H 2 O(л).