методичка р-элементы — Стр 17
161
2СlO2 + РbО + 2NaOH = PbO2 + 2NаСlO2 + Н2O
Хлористая кислота и ее соли обладают сильными окислительными свойствами.
Хлорит натрия применяется как отбеливатель в целлюлозно-бумажной и текстиль-
ной промышленности.
5.4.3. Соединения галогенов в степени окисления V
Для хлора, брома и йода в степени окисления V известны кислоты хлорноватая,
НClО3, бромноватая, НBrО3, йодноватая, НIО3, и соответствующие соли: хлораты, брома-
ты, йодаты. Кислоты НГО3 — сильные электролиты, однако в ряду НСlО3, НBrО3, HIO3
кислотные свойства несколько ослабевают (Ka(HIO3) = 0,2). Хлорноватая и бромноватая кислоты неустойчивы, существуют только в растворе. Выпариванием в вакууме можно получить относительно устойчивые растворы с массовой долей кислоты менее 50 %. В
более концентрированных растворах эти кислоты разлагаются со взрывом. Получить кис-
лоты можно из соответствующих солей:
Ва(С1О3)2 + h3SO4 = BaSO4 + 2HClO3 5АgBrO3 + 3Вr2 + 3Н2O = 5АgBr + 6НВrО3
Йодноватую кислоту получают окислением йода:
I2 + 10НNO3 = 2HIO3 + 10NO2 + 4h3O
I2 + 5Cl2 + 6h3O = 2HIO3 + 10НСl
Ее выделяют в свободном состоянии в виде расплывающихся на воздухе бесцветных кри-
сталлов. В растворе йодноватая кислота образует ассоциаты (НIО3)n, где n = 2–3, в связи с чем она легко кристаллизуется с солями, образуя кислые соли, например, КIO3·2HIO3. При нагревании до 200 °С НIО3 разлагается:
В растворе йодноватая кислота образует ассоциаты (НIО3)n, где n = 2–3, в связи с чем она легко кристаллизуется с солями, образуя кислые соли, например, КIO3·2HIO3. При нагревании до 200 °С НIО3 разлагается:
2НIO3 = I2O5 + h3O
Для НСlО3 и НBrО3 ангидриды не получены.
Окислительные свойства в ряду НСlО3, НBrО3, HIO3 уменьшаются. Значения стан-
дартных электродных потенциалов для полуреакции:
ГO3 + 6H+ + 6ē = Г– + 3h3O
равны 1,45; 1,44 и 1,09 В для Г = Cl, Br, I соответственно.
162
Для полуреакции:
2 ГO3 + 12H+ + 10ē = Г2 + 6h3O
значения стандартных электродных потенциалов равны 1,47; 1,52 и 1,20 В для Г = Cl, Br, I
соответственно. Сравнение стандартных электродных потенциалов φ˚ для НГО и НГО3
показывает, что более устойчивы соединения галогенов со степенью окисления V.
Хлораты, броматы и йодаты получают при взаимодействии свободных галогенов с горячими растворами щелочей:
3Г2 + 6NaOH = 5NаГ + NаГО3 + 3Н2O
Окислительная активность солей ниже, чем соответствующих кислот, и в растворах проявляется только в кислой среде:
KСlО3 + 6НСl = 3Сl2 + 3Н2О + KСl
Наибольшее применение в качестве окислителя имеет хлорат калия — «бертолетова» соль. При нагревании KСlО3 диспропорционирует:
При нагревании KСlО3 диспропорционирует:
4KСlO3 = 3KСlO4 + KСl,
а в присутствии катализаторов (МnO2) разлагается:
2KСlO3 = 2KCl +3O2
При быстром нагревании выше 400 °C разложение идет со взрывом. При сплавлении хлорат калия окисляет многие вещества:
6Р + 5KСlO3 = 5KСl + 3Р2O5
и используется в производстве спичек, в пиротехнике.
5.4.4. Cоединения галогенов в степени окисления VII
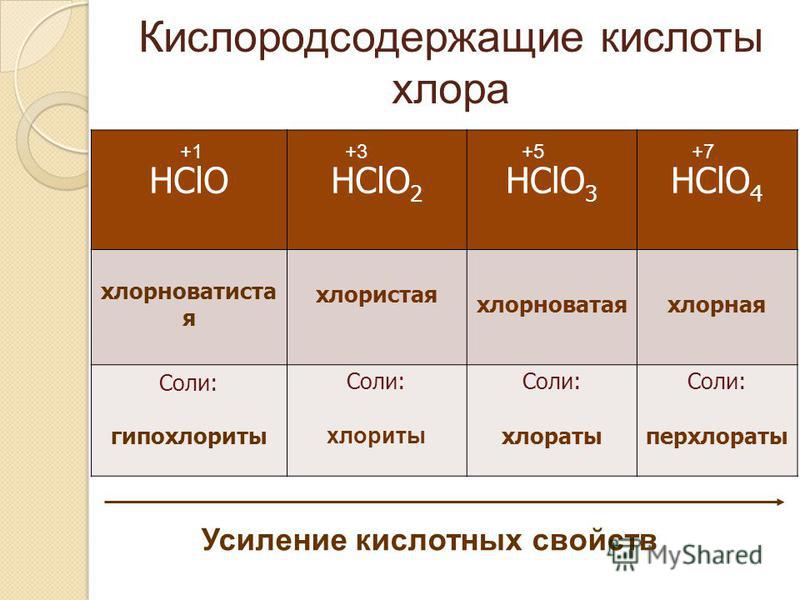
Хлор, бром и йод проявляют степень окисления VII в кислотах НГО4 (хлорная,
бромная и йодная, соответственно) и в солях — перхлоратах, перброматах, перйодатах.
Хлорная кислота самая сильная из всех кислот. Получают ее электролитически из НСl, а также отгонкой в вакууме при 16 °С из смеси перхлората калия и серной кислоты:
2KClO4 + h3SO4 = 2HClO4 + K2SO4
Безводная хлорная кислота — подвижная, дымящая на воздухе жидкость, при нагре-
вании разлагается со взрывом:
163
4НСlO4 = 4ClO2 + 3O2 + 2h3O
При взаимодействии с оксидом фосфора(V) образует оксид хлора(VII) (хлорный ан-
гидрид):
4HСlO4 + Р4O10 = 2Сl2O7 + 4НРO3
Хлорная кислота, как окислитель, гораздо менее активна, чем другие кислоты хлора и в растворах практически не проявляет окислительных свойств.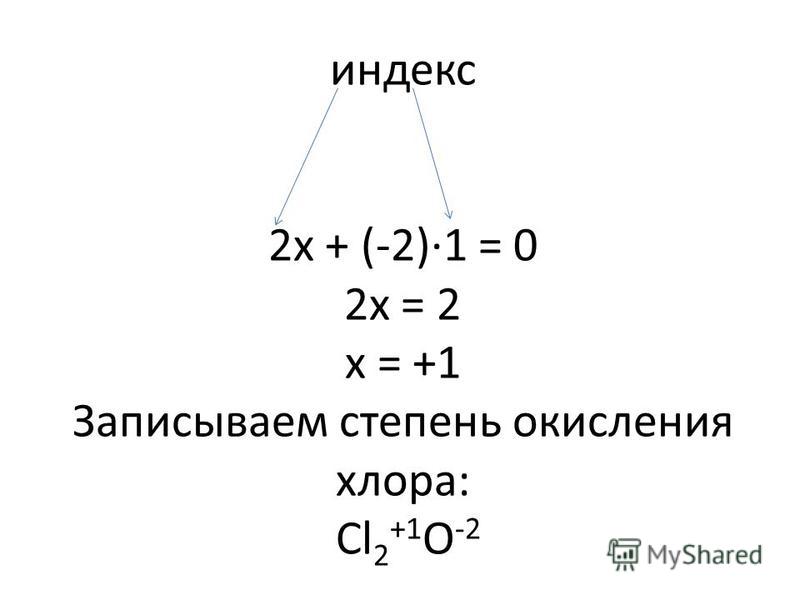
Перхлораты в растворах также не проявляют окислительных свойств. В сухом состо-
янии они термически нестойки:
KСlO4 = KCl + 2O2
Перхлорат магния (ангидрон) легко присоединяет воду и используется в качестве осушителя.
Бромная кислота, НBrО4, наименее устойчивая из кислот НГО4, существует только в водных растворах (w < 55 %), по свойствам близка к хлорной кислоте. НBrО4 и ее соли — перброматы — впервые были получены в 1968 г. окислением бромата калия фторидом ксенона(II):
KBrO3 + ХеF2 + Н2O = KBrО4 +Хе + 2НF
Йодную кислоту получают либо из соответствующих солей, либо электролитиче-
ским окислением йодноватой кислоты. Выделяется она в виде ортоформы Н5IO6. Кислот-
ные свойства йодной кислоты (Ka,1 = 3·10–2, Ka,2 = 2·10–7) выражены значительно слабее,
чем у хлорной кислоты. При нагревании она разлагается: 2НIO4 = I2O5 + h3O + O2
Ангидрид йодной кислоты не получен. Из солей известны метаперйодаты (NаIO4),
ортоперйодаты (Nа5IO6) и кислые соли типа Nа2h4IO6. Получают перйодаты окислением йодатов:
Получают перйодаты окислением йодатов:
KIO3 + KСlО = KIO4 + KСl KIO3 + Сl2 + 3KОН = K2h4IO6 + 2KСl
Йодная кислота и перйодаты — сильные окислители, но не взрывоопасны, поэтому их часто используют в практике:
4Н5IO6 + АsН3 = Н3AsO4 + 4HIO3+ 8Н2O
Различную окислительную активность гипохлоритов, хлоратов и перхлоратов можно показать на примере взаимодействия этих солей с йодидом калия.
Окислительная активность анионов в ряду СlO–, СlO3–, СlO4– уменьшается. Гипохло-
риты являются сильными окислителями во всех средах, хлораты — довольно сильные
164
окислители в кислой среде, а перхлораты в растворе не проявляют окислительных свойств.
2KI + NаСlO + Н2O = I2 + NаСl + 2KOН
6KI + KСlО3 + 3Н2SO4 = 3I2 + KСl + 3K2SO4 + 3Н2O
5.4.5. Оксиды хлора, брома и йода и их реакционная способность
Оксиды галогенов получают косвенным путем. Известны следующие оксиды хлора:
Сl2O, СlO2, (СlO3)2, Сl2O7. Оксид хлора(I) (хлорноватистый ангидрид) — газ желто-бурого цвета, получают пропусканием хлора в свежеприготовленуню суспензию HgO:
2Сl2 + 2HgO = HgCl2·HgO + Cl2O
При взаимодействии с водой Сl2O образует хлорноватистую кислоту.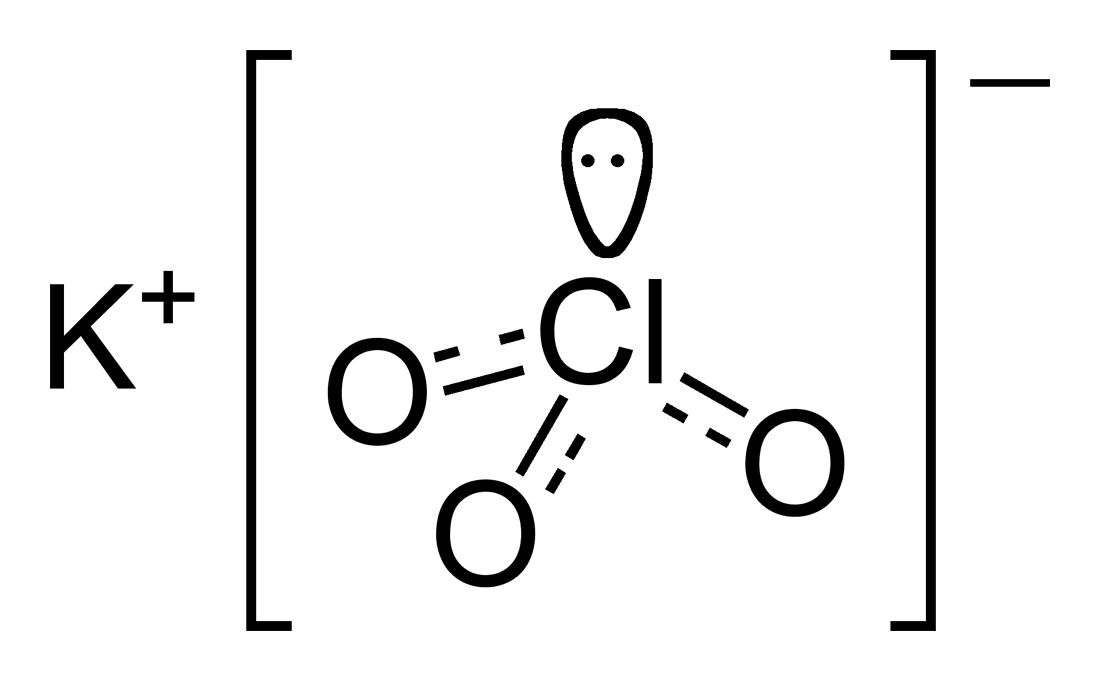
Оксид хлора(IV) — газ желтого цвета, получают восстановлением бертолетовой со-
ли:
2KСlO3 + Н2SO4 + SО2 = 2СlO2 + 2KНSO4 2KСlO3 + h3C2O4 = K2CO3 + 2ClO2 + CO2 + h3O
При взаимодействии с водой и растворами щелочей оксид хлора(IV) диспропорцио-
нирует:
2СlO2 + 2KOH = КСlО2 + KClO3 + h3O
СlO2 широко используют в качестве сильного окислителя для отбеливания бумаги,
тканей и т. д.
Оксид хлора(VI), (СlO3)2, — маслообразная жидкость красного цвета, получают окислением диоксида хлора:
2СlO2 + 2O3 = (СlO3)2 + 2O2
Он энергично взаимодействует с водой и растворами щелочей: (СlO3)2 + Н2O = НСlO3 + HСlО4
Оксид хлора(VII) — бесцветная маслянистая жидкость, является ангидридом хлор-
ной кислоты.
Для брома известны Вr2O, ВrO2 и ВrO3, существующие только в атмосфере озона.
Вследствие малой устойчивости оксиды брома мало изучены.
165
Оксид йода(V), I2O5, — белое кристаллическое вещество, является ангидридом йод-
новатой кислоты, HIO3. При нагревачии выше 300 °С разлагается:
При нагревачии выше 300 °С разлагается:
2I2O5 = 2I2 + 5O2
Сильные окислительные свойства I2O5 используют при количественном определении монооксида углерода:
I2O5 + 5СO = I2 + 5СO2
Оксиды I2O4 и I4O9 — кристаллические вещества желтого цвета. Их можно рассмат-
ривать как солеобразные соединения: (IO)IО3 — йодат йодила и I(IО3)3 — йодат йода(III).
5.5. ЛАБОРАТОРНАЯ РАБОТА «ГАЛОГЕНЫ»
Опыт 1. Получение галогенов7
Все опыты с галогенами следует проводить в вытяжном шкафу!
1.1. Получение хлора. В четыре пробирки поместить по 1 микрошпателю диоксида марганца, диоксида свинца, дихромата калия, перманганата калия соответственно. В каж-
дую пробирку добавить по 2–3 капли концентрированного раствора соляной кислоты. Ес-
ли реакция протекает медленно, пробирку осторожно нагреть. Отметить цвет выделяюще-
гося хлора и изменение цвета растворов. Написать уравнения реакций и определить сте-
хиометрические коэффициенты ионно-электронным методом. Какова роль соляной кисло-
Какова роль соляной кисло-
ты в этих реакциях?
MnO2 + HCl(конц.) →
PbO2 + HCl(конц.) →
К2Cr2O7 + HCl(конц.) →
KMnO4 + HCl(конц.) →
1.2. Получение брома и йода. В две пробирки поместить по 1 микрошпателю диок-
сида марганца. В одну пробирку добавить 2–3 кристалла бромида калия, в другую — столько же кристаллов йодида калия. К полученным смесям добавить по 1–2 капли кон-
центрированного раствора серной кислоты. Если реакция протекает медленно, пробирку
7 По окончании опыта 1 в пробирки с остатками реагентов добавить 4–5 капель раствора тиосульфата натрия и сразу же их вымыть.
166
слегка нагреть. Отметить цвет выделяющихся паров брома и йода. Написать уравнения протекающих реакций. Указать окислитель и восстановитель. Определить стехиометриче-
ские коэффициенты ионно-электронным методом.
MnO2(кр.)+ KBr(кр.) + h3SO4(конц.) →
MnO2(кр.)+ KI(кр.) + h3SO4(конц.) →
Опыт 2. Свойства галогенов
2.1. Растворимость брома и йода в органических растворителях. В одну пробир-
В одну пробир-
ку поместить 2–3 капли бромной воды, в другую — столько же капель йодной воды. В
каждую пробирку добавить по 2–3 кали тетрахлорметана. Растворы взболтать. Отметить окраску слоя CCl4. Как называется данный процесс?
2.2. Растворение хлора в воде. В пробирку поместить 1 микрошпатель пермангана-
та калия и добавить 2–3 капли концентрированного раствора соляной кислоты. Пробирку закрыть пробкой с газоотводной трубкой, конец которой опустить в пробирку, заполнен-
ную на 1/4 водой (следить за тем, чтобы конец газоотводной трубки был погружен в воду).
Через 1–2 мин опыт прекратить. Написать уравнение реакции хлора с водой. Как сместить равновесие в полученном растворе в сторону: а) выделения свободного хлора; б) раство-
рения хлора? Написать уравнения реакций разложения хлорноватистой кислоты.
Cl2 + h3O
HClO свет
HClO + P2O5 →
HClO катализатор,нагрев
2.3. Взаимодействие галогенов с сульфидом водорода. В три пробирки поместить по 2–3 капли сероводородной воды. Добавить по 1 капле: в первую пробирку хлорной во-
Добавить по 1 капле: в первую пробирку хлорной во-
ды, во вторую — бромной и в третью — йодной. Отметить происходящие изменения.
Написать уравнения протекающих реакций. Какие свойства проявляют галогены в этих реакциях?
h3S + Cl2(недост.) →
h3S + Br2(недост.) →
h3S + Cl2(избыт.) + h3O →
h3S + Br2(избыт.) + h3O →
h3S + I2 →
167
2.4. Взаимодействие брома и йода с металлами. В две пробирки поместить по 2–3
капли бромной и йодной воды соответственно. Добавить по 1 микрошпателю порошка цинка или магния. Наблюдать обесцвечивание растворов. Написать уравнения реакций,
указав окислитель и восстановитель.
Br2 + Mg →
I2 + Mg →
2.5. Взаимодействие иода с алюминием (демонстрационный). В фарфоровой чаш-
ке смешать порошок алюминия с мелкорастертым йодом в соотношении 1:5. К получен-
ной смеси добавить 1 каплю воды. Наблюдать бурное протекание реакции. Написать уравнение реакции, указав окислитель и восстановитель. Какова роль воды в этой реак-
Какова роль воды в этой реак-
ции?
Al + I2 катализатор
2.6. Окисление сульфата железа(II). В две пробирки поместить по 3–5 капель бромной и йодной воды соответственно. В каждую пробирку добавить по 1–2 кристалла сульфата железа(II) в виде соли Мора, (Nh5)2SO4·FeSO4·6h3O. В какой пробирке наблю-
дается изменение окраски раствора? Написать уравнение реакции. Выписать значения стандартных электродных потенциалов систем Cl2/2Cl–, Br2/2Br–, I2/2I–, Fe3+/Fe2+ и указать,
в каком случае окисление FeSO4 возможно. Подтвердилось ли это опытом? Доказать обра-
зование в растворе иона Fe3+ реакцией с тиоцианатом аммония. Можно ли окислить FeSO4
хлорной водой?
FeSO4 + Br2 →
FeSO4 + I2 →
2.7. Взаимодействие хлора с йодом. К 2–3 каплям йодной воды добавить 1 каплю раствора крахмала и 2–3 капли хлорной воды. Исчезает ли синяя окраска раствора? Напи-
сать уравнение реакции. Какие свойства проявляют в данной реакции хлор и йод?
Сl2 + I2 + h3O →
2. 8. Сравнение окислительной активности галогенов. В три пробирки поместить по 2–3 капли растворов c c = 0,5 моль/л: в первую — бромида калия, во вторую и тре-
8. Сравнение окислительной активности галогенов. В три пробирки поместить по 2–3 капли растворов c c = 0,5 моль/л: в первую — бромида калия, во вторую и тре-
тью — йодида калия. В каждую пробирку добавить по 2–3 капли тетрахлорметана. В
первую и вторую пробирки добавить 1–2 капли хлорной, в третью — бромной воды.
Наблюдать окрашивание слоя CCl4. Написать уравнения реакций. Как изменяются окис-
лительные свойства галогенов в ряду Cl2, Br2, I2? KBr + Cl2 →
KI + Cl2 →
168
KI + Br2 →
Опыт 3. Получение и свойства галогенидов водорода
3.1. Получение фторида водорода (демонстрационный). В фарфоровый тигель по-
местить 1–2 микрошпателя фторида кальция и 2–3 капли концентрированного раствора серной кислоты. Тигель накрыть стеклянной пластинкой, покрытой слоем парафина (в
слое парафина должна быть прочерчена буква или цифра). Тигель слегка нагреть. Опыт продолжать 2–3 мин. Счистить парафин и наблюдать появление на стекле надписи. Напи-
сать уравнение реакции получения фторида водорода. Какая это реакция: обменная или окислительно-восстановительная?
Какая это реакция: обменная или окислительно-восстановительная?
CaF2 + h3SO4(конц.) →
3.2. Получение хлорида водорода (демонстрационный). В колбу вместимостью
50 мл насыпать 10–20 г твердого хлорида натрия и прилить 10–15 мл концентрированного раствора серной кислоты. Выделяющийся газ собрать в сухую пробирку. Проверить дей-
ствие выделяющегося газа на влажную лакмусовую бумагу. После заполнения пробирки хлоридом водорода перевернуть ее вверх дном и опустить в кристаллизатор с водой,
предварительно подкрашенной метиловым оранжевым. Наблюдать быстрое заполнение пробирки водой. Какова растворимость хлорида водорода в воде? Почему хлорид водоро-
да дымит на воздухе? Написать уравнение реакции получения хлорида водорода. Можно ли получить хлорид водорода, приливая концентрированную серную кислоту к раствору хлорида натрия?
NaCl(крист.) + h3SO4(конц.) →
Опыт 4. Свойства солей галогеноводородных кислот
4.1. Взаимодействие бромида и йодида калия с серной кислотой. В две сухие пробирки поместить по 2–3 микрошпателя бромида и йодида калия соответственно и 2–3
В две сухие пробирки поместить по 2–3 микрошпателя бромида и йодида калия соответственно и 2–3
капли концентрированного раствора серной кислоты. Наблюдать выделение белого дыма,
а затем окрашенных паров брома и йода. Проверить действие выделяющихся газов на влажную лакмусовую бумагу и фильтровальную бумагу, смоченную раствором нитрата свинца. Написать уравнения реакций, учитывая, что образующиеся в первый момент бро-
мид и йодид водорода окисляются затем до свободных галогенов. Серная кислота восста-
навливается бромидом калия до диоксида серы, йодидом калия — до сульфида водорода.
169
Сравнить полученные результаты с выводами опытов 3.1 и 3.2. Как изменяются восстано-
вительные свойства веществ в ряду HF, HCl, HBr, HI? KBr(крист.) + h3SO4(конц.) →
KI(крист.) + h3SO4(конц.) →
4.2. Сравнение восстановительных свойств бромида и йодида калия. В две про-
бирки поместить по 2–3 капли раствора хлорида железа(III) (c = 0,2 моль/л) и по 2–3 капли тетрахлорметана. Добавить по 1–2 капли растворов c c = 0,5 моль/л: в первую пробирку — бромида калия, во вторую — йодида калия. Пробирки встряхнуть. В какой пробирке орга-
Добавить по 1–2 капли растворов c c = 0,5 моль/л: в первую пробирку — бромида калия, во вторую — йодида калия. Пробирки встряхнуть. В какой пробирке орга-
нический растворитель окрасился? Написать уравнение реакции. По значениям соответ-
ствующих стандартных электродных потенциалов сделать заключение, в каком случае не-
возможно восстановление FeCl3. Подтвердилось ли это опытом?
KI + FeCl3 →
KBr + FeCl3 →
4.3. Получение фторида магния. В пробирку, содержащую 2–3 капли раствора фто-
рида калия (натрия) (c = 0,5 моль/л), добавить 2–3 капли раствора соли магния (c = 0,25 моль/л). Наблюдать образование осадка. Написать уравнение реакции в молекуляр-
ной и ионной форме. KF + MgCl2 →
4.4. Получение галогенидов серебра. В четыре пробирки поместить по 2–3 капли растворов c c = 0,5 моль/л фторида калия (натрия), хлорида калия, бромида калия и йодида калия соответственно. В каждую пробирку добавить по 1 капле раствора нитрата серебра
(c = 0,1 моль/л). В каких пробирках образуются осадки? Написать уравнения реакций в молекулярной и ионной форме. Выписать значение Ksp галогенидов серебра и рассчитать их растворимость. Как изменяется растворимость в ряду AgF, AgCl, AgBr, AgI?
В каких пробирках образуются осадки? Написать уравнения реакций в молекулярной и ионной форме. Выписать значение Ksp галогенидов серебра и рассчитать их растворимость. Как изменяется растворимость в ряду AgF, AgCl, AgBr, AgI?
KF+ AgNO3 →
KCl+ AgNO3→
KBr+ AgNO3 →
KI+ AgNO3 →
Опыт 5. Получение и свойства кислородсодержащих соединений галогенов
5.1. Взаимодействие хлора со щелочью. Пробирку с раствором гидроксида натрия
(c = 2 моль/л) установить в стакан со льдом. Затем хлор, полученный, как описано в опыте
1.1, пропустить через раствор NaOH в течение 1–2 мин. Написать уравнение реакции хло-
170
ра с гидроксидом натрия при охлаждении. Как пойдет это взаимодействие при нагревании раствора? Сохранить полученный раствор для опытов 5.2 и 5.3.
Cl2 + NaOH холод Cl2 + NaOH нагрев
5.2. Окислительные свойства гипохлорита натрия и хлорной извести. В одну
пробирку поместить по 2–3 капли раствора сульфата марганца (c = 0,25 моль/л) и раствора гипохлорита натрия, полученного в опыте 5. 1. В другую пробирку поместить 2–3 капли раствора ацетата свинца (c = 0,25 моль/л) и 1 микрошпатель хлорной извести и прокипя-
1. В другую пробирку поместить 2–3 капли раствора ацетата свинца (c = 0,25 моль/л) и 1 микрошпатель хлорной извести и прокипя-
тить. Наблюдать образование осадков MnO2 и PbO2. Написать уравнения реакций и опре-
делить стехиометрические коэффициенты ионно-электронным методом.
MnSO4 + NaClO + h3O → CaOCl2 + Pb(Ch4COO)2 + h3O →
5.3. Сравнение окислительных свойств гипохлоритов, хлоратов и перхлоратов.
В три пробирки поместить по 2–3 капли раствора йодида калия. Добавить по 1–2 капли растворов гипохлорита натрия (полученного в опыте 5.1), хлората калия и перхлората натрия соответственно. В какой пробирке произошло окисление йодида калия в нейтраль-
ной среде?
Во вторую и третью пробирки добавить по 1–2 капли раствора серной кислоты (c = 1 моль/л). В какой из пробирок происходит окисление йодида калия в кислой среде?
Написать уравнения реакций. Сделать вывод о сравнительной окислительной способности анионов в ряду ClO–, ClO3 , ClO4 .
NaClO + KI + h3O→
NaClO3 + KI + h3O →
NaClO4 + KI + h3O →
NaClO3 + KI + h3SO4 →
NaClO4 + KI + h3SO4→
Опыт 6. Восстановительные свойства иода и иодида калия
Восстановительные свойства иода и иодида калия
6.1. Взаимодействие йода с хлоратом калия. В две пробирки поместить по 2–3
капли раствора хлората калия и йодата калия (c = 0,1 моль/л) соответственно. В каждую пробирку добавить по 1 капле раствора нитрата серебра. В какой пробирке образовался осадок? Написать уравнение реакции. Сравнить растворимость хлората и йодата серебра.
Атомная энергия. Том 10, вып. 6. — 1961 — Электронная библиотека «История Росатома»
Атомная энергия. Том 10, вып. 6. — 1961 — Электронная библиотека «История Росатома»Главная → Указатель произведений
ЭлектроннаябиблиотекаИстория Росатома
Ничего не найдено.
Загрузка результатов…
Закладки
Обложка561562563564565566567568569570571572573574575576577578579580581582583584585586587588589590591592593594595596597598599600601602603604605606607608609610611612613614615616617618619620621622623624625626627628629630631632633634635636637638639640641642643644645646647648649650651652 пустая653654655656657658659660661662
Увеличить/уменьшить масштаб
По ширине страницы
По высоте страницы
Постранично/Разворот
Поворот страницы
Навигация по документу
Закладки
Поиск в издании
Структура документа
Скопировать текст страницы
(работает в Chrome 42+,
Microsoft Internet Explorer и Mozilla FireFox
c установленным Adobe Flash Player)
Добавить в закладки
Текущие страницы выделены рамкой.
Содержание
ОбложкаОбложка
561Титульные листы
563Содержание
564Contents
565Статьи
565Гришанин Е. И., Иванов Б. Г., Шарапов В. Н.
Режим частичных перегрузок горючего в ядерных реакторах 572Агранович В. М., Семенов Л. П.
К теории влияния облучения на некоторые свойства графита 577Вальтер А. К., Вацет П. И., Колесников Л. Я., Тонапетян С. Г., Чернявский К. К., Шпетный А. И.
Выход нейтронов из реакций Li6 (t, n) и Li7 (t, n) 587Несмеянова Г. М., Алхазашвили Г. М.
Исследование влияния добавок некоторых соединений на окисление урана в кислых средах 592Аленчикова И. Ф., Липис Л. В., Николаев Н. С.
Исследование системы PuO2F2—HF—H2O (изотерма 20°C) 597Комаровский А. Н.
Покрытия строительных конструкций в радиоактивных помещениях 606Фридман Я. Б., Соболев Н. Д., Борисов С. В., Егоров В. И., Конопленко В. П., Морозов Е. М., Шаповалов Л. А., Шорр Б. Ф.
Некоторые вопросы термической прочности в реакторостроенииНестеров В. Г., Смиренкин Г. Н., Бондаренко И. И.
Г., Смиренкин Г. Н., Бондаренко И. И.
Глазунов М. П., Гривкова А. И., Зайцев Б. А., Киселев В. А.
Период полураспада Cs137 623Калафати Д. Д.
К вопросу о термодинамических циклах атомных электростанций 624Граммаков А. Г., Овчинников А. К., Любавин Ю. П., Овчинников В. М., Сазонов А. М.
Влияние вещественного состава урановых руд на сцинтилляционный спектр их γ-излучения 626Балясный Н. Д., Болтнева Л. И., Дмитриев А. В., Ионов В. А., Назаров И. М.
Определение содержаний радия, тория и калия в горных породах с самолета 630Красная А. Р., Носенко Б. М., Ревзин Л. С., Ясколко В. Я.
Применение фосфора CaSO4—Sm для целей дозиметрии 631Сивинцев Ю. В.
Предельно допустимые концентрации радиоактивных изотопов инертных газов осколочного происхождения 632 Котоусов Л. С., Мартынов Е. М., Степанов Ю. П.Разделение изотопов неона методом термодиффузии634Новости науки и техники
634Колычев Б. С.
С.
Б. Я.
Накопительное кольцо на электронном синхротроне во Фраскати 637В. Б-ов
Усовершенствование программ для расчета реакторов 637В. Б-ов
Проект реактора CAN-1 639А. К.
Быстрый импульсный реактор 639В. Б-ов
Пуск реактора для исследования плутониевого топливного цикла 640В. Б.
Материалы для высокотемпературных реакторов с газовым охлаждением 643В. В.
Тепловыделяющие элементы для быстрого реактора в Даунри 645Г. З.
Передвижная герметичная камера 646Р. Р.
Геоботанические поиски урана в США647Краткие сообщения
650Библиография
650Новая литература
653Тематический указатель материалов, помещенных в журнале «Атомная энергия», т. 10, 1961 г.
660Алфавитный указатель авторов
661Концевая страница
662Поправки
662Объявление
Обращаясь к сайту «История Росатома — Электронная библиотека»,
я соглашаюсь с условиями использования представленных там материалов.
Правила сайта (далее – Правила)
- Общие положения
- Настоящие правила определяют порядок и условия использования материалов, размещенных на сайте www.biblioatom.ru (далее именуется Сайт), а также правила использования материалов Сайтом и порядок взаимодействия с Администрацией Сайта.
- Любые материалы, размещенные на Сайте, являются объектами интеллектуальной собственности (объектами авторского права или смежных прав, а также прав на средства индивидуализации). Права Администрации Сайта на указанные материалы охраняются законодательством о правах на результаты интеллектуальной деятельности.
- Использование материалов, размещенных на Сайте, допускается только с письменного согласия Администрации Сайта или иного правообладателя, прямо указанного на конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
- Права на использование и разрешение использования материалов, размещенных на Сайте, принадлежащих иным правообладателям, нежели Администрация Сайта, допускается с разрешения таких правообладателей
или в соответствии с условиями, установленными такими правообладателями.
 Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на
конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на
конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
- Настоящие Правила распространяют свое действие на следующих пользователей: информационные агентства, электронные и печатные средства массовой информации, любые физические и юридические лица, а также индивидуальные предприниматели (далее — «Пользователи»).
- Использование материалов. Виды использования
- Под использованием материалов Сайта понимается воспроизведение, распространение, публичный показ, сообщение в эфир, сообщение по кабелю, перевод, переработка, доведение до всеобщего сведения и иные способы использования, предусмотренные действующим законодательством Российской Федерации.
- Использование материалов Сайта без получения разрешения от Администрации Сайта не допустимо.

- Внесение каких-либо изменений и/или дополнений в материалы Сайта запрещено.
- Использование материалов Сайта осуществляется на основании договоров с Администрацией Сайта, заключенных в письменной форме, или на основании письменного разрешения, выданного Администрацией Сайта.
- Запрещается любое использование (бездоговорное/без разрешения) фото-, графических, видео-, аудио- и иных материалов, размещенных на Сайте, принадлежащих Администрации Сайта и иным правообладателям (третьим лицам).
- Стоимость использования каждого конкретного материала или выдача разрешения на его использование согласуется Пользователем и Администрацией Сайта в каждом конкретном случае.
- В случае необходимости использования материалов Сайта, права на которые принадлежат третьим лицам (иным правообладателям, нежели Администрация Сайта, о чем прямо указано на таких материалах либо в
непосредственной близости от них), Пользователи обязаны обращаться к правообладателям таких материалов для получения разрешения на использование материалов.

- Обязанности Пользователей при использовании материалов Сайта
- 3.1. При использовании материалов Сайта в любых целях при наличии разрешения Администрации Сайта, ссылка на Сайт обязательна и осуществляется в следующем виде:
- в печатных изданиях или в иных формах на материальных носителях Пользователи обязаны в каждом случае использования материалов указать источник – электронная библиотека «История Росатома» (www.biblioatom.ru)
- в интернете или иных формах использования в электронном виде не на материальных носителях, Пользователи в каждом случае использования материалов обязаны разместить гиперссылку на Сайт —
электронная
библиотека «История Росатома» (www.biblioatom.ru), гиперссылка должна являться активной и прямой, при нажатии на которую Пользователь переходит на конкретную страницу Сайта, с которой заимствован
материал.

- Ссылка на источник или гиперссылка, указанные в пп. 3.1.1 и 3.1.2. настоящих Правил, должны быть помещены Пользователем в начале используемого текстового материала, а также непосредственно под используемым аудио-, видео-, фотоматериалом, графическим материалом Администрации Сайта.
- Размеры шрифта ссылки на источник или гиперссылки не должны быть меньше размера шрифта текста, в котором используются материалы Сайта, либо размера шрифта текста Пользователя, сопровождающего аудио-, видео-, фотоматериалы и графические материалы Сайта, а также цвет ссылки должен быть идентичен цветам ссылок на Сайте и должен быть видимым Пользователю.
- Использование материалов с Сайта, полученных из вторичных источников (от иных правообладателей, нежели Администрация Сайта, о чем прямо указано на таких материалах либо в непосредственной близости от
них), возможно только со ссылкой на эти источники и, в случае необходимости, установленной такими источниками (правообладателями), — с их разрешения.

- Не допускается переработка оригинального материала (произведения), взятого с Сайта, в том числе сокращение материала, иная его переработка, в том числе приводящая к искажению его смысла.
- 3.1. При использовании материалов Сайта в любых целях при наличии разрешения Администрации Сайта, ссылка на Сайт обязательна и осуществляется в следующем виде:
- Права на материалы третьих лиц, урегулирование претензий
- Материалы, права на которые принадлежат третьим лицам, размещенные на Сайте, размещены либо с разрешения правообладателя, полученного Администрацией Сайта, либо, в случае, если таковое использование прямо не запрещено правообладателем, в соответствии с Законодательством РФ в информационных целях с обязательным указанием имени автора, материал которого используется, и источника заимствования.
- В случае, если в обозначении авторства материалов в соответствии с п. 4.1. настоящих Правил содержится ошибка, или в случае использования материала с предполагаемым или реальным нарушением прав
третьих лиц, или в иных спорных случаях использования объектов интеллектуальной собственности, размещенных на Сайте, в том числе в случае, когда права третьего лица тем или иным образом нарушаются с
использованием Сайта, применяется следующая схема урегулирования претензий третьих лиц к Администрации Сайта:
- в адрес Администрации Сайта по электронной почте на адрес info@biblioatom.

- Администрация Сайта обязуется рассмотреть надлежаще оформленную претензию в срок не менее 5 (пяти) рабочих дней с даты ее получения по электронной почте.
 Администрация Сайта обязуется
уведомить
заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес,
указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация
Сайта
вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все
возможные
меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии;
Администрация Сайта обязуется
уведомить
заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес,
указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация
Сайта
вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все
возможные
меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии;
- Администрация Сайта в любом случае предпринимает все возможные меры к скорейшему удовлетворению обоснованных претензий третьих лиц и стремиться к максимально скорому урегулированию всех
спорных
вопросов.

- в адрес Администрации Сайта по электронной почте на адрес info@biblioatom.
- Прочие условия
- Администрация Сайта оставляет за собой право изменять настоящие Правила в одностороннем порядке в любое время без уведомления Пользователей. Любые изменения будут размещены на Сайте. Изменения вступают в силу с момента их опубликования на Сайте.
- По всем вопросам использования материалов Сайта Пользователи могут обращаться к Администрации Сайта по следующим координатам: [email protected]
- Во всем, что не урегулировано настоящими Правилами в отношении вопросов использования материалов на Сайте, стороны руководствуются положениями Законодательства РФ.
СогласенНе согласен
ICSC 0548 — ХЛОРАТ КАЛИЯ
ICSC 0548 — ХЛОРАТ КАЛИЯ« back to the search result list(ru)
Chinese — ZHEnglish — ENFinnish — FIFrench — FRHebrew — HEHungarian — HUItalian — ITJapanese — JAKorean — KOPersian — FAPolish — PLPortuguese — PTRussian — RUSpanish — ES
| ХЛОРАТ КАЛИЯ | ICSC: 0548 (Апрель 2013) |
| БЕРТОЛЕТОВА СОЛЬ | |
| CAS #: 3811-04-9 |
| UN #: 1485 |
| EINECS #: 223-289-7 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючее, но способствует возгоранию других веществ. При пожаре выделяет раздражающие или токсичные пары (или газы). Риск взрыва при контакте с органическими материалами, порошками металлов, солями аммиака, горючими веществами или восстановительными веществами. При пожаре выделяет раздражающие или токсичные пары (или газы). Риск взрыва при контакте с органическими материалами, порошками металлов, солями аммиака, горючими веществами или восстановительными веществами. |
НЕ использовать открытый огонь. НЕ допускать контакта с легковоспламеняющимися веществами. НЕ допускать контакта с горячими поверхностями. НЕ подвергать трению или ударам. | В случае возникновения пожара в рабочей зоне, использовать надлежащие средства пожаротушения. В случае пожара: охлаждать бочки и т.д. распыляя воду. Бороться с огнем из укрытия. |
| НЕ ДОПУСКАТЬ ОБРАЗОВАНИЕ ПЫЛИ! СТРОГО СОБЛЮДАТЬ ГИГИЕНИЧЕСКИЕ ТРЕБОВАНИЯ! ВО ВСЕХ СЛУЧАЯХ ОБРАТИТЬСЯ К ВРАЧУ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Кашель. Боли в горле. Боли в горле. |
Применять местную вытяжку или средства защиты органов дыхания. | Свежий воздух, покой. Обратиться за медицинской помощью. |
| Кожа | Покраснение. | Защитные перчатки. | Сначала промыть большим количеством воды в течение не менее 15 минут, затем удалить загрязненную одежду и снова промыть. обратиться за медицинской помощью . |
| Глаза | Покраснение. Боль. | Использовать защитные очки. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | Боль в животе. Синие губы, ногти и кожа. Помутнение сознания. Судороги. Диарея. Головокружение. Головная боль. Тошнота. Сбивчивое дыхание. Боль в горле. Потеря сознания. Рвота. Симптомы могут проявляться с задержкой. См. Примечания. Рвота. Симптомы могут проявляться с задержкой. См. Примечания. |
Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. Обратиться за медицинской помощью. |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
| Проконсультироваться со специалистом! БлокируемыеСмести просыпанное вещество в закрытые контейнеры. При необходимости, сначала намочить, чтобы избежать появления пыли. Смыть остаток большим количеством воды. НЕ засыпать древесными опилками или другими горючими абсорбентами. |
Согласно критериям СГС ООН ОПАСНО Может вызвать пожар или взрыв; сильный окислительНаносит вред при вдыхании Вызывает поражение крови Может вызвать повреждения крови в результате длительного или многократного воздействия Очень токсично для водных организмов с долговременными последствиями Транспортировка |
| ХРАНЕНИЕ | |
| Отдельно от горючих веществ, восстановителей, сильных кислот, органических химических веществ, соединений аммония, порошкообразных материалов и пищевых продуктов и кормов. Хранить сухим. | |
| УПАКОВКА | |
| Не перевозить с продуктами питания и кормами для животных. |
| ХЛОРАТ КАЛИЯ | ICSC: 0548 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: ClKO3 / KClO3 |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
Воздействие вещества на окружающую среду не было исследованы должным образом. |
| ПРИМЕЧАНИЯ |
|---|
| Приобретает чувствительность к ударам при загрязнении органическими веществами, восстанавливающими веществами, порошками металлов и аммониевыми соединениями. В зависимости от степени воздействия, рекомендуется периодическое медицинское обследование. В случае отравления этим веществом необходимо специфическое лечение; должны иметься в наличии соответствующие средства с инструкциями. Промойте загрязненную одежду большим количеством воды ввиду опасности возгорания |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС Символ: O, Xn, N; R: 9-20/22-51/53; S: (2)-13-16-27-61 |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
CLO3- Структура Льюиса, молекулярная геометрия, гибридизация и форма
Структура Льюиса
- Опубликовано Priyanka
17 Apr
PROMULA Clo 3 9007 –9003 Hemical Formula Clo 3 9007 –9003 . . Хлор может достигать степеней окисления +1, +3, +5 и +7. В этом случае, как видно из рисунка, хлораты существуют в степени окисления +5. Благодаря большому количеству окисляющих элементов ион хлората и его соли образуют мощные окисляющие соединения. Хлорат калия (KCLO 3 ) является широко используемым окислителем, который содержится в различных объектах, от дезинфицирующих средств до пиротехники и взрывчатых веществ. Соединение имеет следующие свойства: Contents A Chlorate ion состоит из одного атома хлора и трех атомов кислорода . В ионе также существует отрицательный ионный заряд -1. Находясь в группе 7 периодической таблицы, хлор имеет семь валентных электронов с валентностью -1. Отсюда и знаменитый Cl – ион. Электронная конфигурация хлора представлена как [Ne]3s 2 3p 5 . Возможность электронов в его d-оболочке делает его гипервалентным. Следовательно, один атом хлора дает 7 x 1 = 7 электронов. Находясь в группе 6 периодической таблицы, кислород имеет шесть валентных электронов и имеет валентность -2. Электронная конфигурация кислорода: 1s 2 2s 2 2p 4 . Следовательно, при 3 атомах кислорода вносят 6 x 3 = 18 электронов. Анионный заряд -1 и вносит один валентный электрон. Следовательно, общее количество валентных электронов в хлорат-ионе равно 7 + 18 +1 = 26 Точечные структуры Льюиса элемента представляют собой схематическое расположение составляющих его элементов. молекулы, атомы и их электронные связи. Общее число электронных пар в хлорат-ионе определяется как: 26 валентных электронов ÷ 2 = 13 пар. Атом хлора занимает центральное положение в структуре благодаря своей способности делиться большим количеством электронов. Следовательно, он становится проводником для большего количества электронных связей, чем кислород, поэтому занимает центральное место, как показано на рисунке. В структуре показаны 3 пары электронов. Остальные пары можно расположить по правилу октетов. Электроны располагаются, начиная снаружи внутрь. Три атома кислорода образуют по 3 пары каждый, а последняя пара отмечена хлором, как показано на рисунке. Для определения наиболее стабильной структуры хлората (ClO 3 – ) мы используем понятие формальных зарядов. Формальные заряды для элемента/структуры помогают определить наиболее стабильное состояние структуры Льюиса. Он определяется таким образом, чтобы заряд каждого атома был близок к нулю. FC = Валентные электроны – Несвязывающие электроны – (Связывающие электроны ÷ 2) В данном случае Заряды на этих атомах, как показано на рисунке, делают его нестабильным. Чтобы бороться с этим, мы можем перенести неподеленные пары в атомах кислорода, чтобы сформировать связи с хлором в середине. Это дает хлору более 8 электронов посередине. Это возможно благодаря пустым трехмерным орбитам хлора, что делает его исключением из правила октетов. Ионы хлората существуют в нескольких резонансных состояниях из-за смещения связей, как показано на рисунке. Центральный атом хлора (Cl) образует ковалентные связи двойного и одинарного характера с окружающими атомами кислорода. Для расчета состояния гибридизации ClO 3 – нам необходимо определить количество неподеленных пар и количество сигма-связей, присутствующих в ионе. Поскольку хлор находится в третьей строке периодической таблицы, он способен расширять свои орбитали в возбужденном состоянии . Его электронная конфигурация задается как [Ne] 3s 2 3p 5 . Следовательно, две неподеленные пары заполняют 3s-орбиталь, а три имеющихся сигма-связи заполняют 3p-орбиталь. Теперь мы вставляем две пи-связи в первые два трехмерных орбитальных пространства. Остальные электроны от сигма-связей заполняются на 3р-орбитали. Следовательно, гибридизация ClO 3 – – это sp 3 . Из-за отталкивания электронов на окружающих атомах кислорода и неподеленной пары на хлоре атомы раздвигаются и образуют углы связи 109,5°. Хлор образует центральный атом в ClO 3 – ион с окружающими его атомами кислорода. Согласно теории VSEPR (отталкивание электронных пар валентной оболочки), неподеленная пара на хлоре и электронные облака на окружающих атомах кислорода отталкивают друг друга. Поскольку мы знаем, что стерическое число ClO 3 – равно 4 (1 неподеленная пара и три связанные пары), мы можем определить, что молекулярная геометрия ClO 3 – является тригонально-пирамидальной. Из приведенной выше структуры Льюиса мы знаем, что ее электронная форма равна четырехгранный . Заключительные замечания Давайте быстро суммируем важные особенности CLO 3 — Название урока: Терминатор мармеладных мишек Тема:
Электрохимия Уровень: 10 и 11 класс Необходимое время: 1
45-минутный период Наука или
Справочный материал по математике для учителя Это
демонстрация ярко и наглядно иллюстрирует концепцию сильного процессора окислитель . Учебная программа по химии следующими способами: wiz», или, лучше, как иллюстрацию основной идеи сильный
окислитель . Если оно используется для последней цели, оно должно быть представлено как часть
обсуждение окисления и восстановления. На этикетке бутылки указано, что калий
хлорат — сильный окислитель, и эта демонстрация показывает, что это значит. Расплав KClO 3 банка
вызвать очень сильные ожоги . Подумайте о своей коже или верхней части лабораторного стола
как еще один мармеладный мишка. Применяйте лучшую технику безопасности, представляя это
демонстрация. Это послужит хорошим примером для вашего класса. Есть также много
дыма, образующегося при окислении (пар и KCl?), поэтому этот эксперимент
должно быть сделано только в комнате с хорошая вентиляция. Учебные задачи : SWBAT: 1.
Перечислите доказательства того, что химическая реакция
(разложение) произошло. 2.
Опишите экзотермические реакции. 3.
Определите атомы, которые окисляются или восстанавливаются в результате
перенос электрона. 4.
Определите окислительно-восстановительные реакции, анализируя изменения в
степени окисления различных атомов в реакции. 5.
Уравнения баланса окислительно-восстановительных реакций. 6.
Опишите влияние катализатора на реакцию
скорость и как происходит этот эффект. Национальное научное образование
Стандарты, которым соответствует этот урок : Основные темы: VIII.1, VIII.2,
VIII.3, VIII.4, VII.5, VIII.6, VIII.7 Основное понимание: 3.2d, 3.2
e, 3.2f, 3.2g, 3.2h, 3.2i, 3.3b Оборудование
и Материалы: Наименование молекулы Хлорат (CLO 3 — ) № Valence Electrons 7+ (6 as 3) +1128 № Valence Electrons 7+ (6 as 3) +1128 .  = 26 валентных электронов
= 26 валентных электронов Гибридизация sp 3 Валентные углы 109.5° Molecular Geometry of ClO 3 – Trigonal Pyramidal 
Элемент В N B/2 FC Cl 7 2 6/2 +2 O 6 6 2/2 -1  Чем выше заряд, тем он нестабильнее.
Чем выше заряд, тем он нестабильнее.

урок химии
урок химииMs. Юстина Празуч
Мистер Джозеф Коэн

Этот
demo дает пример чрезвычайно экзотермической реакции. Это также
пример реакции разложения, которая протекает быстро, когда катализатор (тепло)
используется. Кроме того, дает возможность накладывать светящуюся шину.
тест на наличие кислорода.
Это также
пример реакции разложения, которая протекает быстро, когда катализатор (тепло)
используется. Кроме того, дает возможность накладывать светящуюся шину.
тест на наличие кислорода.
Соображения безопасности:
Поскольку эта реакция чрезвычайно экзотермична, обязательно тщательное рассмотрение пунктов, упомянутых ниже.
Убедитесь, что защитный экран находится между аппарат и ваши ученики
Проверьте пробирку Pyrex на наличие дефектов. Если какие-либо дефекты (небольшие трещины и т.п.) присутствуют, воздержитесь от его использования.
Убедитесь, что вы носите защитный экран и лабораторный Пальто.
Обязательно направьте пробирку от себя и ваши студенты.
1. Заполните тест трубку на глубину около одного дюйма с хлоратом калия.
2. Зажать тест трубка установлена под углом примерно 45°.
3. Установите кольцо сборка стенд-зажим-пробирка за защитным экраном перед классом.
4. Подключите
горелку, чтобы пробирку можно было легко нагреть.
5. Зажгите горелки и нагрейте пробирку на дне, пока твердое вещество не расплавится (т.пл. 350 С).
6. После твердого KClO 3 начал разжижают, проверяют на наличие кислорода с помощью светящейся шины.
7. Если тест работал, вы можете удалить горелку Бунзена и выключить ее.
8. Встаньте за защитный щит и осторожно опустите одного мармеладного мишку в пробирку с помощью щипцов или щипцов.
9. Жестокий возникает огнестрельная реакция, которая длится около одной минуты. Ваш класс будет запомнить на долгие годы!
Включите вопросы для обсуждения и возможные ответы :
Ключевые вопросы:
Вопросы, которые необходимо задать до демо
- Что такое реакция разложения?
- Обсудите и составьте химическое уравнение для этого реакция.
- Как мы проверяем наличие кислорода в реакция?
- Почему мы используем катализатор для некоторых реакций? Что несколько примеров катализатора?
- Какая разница между экзотермической и эндотермической реакцией?
Вопросы к спросите во время демонстрации
- Почему мы используем горелку Бунзена в этой реакции?
- Почему мы делаем светящиеся перед тем, как положить мармеладного мишку в пробирку?
Вопросы к спросите после демо
- Что заставило мармеладного мишку взорваться?
- Проверить, какие продукты
находятся.

Объяснение:
Химическая промышленность уравнение реакции для этой демонстрации:
2 KClO 3(s) 2 KCl (т) + 3 О 2 (г)
1. Символ «r», или слово «тепло» может быть написано над стрелкой, чтобы показать, что тепло используется как катализатор.
2. Тепло от горелки Бунзена используется в качестве катализатора для увеличения скорости реакции. Светящаяся шина будет повторно зажечь, как только появится кислород, что означает, что разложение реакция началась.
3. Поскольку эта реакция чрезвычайно экзотермична, тепло в результате реакции сахар в мармеладном мишке взрывается. вещество, похожее на зефир.
Крышка :
Мармеладный мишка состоит в основном из сахара,
который легко окисляется чем-то вроде расплавленного хлората калия. Идеально,
сбалансированное уравнение покажет сахарозу (C 12 H 22 O 11 )
превращается в углекислый газ и воду, в то время как KClO 3 становится
KCl. Действительная реакция, по-видимому, не доходит до полного завершения, поскольку
обычно остается небольшой липкий осадок.
Действительная реакция, по-видимому, не доходит до полного завершения, поскольку
обычно остается небольшой липкий осадок.
Оценка : «Разборки» Учащиеся отвечают на вопросы без помощи. Затем команды проверяют и тренируют. Каждая команда имеет набор контрольных карточек. сложены в центре стола. Учитель выбирает капитана каждой команды. Капитан вытягивает верхнюю карту и вслух читает вопрос. Работаем индивидуально, все учащиеся записывают свои ответы. Затем товарищи по команде делятся ответами.
Дополнительная деятельность : Дайте несколько советов учащимся, которые хотят больше узнать по этой теме. Это могут быть действия, которые можно выполнять дома или в Интернете.
Библиография/Ссылки : (перечислите любые полезные книги, статьи, веб-сайты)
1. Plumb, D. (2005). Структуры успеха в химии, Занятия в старшей школе: Каган Издательский.
2. Амато И. (1997). Stuff-Материалы, из которых сделан мир. Нью-Йорк: Книги Эйвона.
3. Майерс Т.
(2004). Химия, физическая установка. Учителя национальных наук
Ассоциации.
Майерс Т.
(2004). Химия, физическая установка. Учителя национальных наук
Ассоциации.
Структура, водородная связь, молярная масса
- Автор Akanksha P John
- Последнее изменение 19-07-2022
- Автор Аканкша П Джон
- Последнее изменение 19-07-2022
Хлорат – анионсодержащее химическое соединение; хлораты также являются солями хлорной кислоты. Практически любой горючий элемент (сахар, опилки, древесный уголь, органические растворители, металлы и т. д.) быстро воспламеняет соединения хлоратных солей. Первоначально хлораты часто использовались в пиротехнике; однако от их использования отказались из-за их нестабильности. Большинство пиротехнических приложений, в которых ранее использовались хлораты, перешли на более стабильные перхлораты. В этой статье мы подробно рассмотрим хлорат и его химическую формулу. 9-\).
В этом анионе атом хлора находится в степени окисления \(+5\). Когда мы используем римское число в скобках с хлоратами, такими как хлорат (V), мы имеем в виду определенный оксианион хлора. — \). 9{\rm{o}} \) в хлорате калия), мы не можем адекватно представить его одной структурой Льюиса. Кроме того, атом хлора гипервалентен. Вместо этого его часто рассматривают как гибридную структуру из нескольких резонансных структур.
— \). 9{\rm{o}} \) в хлорате калия), мы не можем адекватно представить его одной структурой Льюиса. Кроме того, атом хлора гипервалентен. Вместо этого его часто рассматривают как гибридную структуру из нескольких резонансных структур.
Анионы хлората имеют тригональную пирамидальную структуру, как и предсказывает теория отталкивания электронных пар валентной оболочки. Хлораты имеют молярную массу \(83,45\;{\rm{г}}/{\rm{моль}}\).
Получение хлоратаРазличные методы получения хлората объясняются ниже
Лабораторный препарат хлоратаХлораты металлов получают добавлением хлора к горячим и концентрированным гидроксидам металлов, таким как \({\rm{KOH}}\):
\(3{\rm{C}}{{\rm{l}}_2} + 6{\rm{KOH}} \to 5{\rm{KCl}} + {\rm{KCl}}{{ \rm{O}}_3} + 3{{\rm{H}}_2}{\rm{O}}\)
В этой реакции хлор подвергается диспропорционированию (восстановлению и окислению). – \) (степень окисления \(+5\)). Когда холодные водные гидроксиды металлов реагируют с хлором, они образуют хлорид и гипохлорит (степень окисления \(+1\)). 9\circ }{\rm{C}}\).
– \) (степень окисления \(+5\)). Когда холодные водные гидроксиды металлов реагируют с хлором, они образуют хлорид и гипохлорит (степень окисления \(+1\)). 9\circ }{\rm{C}}\).
Согласно недавнему исследованию, природные залежи хлората можно найти по всему миру, при этом относительно высокие концентрации обнаруживаются в засушливых и сверхзасушливых регионах.
Также было измерено содержание хлората в пробах осадков, при этом количество хлората было сопоставимо с количеством перхлората. Считается, что хлорат и перхлорат имеют общий естественный механизм образования и могут участвовать в биогеохимическом цикле хлора. Присутствие природного хлората также может объяснить, почему широкий спектр микроорганизмов способен восстанавливать хлорат до хлорида.
Кроме того, эволюция восстановления хлората может быть древним явлением, потому что все описанные до сих пор бактерии, восстанавливающие перхлораты, используют хлорат в качестве конечного акцептора электронов. Следует однозначно заявить, что в настоящее время не известно ни одного минерала с преобладанием хлората. Это означает, что хлорат-анион существует только как замещение в известных минеральных разновидностях или, в конечном счете, в растворах, заполняющих поры.
Следует однозначно заявить, что в настоящее время не известно ни одного минерала с преобладанием хлората. Это означает, что хлорат-анион существует только как замещение в известных минеральных разновидностях или, в конечном счете, в растворах, заполняющих поры.
Если после слова «хлорат» в скобках стоит римская цифра, это означает, что оксианион содержит хлор в указанной степени окисления, а именно:
Хлораты ОксианионыПо этому определению «хлорат» относится к любому оксианиону хлора. Термин «хлорат» обычно используется для обозначения оксианиона хлора в степени окисления \(+5\).
Соединения хлоратовПримеры хлоратов включают хлорат натрия, хлорат калия и хлорат магния.
Хлорат натрия Хлорат натрия Хлорат натрия имеет химическую формулу \({\rm{NaCl}}{{\rm{O}}_3}\) и представляет собой неорганическое соединение. Это белый кристаллический порошок, который легко растворяется в воде. \circ }{\rm{C}}\, высвобождая кислород и оставляя хлорид натрия. Ежегодно производится несколько сотен миллионов тонн хлората натрия, в основном для использования в отбеливании целлюлозы для производства бумаги высокой белизны.
\circ }{\rm{C}}\, высвобождая кислород и оставляя хлорид натрия. Ежегодно производится несколько сотен миллионов тонн хлората натрия, в основном для использования в отбеливании целлюлозы для производства бумаги высокой белизны.
- Основным коммерческим применением хлората натрия является производство диоксида хлора \(\left( {{\rm{Cl}}{{\rm{O}}_2}} \right)\).
- Все перхлоратные соединения производятся в промышленных масштабах путем окисления растворов хлората натрия при электролизе.
- Используется в химических генераторах кислорода, например, в коммерческих самолетах.
- Неселективный гербицид. Считается фитотоксичным для всех частей зеленых растений. Это также может привести к смерти из-за поглощения корней.
- Хлорат натрия может быть объединен с сахарозой для создания взрывоопасного топлива, которое горит в герметичных помещениях, подобно пороху.
Хлорат калия — это соединение с молекулярной формулой \({\rm{KCl}}{{\rm{O}}_3}\), содержащее калий, хлор и кислород. Это белое кристаллическое вещество в чистом виде. Это второй по распространенности хлорат в промышленности после хлората натрия. Это сильный окислитель, и его основное применение — безопасные спички.
Это белое кристаллическое вещество в чистом виде. Это второй по распространенности хлорат в промышленности после хлората натрия. Это сильный окислитель, и его основное применение — безопасные спички.
- Для получения кислорода,
- В качестве дезинфицирующего средства,
- Во взрывчатых веществах и фейерверках, и
- В выращивании, форсируя стадию цветения лонгана, заставляя его плодоносить в более теплом климате.
Хлорат магния
Хлорат магния Хлорат магния представляет собой неорганическое соединение, состоящее из катиона магния и двух анионов хлората, с химической формулой \({\rm{Mg}}{\left( {{\rm{Cl}}{{\rm{O}} _3}} \справа)_2}\). Это белое кристаллическое твердое вещество с молярной массой \(19-\). Поскольку хлораты являются сильными окислителями, их следует хранить вдали от органических и легко окисляемых материалов. Они имеют пирамидально-треугольную структуру. Мы также изучили некоторые примеры и использование хлоратов, таких как хлорат натрия, хлорат калия и хлорат магния.

 Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на
конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на
конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.





 Администрация Сайта обязуется
уведомить
заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес,
указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация
Сайта
вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все
возможные
меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии;
Администрация Сайта обязуется
уведомить
заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес,
указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация
Сайта
вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все
возможные
меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии;
 1; Группа упаковки по ООН: II
1; Группа упаковки по ООН: II
 Разлагается при контакте с сильными кислотами. При этом выделяется кислород и токсичные газы, включая двуокись хлора и хлор. Вещество является сильным окислителем. Активно вступает в реакцию с Горючими материалами и восстановителями. Приводит к появлению опасности пожара и взрыва. Разъедает многие металлы в присутствии воды.
Разлагается при контакте с сильными кислотами. При этом выделяется кислород и токсичные газы, включая двуокись хлора и хлор. Вещество является сильным окислителем. Активно вступает в реакцию с Горючими материалами и восстановителями. Приводит к появлению опасности пожара и взрыва. Разъедает многие металлы в присутствии воды.
 Вещество может оказать воздействие на кровь и почки. Может привести к гемолизу, образованию метгемоглобина и ухудшению рабты почек. Эффект от воздействия может проявляться с задержкой. Необходимо медицинское обследование.
Вещество может оказать воздействие на кровь и почки. Может привести к гемолизу, образованию метгемоглобина и ухудшению рабты почек. Эффект от воздействия может проявляться с задержкой. Необходимо медицинское обследование.
