Галогены. История открытия галогенов — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Галогены
2. История открытия галогенов
ФторХлор
Бром
Йод
Астат
3. История открытия фтора
В 1886 году французский химик А.Муассан,
используя
электролиз
жидкого
фтороводорода,
охлажденного до температуры –23°C,
смог на аноде получить первую
порцию нового, газа. В первых
опытах для получения фтора Муассан
использовал
очень
дорогой
электролизер,
изготовленный
из
платины и иридия.
 При этом каждый
При этом каждыйграмм полученного фтора «съедал»
до 6 г платины.
Анри
Муассан
(1852 –
1907)
4. История открытия хлора
КарлВильгельм
Шееле
(1742 – 1786)
В 1774 году шведский ученый К.
Шееле
открыл
хлор,
который
принял за сложное вещество и назвал
«дефлогистированной
соляной
кислотой».
В 1807 году английский химик
Гемфри Дэви получил тот же газ. Он
пришел к выводу, что получил новый
элемент и назвал его «хлорин» (от
«хлорос» — желто-зеленый).
В 1812 году Гей-Люссак дал
газу название
хлор.
5. История открытия брома
В1825 году французский
химик А.Ж.Балар
при изучении
маточных
рассолов
выделил
темно-бурую жидкость, который он
назвал — «мурид» (от латинского
слова
muria,
означающего
«рассол»).
Комиссия
Академии,
проверив
это
сообщение,
подтвердила открытие Балара и
предложила
назвать
элемент
бромом (от «бромос», с греческого
«зловонный»).

Антуан
Жером
Балар
(1802 –
1876)
6. История открытия йода
БернарКуртуа
(1777 –
1838 )
В 1811 году французский химик
Бернар Куртуа открыл иод
путём
перегонки маточных растворов от
своего
азотнокислого
кальция
с
серной кислотой
Чтобы другие
химики
могли
изучать
новое
вещество, Б. Куртуа подарил его
(правда, очень небольшое количество)
фармацевтической фирме в Дижоне.
В
1813
году
Гей-Люссак
подробно изучил этот элемент и дал
ему современное название. Название
«иод» происходит от греческого слова
«иодэс» — «фиолетовый» (по цвету
паров).
I
I
1
H
II
2
Li
III
3
Na
4
K
IV
5
6
V
7
8
VI
9
VII
10
II
Группы элементов
IV
V
VI
III
Водород
3
Литий
Cu
63.546
Медь
Rb
37
85.47
Рубидий
47
Ag
107.868
Серебро
Cs
55
132.
 905
905Цезий
79
Au
196.966
Золото
Fr
4
9,012
Франций
65.37
Цинк
38
87.62
Стронций
Sс
44.956
Скандий
Иттрий
112.41
Кадмий
Индий
56 57
137.34
Барий
Ртуть
200.59
Радий
Ac
227.028
Актиний
Ti
47.90
Zr
91.224
Цирконий
Hf
178.49
Гафний
Свинец
Rf
[261]
Резерфордий
O
8
15.996
Кислород
15 S
Фосфор
V
23
50.942
Ванадий
33
74.9216
Мышьяк
41
Nb
92.906
Ниобий
73
Ta
180.9479
Тантал
83
208.98
Висмут
105
Db
[262]
Дубний
F
фтор
16 Cl
32,064
Сера
Cr
24
51.996
Хром
Se
34
78.96
Селен
42
Mo
95.94
Молибден
51 Te
121.75
Сурьма
82 Bi
207.2
7
14.0067
30,9738
50 Sb
118.71
Олово
104
Азот
32 As
72.59
Германий
72
N
14 P
28,086
Титан
81 Pb
204.
 383
383Таллий
88 89
[226]
La
138.81
Лантан
Hg Tl
80
22
49 Sn
114.82
12,011
Кремний
39 40
88.9059
6
Углерод
31 Ge
69.72
Галлий
Y
C
13 Si
26,9815
Алюминий
Cd In
48
87 Ra
[223]
5
10 .811
Zn Ga
30
Ba
Бор
20 21
40,08
Кальций
Sr
В
12 Al
24,312
Магний
19 Ca
39.102
Калий
29
Be
11 Mg
Натрий
2
Гелий
Вериллий
22,9898
VIII
He
Галогены
1
1.00797
6,939
VII
Теллур
74
52
127.60
W
183.85
Вольфрам
Po
25
Br
Бром
43
Иод
75
Sg
[263]
Сиборгий
54.938
107
Неон
18
Аргон
39,948
27
55.847
Железо
35 Kr
79.904
Co 28 Ni
58.933
Кобальт
99
36
Криптон
101.07
Re
186.2
Ксенон
76
Родий
[262]
Pd
106.4
Палладий
131,3
Os 77 Ir 78 Pt
190.
 2
2192.2
Осмий
Иридий
86
Радон
[222]
Bh 108 Hs 109 Mt
Борий
46
54
85 Rn
210
102.905
Рутений
53 Xe
126.904
58.71
Никель
83,8
Tс 44 Ru 45 Rh
Рений
Астат
10
20,18
Mn 26 Fe
Технеций
I
Ne
17 Ar
35,453
Марганец
84 At
208.982
Полоний
106
Хлор
9
18.9984
4,003
[265 ]
Хассий
[266 ]
Мейтнерий
195.09
Платина
I
I
1
II
2
III
3
4
IV
5
6
V
7
8
VI
9
VII
10
II
III
Группы элементов
IV
V
VI
VII
VIII
Фтор/Fluorum (F)
Внешний вид
Бледно-жёлтый
простого вещества газ.
Очень ядовит.
Электронная
[He] 2s2 2p5
конфигуранция
ЭО
3,98
(по Полингу)
Степень окисления −1
Плотность
(при −189 °C)1,108
г/см ³
53,53К
Температура
плавления
Температура
85,01 К
кипения
I
I
1
II
2
III
3
4
IV
5
6
V
7
8
VI
9
VII
10
II
III
Группы элементов
IV
V
VI
VII
VIII
Хлор / Chlorum (Cl)
Внешний вид
Газ жёлто-зеленого
простого вещества цвета с резким
запахом.
 Ядовит.
Ядовит.Электронная
[Ne] 3s2 3p5
конфигуранция
ЭО
3.16
(по Полингу)
Степень окисления 7, 6, 5, 4, 3, 1, −1
Плотность
(при −33.6 °C)1,56
г/см ³
Температура
172.2 К
плавления
Температура
238.6 К
кипения
I
I
1
II
2
III
3
4
IV
5
6
V
7
8
VI
9
VII
10
II
III
Группы элементов
IV
V
VI
VII
VIII
Бром / Bromum (Br)
Внешний вид
красно-бурая
простого вещества жидкость с
сильным
неприятным
запахом
Электронная
[Ar] 3d10 4s2 4p5
конфигуранция
ЭО
2,96
(по Полингу)
Степень окисления 7, 5, 3, 1, -1
Плотность
3,12 г/см³
265,9 К
Температура
плавления
Температура
331,9 К
кипения
I
I
1
II
2
III
3
4
IV
5
6
V
7
8
VI
9
VII
10
II
III
Группы элементов
IV
V
VI
VII
VIII
Ио́д / Iodum (I)
Внешний вид
простого вещества
Черно-фиолетовые
кристаллы с
металлическим
блеском
Электронная
конфигуранция
ЭО
(по Полингу)
Степень окисления
Плотность
[Kr] 4d10 5s2 5p5
Температура
плавления
Температура
кипения
386,7 К
2,66
7, 5, 3, 1, -1
4,93г/см³
457,5 К
I
I
1
II
2
III
3
4
IV
5
6
V
II
III
Группы элементов
IV
V
VI
VII
Аста́т / Astatium (At)
Внешний вид
Нестабильные
простого вещества чёрно-синие
кристаллы
Электронная
[Xe] 4f14 5d10 6s2 6p
5
конфигуранция
ЭО
2,2
(по Полингу)
Степень окисления 7, 5, 3, 1, −1
Плотность
n/a г/см
7
8
VI
9
VII
10
VIII
Температура
плавления
Температура
кипения
517 К
582 К
14.
 Химические свойстваВзаимодействие с металлами:
Химические свойстваВзаимодействие с металлами:1. 2К + Cl2→ 2КCl
2. 2Fe + 3Cl2 → 2FeCl3
3. Cu + Cl2 → Cu Cl2
4. 2Al + 3Br2 → 2AlBr3
5. 2Al + 3I2 → 2AlI3
15. Химические свойства
Взаимодействие с неметаллами:А) с водородом
1.
2.
3.
4.
h3
h3
h3
h3
+ F2 → 2HF +Q
+ Cl2 → 2HCl +Q
+ Br2 → 2HBr +Q
+ I2 → 2HI- Q
В) с другими неметаллами
Скорость
реакции
уменьш.
1. 2P + 5Cl2 → 2PCl5 ( tº, в изб.Сl2)
18. Химические свойства
Взаимодействие со сложными веществами:А) с водой
1.
2.
3.
4.
2h3O + F2 → 4HF + O2 (взрыв)
h3O + Cl2 → HCl + HClO хлорная вода
Br2 + h3O → HBr + HBrO бромная вода
I2 + h3O → HI + HIO
19. Химические свойства
Взаимодействие со сложными веществами:Б) «ряд активности» галогенов
F2 > Cl2 > Br2 > I2
1. 2KBr + Cl2 → Br2 + 2КCl
2. 2KI + Cl2 → I2 + 2КCl
3. 2KI
+ Br2 → I2 + 2КCl
В) с органическими веществами:
I2 + крахмал → синий
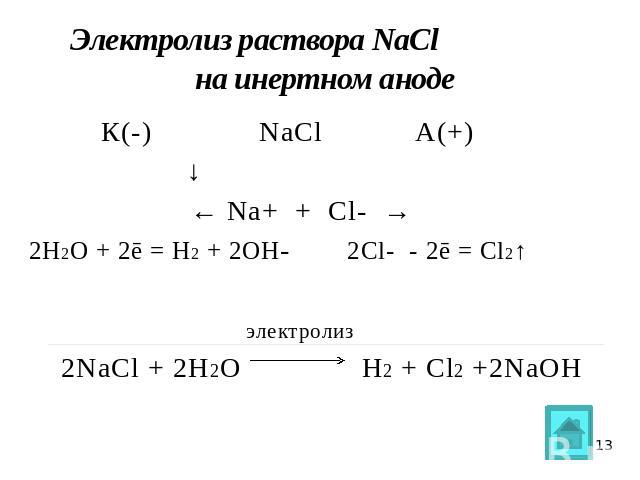
Получение хлора
F
Кости, зубы
Br
Регуляция
нервных
процессов
Сl
Кровь, желудочный
сок
I
Регуляция обмена
веществ
Тефлон
Применение
фтора
Заменитель
крови
Фториды
в зубных
пастах
Фреон
Окислитель
ракетного
топлива
Дезинфекция
воды
Органические
растворители
Отбеливатели
Лекарственные
препараты
Применение
хлора
Хлорирование
органических
веществ
Производство
HCl
Получение
неорганических
хлоридов
Получение
брома, йода
Лекарственные
препараты
Ветеренарные
препараты
Фотография
Применение
брома
Присадки
к бензину
Красители
Ингибиторы
Лекарственные
препараты
Дезинфекция
одежды
Применение
йода
Фотография
Электролампы
Красители
26.
 Химические свойства галогенов Вставьте коэффициенты:Na + Cl2 = NaCl
Химические свойства галогенов Вставьте коэффициенты:Na + Cl2 = NaClS + F2 = SF6
Fe + Br2= FeBr3
P+
Cl2 = PCl5
NaI + Cl2 = NaCl + I2
F2 + h3O = HF + O2
NaBr + Cl2 = NaCl + Br2
KOH + Cl2 = KCl + KClO3 + h3O
27. Подумайте…
Что образуется в даннойреакции, оксид фтора
или фторид кислорода?
F2 + O2
English Русский Правила
Хлор и его соединения. Свободный хлор Cl.
Основаны на процессе окисления анионов Cl—
2Cl—— 2e— = Cl20
Электролиз водных растворов хлоридов, чаще — NaCl:
2NaCl + 2Н2O = Cl2↑ + 2NaOH + H2↑
Окисление конц. HCI различными окислителями:
4HCI + MnO2 = Cl2↑ + МпCl2 + 2Н2O
16НСl + 2КМпО4 = 5Cl2↑ + 2MnCl2 + 2KCl + 8Н2O
6HCl + КСlO3 = ЗCl2↑ + KCl + 3Н2O
14HCl + К2Сr2O7 = 3Cl2↑ + 2CrCl3 + 2KCl + 7Н2O
Хлор — очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl—:
Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl—:
Cl20+ 2e— = 2Cl—
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Примеры:
Cl2+ 2Na = 2NaCl
3Cl2 + 2Fe = 2FeCl3
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Примеры:
Cl2 + Сu = CuCl2
3Cl2 + 2Аu = 2AuCl3
Хлор непосредственно не взаимодействует только с O2, N2, С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
Примеры:
Cl2 + Н2 =2НС1
Cl2 + 2S (расплав) = S2Cl2
ЗCl2 + 2Р = 2РCl3 (или РCl5 — в избытке Cl2)
2Cl2 + Si = SiCl4
3Cl2 + I2 = 2ICl3
Примеры:
Cl2 + 2KBr = Br2 + 2KCl
Cl2 + 2KI = I2 + 2KCl
Cl2 + 2HI = I2 + 2HCl
Cl2 + H2S = S + 2HCl
ЗСl2 + 2NH3 = N2 + 6HCl
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl—, а другие в положительной степени окисления входят в состав анионов ClO— или ClO3—.
Cl2 + Н2O = HCl + НClO хлорноватистая к-та
Cl2 + 2КОН =KCl + KClO + Н2O
3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2O
3Cl2 + 2Са(ОН)2 = CaCl2 + Са(ClO)2+ 2Н2O
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO3 и Са(ClO)2 — гипохлориты; КClO3 — хлорат калия (бертолетова соль).
а) замещение атомов водорода в молекулах ОВ
б) присоединение молекул Cl2 по месту разрыва кратных углерод-углеродных связей
H2C=CH2 + Cl2 → ClH2C-CH2Cl 1,2-дихлорэтан
HC≡CH + 2Cl2 → Cl2HC-CHCl2 1,1,2,2-тетрахлорэтан
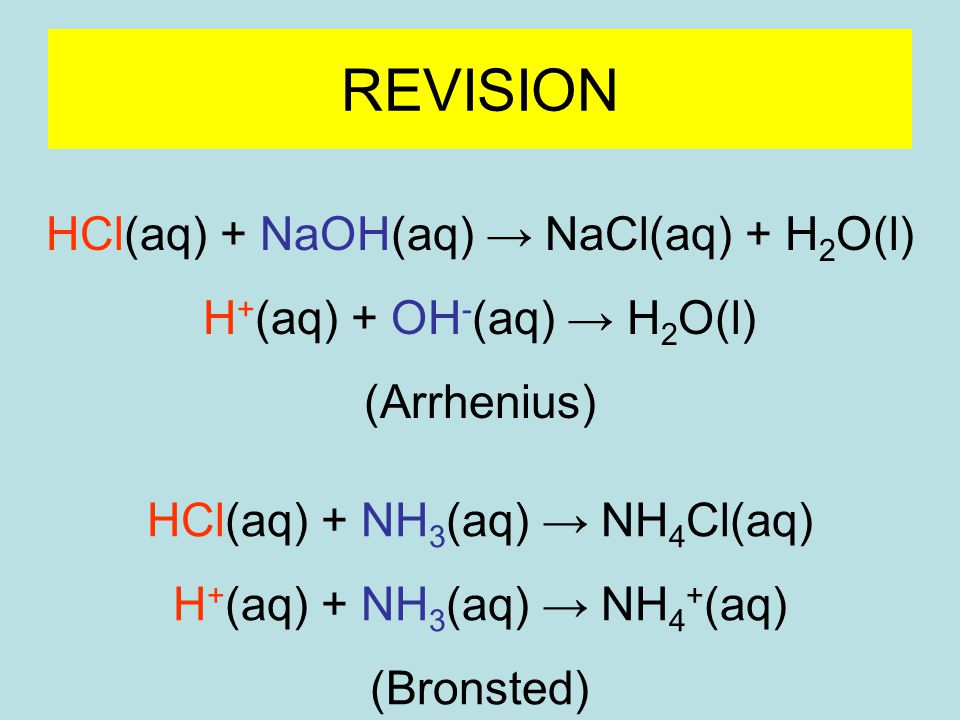
Хлороводород и соляная кислота
HCl — хлорид водорода. При об. Т — бесцв. газ с резким запахом, достаточно легко сжижается (т. пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
2HCl + F2 = Сl2 + 2HF
4HCl + O2 = 2Сl2 + 2Н2O
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
1. Синтез из простых веществ:
Н2 + Cl2 = 2HCl
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl2 = R-Cl + HCl
3. В лаборатории получают действием конц. H2SO4 на хлориды:
В лаборатории получают действием конц. H2SO4 на хлориды:
H2SО4(конц.) + NaCl = 2HCl↑ + NaHSО4 (при слабом нагревании)
H2SО4(конц.) + 2NaCl = 2HCl↑ + Na2SО4 (при очень сильном нагревании)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н2O растворяется ~ 450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н+
HCl → H+ + Cl—
Взаимодействие:
а) с металлами (до Н):
2HCl2 + Zn = ZnCl2 + H2
б) с основными и амфотерными оксидами:
2HCl + CuO = CuCl2 + Н2O
6HCl + Аl2O3 = 2АlCl3 + ЗН2O
в) с основаниями и амфотерными гидроксидами:
2HCl + Са(ОН)2 = CaCl2 + 2Н2О
3HCl + Аl(ОН)3 = АlСl3 + ЗН2O
г) с солями более слабых кислот:
2HCl + СаСО3 = CaCl2 + СO2 + Н3O
HCl + C6H5ONa = С6Н5ОН + NaCl
д) с аммиаком:
HCl + NH3 = NH4Cl
Реакции с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. Анион Cl—окисляется до свободного галогена:
Анион Cl—окисляется до свободного галогена:
2Cl—— 2e— = Cl20
Уравнения реакция см. «Получение хлора». Особое значение имеет ОВР между соляной и азотной кислотами:
Взаимодействие:
а) с аминами (как органическими основаниями)
R-NH2 + HCl → [RNH3]+Cl—
б) с аминокислотами (как амфотерными соедимнеиями)
Оксиды и оксокислоты хлора
Кислородсодержащие соединения хлора — чрезвычайно неустойчивые вещества, так как включают атомы Cl в нестабильных положительных с. о. Тем не менее некоторые из них имеют важное практическое значение.
гипохлориты | хлориты | хлораты | перхлораты |
NaClOKClOCa(ClO)2 | Ca(ClO2)2 | KClO3 бертолетова сольMg(ClO3)2 | KClO4NaClO4NH4ClO4 |
1. Все оксокислоты хлора и их соли являются сильными окислителями.
Все оксокислоты хлора и их соли являются сильными окислителями.
2. Почти все соединения при нагревании разлагаются за счет внутримолекулярного окисления-восстановления или диспропорционирования.
Примеры:
Хлорная известь
Хлорная (белильная) известь — смесь гипохлорита и хлорида кальция, обладает отбеливающим и дезинфицирующим действием. Иногда рассматривается как пример смешанной соли, имеющей в своем составе одновременно анионы двух кислот:
Жавелевая вода
Водный раствор хлорида и гапохлорита калия KCl + KClO + H2O
Химия
Уравновешенные уравнения и химические реакции
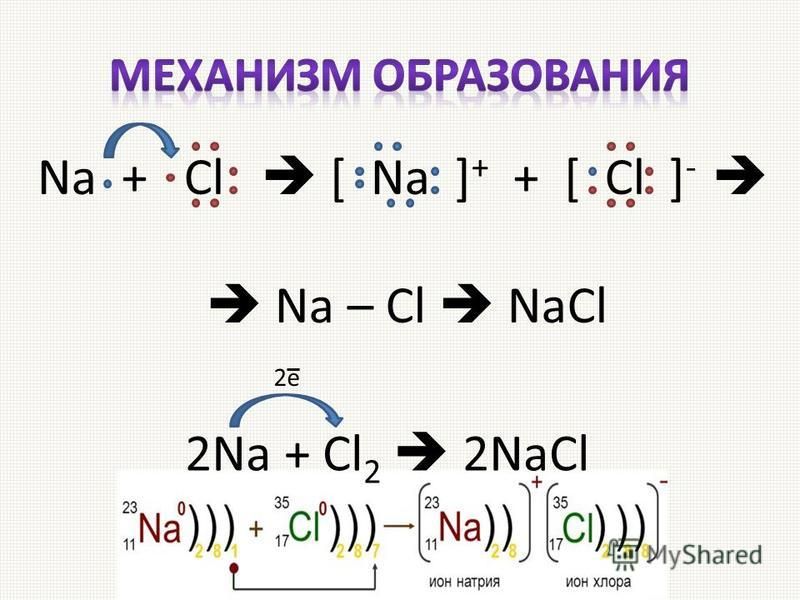
Существует четыре основных типа химических реакций. Первый является самым простым и известен как синтез или композиционная реакция. Этот тип реакции объединяет два или более веществ с образованием по крайней мере одного нового соединения. Один пример уже приводился, когда металлический натрий в твердом состоянии соединяется с газообразным хлором с образованием хлорида натрия.
Na (т) + Cl 2 (г) NaCl (т)
Реагенты находятся слева от стрелки, а продукт(ы) справа. Это может означать, что реагенты, натрий и хлор, будут реагировать с образованием одного продукта, хлорида натрия. В приведенном выше химическом уравнении (s) обозначает твердое вещество, а (g) обозначает газ, что указывает, в каком состоянии вещества находится вещество. Иногда стрелка читается как «урожайность». Глядя на это уравнение, возникает естественный вопрос: почему с одной стороны уравнения три атома, а с другой только два? Что случилось с лишним атомом хлора? Хороший вопрос. Это уравнение не является сбалансированным уравнением, и материя не просто исчезает и появляется. Более точно можно правильно представить эту реакцию следующим образом:
2Na (т) + Cl 2 (г) 2NaCl (т)
Это можно понять, сказав, что два атома натрия соединяются с одной двухатомной молекулой хлора, образуя две ионные единицы хлорида натрия.
Другим аспектом химических реакций являются физические свойства соединений или то, как атомы и молекулы соединяются друг с другом. Если мы посмотрим на кристаллическую структуру NaCl, то заметим, что это плотно упакованный куб.
Кристаллическая структура хлорида натрия имеет каждый атом с шестью его ближайшими соседями в октаэдрической геометрической структуре. Ионы Na окрашены в светло-голубой цвет, а ионы Cl — в темно-зеленый цвет для контраста.
Все реакции — это просто перераспределение материи более устойчивым образом. Новая материя никогда не создается, и никакая материя никогда не уничтожается. Это известно как закон сохранения материи ; материя не может быть ни создана, ни уничтожена, она просто меняет форму.
натрий + хлор → хлорид натрия
2 Na(т) + Cl 2 (г) 2 NaCl(т)
2 моля + 1 моль = 2 моля
2(23 а.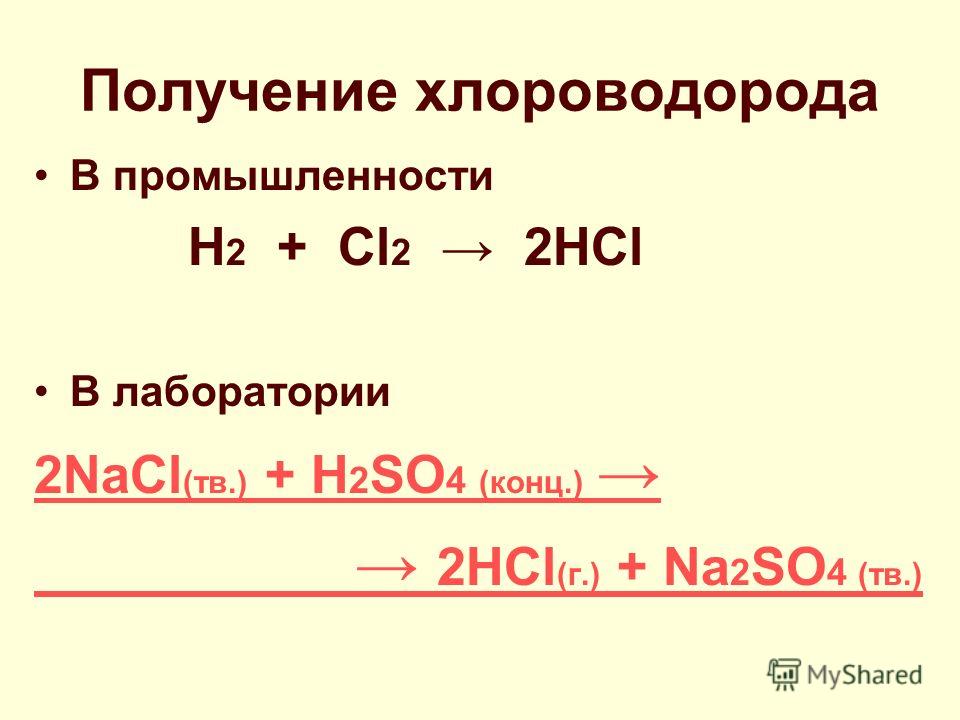 е.м.) + 2(35 а.е.м.) = 2(58 а.е.м.)
е.м.) + 2(35 а.е.м.) = 2(58 а.е.м.)
46 а.е.м. + 70 а.е.м. = 116 а.е.м.
116 а.е.м. = 116 а.е.м.
Используя атомные веса из таблицы Менделеева, вы можете увидеть, что два атома натрия весят 46 атомных единиц массы. Одна молекула хлора весит 70 атомных единиц массы. Две единицы кристалла хлорида натрия весят 116 атомных единиц массы. Суммарная масса реагентов должна равняться общей массе продукта.
Почему натрий образует NaCl?
Почему натрий образует NaCl?Почему?
Почему натрий образует NaCl?
Натрий реагирует с хлором с образованием ионов Na + и ионов Cl — в
несмотря на то, что первая энергия ионизации натрия больше энергии электрона
сродство хлора. Чтобы объяснить это, нам нужно разделить реакцию между натрием и
хлора на ряд гипотетических стадий, для которых мы знаем количество энергии,
выключен или поглощен.
Исходными материалами для этой реакции являются твердый металлический натрий и молекулы хлора. в газовой фазе, а продуктом реакции является твердый хлорид натрия.
2 Na( с ) + Cl 2 ( г ) 2 NaCl( с )Представим, что реакция протекает по следующей последовательности шагов.
- Моль натрия превращается из твердого состояния в газообразное. Как и следовало ожидать, это реакция эндотермическая.
| На( с ) Na( г ) | H или = 107,3 кДж |
- Затем от каждого атома натрия удаляется электрон с образованием моля Na + ионов.
Энергия, затраченная на эту реакцию, равна первой энергии ионизации натрия.

| Na( г ) Na + ( г ) | H или = 495,8 кДж |
- Моль атомов хлора образуется при разрыве связей в половине моля хлора молекулы. Как и предыдущие шаги, это эндотермическая реакция.
| 1 / 2 Класс 2 ( г ) Cl( г ) | H или = 121,7 кДж |
- Затем к каждому атому хлора присоединяется электрон, образуя ион Cl — . Это
первая экзотермическая стадия в этом процессе, а выделяемая энергия равна
сродство к электрону хлора.

| Cl( г ) + e — кл — ( г ) | H или = -348,8 кДж |
- Ионы Na + и Cl — в газовой фазе затем объединяются с образованием твердого NaCl. Это сильно экзотермическая реакция, для которой H o равна энергии решетки NaCl.
| Na + ( г ) + Cl — ( г ) NaCl( с ) | H или = -787,3 кДж |
Если мы рассмотрим только первые четыре стадии этой реакции, закон Гесса предполагает, что она
5.
| Na( s ) + 1 / 2 Cl 2 ( г ) Na + ( г ) + Cl — ( г ) | H или = 376,0 кДж/моль |
Когда мы включаем в расчет последний шаг, энергия решетки NaCl велика достаточно, чтобы компенсировать все этапы этой реакции, которые потребляют энергию, как показано на рисунке ниже.
| Na( s ) + 1 / 2 Cl 2 ( г ) NaCl( с ) | H или = -411,3 кДж/моль |
 между Na + и Cl — ионов, образующихся в результате реакции, а не
сродство атома хлора к электронам.
между Na + и Cl — ионов, образующихся в результате реакции, а не
сродство атома хлора к электронам. Почему реакция останавливается на NaCl? Почему он не продолжает образовывать NaCl 2 или NaCl 3 ? Энергия решетки будет увеличиваться по мере увеличения заряда атома натрия.
увеличивается от Na + до Na 2+ или Na 3+ . Но для образования Na 2+ ион, мы должны удалить второй электрон от атома натрия, и вторая ионизация
энергия натрия (4562,4 кДж/моль) почти в 10 раз больше энергии первой ионизации
энергия. Увеличение энергии решетки в результате образования Na 2+ ион не может начать компенсировать энергию, необходимую для проникновения в заполненную оболочку
конфигурация иона Na
Почему магний образует MgCl 2 ?
Если реакция между натрием и хлором останавливается при NaCl, то почему реакция
между магнием и хлором образуют MgCl 2 ? Чтобы ответить на этот вопрос,
давайте разобьем реакцию на следующие шаги.
- Моль магния превращается из твердого состояния в газообразное.
| Мг( с ) Мг( г ) | H или = 147,7 кДж |
- От каждого атома магния отнимается электрон с образованием моля Mg + ионов.
| Мг( г ) мг + ( г ) | H или = 737,7 кДж |
- Второй электрон затем удаляется с образованием моля Mg 2+ ионов.
| Мг + ( г ) мг 2+ ( г ) | H или = 1450,6 кДж |
- Два моля атомов хлора образуются при разрыве связей в моле хлора
молекулы.

| Класс 2 ( г ) 2 кл( г ) | H или = 243,4 кДж |
- Затем к каждому атому хлора присоединяется электрон с образованием Cl — ионов.
| 2 Cl( г ) + e — 2 Кл — ( г ) | H или = -697,4 кДж |
- Изолированный Mg 2+ и ионы Cl — в газовой фазе затем объединяются
с образованием твердого MgCl 2 .

| Мг 2+ ( г ) + 2 Cl — ( г ) MgCl 2 ( с ) | H или = -2526 кДж |
Энергия решетки для MgCl 2 достаточно велик, чтобы компенсировать энергию, которую он требуется, чтобы удалить второй электрон из атома магния, потому что нам не нужно ломать в конфигурацию с заполненной оболочкой с образованием ионов Mg 2+ .
| Мг( с ) + Cl 2 ( г ) MgCl 2 ( с ) | H или = -644 кДж/моль |
Реакция останавливается при MgCl 2 , однако, потому что это потребовало бы огромного
количество энергии, необходимое для разрыва конфигурации заполненной оболочки иона Mg 2+ удалить еще один электрон.
Почему существуют полуметаллы?
Металлы обладают некоторыми или всеми из следующих свойств.
- Имеют металлический блеск или блеск.
- Обычно они представляют собой твердые вещества при комнатной температуре.
- Они податливы и пластичны.
- Они проводят тепло и электричество.
- Они существуют в виде протяженных плоскостей атомов.
- Они соединяются с другими металлами, образуя сплавы, которые ведут себя как металлы.
- Образуют положительные ионы, такие как Na + , Mg 2+ , Fe 3+ ,
и Cu 2+ ионов.
Неметаллы обладают противоположными свойствами.
- Редко имеют металлический блеск.
- Они часто представляют собой газы при комнатной температуре.
- Они не податливы и не пластичны.

- Они плохо проводят тепло и электричество.
- Они часто образуют молекулы в своей элементарной форме.
- Они соединяются с другими неметаллами, образуя ковалентные соединения.
- Они имеют тенденцию образовывать отрицательные ионы, такие как F —, Cl —, P 3-, ионы SO 4 2- и PO 4 3-.
Различия в химических и физических свойствах металлов и неметаллов могут быть объясняются различиями в их электронных конфигурациях, энергиях ионизации, сродство к электрону и радиусы их атомов и ионов. Как правило, металлов имеют относительно небольшое количество электронов на их самой внешней оболочке орбиталей, более низкие энергии ионизации, меньшее сродство к электрону и большие атомы, чем у неметаллов .
Нет резких изменений в физических свойствах, обсуждаемых в этой главе, когда мы
пройти через строку периодической таблицы или вниз по столбцу. В результате переход от металла
до неметалла должно быть постепенным. Вместо произвольного деления элементов на металлы и
неметаллы, может быть, лучше описать некоторые элементы как более металлические, а другие
элементы как более неметаллические. Металлический характер уменьшается по мере прохождения ряда
периодической таблицы слева направо, при этом неметаллический характер увеличивается.
В результате переход от металла
до неметалла должно быть постепенным. Вместо произвольного деления элементов на металлы и
неметаллы, может быть, лучше описать некоторые элементы как более металлические, а другие
элементы как более неметаллические. Металлический характер уменьшается по мере прохождения ряда
периодической таблицы слева направо, при этом неметаллический характер увеличивается.
Металлический характер уменьшается
| Нет данных | Мг | Ал | Си | Р | С | Кл | Ар |
Неметаллический характер увеличивается
По тем же причинам элементы в верхней части столбца периодической таблицы являются
наиболее неметаллические, в то время как элементы в нижней части колонны являются наиболее металлическими.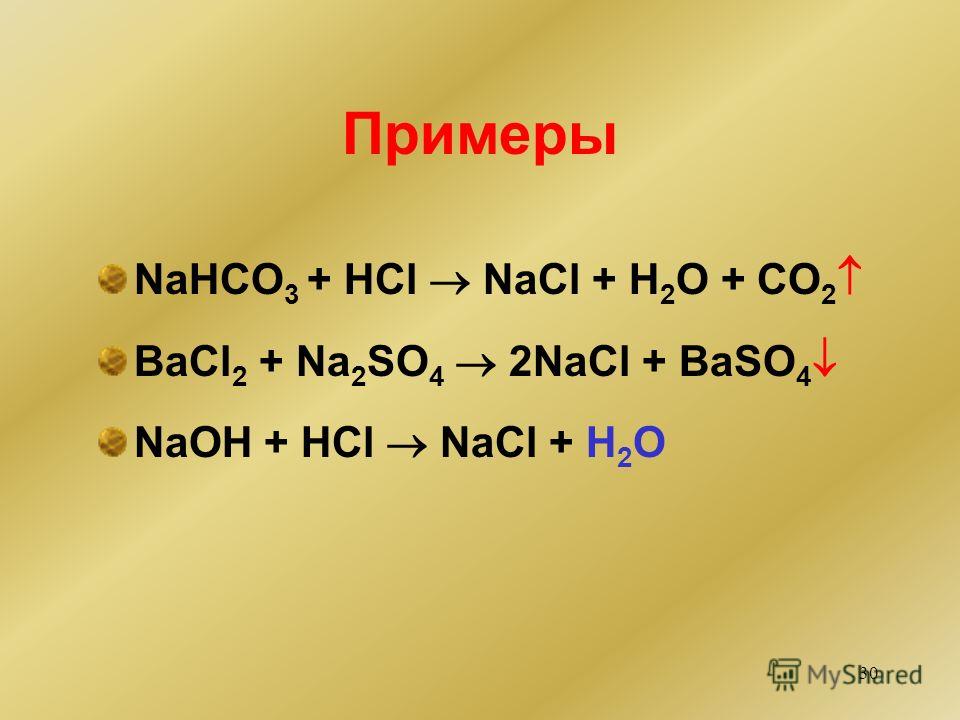 Этот
проявляется в группе IVA, где наблюдается постепенный переход от неметаллического элемента
(углерод) к хорошо известным металлам олову и свинцу.
Этот
проявляется в группе IVA, где наблюдается постепенный переход от неметаллического элемента
(углерод) к хорошо известным металлам олову и свинцу.
| металлик символ увеличение | С | неметаллический символ увеличение | ||
| Si | ||||
| Ге | ||||
| Сн | ||||
| Пб |
Если элементы становятся менее металлическими и более неметаллическими по мере того, как мы пересекаем ряд
периодической таблицы слева направо, мы должны встретить элементы вдоль каждой строки, которые имеют
свойства, лежащие между крайностями металлов и неметаллов. восемь элементов в
этого класса (B, Si, Ge, As, Sb, Te, Po, At) часто выглядят металлическими, но они хрупкие,
как неметаллы.