| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | ||
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | ||
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
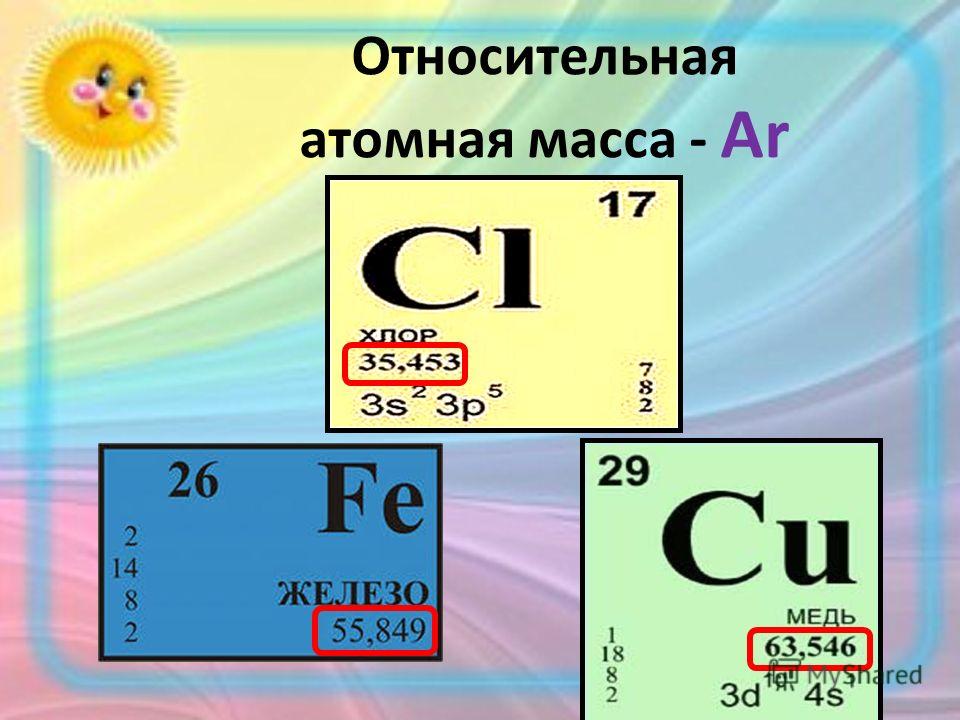
Масса и энергия связи ядра
Масса и энергия связи ядра Масса ядра измеряется в атомных единицах массы (а. 1а.е.м = 1.6606 10-27 кг. А.е.м. выражается через энергетические единицы: 1а.е.м = 1.510-3 эрг = 1.510-10Дж = 931.49 МэВ Масса ядра всегда меньше суммы масс составляющих его нуклонов. Избыток масс Δ связан с массой атома Mат(A,Z) и массовым числом A соотношением: Δ = Мат(A,Z) — А. Энергия связи ядра Eсв(A,Z) это минимальная энергия, необходимая, чтобы развалить ядро на отдельные, составляющие его нуклоны. Есв(A, Z) = [Z mp + (A — Z)mn — M(A, Z)]c2, где Z — число протонов, ( A — Z) — число нейтронов, mp — масса протона, mn — масса нейтрона, М(A,Z) — масса ядра с
массовым числом А и зарядом Z. Есв(A, Z) = [ZmH + (A — Z)mn — Mат(A, Z)]c2 , где mH — масса атома водорода.
Удельная энергия связи ядра ε(A, Z) это энергия связи, приходящаяся на один нуклон ε(A, Z) = Eсв(A,Z) / A. На рис. 1 показана зависимость удельной энергии связи ядра ε от числа нуклонов A. Видно, что наиболее сильно связаны ядра в районе железа и никеля (A ~ 55-60). Такой ход зависимости ε(A) показывает, что для легких ядер энергетически выгодны реакции синтеза более тяжелых ядер, а тяжелых − деление на более легкие осколки. Используется также понятие энергия связи (отделения) частицы в ядре Энергия отделения нейтрона Bn = [М(А-1,Z) + mn − М(А, Z)]c2 = W(А, Z) − W(А-1,Z). Энергия отделения протона Bp = [М(А-1,Z-1) + mp − М(А, Z)]c2 = W(А, Z) − W(А-1,Z-1). Энергия отделения α-частицы Bα = [M(A-4,Z-2) + mα − M(A,Z)]c2 = W(A,Z) − W(A-4,Z-2) − W(4,2).
Наиболее устойчивы ядра, у которых магическое число протонов или нейтронов.
ЗАДАЧИ Подробно
о массовых формулах см. Н.Н. Колесников.
Массы ядер и массовые формулы. 17.11.15 | |||||||||||||
Die Masse von Atomen und Molekülen
Мы отлично привыкли определять массу макроскопического объекта. Обычно мы используем весы для этого типа измерения. Строго говоря, весы измеряют вес объекта в результате воздействия земного притяжения.
Масса — физическая величина, не зависящая от местной гравитации. Мы все знаем примеры астронавтов на Луне, где они испытывают всего 1/6 своего веса на Земле. Однако их масса остается неизменной независимо от того, где они находятся.
Единицей массы является килограмм (кг).
Массы атомов и молекул чрезвычайно малы, намного превосходя наше воображение. Количество 12,0 г углерода соответствует количеству вещества, которое мы определяем как один моль (1 моль). Моль определяется как количество частиц, 6,022 ´ 10 23 частиц, если быть точным.
Количество 12,0 г углерода соответствует количеству вещества, которое мы определяем как один моль (1 моль). Моль определяется как количество частиц, 6,022 ´ 10 23 частиц, если быть точным.
Чтобы рассчитать массу одного атома углерода, нам просто нужно разделить молярную массу 12,0 г (0,012 кг) на количество частиц на моль (число Авогадро). Это дает 1,99´´10
Чтобы проиллюстрировать крошечный размер молекулы, можно сравнить пропорции молекулы аскорбиновой кислоты (витамин С, около 1 нм) с пропорциями грейпфрута (около 10 см), содержащего витамин С. Мы находим, что отношение примерно 1:100.000.000. Теперь пропорция этого грейпфрута к Земле также составляет около 1: 100 000 000.
Таким образом, взвешивание становится невозможным. Даже самые чувствительные лабораторные весы, способные взвешивать примерно до 1 мкг (микрограмма, одной миллионной доли г или 10 –6 г), далеки от измерения массы молекулы. Итак, уменьшимся на несколько порядков: 1 нг (нанограмм, одна миллиардная г или 10 –9 г), 1 пг (10 –12 г), 1 фг (фемтограмм, 10 –15 г). г), 1 аг (аттограмма, 10 –18 г). И даже аттограмма примерно в 1000 раз больше массы одной молекулы инсулина. Ясно, что взвешивание больше не вариант.
Так называемая единая атомная масса (символ единицы измерения u) служит для количественного определения атомной и молекулярной массы. Единая атомная масса определяется как 1 / 12 массы одного атома нуклида 12 С. (Нуклид 12 С представляет собой наиболее распространенный тип атомов углерода, около 99%, остальные 13 С, а в следах радиоактивных 14 С). По аналогии с приведенным выше расчетом получаем
По аналогии с приведенным выше расчетом получаем
1 u = 1,67 ´ 10 –27 кг.
Если мы знаем массовое число атома, его массу можно вычислить достаточно точно, умножив это массовое число на 1 ед. Может показаться до некоторой степени разочаровывающим тот факт, что этот простой расчет не дает точной массы, но это можно даже использовать в наших интересах для определения формулы, основанной на измерении точной массы.
Значит, один атом углерода 12 C имеет массу 12 ед или 1,99´10 –26 кг, одна молекула инсулина имеет 5734 ед или 9.53 ´ 10 –24 кг. Очевидно, что использование атомных единиц массы более удобно, чем использование килограммов. Тем не менее, они далеко за пределами нашего воображения, и для их точного измерения определенно требуется совершенно другой подход: масс-спектрометрия!
Заметка о гигантских и мизерных числах в науке. Природа включает в себя огромные порядки. Факторы миллиардов распространены в естественных науках. Атмосферное давление, например, составляет 1000 мбар, а высокий вакуум — 10 –6 мбар, одна миллиардная часть атмосферного давления. Благодаря формуле C 12 H 22 O 11 молекула сахара (сахароза) имеет массу 342,3 ед или 5,72 ´ 10 –25 кг; таким образом, крупинка сахара массой 0,05 мг соответствует 1,46 ´ 10 –5 моль или 88 триллионам молекул. Все, что находится за пределами нашей повседневной реальности, может показаться чем-то очень особенным или даже нереальным. Просто примите эти порядки как нечто естественное.
Атмосферное давление, например, составляет 1000 мбар, а высокий вакуум — 10 –6 мбар, одна миллиардная часть атмосферного давления. Благодаря формуле C 12 H 22 O 11 молекула сахара (сахароза) имеет массу 342,3 ед или 5,72 ´ 10 –25 кг; таким образом, крупинка сахара массой 0,05 мг соответствует 1,46 ´ 10 –5 моль или 88 триллионам молекул. Все, что находится за пределами нашей повседневной реальности, может показаться чем-то очень особенным или даже нереальным. Просто примите эти порядки как нечто естественное.
4.20: Расчет средней атомной массы
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 52945
 Гроутас; Источник: Flickr Boulders beach, Cape Peninsula(opens in new window) [www.flickr.com]; License: CC by 2.0(opens in new window) ))
Гроутас; Источник: Flickr Boulders beach, Cape Peninsula(opens in new window) [www.flickr.com]; License: CC by 2.0(opens in new window) ))Вы когда-нибудь пытались сдвинуть валун?
У вас есть куча камней, которые нужно переместить, и вам нужно решить, какое оборудование вы хотите арендовать, чтобы их переместить. Если камни довольно маленькие, вы можете взять лопату, чтобы поднять их. Более крупные камни можно перемещать вручную, но для больших валунов потребуется какой-то механический совок. Количество каждого вида камня также будет определять, сколько времени вам потребуется для выполнения работы. Знание относительного количества крупных, средних и мелких камней может быть очень полезным при принятии решения о подходе к работе.
Процент естественного содержания
Большинство элементов встречаются в природе в виде смеси двух или более изотопов. В приведенной ниже таблице показаны естественные изотопы нескольких элементов, а также 90 122% естественного содержания 90 123 каждого из них.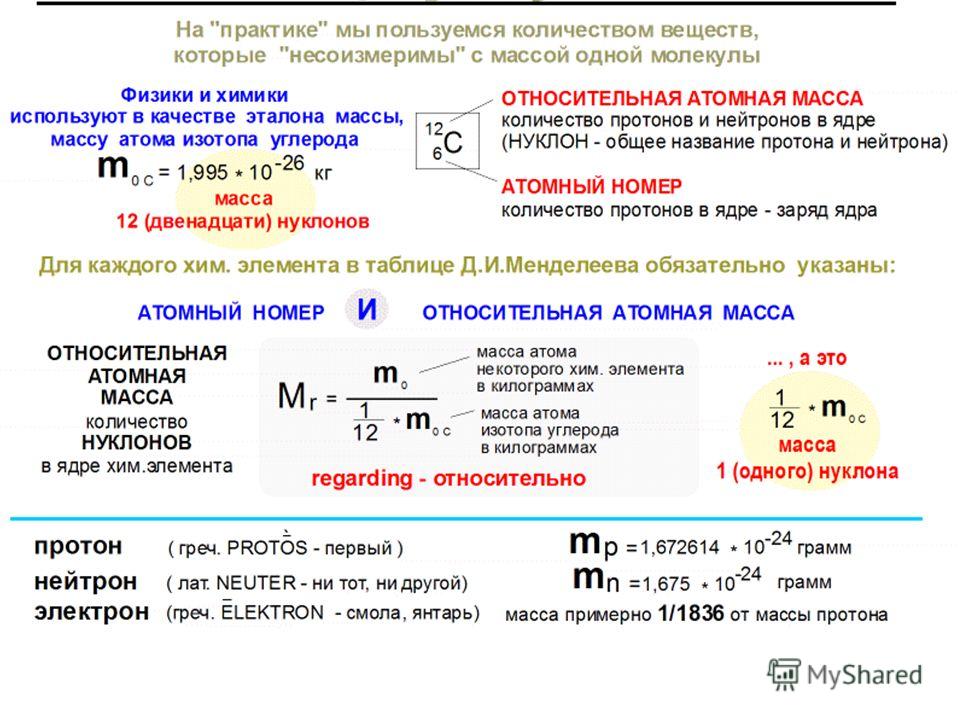
| Элемент | Изотоп (символ) | Процент естественного обилия | Атомная масса \(\left( \text{аму} \right)\) 9{65}Cu}\) | 30,83 | 64,928 |
|---|
Для некоторых элементов один конкретный изотоп значительно преобладает над другими изотопами. Встречающийся в природе водород почти полностью состоит из водорода-1, а встречающийся в природе кислород почти полностью состоит из кислорода-16. Однако для многих других элементов может существовать более одного изотопа в более значительных количествах. Хлор (атомный номер 17) — ядовитый газ желтовато-зеленого цвета. Около трех четвертей всех атомов хлора имеют 18 нейтронов, что дает этим атомам массовое число 35. Около четверти всех атомов хлора имеют 20 нейтронов, что дает этим атомам массовое число 37. Если бы вы просто вычислили среднее арифметическое точный атомных масс , вы получите 36.
Около четверти всех атомов хлора имеют 20 нейтронов, что дает этим атомам массовое число 37. Если бы вы просто вычислили среднее арифметическое точный атомных масс , вы получите 36.
\[\frac{\left( 34,969 + 36,966 \right)}{2} = 35,968 \: \text{amu}\nonumber \]
масса из последнего столбца таблицы значительно ниже. Почему? Нам нужно принять во внимание процент естественного содержания каждого изотопа, чтобы рассчитать средневзвешенное значение. Атомная масса элемента представляет собой средневзвешенное значение атомных масс встречающихся в природе изотопов этого элемента. Пример задачи ниже демонстрирует, как рассчитать атомную массу хлора.
Пример \(\PageIndex{1}\)
Используйте атомные массы каждого из двух изотопов хлора вместе с их соответствующим процентным содержанием для расчета средней атомной массы хлора.
Решение
Шаг 1: Перечислите известные и неизвестные величины и спланируйте задачу. Известные- Хлор-35: атомная масса \(= 34,969 \: \text{аму}\) и процент содержания \(= 75,77\%\)
- Хлор-37: атомная масса \(= 36,966 \: \text{аму}\) и процент содержания \(= 24,23\%\)
- Средняя атомная масса хлора
Измените каждый процент содержания в десятичной форме, разделив на 100. Умножьте это значение на атомную массу этого изотопа. Сложите для каждого изотопа, чтобы получить среднюю атомную массу.
Умножьте это значение на атомную массу этого изотопа. Сложите для каждого изотопа, чтобы получить среднюю атомную массу.
\[\begin{array}{ll} \text{хлор-35} & 0,7577 \times 34,969 = 26,50 \: \text{а.е.м.} \\ \text{хлор-37} & 0,2423 \умножить на 36,966 = 8,957 \: \text{аму} \\ \text{средняя атомная масса} & 26,50 + 8,957 = 35,46 \: \text{amu} \end{array}\nonumber \]
Примечание. Применение правил значащей цифры приводит к результату \(35,45 \: \text{amu}\) без чрезмерной ошибки округления. За один шаг:
\[\left( 0,7577 \times 34,969 \right) + \left(0,2423 \times 36,966 \right) = 35,46 \: \text{amu}\nonumber \]
Шаг 3: Подумайте о ваш результат.Вычисленная средняя атомная масса ближе к 35, чем к 37, потому что больший процент встречающихся в природе атомов хлора имеет массовое число 35. Это согласуется со значением из таблицы выше.
Резюме
- Атомная масса элемента представляет собой средневзвешенное значение атомных масс встречающихся в природе изотопов этого элемента.

- При расчете атомной массы используется процент содержания каждого изотопа.
Обзор
- Определение атомной массы.
- Какая информация необходима для расчета атомной массы элемента?
- Рассчитайте атомную массу углерода, используя данные, представленные в таблице ниже.
Изотоп | Атомная масса | Процент изобилия |
|---|---|---|
углерод-12 | 12.000000 | 98,90 |
углерод-13 | 13. |

 е.м). За одну атомную единицу массы
принимается 1/12 часть массы нейтрального атома углерода 12 С:
е.м). За одну атомную единицу массы
принимается 1/12 часть массы нейтрального атома углерода 12 С:
.jpg)