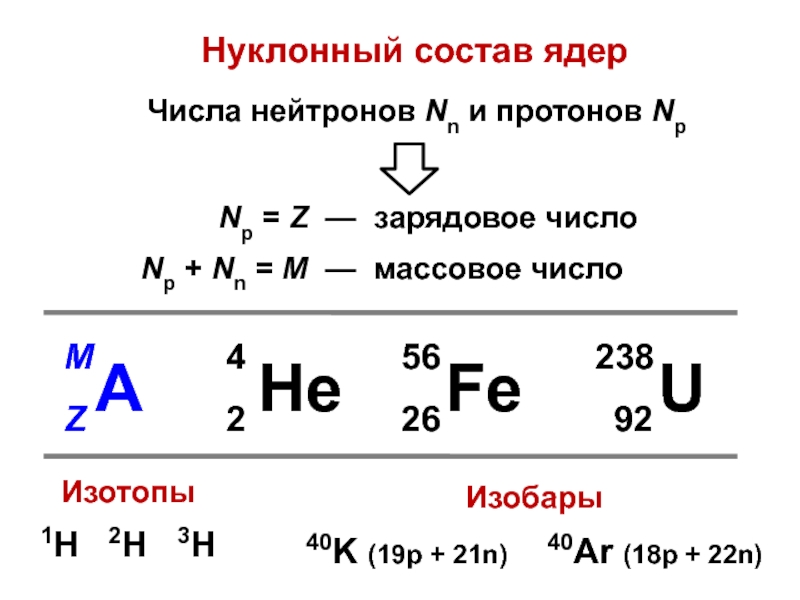
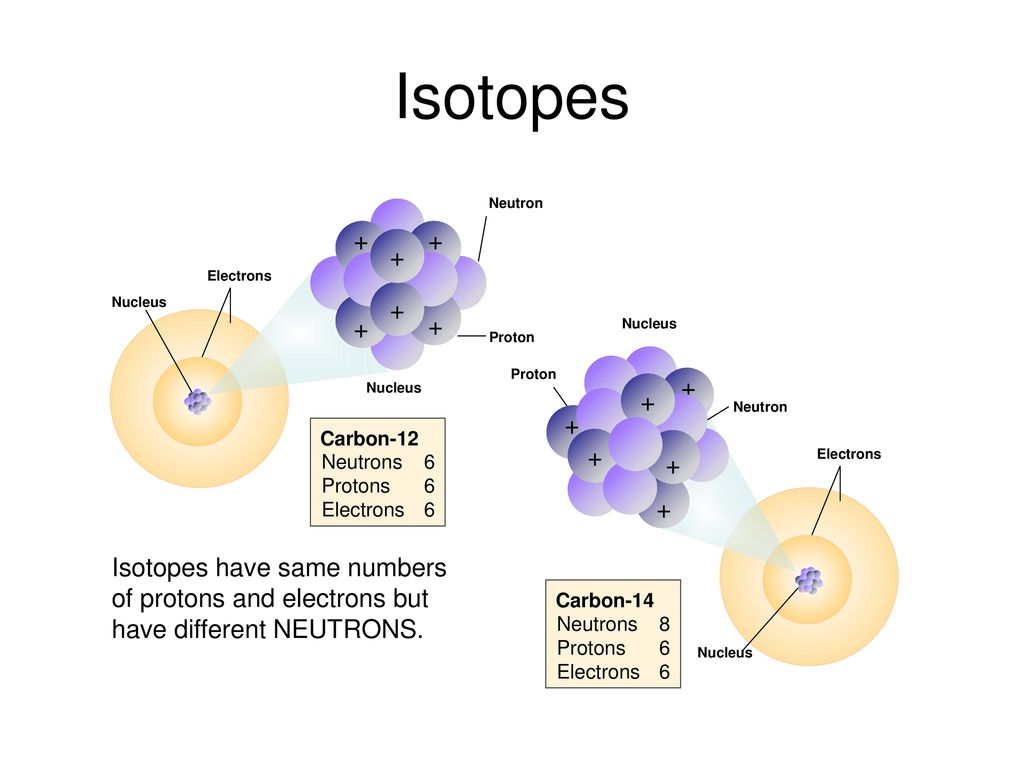
Как определить число нейтронов протонов и электронов в изотопе?
Для того чтобы это сделать вам нужно знать 3 вещи:
- Как определить число протонов и нейтронов в атоме?
- Как определить общее число электронов в атоме?
- Что такое изотоп.
Вкратце напомню.
Число протонов и электронов в атоме одинаково и равно порядковому номеру элемента в периодической таблице.
Число нейтронов вычисляется по формуле:
N = A — Z
Где N — число нейтронов, A — атомная масса элемента (в целых числах), Z — заряд ядра атома (число протонов) или порядковый номер атома в периодической таблице Менделеева.
Что такое изотоп?
Изотопы это разновидности атомов химического элемента, которые имеют одинаковый заряд ядра (порядковый номер в таблице), но разные массовые числа.
Проще говоря, у изотопов в ядре атома одинаковое число протонов, но разное число нейтронов.
Таким образом, число протонов и электронов у изотопов такое же, как и у обычных атомов, разница лишь в количестве нейтронов

Примеры
Сколько электронов, протонов и нейтронов содержит атом изотопа титана 50Ti?
Титан имеет порядковый номер 22. Значит в ядре содержится 22 протона, а в атоме 22 электрона.
Число нейтронов: N = 50 — 22 = 28 нейтронов.
Сколько электронов содержит нейтральный атом изотопа полония?
В данном случае нам даже не нужно знать массовое число изотопа, т.к. речь идет только об электронах. Порядковый номер полония 84, значит в ядре атома 84 протона, а в атоме 84 электрона.
Определите число протнов, нейтронов и электронов для изотопа 55Mn.
Порядковый номер марганца 25. Значит в ядре атома 25 протонов, а в атоме 25 электронов.
Найдем число нейтронов: N = 55 — 25 = 30 нейтронов.
Определите число протонов изотопа калия.
В этом случае массовое число изотопа не имеет значения, т.к. речь идет о протонах, число которых у изотопов одинаково. Калий имеет порядковый номер в таблице 19, значит у любого изотопа калия будет 19 протонов.
Калий имеет порядковый номер в таблице 19, значит у любого изотопа калия будет 19 протонов.
Похожие вопросы:
— Какие атомы имеют одинаковое число нейтронов?
— Как определить общее число электронов в атоме?
| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | O | |
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | NaOH | ||
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | K | |
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
Информаторий — ФЭО
Структура материи
В нашем мире все состоит из атомов. Они являются основными строительными блоками таких элементов, как водород, углерод, кислород, железо и свинец. Каждый атом содержит центральное крошечное положительно заряженное ядро и несколько электронов. Электроны обладают отрицательным электрическим зарядом и движутся вокруг ядра по облакам или как их называют — оболочкам, у которых слабо определенны границы. Ядро обычно в 10 000 раз меньше, чем электронные облака, а сами электроны еще меньше ядер. Это означает, что атом в основном пустой. Ядро атома содержит протоны, которые несут положительный заряд, равный отрицательному заряду электрона, и нейтроны, которые не несут никакого заряда. Каждый атом содержит одинаковое число протонов и электронов и, следовательно, электрически нейтрален. Атомы одного или разных элементов могут объединяться в более крупные, незаряженные структуры, называемые молекулы. Например, два атома кислорода образуют одну молекулу кислорода, а два атома водорода в сочетании с одним атомом кислорода образуют одну молекулу воды.
Они являются основными строительными блоками таких элементов, как водород, углерод, кислород, железо и свинец. Каждый атом содержит центральное крошечное положительно заряженное ядро и несколько электронов. Электроны обладают отрицательным электрическим зарядом и движутся вокруг ядра по облакам или как их называют — оболочкам, у которых слабо определенны границы. Ядро обычно в 10 000 раз меньше, чем электронные облака, а сами электроны еще меньше ядер. Это означает, что атом в основном пустой. Ядро атома содержит протоны, которые несут положительный заряд, равный отрицательному заряду электрона, и нейтроны, которые не несут никакого заряда. Каждый атом содержит одинаковое число протонов и электронов и, следовательно, электрически нейтрален. Атомы одного или разных элементов могут объединяться в более крупные, незаряженные структуры, называемые молекулы. Например, два атома кислорода образуют одну молекулу кислорода, а два атома водорода в сочетании с одним атомом кислорода образуют одну молекулу воды. Число протонов в ядре называется атомным номером и является уникальной характеристикой атома. Например, атомный номер углерода — 6, а свинца — 82. Протоны и нейтроны имеют одинаковую массу, и намного тяжелее, чем электроны. Большая часть массы в атоме сосредоточена в ядре. Общее количество протонов и нейтронов называется массовым числом. Как правило, для обозначения элемента используется его имя вместе с массовым числом. Так углеродом-12 является нуклид с шестью протонами и шестью нейтронами. Свинцом-208 является нуклид с 82 протонами и 126 нейтронами. Элементы, которые имеют одинаковое число протонов, но разное число нейтронов, называются изотопами этого элемента. Водород, например, имеет три изотопа: водород-1 (водорода с ядром состоящим только из одного протона), водород-2 — дейтерий (один протон и один нейтрон), и водород-3 -тритий (один протон и два нейтрона). Железо имеет десять изотопов: 26 протонов и от 26 до 35 нейтронов в ядре.
Число протонов в ядре называется атомным номером и является уникальной характеристикой атома. Например, атомный номер углерода — 6, а свинца — 82. Протоны и нейтроны имеют одинаковую массу, и намного тяжелее, чем электроны. Большая часть массы в атоме сосредоточена в ядре. Общее количество протонов и нейтронов называется массовым числом. Как правило, для обозначения элемента используется его имя вместе с массовым числом. Так углеродом-12 является нуклид с шестью протонами и шестью нейтронами. Свинцом-208 является нуклид с 82 протонами и 126 нейтронами. Элементы, которые имеют одинаковое число протонов, но разное число нейтронов, называются изотопами этого элемента. Водород, например, имеет три изотопа: водород-1 (водорода с ядром состоящим только из одного протона), водород-2 — дейтерий (один протон и один нейтрон), и водород-3 -тритий (один протон и два нейтрона). Железо имеет десять изотопов: 26 протонов и от 26 до 35 нейтронов в ядре.
Строение атома
Атом — это наименьшая частица химического элемента, сохраняющая все его химические свойства. 2) и т.д.
2) и т.д.
Каждый энергетический уровень делится на подуровни. На первом уровне только один подуровень — s. На втором уровне два подуровня — s и p. на третьем — s, p и d. На четвертом — s, p, d и f.
Максимальное число электронов на подуровнях
- 2 — максимальное число электронов на s-подуровне.
- 6 — максимальное число электронов на p-подуровне.
- 10 — максимальное число электронов на d-подуровне.
- 14 — максимальное число электронов на f-подуровне.
Максимальное число электронов на подуровне не зависит от номера уровня.
Заполнение энергетических уровней
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s
Геометрия орбиталей
Примеры
Полезные ссылки
Источник материала
Электронная оболочка атома (видео)
Строение атома (Часть 1) (видео)
Строение атома (Часть 2) (видео)
Строение атома. Ядерные силы (видео)
Ядерные силы (видео)
Дополнительные материалы
Модели строения атома (видео)
Строение атома: Атомное ядро (видео)
Химия. Строение атома: Строение электронных оболочек (видео)
Строение атома (видео)
Как определить протон, нейтрон, электрон
Атом – это мельчайшая частица, которую разделить на составные части химическим путем невозможно. Атом состоит из положительно заряженного ядра за счетпротонов (р) с зарядом + и нейтральных частицнейтронов (n). Вокруг него вращаются электроны (ē), имеющие отрицательный заряд.Вам понадобитсяБлагодаря умениюправильно вычислять количество ,или электронов,можно определить валентность химического элемента, а также составить электронную формулу. Для этого потребуется толькопериодическая система химических элементов Д.И. Менделеева, которая является обязательным справочным материалом.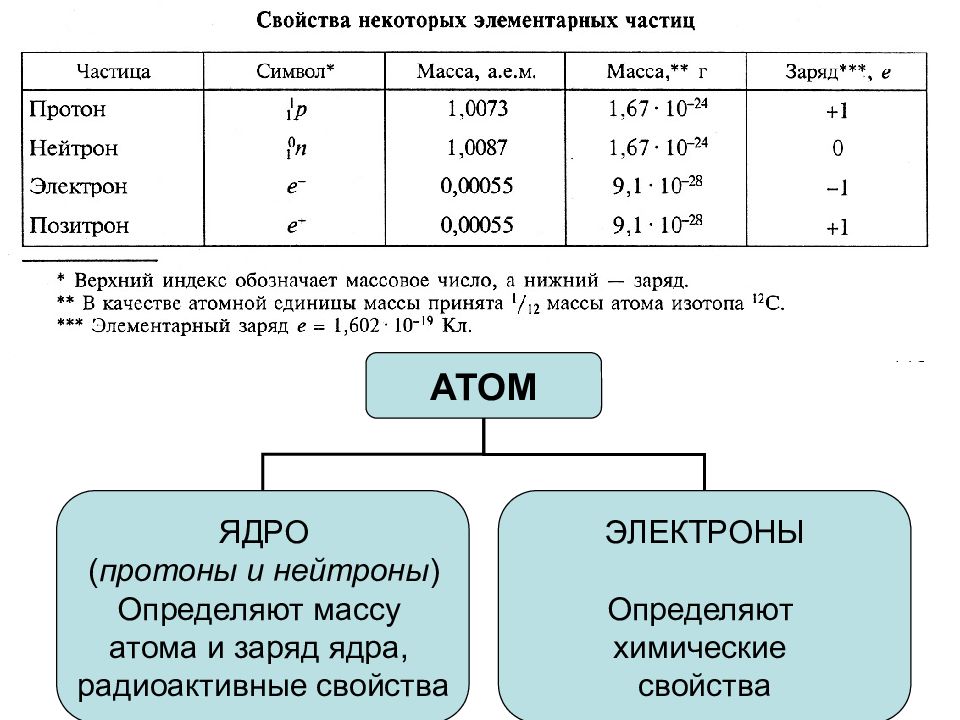
Таблица Д.И. Менделеева разделена на группы (располагаются вертикально), которых всего восемь, а также на периоды, расположенные горизонтально. Каждый химический элемент имеет свой порядковый номер и относительную атомную массу, что указано в каждой клетке периодической таблицы.Количество протонов (р) и электронов (ē) численно совпадает с порядковым номером элемента. Для определения числа нейтронов (n) необходимо из относительной атомной массы (Ar) вычесть номер химического элемента.
Пример № 1. Вычислите количество протонов, электронов и нейтронов атома химического элемента № 7.Химический элемент№ 7 – это азот (N). Сначала определите количество протонов (р).Если порядковый номер 7, значит, будет 7 протонов. Учитывая, чтоэто числосовпадает с количеством отрицательно заряженных частиц, электронов (ē) тоже будет 7. Для определения числа нейтронов (n) из относительной атомной массы (Ar (N) = 14) вычтите порядковый номер азота (№ 7). Следовательно, 14 – 7 = 7. В общем виде вся информация выглядит таким образом:р = +7;ē = -7;n = 14-7 = 7.
Пример № 2. Вычислите количество протонов, электронов и нейтронов атома химического элемента № 20.Химический элемент№ 20 – это кальций (Са). Сначала определите количество протонов (р).Если порядковый номер 20, следовательно, будет 20 протонов. Зная, чтоэто числосовпадает с количеством отрицательно заряженных частиц, значит электронов (ē) тоже будет 20. Для определения числа нейтронов (n) из относительной атомной массы (Ar (Са) = 40) вычтите порядковый номер кальция (№ 20). Следовательно, 40 – 20 = 20. В общем виде вся информация выглядит таким образом:р = +20;ē = -20;n = 40-20 = 20.
Пример № 3. Вычислите количество протонов, электронов и нейтронов атома химического элемента № 33.Химический элемент№ 33 – это мышьяк (As). Сначала определите количество протонов (р).Если порядковый номер 33, значит, будет 33 протона. Учитывая, чтоэто числосовпадает с количеством отрицательно заряженных частиц, электронов (ē) тоже будет 33. Для определения числа нейтронов (n) из относительной атомной массы (Ar (As) = 75) вычтите порядковый номер азота (№ 33). Следовательно, 75 – 33 = 42. В общем виде вся информация выглядит таким образом:р = +33;ē = -33;n = 75 -33 = 42.
Следовательно, 75 – 33 = 42. В общем виде вся информация выглядит таким образом:р = +33;ē = -33;n = 75 -33 = 42.
Ядерные реакции (задачи)
Ядерные реакции
1. Перечислить несколько ядерных реакций, в которых может образоваться изотоп 8Be.
2. Какую минимальную кинетическую энергию в лабораторной системе Tmin должен иметь нейтрон, чтобы стала возможной реакция 16O(n,α)13C?
3. Является ли реакция 6Li(d,α)4He эндотермической или экзотермической? Даны удельные энергии связи ядер в МэВ: ε(d) = 1.11; ε() = 7.08; ε(6Li) = 5.33.
4. Определить пороги Tпор реакций фоторасщепления 12С.
- γ + 12С → 11С + n
- γ + 12С → 11В + р
- γ +
5. Определить пороги реакций: 7Li(p,α)4He и 7Li(p,γ)8Be.
Определить пороги реакций: 7Li(p,α)4He и 7Li(p,γ)8Be.
6. Определить, какую минимальную энергию должен иметь протон, чтобы
стала возможной реакция
p + d → p +
p + n. Даны избытки масс. Δ(1H)
= 7.289
МэВ, Δ(2H) = 13.136 МэВ,
Δ(n)
= 8.071 МэВ.
7. Возможны ли реакции:
- α + 7Li → 10B + n;
- α + 12C → 14N + d
под действием α-частиц с кинетической энергией T = 10 МэВ?
8. Идентифицировать частицу X и рассчитать энергии реакции Q в следующих случаях:
| 1. 35Сl + X→ 32S + α; | 4. 23Na + p→ 20Ne + X; |
| 2. 10B + X→ 7Li + α; | 5. 23Na + d→ 24Mg + X; |
3. 7Li + X →7Be
+ n; 7Li + X →7Be
+ n; | 6. 23Na + d→ 24Na + X. |
9. Какую минимальную энергию Tmin должен иметь дейтрон, чтобы в результате неупругого рассеяния на ядре 10B возбудить состояние с энергией Eвозб = 1.75 МэВ?
10. Вычислить порог реакции: 14N + α→17О + p, в двух случаях,
если налетающей частицей является:
1) α-частица,
2) ядро 14N. Энергия реакции Q = 1.18 МэВ. Объяснить
результат.
11. Рассчитать энергии и пороги следующих реакций:
| 1. d( p,γ)3He; | 5. 32S(γ,p )31P; |
| 2. d( d,3He )n; | 6. 32 (γ,n )31S; |
| 3. 7Li( p,n )7Be; | 7. 32S(γ,α)28Si; 32S(γ,α)28Si; |
| 4. 3He(α,γ)7Be; | 8. 4He(α,p)7Li; |
12. Какие ядра могут образовываться в результате реакций под действием: 1) протонов с энергией 10 МэВ на мишени из 7Li; 2) ядер 7Li с энергией 10 МэВ на водородной мишени?
13. Ядро 7LI захватывает медленный нейтрон и испускает γ-квант. Чему равна энергия γ-кванта?
14. Определить в лабораторной системе кинетическую энергию ядра 9Ве, образующегося при пороговом значении энергии нейтрона в реакции 12C(n,α)9Be.
15. При облучении мишени из натурального бора наблюдалось появление радиоактивных изотопов с периодами полураспада 20.4 мин и 0.024 с. Какие образовались изотопы? Какие реакции привели к образованию этих изотопов?
16. Мишень из натурального бора бомбардируется протонами. После
окончания облучения детектор -частиц зарегистрировал активность 100
Бк. Через 40 мин активность образца снизилась до ~25 Бк. Каков источник
активности? Какая ядерная реакция происходит?
Мишень из натурального бора бомбардируется протонами. После
окончания облучения детектор -частиц зарегистрировал активность 100
Бк. Через 40 мин активность образца снизилась до ~25 Бк. Каков источник
активности? Какая ядерная реакция происходит?
17. α-Частица с кинетической энергией T = 10 МэВ испытывает упругое лобовое столкновение с ядром 12С. Определить кинетическую энергию в л.с. ядра 12C TC после столкновения.
18. Определить максимальную и минимальную энергии ядер 7Ве,
образующихся в реакции
7Li(p,n)7Be
(Q = -1,65 МэВ) под действием ускоренных протонов с энергией Tp = 5
МэВ.
19. -Частицы, вылетающие под углом
θнеупр = 300 в результате реакции неупругого рассеяния с возбуждением
состояния ядра 12C с энергией Eвозб = 4.44 МэВ, имеют
такую же энергию в л. с., что и упруго рассеянные на том же ядре α-частицы под
углом θупр = 450. Определить энергию α-частиц, падающих на мишень .
с., что и упруго рассеянные на том же ядре α-частицы под
углом θупр = 450. Определить энергию α-частиц, падающих на мишень .
20. α-Частицы с энергией T = 5 МэВ взаимодействуют с неподвижным ядром 7Li. Определить величины импульсов в с.ц.и., образующихся в результате реакции 7Li(α,n)10B нейтрона pα и ядра 10B pBe.
21. С помощью реакции 32S(α,p)35Cl исследуются низколежащие возбужденные состояния 35Cl (1.219; 1.763; 2.646; 2.694; 3.003; 3.163 МэВ). Какие из этих состояний будут возбуждаться на пучке α-частиц с энергией 5.0 МэВ? Определить энергии протонов, наблюдаемых в этой реакции под углами 00 и 900 при Е =5.0 МэВ.
22. Используя импульсную диаграмму получить связь между углами в л.с. и с.ц.и.
23. Протон с кинетической энергией Тa= 5 МэВ налетает на
ядро 1Н и упруго рассеивается на нем. Определить энергию TB и угол рассеяния θB ядра отдачи 1Н, если угол рассеяния протона θb = 300.
Протон с кинетической энергией Тa= 5 МэВ налетает на
ядро 1Н и упруго рассеивается на нем. Определить энергию TB и угол рассеяния θB ядра отдачи 1Н, если угол рассеяния протона θb = 300.
24. Для получения нейтронов широко используется реакция t(d,n)α. Определить энергию нейтронов Tn, вылетающих под углом 900 в нейтронном генераторе, использующем дейтроны, ускоренные до энергии Тd = 0.2 МэВ.
25. Для получения нейтронов используется реакция 7Li(p,n)7Be.
Энергия протонов Tp = 5 МэВ. Для эксперимента необходимы нейтроны с энергией Tn = 1.75
МэВ. Под каким углом θn относительно направления протонного пучка будут вылетать нейтроны с такой
энергией? Какой будет разброс энергий нейтронов ΔT, если их выделять с помощью
коллиматора размером 1 см, расположенного на расстоянии 10 см от мишени.
26. Определить орбитальный момент трития lt, образующегося в реакции 27Al(,t)28Si, если орбитальный момент налетающей α-частицы lα = 0.
27. При каких относительных орбитальных моментах количества движения протона возможна ядерная реакция p + 7Li → 8Be*→ α + α?
28. С какими орбитальными моментами lp могут вылетать протоны в реакции 12C(,p)11B, если: 1) конечное ядро образуется в основном состоянии, а поглотился Е2- фотон; 2) конечное ядро образуется в состоянии 1/2+, а поглотился М1- фотон; 3) конечное ядро образуется в основном состоянии, а поглотился Е1- фотон?
29. В результате поглощения ядром -кванта
вылетает нейтрон с орбитальным моментом ln = 2. Определить
мультипольность -кванта, если конечное ядро образуется в
основном состоянии.
30. Ядро 12C поглощает γ-квант, в результате чего вылетает протон с орбитальным моментом l = 1. Определить мультипольность поглощенного γ-кванта, если конечное ядро образуется в основном состоянии?
31. Определить орбитальный момент дейтрона ld в реакции подхвата 15N(n,d)14C, если орбитальный момент нейтрона ln = 0.
33. Ядро 40Cа поглощает Е1 γ-квант. Какие одночастичные переходы возможны?
34. Ядро 12C поглощает Е1 γ-квант. Какие одночастичные переходы возможны ?
35. Можно ли в реакции неупругого рассеяния дейтронов на ядре 10В возбудить состояние с характеристиками JP = 2+ , I = 1?
36. Вычислить сечение рассеяния -частицы
с энергией 3 МэВ в кулоновском поле ядра 238U в интервале углов от
1500 до 1700.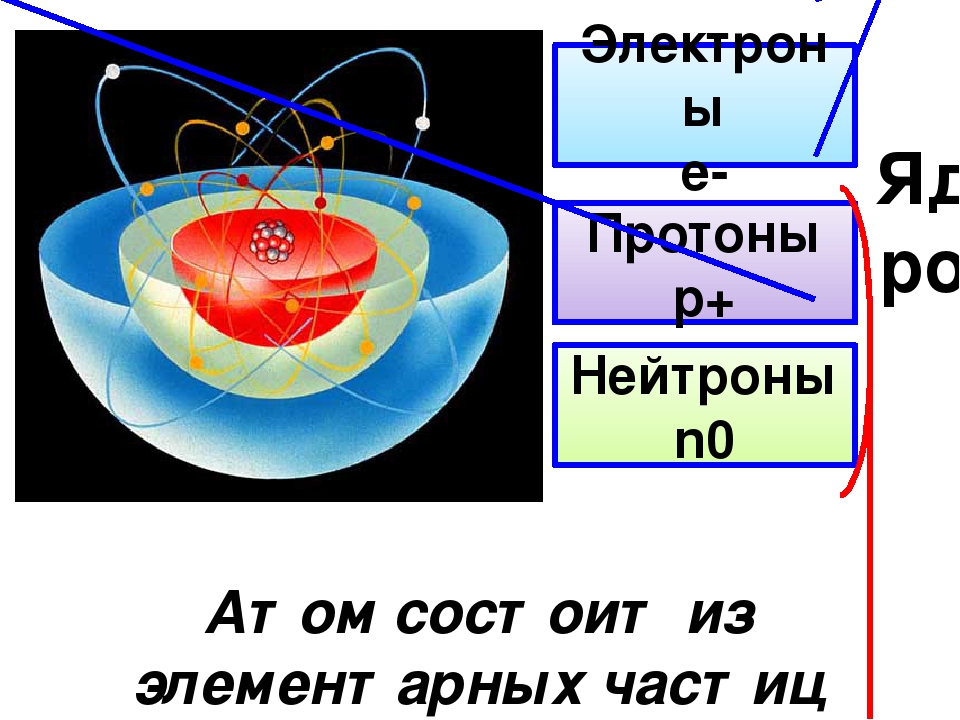
37. Золотая пластинка толщиной d = 0.1 мм облучается пучком α-частиц с интенсивностью N0 = 103 частиц/c. Кинетическая энергия -частиц T = 5 МэВ. Сколько α-частиц на единицу телесного угла падает в секунду на детектор, расположенный под углом = 1700? Плотность золота ρ = 19.3 г/см3.
38. Коллимированный пучок α-частиц с энергией T = 10 МэВ падает перпендикулярно на медную фольгу толщиной δ = 1 мг/см2. Частицы, рассеянные под углом = 30, регистрируются детектором площадью S = 1см2, расположенным на расстоянии l = 20 см от мишени. Какая доля от полного числа рассеянных α-частиц будет зарегистрирована детектором?
39. При исследовании реакции 27Al(p,d)26Al
под действием протонов с энергией Tp = 62 МэВ в спектре дейтронов,
измеренном под углом θd = 90 с помощью
детектора с телесным углом
dΩ
= 2·10-4 ср, наблюдались пики с энергиями Td = 45,3;
44,32; 40. 91 МэВ. При суммарном заряде протонов q = 2.19 мКл, упавших на мишень
толщиной δ = 5 мг/см2,
количество отсчетов в этих пиках N составило 5180, 1100 и 4570 соответственно.
Определить энергии уровней ядра 26Al, возбуждение которых наблюдалось
в этой реакции. Рассчитать дифференциальные сечения dσ/dΩ этих процессов.
91 МэВ. При суммарном заряде протонов q = 2.19 мКл, упавших на мишень
толщиной δ = 5 мг/см2,
количество отсчетов в этих пиках N составило 5180, 1100 и 4570 соответственно.
Определить энергии уровней ядра 26Al, возбуждение которых наблюдалось
в этой реакции. Рассчитать дифференциальные сечения dσ/dΩ этих процессов.
40. Интегральное сечение реакции 32S(γ,p)31P с образованием конечного ядра 31P в основном состоянии при энергии падающих γ-квантов, равной 18 МэВ, составляет 4 мб. Оценить величину интегрального сечения обратной реакции 31P(p,γ)32S, отвечающей той же энергии возбуждения ядра 32S, что и в реакции 32S(γ,p)31P. Учесть, что это возбуждение снимается за счет γ-перехода в основное состояние.
41. Рассчитать интенсивность пучка
нейтронов J, которым облучали пластинку 55Mn толщиной d = 0. 1 см в
течении tакт = 15 мин, если спустя tохл = 150 мин после
окончания облучения ее активность I составила 2100 Бк. Период полураспада 56Mn 2.58 ч, сечение активации σ =
0.48 б, плотность вещества пластины ρ
= 7.42 г/см3.
1 см в
течении tакт = 15 мин, если спустя tохл = 150 мин после
окончания облучения ее активность I составила 2100 Бк. Период полураспада 56Mn 2.58 ч, сечение активации σ =
0.48 б, плотность вещества пластины ρ
= 7.42 г/см3.
42. Дифференциальное сечение реакции dσ/dΩ под углом 900 составляет 10 мб/ср. Рассчитать величину интегрального сечения, если угловая зависимость дифференциального сечения имеет вид 1+2sinθ.
43. Рассеяние медленных (Tn1 кэВ) нейтронов на ядре изотропно. Как можно объяснить этот факт?
44. Определить энергию возбуждения составного ядра, образующегося при захвате α-частицы с энергией T = 7 МэВ неподвижным ядром 10В.
45. В сечении реакции 27Аl (α,р) 30Si наблюдаются максимумы при энергиях α-частиц T 3. 95; 4.84 и 6.57 МэВ.
Определить энергии возбуждения составного ядра, соответствующие максимумам в
сечении.
95; 4.84 и 6.57 МэВ.
Определить энергии возбуждения составного ядра, соответствующие максимумам в
сечении.
46. С каким орбитальным моментом могут рассеиваться протоны с Тр = 2 МэВ на ядре 112Sn?
47. Оценить сечение образования составного ядра при взаимодействии нейтронов с кинетической энергией Tn = 1 эВ с ядрами золота 197Au.
48. Оценить сечение образования составного ядра при взаимодействии нейтронов с кинетической энергией Tn = 30 МэВ с ядрами золота 197Au.
49. Сравнить полные сечения реакции для α-частиц с энергией 20 Мэв на ядрах 56Fe и 197Au.
50. Оценить сечение реакции 63Cu(p,n)63Zn,
если известны сечения реакций, идущих с образованием того же составного ядра с
той же энергией возбуждения:
60Ni(α,p)63Zn — 0.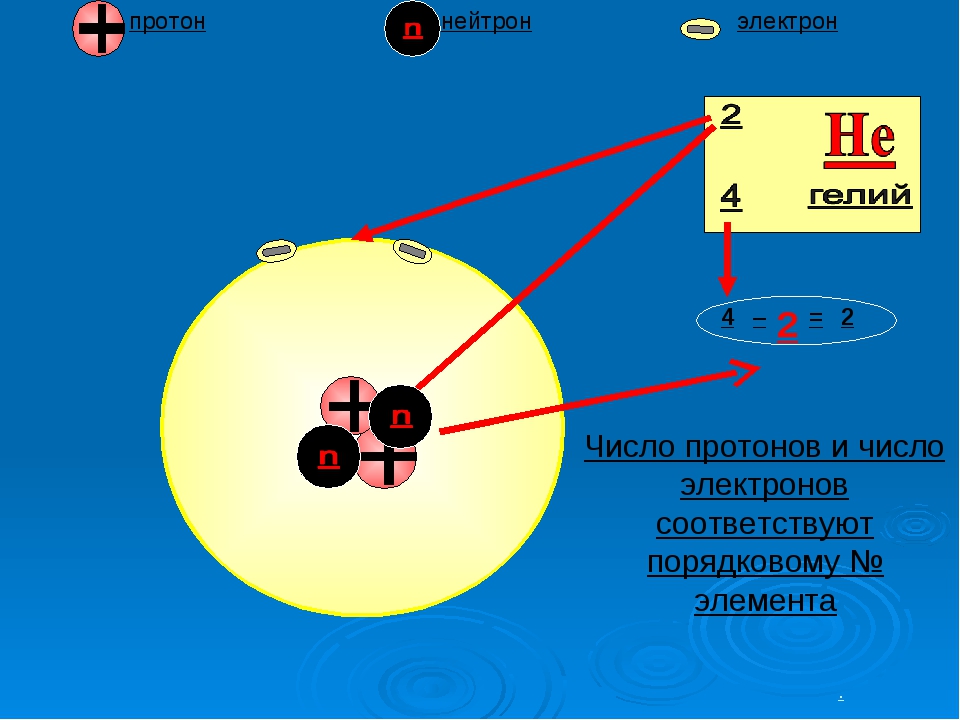 7 б; 63Cu(p,pn)62Cu
— 0.87 б; 60Ni(α,pn)62Cu — 0.97 б.
7 б; 63Cu(p,pn)62Cu
— 0.87 б; 60Ni(α,pn)62Cu — 0.97 б.
51. Оценить нейтронную ширину Гn изолированного уровня 0+ ядра 108Rh (энергия уровня E0 = 1.21 эВ, полная ширина Г = 0.21 эВ), если при резонансном поглощении нейтронов с образованием этого уровня составного ядра сечение поглощения для энергии нейтронов Tn = 1 эВ σ = 2700 б. Спин ядра-мишени I(107Rh) = 1/2.
52. Получить, исходя из модели оболочек, отношение сечений реакций подхвата 16O(p,d)15O, с образованием конечного ядра 15Oв основном состоянии (JP =1/2—) и в состоянии (JP =3/2—).
53. Для реакции срыва 35Cl(d,p)36Cl
найти возможные значения орбитального момента ln захваченного ядром нейтрона. Указать, исходя из простейшей оболочечной модели,
какое из значений ln реализуется, если ядро 36Cl
образуется в основном состоянии.
Указать, исходя из простейшей оболочечной модели,
какое из значений ln реализуется, если ядро 36Cl
образуется в основном состоянии.
54. Оценить спин и четность состояния ядра 24Mg с энергией 1.37 МэВ, если при возбуждении этого состоянии в реакции неупругого рассеяния α-частиц с энергией T = 40 Мэв, первый максимум в угловом распределении α-частиц наблюдается под углом 100.
55. Найти угол , под которым должен быть максимум углового распределения протонов в реакции (d,p) на ядре 58Ni, вызванной дейтронами с энергией T=15 МэВ, с образованием ядра 59Ni в основном состоянии.
56. Показать, что в реакции неупругого рассеяния дейтронов на ядре 10B, идущей за счёт сильного взаимодействия, невозможно возбуждение уровней этого ядра с изоспином I = 1.
| Спектр нижних уровней ядра |
57. Какие состояния из приведенного на рисунке
спектра ядра могут возбуждаться в реакциях неупругого рассеяния (α,α’), (d,d’) и
(p,p’)?
Какие состояния из приведенного на рисунке
спектра ядра могут возбуждаться в реакциях неупругого рассеяния (α,α’), (d,d’) и
(p,p’)?
58. Оценить отношение сечений двух каналов реакции фоторасщепления ядра 16O:
γ + 16O → 15Ngs + p,
(а)
γ + 16O → 15N*(JP = 3/2−) + p.
(б)
59. При изучении дифракционного рассеяния протонов с кинетической энергией Т = 20 ГэВ на ядрах свинца первый дифракционный минимум наблюдается при θmin = 0.3о. Оценить радиус ядра свинца.
60. Оценить радиус ядра меди, если известно, что при прохождении
высокоэнергетичных нейтронов через пластинку меди толщиной 2 см поток
нейтронов уменьшился в 1. 1 раза. Размером нейтрона
пренебречь. ρ(Cu) = 9 г/см3.
1 раза. Размером нейтрона
пренебречь. ρ(Cu) = 9 г/см3.
Физики получили самый тяжелый изотоп кальция
O. B. Tarasov et al./ Physical Review Letters, 2018
Физики впервые синтезировали самый тяжелый на сегодняшний день изотоп кальция 60Ca, ядро которого содержит 20 протонов и 40 нейтронов. Также впервые были получены самые тяжелые изотопы для других элементов: фосфора, серы, хлора, аргона, калия и скандия. Полученные результаты подтвердили теоретические модели, которые существуют для границы стабильности атомных ядер. Это означает, что, вероятнее всего, для кальция возможно образование и более тяжелых ядер, вплоть до 70Ca, пишут ученые в Physical Review Letters.
Полученные результаты подтвердили теоретические модели, которые существуют для границы стабильности атомных ядер. Это означает, что, вероятнее всего, для кальция возможно образование и более тяжелых ядер, вплоть до 70Ca, пишут ученые в Physical Review Letters.
Максимальное количество нейтронов в ядре каждого элемента, при котором это ядро будет жить хоть какое-то время, определяется силами, связывающими нуклоны между собой. Для описания устойчивых конфигураций атомных ядер существует несколько теоретических моделей, ни одна из которых на сегодняшний день не может однозначно определить границу нуклонной устойчивости. Самые устойчивые нуклонные конфигурации часто описываются с использованием магических чисел, которые соответствуют полностью заполненным оболочкам нейтронов или протонов.
Например, ядро кальция интересно тем, что число протонов в нем всегда магическое — 20, а при определенных числах нейтронов ядро кальция становится «дважды магическим». Для этого в ядре должно быть 20, 28, 32 или 34 нейтрона. Так, в природе чаще всего встречается изотоп кальция, который имеет массовое число 40 — с 20 протонами и 20 нейтронами, самый тяжелый из устойчивых изотопов кальция содержит 28 нейтронов. У радиоактивных изотопов кальция с коротким периодом полураспада, число нейтронов в ядре может быть и больше: например, существование устойчивых ядер предполагалось для ядер с 40 и 50 нейтронами, однако получить их экспериментально не удавалось.
Так, в природе чаще всего встречается изотоп кальция, который имеет массовое число 40 — с 20 протонами и 20 нейтронами, самый тяжелый из устойчивых изотопов кальция содержит 28 нейтронов. У радиоактивных изотопов кальция с коротким периодом полураспада, число нейтронов в ядре может быть и больше: например, существование устойчивых ядер предполагалось для ядер с 40 и 50 нейтронами, однако получить их экспериментально не удавалось.
Каждое открытие самых легких и самых тяжелых изотопов для отдельных элементов позволяет сместить границу нуклонной стабильности и подтвердить или опровергнуть существующие теоретические модели. Группа физиков из России, США, и Японии под руководством Олега Тарасова (O. B. Tarasov) из Университета штата Мичиган предложили новый метод синтеза тяжелых изотопов с большим количеством нейтронов. Для этого ученые облучали вращающуюся мишень из бериллия 9Be пучком ядер цинка 70Zn с энергией 345 электронвольт. Образующиеся при этом частицы фиксировались с помощью спектрометра для идентификации частиц.
Общая диаграмма зарегистрированных в ходе эксперимента ядер: по вертикальной оси приведен номер элемента, по горизонтальной — отношение массового числа к заряду ядра. Красной линией обозначена граница самых тяжелых изотопов до этого исследования
O. B. Tarasov et al./ Physical Review Letters, 2018
В результате ученым зарегистрировали восемь новых изотопов, которые не удавалось получить ранее. Все эти изотопы (фосфор 47P, сера 49S, хлор 52Cl, аргон 54Ar, калий 57K, кальций 59,60Ca и скандий 62Sc) оказались самыми тяжелыми из известных на сегодняшний день для своих элементов. Также было зарегистрировано одно ядро 59K, однако эти данные пока нельзя считать статистически значимыми. Самым важным из синтезированных ядер ученые называют именно изотоп кальция 60Ca, устойчивость которого косвенно подтверждает «магичность» числа нейтронов 40. Время жизни такого изотопа составляет несколько тысячных секунды.
Самым важным из синтезированных ядер ученые называют именно изотоп кальция 60Ca, устойчивость которого косвенно подтверждает «магичность» числа нейтронов 40. Время жизни такого изотопа составляет несколько тысячных секунды.По словам авторов работы, полученные результаты позволили подтвердить некоторые из теоретических моделей, которые предполагают, что для кальция возможно образование и более тяжелых ядер, вплоть до 70Ca.
Стоит отметить, что интерес вызывают не только изотопы с большим количеством нейтронов, но нейтрон-дефицитные ядра. Так, в 2015 году физикам удалось синтезировать сразу несколько изотопов, которые, наоборот, были самыми легкими из известных для урана, нептуния, берклия и америция. Эти ядерные структуры, которые находятся на границе нуклонной стабильности могут помочь в развитии теоретических моделей ядра атома.
Александр Дубов
Определение нейтрона по Merriam-Webster
нейтрон | \ Nü-ˌträn , ˈNyü- \ : незаряженная элементарная частица, имеющая массу, почти равную массе протона, и присутствует во всех известных атомных ядрах, кроме ядра водорода.
нейтронов: определение и концепция | Изучение.
 com
comЧисла
Нейтрон на 0,2% больше протона. Вместе нейтрон и протон составляют 99,99% всей массы атома. Нейтрон на самом деле имеет ту же массу, что и электрон и протон вместе взятые. Атомная масса атома находится путем сложения количества протонов и нейтронов. Поскольку атомный номер относится к количеству протонов в атоме, мы можем использовать как атомную массу, так и атомный номер, чтобы вычислить количество нейтронов.Используя приведенное ниже простое уравнение, мы можем найти количество нейтронов в атоме.
Атомная масса — атомный номер = количество нейтронов
Например, углерод имеет атомную массу 12 и атомный номер 6. Итак, если мы поместим эти числа в наше уравнение, оно будет выглядеть так…
12 ( Атомная масса) — 6 (атомный номер) = 6 нейтронов.
Изотопы и радиоактивность
Атомы одного и того же элемента могут иметь разное количество нейтронов, поэтому, когда ученые говорят об атомной массе, они имеют в виду среднюю атомную массу. Например, углерод обычно имеет 6 нейтронов и 6 протонов с атомной массой 12, но иногда встречается с атомной массой 13 (6 протонов и 7 нейтронов). Углерод с атомным номером 14 также существует, но встречается редко. Итак, атомная масса углерода в среднем равна 12,011.
Например, углерод обычно имеет 6 нейтронов и 6 протонов с атомной массой 12, но иногда встречается с атомной массой 13 (6 протонов и 7 нейтронов). Углерод с атомным номером 14 также существует, но встречается редко. Итак, атомная масса углерода в среднем равна 12,011.
Когда атомы имеют количество нейтронов, отличное от их нормального ожидаемого количества, они называются изотопами . Таким образом, приведенный выше пример с углеродом сделает C-12 нормальным, а изотопы C-13 и C-14 углерода.
Ученые нашли способы добавления нейтронов к ядру, чтобы получить изотопы большего размера. Теперь добавление нейтронов не влияет на заряд атома, поскольку нейтрон не имеет заряда. Однако это увеличивает радиоактивность атома. Это может сделать атомы очень нестабильными, которые могут выделять большие уровни энергии.
Когда атом теряет нейтрон, этот процесс называется радиоактивным распадом . C-14 — изотоп, который часто возвращается в более комфортное состояние C-12. Поскольку известно, сколько времени занимает этот процесс, археологи могут использовать информацию о количестве нейтронов в углероде, чтобы выяснить, сколько лет тому или иному предмету, даже если оно было похоронено в течение длительного времени. Этот процесс называется углеродным датированием .
Поскольку известно, сколько времени занимает этот процесс, археологи могут использовать информацию о количестве нейтронов в углероде, чтобы выяснить, сколько лет тому или иному предмету, даже если оно было похоронено в течение длительного времени. Этот процесс называется углеродным датированием .
У нейтронов есть еще пара интересных хитростей.Например, нейтроны могут существовать вне ядра атома. Не забывайте, что когда нейтрон уходит от атома, этот процесс называется радиоактивным распадом. Нейтроны обладают многими другими научными качествами и по-прежнему являются важной частью различных научно-исследовательских проектов. И последний лакомый кусочек: когда вы смотрите во Вселенную, нейтроны составляют половину всей видимой материи.
Резюме урока
Нейтроны — самые большие из субатомных частиц. Они могут не иметь никакого заряда, но они все равно имеют большой вес.Нейтроны, удерживаемые сильным ядерным взаимодействием с протонами, составляют плотное ядро атома. Атомная масса определяется как среднее количество протонов и нейтронов, которые находятся в ядре атома. Когда количество нейтронов в атоме отличается от среднего числа, их называют изотопами. Изотопы углерода помогают археологам определить возраст некоторых из их находок. Ученые используют нейтроны и во многих других областях исследований.
Они могут не иметь никакого заряда, но они все равно имеют большой вес.Нейтроны, удерживаемые сильным ядерным взаимодействием с протонами, составляют плотное ядро атома. Атомная масса определяется как среднее количество протонов и нейтронов, которые находятся в ядре атома. Когда количество нейтронов в атоме отличается от среднего числа, их называют изотопами. Изотопы углерода помогают археологам определить возраст некоторых из их находок. Ученые используют нейтроны и во многих других областях исследований.
Памятные термины
| Словарь терминов | Пояснения |
|---|---|
| Нейтроны | самая большая из субатомных частиц |
| Барион | массивная частица |
| Кварки | строит все дело |
| Сильная ядерная сила | нейтрона и протона удерживаются вместе в ядре |
| Протон | субатомная частица с положительным зарядом |
| Атомный номер | относится к числу протонов атома |
| Изотопы | неожиданное количество нейтронов |
| Радиоактивность | высокая энергия, которая может быть выброшена атомами |
| Радиоактивный распад | возникает, когда атом теряет нейтрон |
| Углеродное датирование | датируется чем-то похороненным эоны назад |
Результаты обучения
После того, как вы накопите свои знания о нейтронах, вы захотите:
- Присвоить значения нейтронам, барионам и кваркам
- Обратите внимание на характеристики нейтронов
- Используйте уравнение, чтобы найти количество нейтронов в атоме
- Объясните процесс углеродного датирования с использованием радиоактивного распада
нейтронов
От См. Также электрон.
Также электрон.
Нейтрон — это субатомная частица, находящаяся в ядре каждого атома, кроме атома простого водорода. Частица получила свое название из-за того, что у нее нет электрического заряда; это нейтрально. Нейтроны очень плотные. Если бы один нейтрон был изолирован, он имел бы массу всего 1,675? 10 -27 килограмм, но если бы можно было зачерпнуть чайную ложку плотно упакованных нейтронов, полученный кусок материи весил бы миллионы тонн на поверхности Земли.
Число протонов в ядре элемента называется атомным номером .Этот номер придает каждому элементу уникальную индивидуальность. В атомах любого конкретного элемента, например углерода, количество протонов в ядрах всегда одинаково, но количество нейтронов может варьироваться. Атом данного элемента, имеющий определенное количество нейтронов в ядре, называется изотопом . Изотоп атома обозначается написанием названия элемента, за которым следует сумма количества протонов и нейтронов.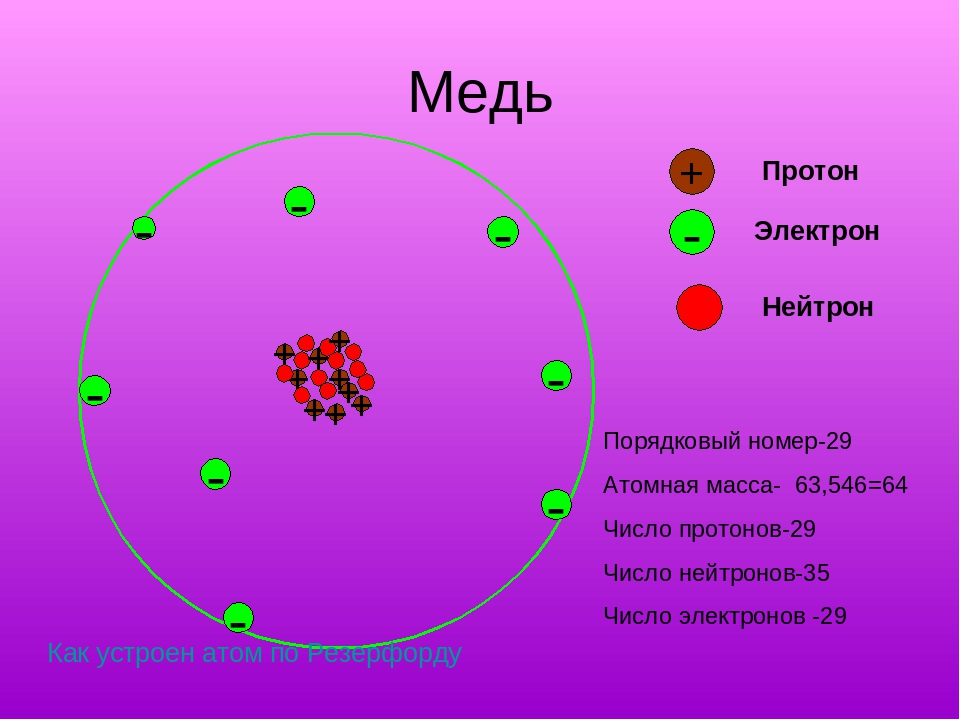 В ядре атома углерода всегда шесть протонов и обычно шесть нейтронов, но некоторые ядра углерода содержат восемь нейтронов.Таким образом, углерод-12 является наиболее распространенным изотопом углерода; углерод-14 также встречается, но встречается реже.
В ядре атома углерода всегда шесть протонов и обычно шесть нейтронов, но некоторые ядра углерода содержат восемь нейтронов.Таким образом, углерод-12 является наиболее распространенным изотопом углерода; углерод-14 также встречается, но встречается реже.
Нейтроны не должны ограничиваться ядрами атомов. Они могут существовать сами по себе. Когда нейтроны находятся вне ядер атомов, они приобретают удивительные, причудливые и потенциально опасные свойства. Когда они движутся с большой скоростью, они производят смертельную радиацию. Так называемая нейтронная бомба , известная своей способностью убивать людей и животных при минимальном воздействии на неодушевленные физические конструкции, работает, создавая поток высокоскоростных нейтронов.Высокая плотность этих частиц в сочетании с их скоростью придает им огромную энергию. В результате они обладают способностью изменять или даже разрушать ядра атомов, на которые они наносят удар.
Когда большая звезда взрывается, сдувая свои внешние слои в виде блестящего огненного шара, называемого сверхновой , оставшееся вещество невероятно плотное и коллапсирует под действием собственной гравитации.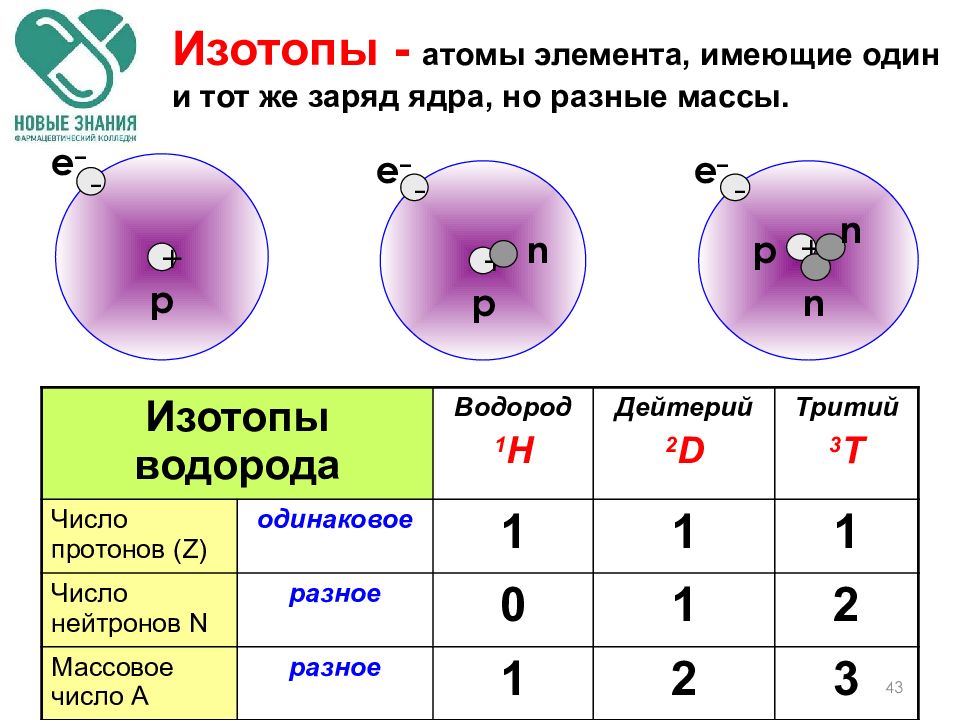 Когда этот звездный остаток приобретает определенную критическую плотность, практически все субатомные частицы становятся нейтронами.В результате получился объект , нейтронная звезда , диаметр которой может быть меньше диаметра Земли, но масса в сотни раз больше массы Солнца. Нейтронные звезды могут вращаться с высокой скоростью, создавая всплески электромагнитного излучения, которые можно услышать как периодические импульсы в радиотелескопах. Эти небесные объекты известны как пульсар . Если нейтронная звезда достаточно плотная, она коллапсирует в черную дыру , гравитация которой настолько сильна, что ничто не может ускользнуть, даже фотон.
Когда этот звездный остаток приобретает определенную критическую плотность, практически все субатомные частицы становятся нейтронами.В результате получился объект , нейтронная звезда , диаметр которой может быть меньше диаметра Земли, но масса в сотни раз больше массы Солнца. Нейтронные звезды могут вращаться с высокой скоростью, создавая всплески электромагнитного излучения, которые можно услышать как периодические импульсы в радиотелескопах. Эти небесные объекты известны как пульсар . Если нейтронная звезда достаточно плотная, она коллапсирует в черную дыру , гравитация которой настолько сильна, что ничто не может ускользнуть, даже фотон.
Последний раз обновлялся в мае 2008 г.
4.11: Нейтроны — Химия LibreTexts
Стрелка на фотографии ниже указывает на звезду, которая не так уж много по сравнению с некоторыми другими звездами на картинке. Это определенно намного меньше, чем у большинства других звезд. Фактически, это всего около 20 километров в диаметре. Сравните это с диаметром нашего Солнца 1,4 миллиона километров. Однако, несмотря на свой небольшой размер, эта звезда имеет большую массу, чем Солнце, что делает ее невероятно плотной.{11} \) раз больше силы тяжести, которую мы ощущаем на Земле !. Что это за звезда? Это называется нейтронная звезда. Это потому, что он состоит исключительно из нейтронов.
Сравните это с диаметром нашего Солнца 1,4 миллиона километров. Однако, несмотря на свой небольшой размер, эта звезда имеет большую массу, чем Солнце, что делает ее невероятно плотной.{11} \) раз больше силы тяжести, которую мы ощущаем на Земле !. Что это за звезда? Это называется нейтронная звезда. Это потому, что он состоит исключительно из нейтронов.
Что такое нейтрон?
Нейтрон — одна из трех основных частиц, составляющих атом. Две другие частицы — это протон и электрон. Атомы всех элементов, за исключением большинства атомов водорода, имеют нейтроны в своем ядре. Ядро — это небольшая плотная область в центре атома, где также находятся протоны.{-15} \) метров.
Одинаковый элемент, разное количество нейтронов
Все атомы данного элемента имеют одинаковое количество протонов и электронов. Однако количество нейтронов может быть разным для атомов одного и того же элемента. Например, почти 99 процентов атомов углерода имеют шесть нейтронов, а остальные имеют семь или восемь нейтронов.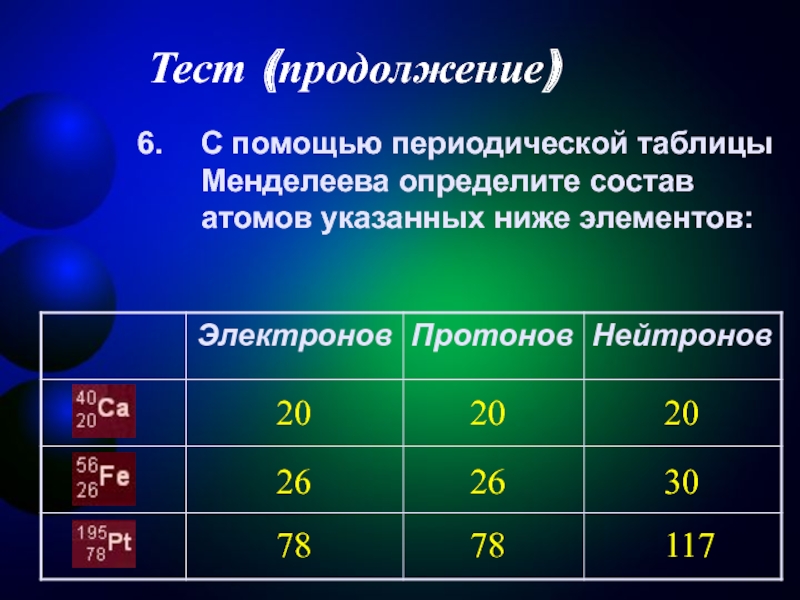 Атомы элемента, различающиеся числом нейтронов, называются изотопами. Ядра этих изотопов углерода показаны на рисунке ниже.Изотоп под названием углерод-14 используется для определения возраста окаменелостей.
Атомы элемента, различающиеся числом нейтронов, называются изотопами. Ядра этих изотопов углерода показаны на рисунке ниже.Изотоп под названием углерод-14 используется для определения возраста окаменелостей.
Частицы в нейтронах
Нейтроны состоят из элементарных частиц, известных как кварки и глюоны. Каждый нейтрон содержит три кварка. Два кварка называются нижними кварками, а третий кварк — верхним кварком. Глюоны — это элементарные частицы, которые испускаются или поглощаются кварками. Они несут в себе сильное ядерное взаимодействие, которое удерживает кварки в нейтроне.
Сводка
Нейтрон — одна из трех основных частиц, составляющих атом.Он находится в ядре и имеет нейтральный электрический заряд. Его масса и диаметр примерно такие же, как у протона. Нейтроны присутствуют во всех атомах, кроме большинства атомов водорода. Все атомы данного элемента имеют одинаковое количество протонов и электронов, но они могут различаться по количеству нейтронов. Атомы одного и того же элемента, различающиеся числом нейтронов, называются изотопами. Нейтроны состоят из элементарных частиц, известных как кварки и глюоны. Глюоны несут в себе сильную ядерную силу, которая связывает кварки в нейтроне.
Атомы одного и того же элемента, различающиеся числом нейтронов, называются изотопами. Нейтроны состоят из элементарных частиц, известных как кварки и глюоны. Глюоны несут в себе сильную ядерную силу, которая связывает кварки в нейтроне.
Узнать больше
Прочтите статью о нейтронах по следующему URL-адресу, а затем заполните приведенные ниже утверждения.
1. ________ создаются, когда вы меняете нормальное количество нейтронов в атоме.
2. Если к атому добавить много нейтронов, он станет __________.
3. Лишние нейтроны могут выбиваться из ядра в процессе _________________.
4. Единственный элемент, в котором обычно отсутствуют нейтроны, — это ________.
Авторы и авторство
Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Жан Дюпон.
4.4: Свойства протонов, нейтронов и электронов
Цели обучения
- Опишите расположение, заряды и массы трех основных субатомных частиц.

- Определите количество протонов и электронов в атоме.
- Определите атомную единицу массы (а.е.м.).
Атомная теория Далтона многое объяснила о материи, химических веществах и химических реакциях. Тем не менее, это не было полностью точным, потому что вопреки тому, что полагал Дальтон, атомы на самом деле могут быть разбиты на более мелкие субъединицы или субатомные частицы.Мы очень подробно говорили об электроне, но нас интересуют еще две частицы: протоны и нейтроны. Мы уже узнали, что Дж. Дж. Томсон открыл отрицательно заряженную частицу, названную электроном . Резерфорд предположил, что эти электроны вращаются вокруг положительного ядра. В последующих экспериментах он обнаружил, что в ядре есть положительно заряженная частица меньшего размера, называемая протоном . Существует также третья субатомная частица, известная как нейтрон.
Электронов
Электроны — это один из трех основных типов частиц, из которых состоят атомы. В отличие от протонов и нейтронов, которые состоят из более мелких и простых частиц, электроны являются элементарными частицами, которые не состоят из более мелких частиц. Это тип фундаментальных частиц, называемых лептонами. Все лептоны имеют электрический заряд \ (- 1 \) или \ (0 \). Электроны очень маленькие. Масса электрона составляет всего около 1/2000 массы протона или нейтрона, поэтому электроны практически ничего не вносят в общую массу атома.Электроны имеют электрический заряд \ (- 1 \), который равен, но противоположен заряду протона, который равен \ (+ 1 \). Все атомы имеют такое же количество электронов, что и протоны, поэтому положительный и отрицательный заряды «уравновешиваются», делая атомы электрически нейтральными.
В отличие от протонов и нейтронов, которые состоят из более мелких и простых частиц, электроны являются элементарными частицами, которые не состоят из более мелких частиц. Это тип фундаментальных частиц, называемых лептонами. Все лептоны имеют электрический заряд \ (- 1 \) или \ (0 \). Электроны очень маленькие. Масса электрона составляет всего около 1/2000 массы протона или нейтрона, поэтому электроны практически ничего не вносят в общую массу атома.Электроны имеют электрический заряд \ (- 1 \), который равен, но противоположен заряду протона, который равен \ (+ 1 \). Все атомы имеют такое же количество электронов, что и протоны, поэтому положительный и отрицательный заряды «уравновешиваются», делая атомы электрически нейтральными.
В отличие от протонов и нейтронов, которые находятся внутри ядра в центре атома, электроны находятся вне ядра. Поскольку противоположные электрические заряды притягиваются друг к другу, отрицательные электроны притягиваются к положительному ядру. Эта сила притяжения заставляет электроны постоянно двигаться через пустое пространство вокруг ядра. На приведенном ниже рисунке показан общий способ представления структуры атома. Он показывает электрон как частицу, вращающуюся вокруг ядра, подобно тому, как планеты вращаются вокруг Солнца. Однако это неверная точка зрения, поскольку квантовая механика показывает, что электроны более сложны.
Эта сила притяжения заставляет электроны постоянно двигаться через пустое пространство вокруг ядра. На приведенном ниже рисунке показан общий способ представления структуры атома. Он показывает электрон как частицу, вращающуюся вокруг ядра, подобно тому, как планеты вращаются вокруг Солнца. Однако это неверная точка зрения, поскольку квантовая механика показывает, что электроны более сложны.
Протоны
Протон — одна из трех основных частиц, составляющих атом.{-15} \) метров.
Как вы уже догадались по названию, нейтрон нейтрон. Другими словами, он совершенно не заряжен и поэтому не привлекается и не отталкивается от других объектов. Нейтроны есть в каждом атоме (за одним исключением), и они связаны вместе с другими нейтронами и протонами в атомном ядре.
Прежде чем мы продолжим, мы должны обсудить, как различные типы субатомных частиц взаимодействуют друг с другом. Что касается нейтронов, ответ очевиден.Поскольку нейтроны не притягиваются к объектам и не отталкиваются от них, они на самом деле не взаимодействуют с протонами или электронами (кроме связывания в ядре с протонами).
Что касается нейтронов, ответ очевиден.Поскольку нейтроны не притягиваются к объектам и не отталкиваются от них, они на самом деле не взаимодействуют с протонами или электронами (кроме связывания в ядре с протонами).
Хотя электроны, протоны и нейтроны — все типы субатомных частиц, они не все одинакового размера. Когда вы сравниваете массы электронов, протонов и нейтронов, вы обнаруживаете, что электроны имеют чрезвычайно малую массу по сравнению с протонами или нейтронами. С другой стороны, массы протонов и нейтронов довольно похожи, хотя технически масса нейтрона немного больше массы протона.Поскольку протоны и нейтроны намного массивнее электронов, почти вся масса любого атома исходит от ядра, которое содержит все нейтроны и протоны.
| Частица | Символ | Масса (а. е.м.) е.м.) | Относительная масса (протон = 1) | Относительный заряд | Расположение |
|---|---|---|---|---|---|
| протон | п. + | 1 | 1 | +1 | внутри ядра |
| электрон | e — | 5.45 × 10 −4 | 0,00055 | -1 | вне ядра |
| нейтрон | n 0 | 1 | 1 | 0 | внутри ядра |
Таблица \ (\ PageIndex {1} \) дает свойства и расположение электронов, протонов и нейтронов. В третьем столбце показаны массы трех субатомных частиц в «атомных единицах массы».» атомная единица массы (\ (\ text {amu} \)) определяется как одна двенадцатая массы атома углерода-12. Атомные единицы массы (\ (\ text {amu} \)) полезны , потому что, как вы можете видеть, масса протона и масса нейтрона в этой системе единиц почти точно равны \ (1 \).
В третьем столбце показаны массы трех субатомных частиц в «атомных единицах массы».» атомная единица массы (\ (\ text {amu} \)) определяется как одна двенадцатая массы атома углерода-12. Атомные единицы массы (\ (\ text {amu} \)) полезны , потому что, как вы можете видеть, масса протона и масса нейтрона в этой системе единиц почти точно равны \ (1 \).
Отрицательный и положительный заряды равной величины нейтрализуют друг друга. Это означает, что отрицательный заряд электрона идеально уравновешивает положительный заряд протона. Другими словами, нейтральный атом должен иметь ровно один электрон на каждый протон.Если нейтральный атом имеет 1 протон, он должен иметь 1 электрон. Если у нейтрального атома 2 протона, у него должно быть 2 электрона. Если у нейтрального атома 10 протонов, у него должно быть 10 электронов. Вы уловили идею. Чтобы быть нейтральным, атом должен иметь одинаковое количество электронов и протонов.
Сводка
- Электроны — это разновидность субатомных частиц с отрицательным зарядом.

- Протоны — это субатомные частицы с положительным зарядом. Протоны связаны вместе в ядре атома в результате сильного ядерного взаимодействия.
- Нейтроны — это тип субатомных частиц без заряда (они нейтральны). Как и протоны, нейтроны связаны с ядром атома в результате сильного ядерного взаимодействия.
- Протоны и нейтроны имеют примерно одинаковую массу, но оба они намного массивнее электронов (примерно в 2000 раз массивнее электрона).
- Положительный заряд протона равен по величине отрицательному заряду электрона. В результате в нейтральном атоме должно быть равное количество протонов и электронов.
- Атомная единица массы (а.е.м.) — единица массы, равная одной двенадцатой массы атома углерода-12
Материалы и авторство
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или всесторонне) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
Что такое нейтрон | Определение и свойства
Типичные поперечные сечения делящегося материала. Замедление нейтронов приводит к увеличению вероятности взаимодействия (например,грамм. реакция деления).Степень взаимодействия нейтронов с ядрами описывается величинами, известными как сечения . Сечения используются для выражения вероятности конкретного взаимодействия между падающим нейтроном и ядром-мишенью . Следует отметить, что эта вероятность не зависит от реальных размеров цели. В сочетании с потоком нейтронов он позволяет рассчитать скорость реакции, например, для получения тепловой мощности атомной электростанции.Стандартной единицей измерения микроскопического поперечного сечения ( σ-сигма ) является сарай , что равно 10 -28 м 2 . Этот блок очень маленький, поэтому обычно используются сараи (сокращенно «б»). Микроскопическое поперечное сечение можно интерпретировать как эффективную «целевую область», в которой ядро взаимодействует с падающим нейтроном.
Макроскопическое сечение получено из микроскопического и плотности материала:
Σ = σ.№
Здесь σ, имеющая единицы m 2 , называется микроскопическим поперечным сечением. Поскольку единицами N (плотности ядер) являются ядра / м 3 , макроскопическое сечение Σ имеет единицы м -1 , поэтому на самом деле это неправильное название, потому что это не правильный блок сечений.
Нейтронные сечения являются ключевыми параметрами ядерного топлива.Нейтронные сечения необходимо рассчитывать для свежих ТВС, как правило, в двумерных моделях топливной решетки.
Нейтронное сечение переменное и зависит от:
- Ядро-мишень (водород, бор, уран и т. Д.) Каждый изотоп имеет свой собственный набор сечений.
- Тип реакции (захват, деление и т. Д.). Сечения разные для каждой ядерной реакции.
- Энергия нейтронов (тепловые нейтроны, резонансные нейтроны, быстрые нейтроны).Для данной мишени и типа реакции сечение сильно зависит от энергии нейтронов. В общем случае сечение обычно намного больше при низких энергиях, чем при высоких. Вот почему в большинстве ядерных реакторов используется замедлитель нейтронов для уменьшения энергии нейтрона и, таким образом, увеличения вероятности деления, необходимого для производства энергии и поддержания цепной реакции.
- Энергия мишени (температура материала мишени — доплеровское уширение) Эта зависимость не столь существенна, но энергия мишени сильно влияет на внутреннюю безопасность ядерных реакторов из-за доплеровского уширения резонансов.
См. Также: JANIS (программное обеспечение ядерной информации на основе Java)
См. Также: Взаимодействие нейтронов с веществом
См. Также: Нейтронное сечение
Закон 1 / v
Для тепловых нейтронов (в области 1 / v) сечения поглощения увеличиваются по мере уменьшения скорости (кинетической энергии) нейтрона.Источник: JANIS 4.0
Для тепловых нейтронов ( в области 1 / v ) сечения поглощения увеличиваются по мере уменьшения скорости (кинетической энергии) нейтрона.Следовательно, закон 1 / v может использоваться для определения сдвига в поперечном сечении поглощения, если нейтрон находится в равновесии с окружающей средой. Это явление связано с тем, что ядерная сила между ядром-мишенью и нейтроном имеет больше времени для взаимодействия.
Этот закон применим только для сечения поглощения и только в области 1 / v.
Пример сечений в 1 / v области:
Сечение поглощения 238U при 20 ° C = 293K (~ 0.0253 эВ) составляет:
.
Поперечное сечение поглощения 238U при 1000 ° C = 1273K равно:
Это уменьшение поперечного сечения вызвано только изменением температуры окружающей среды.
Резонансный захват нейтронов
Резонансные пики радиационного захвата U238. При резонансных энергиях вероятность захвата может быть более чем в 100 раз выше базового значения.Источник: программа JANIS
Сечение поглощения часто сильно зависит от энергии нейтронов.Обратите внимание, что при делении ядра образуются нейтроны со средней энергией 2 МэВ (200 ТДж / кг, т.е. 20000 км / с). Нейтрон можно условно разделить на три диапазона энергии:
- Быстрый нейтрон. (10МэВ — 1кэВ)
- Резонансный нейтрон (1 кэВ — 1 эВ)
- Тепловой нейтрон. (1 эВ — 0,025 эВ)
Резонансные нейтроны называются резонансными из-за их особого поведения. При резонансных энергиях поперечное сечение может достигать пиков, более чем в 100 раз превышающих базовое значение поперечного сечения.При этих энергиях захват нейтрона значительно превышает вероятность деления. Поэтому очень важно (для тепловых реакторов), чтобы быстро преодолели этот диапазон энергий и эксплуатировали реактор с тепловыми нейтронами, что привело бы к увеличению вероятности деления.
Доплеровское уширение
Эффект Доплера улучшает стабильность реактора. Расширенный резонанс (нагрев топлива) приводит к более высокой вероятности поглощения, таким образом, вызывает добавление отрицательной реактивности (снижение мощности реактора).
A Доплеровское уширение резонансов является очень важным явлением, которое улучшает стабильность реактора . Мгновенный температурный коэффициент большинства тепловых реакторов равен отрицательным из-за ядерного эффекта Доплера. Хотя поперечное сечение поглощения существенно зависит от энергии падающих нейтронов, форма кривой поперечного сечения зависит также от температуры мишени.
Ядра расположены в атомах, которые сами находятся в непрерывном движении благодаря своей тепловой энергии.В результате этих тепловых движений нейтрона, падающего на мишень, кажутся ядрам в мишени имеющими непрерывный разброс по энергии. Это, в свою очередь, влияет на наблюдаемую форму резонанса. Резонанс становится на короче и на шире, чем когда ядра находятся в покое.
Хотя форма резонанса изменяется с температурой, общая площадь под резонансом остается практически постоянной. Но это не означает постоянного поглощения нейтронов .Несмотря на постоянную площадь резонанса, интеграл резонанса , который определяет поглощение, увеличивается с увеличением температуры объекта. Это, конечно, снижает коэффициент k (добавляется отрицательная реактивность).
Типовые сечения материалов в реактореВ следующей таблице показано нейтронных сечений наиболее распространенных изотопов активной зоны реактора.
Таблица сеченийСтруктура атома
Обзор атомной структуры
Атомы состоят из частиц, называемых протонами, нейтронами и электронами, которые отвечают за массу и заряд атомов.
Цели обучения
Обсудить электронные и структурные свойства атома
Ключевые выводы
Ключевые моменты
- Атом состоит из двух областей: ядра, которое находится в центре атома и содержит протоны и нейтроны, и внешней области атома, которая удерживает свои электроны на орбите вокруг ядра.
- Протоны и нейтроны имеют примерно одинаковую массу, около 1,67 × 10-24 грамма, которую ученые определяют как одну атомную единицу массы (а.е.м.) или один дальтон.
- Каждый электрон имеет отрицательный заряд (-1), равный положительному заряду протона (+1).
- Нейтроны — это незаряженные частицы, находящиеся в ядре.
Ключевые термины
- атом : Наименьшее возможное количество вещества, которое все еще сохраняет свою идентичность как химический элемент, состоящее из ядра, окруженного электронами.
- протон : положительно заряженная субатомная частица, составляющая часть ядра атома и определяющая атомный номер элемента.Он весит 1 а.е.м.
- нейтрон : субатомная частица, составляющая часть ядра атома. Это бесплатно. По массе он равен протону или весит 1 а.е.м.
Атом — это наименьшая единица вещества, которая сохраняет все химические свойства элемента. Атомы объединяются в молекулы, которые затем взаимодействуют с образованием твердых тел, газов или жидкостей. Например, вода состоит из атомов водорода и кислорода, которые объединились в молекулы воды.Многие биологические процессы посвящены расщеплению молекул на составляющие их атомы, чтобы из них можно было собрать более полезную молекулу.
Атомные частицы
Атомы состоят из трех основных частиц: протонов, электронов и нейтронов. Ядро (центр) атома содержит протоны (положительно заряженные) и нейтроны (без заряда). Внешние области атома называются электронными оболочками и содержат электроны (отрицательно заряженные). Атомы имеют разные свойства в зависимости от расположения и количества их основных частиц.
Атом водорода (H) содержит только один протон, один электрон и не содержит нейтронов. Это можно определить, используя атомный номер и массовое число элемента (см. Понятие атомных номеров и массовых чисел).
Структура атома : Изображенные здесь элементы, такие как гелий, состоят из атомов. Атомы состоят из протонов и нейтронов, расположенных внутри ядра, а электроны находятся на орбиталях, окружающих ядро.
Атомная масса
Протоны и нейтроны имеют примерно одинаковую массу, около 1.67 × 10 -24 грамм. Ученые определяют это количество массы как одну атомную единицу массы (а.е.м.) или один дальтон. Протоны схожи по массе, но заряжены положительно, а нейтроны не имеют заряда. Следовательно, количество нейтронов в атоме существенно влияет на его массу, но не на его заряд.
Электроны намного меньше по массе, чем протоны, всего 9,11 × 10 -28 грамм, или примерно 1/1800 атомной единицы массы. Следовательно, они не вносят большой вклад в общую атомную массу элемента.При рассмотрении атомной массы принято игнорировать массу любых электронов и вычислять массу атома, исходя только из числа протонов и нейтронов.
Электроны вносят большой вклад в заряд атома, поскольку каждый электрон имеет отрицательный заряд, равный положительному заряду протона. Ученые определяют эти обвинения как «+1» и «-1». В незаряженном нейтральном атоме количество электронов, вращающихся вокруг ядра, равно количеству протонов внутри ядра. В этих атомах положительный и отрицательный заряды нейтрализуют друг друга, в результате чего получается атом без чистого заряда.
Протоны, нейтроны и электроны : И протоны, и нейтроны имеют массу 1 а.е.м. и находятся в ядре. Однако протоны имеют заряд +1, а нейтроны не заряжены. Электроны имеют массу примерно 0 а.е.м., вращаются вокруг ядра и имеют заряд -1.
Изучение свойств электрона : Сравните поведение электронов с поведением других заряженных частиц, чтобы обнаружить такие свойства электронов, как заряд и масса.
Объем атомов
С учетом размеров протонов, нейтронов и электронов большая часть объема атома — более 99 процентов — фактически является пустым пространством. Несмотря на все это пустое пространство, твердые объекты не проходят сквозь друг друга. Электроны, окружающие все атомы, заряжены отрицательно и заставляют атомы отталкиваться друг от друга, не позволяя атомам занимать одно и то же пространство. Эти межмолекулярные силы не позволяют вам провалиться сквозь такой предмет, как стул.
Interactive: создайте атом : создайте атом из протонов, нейтронов и электронов и посмотрите, как изменяются элемент, заряд и масса. Тогда сыграйте в игру, чтобы проверить свои идеи!
Атомный номер и массовое число
Атомный номер — это количество протонов в элементе, а массовое число — это количество протонов плюс количество нейтронов.
Цели обучения
Определите соотношение между массовым числом атома, его атомным номером, его атомной массой и количеством субатомных частиц.
Ключевые выводы
Ключевые моменты
- Нейтральные атомы каждого элемента содержат равное количество протонов и электронов.
- Число протонов определяет атомный номер элемента и используется, чтобы отличить один элемент от другого.
- Число нейтронов варьируется, в результате чего образуются изотопы, которые представляют собой разные формы одного и того же атома, которые различаются только количеством нейтронов, которыми они обладают.
- Вместе количество протонов и количество нейтронов определяют массовое число элемента.
- Поскольку изотопы элемента имеют несколько разные массовые числа, атомная масса рассчитывается путем получения среднего массового числа его изотопов.
Ключевые термины
- массовое число : сумма количества протонов и количества нейтронов в атоме.
- атомный номер : число протонов в атоме.
- атомная масса : Средняя масса атома с учетом всех его встречающихся в природе изотопов.
Атомный номер
Нейтральные атомы элемента содержат равное количество протонов и электронов. Число протонов определяет атомный номер элемента (Z) и отличает один элемент от другого.Например, атомный номер углерода (Z) равен 6, потому что у него 6 протонов. Количество нейтронов может изменяться для получения изотопов, которые представляют собой атомы одного и того же элемента, имеющие разное количество нейтронов. Число электронов также может быть различным в атомах одного и того же элемента, в результате чего образуются ионы (заряженные атомы). Например, железо Fe может существовать в нейтральном состоянии или в ионных состояниях +2 и +3.
Массовое число
Массовое число элемента (A) — это сумма количества протонов и количества нейтронов.Небольшой вклад массы электронов не учитывается при вычислении массового числа. Это приближение массы можно использовать, чтобы легко вычислить, сколько нейтронов имеет элемент, просто вычтя количество протонов из массового числа. Протоны и нейтроны весят около одной атомной единицы массы или а.е.м. Изотопы одного и того же элемента будут иметь одинаковый атомный номер, но разные массовые числа.
Атомный номер, химический символ и массовое число : Углерод имеет атомный номер шесть и два стабильных изотопа с массовыми числами двенадцать и тринадцать соответственно.Его средняя атомная масса 12,11.
Ученые определяют атомную массу, вычисляя среднее значение массовых чисел естественных изотопов. Часто полученное число содержит десятичную дробь. Например, атомная масса хлора (Cl) составляет 35,45 а.е.м., потому что хлор состоит из нескольких изотопов, некоторые (большинство) с атомной массой 35 а.е.м. (17 протонов и 18 нейтронов), а некоторые с атомной массой 37 а.е.м. (17 протонов и 20 нейтронов).
Зная атомный номер (Z) и массовое число (A), вы можете найти количество протонов, нейтронов и электронов в нейтральном атоме.Например, атом лития (Z = 3, A = 7 а.е.м.) содержит три протона (находится из Z), три электрона (поскольку количество протонов равно количеству электронов в атоме) и четыре нейтрона (7 — 3 = 4).
Изотопы
Изотопы — это различные формы элементов, которые имеют одинаковое количество протонов, но разное количество нейтронов.
Цели обучения
Обсудить свойства изотопов и их использование в радиометрическом датировании
Ключевые выводы
Ключевые моменты
- Изотопы — это атомы одного и того же элемента, содержащие одинаковое количество протонов, но разное количество нейтронов.
- Несмотря на разное количество нейтронов, изотопы одного и того же элемента имеют очень похожие физические свойства.
- Некоторые изотопы нестабильны и при радиоактивном распаде превращаются в другие элементы.
- Предсказуемый период полураспада различных распадающихся изотопов позволяет ученым датировать материал на основе его изотопного состава, например, с помощью датирования углерода-14.
Ключевые термины
- изотоп : Любая из двух или более форм элемента, в которых атомы имеют одинаковое количество протонов, но разное количество нейтронов в их ядрах.
- период полураспада : время, необходимое для того, чтобы половина исходной концентрации изотопа распалась обратно в более стабильную форму.
- радиоактивные изотопы : атом с нестабильным ядром, характеризующийся избыточной доступной энергией, который подвергается радиоактивному распаду и чаще всего создает гамма-лучи, альфа- или бета-частицы.
- радиоуглеродное датирование : Определение возраста объекта путем сравнения отношения обнаруженной в нем концентрации 14C к количеству 14C в атмосфере.
Что такое изотоп?
Изотопы — это различные формы элементов, которые имеют одинаковое количество протонов, но разное количество нейтронов. Некоторые элементы, такие как углерод, калий и уран, содержат несколько изотопов природного происхождения. Изотопы определяются сначала их элементом, а затем суммой присутствующих протонов и нейтронов.
- Углерод-12 (или 12 C) содержит шесть протонов, шесть нейтронов и шесть электронов; следовательно, он имеет массовое число 12 а.е.м. (шесть протонов и шесть нейтронов).
- Углерод-14 (или 14 C) содержит шесть протонов, восемь нейтронов и шесть электронов; его атомная масса 14 а.е.м. (шесть протонов и восемь нейтронов).
Хотя масса отдельных изотопов разная, их физические и химические свойства в основном не меняются.
Изотопы действительно различаются по стабильности. Углерод-12 ( 12 C) — самый распространенный изотоп углерода, составляющий 98,89% углерода на Земле. Углерод-14 ( 14 C) нестабилен и встречается только в следовых количествах.Нестабильные изотопы чаще всего испускают альфа-частицы (He 2+ ) и электроны. Также могут испускаться нейтроны, протоны и позитроны, а электроны могут быть захвачены для достижения более стабильной атомной конфигурации (более низкого уровня потенциальной энергии) посредством процесса, называемого радиоактивным распадом. Созданные новые атомы могут находиться в состоянии высокой энергии и испускать гамма-лучи, которые понижают энергию, но сами по себе не превращают атом в другой изотоп. Эти атомы называются радиоактивными изотопами или радиоизотопами.
Радиоуглеродное датирование
Углерод обычно присутствует в атмосфере в виде газообразных соединений, таких как диоксид углерода и метан. Углерод-14 ( 14 C) представляет собой радиоизотоп природного происхождения, который создается из атмосферного 14 N (азота) в результате добавления нейтрона и потери протона, вызванной космическими лучами. Это непрерывный процесс, поэтому в атмосфере всегда образуется больше 14 ° C. После производства 14 C часто соединяется с кислородом атмосферы с образованием диоксида углерода.Образовавшийся таким образом углекислый газ диффундирует в атмосфере, растворяется в океане и попадает в организм растений посредством фотосинтеза. Животные поедают растения, и в конечном итоге радиоуглерод распространяется по биосфере.
В живых организмах относительное количество 14 C в их теле примерно равно концентрации 14 C в атмосфере. Когда организм умирает, он больше не поглощает 14 C, поэтому соотношение между 14 C и 12 C будет снижаться по мере того, как 14 C постепенно возвращается к 14 N.Этот медленный процесс, который называется бета-распадом, высвобождает энергию за счет испускания электронов из ядра или позитронов.
Примерно через 5730 лет половина начальной концентрации 14 C будет преобразована обратно в 14 N. Это называется периодом полураспада, или временем, которое требуется для получения половины исходной концентрации вещества. изотоп, чтобы вернуться в более стабильную форму. Поскольку период полураспада 14 C большой, он используется для датирования ранее живых объектов, таких как старые кости или дерево.Сравнивая отношение концентрации 14 C, обнаруженной в объекте, к количеству 14 C в атмосфере, можно определить количество изотопа, который еще не распался. На основе этого количества можно точно рассчитать возраст материала, если предполагается, что возраст материала составляет менее 50 000 лет.