Оксиды азота — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
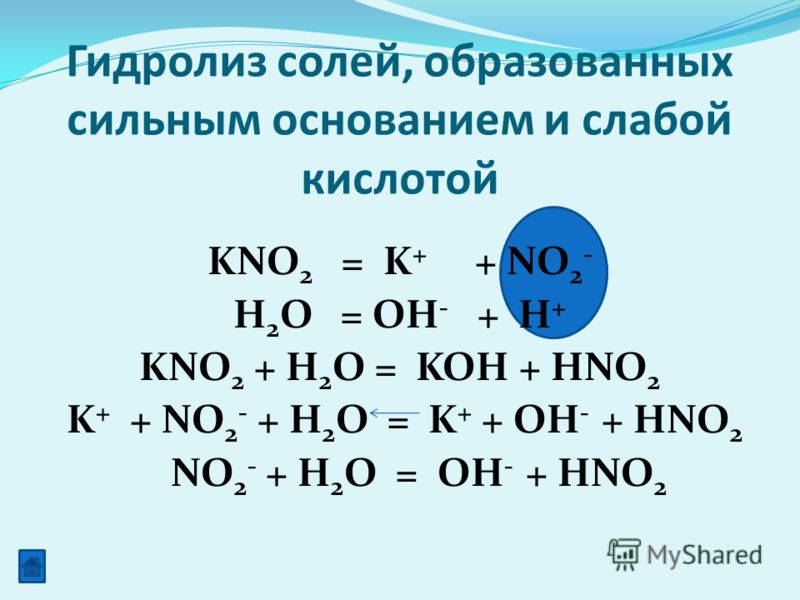
Оксиды азота.
Виды оксидов азота
+1
+2
N2O
+3
NO
+4
N2O3
N2O – оксид азота(I)
NO – оксид азота(II)
NO2
+5
N2O5
Несолеобразующие оксиды, т.к.
не взаимодействуют при обычных
условиях с кислотами и щелочами
с образованием солей.
N2O3 – оксид азота(III) — азотистый ангидрид
NO2 – окcид азота(IV) и его димер N2O4 – ангидриды
азотной и азотистой кислот.
N2O5 – азотный ангидрид
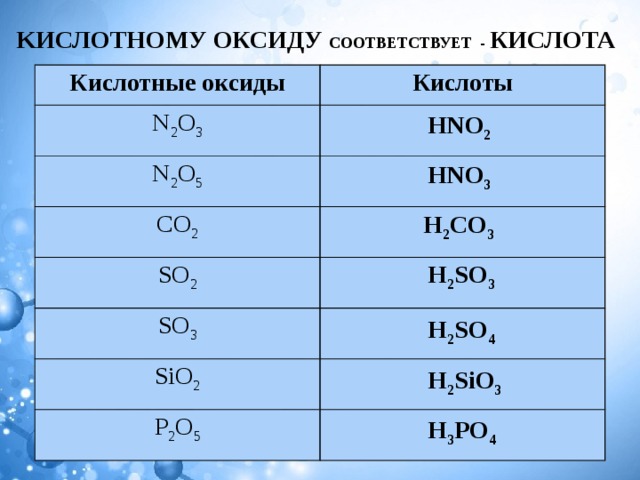
Кислотные оксиды
N2O- оксид азота (I)
IV
II
N=N=O
Против всех правил
Степень окисления не всегда
совпадает с валентностью.

Несолеобразующий оксид
+2 -2
N=N=O
степень окисления
распределяется на два атома азота и
равна для обоих +2, а для одного +1
Молекула линейна
Бесцветный газ со слабым запахом и сладковатым вкусом, хорошо
растворим в воде, но не взаимодействует с ней. В смеси с кислородом
используется в медицине для слабого наркоза. («веселящий» газ).
Проявляет окислительные свойства. Легко разлагается.
При 700 С разлагается: 2N2O= 2N2 + O2
4. Оксид азота (I) N2O
Получение.Разложение нитрата аммония при
нагревании:
Nh5NO3 = N2O + 2h3O
Нагрев должен быть не более 2450С.
Химические свойства.
1. Разлагается при 7000С с образованием
кислорода:
2N2O = 2N2 + O2
Поэтому поддерживает горение и является
окислителем.
2. С водородом:
N2O + h3 = N2 + h3O
II
NO-оксид азота (II)
II
N=О молекула линейна, имеет неспаренный электрон, поэтому
является радикалом, используется как донор электронов.

Окислительно-восстановительная двойственность
Восстановитель:
Окислитель:
2NO + O2 = 2NO2
2NO + 2SO2 = 2SO3 + N2
(легко!)
так как радикал, очень легко
подвергается окислению
Нитрозный способ получения серной
кислоты
Несолеобразующий оксид. Бесцветный газ, не имеет запаха. В воде
малорастворим. Термически устойчив. Образуется из азота и кислорода
при сильных электрических разрядах (например, во время грозы в воздухе)
или при высокой температуре:
2NO 3
8
N2 + O2
3
2
4
В лаборатории: Сu + HNO3 == Cu(NO3)2 + NO + h3O
6. Оксид азота (II) NO
Получение. 1. При реакции неактивныхметаллов с
разбавленной азотной кислотой:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4h3O
2. При каталитическом окислении аммиака:
4Nh4 + 5O2 = 4NO + 6h3O
3. При взаимодействии с кислородом воздуха:
N2 + O2 = 2NO (t0 ≥ 20000C, кат. Pt/Rh)
4. При взаимодействии нитритов с серной
кислотой:
2 NaNO2 + h3SO4 = Na2SO4 + NO + NO2 + h3O
Химические свойства.
 Очень реакционноспособное
Очень реакционноспособноевещество. Может проявлять и окислительные и
восстановительные свойства.
1. При обычной температуре окисляется кислородом
воздуха:
2NO + O2 = 2NO2
2. Восстановитель:
NO + NO2 = N2O3
2NO + Cl2 = 2NOCl (нитрозилхлорид)
3. Окислитель:
2NO + 2SO2 = 2SO3 + N2
2NO + 2Н2 = N2 + 2Н2О (2000С)
2NO + 2Cu = N2 + 2CuO (5000С)
2NO + 2h3S = N2 + 2S + 2Н2О (3000С)
4. Взаимодействует с органическими веществами.
Применяется в производстве азотной кислоты.
N2O3-оксид азота (III)
Азотистый ангидрид
Кислотный оксид:
N2O3 + h3O = 2HNO2
N2O3 + 2 KOH = 2 KNO2 = h3O
Жидкость, темно – синего цвета, термически неустойчива, t
кип.= 3,5 С, т. е. существует в жидком состоянии только при
охлаждении, в обычных условиях переходит в газообразное
состояние. При взаимодействии с водой образуется
азотистая кислота.
При низких температурах и разлагается: N2O3 = NO + NO2
Оксид азота (III) N2O3
Получить можно при сильном охлаждении
эквимолярной смеси NO и NO2:
NO + NO2 = N2O3
Химические свойства.
 N2O3 — кислотный оксид.
N2O3 — кислотный оксид.1. Взаимодействие со щелочами:
2NaOH + N2O3 = 2NaNO2 + h3O
2. Взаимодействие с водой:
N2O3 + h3O(хол) = 2HNO2
3N2O3 + h3O(гор) = 2HNO3 + 4NO
3. Окисляется кислородом воздуха при -100С:
2N2O3 + О2 = 4NO2
Оксид азота (IV)
Кислотный оксид.
Сильный окислитель
+3
+5
II
III III
II
O=N-N=O
2NO2 + h3O = HNO2 + HNO3
Взаимодействие с водой происходит таким
образом, так как это смешанный оксид,
которому соответствует две кислоты
2NO2 + 2NaOH = NaNO3 + NaNO2 + h3O
2NO2 === N2O4
Ниже 22 С молекулы оксида азота(IV) легко соединяются
попарно и образуют бесцветную жидкость состава N2O4 ,
которая при охлаждении до -10,2 С превращается в
бесцветные кристаллы. Димер в жидком состоянии
бесцветный, в твердом — белый. t(пл) = -11,20С. Хорошо
растворяется в холодной воде. Насыщенный раствор имеет
«Лисий
хвост»цвет.
Ядовитый газ бурого цвета, имеет характерный
ярко-зеленый
запах.
 Хорошо растворяется в воде. Полностью растворяется в ней.
Хорошо растворяется в воде. Полностью растворяется в ней.Проявляет все свойства кислотных оксидов.
Оксид азота (IV) NO2
Получение.
1. Термическим разложением нитратов
металлов,
расположенных в ряду активности в
интервале Al-Сu:
2Cu(NO3)2 = 2CuO + 4NO2 + O2
2. Взаимодействием меди с концентрированной
азотной
кислотой:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2h3O
3. Окислением оксида азота(II):
2NO + O2 = 2NO2
12. Оксид азота (IV) NO2
Химические свойства.1. Взаимодействие с водой:
2NO2 + h3O(хол) = HNO3 + HNO2
3NO2 + h3O(гор) = 2HNO3 + NO
2. Взаимодействие с растворами щелочей:
2NO2 + 2КОН = КNO3 + КNO2 + Н2О
3. При растворении в воде в присутствии кислорода:
4NO2 + 2h3O + О2 = 4HNO3
Используется в промышленном способе получения
азотной кислоты.
3. Хороший окислитель:
NO2 + SO2 = SO3 + NO
2NO2 + 4Cu = 4CuO + N2 (500-6000C)
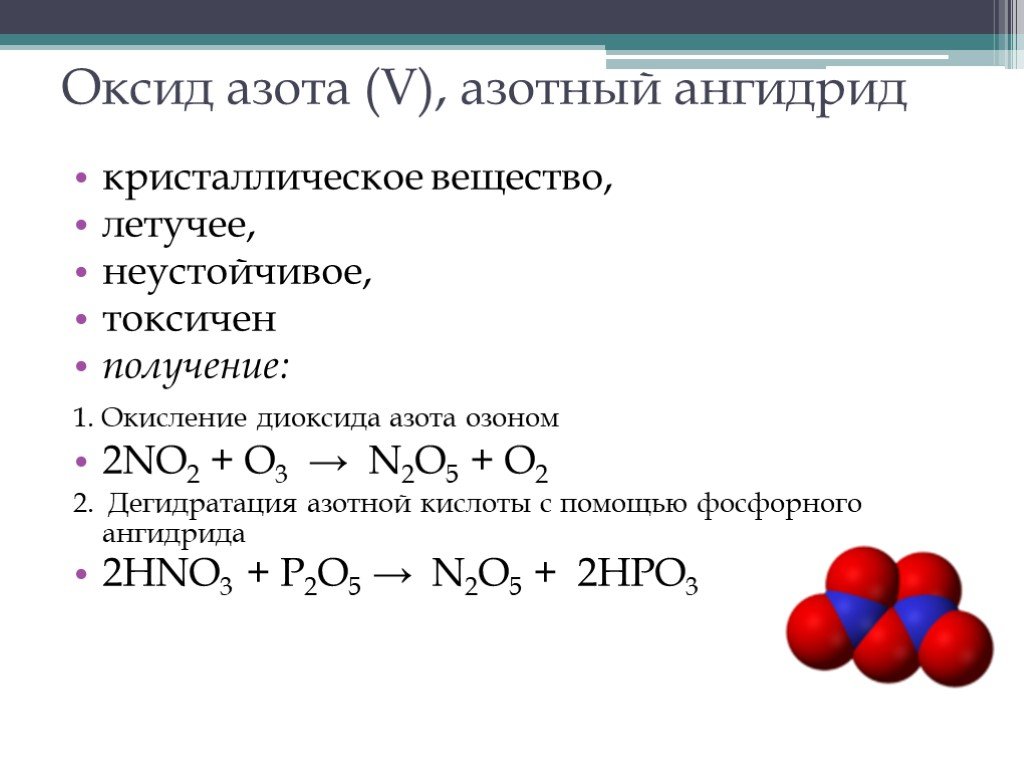
Оксид азота (V)
Азотный ангидрид. Является очень
сильным окислителем.
 Кислотный оксид:
Кислотный оксид:N2O5 + h3O == 2HNO3
Легко разлагается (при нагревании – со взрывом):
2N2O5 == 4NO2 + O2
Бесцветные прозрачные кристаллы, хорошо растворяющиеся в
воде с образованием азотной кислоты : N2O5 + h3O == 2HNO3
Нестойкие кристаллы: 2N2O5 ==4NO2 + O2
Как и оксид азота(III) практического значения не имеет.
Получение. Действие дегидратирующего агента Р4О10 на
азотную кислоту:
4HNO3 + P4O10 = 2N2O5 + 4HPO3
Химические свойства. Оксид азота(V) — кислотный оксид.
1. При растворении в воде образует азотную кислоту:
N2O5 + h3O = 2HNO3
2. Со щелочами образует нитраты:
N2O5 + 2NaOH = 2NaNO3 + h3O
3. Малоустойчив и легко разлагается уже при
комнатной температуре:
2N2O5 = 4NO2 + O2
Прb нагревании разлагается со взрывом.
4. Сильный окислитель:
N2O5 + 5Сu = 5CuO + N2 (5000C)
На практике реакции не проводятся ввиду его
труднодоступности и малой устойчивости
15. Оксид азота (V) N2O5
N2O5 + h3O → HNO316.
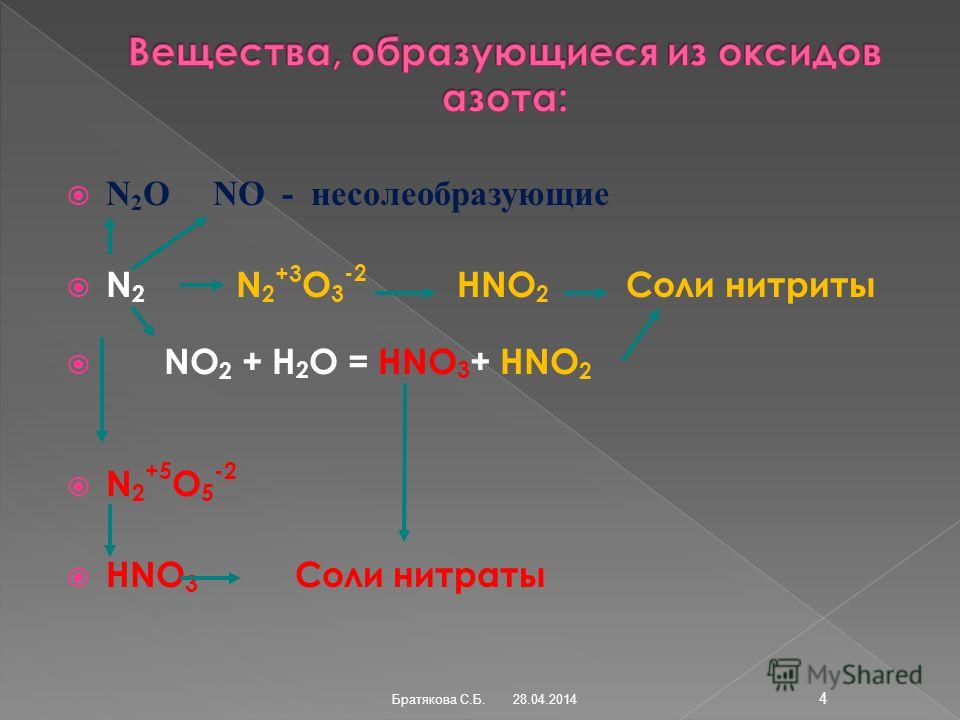
 Вещества, образующиеся из оксидов азота:NO — несолеобразующие
Вещества, образующиеся из оксидов азота:NO — несолеобразующиеN2O
N2+3O3-2
N2
HNO2
Соли нитриты
NO2 + h3O = HNO3+ HNO2
+5
-2
N2 O5
HNO3
Соли нитраты
Обобщающие задания.
1.Имеются три
закрытых цилиндра: с оксидом азота (IV), с азотом, с
аммиаком.
Как проще всего узнать, в каком цилиндре какой газ содержится?
В каких цилиндрах и как изменится окраска влажной фиолетовой
лакмусовой бумажки?
Nh4
NO2
2.Цилиндр с оксидом азота (II) был закрыт пластинкой. Как только
пластинку сняли, в верхней части цилиндра появились бурые пары. Чем это
объясняется?
NO2
O2
NO
19. Кислотные дожди
20. Влияние кислотных дождей на животных
21. Влияние кислотных дождей на архитектурные сооружения
English Русский Правила
44. Оксиды азота (n2o, no, n2o3, n2o5).
Ответ. Оксонитрид азота (I) (оксид азота (I), закись азота, окись азота, веселящий
газ) – соединение с химической формулой
N2O. Иногда называется «веселящим газом»
из-за производимого им опьяняющего
эффекта. При нормальной температуре
это бесцветный негорючий газ с приятным
сладковатым запахом и привкусом. Впервые
был получен в 1772 г. Джозефом Пристли,
который назвал его «флогистированным
нитрозным воздухом». Оксид азота (I)
получают нагреванием сухого нитрата
аммония. Разложение начинается при 170
°C и сопровождается выделением тепла:
Nh5NO3 = N2O + 2h3O. Более удобным способом
является нагревание сульфаминовой
кислоты с 73 %-ной азотной кислотой:
Nh3SO2OH + HNO3 (73 %) = N2O + H 2SO4 + H 2O. Используют в
медицине. Бесцветный газ, тяжелее воздуха
(относительная плотность 1,527), с характерным
сладковатым запахом. Растворим в воде
(0,6 объема N2O растворяется в 1 объеме воды
при 25 °C, или 0,15 г – в 100 мл воды при 15 °C),
растворим также в этиловом спирте,
эфире, серной кислоте. Молекула N2O имеет
дипольный момент 0,166 Дб, коэффициент
преломления в жидком виде равен 1,330 (для
желтого света с длиной волны 589 нм).
Иногда называется «веселящим газом»
из-за производимого им опьяняющего
эффекта. При нормальной температуре
это бесцветный негорючий газ с приятным
сладковатым запахом и привкусом. Впервые
был получен в 1772 г. Джозефом Пристли,
который назвал его «флогистированным
нитрозным воздухом». Оксид азота (I)
получают нагреванием сухого нитрата
аммония. Разложение начинается при 170
°C и сопровождается выделением тепла:
Nh5NO3 = N2O + 2h3O. Более удобным способом
является нагревание сульфаминовой
кислоты с 73 %-ной азотной кислотой:
Nh3SO2OH + HNO3 (73 %) = N2O + H 2SO4 + H 2O. Используют в
медицине. Бесцветный газ, тяжелее воздуха
(относительная плотность 1,527), с характерным
сладковатым запахом. Растворим в воде
(0,6 объема N2O растворяется в 1 объеме воды
при 25 °C, или 0,15 г – в 100 мл воды при 15 °C),
растворим также в этиловом спирте,
эфире, серной кислоте. Молекула N2O имеет
дипольный момент 0,166 Дб, коэффициент
преломления в жидком виде равен 1,330 (для
желтого света с длиной волны 589 нм).
 Молекула NO имеет нечетное
число электронов. Наличие неспаренного
электрона должно обуславливать склонность
NO к полимеризации. Однако димеры N2O2 –
достаточно непрочные соединения (ΔH 0
димеризации около 17 кДж/моль). Жидкий
оксид азота (II) на 25 % состоит из молекул
N 2O2, а твердый оксид целиком состоит из
них. Молекула NO легко отдает свой
неспаренный электрон и превращается в
нитрозил-ион: NO – 1е– → NO+ – нитрозил-ион.
Нитрозил-ион более устойчив, чем молекула
NO. При комнатной температуре и атмосферном
давлении происходит окисление NO
кислородом воздуха: 2NO + O2 = 2NO2. Для NO
характерны также реакции присоединения
галогенов с образованием нитрозилгалогенидов,
в этой реакции NO проявляет свойства
восстановителя с образованием
нитрозилхлорида: 2NO + Cl2 = 2NOCl. В присутствии
более сильных восстановителей NO проявляет
окислительные свойства: 2SO2 + 2NO = 2SO3 + N2.
В воде NO малорастворим и с ней не
реагирует, являясь несолеобразующим
оксидом. Оксид азота (II) – единственный
из оксидов азота, который можно получить
непосредственно взаимодействием азота
с кислородом при высоких температурах
(2 000–3 000 °C) или в электрическом разряде.
Молекула NO имеет нечетное
число электронов. Наличие неспаренного
электрона должно обуславливать склонность
NO к полимеризации. Однако димеры N2O2 –
достаточно непрочные соединения (ΔH 0
димеризации около 17 кДж/моль). Жидкий
оксид азота (II) на 25 % состоит из молекул
N 2O2, а твердый оксид целиком состоит из
них. Молекула NO легко отдает свой
неспаренный электрон и превращается в
нитрозил-ион: NO – 1е– → NO+ – нитрозил-ион.
Нитрозил-ион более устойчив, чем молекула
NO. При комнатной температуре и атмосферном
давлении происходит окисление NO
кислородом воздуха: 2NO + O2 = 2NO2. Для NO
характерны также реакции присоединения
галогенов с образованием нитрозилгалогенидов,
в этой реакции NO проявляет свойства
восстановителя с образованием
нитрозилхлорида: 2NO + Cl2 = 2NOCl. В присутствии
более сильных восстановителей NO проявляет
окислительные свойства: 2SO2 + 2NO = 2SO3 + N2.
В воде NO малорастворим и с ней не
реагирует, являясь несолеобразующим
оксидом. Оксид азота (II) – единственный
из оксидов азота, который можно получить
непосредственно взаимодействием азота
с кислородом при высоких температурах
(2 000–3 000 °C) или в электрическом разряде.
 N2O3 образуется при охлаждении получающейся
смеси газов. При пропускании электрического
разряда через жидкий воздух N2O3 можно
получить в виде порошка голубого цвета:
N2
+ O2
= 2NO,
2NO
+ O2
= 2NO2,
NO
+ NO2
= N2O3.
(смесь газов охлаждают) Кислотный оксид
N2O3 подвержен термической диссоциации:
N2O3 = NO + NO2. Жидкий оксид азота (III) синего
цвета, он также частично диссоциирован.
Являясь азотистым ангидридом, при
взаимодействии с водой N2O3 дает азотистую
кислоту: N2O3 + h3O = 2HNO2. При взаимодействии
с растворами щелочей образуются
соответствующие нитриты: N2O3 + 2KOH = 2KNO2 +
h3O.
N2O3 образуется при охлаждении получающейся
смеси газов. При пропускании электрического
разряда через жидкий воздух N2O3 можно
получить в виде порошка голубого цвета:
N2
+ O2
= 2NO,
2NO
+ O2
= 2NO2,
NO
+ NO2
= N2O3.
(смесь газов охлаждают) Кислотный оксид
N2O3 подвержен термической диссоциации:
N2O3 = NO + NO2. Жидкий оксид азота (III) синего
цвета, он также частично диссоциирован.
Являясь азотистым ангидридом, при
взаимодействии с водой N2O3 дает азотистую
кислоту: N2O3 + h3O = 2HNO2. При взаимодействии
с растворами щелочей образуются
соответствующие нитриты: N2O3 + 2KOH = 2KNO2 +
h3O.  В обычных
условиях NO2 существует в равновесии с
димером-тетраоксидом диазота N2O4 (Eдим
= – 57,3 кДж/моль). При нормальном давлении
в такой смеси содержится 31 % NO2, при 100 °С
– 88 % NO 2, выше 140 °С N2O4 целиком переходит
в NO2. Жидкая смесь состоит в основном из
N 2O4, а твердое вещество – чистый димер.
Молекула димера диамагнитна, имеет
плоскую структуру. Диоксид взаимодействует
с водой и растворами щелочей: 2NO2
+ h3O
= HNO3
+ HNO2,
4NO2
+ 2h3O
+ О2(изб) = 4HNO3,
3NO2 + h3O = 2HNO3 + NO. Аналогично идут реакции
со щелочами с образованием солей: 2NO2
+ 2NaOH
= NaNO3
+ NaNO2
+ h3O.
Многие вещества (С, S, P, органические
соединения) сгорают в NO2, т.к. NO2 и N 2O4 –
сильные окислители. В жидком N2O4 существует
равновесие: N2O4 ↔ NO+ + NO3–. Некоторые
металлы (например Zn, Сu), реагируя с жидким
N2O4, образуют безводные нитраты: Zn
+ 2N2O4
= Zn(NO3)2
+ 2NO.
Диоксид азота – промежуточный продукт
в производстве HNO3. В лаборатории NO 2
получают разложением безводного Pb(NO3)2
или взаимодействием меди с концентрированной
азотной кислотой.
В обычных
условиях NO2 существует в равновесии с
димером-тетраоксидом диазота N2O4 (Eдим
= – 57,3 кДж/моль). При нормальном давлении
в такой смеси содержится 31 % NO2, при 100 °С
– 88 % NO 2, выше 140 °С N2O4 целиком переходит
в NO2. Жидкая смесь состоит в основном из
N 2O4, а твердое вещество – чистый димер.
Молекула димера диамагнитна, имеет
плоскую структуру. Диоксид взаимодействует
с водой и растворами щелочей: 2NO2
+ h3O
= HNO3
+ HNO2,
4NO2
+ 2h3O
+ О2(изб) = 4HNO3,
3NO2 + h3O = 2HNO3 + NO. Аналогично идут реакции
со щелочами с образованием солей: 2NO2
+ 2NaOH
= NaNO3
+ NaNO2
+ h3O.
Многие вещества (С, S, P, органические
соединения) сгорают в NO2, т.к. NO2 и N 2O4 –
сильные окислители. В жидком N2O4 существует
равновесие: N2O4 ↔ NO+ + NO3–. Некоторые
металлы (например Zn, Сu), реагируя с жидким
N2O4, образуют безводные нитраты: Zn
+ 2N2O4
= Zn(NO3)2
+ 2NO.
Диоксид азота – промежуточный продукт
в производстве HNO3. В лаборатории NO 2
получают разложением безводного Pb(NO3)2
или взаимодействием меди с концентрированной
азотной кислотой.
Пятиокись азота – получение, свойства, применение
Пятиокись азота
Что такое N 2 O 5 ? N 2 O 5 Название соединения: пятиокись азота, пятиокись азота или нитрат нитрата. Название N 2 O 5 символизирует два атома азота и пять атомов кислорода в молекуле. Пятиокись азота представляет собой форму ангидрида азотной кислоты. Это происходит в виде белых кристаллов, когда озон окисляет диоксид азота. Его также получают обезвоживанием HNO 3 с пятиокисью дифосфора. Соединение нестабильно и разлагается на кислород и диоксид азота при комнатной температуре. Это умеренно взрывоопасный химикат с небольшой коммерческой ценностью.
Пятиокись азота представляет собой форму ангидрида азотной кислоты. Это происходит в виде белых кристаллов, когда озон окисляет диоксид азота. Его также получают обезвоживанием HNO 3 с пятиокисью дифосфора. Соединение нестабильно и разлагается на кислород и диоксид азота при комнатной температуре. Это умеренно взрывоопасный химикат с небольшой коммерческой ценностью.
Получение пятиокиси азота
Метод 1: Его можно приготовить из концентрированной азотной кислоты (HNO 3 ) и фосфорного ангидрида (P 4 O 66). Этот процесс предпочтителен для лабораторного синтеза.
12 молей концентрированной азотной кислоты реагируют с фосфорным ангидридом с образованием 6 молей пятиокиси азота и 4 молей фосфорной кислоты.
Химическое уравнение для реакции следующим образом:
12 HNO 3 + P 4 O 10 → 6 N 2 O 5 + 4 H 3 PO 4
+ 4 H
3 PO 4+ 4 H
3 PO 4 + 4 H 3 . Метод 2:
Метод 2: Другой лабораторный синтез включает нитрат лития LiNO 3 и пентафторид брома BrF 5 .
3 моля нитрата лития реагируют с 1 молем пентафторида брома. Соотношение остается 3:1, а количество может варьироваться. Реакция дает нитрилфторид, который далее реагирует с нитратом лития с образованием фторида лития и пятиокиси азота.
BRF 5 + 3 LINO 3 → 3 LIF + BRONO 2 + O 2 + 2 FNO 2
FNO 2 + LINO 3 → LIF + N 2 . 5
Метод 3:Его также можно приготовить из азотной кислоты (HNO 3 ) и пятиокиси фосфора (P 2 O 5 ).
2 моля азотной кислоты реагируют с пятиокисью фосфора с образованием пятиокиси азота и 2 молей мета-фосфорной кислоты.
Химическое уравнение для фракции следующим образом:
2 HNO 3 + P 2 O 5 → N 2 O 5 + 2 HPO 3
Метод 4: Он также образуется в газовой фазе, когда двуокись азота (NO 2 ) или четырехокись азота (N 2 O 4 ) реагирует с озоном.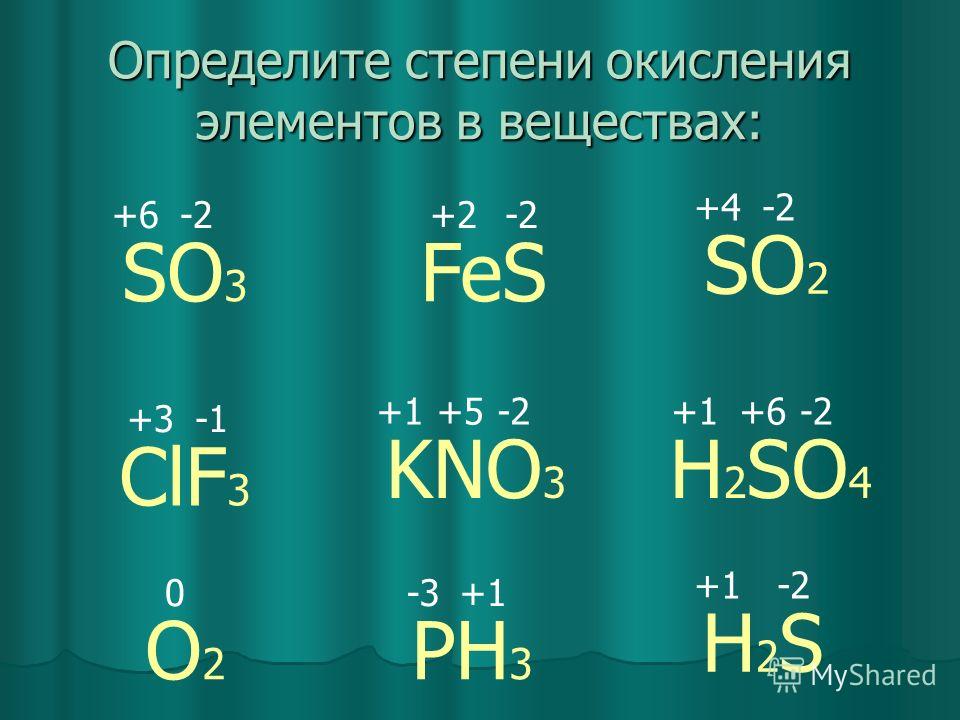
2 моля газообразного диоксида азота реагируют с одним молем озона с образованием пятиокиси азота и кислорода.
Реакция может быть представлена следующим образом:
2 NO 2 + O 3 → N 2 O 5 + O 2.
Таким образом, это один из тех газов, которые ответственны за разрушение озонового слоя.
| Знаете ли вы: Пятиокись азота была впервые описана в 1840 году Девилем. Он приготовил его, используя нитрат серебра (AgNO 3 ) и хлор. |
Структура пятиокиси азота
Кристаллическая структура N 2 O 5 является гексагональной. Его молекулярная форма плоская. Это бинарное соединение с двумя элементами – азотом и кислородом. Он твердый, но сублимируется в бесцветный газ, когда температура поднимается выше комнатной.
Твердая пятиокись азота представляет собой соль. Он имеет отдельные катионы и анионы. В то время как катион иона нитрония имеет линейную структуру, анион плоский. Таким образом, твердый пятиокись азота также может называться нитратом нитрония. Азотные центры имеют пять степеней окисления.
Он имеет отдельные катионы и анионы. В то время как катион иона нитрония имеет линейную структуру, анион плоский. Таким образом, твердый пятиокись азота также может называться нитратом нитрония. Азотные центры имеют пять степеней окисления.
Структура пятиокиси азота
- Общее число атомов 7.
- Всего валентных электронов 10 + 30 = 40.
- Для октета требуется 56 электронов.
- Недостающие электроны потребуются для октета – общее количество валентных электронов (56 – 40) = 16.
- Общее количество образованных связей будет 16/2 = 8 связей.
Физические свойства пятиокиси азота
В следующей таблице указаны некоторые важные свойства N 2 O 5
- Молекулярная масса/ Молярная масса: 108,01 г/моль
- Плотность: 1,64 г/см³
- Температура плавления: 41 °C
- Температура кипения: 47 °C
- Запах: Без запаха
- Сложность: 71.2
- Внешний вид: Белый твердый
- Акцептор водородной связи: 5
- Ковалентно-связанный Единица: 1
- Растворимость: Растворим в эфире и спирте
- Очень кислый.

Формула соединения: N 2 O 5.
Молекулярная масса азота 14,0067.
Молекулярная масса кислорода 15,999.
Таким образом, его молярная масса может быть рассчитана следующим образом:
= (2 × 14,0067) + (5 × 15,999)
= 108,01 г/моль
Таким образом, молярная масса или молекулярная масса пятиокиси азота составляет 108,01 г. /моль.
Химические свойства пятиокиси азота
Пятиокись азота является сильным окислителем. Реагирует с различными веществами. Вот некоторые из ключевых реакций:
Реакция с водой
Реагирует с водой в соотношении 1:1 с образованием азотной кислоты. Таким образом, реакция доказывает, что пятиокись азота является ангидридом воды. Химическая реакция может быть записана следующим образом:
N 2 O 5 + H 2 O → 2 HNO 3
Реакция с основанием
Реакция с основанием, таким как гидроксид натрия нитраты и вода. Сбалансированное химическое уравнение выглядит следующим образом:
Сбалансированное химическое уравнение выглядит следующим образом:
N 2 O 5 + 2 NaOH → 2NaNO 3 + H 2 O
Реакция с кислотой Химическое уравнение выглядит следующим образом:
N 2 O 5 + HCl → HNO 3 + NO 2 Cl
Разложение
Пятиокись азота легко разлагается при повышении температуры выше комнатной.
Разложение при комнатной температуреОбразует диоксид азота и кислород. При 0 °C разложением можно пренебречь, если поместить в инертные контейнеры.
2 N 2 O 5 → 4 NO 2 + O 2
Decomposition at high temperaturesAt high temperatures between 600 K and 1,100 K or 327–827°C, dinitrogen pentoxide разлагается в два последовательных этапа:
Шаг 1: N 2 O 5 → NO 2 + NO 3
Шаг 2: 2 NO 3 → 2 NO 2 + O 2
Разложение в CCL 4 на 30 ° C при высоких температурах пятиокись азота разлагается в четыреххлористом углероде (CCl 4 ) при 30 °C или 303 K.
Образующиеся продукты представляют собой двуокись азота и кислород. В то время как пятиокись азота и двуокись азота остаются растворимыми в четыреххлористом углероде, нерастворимый кислород улетучивается в виде газа. Уравнение реакции выглядит следующим образом:
2 N 2 O 5 → 4 NO 2 + O2 (G)
Реакция с аммиаком
Пентоксид динитроген дает несколько продуктов в реакции с AMM
Onea (NH 3 ), в том числе атрол. оксид (N 2 O), нитрамид (NH 2 NO 2 ), нитрат аммония (NH 4 NO 3 ) и динитрамид аммония (NH 4 0 N(5 0 0 2 ) 5 0 0 N(5 0 0 ) , в зависимости от условий реакции
| Подумайте об этом: Хотя азот образует пятиокись, он не образует пентахлорид. Почему? Азот не может образовать пентахлорид азота, потому что у него нет вакантной d-орбитали, и он не может расширить свой октет. Кроме того, в пятиокиси азота есть две молекулы азота, поэтому у них нет необходимости иметь d-орбиталь. |
Применение пятиокиси азота
Ниже приведены некоторые ключевые области применения пятиокиси азота:
- Используется в качестве сильного окислителя в высокотопливных ракетах.
- В растворителях не на водной основе может происходить легкое нитрование молекул, очень чувствительных к воде.
- Как нитрующий агент помогает в современной органической химии. Для нитрования подходит смесь N 2 O 5 и HNO 3 .
- Используется при приготовлении взрывчатых веществ.
- Раньше он использовался в качестве реагента для нитрования, но сейчас его в значительной степени вытеснил NO 2 БФ 4 .
- В виде раствора в хлороформе он используется в качестве реагента для добавления функциональности −NO 2 в органические соединения.
 Реакция нитрования выглядит следующим образом:
Реакция нитрования выглядит следующим образом:
N 2 O 5 + Ar-H → HNO 3 + Ar-NO 2
Биологические эффекты пятиокиси азота
Помимо физических и химических свойств важно понимать, что действие пятиокиси азота. Вот некоторые из основных воздействий:
- Как и любой другой оксид азота, вдыхание пятиокиси азота вызывает токсические эффекты, которые в основном поражают легкие.
- Меньшее воздействие может вызвать легкое раздражение верхних дыхательных путей. Симптомы могут варьироваться от кашля, боли в горле, головной боли, конъюнктивита и головокружения до стеснения в груди.
- Длительное воздействие может вызвать отек и воспаление легких.
- Газообразный пятиокись азота может вызывать раздражение глаз или конъюнктивит.
- Когда пары пятиокиси азота смешиваются с потом, это может вызвать раздражение кожи или ожоги кожи из-за образования азотной кислоты.
- Он повреждает озоновый слой, что приводит к большему воздействию УФ-лучей и их вредному воздействию.

| Что нужно помнить ● Гибридизация N 2 O 5 представляет собой sp 2 . ● Молекула пятиокиси азота содержит только 2 моля азота и 2 моля кислорода. ● Это бесцветный кристалл. ● Пятиокись азота имеет четыре ковалентные связи. ● Это сильный окислитель. ● Он тяжелее воздуха. ● Легко разлагается на кислород и диоксид азота. Названия соединений N 2 O 5 следующие:
|
Заключение
Пятиокись азота относится к разновидности NO x . Это нестабильный и потенциально опасный окислитель. Это причинный фактор истощения озонового слоя. Соединение легко разлагается. В реакции с водой дает азотную кислоту. Таким образом, его также называют ангидридом азотной кислоты.
В реакции с водой дает азотную кислоту. Таким образом, его также называют ангидридом азотной кислоты.
Часто задаваемые вопросы
Q1. Опасен ли пятиокись азота?
Да, пятиокись азота является опасным соединением. Поскольку это сильный окислитель, он образует взрывчатые вещества с солями аммония. Он легко разлагается с образованием высокотоксичного газа NO 2 . Он также реагирует с озоном и приводит к истощению озонового слоя.
Q2. Как образуется пятиокись азота в атмосфере?
В атмосфере много соединений NOx, которые приводят к разрушению озонового слоя. Пятиокись азота наблюдается в стратосфере. Он реагирует с аэрозолями и оказывает значительное влияние на тропосферный озон.
Q3. От каких условий зависят различные структуры пятиокиси азота?
Пятиокись азота представляет собой соединение, имеющее две структуры в зависимости от условий. В твердом состоянии это соль, нитрат нитрония, с отдельными катионами нитрония [NO2]+ и нитрат-анионами [NO3]-. В газовой фазе он находится в виде ковалентно связанной молекулы.
В газовой фазе он находится в виде ковалентно связанной молекулы.
Ответ: Для следующей реакции: 2h3O + N2O5…
Усилитель знаний
Подробнее о
Хотите подробно изучить концепцию этого приложения? Не смотрите дальше. Узнайте больше об этой теме, химии и связанных с ней других темах, изучив похожие вопросы и дополнительный контент ниже.
Пояснение понятий
Артикул
Стехиометрия – это химическое подразделение, оценивающее количественное содержание химического процесса с помощью реагирующих молекул или продуктов, участвующих в реакции. Термин «стехейон» в «Стехиометрии» — это древнегреческий термин, означающий «элемент… 9».0019
Похожие вопросы
На приведенных ниже рисунках показано молекулярное представление химической реакции между h3 и CO с образованием метанола Ch4OH. то, что осталось после завершения реакции. D Был ли в этой реакции лимитирующий реагент? Если да, то что это было? Напишите сбалансированное химическое уравнение этой реакции.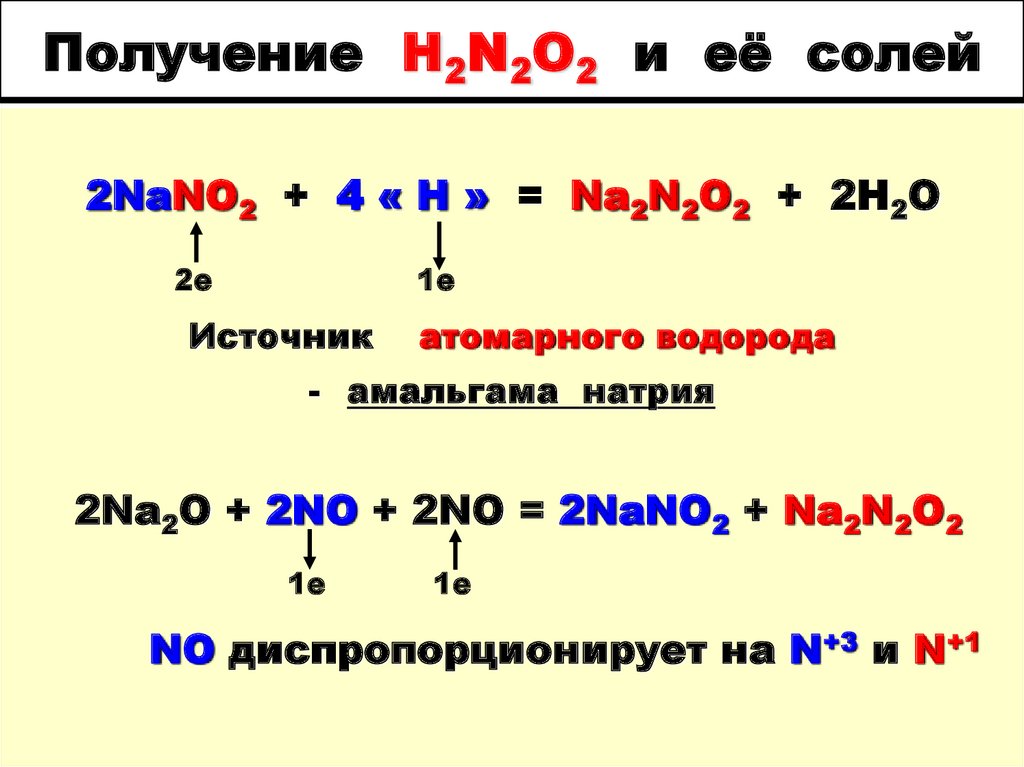 Как обычно, ваше уравнение должно использовать наименьшие возможные целочисленные коэффициенты для всех веществ.
Как обычно, ваше уравнение должно использовать наименьшие возможные целочисленные коэффициенты для всех веществ.
arrow_forward
Ниже приведены фактические ответы учащихся на вопрос: Почему необходимо уравновешивать химические уравнения? а. Химикаты не будут реагировать, пока вы не добавите правильные молярные соотношения. б. Правильные продукты не будут образовываться, если не будет добавлено нужное количество реагентов. в. Определенное количество продуктов не может образоваться без определенного числа реагентов. д. Сбалансированное уравнение говорит вам, сколько реагента вам нужно, и позволяет предсказать, сколько продукта вы произведете. е. Чтобы реакция происходила, как написано, должно быть установлено соотношение молей к молям. Обоснуйте лучший выбор, а для вариантов, которые вы не выбрали, объясните, что с ними не так.
arrow_forward
ДДТ, инсектицид, вредный для рыб, птиц и человека, производится в результате следующей реакции: в государственной лаборатории 1142 г хлорбензола реагируют с 485 г хлораля. а. Какая масса ДДТ образуется при 100% выходе? б. Какой реагент является лимитирующим? Что в избытке? в. Какая масса избыточного реагента осталась? д. Если фактический выход ДДТ составляет 200,0 г, каков выход в процентах?
а. Какая масса ДДТ образуется при 100% выходе? б. Какой реагент является лимитирующим? Что в избытке? в. Какая масса избыточного реагента осталась? д. Если фактический выход ДДТ составляет 200,0 г, каков выход в процентах?
arrow_forward
Вы готовите печенье, но у вас не хватает ключевого ингредиента — яиц. У вас есть большинство других ингредиентов, необходимых для приготовления печенья, за исключением того, что у вас есть только 1,33 чашки масла и нет яиц. Вы заметили, что рецепт требует двух чашек сливочного масла и трех яиц (плюс другие ингредиенты), чтобы приготовить шесть дюжин печенья. Вы звоните другу и просите его принести вам несколько яиц. а. Какое количество яиц вам нужно? б. Если вы используете все масло (и получаете достаточное количество яиц), сколько печений вы испечете? К сожалению, ваш друг вешает трубку до того, как вы говорите ему, сколько яиц вам нужно. Когда он приедет, у него будет для вас сюрприз, чтобы сэкономить время, он разбил их все в миску для вас.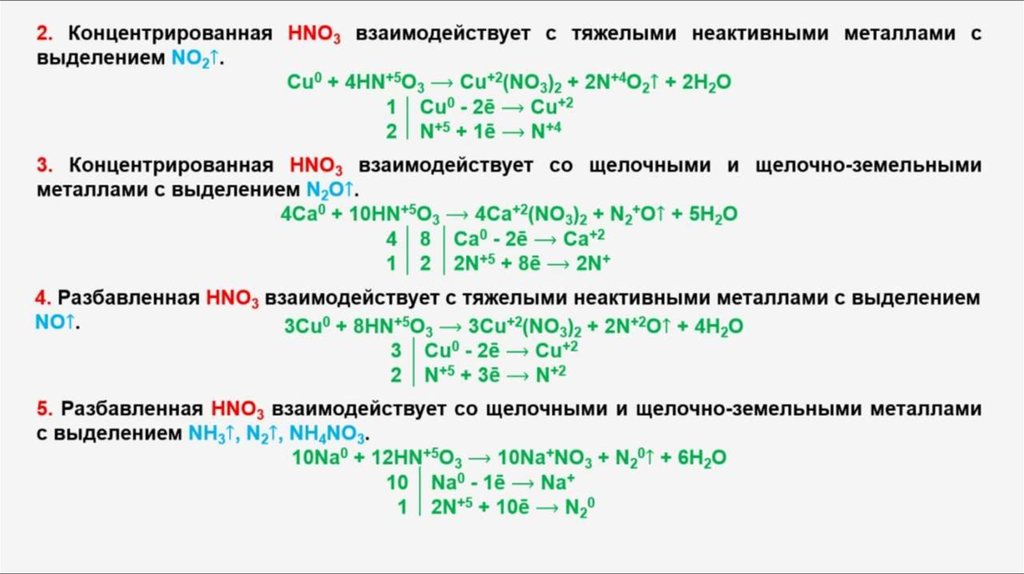 Вы спрашиваете его, сколько он принес, и он отвечает. Я не могу вспомнить. Вы взвешиваете яйца и обнаруживаете, что они весят 62,1 г. Предположим, что среднее яйцо весит 34,21 г. а. Какое количество масла необходимо для реакции со всеми яйцами? б. Какое количество куки можно сделать? в. Что у вас останется, яйца или масло? д. Какое количество осталось?
Вы спрашиваете его, сколько он принес, и он отвечает. Я не могу вспомнить. Вы взвешиваете яйца и обнаруживаете, что они весят 62,1 г. Предположим, что среднее яйцо весит 34,21 г. а. Какое количество масла необходимо для реакции со всеми яйцами? б. Какое количество куки можно сделать? в. Что у вас останется, яйца или масло? д. Какое количество осталось?
arrow_forward
Цианогенный газ C2N2 был обнаружен в газах космического пространства. Он может реагировать с фтором с образованием четырехфтористого углерода и трехфтористого азота. C2N2(г)+7F2(г)2CF4(г)+2NF3(г)(а) Сколько молей фтора вступает в реакцию с 1,37 моль циана? б) Сколько молей CF4 получается из 13,75 моль фтора? в) Сколько молей циана требуется для получения 0,8974 моль NF3? г) Сколько молей фтора даст 4,981 моль трифторида азота?
arrow_forward
Метан, глава 5, горит в кислороде. а) Какие продукты реакции? б) Напишите уравнение реакции. в) Какая масса О2 в граммах требуется для полного сгорания 25,5 г метана? г) Какова общая масса продуктов сгорания 25,5 г метана?
arrow_forward
Пропан, C3H8, является предпочтительным топливом для газового барбекю. При сжигании сбалансированное уравнение C3H8+5O23CO2+4h3O a Что является ограничивающим реагентом при приготовлении пищи на газовом гриле? b Если гриль не зажигается, а вы знаете, что у вас есть достаточный поток пропана к горелке, какой ограничивающий реагент? c При использовании газового гриля иногда можно увеличить газ до такой степени, что пламя становится желтым и дымным. С точки зрения химической реакции, что происходит?
При сжигании сбалансированное уравнение C3H8+5O23CO2+4h3O a Что является ограничивающим реагентом при приготовлении пищи на газовом гриле? b Если гриль не зажигается, а вы знаете, что у вас есть достаточный поток пропана к горелке, какой ограничивающий реагент? c При использовании газового гриля иногда можно увеличить газ до такой степени, что пламя становится желтым и дымным. С точки зрения химической реакции, что происходит?
arrow_forward
Борнит (Cu3FeS3) — медная руда, используемая в производстве меди. При нагревании происходит следующая реакция: 2Cu3FeS3(т)+7O2(г)6Cu(т)+2FeO(т)+6SO2 Если 2,50 метрических тонны борнита вступают в реакцию с избытком О2 и в процессе получается 86,3% меди, какая масса меди получается?
arrow_forward
У вас есть химическое вещество в герметичном стеклянном контейнере, наполненном воздухом. Установка находится на балансе, как показано ниже. Химическое вещество воспламеняется с помощью увеличительного стекла, фокусирующего солнечный свет на реагенте. Что из следующего верно после того, как химическое вещество полностью сгорело? Поясните свой ответ. а. Баланс покажет менее 250,0 г. б. Баланс покажет 250,0 г. в. Баланс покажет более 250,0 г. д. Невозможно определить, не зная идентичности химического вещества.
Что из следующего верно после того, как химическое вещество полностью сгорело? Поясните свой ответ. а. Баланс покажет менее 250,0 г. б. Баланс покажет 250,0 г. в. Баланс покажет более 250,0 г. д. Невозможно определить, не зная идентичности химического вещества.
arrow_forward
При сгорании жидкого хлорэтилена C2h4Cl образуются двуокись углерода, пар и газообразный хлористый водород. а) Напишите уравнение реакции. б) Сколько молей кислорода потребуется для реакции с 35,00 г хлорэтилена? в) Если 25,00 г хлорэтилена прореагируют с избытком кислорода, сколько граммов каждого продукта образуется?
arrow_forward
Рассмотрим гипотетическую реакцию между A2 и AB, изображенную ниже. Что такое сбалансированное уравнение? Если 2,50 моля А2 прореагируют с избытком АВ, какое количество (молей) продукта образуется? Если масса АВ равна 30,0 ед, а масса А2 равна 40,0 ед, какова масса продукта? Если в реакцию вступает 15,0 г АБ, то какая масса А2 потребуется, чтобы прореагировать со всем АБ, и какая масса продукта образуется?
arrow_forward
Напишите уравнение из следующего описания: реагенты — газообразные Nh4 и O2, продукты — газообразный NO2 и жидкий h3O, стехиометрические коэффициенты равны 4, 7, 4 и 6 соответственно.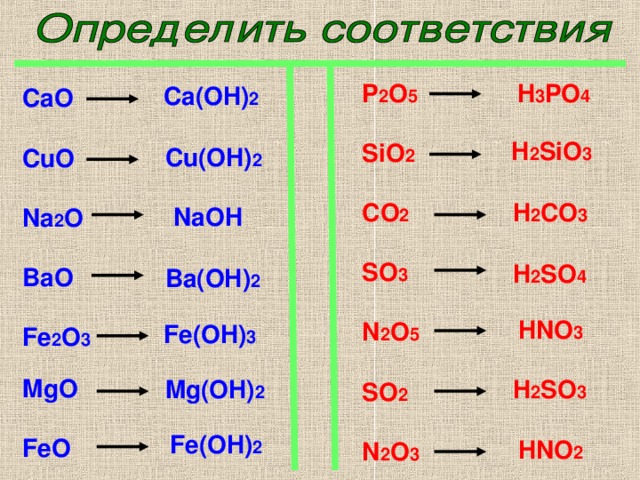
ARROW_FORWARD
ARROW_BACK_IOS
См. Больше вопросов
8._FORBIOR.0019 Chemistry Chemistry ISBN:9781133611097 Author:Steven S. Zumdahl Publisher:Cengage Learning Chemistry Chemistry ISBN:9781305957404 Author:Steven S. Zumdahl, Susan A. Zumdahl , Дональд Дж. ДеКосте Издатель: Cengage Learning Chemistry: An Atoms First Approach Chemistry ISBN:9781305079243 Автор:Steven S. Zumdahl, Susan A. Zumdahl Издатель: Cengage Learning. , Даррелл Эббинг, Стивен Д. Гэммон, Даррелл Д., Гэммон, Эббинг, Стивен Д. Гэммон, Даррелл Издатель: Cengage Learning Химия: принципы и реакции Химия ISBN: 978130507 Автор: Уильям Л. Издатель: Cengage Learning Chemistry & Chemical Reactivity Chemistry ISBN:9781337399074 Автор: John M. Konds Towns, John M. Treichel Towns Treichel Издатель: Cengage Learning Мастертон, Сесиль Н. Херли
Мастертон, Сесиль Н. Херли
Химия
Химия
ISBN: 9781133611097
Автор: Steven S. Zumdahl
Publisher: Cengage Learning
3440
9090
49090490909090909090909090
4909090909090909090900019
Химия
ISBN: 9781305957404
Автор: Стивен С. Зумдаль, Сьюзан А. Зумдаль, Дональд Дж. Декосте
. Автор: Стивен С. Зумдал, Сьюзан А. Зумдал
Издатель: Cengage Learning
Общая химия — отдельная книга (MindTap Cour.

 Реакция нитрования выглядит следующим образом:
Реакция нитрования выглядит следующим образом: