Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука
| Похожие вопросы |
Решено
Если два художника могут разрисовать 2 комнаты, за 2 часа. . Сколько художников надо, чтобы разрисовать 18 комнат за 6 часов.. И подробно обьснить решение
. Сколько художников надо, чтобы разрисовать 18 комнат за 6 часов.. И подробно обьснить решение
Чаша,яка повністю заповнена водою,важить девять кілограмів,а наполовину—як дві порожні чаші.Скільки кілограмів важить порожня чаша?
Тонкая собирающая линза диаметром D 2 см имеет фокусное расстояние F1 10 см. Вдоль ее оптической оси просверлили круглое отверстие диаметром d 1см и
написать сочинение рассуждение ,раскрывая смысл высказывания известного русского лингвиста Валентины Даниловны Черняк:»в сложном предложении отражаются отношения ,которые говорящий усматривает
На экзамене 20 билетов, Андрей не выучил 1 из них. Найдите вероятность того, что ему попадется выученный билет
Пользуйтесь нашим приложением
Подборка полезной теории по химии
Химия — предмет, который сдают будущие медики, биологи и технологи. Многие считают его непонятным, но если разобраться в основах, писать реакции и решать задачи будет несложно. Этому учат на курсах подготовки к ЕГЭ. Там преподаватели начинают с нуля и доходят до самых сложных тем. В этой статье мы разберем теорию по ЕГЭ, которую должен знать каждый старшеклассник.
Этому учат на курсах подготовки к ЕГЭ. Там преподаватели начинают с нуля и доходят до самых сложных тем. В этой статье мы разберем теорию по ЕГЭ, которую должен знать каждый старшеклассник.
Соли
Соли — первая часть теории по химии для подготовки к ЕГЭ. Способы получения солей:
- кислотный оксид + основный оксид: SO3 + Na2O → Na2SO4;
- основание + кислота: HCl + NaOH → NaCl + h3O;
- кислота + основный или амфотерный оксид: 2HCl + CuO → CuCl2 + h3O;
- основание + кислотный оксид: CO2 + Cu(OH)2 → CuCO2 + 2h3O;
- кислота + соль: CaCO3 + h3SO4 → CaSO4 + 2h3O + CO2;
- окисление оксидов: 2Na2SO3 + O2 → 2Na2SO4;
- металл + неметалл: Ca + S → CaS;
- металл + кислота: Fe + 2HCl → FeCl2 + h3.
Следующая часть теории по химии по солям — химические свойства:
- диссоциация: CaCl2 → Ca2+ + 2Cl–;
- с кислотными и амфотерными оксидами: K2CO3 + SiO2 → K2SiO3 + CO2↑;
- c кислотами: KCl + h3SO4 → K2SO4 + HCl;
- с щелочами: CuSO4 + 2KOH → Cu(OH)2 + K2SO4;
- с солями: CuSO4 + BaCl2 → BaSO4↓+ CuCl2;
- с металлами, более активными чем металл соли: CuSO4 + Fe → FeSO4 + Cu;
- разложение: 2AgNO3 → 2Ag +2NO2 + O2;
- окисление: 2KI— + 2Cu+2Cl2 → 2KCl + 2Cu+Cl + I20.

Кислоты
Первая часть теории по кислотам в химии — способы получения:
- кислотный оксид + вода: SO3 + h3O → h3SO4;
- неметалл + водород: h3 + Cl2 → 2HCl;
- электролиз солей: 2CuSO4 + 2h3O → 2Cu + 2h3SO4 + O2;
- кислота + соль: CaCO3 + h3SO4 → CaSO4 + 2h3O + CO2;
- окисление оксидов: P + 5HNO3 → h4PO4 + 5NO2 + h3O.
Вторая часть теории по кислотам — химические свойства:
- диссоциация: HCl → H+ + Cl–;
- с основаниями и амфотерными гидроксидами: Cu(OH)2 + 2HBr → CuBr2 + 2h3O;
- с основными и амфотерными оксидами: CuO + 2HBr → CuBr2 + h3O;
- окисление: 2HI— + 2Cu+2Cl2 → 2HCl + 2Cu+Cl + I20;
- с солями: CaCO3 + 2HCl → CaCl2 + h3O + CO2;
- с металлами, стоящими в ряду активности до водорода: Fe + 2HCl → FeCl2 + h3;
- разложение при нагревании: 2HNO2 → NO + h3O + NO2.
Основания
Теория по химии по основаниям включает в себя способы получения:
- основные оксиды + вода: Na2O + h3O → 2NaOH;
- металл + вода: 2K + 2h3O → 2KOH + h3;
- электролиз некоторых солей щелочных металлов: 2NaCl + 2h3O → 2NaOH + h3↑ + Cl2↑;
- щелочь + соль: CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl.

Далее разберем теорию по химическим свойствам оснований. Первая реакция относится ко всем типам, остальные — только к щелочам:
- с кислотами: NaOH + h4PO4 → Nah3PO4 + h3O;
- с амфотерными оксидами и гидроксидами в расплаве: NaOH + Al(OH)3 → NaAlO2 + 2h3O. И в растворе: NaOH + Al(OH)3 → Na[Al(OH)4];
- с кислотными оксидами: 2NaOH + CO2 → Na2CO3 + h3O;
- с солями: CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4;
- с металлами: 2Al + 2NaOH + 6h3O → 2Na[Al(OH)4] + 3h3;
- с неметаллами: 2NaOH +Cl2 → NaCl + NaClO + h3O.
Оксиды
Теорию по химии по оксидам мы начнем изучать со способов получения:
- окисление металлов: 4Al + 3O2 → 2Al2O3;
- окисление неметаллов: S + O2 → SO2;
- окисление бинарных соединений: 4FeS2 + 11O2 → 2Fe2O3 + 8SO2;
- разложение гидроксидов: h3SO3 → h3O + SO2;
- разложение солей при нагревании: Li2CO3 → CO2 + Li2O.
Теорию по химическим свойствам разных типов оксидов представим в таблице:
|
Основные |
Амфотерные |
Кислотные |
|
Al2O3 + 6HCl → 2AlCl3 + 3H2O |
Na2O + SO2 → Na2SO3 |
SO3 + H2O → H2SO4 |
|
CaO + H2O → Ca(OH)2 |
Al2O3 + 2NaOH → 2NaAlO2 + H2O ZnO + 2NaOH + H2O → Na2[Zn(OH)4] |
3SO3 + Al2O3 → Al2(SO4)3 |
|
K2O + Al2O3 → 2KAlO2 |
Al2O3 + Na |
SO3 + CuO → CuSO4 |
|
CaO + 3C → CaC2 + CO |
Na2CO3 + Al2O3 → 2NaAlO2 + CO2 |
CaCO3 + SiO2 → CaSiO3 + CO2 |
|
3ZnO + 2Al → Al2O3 + 3Zn |
2SO2 + O2 → 2SO3 | |
|
4FeO + O2 → 2Fe2O3 |
Электролиз растворов солей
Следующий важный раздел — теория электролиза по химии. Электролиз — процессы окисления и восстановления, которые происходят при пропускании тока. Если рассматриваются растворы, то вода часто участвует в реакции. Варианты катодных процессов:
Электролиз — процессы окисления и восстановления, которые происходят при пропускании тока. Если рассматриваются растворы, то вода часто участвует в реакции. Варианты катодных процессов:
- если металл активный (до Al включительно в ряду напряжения), то восстанавливается водород, образуется щелочная среда: 2h3O + 2ē → h3 + 2OH—;
- если металл средней активности (от Al до h3), то восстанавливаются и водород, и металл: Fe2+ + 2ē → Fe0 и 2H+2O +2ē → h30 + 2OH—;
- если металл неактивный (после водорода), то восстанавливается только он: Cu2+ + 2ē → Cu0.
Анодные процессы при электролизе:
- кислотный остаток, не содержащий кислорода: 2Cl— – 2ē → Cl20;
- в случае кислотного остатка, содержащего кислород, или иона F— окисляется вода: 2h3O-2 – 4ē → O20 + 4H+;
- окисление гидроксид-иона: 4O-2H– – 4ē → O20 + 2h3O;
- в случае с остатком карбоновой кислоты окислению подвергается углерод: 2Ch4C+3OO– –2ē → 2C+4O2+ Ch4-Ch4.

Пример написания суммарной реакции электролиза:
- 2Cu2+SO4 + 2h3O-2 → 2Cu0 + 2h3SO4 + O20
- Катод (–): 2H+2O +2ē → h30 + 2OH–
- Анод (+): 2Cl– – 2ē → Cl20
Гидролиз солей
Последняя тема по химии — гидролиз солей, то есть реакция с водой. Он идет в тех случаях, когда ионы соли способны образовать с ионами H+ и OH— (они получаются при диссоциации воды) малорастворимые электролиты. Из этого следует, что соли, образованные сильным основанием и сильной кислотой (например, NaCl), не гидролизуются. Существуют необратимые реакции, но они в школьном курсе не рассматриваются. Как правило, они связаны с взаимным гидролизом нескольких солей. Рассмотрим теорию по обратимому гидролизу для ЕГЭ по химии. В этом случае гидролиз идет по слабому месту. Если это кислота, то по аниону, а если основание — по катиону. В случае, когда обе части соли являются «слабыми», гидролиз идет и по катион
- соль образована сильным основанием и слабой кислотой.
 Гидролиз идет по аниону: Ch4COONa + HOH ↔ Ch4COOH + NaOH;
Гидролиз идет по аниону: Ch4COONa + HOH ↔ Ch4COOH + NaOH; - соль образована слабым основанием и сильной кислотой. Реакция идет по катиону: Nh5Cl + HOH ↔ Nh5OH + HCl;
- соль образована слабым основанием и слабой кислотой. Гидролиз идет и по аниону, и по катиону, среда ближе к нейтральной: Ch4COONh5 + HOH ↔ Ch4COOH + Nh5OH.
Мы разобрали основные классы неорганических соединений, а также гидролиз и электролиз в химии. Надеемся, что эта шпаргалка поможет вам подготовиться и сдать ЕГЭ. Но не забывайте о важности фундаментальных знаний, которые можно получить в школе или на курсах. Мы уверены, что у вас все получится, и вы обязательно поступите в вуз мечты.
Калькулятор эмпирических формул для ионных соединений
AlleBilderVideosBücherMapsNewsShopping
suchoptionen
Калькулятор химических названий
www.omnicalculator.com необходимость запоминать терминологию (или, по крайней мере, всю ее). Если вы когда-нибудь задумывались …
Если вы когда-нибудь задумывались …
Калькулятор эмпирических формул — ezcalc.me
ezcalc.me › калькулятор эмпирических формул
Онлайн-калькулятор эмпирических формул находит эмпирическую формулу, соответствующую данному химическому составу соединения.
Онлайн-калькулятор ионной химической формулы — Снижение риска бедствий
drr.ikcest.org › приложение
Ионная химическая формула онлайн-калькулятор … Описание приложения. На основе элемента и формулы в приведенной ниже таблице указано название синтетического химического вещества …
Калькулятор эмпирических формул — Факультет естественных наук
scilearn.sydney.edu.au › химия › калькуляторы
09.12.2009 · Введите атомные символы и процентные массы для каждого из присутствующих элементов и нажмите «рассчитать», чтобы вычислить эмпирическую формулу.
Ähnliche Fragen
Как найти эмпирическую формулу ионного соединения?
Могут ли ионные соединения иметь эмпирические формулы?
Какова эмпирическая формула не менее 4 ионных соединений?
Как найти молекулярную формулу из калькулятора эмпирических формул?
Калькулятор эмпирических формул
calculate-online. net › Калькулятор эмпирических формул
net › Калькулятор эмпирических формул
Онлайн-калькулятор эмпирических формул позволяет найти эмпирическую формулу, соответствующую заданному химическому составу.
Формула для вычисления числа… · Как найти эмпирическую формулу…
Калькулятор ионной формулы — Byjus
byjus.com › Калькуляторы › Математические калькуляторы
В химии ионное соединение определяется как химическое вещество соединение, состоящее из ионов, удерживаемых вместе электростатической силой, известной как ионная …
Калькулятор эмпирической формулы — ChemicalAid
www.chemicalaid.com › инструменты › эмпирическая формула
Для расчета эмпирической формулы введите состав (например, C=40%, H=6,67%, O=53,3%) сложный. Введите необязательную молярную массу, чтобы найти молекулярную …
Как найти эмпирическую формулу гидратированного ионного соединения
www.youtube.com › смотреть
13.07.2020 · Этот видеоурок по химии посвящен гидратам. Это объясняет, как найти эмпирическую формулу …
Это объясняет, как найти эмпирическую формулу …
Dauer: 5:33
Прислан: 13.07.2020
Aleks Предсказание формулы ионных соединений с… — YouTube
www.youtube.com › смотреть
06.08.2018 многоатомное ионное соединение из его эмпирической формулы. Webster …
Dauer: 5:58
Прислан: 06.08.2018
Калькулятор молекулярной массы (молярная масса) — Lenntech
www.lenntech.com › калькуляторы › молекулярная масса…
выберите один из следующих двух вариантов-списков, который содержит ряд общих органических соединений (включая их химическую формулу) и все …
Anzeige·www.wolframalpha.com/
Бесплатные химические калькуляторы — от соединений к реакциям
Исследуйте химические соединения, уравновешивайте реакции, стройте точечные структуры Льюиса, находите растворимость. Элементы. Соединения. Ионы. Решения. Реакции. Облигации. Молярность. Количество. Структуры.
Pro для студентов · Цены для студентов Pro · Научные калькуляторы · Пошаговая химия · Carbon
Ähnlichesuchanfragen
Калькулятор ионного соединения катиона и аниона
Empirical formula of ionic compound
Chemical formula Calculator
Mass calculator
Ionic compound formula
Molecular weight calculator
Ionic formula Calculator
Compound name generator
pb-hco3-2 — Google Suche
AlleBilderVideosShoppingMapsNewsBücher
suchoptionen
Tipp: Begrenze diesuche auf deutschsprachige Ergebnisse. Du kannst deinesuchsprache in den Einstellungen ändern.
Du kannst deinesuchsprache in den Einstellungen ändern.
Молярная масса Pb(HCO3)2
de.webqc.org › молекулярная масса Pb(HCO3)2
… Молярная масса Pb(HCO3)2 )2 составляет 329,2337 г/моль. Berechnen Sie das Gewicht von Pb(HCO3)2 или Mol …
Pb + O2 + h3O + CO2 = Pb(HCO3)2 — Chemischer Gleichungs …
уравнение=Pb+++O2+++…
Химический анализ или реакция Pb + O2 + h3O + CO2 = Pb(HCO3)2 с учетом результатов поиска!
Pb(HCO3)2 — Гидрокарбонат свинца(II) — EndMemo
www.endmemo.com › Химия
Наименование: Гидрокарбонат свинца(II); Псевдоним: Свинцово-водородный карбонат; свинца(II) бикарбонат; Формула: Pb(HCO3)2 ; Молярная масса: 329,2337.
Как написать формулу бикарбоната свинца (II) — YouTube
www.youtube.com › смотреть
09.12.2020 · В этом видео мы напишем правильную формулу бикарбоната свинца (II) (Свинец (II) водород …
Dauer: 1:17
Прислан: 12. 09.2020
09.2020
Как сбалансировать Pb(HCO3)2 + HCl = PbCl2 + h3O + CO2 — YouTube
m.youtube.com › смотреть
· Как сбалансировать чтобы сбалансировать Pb(HCO3)2 + HCl = PbCl2 + h3O + CO2. 150 просмотров · 10 месяцев назад …подробнее …
Dauer: 1:37
Прислан: 01.04.2022
Реакция h3O (nước) реагирует с CO2 (Cacbon dioxit) и PbCO3 (Chì cacbonat) с образованием Pb (HCO3 )2 (Chì (II) hidro cacbonat) Реакция, в результате которой образуется вещество …
[PDF] Merkblatt zum sinnvollen Aufstellen von Formeln chemischer …
www.gymnasium-pegnitz.de › wp-content › uploads › 2018/11 › che…
gefunden werden; Daher muss die Formel Ca3(PO4)2 состоит из: 3 Ca2+ + 2 PO4. 3-. → Da Blei-Kationen Pb. 4+ vierwertig sind, muss die Формаль Pb3(PO4)4 sein: 3 …
Карбонат свинца — Википедия
en.wikipedia.org › wiki › Lead_carbonate
Карбонат свинца(II) – это химическое соединение с химическая формула PbCO 3 .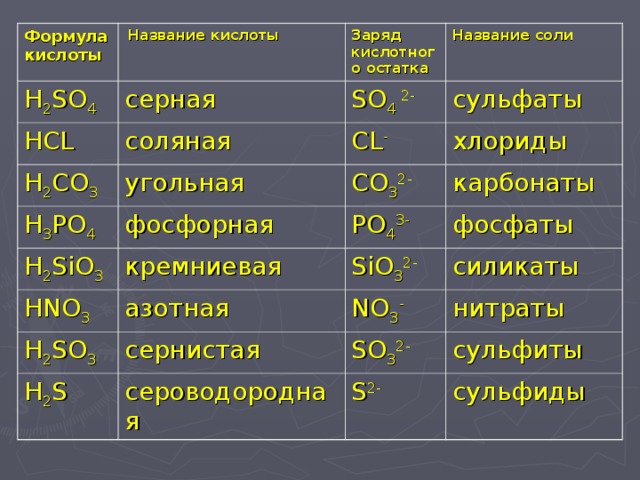

 12.16
12.16


 Гидролиз идет по аниону: Ch4COONa + HOH ↔ Ch4COOH + NaOH;
Гидролиз идет по аниону: Ch4COONa + HOH ↔ Ch4COOH + NaOH;