Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
В каком году была сформулирована теория — предшественница кислородной теории горения.
Решено
1)На нейтрализацию предельной органической карбоновой кислоты массой 4,8 г потребовался раствор объемом 16,95 мл (плотность = 1,18 г/моль) с массовой долей КОН 22,4%. Определите формулу кислоты.
Решено
1) решить цепочку N2—>NO—>NO2—>HNO3—>Nh4 2) HNO3—>NO2 3) HNO3—>Ca(NO3)2 4) N2—>Nh4—>(Nh5)2SO—>Nh4—>N2 5) Nh4—>NO
Решено
Оксид алюминия реагирует с каждым из двух веществ 1) Na2O и h3O 2) SiO2 и Ag 3) NaOH и HCl 4) HNO3 и O2
Пользуйтесь нашим приложением
Задания по теме «Окислительно-восстановительные реакции»
1. KMnO4 + … → N2 + MnO2 + KOH + … .
KMnO4 + … → N2 + MnO2 + KOH + … .
2. Zn + KMnO4 + … → MnSO4 + … + … + h3O
3. MnO + KClO3 + … → K2MnO4 + … +h3O
4. MnO2 + … + K2CO3 → KNO2 + K2MnO4 + … .
5. h4PO3 + KIO3 + … → … + I2 + K2SO4 + h3O
6. NaHS + MnO2 + … → … + S + NaNO3 + h3O
7. MnO2 + … + h3SO4 → I2 + … + K2SO4 + h3O
8. SO2 + HMnO4 + … → … + MnSO4
9. AlP + HNO3 → h4PO4 + … + … + h3O
10. h3O2 + HIO3 → I2 + … + … .
11. Cl2 + I2 + … → HIO3 +… .
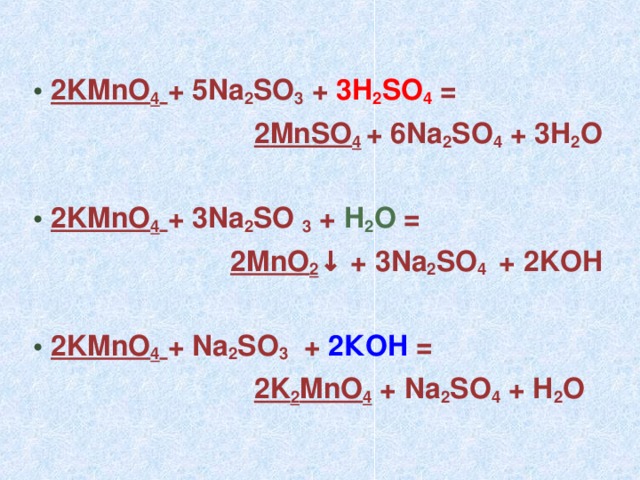
12. Na2SO3 + KMnO4 + … → … + MnO2 + KOH
13. FeCl2 + K2Cr2O7 + … → FeCl3 + … +… + h3O
14. FeCl3 + Cl2 + … → KCl + … + h3O
15. Cr(NO3)3 + O3 + … → K2CrO4 + … + h3O
16. FeCl2 + … → … + NO + HCl + h3O
17. CrCl2 + … → … + SO2 + HCl + h3O
18. MnSO4 + O3 + … → K2MnO4 + … + h3O
19. CrCl2 + K2Cr2O7 + … → CrCl3 + … + h3O
20. CrCl3+ Cl2 + … → K2CrO4 + h3O
21. Nh4 + KMnO4 + … → … + K2MnO4 + h3O
22. NaClO3 + MnO2 + … → Na2MnO4 + NaCl +…
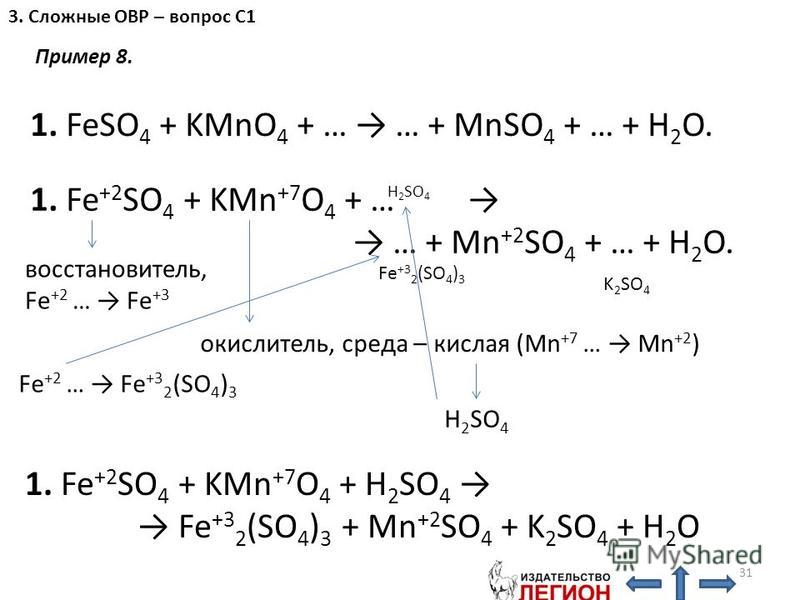
23. FeSO4 + KClO3 +… → Fe2(SO4)3 + … + h3O
24. Si + … + HF → h3SiF6 + NO + …
Si + … + HF → h3SiF6 + NO + …
25. K2S + h3O + KBrO4 → S+ KBr +…
26. KNO3 + Mg + h3O → Nh4 + Mg(OH)2 + …
27. HClO3 + FeSO4 + h3SO4 → HCl + … + …
28. h3O2 + … + NaOH → Na2CrO4 + Na2SO4 + …
29. Na2SO3 + KIO3 + … → K2SO4 + … + … + h3O
30. K2Cr2O7 + … + h3O → Cr(OH)3 + Na2SO4 +…
31. FeSO4 + KMnO4 + … → … + K2MnO4 + K2SO4
32. P2O3 + h3Cr2O7 + … → h4PO4 + CrPO4
33. KIO3 + … + h3SO4 → I2 + K2SO4 + …
34. KMnO4 + MnSO4 + h3O → MnO2 + … + …
35. KNO2 + K2Cr2O7 + … → … + Cr(NO3)3 + h3O
36. NO + HBrO4 + … → HNO3 + Br2
37. Ph4 + KMnO4 + … → MnSO4 + … + … + …
38. KNO2 + … + h3SO4 → N2 + FeCl3 + … + … + h3O
39. NO2 + P2O3 + … → NO + K2HPO4 + …
40. NO + KClO + … → KNO3 + KCl +…
41. HCOH + KMnO4 + … → CO2 + K2SO4 + … +…
42. FeSO4 + KMnO4 + … → … + MnSO4 + K2SO4 + h3O
43. Cr2O3 + … + KOH → K2CrO4 + KNO2 +…
44. KNO2 + KMnO4 + … → KNO3 + MnCl2 + … + h3O
45. Cu + … + h3SO4 → NO2 + … + Na2SO4 + h3O
46. NaBrO3 + … + NaOH → NaF + NaBrO4 + …
NaBrO3 + … + NaOH → NaF + NaBrO4 + …
47. Cr2(SO4)3 + … + KOH → … + KCl + K2SO4 + …
48. CrCl2 + h3SO4 → Cr2(SO4)3 + … + HCl +…
49. KNO2 + KI +… → NO + K2SO4 + h3O + …
50. NaNO3+ Cu +… → … + Na2SO4 + NO2 + h3O
51. KMnO4 + … → MnO2 + N2 + … + …
52. FeSO4 + h3O2 + h3SO4 → … + …
53. SO2 + K2Cr2O7 + … → K2SO4 + … + h3O
54. Na2O2 + FeSO4 + … → Fe2(SO4)3 + Na2SO4 + …
55. SO2 + KMnO4 + … → MnSO4 + … + h3SO4
56. FeSO4 + h3SO4 + MnO2 → Fe2(SO4)3 + … + …
57. NaMnO4 + Na2SO3 + … → Na2MnO4 + … + h3O
58. KMnO4 + K2S + h3O → … + … + KOH
59. h3S + K2Cr2O7 + h3SO4 → … + … + … + …
60. h3O2 + Na3[Cr(OH)6] → … + h3O + NaOH
61. NaI + h3SO4 (конц) → … + h3S + Na2SO4 + …
62. NaBr + NaBrO3 + … → … + Na2SO4 + h3O
63. AgNO3 + Ph4 + … → Ag + … + HNO3
64. Na2SO3 + Zn + … → h3S + … + NaCl + … + h3O
65. KClO3 + … + h3SO4 → I2 + … + KCl + h3O
66. KNO2 + … + HCl → MnCl2 + … + KCl + h3O
67. CrCl2 + … → Cr(NO3)3 + … + NO2 + h3O
CrCl2 + … → Cr(NO3)3 + … + NO2 + h3O
68. Mg + KMnO4 + … → K2SO4 + … + … + h3O
69. K2MnO4 + … → MnBr2 + Br2 + … + h3O
70. NaNO2 + CrO3 + … → Cr2(SO4)3 + … + h3O
71. Na2SO3 + Mg + … → h3S + … + NaCl + h3O
72. Ph4 + CrO3 + h3SO4 → h4PO4 + … + …
73. P2O3 + K2CrO4 + … → h4PO4 + … + KCl + …
74. NaClO3 + MnO2 + … → Na2MnO4 + … + h3O
75. Cr2O3 + KBrO3 + … → … + CO2 + Na2CrO4
76. HNO3(конц.) + … → Fe(NO3)3 + HCl + … + h3O
77. h3O2 + Br2 + … → O2 + NaBr + …
78. KClO3 + … + Na2SO3 → Cl2 + K2SO4 + … + h3O
79. KClO2 + h3SO4 + … → KClO3 + MnSO4 + … + h3O
80. CrCl2 + h3SO4 (конц.) → Cr2(SO4)3 + … + HCl + …
81. FeSO4 + KMnO4 + … → Fe2(SO4) 3 + … + … + h3O
82. NO + KClO + … → KNO3 + … + h3O
83. K2Cr2O7 + KNO2 + … → Cr(NO3)3 + … + h3O
84. Cr2(SO4)3 + Н2О2 … → Na2CrO4 + Na2SO4 + …
85. MnO + KClO3 + … → K2MnO4 + … + …
86. KClO3 + … + Na2SO3 → Cl2 + K2SO4 + … + h3O
87. NaCrO2 + … + NaOH → … + NaBr + …
NaCrO2 + … + NaOH → … + NaBr + …
Нанопроволоки MnO2-Ir, сочетающие сверхмалые размеры наночастиц с улучшенной активностью в отношении реакции восстановления кислорода
Autores
1 Pereira, F.S.; 2 Лима, S.L.S.; 3 Танака, А.А.; 4 Гарсия, Массачусетс; 5 Сильва, А.Г.М.
Резюме
Настоящее исследование показывает, что можно достичь высокой каталитической активности к ORR с использованием наночастиц Ir размером 1,8 ± 0,7 нм, нанесенных на Поверхность нанопроволок MnO2 при низких нагрузках металлов (1,2 мас.%). Интересно, мы наблюдали, что наногибрид MnO2-Ir проявляет высокую каталитическую активность для ORR близок к коммерческому Pt/C (20,0 мас.% Pt), что указывает на возможность получения эффективная работа с использованием простой синтетической процедуры.
Палаврас чавес
Двуокись марганца; иридий; ORR
Introdução
Как правило, ORR в основном происходит двумя путями, один из которых включает передачу
из двух электронов (2e− ORR), образующих h3O2, а другой, состоящий из
перенос четырех электронов (4e- ORR), в результате чего образуется h3O [1]. Поэтому разработка электрокатализаторов для прохождения этого пути имеет решающее значение для
оптимальные электрохимические характеристики топливных элементов. Тем не менее, пределы ORR
производительность многих электрохимических устройств из-за его вялой кинетики,
что приводит к значительным перенапряжениям, что приводит к значительным потерям в
энергоэффективность; таким образом, дизайн наноматериалов на основе переходных металлов
распространенный [2, 3]. Диоксид марганца (MnO2) является многообещающим кандидатом в качестве
электрокатализатора для ORR, потому что, помимо низкой стоимости, связанной с
обилие в виде природных руд, обладает экологичностью, низким
токсичность и различные степени окисления [4]. Однако ее основным ограничением является
низкая электронная проводимость, неблагоприятная для быстрых электронов
перенос в ходе электрохимического процесса [5]. Стратегия решения MnO2
низкая электронная проводимость заключается в отложении небольших количеств (<2,0 мас.
Поэтому разработка электрокатализаторов для прохождения этого пути имеет решающее значение для
оптимальные электрохимические характеристики топливных элементов. Тем не менее, пределы ORR
производительность многих электрохимических устройств из-за его вялой кинетики,
что приводит к значительным перенапряжениям, что приводит к значительным потерям в
энергоэффективность; таким образом, дизайн наноматериалов на основе переходных металлов
распространенный [2, 3]. Диоксид марганца (MnO2) является многообещающим кандидатом в качестве
электрокатализатора для ORR, потому что, помимо низкой стоимости, связанной с
обилие в виде природных руд, обладает экологичностью, низким
токсичность и различные степени окисления [4]. Однако ее основным ограничением является
низкая электронная проводимость, неблагоприятная для быстрых электронов
перенос в ходе электрохимического процесса [5]. Стратегия решения MnO2
низкая электронная проводимость заключается в отложении небольших количеств (<2,0 мас.
Материал и методы
Синтез нанопроводов MnO2
В типичной процедуре MnSO4·h3O и KMnO4 растворяли в деионизированной воде.
Этот раствор переносили в автоклав из нержавеющей стали с тефлоновым покрытием, который
нагревали и перемешивали, а затем давали остыть до комнатной температуры.
нанопроволоки несколько раз промывали этанолом и водой путем центрифугирования и
удаление супернатанта и окончательное высушивание на воздухе.
Синтез нанопроволок MnO2, декорированных НЧ Ir (НЧ MnO2–Ir)
К ЭГ добавляли нанопроволоки MnO2 и поливинилпирролидон (ПВП). Полученный
суспензию переносили в круглодонную колбу и выдерживали при энергичном
перемешивание. Затем в смесь последовательно добавляли растворы NaBh5 и IrCl3–.
реакционная колба. Эту смесь выдерживали при интенсивном перемешивании для получения MnO2–
IrNP и промывают этанолом и водой путем циклов центрифугирования и удаления.
Результаты и обсуждение
На рис. 1 представлены СЭМ и ПЭМ изображения ультрамалых НЧ Ir, осажденных на MnO2.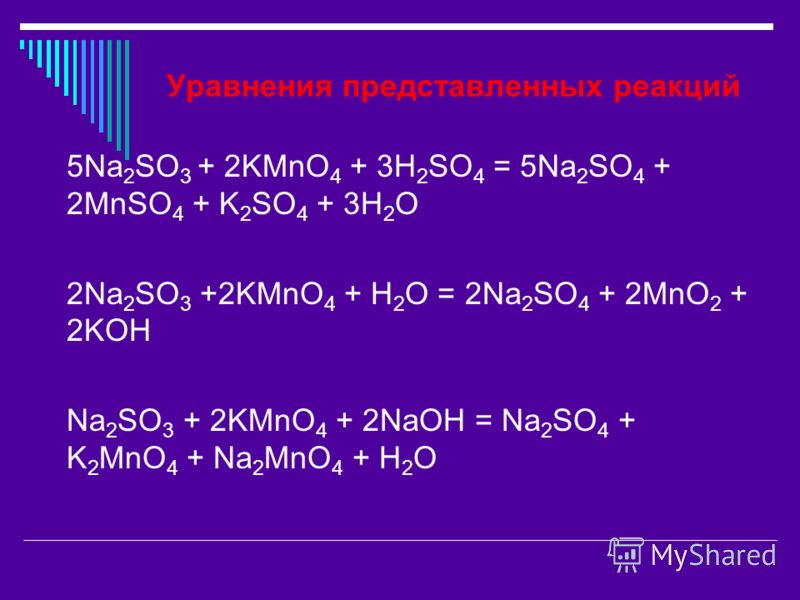 нанопроволоки. Равномерное распределение монодисперсных ультрамалых НЧ с узким
распределения по размерам по всей поверхности нанопроволоки с размером частиц
1,8 ± 0,7 нм. Кольцевые изображения в темном поле под большим углом и сканирующая передача
анализы электронной микроскопии были выполнены для дальнейшего изучения структуры
и распределения элементов Mn, O и Ir в MnO2, украшенных НЧ Ir.
Изображения STEM в светлом поле (рис. 1C) и HAADF-STEM (рис. 1D) иллюстрируют
равномерное распределение сверхмалых НЧ Ir на подложке из нанопроволок MnO2. Нет
обнаружена значительная агломерация. Кроме того, элементное картирование STEM-EDS
(Рисунок 1E) подтвердил равномерное отложение ультрамалых НЧ Ir ультрамалых размеров.
НЧ Ir на внешней поверхности нанопроволок MnO2. Отсутствие морфологических изменений в
форма нанопроволок может быть обнаружена после осаждения НЧ Ir.
Когда нанопроволоки MnO2 и электрокатализатор MnO2-Ir сравнивали с
коммерческий электрокатализатор Pt/C, можно заметить, что нанопроволоки MnO2-Ir
представил более низкий начальный потенциал и более высокий предельный ток, показывая его
невероятная эффективность (рис.
нанопроволоки. Равномерное распределение монодисперсных ультрамалых НЧ с узким
распределения по размерам по всей поверхности нанопроволоки с размером частиц
1,8 ± 0,7 нм. Кольцевые изображения в темном поле под большим углом и сканирующая передача
анализы электронной микроскопии были выполнены для дальнейшего изучения структуры
и распределения элементов Mn, O и Ir в MnO2, украшенных НЧ Ir.
Изображения STEM в светлом поле (рис. 1C) и HAADF-STEM (рис. 1D) иллюстрируют
равномерное распределение сверхмалых НЧ Ir на подложке из нанопроволок MnO2. Нет
обнаружена значительная агломерация. Кроме того, элементное картирование STEM-EDS
(Рисунок 1E) подтвердил равномерное отложение ультрамалых НЧ Ir ультрамалых размеров.
НЧ Ir на внешней поверхности нанопроволок MnO2. Отсутствие морфологических изменений в
форма нанопроволок может быть обнаружена после осаждения НЧ Ir.
Когда нанопроволоки MnO2 и электрокатализатор MnO2-Ir сравнивали с
коммерческий электрокатализатор Pt/C, можно заметить, что нанопроволоки MnO2-Ir
представил более низкий начальный потенциал и более высокий предельный ток, показывая его
невероятная эффективность (рис.
Рисунок 1
СЭМ-изображения нанопроволок MnO2-Ir (A) и ПЭМ (B). БФ- STEM (C) и карты HAADF-STEM (D) и STEM-EDS (E) Mn (красный), O (зеленый) и Ir (желтый).
Рис. 2
Поляризационные кривые для ORR на MnO2, MnO2-Ir и
1,2 мас.% материалов Pt/C, в 0,1 моль л–1 KOH
раствор, f = 1600 об/мин при комнатной температуре.
Выводы
В заключение, настоящее исследование показало, что нанопроволоки MnO2 декорированные НЧ Ir, могут быть использованы в качестве гетерогенных электрокатализаторов для реакция восстановления кислорода, являющаяся перспективным нанокатализатором по сравнению с коммерческими платина. Путем простого синтеза удалось получить нанопроволоки с определенная форма и размер, которые могут служить шаблонами для зарождения НЧ Ir и роста без какой-либо модификации поверхности, которые окисляются до IrO2, в то время как MnO2 уменьшенный.
Agradecimentos
Referências
[1] Li, Y.; Ли, В.; Ван, Х .; Чжан, Л.; Уилкинсон, Д.П.; Чжан, Дж. Последние достижения в электрокатализаторах реакции восстановления кислорода для электрохимических энергетических применений. Электрохим. Energy Rev. 2019, 2, 518–538.
[2] Стейси, Дж.; Регми, Ю. Н.; Леонард, Б.; Фан, М. Недавний прогресс и будущее катализа реакции восстановления кислорода: обзор. Продлить. Поддерживать. Energy Rev. 2017, 69, 401–414.
Поддерживать. Energy Rev. 2017, 69, 401–414.
[3] Ся, Ю.; Ян, X. На пути к рентабельному и устойчивому использованию драгоценных металлов в гетерогенных катализаторах. Акк. хим. Рез. 2017, 50, 450–454.
[4] Госвами, К.; Хазарика, К.К.; Бхарали, П. Нанокатализаторы на основе оксидов переходных металлов для реакции восстановления кислорода. Матер. науч. Энергетика. 2018, 1, 117–128
[5] Ченг, Ф.; Су, Ю.; Лян, Дж.; Тао, З .; Чен, Дж. Наноструктуры на основе MnO2 как катализаторы электрохимического восстановления кислорода в щелочных средах. хим. Матер. 2010, 22, 898–905.
[6] Ван, З.; Гао, В .; Сюй, В .; Рен, X .; Сюй, С .; Чжу, С .; Ниу, X .; Ли, Х .; Чжао, Р .; Хан, Ю.; и другие. Влияние фазы MnO2 на характеристики реакции выделения кислорода для низкозагруженных иридиевых электрокатализаторов. ХимЭлектроХим 2021, 8, 418–424.
通过改变KMnO4与MnSO4·h3O的摩尔比提高一锅法制备的α@δ-MnO2复合材料的甲苯去除率, Applied Surface Science — X-0090 90 当前位置: X-MOL 学术 › заявл.
 Серф. науч.
›
论文详情
Серф. науч.
›
论文详情 通过改变KMnO4与MnSO4·h3O的摩尔比提高一锅法制备的α@δ-MnO2复合材料的甲苯去除率
Прикладная наука о поверхности (
ЕСЛИ
7. 392
) Дата публикации: 2021-08-18 , ДОИ:
10.1016/j.apsusc.2021.150972
Синь Мин 1 ,
Минминг Го 1,
2 ,
Кан Ли 1,
3 ,
Цзя-нан Гу 1 ,
Синь Го 1 ,
Исинь Сюэ 1 ,
Цзяньсин Лян 1 ,
Сунцзе Ху 1 ,
Цзиньпин Цзя 1,
3 ,
Тунхуа Сан 1,
2
392
) Дата публикации: 2021-08-18 , ДОИ:
10.1016/j.apsusc.2021.150972
Синь Мин 1 ,
Минминг Го 1,
2 ,
Кан Ли 1,
3 ,
Цзя-нан Гу 1 ,
Синь Го 1 ,
Исинь Сюэ 1 ,
Цзяньсин Лян 1 ,
Сунцзе Ху 1 ,
Цзиньпин Цзя 1,
3 ,
Тунхуа Сан 1,
2
Принадлежность
复合 结构 的 构建 是 开发 增强 功能 的 有效 策略 , 通常 可以 通过 个 步骤 构建。 文 采用 水热法 一 锅法 合成 了 一 不同 α/Δ 相比 α@Δ-Mno 2 催化剂;他们的KMnO 4 与MnSO 4 ·H 2 O的摩尔比精确地控制在2.

 02.19
02.19