Решите цепочку уравнений: K2O->KOH->K2SO4->KNO3 — Знания.site
Последние вопросы
Химия
47 секунд назад
Химия 10 классХимия
16 минут назад
Виберіть всі можливі назви оцтової КИСЛОТИ етанова кислота пропанова кислота мурашина кислота льодова кислота оцтова кислота Лимонна кислота СРОЯНОХимия
21 минут назад
3. Визнач можливі валентності Карбону в сполуках. а I; Б II; B III Г IV;Химия
31 минут назад
Визнач валентність елемента у сполуці з Оксигеном: I2O5 (відповідь вкажіть звичайною цифрою)Химия
40 минут назад
Задача 1.
 Рассчитать массу соли и массу воды, необходимых для приготовления 120 г 15%раствора.
Рассчитать массу соли и массу воды, необходимых для приготовления 120 г 15%раствора.Задача2. Какую массу соли нужно
добавить к 300 г 5% раствора, чтобы
получить 10% раствор этой соли,
Нужно решить по правилам
Химия
46 минут назад
Напишите уравнение реакций,с помощью которых можно осуществить следующие превращения: а)C2h3=C6H6=C6H5=NO2 б)C6H6=C6H5Br=C6H5Ch4=CO2Химия
51 минут назад
Хлорування толуолу на холоді при наявності каталізаторів (які речовини утворюються)Химия
56 минут назад
Помогите пожалуйста оооочень срочноХимия
1 час назад
Вкажіть речовину, яка реагує і з етиловим спиртом і з оцтовою кислотою: А) Na2CO3 ; Б) Na; В) NaCl ; Г)NaOH ;Химия
1 час назад
СРОЧНО ПЖПЖПЖПЖ1212312Химия
1 час назад
у сольовому розчині розчиненою речовиною єХимия
2 часа назад
2. 2. Обчисліть масу нітратної кислоти та калій карбонату, з яких добули цінне добриво — калійну селітру КNО3 масою 10,1 т.
2. Обчисліть масу нітратної кислоти та калій карбонату, з яких добули цінне добриво — калійну селітру КNО3 масою 10,1 т.Химия
2 часа назад
сформируйте следующие уравнения цепи, пожалуйста h3→h3O→NaOH→NaClХимия
2 часа назад
Встановіть відповідність: 1. Пентан а) С 3 Н 8 2. Пропан б)С 2 Н 4 3. Етин в) С 2 Н 2 4. Етан г) С 2 Н 6 д) С 5 Н 12Химия
2 часа назад
ZnSO4+K4[Fe(CN)6= Записать управление происходящей реакции в молекулярной, полной и сокращенной ионных формах
Все предметы
Выберите язык и регион
English
United States
Polski
Polska
Português
Brasil
English
India
Türkçe
Türkiye
English
Philippines
Español
España
Bahasa Indonesia
Indonesia
Русский
Россия
How much to ban the user?
1 hour 1 day 100 years
подберите коэффициенты в следующих реакциях ионно-электронным методомa) Os+KNO3+KOH->K2OsO4+KNO2+h3Ob)KMnO4+NO2+h3O-> MnO2+KNO3+HNO3
Ответы 2
Расставь сам(а):
NO2 + KMnO4 + h3O = MnO2 + KNO3 + HNO3, баланс:
NO2 + h3O -e- = (NO3)- + 2H+ | 1 | 3 | 3 |
(MnO4)- + 4H+ +3e- = MnO2 + 2h3O | 3 | | 1 |
a) Os+ 3KNO3+ 3KOH->K2OsO4+ 3KNO2+h3O
a) Os(0) + 3K(+1)N(+5)O3(-2) + 2K(+1)OH(-1)->K2(+1)Os(+6)O4(-2) + 3K(+1)N(+3)O2(-2) + h3(+1)O(-2)
Os(0) — 6e = Os (+6) | 1
N (+5) + 2e = N (+3) |3
KMnO4+3NO2+h3O-> MnO2+KNO3+2HNO3
K(+1)Mn(+7)O4(-2) + 2N(+4)O2(-2) + h3(+1)O(-2)-> Mn(+4)O2(-2) + K(+1)N(+5)O3(-2) + 2H(+1)N(+5)O3(-2)
Mn(+7) + 3e = Mn (+4) |1
N(+4) — 1e = N(+5) |3
Знаешь ответ? Добавь его сюда!
Последние вопросы
Химия
47 секунд назад
Химия 10 классХимия
16 минут назад
Виберіть всі можливі назви оцтової КИСЛОТИ етанова кислота пропанова кислота мурашина кислота льодова кислота оцтова кислота Лимонна кислота СРОЯНОХимия
21 минут назад
3. Визнач можливі валентності Карбону в сполуках. а I; Б II; B III Г IV;
Визнач можливі валентності Карбону в сполуках. а I; Б II; B III Г IV;Химия
31 минут назад
Визнач валентність елемента у сполуці з Оксигеном: I2O5 (відповідь вкажіть звичайною цифрою)Химия
40 минут назад
Задача 1. Рассчитать массу соли и массу воды, необходимых для приготовления 120 г 15%раствора.
Задача2. Какую массу соли нужно
добавить к 300 г 5% раствора, чтобы
получить 10% раствор этой соли,
Нужно решить по правилам
Химия
46 минут назад
Напишите уравнение реакций,с помощью которых можно осуществить следующие превращения: а)C2h3=C6H6=C6H5=NO2 б)C6H6=C6H5Br=C6H5Ch4=CO2Химия
51 минут назад
Хлорування толуолу на холоді при наявності каталізаторів (які речовини утворюються)Химия
56 минут назад
Помогите пожалуйста оооочень срочноХимия
1 час назад
Вкажіть речовину, яка реагує і з етиловим спиртом і з оцтовою кислотою: А) Na2CO3 ; Б) Na; В) NaCl ; Г)NaOH ;Химия
1 час назад
СРОЧНО ПЖПЖПЖПЖ1212312Химия
1 час назад
Химия
2 часа назад
2. 2. Обчисліть масу нітратної кислоти та калій карбонату, з яких добули цінне добриво — калійну селітру КNО3 масою 10,1 т.
2. Обчисліть масу нітратної кислоти та калій карбонату, з яких добули цінне добриво — калійну селітру КNО3 масою 10,1 т.Химия
2 часа назад
сформируйте следующие уравнения цепи, пожалуйста h3→h3O→NaOH→NaClХимия
2 часа назад
Встановіть відповідність: 1. Пентан а) С 3 Н 8 2. Пропан б)С 2 Н 4 3. Етин в) С 2 Н 2 4. Етан г) С 2 Н 6 д) С 5 Н 12Химия
2 часа назад
ZnSO4+K4[Fe(CN)6= Записать управление происходящей реакции в молекулярной, полной и сокращенной ионных формах
How much to ban the user?
1 hour 1 day 100 years
Зеленый оксид хрома (А) при сплавлении с КОН и KNO3 дает желтое соединение (В).
 Водный раствор (В) при подкислении разбавленной H3SO4 дает соединение (С) оранжевого цвета. Определите (B) и (C) и запишите соответствующие химические уравнения.
Водный раствор (В) при подкислении разбавленной H3SO4 дает соединение (С) оранжевого цвета. Определите (B) и (C) и запишите соответствующие химические уравнения.CHHAYA ПУБЛИКАЦИЯ-ПРЕДЫДУЩИЕ ГОДЫ ВОПРОСНИК 2017-NEET 2017
21 видеоРЕКЛАМА
Ab Padhai каро бина адс ке
Khareedo DN Pro и дехо сари видео бина киси ад ки!
Ответить
Пошаговое решение от экспертов, которое поможет вам в разрешении сомнений и получении отличных оценок на экзаменах.
Похожие видео
Идентификация от A до E. Пиролюзит при нагревании с KOH в присутствии воздуха дает темно-зеленое соединение (A). Раствор (А) при обработке h3SO4 дает соединение (В) пурпурного цвета, которое дает следующие реакции:
(а). KI при реакции с щелочным раствором (Б) превращается в соединение (С).
(б). Окраска соединения (В) исчезает при обработке кислым раствором FeSO4.
(с). С конц. Соединение h3SO4 (B) дает (D), из которого можно получить (E) и кислород.
11480275
(а). Порошкообразное вещество (А) при обработке плавильной смесью дает соединение (В) зеленого цвета.
(б). Раствор (B) Раствор (B) в кипящей воде при подкислении разбавленной H3SO4 дает соединение (C) розового цвета.
11480278
Смешанный оксид железа и хрома FeO.Cr2O3 сплавляют с карбонатом натрия в присутствии воздуха с образованием соединения желтого цвета (A). При подкислении соединение (А) образует соединение (В) оранжевого цвета, которое является сильным окислителем. Определите (i) соединения A и B (ii) Напишите сбалансированное химическое уравнение для каждого шага.
30713362
Текст Раствор
(i)Порошкообразное вещество (A) при обработке плавильной смесью (Na2CO3+KNO3) дает соединение зеленого цвета (B).
(ii) Раствор (B) в кипящей воде при подкислении разбавленной H3SO4 дает соединение розового цвета (C).
(iii) Водный раствор (A) при обработке избытком NaOH и бромной водой дает соединение (D)
(iv) Раствор (D) в конц. HNO3 при обработке PbO2 при температуре кипения дает соединение (Е), которое имеет тот же цвет, что и (С).
HNO3 при обработке PbO2 при температуре кипения дает соединение (Е), которое имеет тот же цвет, что и (С).
Сумма степеней окисления центрального атома A,B,C,D и E:
32523201
Текст Раствор
Смешанный оксид железа и хрома сплавляют с карбонатом натрия при свободном доступе воздуха до желтого цвета. , окрашенное соединение (А). При подкислении соединение (А) превращается в соединение (В) оранжевого цвета, которое является сильным окислителем. Определите соединения (А) и (В). Напишите химические реакции.
41275929
Сложный эфир В подвергают взаимодействию с кислотой в присутствии серной кислоты органического соединения А. А дает С при медленном окислении. C, 50 % После реакции с раствором KOH при подкислении разбавленной HCl получают A и D. Определите A, B, C и D, а также приведите химические уравнения.
58136579
Смешанный оксид железа и хрома FeO.Cr_(2)O_(3) сплавляется с карбонатом натрия в присутствии воздуха с образованием соединения желтого цвета (A).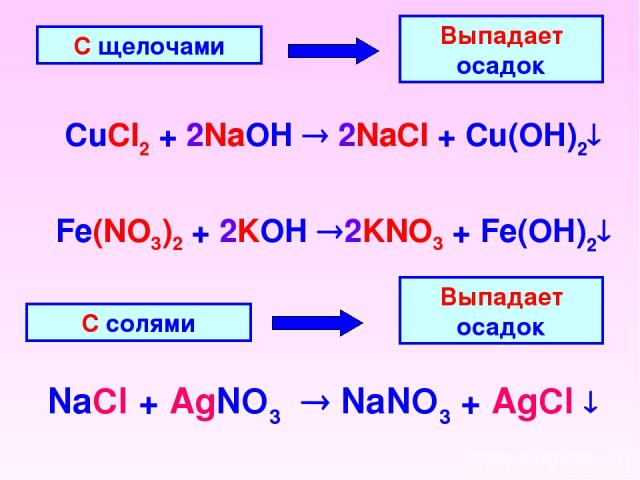 При подкислении соединение (А) образует соединение (В) оранжевого цвета, которое является сильным окислителем. (i) Определите соединения (A) и (B). (ii) Напишите сбалансированное химическое уравнение для каждого шага.
При подкислении соединение (А) образует соединение (В) оранжевого цвета, которое является сильным окислителем. (i) Определите соединения (A) и (B). (ii) Напишите сбалансированное химическое уравнение для каждого шага.
74449971
Зеленое соединение хрома (А) при сплавлении со щелочью дает желтый цвет
277382291
Text Solution
Зеленое соединение хрома
(B), которое при подкислении дает соединение оранжевого цвета
277382293
Text Solution
Зеленое соединение хрома
(C). Определите A, B, C. Напишите уравнения реакций.
277382295
Text Solution
Смешанный оксид железа и хрома FeO.Cr_2O_3 сплавляется с карбонатом натрия в присутствии воздуха с образованием соединения желтого цвета (A). При подкислении соединение (А) образует соединение (В) оранжевого цвета, которое является сильным окислителем. Определите (i) соединения (A) и (B) (ii) напишите сбалансированные химические уравнения для каждого шага.
501543233
Смешанный оксид железа и хрома FeO.Cr2O3 сплавляют с карбонатом натрия в присутствии воздуха с образованием соединения желтого цвета (A). При подкислении соединение (А) образует соединение (В) оранжевого цвета, которое является сильным окислителем. Идентифицируйте
(i) соединения (A) и (B).
(ii) напишите сбалансированное химическое уравнение для каждого шага.
555581288
Текст Раствор
Смешанный оксид железа и хрома сплавляют с карбонатом натрия при свободном доступе воздуха до образования желтого окрашенного соединения (А). При подкислении соединение (А) превращается в соединение (В) оранжевого цвета, которое является сильным окислителем. Определите соединения (А) и (В). Напишите химические реакции. 9(@)KOH После реакции с раствором при подкислении разбавленной HCl получаются A и D. Определите A, B, C и D, а также напишите химическое уравнение.
642787229
Идентифицировать от A до E. Пиролюзит при нагревании с KOH в присутствии воздуха дает темно-зеленое соединение (A). Раствор (А) при обработке H_2SO_4 дает соединение (В) пурпурного цвета, которое дает следующие реакции: (а). KI при реакции с щелочным раствором (Б) превращается в соединение (С). (б). Окраска соединения (В) исчезает при обработке кислым раствором FeSO_4. (с). С конц. Соединение H_2SO_4 (B) дает (D), из которого можно получить (E) и кислород.
Раствор (А) при обработке H_2SO_4 дает соединение (В) пурпурного цвета, которое дает следующие реакции: (а). KI при реакции с щелочным раствором (Б) превращается в соединение (С). (б). Окраска соединения (В) исчезает при обработке кислым раствором FeSO_4. (с). С конц. Соединение H_2SO_4 (B) дает (D), из которого можно получить (E) и кислород.
644129517
ВведениеВ некоторых частях мира трудно найти нитрат калия, по крайней мере, в экономичных количествах. Наиболее экономичной формой калийной селитры является удобрение 13-0-46. Однако, поскольку это «специализированное» удобрение, его доступность может быть ограничена. С другой стороны, аммиачная селитра (АН) является распространенным и недорогим удобрением (правда, АН становится менее доступным из-за ограничений на ее продажу). Ежегодное глобальное потребление составляет около 20 миллионов тонн [1] и встречается в большинстве частей мира для самых разных культур. Таким образом, действительно удачно, что нитрат калия может быть легко синтезирован с использованием нитрата аммония в качестве основного материала. На этой веб-странице описывается относительно простой и безопасный процесс производства синтетического нитрата калия, достаточно чистого и идеально подходящего для использования в качестве окислителя ракетного топлива. Синтез ОписаниеОписанный здесь процесс синтеза включает реакцию между нитратом аммония и гидроксидом калия (КОН), которая происходит в водном растворе. Гидроксид калия также известен как «едкий кали» и является широко используемым и относительно недорогим химическим веществом, широко используемым в промышленности [2] [3].
KOH доступен в виде гранул, как правило, с чистотой 9.8% (карбонат калия — обычная примесь). KOH очень гигроскопичен, и коммерческий продукт обычно содержит 10-15% воды. Гидроксид калия также известен как «едкий кали» и является широко используемым и относительно недорогим химическим веществом, широко используемым в промышленности [2] [3].
KOH доступен в виде гранул, как правило, с чистотой 9.8% (карбонат калия — обычная примесь). KOH очень гигроскопичен, и коммерческий продукт обычно содержит 10-15% воды.Реакция между нитратом аммония (NH 4 NO 3 ) и гидроксидом калия приводит к образованию аммиака (NH 3 ), воды и нитрата калия в соответствии со следующим химическим уравнением: NH 4 NO 3 + KOH -> NH 3 + H 2 O+ KNO 3 Один моль нитрата аммония реагирует с одним молем KOH, образуя по одному молю NH 3 , H 2 O и KNO 3 . Это можно поместить по массой, зная молекулярные массы различных реагентов и продуктов:
80grams NH 4 NO 3 + 56,1 г KOH -> 17 г NH 3 + 18 г H 2 O + 101,1 г KNO 3 Видно, что «масса сохраняется», то есть общая масса реагентов (136,1 г) равна общей массе продуктов (136,1 г). Так как товарный КОН содержит до 15% воды, массу гранул КОН необходимо увеличить на 15%. Это подтверждено экспериментально. Двумя побочными продуктами процесса синтеза являются вода и аммиак. Аммиак представляет собой газ с резким запахом и обычно используется в качестве бытового чистящего средства, растворенного в воде до концентрации аммиака 5-10 весовых процентов. Процесс синтезаОписанный здесь процесс дает примерно 100 граммов KNO 3 . Процесс может быть напрямую увеличен или уменьшен по мере необходимости . Поскольку образуется большой объем газообразного аммиака, данную процедуру необходимо проводить на открытом воздухе в хорошо проветриваемом помещении. Прежде чем продолжить, прочтите раздел о безопасности. Процесс может быть напрямую увеличен или уменьшен по мере необходимости . Поскольку образуется большой объем газообразного аммиака, данную процедуру необходимо проводить на открытом воздухе в хорошо проветриваемом помещении. Прежде чем продолжить, прочтите раздел о безопасности. Процесс включает реакцию нитрата аммония и гидроксида калия в водном растворе. Продуктами этой реакции являются вода, газообразный аммиак и нитрат калия. Образующийся газообразный аммиак хорошо растворяется в холодной воде и выводится из раствора при нагревании. Растворимость NH 3 сильно зависит от температуры, как видно на рисунке 1, уменьшаясь с повышением температуры. При охлаждении выкристаллизовывается нитрат калия, хорошо растворимый в горячей воде. Растворимость нитрата калия сильно зависит от температуры, уменьшаясь с понижением температуры, как показано на рис. 2. Затем кристаллы нитрата калия выделяют путем дальнейшего охлаждения с последующим механическим отделением кристаллов от насыщенного раствора. Процесс растворения аммиачной селитры в воде эндотермический, то есть поглощается теплота, что приводит к значительному падению температуры раствора. Противоположное верно для KOH. Процесс сильно экзотермичен, что приводит к значительному повышению температуры раствора. Теплоты растворения (изменение энтальпии в ккал/моль в воде) приведены ниже [5]: нитрат аммония +6,14 ккал/моль = 77 кал/грамм поглощенного тепла Если синтетический нитрат калия будет использоваться в качестве пропеллента для сахара, важно, чтобы
 Для устранения этого используют избыточное количество КОН (чтобы обеспечить полное расходование аммиачной селитры), затем любой оставшийся КОН нейтрализуют слабой кислотой. Уксус (5% уксусная кислота) используется с успехом, хотя вместо него можно использовать и другие кислоты. Для устранения этого используют избыточное количество КОН (чтобы обеспечить полное расходование аммиачной селитры), затем любой оставшийся КОН нейтрализуют слабой кислотой. Уксус (5% уксусная кислота) используется с успехом, хотя вместо него можно использовать и другие кислоты.Аппарат
Процедура
Фотографии
Другие средства для синтеза KNO3Существуют и другие способы синтеза нитрата калия. Вот три примера: Из нитрата кальция и карбоната калия: Из нитрата кальция и хлорида калия: Из декагидрата аммиачно-кальциевой селитры и хлорида калия: Декагидрат аммиачно-кальциевой селитры является общедоступным удобрением, которое заменяет аммиачную селитру на сельскохозяйственном рынке. ОбсуждениеУ энтузиастов ракетной техники есть несколько способов синтезировать нитрат калия, если он недоступен. Представленный здесь метод с использованием нитрата аммония и гидроксида калия в качестве основных химических веществ является относительно простым и безопасным, если он выполняется в соответствии с описанным здесь методом с соблюдением предоставленных советов по безопасности. Полученный продукт будет очень хорошего качества, хорошо подходящим для пропеллентов горячего отливки сахара или пропеллентов холодного отливки, таких как разновидность RNX. Продукт также хорошо подходит для изготовления воспламенительного пиролентного или эжекционного заряда. Полученный продукт будет очень хорошего качества, хорошо подходящим для пропеллентов горячего отливки сахара или пропеллентов холодного отливки, таких как разновидность RNX. Продукт также хорошо подходит для изготовления воспламенительного пиролентного или эжекционного заряда.Безопасность
Обновление, май 2008 г. |

 Рассчитать массу соли и массу воды, необходимых для приготовления 120 г 15%раствора.
Рассчитать массу соли и массу воды, необходимых для приготовления 120 г 15%раствора. 2. Обчисліть масу нітратної кислоти та калій карбонату, з яких добули цінне добриво — калійну селітру КNО3 масою 10,1 т.
2. Обчисліть масу нітратної кислоти та калій карбонату, з яких добули цінне добриво — калійну селітру КNО3 масою 10,1 т. Визнач можливі валентності Карбону в сполуках. а I; Б II; B III Г IV;
Визнач можливі валентності Карбону в сполуках. а I; Б II; B III Г IV; 2. Обчисліть масу нітратної кислоти та калій карбонату, з яких добули цінне добриво — калійну селітру КNО3 масою 10,1 т.
2. Обчисліть масу нітратної кислоти та калій карбонату, з яких добули цінне добриво — калійну селітру КNО3 масою 10,1 т. /моль
/моль

 Начнут образовываться кристаллы нитрата калия.
Начнут образовываться кристаллы нитрата калия.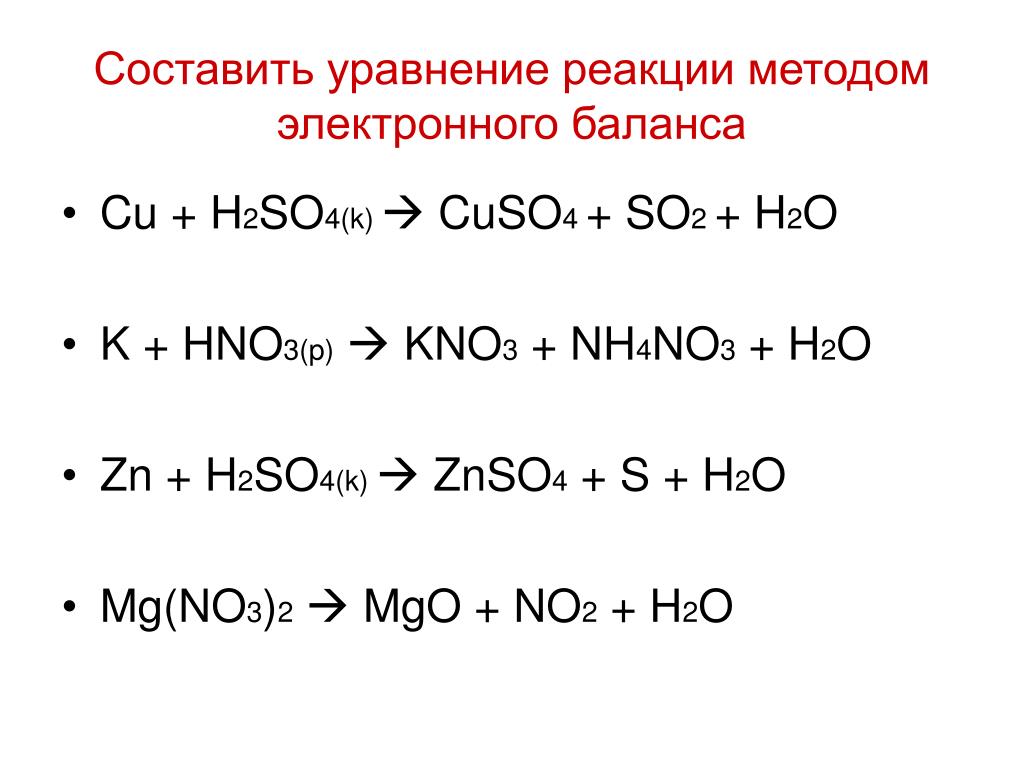
 Этот этап особенно важен, если газ-вытеснитель должен быть получен методом горячего литья.
Этот этап особенно важен, если газ-вытеснитель должен быть получен методом горячего литья. Хлорид калия легко доступен в виде соли для смягчения воды, не содержащей натрия. Эти три метода синтеза на самом деле просты в выполнении, при этом реагенты растворяются в горячей воде, смешиваются, при этом происходит реакция ионного обмена с последующим охлаждением раствора для получения желаемого продукта (KNO 3 ), которые будут кристаллизоваться в реакционном сосуде, поскольку KNO 3 имеет гораздо более низкую растворимость, чем другие продукты, при температуре ниже нуля. Последний метод, дающий прекрасный продукт, описан в книге коллеги-экспериментатора ракетной техники Дянко Чернева.
веб-страница.
Хлорид калия легко доступен в виде соли для смягчения воды, не содержащей натрия. Эти три метода синтеза на самом деле просты в выполнении, при этом реагенты растворяются в горячей воде, смешиваются, при этом происходит реакция ионного обмена с последующим охлаждением раствора для получения желаемого продукта (KNO 3 ), которые будут кристаллизоваться в реакционном сосуде, поскольку KNO 3 имеет гораздо более низкую растворимость, чем другие продукты, при температуре ниже нуля. Последний метод, дающий прекрасный продукт, описан в книге коллеги-экспериментатора ракетной техники Дянко Чернева.
веб-страница.