Ответы на вопросы переченя
35
Методы получения важнейших веществ в химической промышленности и в лабораторной практике
Вопрос 1. Натрий, гидроксид натрия, карбонат натрия.
Натрий относится к щелочным металлам и расподожен вглавной подгруппе первой группы ПСЭ им. Д.И. Менделеева. На внешнем энергетическом уровне его атома на сравнительно большом удалении от ядра находится один электрон, который атомы щелочных металлов довольно легко отдают, превращаясь в однозарядные катионы; этим объясняется очень высокая химическая активность щелочных металлов.
Общим способом получения щелочных является электролиз расплавов их солей (обычно хлоридов).
Натрий, как щелочной металл, характеризуются незначительной твёрдостью, малой плотностью и низкими температурами плавления.
Натрий, взаимодействуя с кислородом, образует преимущественно пероксид натрия
2 Na + O2 Na2O2
Восстановлением пероксидов и надпероксидов избытком щелочного металла можно получить оксид:
Na2O2 + 2 Na 2 Na2O
Оксиды натрия
взаимодействует с водой с образованием
гидроксида: Na2O
+ h3O
→ 2 NaOH .
Пероксиды полностью гидролизуются водой с образованием щёлочи: Na2O2 + 2 HOH → 2 NaOH + h3O2
Как и все щелочные металлы, натрий является сильным восстановителем и энергично взаимодействуют со многими неметаллами (за исключением азота, иода, углерода, благородных газов):
С азотом реагирует крайне плохо в тлеющем разряде, образуя очень неустойчивое вещество — нитрид натрия
С разбавленными кислотами взаимодействует как обычный металл:
С концентрированными окисляющими кислотами выделяются продукты восстановления:
Гидроксид натрия NaOH (едкая щелочь) – сильное химическое основание. В промышленности гидроксид натрия получают химическими и электрохимическими методами.
Химические методы получения:
— известковый,
который заключается во взаимодействии
раствора соды с известковым молоком
при температуре около 80°С.
Na2CО3 + Са (ОН)2 → 2NaOH + CaCО3
— ферритный, который включает два этапа:
Na2CО3 + Fe2О3 → 2NaFeО2 + CО2
2NaFeО2 + xH2О = 2NaOH + Fe2O3*xH2О
Электрохимически гидроксид натрия получают электролизом растворов галита (минерала, состоящего в основном из поваренной соли NaCl) с одновременным получением водорода и хлора. Этот процесс можно представить суммарной формулой:
2NaCl + 2H2О ±2е- → H2↑ + Cl2↑ + 2NaOH
1) нейтрализации:
NaOH + HCl → NaCl + H2O
2) обмена с солями в растворе:
2NaOH +CuSO4 → Cu (OH)2↓ + Na2SO4
3) реагирует с неметаллами
3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O
4) реагирует с металлами
2Al + 2NaOH + 6H2O → 3H2↑ + 2Na[Al(OH)4]
Гидроксид натрия
широко используется в различных отраслях
промышленности, например, при варке
целлюлозы, для омыления жиров при
производстве мыла; как катализатор
химических реакций, при получении
дизельного топлива и т. д.
д.
Карбонат натрия вырабатывается или в виде Na2CO3 (кальцинированная сода), или в виде кристаллогидрата Na2CO3*10Н 2О (кристаллическая сода), или в виде гидрокарбоната NaНCO3 (питьевая сода).
Сода чаще всего производится по аммиачно-хлоридному методу, основанному на реакции:
NaCl + NH4HCO3 ↔NaHCO3 + Nh5Cl
Потребляют карбонаты натрия многие отрасли промышленности: химическая, мыловаренная, целлюлозно-бумажная, текстильная, пищевая и т.д.
Химические свойства простых веществ
Гурына Ира
Химия для 9 классаХимические свойства металлов
Металл + Кислород
С кислородом большинство металлов образует оксиды — амфотерные и основные:
- 4Li + O2= 2Li2O
- 4Al + 3O2 = 2Al2O3
Щелочные металлы, за исключением лития, образуют пероксиды:
- 2Na + O2 = Na2O2
Металл + галогены
С галогенами металлы образуют соли галогеноводородных кислот:
- Cu + Cl2 = CuCl2
Металл + Водород
С водородом самые активные металлы образуют ионные гидриды — солеподобные вещества, в которых водород имеет степень окисления -1.
- 2Na + h3 = 2NaH
Металл + Сера
С серой металлы образуют сульфиды — соли сероводородной кислоты
- Zn + S = ZnS
Металл + Азот
С азотом некоторые металлы образуют нитриды, реакция практически всегда протекает при нагревании
- 3Mg + N2 = Mg3N2
Металл + Углерод
С углеродом образуются карбиды
- 4Al + 3C = Al3C4
Металл + Фосфор
С фосфором — фосфиды
- 3Ca + 2P = Ca3P2
Металл + вода
С водой — гидроксиды. Активные металлы (щелочные металлы) взаимодействуют с водой при обычных условиях с образованием гидроксидов и выделением водорода
- 2Nа + 2Н2О = 2NаОН + Н2
- Са + 2Н2О = Са(ОН)2 + Н2
Химические свойства неметаллов
Взаимодействие с металлами. В этих случаях неметаллы проявляют окислительные свойства, они принимают электроны, образуя отрицательно заряженные частицы.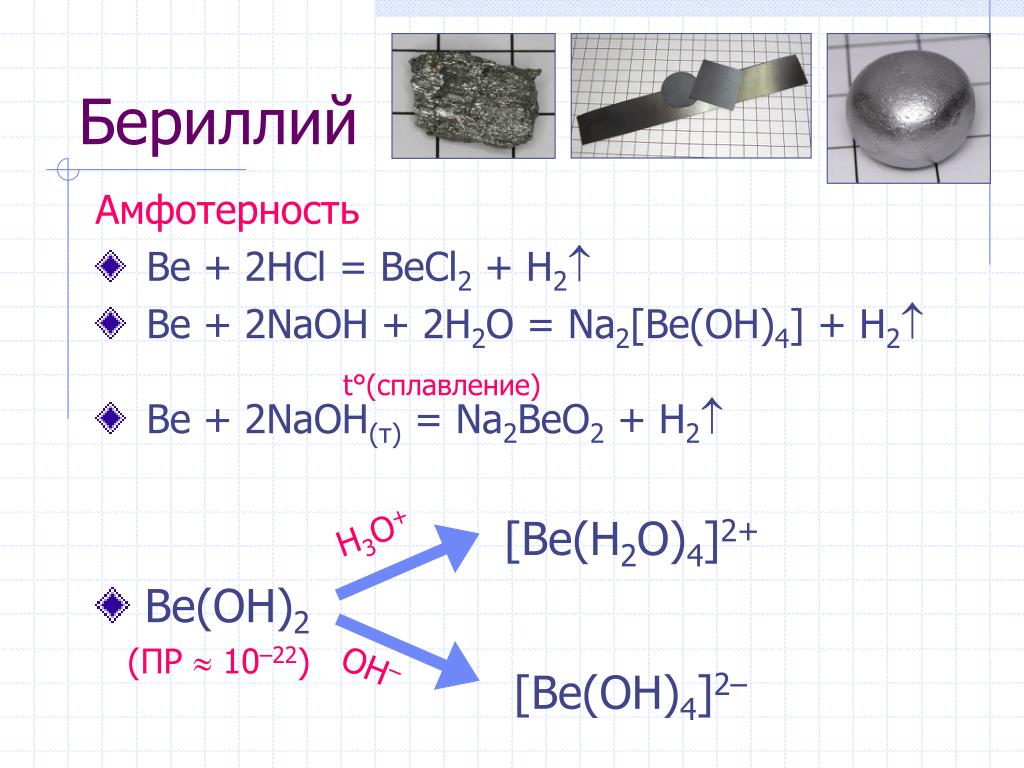
- 2Na + Cl2 = 2NaCl
- Fe + S = FeS
- 6Li + N2 = 2Li3N
- 2Ca + O2 = 2CaO
Взаимодействие с другими неметаллами. Взаимодействуя с водородом, большинство неметаллов проявляет окислительные свойства, образуя летучие водородные соединения — ковалентные гидриды.
- 3h3 + N2 = 2Nh4
- h3 + Br2 = 2HBr
Взаимодействуя с кислородом, все неметаллы, кроме фтора, проявляют восстановительные свойства.
- S + O2 = SO2
- 4P + 5O2 = 2P2O5
При взаимодействии с фтором фтор является окислителем, а кислород — восстановителем.
- 2F2 + O2 = 2OF2
Неметаллы взаимодействуют между собой: более электроотрицательный металл играет роль окислителя, менее электроотрицательный — роль восстановителя.
- S + 3F2 = SF6
- C + 2Cl2 = CCl4
Полезные ссылки
Источник материала
Поделиться Share Tweet
Формула перекиси натрия – структура, свойства, применение, примеры вопросов
Натрий (Na) – химический элемент. Это щелочной металл. Он имеет атомный номер 11 в периодической таблице. Это очень реакционноспособный металл. Он мягкий и серебристо-белого цвета. Кислород (O) — химический элемент с атомным номером 8 в периодической таблице. Это очень реакционноспособный неметалл и окислитель, который легко образует оксиды с большинством элементов, а также с другими соединениями.
Это щелочной металл. Он имеет атомный номер 11 в периодической таблице. Это очень реакционноспособный металл. Он мягкий и серебристо-белого цвета. Кислород (O) — химический элемент с атомным номером 8 в периодической таблице. Это очень реакционноспособный неметалл и окислитель, который легко образует оксиды с большинством элементов, а также с другими соединениями.
Пероксид натрия — неорганическое химическое соединение. Это продукт как натрия, так и кислорода. Он желтоватого цвета и является сильным основанием. Он также известен как двуокись натрия, солозон или флокул. Он существует в форме гидратов и гидратов для окси, включая NA 2 O 2 · 2H 2 O 2 · 4H 2 O, NA 2 O 2 · 2H 2 O, Na 2 O 2 ·2H 2 O 2 , и Na 2 O 2 ·8H 2 O.
Химическая формула пероксида натрия Na 2 O 2 .
Пероксид натрия имеет кристаллическую структуру и шестиугольную форму.
Получение перекиси натрия
- Перекись натрия можно получить при обработке гидроксида натрия перекисью водорода.
2NaOH + H 2 O 2 → Na 2 O 2 + 2 H 2 O .
- Пероксид натрия можно получить реакцией металлического натрия с кислородом при 130–200 °C, сначала образуется оксид натрия, а затем, на другой стадии, он реагирует с кислородом.
4Na + O 2 → 2 Na 2 O
2Na 2 O + O 2 → 2 Na 2 O 2
- Перекись натрия также можно получить пропусканием газообразного озона над твердым йодидом платины или йодидом натрия внутри трубки.
 Затем озон окисляет натрий с образованием перекиси натрия.
Затем озон окисляет натрий с образованием перекиси натрия.
- Молекулярная масса пероксида натрия 77,98 г/моль.
- Плотность пероксида натрия 2,805 г/см 3 .
- Температура плавления пероксида натрия 460 °С.
- Температура кипения пероксида натрия 657 °С.
- Представляет собой порошок от желтого до белого цвета.
- Растворим в воде, этаноле и кислоте и нерастворим в щелочи.
- Магнитная восприимчивость (χ) пероксида натрия составляет −28,10*10 -6 см 3 /моль.
- При нагревании пероксида натрия гексагональная форма пероксида натрия претерпевает переход при 512 °C, а при дальнейшем нагревании выше температуры кипения 657 °C соединение разлагается до На 2 O и выделяет кислород.
2NA 2 O 2 → 2NA 2 O + O 2
- Пероксид натрия при реагировании с водой ИТ дает гидроксид натрия и пероксид ворота в соответствии с реакцией.

Na 2 O 2 + 2H 2 O → 2NaOH + H 2 O 2
При взаимодействии перекиси натрия с двуокисью углерода образуется карбонат натрия и кислород.
Использование Peroxide2NA 2 O 2 + 2CO 2 → 2NA 2 CO 3 + O 2
- 9003 мякоть.
- Используется в производстве бумаги и текстиля.
- Используется для добычи полезных ископаемых из различных руд.
- Используется как окислитель.
- Используется в аквалангах и подводных лодках.
Вопрос 1: Что происходит при обработке перекиси натрия серной кислотой?
Ответ:
При обработке перекиси натрия серными кислотами мы получаем сульфат натрия и перекись водорода.
Na 2 O 2 + H 2 SO 4 →Na 2 SO 4 +H 2 O 2 .
Вопрос 2. Растворяется ли пероксид натрия в воде?
Ответ:
Перекись натрия растворима в воде. Перекись натрия при взаимодействии с водой дает гидроксид натрия и перекись водорода в соответствии с реакцией.
Na 2 O 2 + 2H 2 O → 2NaOH + H 2 O 2 .
Вопрос 3. Является ли перекись натрия сильным основанием или кислотой?
Ответ:
Перекись натрия является сильным основанием. Это неорганическое химическое соединение. Это продукт как натрия, так и кислорода. Он желтоватого цвета.
Вопрос 4: Чем опасен для здоровья перекись натрия?
Ответ:
При вдыхании может раздражать нос, горло и легкие.
Это может вызвать кашель, чихание, а также может вызвать одышку.
Вопрос 5: Можно ли нейтрализовать перекись натрия?
Ответ:
Пероксид натрия можно нейтрализовать любой кислотой и диоксидом марганца. При этом он восстанавливается до натриевой соли этой кислоты и кислорода.
Na 2 O 2 + HCl → 2NaCl + H 2 + O 2
Используется ли пероксид натрия Вопрос 6:
Ответ:
Да, пероксид натрия используется как сильный окислитель. Так как пероксид натрия содержит атом натрия и кислорода. Степень окисления +1, ее можно уменьшить от +1 до 0. Таким образом, элементы, которые могут подвергаться уменьшению степени окисления, т.е. восстановлению, известны как сильные окислители.
Перекись натрия — wikidoc
Template:Chembox new Пероксид натрия , Na 2 O 2 , является нормальным продуктом при сжигании натрия.
Содержание
- 1 Химические свойства
- 2 структурных перехода
- 3 Подготовка
- 4 варианта использования
- 5 Каталожные номера
Химические свойства
Пероксид натрия гидролизуется водой с образованием гидроксида натрия и пероксида водорода в соответствии с реакцией:
- Na 2 O 2 + 2 H 2 O → 2 NaOH + H 2 O 2
. Реакция является по существу экзотермической и может привести к возгоранию горючих материалов.
Перекись натрия также поджигает многие органические жидкости при контакте (в частности, спирты и гликоли) и бурно реагирует с порошкообразными металлами и многими другими соединениями после минимального инициирования.
Структурные переходы
Шестиугольная кристаллическая структура пероксида натрия была открыта Tallman et al. [1] . При нагреве структура претерпевает переход в фазу неизвестной симметрии при 512 °С. [2] При дальнейшем нагревании выше температуры плавления 675 °C соединение разлагается с выделением O 2 до достижения точки кипения. [3]
При нагреве структура претерпевает переход в фазу неизвестной симметрии при 512 °С. [2] При дальнейшем нагревании выше температуры плавления 675 °C соединение разлагается с выделением O 2 до достижения точки кипения. [3]
Подготовка
Пероксид натрия можно синтезировать прямой реакцией с натрием и кислородом при 130–200 °C. [2] Синтез при более низкой температуре (0–20 °C) может быть достигнут путем пропускания O
Применение
Учитывая сильные окислительные свойства, перекись натрия используется для отбеливания древесной массы для производства бумаги.

 Затем озон окисляет натрий с образованием перекиси натрия.
Затем озон окисляет натрий с образованием перекиси натрия.

 Это может вызвать кашель, чихание, а также может вызвать одышку.
Это может вызвать кашель, чихание, а также может вызвать одышку.