Метод электронного баланса — правила и алгоритмы уравнивания реакций » Kupuk.net
При составлении химических уравнений окислительно-восстановительных реакций удобно использовать метод электронного баланса. Алгоритм расставления коэффициентов состоит всего из шести простых пунктов. В его основе лежит закон сохранения массы веществ. При этом для сложных соединений существует возможность выполнить уравнивание на онлайн-калькуляторе.
Общие понятия
Взаимодействие исходных веществ с образованием новых, при котором ядра атомов остаются неизменными, называют химическими реакциями. Для них характерно перераспределение электронов. Исходные вещества называют реагентами, а прореагирующие — продуктами реакции. Превращение может происходить как сложных, так и простых элементов. Описываются они химическими уравнениями, состоящими из двух частей. Стрелка, разделяющая их, указывает направление протекания реакции.
Числа, стоящие перед веществами, участвующими в превращении, называют коэффициентами. Они указывают на количественную часть веществ. Любая реакция может происходить как с поглощением энергии, так и её выделением. В первом случае химическое уравнение называют эндотермическим, а во втором — экзотермическим.
Они указывают на количественную часть веществ. Любая реакция может происходить как с поглощением энергии, так и её выделением. В первом случае химическое уравнение называют эндотермическим, а во втором — экзотермическим.
Окислительно-восстановительными реакциями (ОВР) называют встречно-параллельные превращения с изменением степени окисления. Протекают они методом перераспределения электронов между акцептором — атомом окислителем и донором — восстановителем. Для составления уравнений, описывающих такого типа процесс, используют метод электронного баланса.
Примеры заданий предполагают, что в любой реакции, которую можно описать способом баланса, участвуют две сопряжённые окислительно-восстановительные пары. В итоге фактически возникают две полуреакции. Одна характеризуется увеличением электронов, а другая их отдачей. Таким образом, процессы окисления и восстановления не могут протекать друг без друга и не изменять степень окисления элементов.
Ионы или атомы, забирающие электроны называют окислителями, а отдающие — их восстановителями.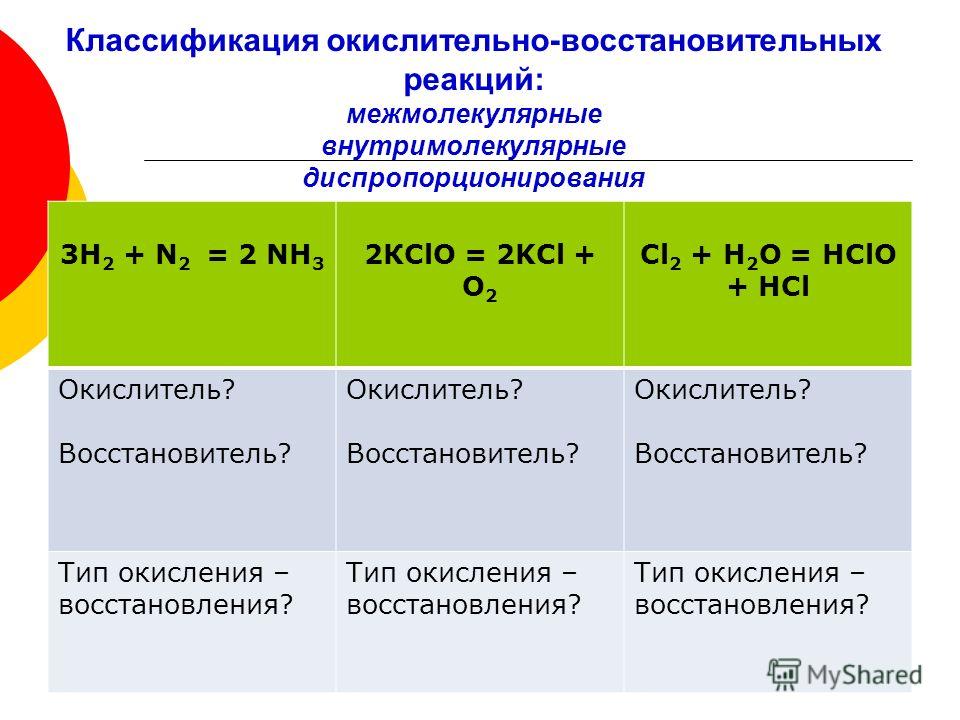 Сложность записи таких уравнений заключается в правильном подборе количества молей возникающих соединений. Уравнивающие коэффициенты могут принимать только целые значения. Конкурентом метода баланса в химии является способ полуреакций. Первый отличается простотой и используется в том случае, когда реакция происходит в газообразной среде. Второй же более подходит для реакций, проходящих в жидкости.
Сложность записи таких уравнений заключается в правильном подборе количества молей возникающих соединений. Уравнивающие коэффициенты могут принимать только целые значения. Конкурентом метода баланса в химии является способ полуреакций. Первый отличается простотой и используется в том случае, когда реакция происходит в газообразной среде. Второй же более подходит для реакций, проходящих в жидкости.
Суть метода
Способ электронного баланса предназначен для облегчения решения заданий по уравниванию двух частей уравнения. В его сути лежит возможность расстановки коэффициентов для окислительно-восстановительной реакции с использованием степени окисления. Впервые с объяснением способа знакомят в восьмом классе на уроке неорганической химии.
В школьных учебниках часто приводится следующая последовательность действий для установления балансировки в ОВР:

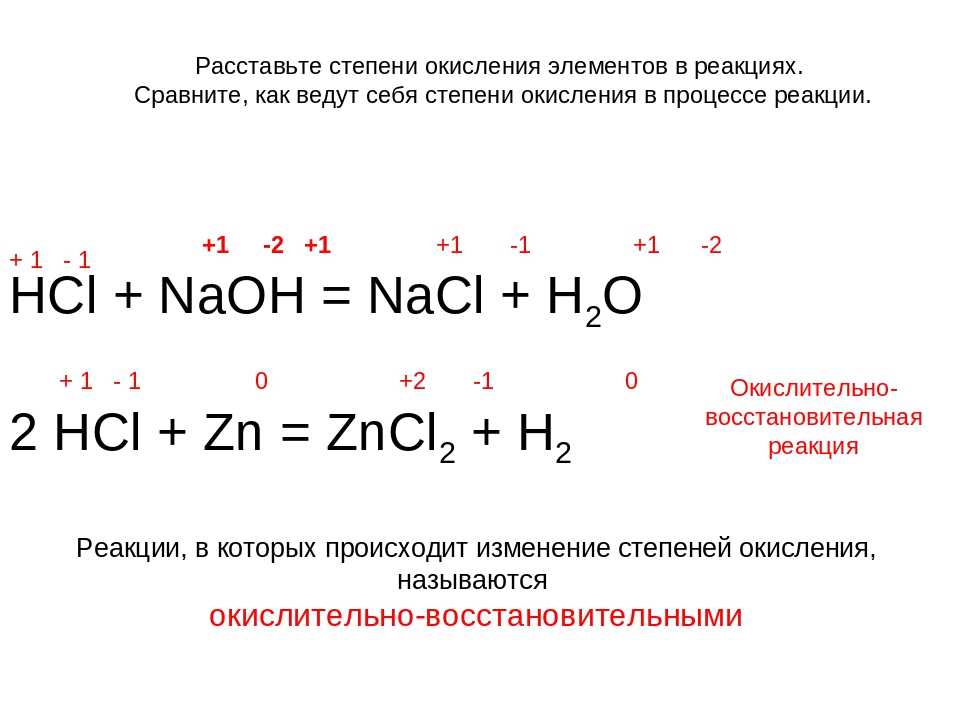
Классический способ, с помощью которого можно уравнять химические выражения, основан на законе сохранения массы, когда методом подбора находятся коэффициенты до начала реакции и после её окончания. Но для ОВР их подобрать очень сложно или невозможно. Поэтому и используют способ электронного баланса, который подходит как для простых, так и сложных реакций.
Степени окисления
Определение коэффициентов методом баланса непосредственно связано с расстановкой валентности. Не зная, как правильно выполнить эту операцию, уравнять ОВР будет невозможно. Под окислением элемента понимается значение заряда его атома. Этот ион может быть условным или реальным.
Не зная, как правильно выполнить эту операцию, уравнять ОВР будет невозможно. Под окислением элемента понимается значение заряда его атома. Этот ион может быть условным или реальным.
Существует несколько видов химических связей. Одними из них могут быть ковалентная и ионная. И в том, и другом случае между атомами образовывается пара. В первом случае пара смещается в сторону отрицательно заряженного атома, а во втором полностью переходит к более электроотрицательной частице. Поэтому под реальным зарядом понимается процесс, характеризующийся ионной связью, а условным — возникновение заряда при ковалентной.
Например, ионное соединение NaCl = Na1+ + Cl1-. Атом натрия имеет один электрон, который в ионном соединении полностью переходит к более отрицательному атому. То есть, электрон натрия отдаётся полностью атому хлора. При этом атом, утратив один ион, приобретает заряд равный один плюс. Хлор же, получая дополнительный электрон, меняет заряд на один минус.
В химии принято заряды обозначать сначала цифрой, а после ставить знак, а степень окисления наоборот.
Поэтому правильной записью с указанием валентности для рассматриваемого примера будет выражение вида: Na+1 Cl-1.
Для ковалентной полярной связи, например, молекулы HCl, общая электронная пара лишь смещается в сторону хлора. На атомах возникают частичные дельта-плюс и минус заряды. Но при расстановке значений на это внимания не обращают. Атом водорода полностью отдаёт свой электрон атому хлора. Соответственно, степень будет выглядеть как H+1Cl-1.
Следует помнить, что существуют элементы, которые всегда имеют постоянную валентность:
Остальные же вещества характеризуются переменной валентностью. При описании реакции характерно выделение и гидроксильной группы. Для соединения ОН значение ионов указывается единым. Например, Na+1(OH)-1. Проверку правильности расстановки зарядов можно выполнить по правилу электронейтральности, согласно которому сумма положительных электронов должна быть равна сумме отрицательных.
Простой расчёт
Разобраться в сути способа поможет простой пример. Пусть необходимо расставить коэффициенты в реакции соединения оксида меди с азотной кислотой. Первым делом необходимо записать схему сложения: CuO + Nh4 = Cu + N2 +h3O. Теперь нужно расставить валентность для каждого элемента. Делать это следует внимательно, ведь от того, насколько верно будет указана валентность, зависит правильность дальнейших действий.
Опираясь на таблицу Менделеева можно утверждать, что правильная степень окисления будет выглядеть для рассматриваемого выражения следующим образом: Cu+2 O-2 + N-3H+1 3 = Cu0 + N02 +H+12O-2. Теперь нужно отметить те элементы, которые поменяли свою валентность. Это медь, была +2, а стала 0, и азот, изменивший своё значение с -3 до 0.
На третьем шаге выписывают схемы уравнений полуреакций, изменивших окисление:
 Эта запись говорит, что два электрона были приняты медью и она стала нулевой. Обозначают этот процесс записью вида +2 e.
Эта запись говорит, что два электрона были приняты медью и она стала нулевой. Обозначают этот процесс записью вида +2 e.Закон сохранения заряда говорит о том, что электроны не могут взяться ниоткуда и пропасть никуда. Иными словами, какое их количество отдал восстановитель, то же их число должно быть принято окислителем.
В рассматриваемом примере получается, что два электрона были приняты, а шесть отданы. Так не бывает, поэтому нужно найти, где же потерялась разница. Для полученных чисел ищется наименьший общий знаменатель. Без остатка на них делится шесть. Выполнив действие, получают два опорных коэффициента: три и один. Таким образом, перед медью нужно поставить тройку, а азотом единицу: 3Cu+2O-2 + 2N-3H+13 = 3Cu0 + N02 +H+12O-2.
Без остатка на них делится шесть. Выполнив действие, получают два опорных коэффициента: три и один. Таким образом, перед медью нужно поставить тройку, а азотом единицу: 3Cu+2O-2 + 2N-3H+13 = 3Cu0 + N02 +H+12O-2.
Опираясь на полученные значения, проводят стандартную процедуру уравнивания: 3Cu+2O-2 +2N-3H+13 = 3Cu0 + N02 + 3H+12O-2. Задача считается выполненной. Пожалуй, ещё можно указать, что медь в уравнении является окислителем, а азот — восстановителем.
Пример сложного соединения
Научившись решать простые задания можно переходить к формулам и сложнее. Например, соединению бромида и перманганата калия с серной кислотой. Схема реакции будет выглядеть следующим образом: KBr + KMnO4 + h3SO4 → MnSO4 + Br2 + K2SO4 + h3O.
Согласно правилу, нужно расставить ионны для каждого элемента: K+1Br+1 + K+1Mn+7O-24 + H+12S+6O-24 → Mn+2S+6O-2 4 + Br02 + K+1 2 S+6O-2 4 + H+12O-2. В уравнении только два элемента изменили степень. Это марганец, который был +7, а стал +2, и бром, поменявший свою валентность с -1 до нуля.
В уравнении только два элемента изменили степень. Это марганец, который был +7, а стал +2, и бром, поменявший свою валентность с -1 до нуля.
Составляя уравнения полуреакций, проводят анализ. Марганец до реакции был + 7, то есть до нулевого значения ему не хватало семь единиц. После реакции же он стал +2, а значит, до нуля стало не хватать два электрона. Исходя из этого, можно утверждать, что марганец принял пять электронов: +5e.
Вторая полуреакция состоит из брома. Был он в степени -1, а стал в нулевой. При этом индекс у него стал два. Значит, первоначально в реакцию должны были вступить два атома брома. Следовательно, в исходном состоянии было 2*(-1) = -2 электрона, а после стало ноль. То есть бром отдал два электрона: — 2e.
Интересной особенностью метода является закономерность, что при составлении полуреакций в обязательном порядке в одной из них будут отдаваться электроны, а в другой забираться. Полученные уравнения будут иметь следующий вид:
Mn+7 — Mn+2|+5e |5.
2Br-1 — Br02 |-2e |2.
Для продолжения решения полученные цифры нужно привести к общему знаменателю. В качестве уравнителя здесь будет число десять. Разделив на него количество электронов, находят два опорных коэффициента. Для марганца это будет двойка, а брома — пятёрка.
Полученные числа подставляют в уравнение:
2KBr + 10KMnO4 + h3SO4 → 5 Br2 + 2MnSO4+ K2SO4 + h3O.
Перед бромом должна стоять пятёрка, а вот перед бромом два следует поставить уже десятку. Проверяем, в левой части десять ионов брома вступило в реакцию и десять получилось в прореагирующей части. Возле марганца ставим двойку, соответственно, изменяется и количество калия. В левой части получается 12 атомов, а в правой только два. Поэтому справа возле калия нужно поставить шесть. Аналогично уравнивают серу, водород и кислород.
В итоге полным правильным уравнением будет следующая химическая формула: 2KBr + 10KMnO4 + 8h3SO4 → 5 Br2 + 2MnSO4+ 6K2SO4 + 8h3O. Полученное выражение дальше править уже не нужно. Глядя на него можно утверждать, что марганец является окислителем, а бром восстановителем.
Глядя на него можно утверждать, что марганец является окислителем, а бром восстановителем.
Использование онлайн-калькулятора
В интернете существуют сервисы, использование которых позволяет не только быстро выполнить уравнивание химических уравнений, но и получить нужные знания для самостоятельных вычислений. Называются они химическими онлайн-калькуляторами. Метод электронного баланса сам по себе несложен, но порой составление полуреакций может занять длительное время. Поэтому даже опытные пользователи прибегают к их помощи.
Эти порталы привлекательны тем, что решить поставленную задачу на них сможет даже тот, кто совершенно не разбирается в химии. Доступны онлайн-калькуляторы любому, кто имеет доступ к интернету.
От пользователя требуется загрузить сайт, ввести в предоставленную форму уравнение и кликнуть по меню «Рассчитать». Через две — три секунды система выдаст правильный ответ. При этом услуга предоставляется бесплатно и без ограничений.
Через две — три секунды система выдаст правильный ответ. При этом услуга предоставляется бесплатно и без ограничений.
Установите соответствие между схемой ОВР и коэффициентом … -reshimne.ru
Новые вопросы
Ответы
Похожие вопросы
Запишіть символи хімічних елементів головної підгрупи першої групи та дайте їм назву…
BeCl2,h3O2- Визначте тип хімічного зв’язку ?…
Значення моделювання в органічній хімії полягає в…
Как записать взоимодействие Mg и N помогите
. ..
..
Уравняйте следующие реакции расставив следующие коэффициенты и укажите их тип 1) С+ Н2-> Ch5 2) HgO -> Hg+ O2 3) FeO+ h3-> Fe+h30 4) KOH+ h3SO4-> K2SO4+h3O Вместо точек напишите формулу соответствующего вещества в нижеприведенных реакциях. Уравняйте реакции, расставив коэффициенты и определите их тип: 1) Mg+…-> MgO 2) Fe(OH)3-> …
Вычеслите объем водорода полученного при растворении 50 грамм цинка…
Математика
Литература
Алгебра
Русский язык
ГеометрияАнглийский язык
Химия
Физика
Биология
Другие предметы
История
Окружающий мир
География
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Информатика
Экономика
Музыка
Право
Французский язык
Немецкий язык
МХК
ОБЖ
Презентация Упражнение в расстановке коэффициентов в окислительно-восстановительных реакциях методом электронного баланса презентация, доклад
Презентация «Упражнение в расстановке коэффициентов в окислительно-восстановительных реакциях методом электронного баланса»
Казанцева Евгения Андреевна
учитель химии
МОУ школа №12
г. Жуковский
Жуковский
Алгоритм расстановки коэффициентов в ОВР методом электронного баланса
Запишите схему реакции:
C + HNO3 → CO2 + NO + h3O
1).Определите степень окисления каждого химического элемента
C⁰ + H⁺N⁺⁵O⁻²3 → C⁺⁴O⁻²2 + N⁺²O⁻² + H⁺2O⁻²
2).Найдите элементы, у которых изменилась степень окисления, подчеркните их
C⁰ + H⁺N⁺⁵O⁻²3 → C⁺⁴O⁻²2 + N⁺²O⁻² + H⁺2O⁻²
3).Напишите схемы процессов окисления и восстановления
C⁰−4e → C⁺⁴ (ок-ние, в-ль)
N⁺⁵+3e→N⁺² (в-ние, ок-ль)
4).Найдите коэффициенты
3 C⁰−4e → C⁺⁴ (ок-ние, в-ль)
4 N⁺⁵+3e→N⁺² (в-ние, ок-ль)
5). Проставьте найденные коэффициенты в схему реакции
3C⁰ + 4H⁺N⁺⁵O⁻²3 →3 C⁺⁴O⁻²2 + 4N⁺²O⁻² + 2H⁺2O⁻²
6).Убедитесь в правильности проставленных коэффициентов, сделав проверку по кислороду
12 атомов «О»=12 атомов «О»
Расставьте коэффициенты методом электронного баланса
1). Nh4 + O2 → NO + h3O
Nh4 + O2 → NO + h3O
N⁻³H⁺3 + O⁰2 →N⁺²O⁻ ²+ H⁺2O⁻²
4 N⁻³−5e→N⁺² (ок-ние, в-ль)
5 O⁰2 +4e→2O⁻² (в-ние, ок-ль)
4 N⁻³H⁺3 + 5O⁰2 →4N⁺²O⁻ ²+ 6H⁺2O⁻²
в-ль ок-ль
Проверь
Расставьте коэффициенты методом электронного баланса
2). Nh4 + O2 → N2 + h3O
Проверь
N⁻³H⁺3 + O⁰2→N⁰2 + H⁺2O⁻²
2 2N⁻³−6e→ N⁰2 (ок-ние, в-ль)
3 O⁰2 +4e→2O⁻² (в-ние, ок-ль)
4N⁻³H⁺3 + 3 O⁰2→2N⁰2 + 6H⁺2O⁻²
в-ль ок-ль
Расставьте коэффициенты методом электронного баланса
3). C + h3SO4 → CO2 + SO2 + h3O
Проверь
C⁰ + H⁺2S⁺⁶O⁻²4 → C⁺⁴O⁻²2 + S⁺⁴O⁻²2 + H⁺2O⁻²
1 C⁰−4e → C⁺⁴ (ок-ние, в-ль)
2 S⁺⁶+2e→ S⁺⁴ (в-ние, ок-ль)
C⁰ +2 H⁺2S⁺⁶O⁻²4 → C⁺⁴O⁻²2 + 2S⁺⁴O⁻²2 + 2H⁺2O⁻²
в-ль ок-ль
Расставьте коэффициенты методом электронного баланса
4). Al + V2O5 → Al2O3 + V
Al + V2O5 → Al2O3 + V
Проверь
Al ⁰+ V⁺⁵2O⁻²5 → Al⁺³2O⁻²3 + V⁰
5 Al ⁰−3e → Al⁺³ (ок-ние, в-ль)
3 V⁺⁵+5e→ V⁰ (в-ние, ок-ль)
10Al ⁰+3V⁺⁵2O⁻²5 → 5Al⁺³2O⁻²3 + 6V⁰
в-ль ок-ль
Расставьте коэффициенты методом электронного баланса
Проверь
5). Nh4 + SO2 → N2 + S + h3O
N⁻³H⁺3 + S⁺⁴O⁻²2 → N⁰2 + S⁰ + H⁺2O⁻²
2 2N⁻³−6e→ N⁰2 (ок-ние, в-ль)
3 S⁺⁴+ 4e → S⁰ (в-ние, ок-ль)
4N⁻³H⁺3 + 3 S⁺⁴O⁻²2 → 2N⁰2 + 3S⁰ + 6H⁺2O⁻²
в-ль ок-ль
Расставьте коэффициенты методом электронного баланса
6). MnS + HNO3 → MnSO4 + NO2 + h3O
Проверь
Mn⁺²S⁻² + H⁺N⁺⁵O⁻²3 → Mn⁺²S⁺⁶O⁻²4 + N⁺⁴O⁻²2 + H⁺2O⁻²
1 S⁻² −8e→ S⁺⁶ (ок-ние, в-ль)
8 N⁺⁵ +1e → N⁺⁴ (в-ние, ок-ль)
Mn⁺²S⁻² + 8H⁺N⁺⁵O⁻²3 → Mn⁺²S⁺⁶O⁻²4 + 8N⁺⁴O⁻²2 + 4H⁺2O⁻²
в-ль ок-ль
Расставьте коэффициенты методом электронного баланса
7). ZnS + O2 → ZnO + SO2
ZnS + O2 → ZnO + SO2
Проверь
Zn⁺²S⁻² + O⁰2 → Zn⁺²O⁻² + S⁺⁴O⁻²2
2 S⁻²− 6e→ S⁺⁴ (ок-ние, в-ль)
3 O⁰2 + 4e →2 O⁻² (в-ние, ок-ль)
2 Zn⁺²S⁻² + 3O⁰2 → 2Zn⁺²O⁻² + 2S⁺⁴O⁻²2
в-ль ок-ль
Расставьте коэффициенты методом электронного баланса
8). KI + Cu(NO3)2 → CuI + I2 + KNO3
Проверь
K⁺I⁻ + Cu⁺²(N⁺⁵O⁻²3)2 → Cu⁺I⁻ + I⁰2 + K⁺N⁺⁵O⁻²3
1 2I⁻−2e→ I⁰2 (ок-ние, в-ль)
2 Cu⁺²+ 1e→ Cu⁺ (в-ние, ок-ль)
4K⁺I⁻ + 2Cu⁺²(N⁺⁵O⁻²3)2 → 2Cu⁺I⁻ + I⁰2 + 4K⁺N⁺⁵O⁻²3
в-ль ок-ль
Расставьте коэффициенты методом электронного баланса
9). FeCl3 + h3S→ FeCl2 + S + HCl
Проверь
Fe⁺³Cl⁻3 + H⁺2S⁻²→Fe⁺²Cl⁻2 + S⁰+ H⁺Cl⁻
2 Fe⁺³+1e→Fe⁺² (в-ние, ок-ль)
1 S⁻²−2e→ S⁰ (ок-ние, в-ль)
2Fe⁺³Cl⁻3 + H⁺2S⁻²→2Fe⁺²Cl⁻2 + S⁰+ 2H⁺Cl⁻
ок-ль в-ль
Расставьте коэффициенты методом электронного баланса
10). Nh4 + CuO→ N2 + Cu + h3O
Nh4 + CuO→ N2 + Cu + h3O
Проверь
N⁻³H⁺3 + Cu⁺²O⁻²→ N⁰2 + Cu⁰ + H⁺2O⁻²
1 2N⁻³−6e→ N⁰2 (ок-ние, в-ль)
3 Cu⁺²+2e→ Cu⁰ (в-ние, ок-ль)
2N⁻³H⁺3 + 3Cu⁺²O⁻²→ N⁰2 + 3Cu⁰ + 3H⁺2O⁻²
в-ль ок-ль
Расставьте коэффициенты методом электронного баланса
11). Ca3(PO4)2 + C + SiO2 → CaSiO3 + CO + P
Проверь
Ca⁺²3(P⁺⁵O⁻²4)2 + C⁰ + Si⁺⁴O⁻²2 → Ca⁺²Si⁺⁴O⁻²3 + C⁺²O⁻² + P⁰
2 P⁺⁵+5e→ P⁰ (в-ние, ок-ль)
5 C⁰−2e→ C⁺² (ок-ние, в-ль)
Ca⁺²3(P⁺⁵O⁻²4)2 +5C⁰ + 3Si⁺⁴O⁻²2→3Ca⁺²Si⁺⁴O⁻²3 +5C⁺²O⁻² + 2P⁰
о-ль в-ль
Расставьте коэффициенты методом электронного баланса
12). HCl + HNO3 → Cl2 + NO + h3O
Проверь
H⁺Cl⁻ + H⁺N⁺⁵O⁻²3 → Cl⁰2 + N⁺²O⁻² + H⁺2O⁻²
3 2Cl⁻ −2e→ Cl⁰2 (ок-ние, в-ль)
N⁺⁵+3e→N⁺² (в-ние, ок-ль)
6H⁺Cl⁻ + 2H⁺N⁺⁵O⁻²3 → 3Cl⁰2 + 2N⁺²O⁻² + 4H⁺2O⁻²
в-ль ок-ль
Расставьте коэффициенты методом электронного баланса
13). CrO3 + h3S + h3SO4 →Cr2(SO4)3 + S + h3O
CrO3 + h3S + h3SO4 →Cr2(SO4)3 + S + h3O
Проверь
Cr⁺⁶O⁻²3 + H⁺2S⁻² + H⁺2S⁺⁶O⁻²4 →Cr⁺³2(S⁺⁶O⁻²4)3 + S⁰ + H⁺2O⁻²
2 Cr⁺⁶+3e→Cr⁺³ ( в-ние, ок-ль)
3 S⁻²−2e→ S⁰ ( ок-ние, в-ль)
2Cr⁺⁶O⁻²3 + 3H⁺2S⁻² + 3H⁺2S⁺⁶O⁻²4 →Cr⁺³2(S⁺⁶O⁻²4)3 + 3S⁰ + 6H⁺2O⁻²
ок-ль в-ль
Расставьте коэффициенты методом электронного баланса
14). CrCl2 + HCl + O2 → CrCl3 + h3O
Проверь
Cr⁺²Cl⁻2 + H⁺Cl⁻ + O⁰2 → Cr⁺³Cl⁻3 + H⁺2O⁻²
4 Cr⁺²−1e→Cr⁺³ (ок-ние, в-ль)
1 O⁰2 +4e→2 O⁻² (в-ние, ок-ль)
4Cr⁺²Cl⁻2 + 4H⁺Cl⁻ + O⁰2 → 4Cr⁺³Cl⁻3 + 2H⁺2O⁻²
в-ль ок-ль
Расставьте коэффициенты методом электронного баланса
15). P + HNO3 + h3O→ h4PO4 + NO
Проверь
P⁰ + H⁺N⁺⁵O⁻²3 + H⁺2O⁻²→ H⁺3P⁺⁵O4⁻²+ N⁺²O⁻²
P⁰−5e→ P⁺⁵ ( ок-ние, в-ль)
N⁺⁵+3e→N⁺² ( в-ние, ок-ль)
3P⁰+5H⁺N⁺⁵O⁻²3 +2H⁺2O⁻²→3H⁺3P⁺⁵O4⁻²+ 5N⁺²O⁻²
в-ль ок-ль
Расставьте коэффициенты методом электронного баланса
16). KMnO4 + HCl → Cl2 + MnO2 + KOH + h3O
KMnO4 + HCl → Cl2 + MnO2 + KOH + h3O
Проверь
K⁺Mn⁺⁷O⁻²4 + H⁺Cl⁻ →Cl⁰2 + Mn⁺² Cl ⁻2 + K⁺ Cl⁻+H⁺2O⁻²
2 Mn⁺⁷+5e → Mn⁺² (в-ние, ок-ль)
5 2Cl⁻ −2e→ Cl⁰2 (ок-ние, в-ль)
2K⁺Mn⁺⁷O⁻²4 +16 H⁺Cl⁻→5Cl⁰2 +2 Mn⁺² Cl ⁻2+ 2K⁺ Cl⁻+8H⁺2O⁻²
ок-ль в-ль
Расставьте коэффициенты методом электронного баланса
K⁺Mn⁺⁷O⁻²4 + N⁻³H⁺3 →K⁺N⁺⁵O⁻²3 + Mn⁺⁴O⁻²2 + K⁺O⁻²H⁺ + H⁺2O⁻²
8 Mn⁺⁷+3e→ Mn⁺⁴ (в-ние, ок-ль)
3 N⁻³−8e→ N⁺⁵ (ок-ние, в-ль)
8K⁺Mn⁺⁷O⁻²4 + 3N⁻³H⁺3 →3K⁺N⁺⁵O⁻²3 + 8Mn⁺⁴O⁻²2 + 5K⁺O⁻²H⁺
ок-ль в-ль +2 H⁺2O⁻
Проверь
17). KMnO4 + Nh4 → KNO3 + MnO2 + KOH + h3O
Расставьте коэффициенты методом электронного баланса
18). Zn + HNO3 → Zn(NO3)2 + Nh5NO3 + h3O
Проверь
Zn⁰+ H⁺N⁺⁵O⁻²3→Zn⁺²(N⁺⁵O⁻²3)2+N⁻³H⁺4N⁺⁵O⁻²3 + H⁺2O⁻²
4 Zn⁰−2e →Zn⁺² (ок-ние,в-ль)
1 N⁺⁵+8e→N⁻³ (в-ние,ок-ль)
4Zn⁰+ 10 H⁺N⁺⁵O⁻²3→4Zn⁺²(N⁺⁵O⁻²3)2+ N⁻³H⁺4N⁺⁵O⁻²3 + 3H⁺2O⁻²
в-ль ок-ль
Подготовка к ОГЭ по химии доклад, проект
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация на тему Подготовка к ОГЭ по химии, предмет презентации: Химия. Этот материал в формате pptx (PowerPoint) содержит 17 слайдов, для просмотра воспользуйтесь проигрывателем. Презентацию на заданную тему можно скачать внизу страницы, поделившись ссылкой в социальных сетях! Презентации взяты из открытого доступа или загружены их авторами, администрация сайта не отвечает за достоверность информации в них, все права принадлежат авторам презентаций и могут быть удалены по их требованию.
Этот материал в формате pptx (PowerPoint) содержит 17 слайдов, для просмотра воспользуйтесь проигрывателем. Презентацию на заданную тему можно скачать внизу страницы, поделившись ссылкой в социальных сетях! Презентации взяты из открытого доступа или загружены их авторами, администрация сайта не отвечает за достоверность информации в них, все права принадлежат авторам презентаций и могут быть удалены по их требованию.
Из опыта подготовки учащихся к ОГЭ по химии
Элементы содержания, проверяемые заданиями
экзаменационной работы
Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению энергии. Окислительно-восстановительные реакции. Окислитель и восстановитель.
Описание требований к уровню
подготовки, достижение которого
проверяется в ходе экзамена
Знать: степень окисления, окислитель и
восстановитель, окисление и восстановление
Уметь: определять валентность и с. о.
о.
элементов в соединении, типы химических
реакций
Объяснять: сущность ОВР
Часть 2 — задания с развернутым ответом наиболее сложные в
экзаменационной работе.
Выполнение заданий этого вида предполагает сформированность
комплексных умений:
составлять электронный баланс и уравнение
окислительно-восстановительной реакции
Этапы формирования умений составлять уравнения реакций ОВР
Упражнения в расстановке с.о.
Понятие об окислителях и восстановителях
3. Алгоритм расстановки коэффициентов методом электронного баланса
Типы реакций ОВР
5. Примеры заданий
Степень окисления. Памятка для обучающегося
В соединениях с.о. водорода +1, кроме гидридов
В соединениях с.о. кислорода -2, кроме пероксидов и фторидов
С. о. металлов в соединениях всегда положительная, для металлов первых 3-х «А» групп постоянна: +1, +2, +3 соответственно
о. металлов в соединениях всегда положительная, для металлов первых 3-х «А» групп постоянна: +1, +2, +3 соответственно
4. Степень окисления фтора в соединениях всегда -1
5. У свободных атомов и простых веществ с.о. = 0
6. Суммарная с.о. всех элементов в соединении = 0
Высшая положительная с.о. соответствует номеру группы
8. Низшая отрицательная с.о. находят по формуле: № группы — 8
Примеры заданий
Расставьте с.о. элементов в соединениях:
XeF4, CCl4, PCl4, SnS2, CrO3, SbCl3, Mn2O7,SO2, SO3
KMnO4, Na2Cr2O7, Na2SO3, KClO3, Na2CrO4,
BaMnO4 , Nh5ClO4, CHCl3, HClO, Al2(SO4)3
Восстановитель и окислитель
Восстановитель – это элемент или вещество,
отдающее электроны. Само оно при этом
окисляется.
Окислитель – это элемент или вещество,
принимающее электроны.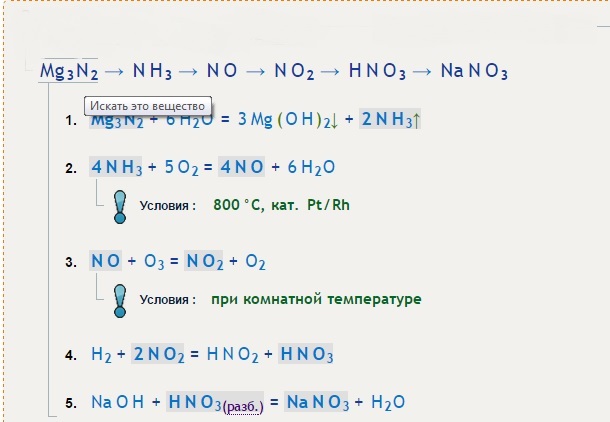
этом восстанавливается.
Окислитель Восстановитель
Активные окислители
Галогены
Кислород
Азот в азотной кислоте
Сера в серной кислоте
Элементы в высшей положительной степени окисления
Активные восстановители
Металлы
Водород
Азот в аммиаке
Сера в сероводороде
Элементы в низшей отрицательной степени окисления
Алгоритм расстановки коэффициентов методом электронного баланса
Записываем уравнение реакций без коэффициентов
Расставляем с.о. у каждого атома, входящего в состав веществ
Подчёркиваем атомы элементов, изменивших с.о.
Составляем электронный баланс
5. За вертикальной чертой выписываем число отданных и принятых электронов
6. Исходя из наименьшего общего кратного, записываем коэффициенты
Исходя из наименьшего общего кратного, записываем коэффициенты
7. В уравнение реакции выставляем коэффициенты из схемы электронного баланса
8. Для атомов элементов не участвующих в балансе, расставляем коэффициенты путём подбора
Взаимодействие простых веществ между собой
В следующих схемах укажите с.о. каждого элемента и расставьте коэффициенты методом электронного баланса:
Na + Br2 NaBr
N2 + Mg Mg3N2
Допишите уравнения реакций ОВР:
Cl2 + Fe
Al + I2
Реакции простых веществ со сложными веществами
Расставьте коэффициенты, используя метод электронного баланса:
Nh4 + O2 N2 + h3O
Al + V2O5 Al2O3 + V
Допишите уравнения реакций ОВР:
С + h3SO4
ZnS + O2
Используя метод электронного баланса, составьте уравнение реакции
Определите окислитель и восстановитель.
h3SO4 + Al → Al2(SO4)3 + S + h3O
Ag + HClO3 → AgCl + AgClO3 + h3O
S + KOH → K2S + K2SO3 + h3O
B + HBrO3 + h3O → h4BO3 + HBr
Cl2 + I2 + h3O→ HIO3 + HCl
HNO3 + P + h3O → NO + h4PO4
Реакции между сложными веществами
Используя метод электронного баланса, составьте уравнение реакции
Определите окислитель и восстановитель.
KMnO4 + KOH → K2MnO4 + O2 + h3O
FeO + HNO3 → Fe(NO3)3 + NO + h3O
HNO2 + HI → I2 + NO + h3O
CuO + Nh5Cl → Cu + N2 + HCl + h3O
NaNO3 + (Nh5)2SO4 → N2O + h3O + Na2SO4
Скачать презентацию
Это сайт презентаций, где можно хранить и обмениваться своими презентациями, докладами, проектами, шаблонами в формате PowerPoint с другими пользователями. Мы помогаем школьникам, студентам, учителям, преподавателям хранить и обмениваться учебными материалами.
Для правообладателей
Обратная связь
Email: Нажмите что бы посмотреть
Реакции окислительно-восстановительные.
 Часть 1
Часть 1Чтобы поделиться, нажимайте
В начале страницы вы можете выполнить тест онлайн (после ввода ответа нажимайте кнопку «Проверить решение»: если ответ неверный, то вводите другой ответ, пока не введёте верный или нажмите кнопку «Показать ответ» и у вас появится правильный ответ на это задание и вы сможете перейти к следующему заданию). В середине страницы вы увидите текстовые условия заданий, а текстовые ответы представлены в конце страницы.
Задание 19
- Установите соответствие между изменением степени окисления серы и формклами веществ, при взаимодействии которых это изменение происходит: к каждой позиции обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ФОРМУЛЫ ВЕЩЕСТВ
А) S0 → S+4 1) Cu и H2SO4 (конц. )
)
Б) S+4 → S+6 2) H2S и I2
В) S-2 → S0 3) S и O2
4) SO2 и Cl2 (p-p)
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между уравнением окислительно-восстановительной реакции и изменением степени окисления серы в ней: к каждой позиции обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ СЕРЫ
А) 2Al + 3S = Al2S3 1) от -2 до +4
Б) 2SO2 + O2 = 2SO3 2) от -2 до 0
В) 2H2S + 3O2 = 2H2O + 2SO2 3) от 0 до -2
4) от +4 до +6
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между схемой химической реакции и изменением степени окисления восстановителя в этой реакции: к каждой позиции обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ
А) FeCl3 + HI → FeCl2 + I2 + HCl 1) Fe+3 → Fe+2
Б) FeCl2 + Cl2 → FeCl3 2) 2I— → I20
В) Fe3O4 + HI → FeI2 + I2 + H2O 3) Fe+2 → Fe+3
4) Cl2 + HI → 2HCl + I2
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между схемой окислительно-восстановительной реакции и коэффициентом перед формулой восстановителя: к каждой позиции обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.

СХЕМА РЕАКЦИИ КОЭФФИЦИЕНТ
А) NH3 + CuO → Cu + N2 + H2O 1) 2
Б) NH3 + O2 → NO + H2O 2) 6
В) HNO3 + Cu → Cu(NO3)2 + NO2 + H2O 3) 4
4) 1
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между схемой реакции и изменением степени окисления восстановителя в ней: к каждой позиции обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ
А) KNO3 → KNO2 + O2 1) +4 → +5
Б) KNO3 + P → KNO2 + P2O5 2) +3 → +5
В) NO2 + KOH → KNO2 + KNO3 +H2O 3) -2 → 0
4) 0 → +5
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между уравнением окислительно-восстановительной реакции и свойством азота, которое он проявляет в этой реакции: к каждой позиции обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ РЕАКЦИИ СВОЙСТВО АЗОТА
А) 3CuO + 2NH3 = N2 + 3Cu + 3H2O 1) окислитель
Б) 4NH3 + 5O2 = 4NO + 6H2O 2) восстановитель
В) 6Li + N2 = 2Li3N 3) и окислитель, и восстановитель
4) не проявляет окислительно-восстановительных св-в
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между схемой превращения и формулами веществ при взаимодействии которых оно происходит: к каждой позиции обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.

СХЕМА ПРЕВРАЩЕНИЯ ФОРМУЛЫ ВЕЩЕСТВ
А) Fe0 → Fe+2 1) Fe и Cl2
Б) Fe0 → Fe+3 2) Fe(OH)2 и O2 (в присутствии Н2О)
В) Fe+2 → Fe+3 3) FeO и CO
4) Fe и H2SO4 (разб.)
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между схемой реакции и формулой вещества восстановителя в ней: к каждой позиции обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ ФОРМУЛА ВОССТАНОВИТЕЛЯ
А) Cl2 + KOH → KCl + KClO3 + H2O 1) KOH
Б) H2O2 + Ag2O → H2O + Ag + O2 2) Cl2
В) H2O2 + Cl2 → HCl + O2 3) H2O2
4) Ag2O
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между уравнением окислительно-восстановительной реакции и изменением степени окисления серы в ней: к каждой позиции обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ СЕРЫ
А) Cu + S = CuS 1) от 0 до -2
Б) SO2 + 2H2S = 3S + 2H2O 2) от -2 и +4 до 0
В) S + O2 = SO2 3) от 0 до +4
4) от +4 до +6
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой частицы и способностью этой частицы проявлять окислительно-восстановительные свойства: к каждой позиции обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ЧАСТИЦЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА
А) N-3 1) только окислитель
Б) SO32- 2) только восстановитель
В) C-4 3) и окислитель, и восстановитель
4) не проявляет окислительно-восстановительных св-в
Запишите в таблицу выбранные цифры под соответствующими буквами.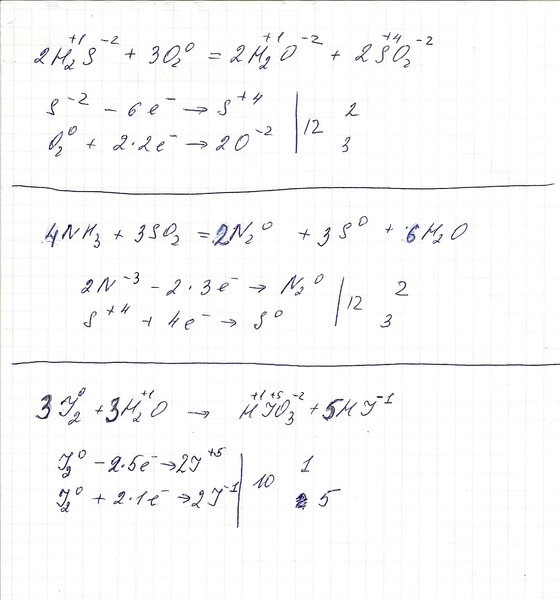
Установите соответствие между уравнением реакции и изменением степени окисления восстановителя в данной реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ РЕАКЦИИ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ
А) PH3 + 8HNO3 (конц) = H3PO4 + 8NO2 + 4H2O 1) –1 → 0
Б) 2Fe(OH)2 + H2O2 = 2Fe(OH)3 2) –3 → +5
В) 2NaBr + MnO2 + 2H2SO4 = Br2 + MnSO4 + Na2SO4 + 2H2O 3) 0 → +1
4) +2 → +3
5) 0 → +2
6) +4 → +2
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между названием элемента и характерными степенями окисления, которые он может проявлять: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.

НАЗВАНИЕ ЭЛЕМЕНТА ХАРАКТЕРНЫЕ СТЕПЕНИ ОКИСЛЕНИЯ
А) кислород 1) -4, 0, +4
Б) бром 2) 0, +2, +3, +6
В) кремний 3) -2, -1, 0, +2
4) 0, +2, +4, +6, +7
5) -1, 0, +1, +5, +7
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой вещества и степенью окисления серы в нём: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ СЕРЫ
А) СS2 1) –2
Б) Ba(HSO4)2 2) –1
В) Ca(HS)2 3) +1
4) +2
5) +4
6) +6
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между уравнением реакции и формулой вещества, являющегося восстановителем в данной реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.

УРАВНЕНИЕ РЕАКЦИИ ВОССТАНОВИТЕЛЬ
А) Fe2(SO4)3 + SO2 + 2H2O = 2FeSO4 + 2H2SO4 1) Fe2(SO4)3
Б) SO2 + H2O2 = H2SO4 2) SO2
В) C + 2S = CS2 3) H2O2
4) C
5) S
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между схемой реакции и изменением степени окисления восстановителя в данной реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ
А) Ca3(PO4)2 + C + SiO2 → P + CO + CaSiO3 1) C0 → C+2
Б) SO2 + Cl2 + NaOH → Na2SO4 + NaCl + H2O 2) S+4 → S+6
В) Si + KOH + H2O → K2SiO3 + H2 3) Si0 → Si+4
4) P+5 → P0
5) Cl0 → Cl-1
6) H+1 → H0
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между схемой изменения степени окисления элемента и уравнением реакции, в ходе которой это изменение происходит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА ИЗМЕНЕНИЯ УРАВНЕНИЕ РЕАКЦИИ
А) P–3 → P+5 1) SiO2 + 3C = SiC + 2CO
Б) Si+4 → Si0 2) SiO2 + 4HF = SiF4 + 2H2O
В) P0 → P+5 3) PH3 + 2O2 = H3PO4
4) SiO2 + 2C = Si + 2CO
5) 5HNO3 + P = H3PO4 + 5NO2 + H2O
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между уравнением реакции и свойством элемента азота, которое он проявляет в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.

УРАВНЕНИЕ РЕАКЦИИ СВОЙСТВО АЗОТА
А) NH4HCO3 = NH3 + H2O + CO2 1) является окислителем
Б) 3СuO + 2NH3 = N2 + 3Cu + 3H2O 2) является восстановителем
В) 4NH3 + 5O2 = 4NО + 6H2O 3) является и окислителем, и восстановителем
4) не проявляет окислительно-восстановительных свойств
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между уравнением реакции и изменением степени окисления окислителя в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ
А) KClO3 + Cr2O3 + 4KOH = 2K2CrO4 + KCl + 2H2O 1) +1 → 0
Б) 3NaNO2 + 2KMnO4 + H2O = 3NaNO3 + 2MnO2 + 2KOH 2) -1 → -2
В) 2KI + H2O2 = I2 + 2KOH 3) +7 → +4
4) +5 → -1
5) 0 → -2
6) +4 → +2
Запишите в таблицу выбранные цифры под соответствующими буквами.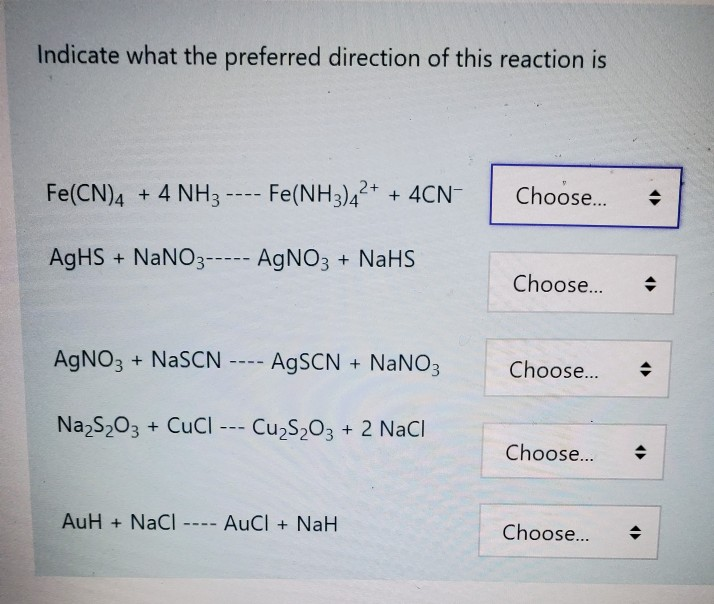
Установите соответствие между уравнением реакции и изменением степени окисления окислителя в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ РЕАКЦИИ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ
А) Na2O2 + 4HCl = Cl2 + 2NaCl + 2H2O 1) +1 → 0
Б) 4Ca + 5H2SO4 = 4CaSO4 + H2S + 4H2O 2) -1 → -2
В) 3Cu2O + Na2Cr2O7 + 10H2SO4 = 6CuSO4 + Cr2(SO4)3 + Na2SO4 + 10H2O 3) +5 → +2
4) +5 → -3
5) +6 → -2
6) +6 → +3
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между схемой реакции и изменением степени окисления окислителя в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ
А) Zn + HNO3(разб.) → Zn(NO3)2 + NO + H2O 1) +1 → 0
Б) Mg + HNO3(разб.) → Mg(NO3)2 + NH4NO3 + H2O 2) -1 → -2
В) BaSO4 + C → BaS + CO 3) +5 → +2
4) +5 → -3
5) +6 → -2
6) +4 → +6
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между схемой реакции и изменением степени окисления восстановителя в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.

СХЕМА РЕАКЦИИ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ
А) Zn + KNO3 + KOH + H2O → K2[Zn(OН)4] + NH3 1) -3 → 0
Б) CaH2 + H2S → CaS + H2 2) -1 → -0
В) S + KOH → K2S + K2SO3 + H2O 3) 0 → +2
4) 0 → +4
5) +2 → +4
6) +4 → +6
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между схемой реакции и изменением степени окисления окислителя в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ
А) Mg + H2SO4 → MgSO4 + H2S + H2O 1) 0 → -1
Б) H2S + H2O2 → H2SO4 + H2O 2) -1 → -2
В) Na2SO3 → Na2S + Na2SO4 3) +4 → 0
4) +6 → -2
5) +4 → -2
6) +5 → -3
Запишите в таблицу выбранные цифры под соответствующими буквами.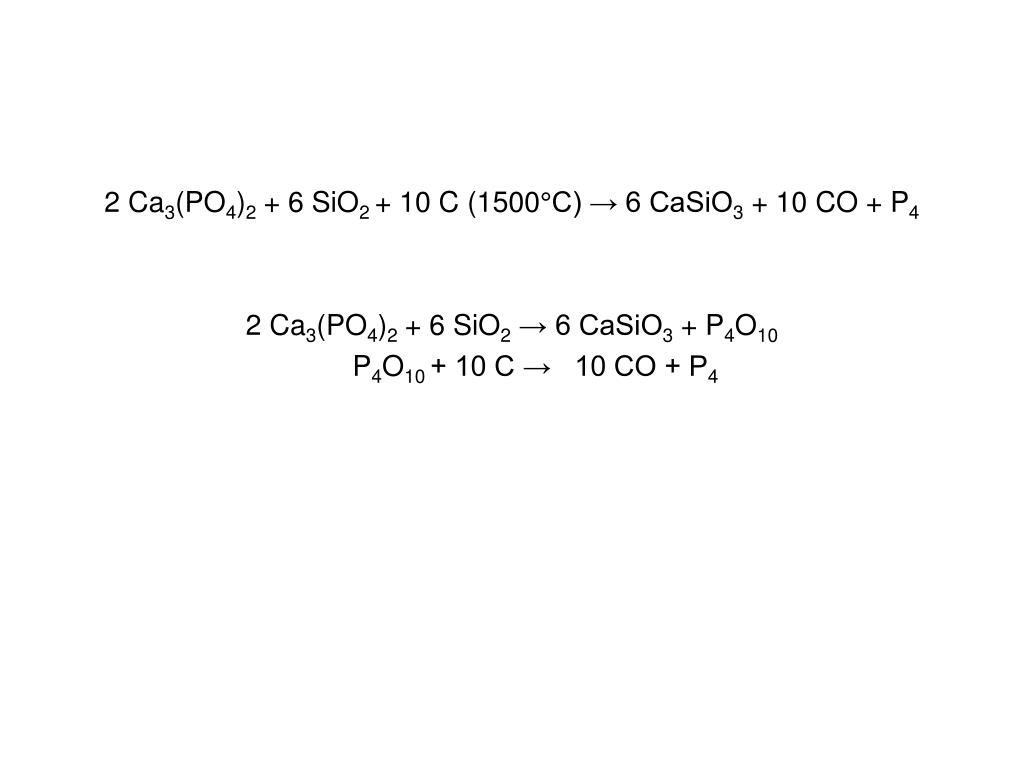
Установите соответствие между схемой реакции и изменением степени окисления восстановителя в ней: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА РЕАКЦИИ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ
А) KNO3 → KNO2 + O2 1) N+4 → N+3
Б) KNO3 + P → KNO2 + P2O5 2) N+4 → N+5
В) KNO2 + H2O2 → KNO3 + H2O 3) N+3 → N+5
4) O–2 → O0
5) P0 → P+5
6) O–1 → O–2
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между уравнением реакции и формулой вещества, являющегося окислителем в данной реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.

УРАВНЕНИЕ РЕАКЦИИ ОКИСЛИТЕЛЬ
А) 2NH3 + 2Na = 2NaNH2 + H2 1) NH3
Б) 4NO2 + O2 + 2H2O = 4HNO3 2) O2
В) 4NH3 + 6NO = 5N2 + 6H2O 3) NO2
4) NO
5) H2O
6) Na
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой заряженной частицы и степенью окисления фосфора в ней: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ЗАРЯЖЕННОЙ ЧАСТИЦЫ СТЕПЕНЬ ОКИСЛЕНИЯ ФОСФОРА
А) PCl4— 1) -1
Б) PF6— 2) +1
В) P2O74- 3) +3
4) +4
5) +5
6) -3
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между уравнением реакции и изменением степени окисления окислителя в данной реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ РЕАКЦИИ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ
А) H2S + 2Na = Na2S + H2 1) -1 → 0
Б) SO2 + NO2 = SO3 + NO 2) 0 → -2
В) 4NO2 + O2 + 2H2O = 4HNO3 3) +4 → +6
4) +1 → 0
5) +4 → +2
6) 0 → -1
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между схемой реакции и формулой вещества, являющегося восстановителем в данной реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.

СХЕМА РЕАКЦИИ ВОССТАНОВИТЕЛЬ
А) NO2 + O2 + H2O → HNO3 1) NH3
Б) HNO3 + Cu → Cu(NO3)2 + NO + H2O 2) H2O
В) NH3 + O2 → N2 + H2O 3) NO2
4) Cu
5) O2
6) HNO3
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между формулой иона и окислительно-восстановительными свойствами, которые этот ион может проявлять: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ИОНА ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА
А) NO2– 1) не проявляет окислительно-восстановительных свойств
Б) Fe2+ 2) и окислитель, и восстановитель
В) S2– 3) только окислитель
4) только восстановитель
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между уравнением реакции и свойством элемента серы, которое он проявляет в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА СЕРЫ
А) SO3 + H2O = H2SO4 1) Является окислителем
Б) S + H2 = H2S 2) Является восстановителем
В) 2H2SO4 + S = 3SO2 + 2H2O 3) Является окислителем и восстановителем
4) Не является ни окислителем, ни восстановителем
Запишите в таблицу выбранные цифры под соответствующими буквами.
Установите соответствие между уравнением реакции и свойством элемента хлора, которое он проявляет в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.

УРАВНЕНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА ХЛОРА
А) 4HCl + MnO2 = MnCl2 + Cl2 + 2H2O 1) Является окислителем
Б) HCl + NaOH= NaCl + H2O 2) Является восстановителем
В) Cl2 + H2O = HCl + HClO 3) Является окислителем и восстановителем
4) Не является ни окислителем, ни восстановителем
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответы:
- 342
- 341
- 232
- 134
- 341
- 221
- 412
- 233
- 123
- 232
- 241
- 351
- 161
- 224
- 123
- 345
- 422
- 432
- 256
- 345
- 324
- 425
- 453
- 124
- 355
- 452
- 341
- 224
- 413
- 243
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
ЕГЭ 2021 по химии. Теория и примеры заданий» src=»https://www.youtube.com/embed/videoseries?list=PLEL-sAdim5FZ81m39YJMjJ4hCLzWL8S61″ frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»>
Также:
- Посмотреть реальные, досрочные и пробные варианты ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки для подготовки к ЕГЭ вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ вы можете здесь, нажав на эту строку
Урок по химии «Окислительно-восстановительные реакции»
#8 класс #Химия #Методические разработки #Урок #Учитель-предметник #Школьное образование
« Кто-то теряет, а кто-то находит…»
«Чтобы что-то узнать, нужно уже что-то знать“ Станислав Лем
Классификация химических реакций Химические реакции По числу исходных и конечных в-в По направлению По использо- ванию катализатора По агрегатному состоянию в-в По тепловому эффекту Реакции соединения Реакции разложения Реакции замещения Реакции обмена Обратимые Необратимые Катали- тические Некатали- тические Гомогенные Гетерогенные Экзо- термические Эндо- термические
Дайте характеристику реакциям по всем известным признакам классификации. t,MnO2
2КClO3(т) → 2KCl(т) + 3O2(г)↑ — Q
2NO(г) + O2(г) ⇄ 2NO2(г) + Q
C(т) + CO2(г) ⇄ 2CO(г) — Q
t,MnO2
2КClO3(т) → 2KCl(т) + 3O2(г)↑ — Q
2NO(г) + O2(г) ⇄ 2NO2(г) + Q
C(т) + CO2(г) ⇄ 2CO(г) — Q
Тема урока: «Окислительно-восстановительные реакции»
Определите степень окисления элементов в веществах, формулы которых: HNO3, Mg(NO3)2, Zn, h3SO4, Br2, h4PO4, Cu2O, O3, NaNO2, КMnO4
Лабораторный опыт Проведите реакции между раствором сульфата меди (II) и: раствором гидроксида натрия, железной кнопкой. Укажите признаки химических реакций, запишите молекулярные уравнения и определите степень окисления каждого элемента.
Классификация химических реакций Химические реакции По числу исходных и конечных в-в По направлению По использо- ванию катализатора По фазовому составу По тепловому эффекту Реакции соединения Реакции разложения Реакции замещения Реакции обмена Обратимые Необратимые Катали- тические Некатали- тические Гомогенные Гетерогенные Экзо- термические Эндо- термические По изменению СО атомов элементов ОВР Без изменения СО
ОВР – это такие реакции, при которых
происходит изменение СО элементов. Окисление – это процесс отдачи электронов, степень окисления при этом повышается.
Восстановление – это процесс присоединения электронов, степень окисления при этом понижается.
Атомы, молекулы или ионы, отдающие электроны, являются восстановителями.
Атомы, молекулы или ионы,
присоединяющие электроны, называются окислителями.
Окисление – это процесс отдачи электронов, степень окисления при этом повышается.
Восстановление – это процесс присоединения электронов, степень окисления при этом понижается.
Атомы, молекулы или ионы, отдающие электроны, являются восстановителями.
Атомы, молекулы или ионы,
присоединяющие электроны, называются окислителями.
«Окислитель как отъявленный злодей, Как пират, бандит, агрессор, Бармалей, Отнимает электроны — и ОК! Потерпев урон, восстановитель Восклицает: «Вот я, помогите! Электроны мне мои верните!»… Но никто не помогает и ущерб Не возмещает…» Запомните! Отдать электроны – окислиться, взять электроны – восстановиться
Какие из приведенных схем уравнений можно отнести к ОВР? Определите типы реакций. 1) СаСО3 → СаО + СО2 2) 2KMnO4 → K2MnО4 + MnО2 + О2↑ 3) N2 + 3Н2 → 2NН3 4) N2O5 + h3O → 2HNO3 5) Mg + 2HCl → MgCl2 + h3↑ 6) AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl 7) 2CuS + 3О2 → 2СuО + 2SО2↑
Вывод:
К окислительно-восстановительным реакциям относятся:
все реакции замещения;
только те реакции соединения и разложения,
в которых участвует хотя бы одно простое
вещество;
реакции горения. Все реакции ионного обмена не будут являться окислительно-восстановительными!
Все реакции ионного обмена не будут являться окислительно-восстановительными!
Многообразие окислительно-восстановительных реакций
Тестовое задание Задание № 1. I вариант К ОВР не относится реакция, представленная схемой: А) N2 + 3Н2 → 2NН3 Б) Mg + 2HCl → MgCl2 + h3↑ В) MgCO3 → MgO + CO2 ↑ Г) 2CuO → 2Cu + O2↑ Задание № 1. II вариант К ОВР относится реакция, представленная схемой: А) h3O + CaO → Ca(OH)2 Б) h3O + N2O5 → 2HNO3 В) Na2CO3 +2HCl →2NaCl+ h3O+CO2 Г) CuO + h3 → Cu + h3O
Тестовое задание Задание № 2. I вариант В каком соединении степени окисления элементов равны -3 и +1 А) NF3 Б) Cl2O3 В) Nh4 Г) AlCl3 Задание № 2. II вариант В каком соединении степени окисления элементов равны +3 и -2 А) NF3 Б) Cl2O3 В) Nh4 Г) AlCl3
Тестовое задание
Задание № 3.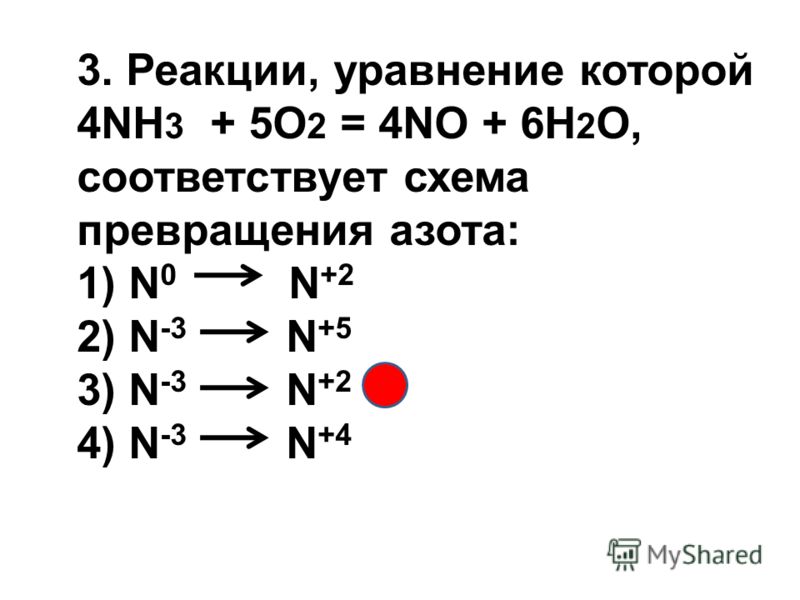 I вариант
Схема Na0 → Na+1
отражает процесс:
А) Окисления
Б) Восстановления
В) Нейтрализации
Г) Диссоциации
Задание № 3.
II вариант
Схема Сl0 → Сl-1
отражает процесс:
А) Окисления
Б) Восстановления
В) Нейтрализации
Г) Диссоциации
I вариант
Схема Na0 → Na+1
отражает процесс:
А) Окисления
Б) Восстановления
В) Нейтрализации
Г) Диссоциации
Задание № 3.
II вариант
Схема Сl0 → Сl-1
отражает процесс:
А) Окисления
Б) Восстановления
В) Нейтрализации
Г) Диссоциации
Тестовое задание Задание № 4. I вариант Восстановительные свойства простых веществ, образованных элементами второго периода, с увеличением заряда ядра: А) Уменьшаются Б) Усиливаются В) Изменяются периодически Г) Не изменяются Задание № 4. II вариант Окислительные свойства простых веществ, образованных элементами седьмой группы главной подгруппы с увеличением заряда ядра: А) Уменьшаются Б) Усиливаются В) Изменяются периодически Г) Не изменяются
Ответы I вариант 1 — В 2 — В 3 — А 4 — А II вариант 1 — Г 2 — Б 3 — Б 4 — А
Поразительно отличительное поведение Nh4-SCR по сравнению с Cu-SSZ-13 в присутствии NO2
Реферат
Коммерческие медно-обменные мелкопористые цеолитные катализаторы SSZ-13 (Cu-SSZ-13) обладают высокой активностью для стандартной селективной каталитической реакции.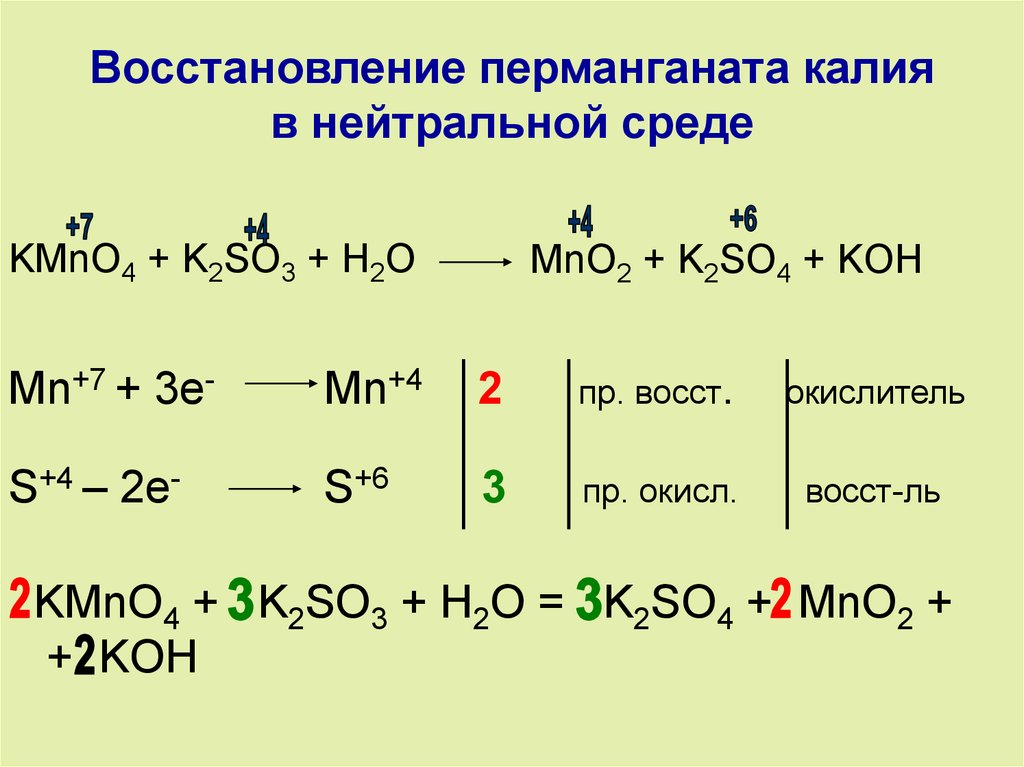 восстановление (SCR) NO с помощью NH 3 . Однако их активность неожиданно ингибируется в присутствии NO 2 при низких температурах. Это разительно отличается от NO 2 ускоренной конверсии NO x по сравнению с другими типичными каталитическими системами SCR. Здесь мы объединяем кинетические эксперименты, рентгеновскую абсорбционную спектроскопию in situ и расчеты теории функционала плотности (DFT), чтобы получить прямые доказательства того, что в условиях реакции сильное окисление NO 2 вынуждает ионы Cu существовать в основном в виде частиц Cu II (fw-Cu 2+ и NH 3 -сольватированная Cu II с высокими значениями ХЧ), что препятствует подвижности частиц Cu. Реакция СКЛ, протекающая на этих сайтах Cu II со слабой подвижностью, демонстрирует более высокий энергетический барьер, чем стандартная реакция СКЛ на динамических биядерных сайтах. Более того, реакция СКВ с участием NO 2 имеет тенденцию происходить на бренстедовских кислотных центрах (БКЦ), а не на Cu II сайтов.
восстановление (SCR) NO с помощью NH 3 . Однако их активность неожиданно ингибируется в присутствии NO 2 при низких температурах. Это разительно отличается от NO 2 ускоренной конверсии NO x по сравнению с другими типичными каталитическими системами SCR. Здесь мы объединяем кинетические эксперименты, рентгеновскую абсорбционную спектроскопию in situ и расчеты теории функционала плотности (DFT), чтобы получить прямые доказательства того, что в условиях реакции сильное окисление NO 2 вынуждает ионы Cu существовать в основном в виде частиц Cu II (fw-Cu 2+ и NH 3 -сольватированная Cu II с высокими значениями ХЧ), что препятствует подвижности частиц Cu. Реакция СКЛ, протекающая на этих сайтах Cu II со слабой подвижностью, демонстрирует более высокий энергетический барьер, чем стандартная реакция СКЛ на динамических биядерных сайтах. Более того, реакция СКВ с участием NO 2 имеет тенденцию происходить на бренстедовских кислотных центрах (БКЦ), а не на Cu II сайтов. Эта работа ясно объясняет поразительно своеобразное селективное каталитическое поведение в этой цеолитной системе.
Эта работа ясно объясняет поразительно своеобразное селективное каталитическое поведение в этой цеолитной системе.
Введение
Во всем мире применяются все более строгие нормы выбросов от мобильных источников для борьбы с загрязнением окружающей среды. Оксиды азота (NO x ) являются неизбежными газообразными загрязнителями, выбрасываемыми двигателями внутреннего сгорания. Селективное каталитическое восстановление NO x с NH 3 (NH 3 -SCR) является наиболее широко применяемой технологией удаления NO x с дизельных двигателей 1,2 . Успешная коммерциализация Cu-SSZ-13 в качестве катализатора NH 3 -SCR является значительным достижением в области доочистки выхлопных газов дизельных двигателей 3 . В последнее десятилетие в ходе многочисленных исследований были предприняты попытки раскрыть стандартный механизм реакции SCR (SSCR) 4,5,6,7 , механизм гидротермальной дезактивации 8,9,10,11 и SO 2 механизм дезактивации отравления 12,13,14 , а также разработать экономичные и устойчивые методы синтеза Cu-SSZ-13 15,16,17,18 , обеспечение непрерывной оптимизации Cu-SSZ-13 для коммерческих катализаторов СКВ.
На практике дизельный катализатор окисления (DOC) используется для окисления монооксида углерода (CO) и углеводородов (HCs), сопровождающегося частичным окислением NO до NO 2 . Формируемый № 2 может участвовать в процессе NH 3 -SCR посредством так называемой «быстрой реакции SCR» (FSCR, реакция 1, состоящая из реакций 2 и 3). Принято считать, что эффективность deNO x реакции FSCR должна быть выше, чем у SSCR (реакция 4), за счет обхода окисления NO, которое обычно является лимитирующей стадией в реакции SSCR на V катализаторы на основе цеолита и железа 19,20 .
$$NO+N{O}_{2}+2N{H}_{3}\to 2{N}_{2}+3{H}_{2}O$$
(1)
$$2N{O}_{2}+2N{H}_{3}\к N{H}_{4}N{O}_{3}+{N}_{ 2}+{H}_{2}O$$
(2)
$$NO+N{H}_{4}N{O}_{3}\to {N}_{2}+ N{O}_{2}+2{H}_{2}O$$
(3)
$$4NO+4N{H}_{3}+{O}_{2}\to 4 {N}_{2}+6{H}_{2}O$$
(4)
Однако было проведено несколько исследований, в которых сообщается, что NO 2 заметно повышает эффективность NH 3 -SCR по сравнению с Каталитические системы Cu-SSZ-13. Напротив, ингибирование превращения NO NO 2 был обнаружен на катализаторах Cu-SSZ-13, богатых алюминием, за счет образования NH 4 NO 3 , так называемой «аномально быстрой реакции NH 3 -SCR» 21 . В нашем недавнем исследовании мы обнаружили, что ингибирующий эффект NO 2 был тесно связан с кислотными центрами Бренстеда (БКЦ) и может быть смягчен гидротермическим старением из-за уменьшения количества БКЦ в Cu-SSZ-13 22. . Поэтому мы предположили, что восстановление NO 2 , вероятно, происходит в БАВ. Также ранее мы наблюдали реакцию между NO и NH 4 NO 3 происходящие в БАВ на катализаторе H-SSZ-13 23 . Кроме того, Kubota et al. установили, что NO реагирует с NH 4 NO 3 быстрее, чем NH 4 NO 3 при разложении на цеолитах H-AFX и H-CHA 24,25 . Однако в медьсодержащих цеолитах ситуация более сложная.
Напротив, ингибирование превращения NO NO 2 был обнаружен на катализаторах Cu-SSZ-13, богатых алюминием, за счет образования NH 4 NO 3 , так называемой «аномально быстрой реакции NH 3 -SCR» 21 . В нашем недавнем исследовании мы обнаружили, что ингибирующий эффект NO 2 был тесно связан с кислотными центрами Бренстеда (БКЦ) и может быть смягчен гидротермическим старением из-за уменьшения количества БКЦ в Cu-SSZ-13 22. . Поэтому мы предположили, что восстановление NO 2 , вероятно, происходит в БАВ. Также ранее мы наблюдали реакцию между NO и NH 4 NO 3 происходящие в БАВ на катализаторе H-SSZ-13 23 . Кроме того, Kubota et al. установили, что NO реагирует с NH 4 NO 3 быстрее, чем NH 4 NO 3 при разложении на цеолитах H-AFX и H-CHA 24,25 . Однако в медьсодержащих цеолитах ситуация более сложная. Макьюэн и др. обнаружили, что в катализаторе Cu-SSZ-13 в условиях FSCR доминируют частицы Cu(II) с четырехкратной координацией, что отличается от состава в условиях SSCR, где присутствуют частицы Cu(I) и Cu(II) 26 . Паолуччи и др. исследовал процесс окисления Cu(I)(NH 3 ) 2 частицами O 2 и NO 2 . Было обнаружено, что окисление NO 2 происходит в изолированных центрах Cu, а не в центрах димера Cu, необходимых для активации O 2 5 . Совсем недавно Лю и соавт. исследовали механизм FSCR на участке Cu-OH на цеолите Cu-CHA и показали важную роль БКВ в реакции FSCR 27 . Таким образом, можно сделать вывод, что путь реакции FSCR на Cu-SSZ-13 уникален и отличается от других каталитических систем, где NO 2 ускоряет скорость SCR. Активные центры, а также окислительно-восстановительные пути могут изменяться на Cu-SSZ-13 в присутствии NO 2 . По сравнению с относительно небольшим количеством исследований механизма реакции FSCR, за последнее десятилетие исследователи провели множество экспериментальных и теоретических исследований для изучения механизма реакции SSCR.
Макьюэн и др. обнаружили, что в катализаторе Cu-SSZ-13 в условиях FSCR доминируют частицы Cu(II) с четырехкратной координацией, что отличается от состава в условиях SSCR, где присутствуют частицы Cu(I) и Cu(II) 26 . Паолуччи и др. исследовал процесс окисления Cu(I)(NH 3 ) 2 частицами O 2 и NO 2 . Было обнаружено, что окисление NO 2 происходит в изолированных центрах Cu, а не в центрах димера Cu, необходимых для активации O 2 5 . Совсем недавно Лю и соавт. исследовали механизм FSCR на участке Cu-OH на цеолите Cu-CHA и показали важную роль БКВ в реакции FSCR 27 . Таким образом, можно сделать вывод, что путь реакции FSCR на Cu-SSZ-13 уникален и отличается от других каталитических систем, где NO 2 ускоряет скорость SCR. Активные центры, а также окислительно-восстановительные пути могут изменяться на Cu-SSZ-13 в присутствии NO 2 . По сравнению с относительно небольшим количеством исследований механизма реакции FSCR, за последнее десятилетие исследователи провели множество экспериментальных и теоретических исследований для изучения механизма реакции SSCR. Таким образом, механизм SSCR был относительно ясен, в котором динамические биядерные частицы Cu + являются первичными активными центрами 4,5,28 . Однако влияние NO 2 на активных центрах меди и механизм реакции СКВ с участием NO 2 почти не обсуждаются и заслуживают изучения, поскольку NO и NO 2 всегда сосуществуют в реальных приложениях.
Таким образом, механизм SSCR был относительно ясен, в котором динамические биядерные частицы Cu + являются первичными активными центрами 4,5,28 . Однако влияние NO 2 на активных центрах меди и механизм реакции СКВ с участием NO 2 почти не обсуждаются и заслуживают изучения, поскольку NO и NO 2 всегда сосуществуют в реальных приложениях.
В этом исследовании реакция СКВ на катализаторе Cu-SSZ-13 в присутствии как NO, так и NO 2 изучалась с помощью кинетических измерений. In situ измерения тонкой структуры поглощения рентгеновских лучей (XAFS) были применены для выявления состояния частиц меди в условиях SSCR (только с NO в качестве NO x ), FSCR (равная смесь NO и NO 2 AS № x ) и NO 2 -SCR (только № 2 как № x ). Условия реакции. Расчеты теории функционала плотности (DFT) были проведены для определения путей реакции SCR, связанных с NO 2 . Эти результаты дают новое представление о роли NO 2 в реакции NH 3 -СКВ и проливают свет на фактическое применение катализаторов Cu-SSZ-13 в присутствии как NO, так и NO 2 .
Эти результаты дают новое представление о роли NO 2 в реакции NH 3 -СКВ и проливают свет на фактическое применение катализаторов Cu-SSZ-13 в присутствии как NO, так и NO 2 .
Результаты и обсуждение
Кинетические исследования превращения NO
x в условиях SSCR, FSCR и NO 2 -SCR условия Сначала мы провели кинетические исследования реакции SSCR, результаты которых показаны на рис. 1. и Дополнительный рисунок 1. Скорость SSCR увеличивается линейно с квадратом загрузки Cu, когда загрузка Cu ниже 1,7 мас.% (увеличено на рис. 1b), что указывает на участие пар Cu в стандарте NH 3 — Реакция SCR. Предыдущие исследования показали, что димеры Cu I образуются с активацией O 2 в полуцикле окисления (Cu I → Cu II ) 4,5 . Недавно Ху и соавт. также предложил полуцикл низкотемпературного восстановления, опосредуемый парами Cu II (Cu II → Cu I ) 6 . Чен и др. также указывалось на участие пар Cu в восстановительном полупериоде 29 . Следовательно, образование пары Cu в одном и том же каркасе имеет существенное значение для общего стандарта NH 3 — Процесс реакции SCR. Тенденция роста замедляется с дальнейшим увеличением нагрузки Cu. Частота оборота (TOF) имеет тенденцию вулканического типа с максимумом при содержании Cu 1,7 мас.% (рис. 1c). Увеличение TOF при низкой нагрузке Cu объясняется квадратичным увеличением скорости SSCR. Однако при высокой нагрузке Cu снижение TOF, вероятно, связано с недоиспользованием активных центров Cu. Согласно методу расчета, описанному Jones et al. 30 , каждые 2,4 и 3,5 клетки CHA содержат один ион Cu для Cu 3,8 -ССЗ-13 и Cu 2,6 -ССЗ-13 соответственно. Образующийся комплекс Cu-NH 3 или димерные частицы Cu в условиях SSCR, вероятно, препятствуют доступу реагентов к ионам Cu глубоко внутри пор, вызывая неэффективность использования ионов Cu 31 .
Чен и др. также указывалось на участие пар Cu в восстановительном полупериоде 29 . Следовательно, образование пары Cu в одном и том же каркасе имеет существенное значение для общего стандарта NH 3 — Процесс реакции SCR. Тенденция роста замедляется с дальнейшим увеличением нагрузки Cu. Частота оборота (TOF) имеет тенденцию вулканического типа с максимумом при содержании Cu 1,7 мас.% (рис. 1c). Увеличение TOF при низкой нагрузке Cu объясняется квадратичным увеличением скорости SSCR. Однако при высокой нагрузке Cu снижение TOF, вероятно, связано с недоиспользованием активных центров Cu. Согласно методу расчета, описанному Jones et al. 30 , каждые 2,4 и 3,5 клетки CHA содержат один ион Cu для Cu 3,8 -ССЗ-13 и Cu 2,6 -ССЗ-13 соответственно. Образующийся комплекс Cu-NH 3 или димерные частицы Cu в условиях SSCR, вероятно, препятствуют доступу реагентов к ионам Cu глубоко внутри пор, вызывая неэффективность использования ионов Cu 31 . Энергия активации (Ea) и предэкспоненциальный фактор (A) увеличиваются с увеличением загрузки Cu, что также наблюдалось Гао и др. 31 . Недавно Криша и соавт. сообщили, что Ea Cu 9Окисление 0017 I монотонно возрастало с плотностью Cu в фиксированном кинетическом режиме из-за поведения Cu-SSZ-13, отличного от среднего поля в реакции NH 3 -SCR, и того, что Ea восстановления Cu II не изменилось когда содержание меди было выше 0,69 мас.% 32 . С другой стороны, кинетическая значимость восстановления Cu II возрастала с увеличением плотности ионов Cu, Ea которого была выше, чем у окисления Cu I 30,32 . Следовательно, увеличение Еа в Cu 9Окисление 0017 I и кинетическая значимость восстановления Cu II способствовали увеличению Ea реакции SSCR.
Энергия активации (Ea) и предэкспоненциальный фактор (A) увеличиваются с увеличением загрузки Cu, что также наблюдалось Гао и др. 31 . Недавно Криша и соавт. сообщили, что Ea Cu 9Окисление 0017 I монотонно возрастало с плотностью Cu в фиксированном кинетическом режиме из-за поведения Cu-SSZ-13, отличного от среднего поля в реакции NH 3 -SCR, и того, что Ea восстановления Cu II не изменилось когда содержание меди было выше 0,69 мас.% 32 . С другой стороны, кинетическая значимость восстановления Cu II возрастала с увеличением плотности ионов Cu, Ea которого была выше, чем у окисления Cu I 30,32 . Следовательно, увеличение Еа в Cu 9Окисление 0017 I и кинетическая значимость восстановления Cu II способствовали увеличению Ea реакции SSCR.
a Скорость реакции SSCR в зависимости от загрузки Cu. b Скорость реакции SSCR в зависимости от квадрата загрузки Cu. c Частота оборота SSCR (TOF) в зависимости от загрузки Cu. d Энергии активации (Ea) и предэкспоненциальные факторы (A) при различных нагрузках Cu.
b Скорость реакции SSCR в зависимости от квадрата загрузки Cu. c Частота оборота SSCR (TOF) в зависимости от загрузки Cu. d Энергии активации (Ea) и предэкспоненциальные факторы (A) при различных нагрузках Cu.
Изображение в полный размер
Затем была проведена реакция FSCR над Cu-SSZ-13, как показано на дополнительных рисунках. 2а и 3а. По сравнению с реакцией SSCR конверсия NO x над Cu3.8-SSZ-13 значительно ингибировалась в присутствии NO 2 , что резко отличалось от NO 2 -ускоренной NO x Преобразование на цеолитных и оксидных катализаторах на основе железа (дополнительный рисунок 3). На дополнительном рисунке 2 показан NO 9.0005 x , NO и NO 2 уровни конверсии по Cu-SSZ-13 с различными нагрузками Cu в стационарных условиях FSCR. Мы нормализовали скорости реакций NO и NO 2 по массе катализатора в зависимости от загрузки Cu, и результаты показаны на рис. 2a, b соответственно. Были сопоставлены скорости потребления NO в условиях FSCR и SSCR (дополнительный рисунок 4), и результат показал, что восстановление NO было сильно подавлено при низких температурах в условиях FSCR. Ранее считалось, что чрезвычайно низкая конверсия NO при низких температурах является результатом блокировки пор цеолита за счет образования стабильного NH 4 НЕТ 3 21,23 . Образование NH 4 NO 3 было подтверждено наблюдением N 2 O в эксперименте FSCR-TPD (дополнительный рисунок 5), поскольку N 2 O в основном происходит из NH 4 NO . 3 разложение. Интересно, что снижение NO 2 заметно уменьшалось с увеличением загрузки Cu, в то время как оно увеличивалось по мере увеличения количества БАВ при низких температурах (рис. 2b, c и дополнительный рис. 6). Это продемонстрировало, что блокирование активных центров с помощью NH 4 NO 3 не была единственной причиной эффектов ингибирования NO 2 , в противном случае ингибировалось восстановление как NO, так и NO 2 .
2a, b соответственно. Были сопоставлены скорости потребления NO в условиях FSCR и SSCR (дополнительный рисунок 4), и результат показал, что восстановление NO было сильно подавлено при низких температурах в условиях FSCR. Ранее считалось, что чрезвычайно низкая конверсия NO при низких температурах является результатом блокировки пор цеолита за счет образования стабильного NH 4 НЕТ 3 21,23 . Образование NH 4 NO 3 было подтверждено наблюдением N 2 O в эксперименте FSCR-TPD (дополнительный рисунок 5), поскольку N 2 O в основном происходит из NH 4 NO . 3 разложение. Интересно, что снижение NO 2 заметно уменьшалось с увеличением загрузки Cu, в то время как оно увеличивалось по мере увеличения количества БАВ при низких температурах (рис. 2b, c и дополнительный рис. 6). Это продемонстрировало, что блокирование активных центров с помощью NH 4 NO 3 не была единственной причиной эффектов ингибирования NO 2 , в противном случае ингибировалось восстановление как NO, так и NO 2 . БАВ в первую очередь участвовали в восстановлении NO 2 , что также наблюдалось в реакции NO 2 -SCR (дополнительный рисунок 7). Более того, частота оборота (TOF) № 2 на БАС практически не менялась при изменении количества БАС. На дополнительном рисунке 8 представлена скорость реакции NO 2 в зависимости от загрузки Cu и БАВ в присутствии NO 9.0005 2 -условия SCR, которые показали ту же тенденцию, что и при сосуществовании NO и NO 2 . Кроме того, мы провели реакцию NO 2 -SCR на H-SSZ-13 и Cu 2,6 -SSZ-13 с различными соотношениями Si/Al и обнаружили, что цеолиты с низким содержанием Si/Al проявляют высокие значения NO x Преобразование из-за большого количества БАВ при низких температурах (дополнительный рисунок 9). Приведенные выше результаты показали, что NO 2 в основном реагировал на БАВ, в то время как NO было трудно восстановить в присутствии NO 9.0005 2 .
БАВ в первую очередь участвовали в восстановлении NO 2 , что также наблюдалось в реакции NO 2 -SCR (дополнительный рисунок 7). Более того, частота оборота (TOF) № 2 на БАС практически не менялась при изменении количества БАС. На дополнительном рисунке 8 представлена скорость реакции NO 2 в зависимости от загрузки Cu и БАВ в присутствии NO 9.0005 2 -условия SCR, которые показали ту же тенденцию, что и при сосуществовании NO и NO 2 . Кроме того, мы провели реакцию NO 2 -SCR на H-SSZ-13 и Cu 2,6 -SSZ-13 с различными соотношениями Si/Al и обнаружили, что цеолиты с низким содержанием Si/Al проявляют высокие значения NO x Преобразование из-за большого количества БАВ при низких температурах (дополнительный рисунок 9). Приведенные выше результаты показали, что NO 2 в основном реагировал на БАВ, в то время как NO было трудно восстановить в присутствии NO 9.0005 2 . NO 2 происходит диспропорционирование на БАВ с образованием нитратов и адсорбированных NO + , которые затем реагируют с NH 3 с образованием NH 4 NO 3 и NH 2 3, NO1 соответственно 35 . Общеизвестно, что NO может эффективно восстанавливаться в Cu-центрах. Однако образование NH 4 NO 3 препятствует доступу NO к активным центрам Cu. Вместо этого NO реагирует с NH 4 NO 3 на БАВ с образованием N 2 и NO 2 посредством реакции (3) (TPSR показан на дополнительном рисунке 10). Кроме того, уровни конверсии NO и NO 2 для Cu2,6-SSZ-13 и Cu0,4-SSZ-13 в условиях SSCR, FSCR и NO 2 -SCR отдельно показаны на дополнительном рисунке 11. Для Cu2 .6-SSZ-13 конверсия NO в условиях SSCR была заметно выше, чем в условиях FSCR, что указывает на то, что путь реакции SSCR значительно ингибируется в условиях FSCR. Низкую конверсию NO мы приписали реакции с NH 4 NO 3 (т.
NO 2 происходит диспропорционирование на БАВ с образованием нитратов и адсорбированных NO + , которые затем реагируют с NH 3 с образованием NH 4 NO 3 и NH 2 3, NO1 соответственно 35 . Общеизвестно, что NO может эффективно восстанавливаться в Cu-центрах. Однако образование NH 4 NO 3 препятствует доступу NO к активным центрам Cu. Вместо этого NO реагирует с NH 4 NO 3 на БАВ с образованием N 2 и NO 2 посредством реакции (3) (TPSR показан на дополнительном рисунке 10). Кроме того, уровни конверсии NO и NO 2 для Cu2,6-SSZ-13 и Cu0,4-SSZ-13 в условиях SSCR, FSCR и NO 2 -SCR отдельно показаны на дополнительном рисунке 11. Для Cu2 .6-SSZ-13 конверсия NO в условиях SSCR была заметно выше, чем в условиях FSCR, что указывает на то, что путь реакции SSCR значительно ингибируется в условиях FSCR. Низкую конверсию NO мы приписали реакции с NH 4 NO 3 (т. е. реакция FSCR) и дополнительное превращение NO 2 в реакцию между NO 2 и NH 3 . Для образца Cu0,4-SSZ-13 конверсия NO в условиях FSCR также ингибировалась по сравнению с конверсией в условиях SSCR. В отличие от этого, конверсия NO 2 в условиях FSCR и NO 2 -SCR была относительно выше, чем конверсия NO в условиях SSCR из-за недостаточного количества Cu активных центров для реакции SSCR. В результате показатели FSCR NO x также может быть выше, чем скорости SSCR NO x , особенно когда Cu-цеолит ведет себя с низкой конверсией NO (низкие нагрузки Cu, состояние гидротермального старения и т. д.), что наблюдалось в предыдущих исследованиях 23 ,27,36,37 . Другими словами, конверсия NO ингибировалась в присутствии NO 2 , в то время как влияние NO 2 на конверсию NO x было неопределенным и относится к конверсии NO 2 в условиях FSCR, а также № x преобразование в условиях SSCR.
е. реакция FSCR) и дополнительное превращение NO 2 в реакцию между NO 2 и NH 3 . Для образца Cu0,4-SSZ-13 конверсия NO в условиях FSCR также ингибировалась по сравнению с конверсией в условиях SSCR. В отличие от этого, конверсия NO 2 в условиях FSCR и NO 2 -SCR была относительно выше, чем конверсия NO в условиях SSCR из-за недостаточного количества Cu активных центров для реакции SSCR. В результате показатели FSCR NO x также может быть выше, чем скорости SSCR NO x , особенно когда Cu-цеолит ведет себя с низкой конверсией NO (низкие нагрузки Cu, состояние гидротермального старения и т. д.), что наблюдалось в предыдущих исследованиях 23 ,27,36,37 . Другими словами, конверсия NO ингибировалась в присутствии NO 2 , в то время как влияние NO 2 на конверсию NO x было неопределенным и относится к конверсии NO 2 в условиях FSCR, а также № x преобразование в условиях SSCR.
a Скорости реакций NO в зависимости от содержания Cu в катализаторах Cu-SSZ-13 в газовых смесях NO и NO 2 . b NO 2 скорость реакции в зависимости от загрузки Cu над Cu-SSZ-13 в газовых смесях NO и NO 2 . c NO 2 скорость реакции как функция БАВ над Cu-SSZ-13 в NO и NO 2 газовые смеси. d NO 2 частоты оборотов (TOF) как функция BAS в NO и NO 2 газовых смесях.
Полноразмерное изображение
Вейвлет-преобразование измерений EXAFS in situ
Кроме того, мы провели измерения XAFS in situ на образцах Cu-SSZ-13, чтобы выявить валентное состояние и координацию частиц меди в различных условиях. Анализ с помощью вейвлет-преобразования (WT) расширенных спектров тонкой структуры рентгеновского поглощения (EXAFS) является мощным методом для выявления перекрывающихся вкладов от различных соседних атомов на близких расстояниях вокруг поглотителя. Как показано на рис. 3а, предварительно обработанный образец показывает отчетливый пик первой оболочки при (4,5 Å -1 , 1,3 Å), что связано с вкладами каркасных атомов кислорода. Этот результат свидетельствует о том, что частицы меди в основном существуют в виде частиц fw-Cu 2+ , которые имеют высокие координационные числа 28 . Для сферы второй оболочки (R(Å) > 2 Å) два лепестка, при (3,5 Å −1 , 2,8 Å) и (6,5 Å −1 3,3 Å), хорошо разрешены из-за различных свойства обратного рассеяния различных атомов, сильно зависящие от атомного номера. Первая доля отнесена к атому кислорода второй оболочки из-за низкого значения k атомов кислорода. Последнее связано с сигналами от атомов Si или Al каркаса. Хотя некоторые исследования приписывают последнюю долю вкладу Cu-Cu в димеры Cu с кислородным мостиком 38,39 , мы почти не наблюдали частицы CuO x в профилях рентгеновского поглощения вблизи края (XANES) и EXAFS (дополнительный рисунок 12) и не проводили процедуру введения O 2 в NH 3 — обработанный Cu-SSZ-13 с образованием димеров Cu с кислородными мостиками с четырьмя лигандами NH 3 .
Как показано на рис. 3а, предварительно обработанный образец показывает отчетливый пик первой оболочки при (4,5 Å -1 , 1,3 Å), что связано с вкладами каркасных атомов кислорода. Этот результат свидетельствует о том, что частицы меди в основном существуют в виде частиц fw-Cu 2+ , которые имеют высокие координационные числа 28 . Для сферы второй оболочки (R(Å) > 2 Å) два лепестка, при (3,5 Å −1 , 2,8 Å) и (6,5 Å −1 3,3 Å), хорошо разрешены из-за различных свойства обратного рассеяния различных атомов, сильно зависящие от атомного номера. Первая доля отнесена к атому кислорода второй оболочки из-за низкого значения k атомов кислорода. Последнее связано с сигналами от атомов Si или Al каркаса. Хотя некоторые исследования приписывают последнюю долю вкладу Cu-Cu в димеры Cu с кислородным мостиком 38,39 , мы почти не наблюдали частицы CuO x в профилях рентгеновского поглощения вблизи края (XANES) и EXAFS (дополнительный рисунок 12) и не проводили процедуру введения O 2 в NH 3 — обработанный Cu-SSZ-13 с образованием димеров Cu с кислородными мостиками с четырьмя лигандами NH 3 .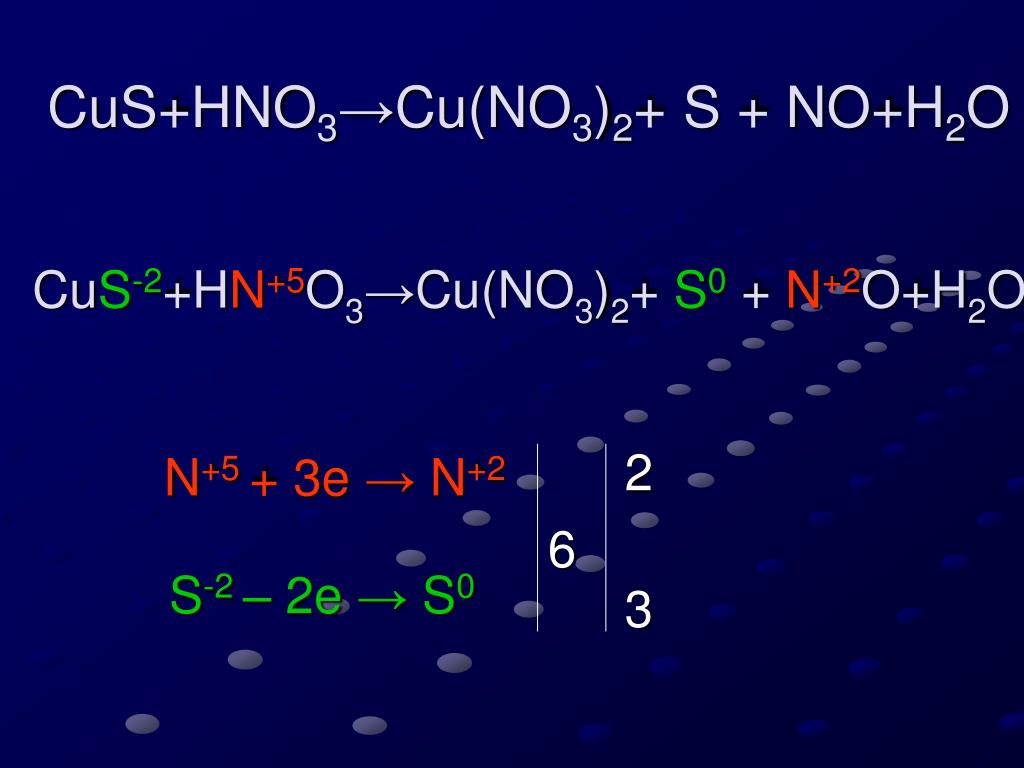 Таким образом, мы пришли к выводу, что лепесток при 6,5 Å –1 в основном происходит от атомов каркаса Si или Al во второй оболочке в этой работе. Фактически, частицы меди в Cu-SSZ-13 изначально находятся в сольватированном состоянии в виде [Cu(H 2 O)n] 2+ в условиях окружающей среды, что ослабляет взаимодействие между частицами меди и каркасом цеолита 28,40 . Высокотемпературная обработка в O 2 /N 2 удаляет координированные молекулы воды и окисляет частицы меди до Cu 2+ . В результате частицы меди находятся в высоковалентном состоянии и сильно взаимодействуют с каркасом цеолита за счет электростатических сил.
Таким образом, мы пришли к выводу, что лепесток при 6,5 Å –1 в основном происходит от атомов каркаса Si или Al во второй оболочке в этой работе. Фактически, частицы меди в Cu-SSZ-13 изначально находятся в сольватированном состоянии в виде [Cu(H 2 O)n] 2+ в условиях окружающей среды, что ослабляет взаимодействие между частицами меди и каркасом цеолита 28,40 . Высокотемпературная обработка в O 2 /N 2 удаляет координированные молекулы воды и окисляет частицы меди до Cu 2+ . В результате частицы меди находятся в высоковалентном состоянии и сильно взаимодействуют с каркасом цеолита за счет электростатических сил.
a Cu-SSZ-13, предварительно обработанный в O 2 /He. b Адсорбция NO. c NH 3 адсорбция. d NO + NH 3 адсорбция. e NO + NH 3 соадсорбция с последующей реакцией с O 2 . f NO + NH 3 соадсорбция с последующей реакцией с NO 2 . г Условия SSCR. ч Условия FSCR. i NO 2 — Условия SCR.
e NO + NH 3 соадсорбция с последующей реакцией с O 2 . f NO + NH 3 соадсорбция с последующей реакцией с NO 2 . г Условия SSCR. ч Условия FSCR. i NO 2 — Условия SCR.
Увеличенное изображение
После адсорбции NO ионы Cu 2+ частично восстанавливаются, что приводит к небольшому уменьшению координационных чисел (КЧ) первой оболочки, что выражается в уменьшении и ослаблении окрашенной области (рис. 3б). Лепестки, образовавшиеся за счет вкладов второй оболочки, вытянулись до (3,5 Å –1 , 3,1 Å) и (6,5 Å –1 , 3,7 Å) соответственно. Когда предварительно обработанный образец подвергался воздействию NH 3 или NO + NH 3 атмосферы сигнал первой оболочки резко уменьшился (рис. 3в, г), что свидетельствует о значительном снижении КЧ ионов Cu за счет их восстановления. Более того, два лепестка плохо разрешаются в спектрах, что указывает на уменьшение рассеяния от второй оболочки. Это согласуется с образованием динамических видов [Cu(NH 3 ) 2 ] + , что подтверждается появлением признака B на дополнительном рисунке 13a после NH 3 или NO + NH 3 адсорбция. После окисления О 2 и NO 2 КЧ первой оболочки увеличилось до уровня, аналогичного предварительно обработанному образцу, что сопровождалось образованием двух хорошо разрешенных лепестков на второй оболочке (рис. 3д, е). Это продемонстрировало, что частицы Cu(NH 3 ) 2 + окисляются до ионов Cu II и что взаимодействие между ионами Cu 2+ и каркасом цеолита восстанавливается. Кроме рассеяния на каркасе Si (или Al), второй лепесток при 6,5 Å -1 , вероятно, является результатом рассеяния частиц второй оболочки Cu, поскольку димеры Cu с кислородным мостиком образуются после окисления Cu I (NH 3 ) 2 O 2 5,38 .
Это согласуется с образованием динамических видов [Cu(NH 3 ) 2 ] + , что подтверждается появлением признака B на дополнительном рисунке 13a после NH 3 или NO + NH 3 адсорбция. После окисления О 2 и NO 2 КЧ первой оболочки увеличилось до уровня, аналогичного предварительно обработанному образцу, что сопровождалось образованием двух хорошо разрешенных лепестков на второй оболочке (рис. 3д, е). Это продемонстрировало, что частицы Cu(NH 3 ) 2 + окисляются до ионов Cu II и что взаимодействие между ионами Cu 2+ и каркасом цеолита восстанавливается. Кроме рассеяния на каркасе Si (или Al), второй лепесток при 6,5 Å -1 , вероятно, является результатом рассеяния частиц второй оболочки Cu, поскольку димеры Cu с кислородным мостиком образуются после окисления Cu I (NH 3 ) 2 O 2 5,38 .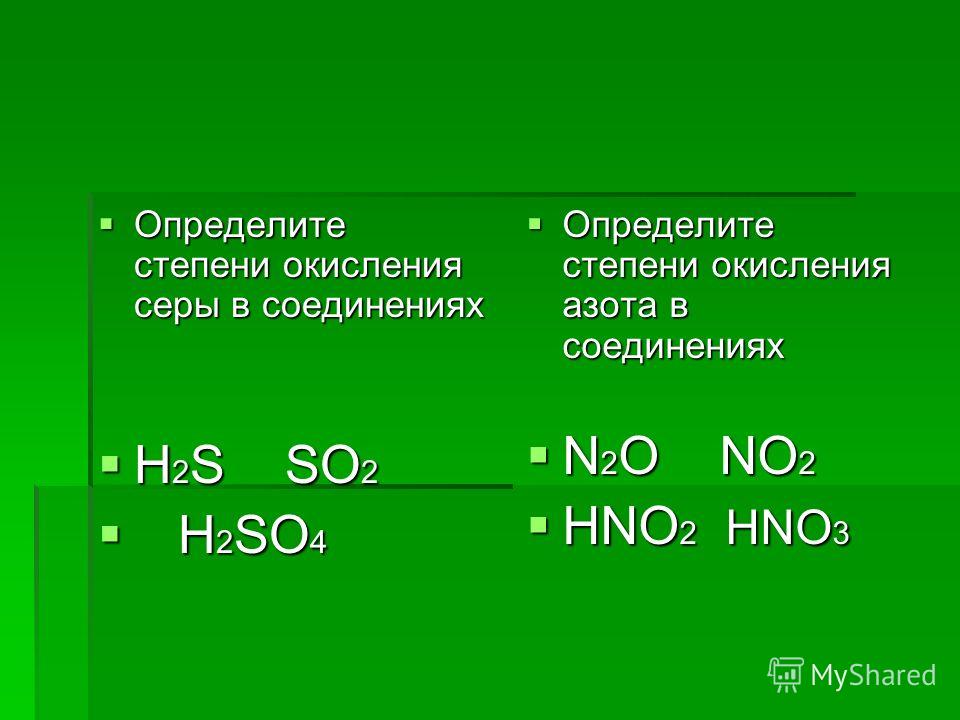 По сравнению с окислением O 2 окисление NO 2 привело к более высокому сигналу для лепестка при ~ 6,5 Å -1 , что указывает на то, что больше частиц Cu I окисляются в ионы Cu II (fw -Cu II или NH 3 -сольватированные Cu II виды с высоким ХЧ) при реакции с NO 2 . Это явление согласуется с результатом, полученным Paolucci et al. показывая, что NO 2 может окислять остаточные частицы Cu I (NH 3 ) 2 , которые не могут быть окислены O 2 . Как также сообщил Паолуччи, переходное окисление соединений Cu I (NH 3 ) 2 с помощью NO 2 представляет собой одноцентровый процесс без образования димеров Cu. Таким образом, можно сделать вывод, что присутствие NO 2 , вероятно, изменили активные центры реакции SCR с димера Cu на изолированные частицы Cu, которые дополнительно влияют на реакцию SSCR.
По сравнению с окислением O 2 окисление NO 2 привело к более высокому сигналу для лепестка при ~ 6,5 Å -1 , что указывает на то, что больше частиц Cu I окисляются в ионы Cu II (fw -Cu II или NH 3 -сольватированные Cu II виды с высоким ХЧ) при реакции с NO 2 . Это явление согласуется с результатом, полученным Paolucci et al. показывая, что NO 2 может окислять остаточные частицы Cu I (NH 3 ) 2 , которые не могут быть окислены O 2 . Как также сообщил Паолуччи, переходное окисление соединений Cu I (NH 3 ) 2 с помощью NO 2 представляет собой одноцентровый процесс без образования димеров Cu. Таким образом, можно сделать вывод, что присутствие NO 2 , вероятно, изменили активные центры реакции SCR с димера Cu на изолированные частицы Cu, которые дополнительно влияют на реакцию SSCR. Этот вывод показал, что большинство частиц Cu связаны с каркасом цеолита и что подвижность частиц Cu ограничена в процессе окисления Cu I (NH 3 ) 2 NO 2 . Хотя переходная реакция может отражать состояние Cu и координацию в течение полуциклов, было сочтено более целесообразным идентифицировать разновидности Cu в условиях реакции FSCR.
Этот вывод показал, что большинство частиц Cu связаны с каркасом цеолита и что подвижность частиц Cu ограничена в процессе окисления Cu I (NH 3 ) 2 NO 2 . Хотя переходная реакция может отражать состояние Cu и координацию в течение полуциклов, было сочтено более целесообразным идентифицировать разновидности Cu в условиях реакции FSCR.
На рисунках 4g–i представлены двумерные графики спектров WT EXAFS в условиях SSCR, FSCR и NO 2 -SCR. В условиях SSCR спектры WT EXAFS напоминают спектры на рис. 3c, d. Пик первой оболочки ослабляется в условиях SSCR, что указывает на уменьшение КЧ частиц Cu. Отсутствие лепестков на второй оболочке свидетельствует о легкой подвижности комплекса меди за счет эффекта сольватации NH 3 . Однако в присутствии NO 2 КЧ первой оболочки значительно увеличились, что указывает на окисление частиц меди, что также подтверждается результатами McEwen et al. 26 . Более того, на второй оболочке наблюдаются два хорошо разрешенных лепестка, что позволяет предположить, что окисление приводит к тесной координации частиц меди с каркасом цеолита, что ограничивает их подвижность во время реакции СКВ. Спектры WT EXAFS согласуются с результатами EXAFS с преобразованием Фурье (FT) (дополнительный рисунок 14 и таблица 1), которые подробно обсуждаются во вспомогательной информации. Приведенные выше результаты доказали существование большего количества динамичного Cu I (NH 3 ) 2 видов в условиях реакции SSCR, чем в условиях реакции FSCR и NO 2 -SCR. Примечательно, что, хотя мы доказали существование значительных видов Cu II , связанных с каркасом, в условиях FSCR, NH 3 -сольватированные виды Cu II нельзя исключить с помощью эксперимента XAFS. Действительно, NH 3 -сольватированные частицы Cu II существовали, о чем свидетельствует наблюдение NH 3 десорбция из участков Cu в профилях FSCR-TPD (дополнительный рисунок 5), что согласуется с расчетной фазовой диаграммой, представленной Paolucci et al. 28 . Поэтому мы затем обратились к расчету DFT, чтобы исследовать возможные пути реакции FSCR над fw- и NH 3 -сольватированными соединениями Cu II [Cu 2+ и (Cu II OH) + ].
Спектры WT EXAFS согласуются с результатами EXAFS с преобразованием Фурье (FT) (дополнительный рисунок 14 и таблица 1), которые подробно обсуждаются во вспомогательной информации. Приведенные выше результаты доказали существование большего количества динамичного Cu I (NH 3 ) 2 видов в условиях реакции SSCR, чем в условиях реакции FSCR и NO 2 -SCR. Примечательно, что, хотя мы доказали существование значительных видов Cu II , связанных с каркасом, в условиях FSCR, NH 3 -сольватированные виды Cu II нельзя исключить с помощью эксперимента XAFS. Действительно, NH 3 -сольватированные частицы Cu II существовали, о чем свидетельствует наблюдение NH 3 десорбция из участков Cu в профилях FSCR-TPD (дополнительный рисунок 5), что согласуется с расчетной фазовой диаграммой, представленной Paolucci et al. 28 . Поэтому мы затем обратились к расчету DFT, чтобы исследовать возможные пути реакции FSCR над fw- и NH 3 -сольватированными соединениями Cu II [Cu 2+ и (Cu II OH) + ]. БАВ и димерные формы Cu.
БАВ и димерные формы Cu.
a Профиль свободной энергии Гиббса. b Оптимизированная геометрия реагентов, переходных состояний (ПС) и продуктов для всех элементарных стадий представлена на нижней панели. За исключением атомов O, связанных с ионом Cu 2+ , все остальные атомы каркаса цеолита для ясности опущены. Оранжевые, красные, синие и белые кружки обозначают атомы Cu, O, N и H соответственно.
Полноразмерное изображение
Расчет ДПФ
Сначала мы рассчитали путь реакции FSCR для видов fw-Cu II (рис. 4). Связанный каркасом Cu II сначала адсорбирует две молекулы NH 3 без отделения от каркаса, которые затем взаимодействуют с NO 2 с образованием Z 2 Cu II NH 3 OH и NH
5 2 НЕТ видов (B → C). Z
2 Cu II NH 3 OH дополнительно адсорбирует молекулу NH 3 и реагирует с NO с образованием Z 2 Cu II NH 3 , NH 2 NO и H 2 O (E → F), который, по прогнозам, является определяющей стадией реакционного цикла СКВ с высоким энергетическим барьером 1,92 эВ.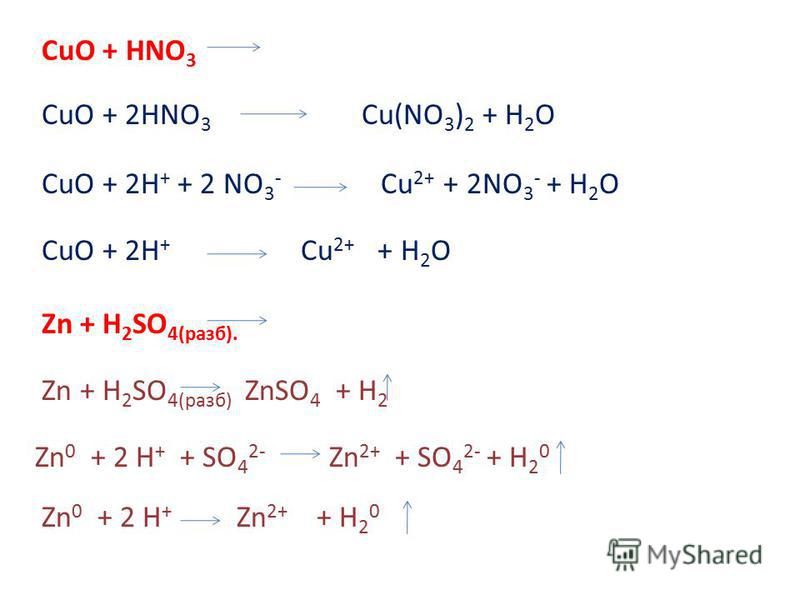 Образовавшийся NH 2 NO легко разлагается на N 2 и H 2 O посредством ряда процессов миграции H и изомеризации (дополнительный рисунок 16) 29 . Наконец, газообразные молекулы NH 3 подаются для регенерации исходных частиц А.
Образовавшийся NH 2 NO легко разлагается на N 2 и H 2 O посредством ряда процессов миграции H и изомеризации (дополнительный рисунок 16) 29 . Наконец, газообразные молекулы NH 3 подаются для регенерации исходных частиц А. Затем был рассчитан путь реакции FSCR над ZCu II OH, который изображен на рис. 5. ZCu II OH сначала адсорбирует молекулу NH 3 , чтобы достичь координационно-насыщенного состояния, которое взаимодействует с NO 2 с образованием молекулы HNO 3 без энергетического барьера. Виды B на самом деле считаются NH 4 NO 3 , адсорбированными на участках Cu. Далее адсорбированная HNO 3 реагирует с NO из газовой фазы с энергетическим барьером 0,87 эВ, в результате чего образуется адсорбированная HNO 2 и высвобождение молекулы NO 2 (C → D). Затем адсорбированная HNO 2 реагирует с лигандом NH 3 с образованием NH 2 NO и H 2 O. По мере десорбции молекул N 2 и H 2 O образуется и NO 2 адсорбируются на участке Cu и реагируют с образованием групп NH 2 NO и -OH. При разложении NH 2 NO на N 2 и H 2 O ZCu II Сайт ОН регенерирован. Определяющая скорость стадия цикла FSCR по центру ZCu II OH соответствует реакции адсорбированной HNO 2 с лигандом NH 3 с образованием NH 2 NO и H 2 O (E → F) с энергетическим барьером 1,58 эВ.
По мере десорбции молекул N 2 и H 2 O образуется и NO 2 адсорбируются на участке Cu и реагируют с образованием групп NH 2 NO и -OH. При разложении NH 2 NO на N 2 и H 2 O ZCu II Сайт ОН регенерирован. Определяющая скорость стадия цикла FSCR по центру ZCu II OH соответствует реакции адсорбированной HNO 2 с лигандом NH 3 с образованием NH 2 NO и H 2 O (E → F) с энергетическим барьером 1,58 эВ.
a Профиль свободной энергии Гиббса. b Оптимизированные геометрии реагентов, TS и продуктов для всех элементарных стадий представлены на нижней панели. За исключением двух атомов О, связанных с группой Cu-OH, все остальные атомы каркаса цеолита для ясности опущены. Все обозначения такие же, как на рис. 4.
4.
Изображение полного размера
Кроме того, пути реакции FSCR над NH 3 -сольватированными соединениями Cu II [Cu II и (Cu II OH) + ] также были рассчитаны и представлены в дополнении. Рис. 17, 18. Все энергетические барьеры оказались относительно высокими (1,54 и 1,65 эВ). Более того, мы рассматриваем возможность того, что различные NH 3 сольватированные частицы Cu II диффундируют в соседнюю клетку с образованием Cu II — пары, как показано на дополнительном рисунке S15. Как и ожидалось, образование пар Cu II из Cu II (NH 3 ) 4 и Cu II NO 2 (NH 3 ) 3 тормозится как кинетически, так и термодинамически стерическому эффекту, а также сильному взаимодействию с цеолитовым каркасом. Однако следует отметить, что Cu II OH(NH 3 ) 3 отличается от других форм, так как биядерная Cu II OH(NH 3 ) 3 в одной клетке термодинамически более устойчива, чем изолированная конфигурация. Вилламена и др. подтвердили образование димерных комплексов Cu II (OH)(NH 3 ) x в атмосфере окисления через CO + NH 3 эксперимент по титрованию 41 . Ху и др. предположил, что Cu II (OH) (NH 3 ), который структурно подобен Cu I (NH 3 ) 2 + , который имеет один заряд и два лиганда, действует как межклеточная транспортная среда 6 . Виды Z2Cu II могут трансформировать ZCu II (OH) с помощью гидролиза с участием NH 3 для получения пары Cu 42 . Однако регенерация Cu II (OH) в димерной форме показала высокий энергетический барьер 1,58 эВ (A → B на дополнительном рисунке S19), что позволяет предположить, что димерные виды Cu II (OH) не были высокоактивными. в реакции FSCR.
Вилламена и др. подтвердили образование димерных комплексов Cu II (OH)(NH 3 ) x в атмосфере окисления через CO + NH 3 эксперимент по титрованию 41 . Ху и др. предположил, что Cu II (OH) (NH 3 ), который структурно подобен Cu I (NH 3 ) 2 + , который имеет один заряд и два лиганда, действует как межклеточная транспортная среда 6 . Виды Z2Cu II могут трансформировать ZCu II (OH) с помощью гидролиза с участием NH 3 для получения пары Cu 42 . Однако регенерация Cu II (OH) в димерной форме показала высокий энергетический барьер 1,58 эВ (A → B на дополнительном рисунке S19), что позволяет предположить, что димерные виды Cu II (OH) не были высокоактивными. в реакции FSCR.
Путь реакции FSCR на БАВ показан на рис. 6. NH 3 адсорбируется на БАВ с образованием соединений NH 4 + .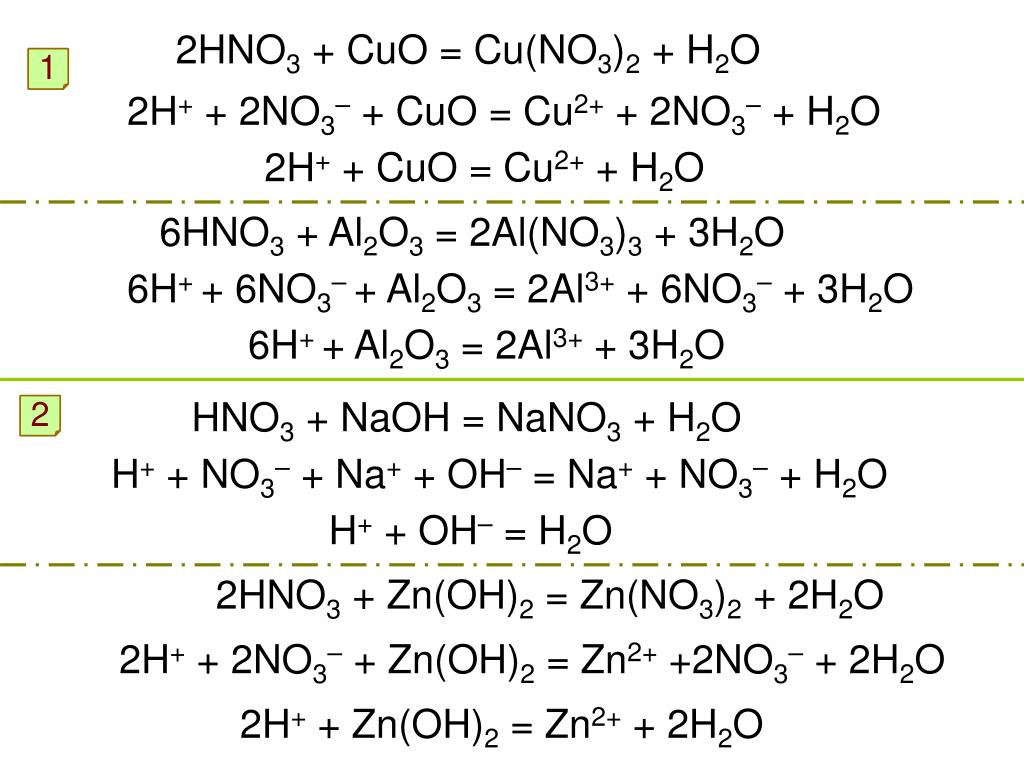 Две молекулы NO 2 взаимодействуют с частицами NH 4 + с образованием частиц NH 4 NO 3 и высвобождают молекулу NO без какого-либо энергетического барьера (A → B). Выделение NO наблюдалось и в наших предыдущих исследованиях при адсорбции NO 2 на цеолите H-SSZ-13 43 . Затем NO взаимодействует с NH 3 из газовой фазы с образованием NH 3 ∙ ∙ ∙ ∙ нет комплекса, который далее реагирует с NH 4 NO 3 , чтобы сформировать NH 4 + , HNO 3 и NH . 2 NO посредством процесса H-миграции (B → C). NH 2 NO разлагается на N 2 и H 2 O. Затем HNO 3 реагирует с NO из газовой фазы, в результате чего образуется HNO 2 и выделяется NO 2 Молекула (E → F). Реакция между HNO 2 и NH 4 + приводит к образованию комплекса NH 3 ∙ ∙ ∙ NO и молекулы H 2 O.
Две молекулы NO 2 взаимодействуют с частицами NH 4 + с образованием частиц NH 4 NO 3 и высвобождают молекулу NO без какого-либо энергетического барьера (A → B). Выделение NO наблюдалось и в наших предыдущих исследованиях при адсорбции NO 2 на цеолите H-SSZ-13 43 . Затем NO взаимодействует с NH 3 из газовой фазы с образованием NH 3 ∙ ∙ ∙ ∙ нет комплекса, который далее реагирует с NH 4 NO 3 , чтобы сформировать NH 4 + , HNO 3 и NH . 2 NO посредством процесса H-миграции (B → C). NH 2 NO разлагается на N 2 и H 2 O. Затем HNO 3 реагирует с NO из газовой фазы, в результате чего образуется HNO 2 и выделяется NO 2 Молекула (E → F). Реакция между HNO 2 и NH 4 + приводит к образованию комплекса NH 3 ∙ ∙ ∙ NO и молекулы H 2 O.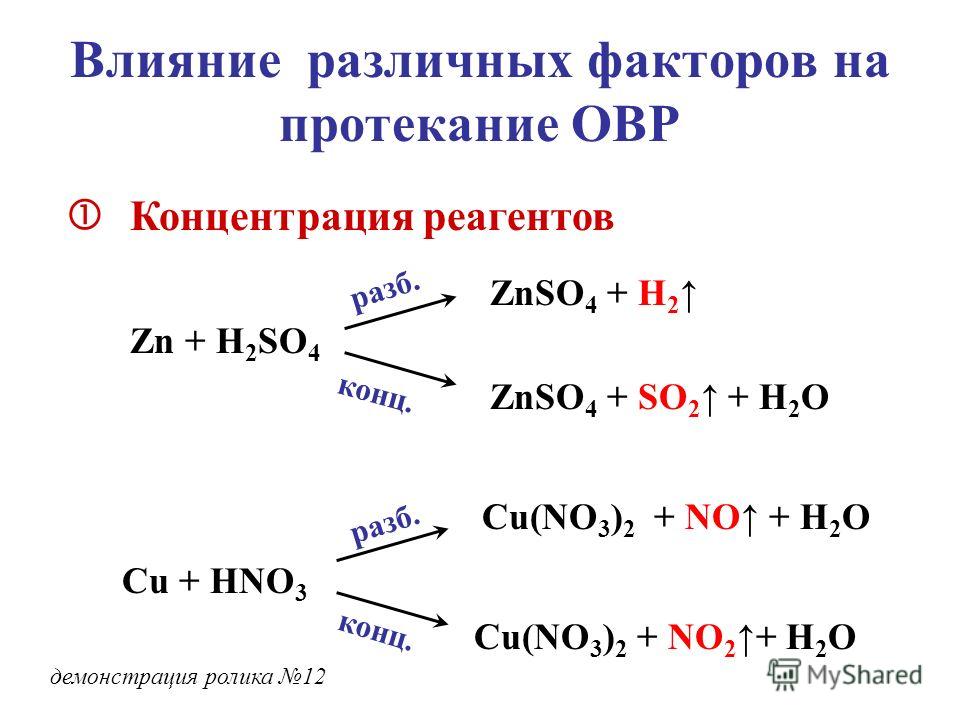 Комплекс NH 3 ∙ ∙ ∙ NO переносит атом H на регенерацию БАВ и превращается в NH 2 NO, который затем распадается на N 2 и H 2 O. Весь каталитический цикл завершается. Суммарный энергетический барьер FSCR над бренстедовским кислотным центром составляет 1,27 эВ, что соответствует реакции между NH 4 NO 3 и комплекса NH 3 ∙ ∙ ∙ NO, значительно ниже, чем на различных участках Cu. Результаты расчетов методом DFT показывают, что процесс FSCR в системе цеолитов SSZ-13, как правило, протекает на BAS.
Комплекс NH 3 ∙ ∙ ∙ NO переносит атом H на регенерацию БАВ и превращается в NH 2 NO, который затем распадается на N 2 и H 2 O. Весь каталитический цикл завершается. Суммарный энергетический барьер FSCR над бренстедовским кислотным центром составляет 1,27 эВ, что соответствует реакции между NH 4 NO 3 и комплекса NH 3 ∙ ∙ ∙ NO, значительно ниже, чем на различных участках Cu. Результаты расчетов методом DFT показывают, что процесс FSCR в системе цеолитов SSZ-13, как правило, протекает на BAS.
a Профиль свободной энергии Гиббса. b Оптимизированная геометрия реагентов, TS и продуктов для всех элементарных стадий. За исключением атомов Si и Al, связанных с группой ОН, все остальные атомы каркаса цеолита для ясности опущены. Желтые и розовые кружки обозначают атомы Si и Al соответственно. Все остальные обозначения такие же, как на рис. 4.
Все остальные обозначения такие же, как на рис. 4.
Изображение в натуральную величину
Таким образом, объединяя анализ спектроскопических измерений in situ с расчетами DFT, мы обнаружили, что NO 2 приводит к глубокому окислению частиц меди в виде частиц Cu II (fw-Cu II и NH 3 -сольватированные Cu II с высоким КЧ), что значительно снижает подвижность центров Cu. В результате реакция FSCR происходит в основном на BAS, хотя она имеет более высокий энергетический барьер (1,27 эВ), чем локально гомогенная реакция SSCR на динамических центрах (около 1,0 эВ). Эта работа раскрывает происхождение аномального NH 9.0005 3 — Поведение СКВ на коммерческом катализаторе Cu-SSZ-13 в присутствии NO 2 .
Методы
Подготовка проб
Исходный цеолит Cu-SSZ-13 был синтезирован на месте однореакторным методом 15 . Соотношение Na 2 O/Al 2 O 3 /H 2 O/SiO 2 /Cu-ТЭПА составляло 3,5/1,0/200/25/3 и проводили кристаллизацию цеолита. при 120 °С в течение 5 дней. Из-за избытка меди в исходном продукте потребовалась дополнительная обработка для оптимизации содержания и распределения меди. В частности, только что синтезированный Cu-SSZ-13 был подвергнут последующей обработке 0,1 моль/л HNO 9 .0005 3 при 80 °C в течение 12 часов для удаления CuO x видов. После прокаливания при 600 °С образец перемешивали в растворе NH 4 NO 3 (0,01~0,2 моль/л) при 40 °С для второй дообработки с последующей фильтрацией, промывкой, сушкой и прокаливанием. при 600 °С. Полученные катализаторы Cu-SSZ-13 представляли собой цеолиты, богатые алюминием, с соотношением Si/Al ~ 5 и различным содержанием Cu от 0,4 до 3,8 мас.% (дополнительная таблица 2).
при 120 °С в течение 5 дней. Из-за избытка меди в исходном продукте потребовалась дополнительная обработка для оптимизации содержания и распределения меди. В частности, только что синтезированный Cu-SSZ-13 был подвергнут последующей обработке 0,1 моль/л HNO 9 .0005 3 при 80 °C в течение 12 часов для удаления CuO x видов. После прокаливания при 600 °С образец перемешивали в растворе NH 4 NO 3 (0,01~0,2 моль/л) при 40 °С для второй дообработки с последующей фильтрацией, промывкой, сушкой и прокаливанием. при 600 °С. Полученные катализаторы Cu-SSZ-13 представляли собой цеолиты, богатые алюминием, с соотношением Si/Al ~ 5 и различным содержанием Cu от 0,4 до 3,8 мас.% (дополнительная таблица 2).
Оценка катализатора
Стандартная SCR (SSCR), быстрая SCR (FSCR) и медленная SCR (NO 2 -SCR) реакции проводили в системе проточного реактора с неподвижным слоем со встроенным спектрометром Nicolet Is50, который использовали для определения концентраций реагентов и продуктов. Условия SSCR включали 500 ppm NO и 500 ppm NH 3 ; условия FSCR включали 250 м.д. NO, 250 м.д. NO 2 и 500 м.д. NH 3 ; условия NO 2 -SCR включали 300 ppm NO 2 и 500 ppm NH 3 . Все условия включали 3,5% H 2 O, 5%O 2 и N 2 остаток. Общая скорость потока составляла 500 мл/мин. Преобразование NO x (NO и NO 2 ) было рассчитано в устойчивом состоянии:
Условия SSCR включали 500 ppm NO и 500 ppm NH 3 ; условия FSCR включали 250 м.д. NO, 250 м.д. NO 2 и 500 м.д. NH 3 ; условия NO 2 -SCR включали 300 ppm NO 2 и 500 ppm NH 3 . Все условия включали 3,5% H 2 O, 5%O 2 и N 2 остаток. Общая скорость потока составляла 500 мл/мин. Преобразование NO x (NO и NO 2 ) было рассчитано в устойчивом состоянии:
$${NO}\,{conversion}=\left(1-\frac{{\left[{NO}} \right]}_{{out}}}{{\left[{NO}\right]}_{{in}}}\right)\times 100\%$$
(5)
$${ {NO}}_{2}\,{преобразование}=\left(1-\frac{{\left[{{NO}}_{2}\right]}_{{out}}}{{\left [{{NO}}_{2}\right]}_{{in}}}\right)\times 100\%$$
(6)
$${{NO}}_{x}\,{преобразование}=\left(1-\frac{{\left[{{{{{\rm{NO}}}}}}} \right]}_{{{{{{\rm{out}}}}}}}+{\left[{{{{{{\rm{NO}}}}}}}}_{2}\right ]}_{{{{{{\rm{out}}}}}}}}{{\left[{{{{{\rm{NO}}}}}}\right]}_{{{{ {{\rm{in}}}}}}}+{\left[{{{{{{\rm{NO}}}}}}}}_{2}\right]}_{{{{{{{ \rm{in}}}}}}}}}\right)\times 100\%$$
(7)
Для проведения кинетических исследований объемную часовую скорость газа (GHSV) контролировали, регулируя массу катализатора . GHSV SSCR, FSCR и NO 2 -SCR составляли около ~800 000 ч 9{\left(-\frac{{Ea}}{{RT}}\right)}$$
GHSV SSCR, FSCR и NO 2 -SCR составляли около ~800 000 ч 9{\left(-\frac{{Ea}}{{RT}}\right)}$$
(9)
где F NOx представляет скорость потока NO x (моль/ с), X NOx представляет собой конверсию NO x , W cat представляет собой массу катализатора (г), а [NO x ] 0 представляет собой концентрацию катализатора на входе. № x . NOx представляет собой NO, NO 2 или их смесь.
Характеристика
Элементный состав катализаторов измеряли с помощью атомно-эмиссионной спектроскопии с индуктивно-связанной плазмой (ICP-AES). Адсорбционно-десорбционный анализ образцов N 2 проводили на приборе Micromeritics ASAP 2020. Распределение и содержание кислотных центров измеряли с помощью температурно-программируемой десорбции NH 3 (NH 3 -TPD) с использованием прибора для измерения активности NH 3 -SCR, описанного выше. Были использованы образцы массой около 30 мг, предварительно обработанные 10% O 2 /N 2 при 500 °C в течение 30 мин перед охлаждением до 120 °C. Затем газ был заменен на NH 3 /N 2 с концентрацией 500 частей на миллион в течение 60 мин с последующей продувкой N 2 в течение 60 мин. Наконец, температуру повышали до 700°С со скоростью 10°С/мин.
Были использованы образцы массой около 30 мг, предварительно обработанные 10% O 2 /N 2 при 500 °C в течение 30 мин перед охлаждением до 120 °C. Затем газ был заменен на NH 3 /N 2 с концентрацией 500 частей на миллион в течение 60 мин с последующей продувкой N 2 в течение 60 мин. Наконец, температуру повышали до 700°С со скоростью 10°С/мин.
Эксперименты по тонкой структуре поглощения рентгеновских лучей in situ (in situ XAFS) были выполнены на линии луча 1W1B Пекинского центра синхротронного излучения (BSRF). Данные поглощения от −200 эВ до 800 эВ Cu K-края (8979 эВ). Образец сначала предварительно обрабатывали в O 2 /He при 500 °C в течение 30 мин, затем снижали температуру до 200 °C, после чего проводили предварительную обработку. были собраны спектры. Затем образец подвергали воздействию NH 3 /He с концентрацией 500 м.д., 500 м.д. NO/He и 500 м.д. NH 3 /He + 500 м.д. NO/He в течение 60 мин, соответственно, и собирали спектры. После восстановления (NO+NH 3 )/He образец подвергали воздействию 5% O 2 /N 2 и 500 ppm NO 2 /N 2 в течение 60 мин соответственно, чтобы получить данные по абсорбции для окисленного образца. Кроме того, данные о поглощении на месте были собраны после того, как предварительно обработанные образцы были подвергнуты воздействию атмосферы SSCR, FSCR и NO 2 -SCR в течение 60 мин. Данные рентгеновской абсорбционной структуры вблизи края (XANES) были скорректированы по фону и нормализованы с использованием модуля Athena, реализованного в программном пакете IFFEFIT 44 . Данные тонкой структуры расширенного рентгеновского поглощения (EXAFS) были проанализированы и подобраны с использованием Athena и Artemis (3,0 < k < 13,0 Å -1 ). Коэффициент уменьшения амплитуды (S 0 2 ), равный 0,85, использовался для всех подобранных наборов данных. Анализ вейвлет-преобразования (WT) EXAFS был выполнен для точного исследования локальной координационной среды частиц меди.
После восстановления (NO+NH 3 )/He образец подвергали воздействию 5% O 2 /N 2 и 500 ppm NO 2 /N 2 в течение 60 мин соответственно, чтобы получить данные по абсорбции для окисленного образца. Кроме того, данные о поглощении на месте были собраны после того, как предварительно обработанные образцы были подвергнуты воздействию атмосферы SSCR, FSCR и NO 2 -SCR в течение 60 мин. Данные рентгеновской абсорбционной структуры вблизи края (XANES) были скорректированы по фону и нормализованы с использованием модуля Athena, реализованного в программном пакете IFFEFIT 44 . Данные тонкой структуры расширенного рентгеновского поглощения (EXAFS) были проанализированы и подобраны с использованием Athena и Artemis (3,0 < k < 13,0 Å -1 ). Коэффициент уменьшения амплитуды (S 0 2 ), равный 0,85, использовался для всех подобранных наборов данных. Анализ вейвлет-преобразования (WT) EXAFS был выполнен для точного исследования локальной координационной среды частиц меди.
Детали вычислений
Расчеты спин-поляризованного периодического DFT были выполнены с использованием пакета моделирования Vienna ab initio (VASP) Гримме (т. е. метод DFT-D3) 46 . Орбитали Кона-Шэма были расширены с помощью базиса плоских волн с энергией отсечки 500 эВ, а для описания взаимодействия между валентными электронами и остовами 47 использовался метод плоских присоединенных волн (PAW). Метод DFT + U был применен к состояниям Cu 3d с U eff = 6,0 эВ для описания локальных кулоновских взаимодействий 29,48 . В ходе геометрической оптимизации электронные энергии самосогласованного поля были сведены к 1 × 10 -5 эВ, а все остальные атомы полностью релаксировали до тех пор, пока максимальная сила, действующая на атомы, не стала меньше 2 × 10 -2 эВ/Å. Зона Бриллюэна была отобрана с помощью сетки k-точек Монкхорста-Пака размером 1 × 2 × 2. Был использован метод гауссовского размытия с шириной размытия 0,2 эВ. Переходные состояния элементарных шагов были обнаружены с использованием метода эластичной ленты с подталкиванием изображения восхождения (CI-NEB) с несколькими промежуточными изображениями между начальным и конечным состояниями 49,50 . Термодинамические данные обрабатывали с помощью программы VASPKIT 9.0017 51 и свободные энергии Гиббса рассчитаны при 200 °C. Структура цеолита SSZ-13 была смоделирована с использованием двух ромбоэдрических элементарных ячеек (24 тетраэдрически координированных атома) размером 18,84 Å × 9,42 Å × 9,42 Å (дополнительный рисунок 20). Один атом Si был заменен одним атомом Al в каждом двойном 6-членном кольце, в результате чего была получена модель с отношением Si/Al, равным 11. Один атом H был введен на один из атомов O, связанных с каждым атомом Al, чтобы сохранить структуру заряд-нейтральный. На основании предыдущих исследований 4,29 , существующие расчетные установки и модели были надежными для исследования механизма NH 3 -SCR на цеолитах Cu-SSZ-13.
Переходные состояния элементарных шагов были обнаружены с использованием метода эластичной ленты с подталкиванием изображения восхождения (CI-NEB) с несколькими промежуточными изображениями между начальным и конечным состояниями 49,50 . Термодинамические данные обрабатывали с помощью программы VASPKIT 9.0017 51 и свободные энергии Гиббса рассчитаны при 200 °C. Структура цеолита SSZ-13 была смоделирована с использованием двух ромбоэдрических элементарных ячеек (24 тетраэдрически координированных атома) размером 18,84 Å × 9,42 Å × 9,42 Å (дополнительный рисунок 20). Один атом Si был заменен одним атомом Al в каждом двойном 6-членном кольце, в результате чего была получена модель с отношением Si/Al, равным 11. Один атом H был введен на один из атомов O, связанных с каждым атомом Al, чтобы сохранить структуру заряд-нейтральный. На основании предыдущих исследований 4,29 , существующие расчетные установки и модели были надежными для исследования механизма NH 3 -SCR на цеолитах Cu-SSZ-13.
Доступность данных
Все данные, полученные и проанализированные в этом исследовании, представлены в статье и дополнительной информации, а также доступны у соответствующих авторов по обоснованному запросу.
Ссылки
Zhang, R., Liu, N., Lei, Z. & Chen, B. Селективное преобразование различных азотсодержащих выхлопных газов в N 2 на цеолитных катализаторах. Хим. Ред. 116 , 3658–3721 (2016).
КАС пабмед Статья Google ученый
Хан, Л. и др. Селективное каталитическое восстановление NO x с помощью NH 3 с использованием новых катализаторов: современное состояние и перспективы на будущее. Хим. Ред. 119 , 10916–10976 (2019 г.).
КАС пабмед Статья Google ученый
«>Гао, Ф., Мей, Д., Ван, Ю., Шаньи, Дж. и Педен, С. Х. Селективное каталитическое восстановление на Cu/SSZ-13: связывание гомо- и гетерогенного катализа. Дж. Ам. хим. соц. 139 , 4935–4942 (2017).
КАС пабмед Статья Google ученый
Паолуччи, К. и др. Динамические многоядерные центры, образованные мобилизованными ионами меди в селективном каталитическом восстановлении NO x . Наука 357 , 898–903 (2017).
ОБЪЯВЛЕНИЯ КАС пабмед Статья Google ученый
«>Паолуччи, К. и др. Выделение окислительно-восстановительных стадий меди в стандартном селективном каталитическом восстановлении на Cu-SSZ-13. Анжю. хим. Междунар. Эд. 126 , 12022–12027 (2014).
ОБЪЯВЛЕНИЯ Статья Google ученый
Kim, Y.J. et al. Гидротермальная стабильность CuSSZ13 для восстановления NOx с помощью NH 3 . J. Катал. 311 , 447–457 (2014).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Гао Ф.
 и Шаньи Дж. О гидротермической стабильности катализаторов СКВ Cu/SSZ-13. Заяв. Катал. А 560 , 185–194 (2018).
и Шаньи Дж. О гидротермической стабильности катализаторов СКВ Cu/SSZ-13. Заяв. Катал. А 560 , 185–194 (2018).КАС Статья Google ученый
Shan, Y. et al. Точный контроль последующей обработки значительно повышает гидротермическую стабильность синтезированных in situ cu-цеолитов для реакции NH 3 -SCR. Заяв. Катал. В 266 , 118655 (2020).
КАС Статья Google ученый
Ye, X. et al. Дезактивация автомобильных выбросов с медным обменом NH 3 — Катализаторы SCR с наноразмерным разрешением с использованием сканирующей просвечивающей рентгеновской микроскопии. Анжю. хим. Междунар. Эд. 59 , 15610–15617 (2020).
КАС Статья Google ученый
Hammershøi, P.
 S., Jangjou, Y., Epling, W.S., Jensen, A.D. & Janssens, T.V.W. Обратимая и необратимая дезактивация катализаторов Cu-CHA Nh4-SCR с помощью SO 2 и SO 3 . Заяв. Катал. B 226 , 38–45 (2018).
S., Jangjou, Y., Epling, W.S., Jensen, A.D. & Janssens, T.V.W. Обратимая и необратимая дезактивация катализаторов Cu-CHA Nh4-SCR с помощью SO 2 и SO 3 . Заяв. Катал. B 226 , 38–45 (2018).Артикул КАС Google ученый
Jangjou, Y. et al. Природа активных центров Cu в Cu-SSZ-13 и их реакции на воздействие SO 2 . ACS Катал. 8 , 1325–1337 (2018).
КАС Статья Google ученый
Месилов В.В. и др. Различия в окислительно-восстановительной кинетике и подвижности частиц Cu в свежем и SO 2 — катализаторы отравленные Cu-SSZ-13. Заяв. Катал. В 284 , 119756 (2021).
КАС Статья Google ученый
Рен Л. и др. Разработан комплекс медь-амин в качестве эффективной матрицы для однореакторного синтеза цеолита Cu-SSZ-13 с превосходной активностью для селективного каталитического восстановления NO x с помощью NH 3 .
 Хим. коммун. 47 , 9789–9791 (2011).
Хим. коммун. 47 , 9789–9791 (2011).КАС Статья Google ученый
Zhang, L. et al. Последние достижения в получении цеолитов для селективного каталитического восстановления NO x в дизельных двигателях. Реагировать. хим. англ. 4 , 975–985 (2019).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Хан, Дж. Ф. и др. Быстрый синтез и NH 3 — Активность СКВ цеолита SSZ-13 через угольную пустую породу. Зеленый. хим. 22 , 219–229 (2020).
КАС Статья Google ученый
Чжао З. и др. Cu-обменный Al-обогащенный цеолит SSZ-13 из синтеза без органоматрицы в качестве катализатора NH 3 -SCR: влияние ионов Na + на активность и гидротермическую стабильность.
 Заяв. Катал. B 217 , 421–428 (2017).
Заяв. Катал. B 217 , 421–428 (2017).КАС Статья Google ученый
Wang, X. et al. Одновременное быстрое разложение NH 4 HSO 4 и эффективное удаление NOx добавлением NO 2 : возможность удаления NOx из H 2 O/SO 2 -содержащих дымовых газов при низкой температуре. Энергетическое топливо 32 , 6990–6994 (2018).
КАС Статья Google ученый
Ши, X. и др. NH 3 — Эффективность SCR свежего и гидротермически состаренного Fe-ZSM-5 в стандартных и быстрых реакциях селективного каталитического восстановления. Окружающая среда. науч. Технол. 47 , 3293–3298 (2013).
ОБЪЯВЛЕНИЯ КАС пабмед Статья Google ученый
«>Shan, Y. et al. Гидротермальное старение ослабляет ингибирующее действие NO 2 на Cu-SSZ-13 для NH 3 -SCR. Заяв. Катал. В 275 , 119105 (2020).
КАС Статья Google ученый
Shan, Y. et al. Влияние добавления NO 2 на NH 3 -SCR над мелкопористыми цеолитами Cu-SSZ-13 с различным содержанием Cu. J. Phys. хим. C. 122 , 25948–25953 (2018).
КАС Статья Google ученый
Kubota, H. et al. Образование и реакции NH 4 NO 3 в переходных и установившихся режимах NH 3 -SCR NO x над цеолитами H-AFX: спектроскопические и теоретические исследования.
 ACS Катал. 10 , 2334–2344 (2020).
ACS Катал. 10 , 2334–2344 (2020).КАС Статья Google ученый
Лю, К. и др. In Situ/Operando ИК и теоретические исследования механизма NH 3 –СКВ NO/NO 2 на цеолитах H–CHA. J. Phys. хим. C. 125 , 13889–13899 (2021).
КАС Статья Google ученый
McEwen, J. S. et al. Интегрированная операционная рентгеновская абсорбция и характеристика DFT центров обмена Cu–SSZ-13 во время селективного каталитического восстановления NOx с помощью NH 3 . Катал. Сегодня 184 , 129–144 (2012).
КАС Статья Google ученый
Лю, К. и др. Механизм NH 3 – селективного каталитического восстановления (SCR) NO/NO 2 (Fast SCR) на цеолитах Cu-CHA изучен In Situ/Operando Инфракрасная спектроскопия и теория функционала плотности.
 J. Phy. хим. C. 125 , 21975–21987 (2021).
J. Phy. хим. C. 125 , 21975–21987 (2021).КАС Статья Google ученый
Паолуччи, К. и др. Катализ в клетке: формирование и динамика обменных катионов Cu в зависимости от условий в цеолитах SSZ-13. Дж. Ам. хим. соц. 138 , 6028–6048 (2016).
КАС пабмед Статья Google ученый
Chen, L. et al. Полный механизм многоцентровой реакции низкотемпературного NH 3 -SCR над Cu-CHA. ACS Катал. 10 , 5646–5656 (2020).
КАС Статья Google ученый
Jones, C.B. et al. Влияние давления кислорода на скорость селективного каталитического восстановления NOx с помощью NH 3 на цеолитах Cu-CHA. J. Катал. 389 , 140–149(2020).
КАС Статья Google ученый
«>Кришна С. Х., Джонс С. Б. и Гундер Р. Температурная зависимость кинетики окисления Cu(I) и восстановления Cu(II) в селективном каталитическом восстановлении NOx с помощью NH 3 на Cu-шабазитовые цеолиты. J. Катал. 404 , 873–882 (2021).
КАС Статья Google ученый
Yeom, Y., Henao, J., Li, M., Sachtler, W. & Weitz, E. Роль NO в механизме восстановления аммиаком на катализаторе BaNa-Y. J. Катал. 231 , 181–193 (2005).
КАС Статья Google ученый
Риваллан М., Риккиарди Г., Бордига С.
 и Зекчина А. Адсорбция и реакционная способность оксидов азота (NO 2 , NO, N 2 O) на Fe-цеолитах. J. Катал. 264 , 104–116 (2009).
и Зекчина А. Адсорбция и реакционная способность оксидов азота (NO 2 , NO, N 2 O) на Fe-цеолитах. J. Катал. 264 , 104–116 (2009).КАС Статья Google ученый
Гроссейл А., Нова И., Тронкони Э., Чаттерджи Д. и Вейбель М. Химия NO/NO 2 –NH 3 «быстрая» реакция СКВ над Fe -ZSM5 исследовали анализом переходных реакций. Дж. Катал. 256 , 312–322 (2008).
КАС Статья Google ученый
Джованни, К. и др. Лабораторные испытания составов мочевины-SCR на соответствие выбросам Уровня 2 Ячейки 5. Серия технических документов SAE 2007-01-1575 (2007).
Квак, Дж. Х. и др. Влияние загрузки меди на селективное каталитическое восстановление оксида азота аммиаком над Cu-SSZ-13. Катал. лат. 142 , 295–301 (2012).

КАС Статья Google ученый
Негри, К. и др. Структура и реакционная способность комплексов диаминодимеди(II) с кислородным мостиком в медно-ионообменном шабазитовом катализаторе для опосредованного селективного каталитического восстановления NH 3 . Дж. Ам. хим. соц. 142 , 15884–15896 (2020).
КАС пабмед ПабМед Центральный Статья Google ученый
Сушкевич В. Л., Сафонова О. В., Палагин Д., Ньютон М. А., ван Боховен Дж. А. Структура участков меди в цеолитах, исследованная с помощью анализа Фурье и вейвлет-преобразования EXAFS. Хим. науч. 11 , 5299–5312 (2020).
КАС пабмед ПабМед Центральный Статья Google ученый
Song, J. et al. На пути к рациональному дизайну катализаторов селективного каталитического восстановления Cu/SSZ-13: выводы из понимания гидротермальной стабильности на атомном уровне.
 ACS Катал. 7 , 8214–8227 (2017).
ACS Катал. 7 , 8214–8227 (2017).КАС Статья Google ученый
Вилламена, Р. и др. Окисление низкотемпературного CO на катализаторах Cu-CHA в присутствии NH 3 : исследование подвижности ионов Cu II и роли многоядерных частиц Cu II . ChemCatChem 12 , 3843–3848 (2020).
КАС Статья Google ученый
Hu, W. et al. Раскрытие гидролиза Z2Cu 2+ в ZCu 2+ (OH) — и его последствий для низкотемпературного селективного каталитического восстановления NO на катализаторах Cu-CHA. ACS Катал. 11 , 11616–11625 (2021).
КАС Статья Google ученый
Лю, К. и др. Количественное определение частиц Cu, кислотных центров и NH 3 — Механизм СКВ на Cu-SSZ-13 и H-SSZ-13 при низких температурах.
 Катал. науч. Технол. 10 , 1135–1150 (2020).
Катал. науч. Технол. 10 , 1135–1150 (2020).ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Ньювилл, М. Интерактивный анализ XAFS и подгонка FEFF. J. Синхротронный рад. 8 , 322–324 (2001).
КАС Статья Google ученый
Крессе, Г. и Фуртмюллер, Дж. Эффективность расчетов полной энергии ab-initio для металлов и полупроводников с использованием базисного набора плоских волн. Вычисл. Матер. науч. 6 , 15–50 (1996).
КАС Статья Google ученый
Grimme, S. Полуэмпирический функционал плотности типа GGA, построенный с поправкой на дальнюю дисперсию. Дж. Вычисл. хим. 27 , 1787–1799 (2006).
КАС пабмед Статья Google ученый
«>Chen, L., Janssens, T.V.W. & Gronbeck, H. Сравнительный тест различных функционалов плотности для расчета NH 3 -SCR над Cu-Chabazite. Физ. хим. хим. физ. 21 , 10923–10930 (2019).
КАС пабмед Статья Google ученый
Хенкельман, Г., Уберуага, Б. П. и Йонссон, Х. Метод лазающего изображения с подталкиванием эластичной ленты для поиска седловых точек и путей с минимальной энергией. J. Chem. физ. 113 , 9901–9904 (2000).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
He, G. et al. Полимерные частицы ванадила определяют низкотемпературную активность катализаторов на основе ванадия для СКВ NOx с NH 3 .
 Науч. Доп. 4 , eaau4637 (2018).
Науч. Доп. 4 , eaau4637 (2018).ОБЪЯВЛЕНИЯ КАС пабмед ПабМед Центральный Статья Google ученый
Ван, В., Сюй, Н., Лю, Дж., Танг, Г. и Генг, В. VASPKIT: программа предварительной и последующей обработки кода VASP. Препринт arXiv arXiv : 1908.08269 (2019).
Kwak, J. H., Tonkyn, R. G., Kim, D. H., Szanyi, J. & Peden, C. H. F. Превосходная активность и селективность Cu-SSZ-13 в селективном каталитическом восстановлении NO x с NH 3 . J. Катал. 275 , 187–190 (2010).
КАС Статья Google ученый
Hu, W. et al. Об окислительно-восстановительном механизме низкотемпературного СКВ Nh4 на Cu-CHA: совместное экспериментальное и теоретическое исследование полуцикла восстановления. Анжю. хим. Междунар. Эд. 60 , 7197–7204 (2021).
КАС Статья Google ученый
Се, Л. и др. Ингибирующее действие NO 2 на селективное каталитическое восстановление NOx NH 3 на однореакторном катализаторе Cu–SSZ-13. Катал. науч. Технол. 4 , 1104–1110 (2014).
КАС Статья Google ученый
Гао, Ф. и др. Понимание кинетики селективного каталитического восстановления аммиака на Cu/SSZ-13 по движению ионов Cu. J. Катал. 319 , 1–14 (2014).
КАС Статья Google ученый
Кресс Г. и Жубер Д. От ультрамягких псевдопотенциалов к проекторному методу дополненной волны. Физ. Ред. B 59 , 1758–1775 (1999).
ОБЪЯВЛЕНИЯ КАС Статья Google ученый
Ссылки на скачивание
Благодарности
Эта работа была поддержана Национальным фондом естественных наук Китая (22188102, 212), Молодежной ассоциации содействия инновациям, CAS (2019045), и Проекта по механизму образования озона и стратегиям контроля Исследовательского центра эколого-экологических наук, CAS (RCEES-CYZX-2020). Мы благодарим лучевую линию 1W1B Пекинского центра синхротронного излучения за предоставление времени луча, а также благодарим Лиронга Чжэна из Института физики высоких энергий Китайской академии наук и Бин Вана из Пекинского научно-исследовательского института химической промышленности Sinopec за их помощь в работе на месте. XAFS-эксперименты.
XAFS-эксперименты.
Информация об авторе
Авторы и организации
Государственная ключевая совместная лаборатория моделирования окружающей среды и контроля загрязнения, Исследовательский центр эколого-экологических наук, Китайская академия наук, Пекин, 100085, Китай
Юлонг Шань, Гуанчжи Хэ, Yu Sun, Zhongqi Liu, Yu Fu, Xiaoyan Shi, Yunbo Yu и Hong He
Центр передового опыта в области региональной атмосферной среды и Ключевая лаборатория преобразования городских загрязнителей, Институт городской среды Академии наук Китая, Сямынь, 361021, Китай
Jinpeng Du, Yunbo Yu и Hong He
Университет Китайской академии наук, Пекин, 100049, Китай
Yu Sun, Zhongqi Liu, Yu Fu, Xiaoyan Shi, Yunbo Yu и Hong He Department
1
1 61
1
1
9 Департамент гражданской, экологической и строительной инженерии, Кластер катализа для возобновляемых источников энергии и химических преобразований (REACT), Центр нанотехнологий (NSTC), Университет Центральной Флориды, Орландо, Флорида, 32816, США
Fudong Liu
Авторы
- Yulong Shan
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Guangzhi He
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Jinpeng Du
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
- Ю Сунь
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Zhongqi Liu
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Yu Fu
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Fudong Liu
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Xiaoyan Shi
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Yunbo Yu
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Hong He
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
Contributions
H. H. and G.H. разработал и руководил исследованием. Ю.Л.С. разработал и провел эксперименты с J.D., Y.S. и З.Л. Г.Х. и Ю.Ф. провел расчеты ДПФ. F.L., X.S. и Y.Y. внесли предложения по рукописи. Ю.Л.С., Г.Х. и HH написали рукопись. Все авторы обсудили результаты и прокомментировали рукопись.
H. and G.H. разработал и руководил исследованием. Ю.Л.С. разработал и провел эксперименты с J.D., Y.S. и З.Л. Г.Х. и Ю.Ф. провел расчеты ДПФ. F.L., X.S. и Y.Y. внесли предложения по рукописи. Ю.Л.С., Г.Х. и HH написали рукопись. Все авторы обсудили результаты и прокомментировали рукопись.
Авторы, переписывающиеся
Соответствие Гуанчжи Хе или Хун Хе.
Заявление об этике
Конкурирующие интересы
Авторы не заявляют об отсутствии конкурирующих интересов.
Рецензирование
Информация о рецензировании
Nature Communications благодарит Сиддарта Кришну и других анонимных рецензентов за их вклад в рецензирование этой работы. Доступны отчеты рецензентов.
Дополнительная информация
Примечание издателя Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Дополнительная информация
Дополнительная информация
Файл рецензирования
Права и разрешения
Открытый доступ Использование, распространение, распространение этой статьи под лицензией Creative Commons. и воспроизведение на любом носителе или в любом формате, при условии, что вы укажете автора(ов) оригинала и источник, предоставите ссылку на лицензию Creative Commons и укажете, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
и воспроизведение на любом носителе или в любом формате, при условии, что вы укажете автора(ов) оригинала и источник, предоставите ссылку на лицензию Creative Commons и укажете, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Перепечатка и разрешения
Об этой статье
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Регулирование частиц Cu в CuO/SiO2 и их структурная эволюция в реакции этинилирования
1. Ge Y.Y., Jia Z.Q., Li H.T. Аморфные алюмосиликаты, используемые в качестве кислотных катализаторов полимеризации тетрагидрофурана. Реагировать. Кинет. мех. Катал. 2014; 112:467–475. doi: 10.1007/s11144-014-0714-2. [Перекрестная ссылка] [Академия Google]
Ge Y.Y., Jia Z.Q., Li H.T. Аморфные алюмосиликаты, используемые в качестве кислотных катализаторов полимеризации тетрагидрофурана. Реагировать. Кинет. мех. Катал. 2014; 112:467–475. doi: 10.1007/s11144-014-0714-2. [Перекрестная ссылка] [Академия Google]
2. Чжан К., Чжан Ю., Ли Х.Т., Гао К.Г., Чжао Ю.С. Гетерогенные CaO-ZrO 2 кислотно-основные бифункциональные катализаторы для парофазной селективной дегидратации 1,4-бутандиола в 3-бутен-1-ол. заявл. Катал. Ген. 2013; 466: 233–239. doi: 10.1016/j.apcata.2013.06.020. [CrossRef] [Google Scholar]
3. Li H.T., Zhao Y.X., Gao C.G., Wang Y.Z., Sun Z.J., Liang X.Y. Исследование дезактивации Ni/Al 2 O 3 катализатора жидкофазного гидрирования водного раствора сырого 1,4-бутандиола. хим. англ. Дж. 2012; 181–182: 501–507. doi: 10.1016/j.cej.2011.06.029. [CrossRef] [Google Scholar]
4. Таниелян С., Шмидт С., Марин Н., Алвес Г., Августин Р. Селективное гидрирование 2-бутин-1,4-диола в 1,4-бутандиол на твердых частицах. Raney ® Никелевые катализаторы. Верхний. Катал. 2010;53:1145–1149. doi: 10.1007/s11244-010-9550-4. [CrossRef] [Google Scholar]
Raney ® Никелевые катализаторы. Верхний. Катал. 2010;53:1145–1149. doi: 10.1007/s11244-010-9550-4. [CrossRef] [Google Scholar]
5. Чаудхари Р.В., Роде К.В., Джаганатан Р. Процесс превращения 1,4-бутиндиола в 1,4-бутендиол и 1,4-бутандиол. 6469221Б1. Патент США. 2002 г., 16 июля;
6. Чжоу С.Л. Технология и перспективы рынка 1,4-бутандиола. Домашний питомец. Домашний питомец. Сегодня. 2014;6:35–40. [Академия Google]
7. Луо М., Ли Х.Т., Ма З.К., Ван Дж.Дж., Чжао Ю.С. Исследования процесса активации катализатора CuO-Bi 2 O 3 /SiO 2 -MgO в реакции этинилирования формальдегида. Инд Катал. (Китай) 2014; 22:363–368. [Google Scholar]
8. Хаас Т., Джагер Б., Вебер Р., Митчелл С.Ф., Кинг С.Ф. Новый диоловый процесс: 1,3-пропандиол и 1,4-бутандиол. заявл. Катал. Ген. 2005; 280: 83–88. doi: 10.1016/j.apcata.2004.08.027. [CrossRef] [Google Scholar]
9. Зак Д.Дж. Производство бутиндиола. 4085151. Патент США. 1978 18 апреля;
10.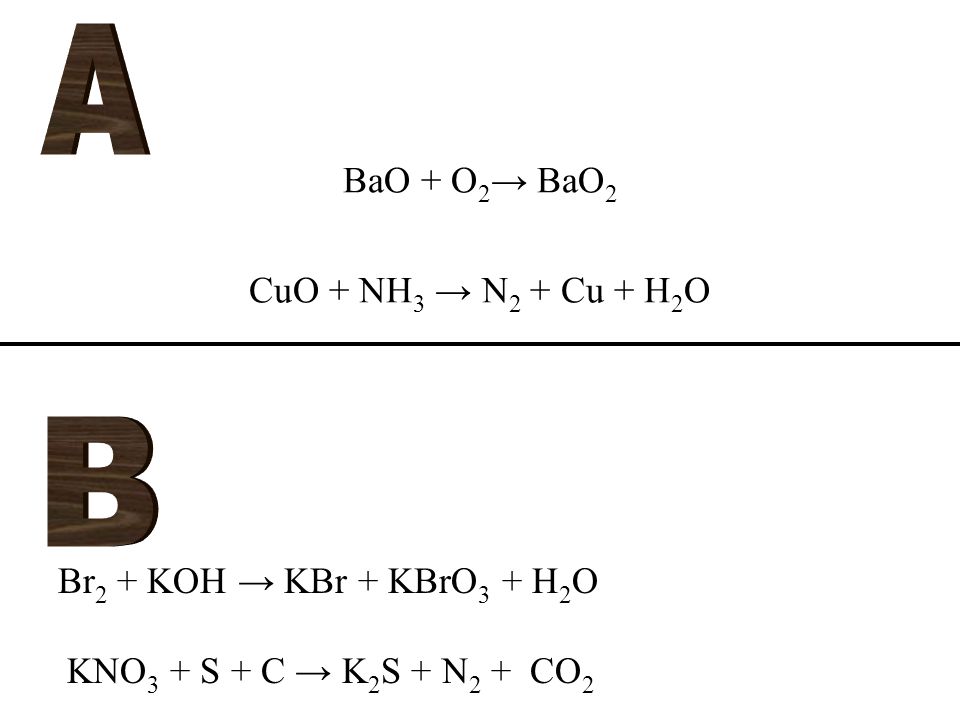 Фремонт Дж. М. Получение бутиндиола. 4584418. Патент США. 1986 г., 22 апреля;
Фремонт Дж. М. Получение бутиндиола. 4584418. Патент США. 1986 г., 22 апреля;
11. Reppe W., Steinhofer A., Spaenig H. Производство алкинолов. 2300969. Патент США. 1942 г., 3 ноября;
12. Hort E.V., Piscataway N.J. Катализатор этинилирования и способ получения алкинолов с помощью реакций низкого давления. 3
9. Патент США. 1975 г., 18 ноября;13. Фремонт Дж. М. Получение бутиндиола с использованием модифицированного висмутом сфероидального малахита. 4127734. Патент США. 1978 28 ноября;
14. Киршнер Р.Дж. Этинилирование формальдегида. 3560576. Патент США. 1971 г., 2 февраля;
15. Бонрат В., Бернд Э., Рейнхард К., Шнайдер М. Процесс этинилирования. 6949685. Патент США. 2005 г., 27 сентября;
16. Тротуш И.Т., Циммерманн Т., Шут Ф. Каталитические реакции ацетилена: новый взгляд на сырье для химической промышленности. хим. 2014; 114:1761–1782. doi: 10.1021/cr400357r. [PubMed] [CrossRef] [Google Scholar]
17. Zheng Y., Sun Z.J., Wang Y. Z., Li H.T., Wang S.A., Luo M., Zhao J.L., Zhao Y.X. Получение CuO-Bi 2 O 3 /SiO 2 -Катализатор MgO и его характеристики этинилирования. Дж. Мол. Катал. (Китай) 2012; 26: 233–238. [Google Scholar]
Z., Li H.T., Wang S.A., Luo M., Zhao J.L., Zhao Y.X. Получение CuO-Bi 2 O 3 /SiO 2 -Катализатор MgO и его характеристики этинилирования. Дж. Мол. Катал. (Китай) 2012; 26: 233–238. [Google Scholar]
18. Wang J.J., Li H.T., Ma Z.Q., Wang Z.P., Guo J.Y., Zhao Y.X. Приготовление магнитного катализатора CuO-Bi 2 O 3 /Fe 3 O 4 -SiO 2 -MgO катализатора и его каталитическая эффективность для этинилирования формальдегида. Дж. Хим. Инд.Инж. 2015;66:2098–2104. [Google Scholar]
19. Ван З.П., Ню З.З., Бан Л.Дж., Хао К.А., Чжан Х.С., Ли Х.Т., Чжао Ю.С. Реакция этинилирования формальдегида на Cu 2 O на TiO 2 с разными фазами. хим. Дж. Чин. ун-т 2019;40:334–341. [Google Scholar]
20. Ян Г.Ф., Ли Х.Т., Чжан Х.С., Ван З.П., Лю Л.Л., Чжао Ю.С. Влияние концентрации NaOH на структуру и каталитическую активность Cu 2 O при этинилировании формальдегидом. Дж. Мол. Катал. (Китай) 2016; 30: 540–546. [Google Scholar]
Дж. Мол. Катал. (Китай) 2016; 30: 540–546. [Google Scholar]
21. Li H.T., Niu Z.Z., Yang G.F., Zhang H.X., Wang Z.P., Zhao Y.X. Опорный эффект Cu 2 O/TiO 2 используется для этинилирования формальдегида. Дж. Хим. Инд.Инж. 2018;69:2512–2518. [Google Scholar]
22. Геррейро Э.Д., Горриз О.Ф., Ларсен Г., Арруа Л.А. Катализаторы Cu/SiO 2 для дегидрирования метанола в метилформиат: сравнительное исследование с использованием различных методов приготовления. заявл. Катал. А. 2000; 204:33–48. doi: 10.1016/S0926-860X(00)00507-X. [CrossRef] [Google Scholar]
23. Chen L.F., Guo P.J., Qiao M.H., Yan S.R., Li H.X., Shen W., Xu H.L., Fan K.N. Cu/SiO 2 катализаторы, приготовленные методом испарения аммиака: Текстура, структура и каталитическая активность при гидрировании диметилоксалата в этиленгликоль. Дж. Катал. 2008; 257: 172–180. doi: 10.1016/j.jcat.2008.04.021. [CrossRef] [Google Scholar]
24. Brands D.S., Poels E. K., Bliek A. Гидрогенолиз сложных эфиров на промотированных катализаторах Cu/SiO 2 . заявл. Катал. А. 1999; 184: 279–289. doi: 10.1016/S0926-860X(99)00106-4. [CrossRef] [Google Scholar]
K., Bliek A. Гидрогенолиз сложных эфиров на промотированных катализаторах Cu/SiO 2 . заявл. Катал. А. 1999; 184: 279–289. doi: 10.1016/S0926-860X(99)00106-4. [CrossRef] [Google Scholar]
25. Kasinathan E., Hwang D.W., Lee U.H. Влияние размера частиц Cu на гидрирование диметилсукцината над Cu-SiO 2 нанокомпозит. Катал. коммун. 2013;41:17–20. doi: 10.1016/j.catcom.2013.06.034. [CrossRef] [Google Scholar]
26. Wang Z., Liu Q., Yu J., Wu T., Wang G. Структура поверхности и каталитическое поведение медных катализаторов на носителе из диоксида кремния, приготовленных методами пропитки и золь-гель. заявл. Катал. А. 2003; 239:87–94. doi: 10.1016/S0926-860X(02)00421-0. [CrossRef] [Google Scholar]
27. Shan S.F., Liu HY., Shi G., Bao X.J. Настройка структуры активной фазы и характеристик гидроочистки триметаллических катализаторов WMoNi, нанесенных на оксид алюминия, путем введения фосфора. Фронт. хим. науч. англ. 2018;12:59–69. doi: 10.1007/s11705-017-1686-3. [CrossRef] [Google Scholar]
[CrossRef] [Google Scholar]
28. Wang Z.P., Niu Z.Z., Hao Q.A., Ban L.J., Li H.T., Zhao Y.X., Jiang Z. Повышение эффективности этинилирования CuO-Bi 2 O 3 нанокатализаторов путем настройки Взаимодействие Cu-Bi и фазовые структуры. Катализаторы. 2019;9:35. doi: 10.3390/catal35. [CrossRef] [Google Scholar]
29. Lapisardi G., Chiker F., Launay F., Nogier J.-P., Bonardet J.-L. «Однореакторный» синтез адипиновой кислоты из циклогексена в мягких условиях с использованием новых бифункциональных мезоструктурированных катализаторов Ti-AlSBA. Катал. коммун. 2004; 5: 277–281. doi: 10.1016/j.catcom.2004.03.005. [Перекрестная ссылка] [Академия Google]
30. Яо К.Л., Лу З.Х., Ван Ю.К., Чен Х.С., Фэн Г. Синергетический катализ неблагородных биметаллических наночастиц Cu-Co, встроенных в SiO 2 Наносферы в гидролитическом дегидрировании борана аммиака. Дж. Физ. хим. C. 2015; 119:14167–14174. doi: 10.1021/acs.jpcc.5b02403. [CrossRef] [Google Scholar]
31. Ван С., Го В.В., Ван Х.С., Чжу Л.Дж., Инь С., Цю К.З. Влияние способа приготовления катализатора Cu/SBA-15 на гидрирование метилацетата для производства этанола. Новый J. Chem. 2014;38:2792. doi: 10.1039/c4nj00134f. [CrossRef] [Google Scholar]
Ван С., Го В.В., Ван Х.С., Чжу Л.Дж., Инь С., Цю К.З. Влияние способа приготовления катализатора Cu/SBA-15 на гидрирование метилацетата для производства этанола. Новый J. Chem. 2014;38:2792. doi: 10.1039/c4nj00134f. [CrossRef] [Google Scholar]
32. Wang Z.Q., Xu Z.N., Peng S.Y., Zhang M.J., Lu G., Chen Q.S., Chen Y.M., Guo G.C. Высокоэффективный и долговечный Cu/SiO 2 Нанокатализатор для CO 2 Гидрирование. Катал. 2015;5:4255–4259. doi: 10.1021/acscatal.5b00682. [CrossRef] [Google Scholar]
33. Van der Grift C.J.G., Wielers A.F.H., Mulder A., Geus J.W. Восстановительное поведение медных катализаторов, нанесенных на оксид кремния, приготовленных осаждением-осаждением. Термохим. Акта. 1990;171:95. doi: 10.1016/0040-6031(90)87011-Z. [CrossRef] [Google Scholar]
34. Toupance T., Kermarec M., Louis C. Размер частиц металла в медных катализаторах, нанесенных на оксид кремния. Влияние условий подготовки и предварительной термической обработки. Дж. Физ. хим. Б. 2000; 104:965–972. doi: 10.1021/jp9
Дж. Физ. хим. Б. 2000; 104:965–972. doi: 10.1021/jp9
35. Diaz G., Perez-Hernandez R., Gómez-Cortés A., Benaissa M., Mariscal R., Fierro J. CuO–SiO 2 Золь-гель катализаторы: характеристика и каталитические свойства для восстановления NO. Дж. Катал. 1999;187:1–14. doi: 10.1006/jcat.1999.2578. [CrossRef] [Google Scholar]
36. Toupance T., Kermarec M., Lambert J.-F., Louis C. Условия образования филлосиликатов меди в медных катализаторах на основе диоксида кремния, полученных селективной адсорбцией. Дж. Физ. хим. Б. 2002; 106: 2277–2286. doi: 10.1021/jp013153x. [CrossRef] [Google Scholar]
37. Cordoba G., Arroyo R., Fierro J.L.G., Viniegra M. Исследование перехода ксерогель-стекло CuO/SiO 2 . J. Химия твердого тела. 1996;123:93–99. doi: 10.1006/jssc.1996.0156. [CrossRef] [Google Scholar]
38. Huang Z.W., Cui F., Xue J.J., Zuo J.L. Катализаторы Cu/SiO 2 , полученные гомогенными и гетерогенными методами осаждения-осаждения: Текстура, структура и каталитические характеристики в гидрогенолиз глицерина до 1,2-пропандиола. Катал. Сегодня. 2012; 183:42–51. doi: 10.1016/j.cattod.2011.08.038. [CrossRef] [Google Scholar]
Катал. Сегодня. 2012; 183:42–51. doi: 10.1016/j.cattod.2011.08.038. [CrossRef] [Google Scholar]
39. Ищенко Е.В., Мацуй Л.Ю., Гайдай С.В., Вовченко Л.Л., Карташова Т.В., Лисняк В.В. Терморасширенный графит, содержащий CuO/Cu 2 (OH) 3 NO 3 :(Co 2+ /Fe 3+ ) Композиты: Получение, характеристика и каталитическая активность в конверсии CO. Материалы. 2010;3:572–584. doi: 10.3390/ma3010572. [CrossRef] [Google Scholar]
40. Юрьева Т.М., Кустова Г.Н., Минюкова Т.П., Поэлс Е.К., Блик А., Демешкина М.П., Плясова Л.М., Кригер Т.А., Зайковский В.И. Негидротермальный синтез медно-, цинк- и медно-цинковых гидросиликатов. Матер. Рез. иннов. 2001; 5:3–11. дои: 10.1007/s1001127. [CrossRef] [Google Scholar]
41. Goldstein H.F., Kim D.S., Yu P.Y., Bourne L.C. Рамановское исследование монокристаллов CuO. физ. Преподобный Б. 1990; 41:7192. doi: 10.1103/PhysRevB.41.7192. [PubMed] [CrossRef] [Google Scholar]
42. Irwin J.C., Chrzanowski J., Wei T., Lockwood D.J., Wold A. Рамановское рассеяние на монокристаллах оксида меди. Physica C. 1990; 166: 456–464. doi: 10.1016/0921-4534(90)-F. [CrossRef] [Google Scholar]
Irwin J.C., Chrzanowski J., Wei T., Lockwood D.J., Wold A. Рамановское рассеяние на монокристаллах оксида меди. Physica C. 1990; 166: 456–464. doi: 10.1016/0921-4534(90)-F. [CrossRef] [Google Scholar]
43. Wang W., Liu Z., Liu Y., Xu C., Zheng C., Wang G. Простой мокрый химический синтез и характеристика наностержней CuO. заявл. физ. А. 2003; 76: 417–420. дои: 10.1007/s00339-002-1514-5. [CrossRef] [Google Scholar]
44. Xu J.F., Ji W., Shen Z.X., Li W.S., Tang S.H., Ye X.R., Jia D.Z., Xin X.Q. Получение и характеристика нанокристаллов CuO. Дж. Рамановская спектроскопия. 1999; 30: 413–415. doi: 10.1002/(SICI)1097-4555(199905)30:5<413::AID-JRS387>3.0.CO;2-N. [CrossRef] [Google Scholar]
45. Raimondi F., Geissler K., Wambach J., Wokaun A. Производство водорода путем риформинга метанола: послереакционная характеристика Cu/ZnO/Al 2 O 3 9Катализатор 0006 XPS и TPD. заявл. Серф. науч. 2002; 189: 59–71. doi: 10.1016/S0169-4332(01)01045-5. [CrossRef] [Google Scholar]
46. Gong J., Yue H., Zhao Y., Zhao S., Zhao L., Lv J., Wang S., Ma X. Синтез этанола с помощью синтез-газа на Cu/ SiO 2 Катализаторы со сбалансированными центрами Cu 0 –Cu + . Варенье. хим. соц. 2012; 134:13922–13925. дои: 10.1021/ja3034153. [PubMed] [CrossRef] [Google Scholar]
Gong J., Yue H., Zhao Y., Zhao S., Zhao L., Lv J., Wang S., Ma X. Синтез этанола с помощью синтез-газа на Cu/ SiO 2 Катализаторы со сбалансированными центрами Cu 0 –Cu + . Варенье. хим. соц. 2012; 134:13922–13925. дои: 10.1021/ja3034153. [PubMed] [CrossRef] [Google Scholar]
47. Ding J., Popa T., Tang J. Высокоселективный и стабильный Cu/SiO 2 катализаторы, приготовленные зеленым способом для гидрирования диэтилоксалата в этиленгликоль. заявл. Катал. Б Окружающая среда. 2017; 209: 530–542. doi: 10.1016/j.apcatb.2017.02.072. [CrossRef] [Google Scholar]
48. Huang Z., Liu H., Cui F., Kang H., Chen J., Zou J., Xia C. Влияние осадителей и редкоземельных добавок на структуру и каталитическая активность в гидрогенолизе глицерина катализаторов Cu/SiO 2 , приготовленных гель-осаждающим методом. Катал. Сегодня. 2014; 234:223–232. doi: 10.1016/j.cattod.2014.02.037. [Перекрестная ссылка] [Академия Google]
49. Gervasini A. , Manzoli M., Martra G., Ponti A., Ravasio N., Sordelli L., Zaccheria F. Зависимость видов меди от природы носителя для дисперсных катализаторов CuO. Дж. Физ. хим. Б. 2006; 110:7851–7861. doi: 10.1021/jp056604c. [PubMed] [CrossRef] [Google Scholar]
, Manzoli M., Martra G., Ponti A., Ravasio N., Sordelli L., Zaccheria F. Зависимость видов меди от природы носителя для дисперсных катализаторов CuO. Дж. Физ. хим. Б. 2006; 110:7851–7861. doi: 10.1021/jp056604c. [PubMed] [CrossRef] [Google Scholar]
50. Auroux A., Gervasini A., Guimon C. Кислотный характер нагруженных металлом аморфных и кристаллических алюмосиликатов, определенный с помощью XPS и адсорбционной калориметрии. Дж. Физ. хим. Б. 1999; 103:7195–7205. дои: 10.1021/jp9ч. [CrossRef] [Google Scholar]
51. Chang F.W., Kuo W.Y., Lee K.C. Дегидрирование этанола на медных катализаторах на золе рисовой шелухи, приготовленной пропиткой по начальной влажности. заявл. Катал. А. 2003; 246: 253–264. doi: 10.1016/S0926-860X(03)00050-4. [CrossRef] [Google Scholar]
52. Wang C., Cheng Q., Wang X., Ma K., Bai X., Tan S., Tian Y., Ding T., Zheng L., Zhang J. , и другие. Улучшенные каталитические характеристики для предпочтительного окисления CO по сравнению с катализаторами CuO, нанесенными на высокодефектный CeO 2 нанокристаллы. заявл. Серф. науч. 2017; 422:932–943. doi: 10.1016/j.apsusc.2017.06.017. [CrossRef] [Google Scholar]
заявл. Серф. науч. 2017; 422:932–943. doi: 10.1016/j.apsusc.2017.06.017. [CrossRef] [Google Scholar]
53. Хорнес А., Бера П., Камара А.Л., Гамарра Д., Мунуэра Г., Мартинес-Ариас А. CO-TPR-DRIFTS-MS in situ исследование CuO/Ce 1-x Tb x O 2-y (x = 0, 0,2 и 0,5) катализаторы: Поддерживающие эффекты на окислительно-восстановительные свойства и катализ окисления CO. Дж. Катал. 2009; 268:367–375. doi: 10.1016/j.jcat.2009.10.007. [CrossRef] [Академия Google]
54. Manzoli M., Monte R.D., Boccuzzi F., Coluccia S., Kašpar J. Окисление CO на катализаторах CuOx-CeO 2 -ZrO 2 : Переходное поведение и роль кластеров меди в контакте с оксидом церия. заявл. Катал. Б. 2005; 61: 192–205. doi: 10.1016/j.apcatb.2005.05.005. [CrossRef] [Google Scholar]
55. Guo XL, Zhou R.X. Новый взгляд на морфологию влияния оксида церия на катализаторы CuO/CeO 2 для селективного окисления СО в богатом водородом газе. Катал. науч. Технол. 2016; 6: 3862–3871. дои: 10.1039/C5CY01816A. [CrossRef] [Google Scholar]
науч. Технол. 2016; 6: 3862–3871. дои: 10.1039/C5CY01816A. [CrossRef] [Google Scholar]
56. Wang C.Y., Ray P., Gong Q.H., Zhao Y.G., Li J., Lueking A.D. Влияние упаковки и ориентации газа на активность FTIR при хемосорбции CO на крыльчатке Cu. физ. хим. хим. физ. 2015;17:26766. doi: 10.1039/C5CP04474J. [PubMed] [CrossRef] [Google Scholar]
CuO + nh4 наблюдение CuO Nh4
Giáo Dục
Hàn Tín20 Tháng Mười, 2021
38 5 минут чтения
Phương trình hoá học có chứa chất tham gia CuO Nh4 và chất sản phẩm Cu h3O N2 kèm trạng thái chất, màu sắc và phân loại phương trình.Bạn đang xem: cuo + nh4 наблюдение CuO Nh4 Tại Веб-сайт saigonmetromall.com.vn
добавление концентрированной HCl (водн.) к CuCl. CuO + h3 → Cu + h3O. Nh4 + cuo = chất rắn a + hỗn hợp khí b. nhờ các bạn giải giúp cho lượng khí nh4 đi từ từ qu ống sứ chứa 3,2g cuo nung nóng ến khi phản ứng xảy ra rang nung thu được rắn A và 1 hỗn hợp khí B. Chất rắn A phản ứng vừa đủ với 20 мл HCl 1M. Дайте около 10 минут для этого dùng thử. а.Вьет птпу. Пожалуйста, зарегистрируйтесь, чтобы оставлять комментарии. Это твердое вещество красного цвета входит в состав некоторых необрастающих красок. медленно добавляйте аммиак, пока не образуется бледно-голубой осадок, добавляйте еще аммиака, пока не образуется темно-синий раствор, добавляйте серную кислоту, пока не образуется бледно-голубой осадок, продолжайте добавлять серную кислоту, пока не образуется первоначальный прозрачный бледно-голубой раствор. Предложены две скелетные схемы в условиях низкой или высокой температуры. Copyright © 2021 Elsevier B.V. или ее лицензиары или участники. Университет не несет ответственности за любые особые, прямые, косвенные, случайные или косвенные убытки любого рода (включая, помимо прочего, гонорары адвокатов) каким-либо образом из-за, в результате или в связи с использованием или невозможность использования веб-сайта или контента. Раздел пользовательских демонстраций на веб-сайте используется инструкторами химии UO для планирования демонстраций, которые не указаны в базе данных.
Chất rắn A phản ứng vừa đủ với 20 мл HCl 1M. Дайте около 10 минут для этого dùng thử. а.Вьет птпу. Пожалуйста, зарегистрируйтесь, чтобы оставлять комментарии. Это твердое вещество красного цвета входит в состав некоторых необрастающих красок. медленно добавляйте аммиак, пока не образуется бледно-голубой осадок, добавляйте еще аммиака, пока не образуется темно-синий раствор, добавляйте серную кислоту, пока не образуется бледно-голубой осадок, продолжайте добавлять серную кислоту, пока не образуется первоначальный прозрачный бледно-голубой раствор. Предложены две скелетные схемы в условиях низкой или высокой температуры. Copyright © 2021 Elsevier B.V. или ее лицензиары или участники. Университет не несет ответственности за любые особые, прямые, косвенные, случайные или косвенные убытки любого рода (включая, помимо прочего, гонорары адвокатов) каким-либо образом из-за, в результате или в связи с использованием или невозможность использования веб-сайта или контента. Раздел пользовательских демонстраций на веб-сайте используется инструкторами химии UO для планирования демонстраций, которые не указаны в базе данных. и переместите ползунок слева направо, чтобы увидеть влияние covid-19в Китае: сравните 2020 год со средним показателем за 3 предыдущих года во время и после блокировки. Комплексный ион меди и аммиака имеет темно-фиолетовый цвет, что придает ему … The Calitha – GOLD engine (c#) (Сделано это … N 2 O 4 является диамагнетиком, поэтому он бесцветный. Мы используем файлы cookie, чтобы предоставлять и улучшать наши услуги, а также адаптировать контент и реклама. UO Libraries Interactive Media Group. Мы также признаем предыдущую поддержку Национального научного фонда в рамках грантов № 1246120, 1525057, … восстановление [CuCl4] 2- с помощью Cu или So2. Таким образом, степень окисления азота снижается с +5 до +2 в то время как степень окисления меди увеличивается от 0 до + 2. Этот навоз является хорошей иллюстрацией принципа Ле Шателье и образования комплексных ионов. Самый простой способ представить эту систему: CuCl 4 2- (зеленый) + 4 H 2 O <==> Cu(H 2 O) 4 2+ (синий) + 4 Cl-. Это равновесие, вероятно, лучше всего представить для обсуждения принципа Ле Шателье на вводном курсе Gen Chem, но система, вероятно, более сложным, возможно, с образованием смешанных комплексов.
и переместите ползунок слева направо, чтобы увидеть влияние covid-19в Китае: сравните 2020 год со средним показателем за 3 предыдущих года во время и после блокировки. Комплексный ион меди и аммиака имеет темно-фиолетовый цвет, что придает ему … The Calitha – GOLD engine (c#) (Сделано это … N 2 O 4 является диамагнетиком, поэтому он бесцветный. Мы используем файлы cookie, чтобы предоставлять и улучшать наши услуги, а также адаптировать контент и реклама. UO Libraries Interactive Media Group. Мы также признаем предыдущую поддержку Национального научного фонда в рамках грантов № 1246120, 1525057, … восстановление [CuCl4] 2- с помощью Cu или So2. Таким образом, степень окисления азота снижается с +5 до +2 в то время как степень окисления меди увеличивается от 0 до + 2. Этот навоз является хорошей иллюстрацией принципа Ле Шателье и образования комплексных ионов. Самый простой способ представить эту систему: CuCl 4 2- (зеленый) + 4 H 2 O <==> Cu(H 2 O) 4 2+ (синий) + 4 Cl-. Это равновесие, вероятно, лучше всего представить для обсуждения принципа Ле Шателье на вводном курсе Gen Chem, но система, вероятно, более сложным, возможно, с образованием смешанных комплексов. Количество добавляемой Cu в начале будет таким же е после реакции. Реакция взаимодействия оксида меди, аммиака и воды CuO + 4NH 3 + H 2 O → [Cu (NH 3) 4 ] (OH) 2 [ Проверить баланс ] Реакция взаимодействия оксида меди, аммиака и воды с образованием гидроксида диамминмеди (II). Хлорид меди(I) получают? Инструкции. Основная проблема катализаторов СКВ на основе CuO хорошо изучена. Прямая ссылка на это сбалансированное уравнение: Инструкции по балансировке химических уравнений: Введите уравнение химической реакции и нажмите «Баланс». Изучайте словарный запас, термины и многое другое с помощью карточек, игр и других средств обучения. Начните изучать наблюдения и уравнения лаборатории Меди. CuO (т) + h3 (г) → Cu(т) + h3O (г) а) Назовите окисляемое вещество. Он горит желтовато-зеленым пламенем с образованием водяного пара и азота. Какие наблюдения можно сделать? В избытке Nh4(aq) ион Cu2+ образует темно-синий комплексный ион Cu(Nh4)42+, константа образования которого Kf = 5,6·1011. Если нагреть приготовленный раствор медного купороса, вода испарится и у вас останутся белые кристаллы безводного сульфата меди.
Количество добавляемой Cu в начале будет таким же е после реакции. Реакция взаимодействия оксида меди, аммиака и воды CuO + 4NH 3 + H 2 O → [Cu (NH 3) 4 ] (OH) 2 [ Проверить баланс ] Реакция взаимодействия оксида меди, аммиака и воды с образованием гидроксида диамминмеди (II). Хлорид меди(I) получают? Инструкции. Основная проблема катализаторов СКВ на основе CuO хорошо изучена. Прямая ссылка на это сбалансированное уравнение: Инструкции по балансировке химических уравнений: Введите уравнение химической реакции и нажмите «Баланс». Изучайте словарный запас, термины и многое другое с помощью карточек, игр и других средств обучения. Начните изучать наблюдения и уравнения лаборатории Меди. CuO (т) + h3 (г) → Cu(т) + h3O (г) а) Назовите окисляемое вещество. Он горит желтовато-зеленым пламенем с образованием водяного пара и азота. Какие наблюдения можно сделать? В избытке Nh4(aq) ион Cu2+ образует темно-синий комплексный ион Cu(Nh4)42+, константа образования которого Kf = 5,6·1011. Если нагреть приготовленный раствор медного купороса, вода испарится и у вас останутся белые кристаллы безводного сульфата меди. Какой замечательный программный продукт!) В этой реакции используются опасные вещества — см. ниже. CuO: 3: 79.5454: N 2: 1: 28,0134: Cu: 3: 63,546: H 2 O: 3: 18,01528: Единицы: молярная масса – г/моль, масса – г. Пожалуйста, расскажите об этом бесплатном программном обеспечении по химии своим друзьям! Предварительный просмотр неформатированного текста: Лабораторная работа 6: Таблицы данных химических реакций Название: _____ Таблицы данных Раздел I: Реакция Mg с раствором HCl: Ваши наблюдения Внешний вид Mg В раствор был помещен кусок ленты Mg. Mg представляет собой небольшой блестящий кусочек. какого цвета и состояния CuCl. Рассчитайте концентрацию Cu2+ в растворе, приготовленном добавлением 4,8·10-3 моль CuSO4 к 0,500 л 0,32. каким-либо образом связанным с (а) любыми ошибками или упущениями на этом веб-сайте и его содержимом, включая, помимо прочего, технические неточности и типографские ошибки, или (б) использованием вами этого веб-сайта и информации, содержащейся на этом веб-сайте… Университет не несет ответственности за любые убытки, травмы, претензии, ответственность или ущерб любого рода, возникшие в результате использования вами веб-сайта.
Какой замечательный программный продукт!) В этой реакции используются опасные вещества — см. ниже. CuO: 3: 79.5454: N 2: 1: 28,0134: Cu: 3: 63,546: H 2 O: 3: 18,01528: Единицы: молярная масса – г/моль, масса – г. Пожалуйста, расскажите об этом бесплатном программном обеспечении по химии своим друзьям! Предварительный просмотр неформатированного текста: Лабораторная работа 6: Таблицы данных химических реакций Название: _____ Таблицы данных Раздел I: Реакция Mg с раствором HCl: Ваши наблюдения Внешний вид Mg В раствор был помещен кусок ленты Mg. Mg представляет собой небольшой блестящий кусочек. какого цвета и состояния CuCl. Рассчитайте концентрацию Cu2+ в растворе, приготовленном добавлением 4,8·10-3 моль CuSO4 к 0,500 л 0,32. каким-либо образом связанным с (а) любыми ошибками или упущениями на этом веб-сайте и его содержимом, включая, помимо прочего, технические неточности и типографские ошибки, или (б) использованием вами этого веб-сайта и информации, содержащейся на этом веб-сайте… Университет не несет ответственности за любые убытки, травмы, претензии, ответственность или ущерб любого рода, возникшие в результате использования вами веб-сайта. 2+. Cu ведет себя как катализатор, и NH 3 окисляется до NO. белый и твердый. © Copyright 2012 Tin nhắn hộp thư онлайн: Трехгорлая круглодонная колба на 500 мл, содержащая 200 мл 0,1 М дигидрата хлорида меди (II) в воде и магнитная мешалка, 24/40 вертикальных шлифов. Резюме Понимание процессов окисления аммиака (NH 3 ) на поверхности CuO, а затем путей образования N 2 и NO x весьма важно для обеспечения благоприятного направления рационального подбора высокоэффективных носителей кислорода на основе меди при химическом петлевом горении. (CLC) и CuO Nh4-содержащие катализаторы в селективном каталитическом восстановлении (СКВ). Тип реакции. капельная воронка, содержащая 150 мл концентрированного раствора аммиака (гидроксида аммония), 24/40 швов матового стекла. ScienceDirect ® является зарегистрированным товарным знаком Elsevier B.V. ScienceDirect ® является зарегистрированным товарным знаком Elsevier B.V. Чтобы сбалансировать химическое уравнение, введите уравнение химической реакции и нажмите кнопку Balance.
2+. Cu ведет себя как катализатор, и NH 3 окисляется до NO. белый и твердый. © Copyright 2012 Tin nhắn hộp thư онлайн: Трехгорлая круглодонная колба на 500 мл, содержащая 200 мл 0,1 М дигидрата хлорида меди (II) в воде и магнитная мешалка, 24/40 вертикальных шлифов. Резюме Понимание процессов окисления аммиака (NH 3 ) на поверхности CuO, а затем путей образования N 2 и NO x весьма важно для обеспечения благоприятного направления рационального подбора высокоэффективных носителей кислорода на основе меди при химическом петлевом горении. (CLC) и CuO Nh4-содержащие катализаторы в селективном каталитическом восстановлении (СКВ). Тип реакции. капельная воронка, содержащая 150 мл концентрированного раствора аммиака (гидроксида аммония), 24/40 швов матового стекла. ScienceDirect ® является зарегистрированным товарным знаком Elsevier B.V. ScienceDirect ® является зарегистрированным товарным знаком Elsevier B.V. Чтобы сбалансировать химическое уравнение, введите уравнение химической реакции и нажмите кнопку Balance. N2(g) + 3h3O(l) + 3Cu(s) Дополните приведенные ниже утверждения. Наконец, также установлено влияние О2 и Н3О на судьбу азота в ходе гетерогенных реакций. Медь является важным минералом, который играет ключевую роль во многих физиологических процессах, включая ангиогенез, формирование и экспрессию кожи, а также стабилизацию белков кожи. Оксид азота — бесцветный газ, степень окисления азота +2. Нажмите здесь, чтобы получить ответ на свой вопрос ️ В реакции 3CuO + 2Nh4 N2 + 3h3O + 3Cu превращение Nh4 в N2 происходит: б) Назовите восстанавливаемое вещество. Оксид меди(I) или оксид меди – это неорганическое соединение с формулой Cu 2 O. Рассмотрите следующие утверждения и расположите их в порядке истинности/неверности, как указано в кодах. Таким образом, восстанавливающиеся вещества — это CuO. По мере добавления большего количества аммиака нерастворимый Cu(OH)2 будет растворяться с образованием [Cu(Nh4)4]2+. Nh4 + O2 = NO + h3O – Калькулятор химических реакций. Продолжая, вы соглашаетесь на использование файлов cookie.
N2(g) + 3h3O(l) + 3Cu(s) Дополните приведенные ниже утверждения. Наконец, также установлено влияние О2 и Н3О на судьбу азота в ходе гетерогенных реакций. Медь является важным минералом, который играет ключевую роль во многих физиологических процессах, включая ангиогенез, формирование и экспрессию кожи, а также стабилизацию белков кожи. Оксид азота — бесцветный газ, степень окисления азота +2. Нажмите здесь, чтобы получить ответ на свой вопрос ️ В реакции 3CuO + 2Nh4 N2 + 3h3O + 3Cu превращение Nh4 в N2 происходит: б) Назовите восстанавливаемое вещество. Оксид меди(I) или оксид меди – это неорганическое соединение с формулой Cu 2 O. Рассмотрите следующие утверждения и расположите их в порядке истинности/неверности, как указано в кодах. Таким образом, восстанавливающиеся вещества — это CuO. По мере добавления большего количества аммиака нерастворимый Cu(OH)2 будет растворяться с образованием [Cu(Nh4)4]2+. Nh4 + O2 = NO + h3O – Калькулятор химических реакций. Продолжая, вы соглашаетесь на использование файлов cookie. Поэтому Cu(OH)2 ppt растворяется в избытке Nh4(водн.) с образованием темно-синего раствора. Рэнди Салливан, Орегонский университет. Университет прямо отказывается от всех гарантий, включая гарантии товарной пригодности, пригодности для конкретной цели и ненарушения прав интеллектуальной собственности.
Поэтому Cu(OH)2 ppt растворяется в избытке Nh4(водн.) с образованием темно-синего раствора. Рэнди Салливан, Орегонский университет. Университет прямо отказывается от всех гарантий, включая гарантии товарной пригодности, пригодности для конкретной цели и ненарушения прав интеллектуальной собственности.
Xem thêm bài viết thuộc chuyên mục: Giáo Dục
Статьи по теме
Образование комплексных ионов
В главе 4 «Реакции в водном растворе» вы узнали, что ионы металлов в водном растворе гидратированы , то есть окружены оболочкой, состоящей обычно из четырех или шести вод молекулы. Гидратированный ион представляет собой один из видов сложных ионов. Ионные частицы, которые образуются между центральным ионом металла и одним или несколькими окружающими лигандами из-за кислотно-основного взаимодействия Льюиса. Положительно заряженный ион металла действует как кислота Льюиса, а лиганд действует как основание Льюиса. (или просто комплекс ), частица, образующаяся между центральным ионом металла и одним или несколькими окружающими лигандамиИон или молекула, содержащая одну или несколько пар электронов, которые могут быть общими с центральным металлом в комплексе металла. Молекулы или ионы, которые содержат по крайней мере, одна неподеленная пара электронов, такая как ион [Al(H 2 O) 6 ] 3+ на рис. 16.12 «Влияние иона металла на кислотность воды».
Молекулы или ионы, которые содержат по крайней мере, одна неподеленная пара электронов, такая как ион [Al(H 2 O) 6 ] 3+ на рис. 16.12 «Влияние иона металла на кислотность воды».
Комплексный ион образуется из иона металла и лиганда из-за кислотно-основного взаимодействия Льюиса. Положительно заряженный ион металла действует как кислота Льюиса, а лиганд с одной или несколькими неподеленными парами электронов действует как основание Льюиса. Небольшие высокозаряженные ионы металлов, такие как Cu 2+ или Ru 3+ , имеют наибольшую склонность действовать как кислоты Льюиса и, следовательно, имеют наибольшую склонность к образованию комплексных ионов.
В качестве примера образования комплексных ионов рассмотрим добавление аммиака к водному раствору гидратированного иона Cu 2+ {[Cu(H 2 O) 6 ] 2+ }. Поскольку это более сильное основание, чем H 2 O, аммиак замещает молекулы воды в гидратированном ионе с образованием [Cu(NH 3 ) 4 (H 2 O) 2 ] 2+ ион. Формирование комплекса [Cu(NH 3 ) 4 (H 2 O) 2 ] 2+ сопровождается резким изменением цвета, как показано на рис. 17.4 «Формирование комплексных ионов». . Цвет раствора изменяется от светло-голубого [Cu(H 2 O) 6 ] 2+ до сине-фиолетового, характерного для [Cu(NH 3 ) 4 (H 2 O ) 2 ] 2+ ион.
Формирование комплекса [Cu(NH 3 ) 4 (H 2 O) 2 ] 2+ сопровождается резким изменением цвета, как показано на рис. 17.4 «Формирование комплексных ионов». . Цвет раствора изменяется от светло-голубого [Cu(H 2 O) 6 ] 2+ до сине-фиолетового, характерного для [Cu(NH 3 ) 4 (H 2 O ) 2 ] 2+ ион.
Константа образования
Замена молекул воды из [Cu(H 2 O) 6 ] 2+ аммиаком происходит последовательно. Опустив для простоты молекулы воды, связанные с Cu 2+ , мы можем записать равновесные реакции следующим образом: K1[Cu(Nh4)]2+(aq)+Nh4(aq)⇌[Cu(Nh4)2]2+(aq)K2[Cu(Nh4)2]2+(aq)+Nh4(aq)⇌[ Cu(Nh4)3]2+(водн.)K3[Cu(Nh4)3]2+(водн.)+Nh4(водн.)⇌[Cu(Nh4)4]2+(водн.)K4
Сумма ступенчатых реакций представляет собой общее уравнение образования комплексного иона: гидратированный ион Cu 2+ содержит шесть лигандов H 2 O, но образующийся комплексный ион содержит только четыре NH 3 лигандов, а не шесть. Причины этого явно необычного поведения будут обсуждаться в главе 23 «The».
Причины этого явно необычного поведения будут обсуждаться в главе 23 «The».
Уравнение 17.7
Cu2+(водн.)+4Nh4(водн.)⇌[Cu(Nh4)4]2+(водн.)
Константа равновесия образования комплексного иона из гидратированного иона называется константой образования ( K f )Константа равновесия образования комплексного иона из гидратированного иона металла; то есть для реакции aA+bB⇌cC+dD, Kf=[C]c[D]d/[A]a[B]b. Выражение константы равновесия для K f имеет тот же общий вид форма как любое другое выражение константы равновесия. В этом случае выражение выглядит следующим образом:
Уравнение 17.8
Kf=[[Cu(Nh4)4]2+][Cu2+][Nh4]4=2,1×1013=K1K2K3K4
Обратите внимание на закономерность
константа образования ( K f ) имеет ту же общую форму, что и любое другое выражение константы равновесия.
Вода, чистая жидкость, не фигурирует явно в выражении константы равновесия, а гидратированный ион Cu 2+ (водн. ) для простоты представлен как Cu 2+ . Что касается любого равновесия, то чем больше значение константы равновесия (в данном случае К f ), тем более устойчив продукт. С К f = 2,1 × 10 13 комплексный ион [Cu(NH 3 ) 4 (H 2 O) 2 ] 2+ очень стабилен. Константы образования некоторых распространенных комплексных ионов приведены в таблице 17.2 «Константы образования отдельных комплексных ионов в водном растворе*».
) для простоты представлен как Cu 2+ . Что касается любого равновесия, то чем больше значение константы равновесия (в данном случае К f ), тем более устойчив продукт. С К f = 2,1 × 10 13 комплексный ион [Cu(NH 3 ) 4 (H 2 O) 2 ] 2+ очень стабилен. Константы образования некоторых распространенных комплексных ионов приведены в таблице 17.2 «Константы образования отдельных комплексных ионов в водном растворе*».
Таблица 17.2 Константы образования отдельных комплексных ионов в водном растворе*
| Комплексный ион | Уравнение равновесия | К ф | |
|---|---|---|---|
| Аммиачные комплексы | [Ag(NH 3 ) 2 ] + | Ag++2Nh4⇌[Ag(Nh4)2]+ | 1,1 × 10 7 |
| [Cu(NH 3 ) 4 ] 2+ | Cu2++4Nh4⇌[Cu(Nh4)4]2+ | 2,1 × 10 13 | |
| [Ni(NH 3 ) 6 ] 2+ | Ni2++6Nh4⇌[Ni(Nh4)6]2+ | 5,5 × 10 8 | |
| Цианидные комплексы | [Ag(CN) 2 ] − | Ag++2CN-⇌[Ag(CN)2]- | 1,1 × 10 18 |
| [Ni(CN) 4 ] 2− | Ni2++4CN-⇌[Ni(CN)4]2- | 2,2 × 10 31 | |
| [Fe(CN) 6 ] 3− | Fe3++6CN-⇌[Fe(CN)6]3- | 1 × 10 42 | |
| Комплексы гидроксидов | [Zn(OH) 4 ] 2− | Zn2++4OH-⇌[Zn(OH)4]2- | 4,6 × 10 17 |
| [Cr(OH) 4 ] − | Cr3++4OH-⇌[Cr(OH)4]- | 8,0 × 10 29 | |
| Галогенные комплексы | [HgCl 4 ] 2− | Hg2++4Cl-⇌[HgCl4]2- | 1,2 × 10 15 |
| [CdI 4 ] 2− | Cd2++4I⇌[CdI4]2- | 2,6 × 10 5 | |
| [АльФ 6 ] 3− | Al3++6F-⇌[AlF6]3- | 6,9 × 10 19 | |
| Прочие комплексы | [Ag(S 2 O 3 ) 2 ] 3− | Ag++2S2O32-⇌[Ag(S2O3)2]3- | 2,9 × 10 13 |
| [Fe(C 2 O 4 ) 3 ] 3− | Fe3++3C2O42-⇌[Fe(C2O4)3]3- | 2,0 × 10 20 | |
*Указанные значения являются общими константами пласта. | |||
Источник: Данные из Lange’s Handbook of Chemistry , 15-е изд. (1999).
Пример 5
Если 12,5 г Cu(NO 3 ) 2 ·6H 2 O добавить к 500 мл 1,00 М водного аммиака, какова будет равновесная концентрация Cu 18 (aq 90 )?
Дано: масса Cu 2+ соль и объем и концентрация раствора аммиака
Запрашиваемый вопрос: равновесная концентрация Cu 2+ (водный)
Стратегия:
A Рассчитайте начальную концентрацию Cu 2+ за счет добавления гексагидрата нитрата меди(II). Используйте стехиометрию реакции, показанную в уравнении 17.7, чтобы составить таблицу, показывающую начальные концентрации, изменения концентраций и конечные концентрации всех соединений в растворе.
B Подставьте конечные концентрации в выражение для константы образования (уравнение 17. 8), чтобы рассчитать равновесную концентрацию Cu 2+ (водн.).
8), чтобы рассчитать равновесную концентрацию Cu 2+ (водн.).
Решение:
Добавление ионогенного соединения, содержащего Cu 2+ , к водному раствору аммиака приведет к образованию [Cu(NH 3 ) 4 ] 2+ (водн.), как показано в уравнении 17.7. Мы предполагаем, что изменение объема, вызванное добавлением твердого нитрата меди(II) к водному раствору аммиака, незначительно.
A Начальная концентрация Cu 2+ из количества добавленного нитрата меди перед любой реакцией следующая: )(1000 мл1 л)=0,0846 М
Поскольку стехиометрия реакции составляет четыре NH 3 на один Cu 2+ , количество NH 3 , необходимое для полной реакции с Cu 2+ , составляет 4 (0,0846) = 0,338 М. Концентрация аммиака после завершения реакции составляет 1,00 М — 0,338 М = 0,66 М. Эти результаты суммированы в первых двух строках следующей таблицы. Поскольку константа равновесия реакции велика (2,1 × 10 13 ), равновесие будет лежать далеко вправо. Таким образом, будем считать, что образование [Cu(NH 3 ) 4 ] 2+ на первой стадии завершено, и позволяем части его диссоциировать на Cu 2+ и NH 3 до достижения равновесия Был достигнут. Если мы определим x как количество Cu 2+ , полученное в результате реакции диссоциации, то стехиометрия реакции говорит нам, что изменение концентрации [Cu(NH 3 ) 4 ] 2+ равно − х , а изменение концентрации аммиака равно +4 х , как указано в таблице. Конечные концентрации всех видов (в нижней строке таблицы) представляют собой суммы концентраций после завершения реакции и изменения концентраций.
Поскольку константа равновесия реакции велика (2,1 × 10 13 ), равновесие будет лежать далеко вправо. Таким образом, будем считать, что образование [Cu(NH 3 ) 4 ] 2+ на первой стадии завершено, и позволяем части его диссоциировать на Cu 2+ и NH 3 до достижения равновесия Был достигнут. Если мы определим x как количество Cu 2+ , полученное в результате реакции диссоциации, то стехиометрия реакции говорит нам, что изменение концентрации [Cu(NH 3 ) 4 ] 2+ равно − х , а изменение концентрации аммиака равно +4 х , как указано в таблице. Конечные концентрации всех видов (в нижней строке таблицы) представляют собой суммы концентраций после завершения реакции и изменения концентраций.
| Cu2++4Nh4⇌[Cu(Nh4)4]2+ | |||
|---|---|---|---|
| [Cu 2+ ] | [НХ 3 ] | [[Cu(NH 3 ) 4 ] 2+ ] | |
| начальный | 0,0846 | 1,00 | 0 |
| после полной реакции | 0 | 0,66 | 0,0846 |
| смена | + х | +4 х | − х |
| окончательная | х | 0,66 + 4 х | 0,0846 − х |
B Подставляя окончательные концентрации в выражение для константы образования (уравнение 17. 6 =[[Cu(Nh4)4]2+][Cu2+][Nh4]4=0,0846−xx(0,66+4x)4≈0,0846x(0,66)4=2,1×1013x=2,1×10−14 Значение x указывает на то, что наше предположение оправдалось. Таким образом, равновесная концентрация Cu 2+ (водн.) в 1,00 М растворе аммиака составляет 2,1 × 10 −14 М. Упражнение Ион ферроцианида } очень стабилен, с K f 1 × 10 35 . Рассчитайте концентрацию цианид-иона в равновесии с 0,65 М раствором K 4 [Fe(CN) 6 ]. Ответ: 2 × 10 −6 M Что происходит с растворимостью малорастворимой соли, если к решение? Одним из таких примеров является обычная черно-белая фотография, которая кратко обсуждалась в главе 4 «Реакции в водном растворе». Напомним, что черно-белая фотопленка содержит светочувствительные микрокристаллы AgBr или смеси AgBr и других галогенидов серебра. Реакция растворения бромида серебра следующая: Уравнение 17.9 AgBr(s)⇌Ag+(водн.)+Br-(водн.)Ksp=5,35×10-13 при 25°C Равновесие лежит далеко левее, а равновесные концентрации ионов Ag + и Br — очень малы (7,31 · 10 -7 М). Реакция Ag + с тиосульфатом следующая: Величина константы равновесия указывает на то, что почти все ионы Ag + в растворе будут немедленно образовывать комплексы с тиосульфатом с образованием [Ag(S 2 О 3 ) 2 ] 3− . Мы можем увидеть влияние тиосульфата на растворимость AgBr, написав соответствующие реакции и сложив их вместе: (водн. Сравнение K с K sp показывает, что образование комплексного иона увеличивает растворимость AgBr примерно в 3 × 10 13 . Значительное увеличение растворимости в сочетании с низкой стоимостью и низкой токсичностью объясняет, почему тиосульфат натрия почти повсеместно используется для проявления черно-белой пленки. При желании серебро может быть извлечено из раствора тиосульфата любым из нескольких способов и использовано повторно. Если комплексный ион имеет большое значение K f , образование комплексного иона может значительно повысить растворимость малорастворимых солей. Из-за общего ионного эффекта можно ожидать, что такая соль, как AgCl, будет гораздо менее растворима в концентрированном растворе KCl, чем в воде. Однако такое предположение было бы неверным, поскольку оно игнорирует тот факт, что ион серебра имеет тенденцию образовывать двухкоординационный комплекс с ионами хлора (AgCl 2 — ). при 25 ° C, K SP = 1,77 × 10 −10 для AGCL и K F = 1,1 × 10 5 для AGCL 2 − . Дано: К sp AgCl, K f AgCl 2 − и концентрация KCl Запрашиваемый вопрос: растворимость AgCl в воде и образование комплекса 9O3 с ионами 1 в KCl Стратегия: A Напишите выражение произведения растворимости AgCl и рассчитайте концентрацию Ag + и Cl − в воде. B Рассчитайте концентрацию Ag + в растворе KCl. C Напишите сбалансированные химические уравнения для растворения AgCl и образования комплекса AgCl 2 − . Сложите два уравнения и рассчитайте константу равновесия для общего равновесия. D Напишите выражение константы равновесия для общей реакции. Найдите концентрацию комплексного иона. Решение: A Если принять x равным растворимости AgCl, то в равновесии [Ag + ] = [Cl — ] = x М. Подставив это значение в выражение произведения растворимости, Таким образом, растворимость AgCl в чистой воде при 25°C составляет 1,33×10 −5 М. B Если x равно растворимости AgCl в растворе KCl, то в равновесии [Ag + ] = x M и [Cl — ] = (1,0 + x 92,216 замещения) эти значения в выражение произведения растворимости и предполагая, что x << 1,0, Если бы общий ионный эффект был единственным важным фактором, мы бы предсказали, что AgCl примерно на пять порядков менее растворим в 1,0 М растворе KCl, чем в воде. C Чтобы учесть эффекты образования сложных ионов, мы должны сначала написать уравнения равновесия как для растворения, так и для образования сложных ионов. Добавление уравнений, соответствующих K sp и K f дает нам уравнение, описывающее растворение AgCl в растворе KCl. D Если принять x равным растворимости AgCl в растворе KCl, то при равновесии [AgCl 2 — ] = x и [Cl — ] = 1,0 — x . Подставив эти величины в выражение константы равновесия для чистой реакции и предполагая, что x << 1,0, То есть AgCl растворяется в 1,0 М KCl с образованием 1,9×10 -5 М раствора AgCl 2 − комплексный ион. Таким образом, мы предсказываем, что AgCl имеет примерно такую же растворимость в 1,0 М растворе KCl, как и в чистой воде, которая составляет 10 5 раз больше, чем предсказано на основе эффекта общего иона. Упражнение Рассчитайте растворимость йодида ртути(II) (HgI 2 ) в каждой ситуации: K SP = 2,9 × 10 −29 для HGI 2 и K F = 6,8 × 10 29 для [HGI 4 ] 2 2 2. Ответ: Комплексообразователи , молекулы или ионы, которые увеличивают растворимость солей металлов за счет образования растворимых комплексов металлов, являются обычными компонентами моющих средств для стирки. Уравнение 17.12 , фосфаты могут нанести ущерб окружающей среде, способствуя эвтрофикации , рост чрезмерного количества водорослей в водоеме, что в конечном итоге может привести к значительному снижению уровня растворенного кислорода, что приводит к гибели рыб и других водных организмов. Следовательно, во многих штатах США запрещено использование фосфатсодержащих моющих средств, а Франция запретила их использование с 2007 г. Коммерческие умягчители воды также используют комплексообразователь для обработки жесткой воды путем пропускания воды через ионообменные смолы, которые представляют собой комплексные соли натрия. При обтекании смолы водой ион натрия растворяется, и нерастворимые соли оседают на поверхности смолы. Вода, обработанная таким образом, имеет более соленый вкус из-за присутствия Na + , но содержит меньше растворенных минералов. Другое применение комплексообразователей встречается в медицине. В отличие от рентгеновских лучей, магнитно-резонансная томография (МРТ) может дать относительно хорошие изображения мягких тканей, таких как внутренние органы. МРТ основана на магнитных свойствах 1 H ядра атомов водорода в воде, которая является основным компонентом мягких тканей. Рис. 17.5 МРТ-изображение сердца, артерий и вен Когда пациенту вводят парамагнитный катион металла в виде стабильного комплекса, известного как контрастное вещество для МРТ, магнитные свойства воды в клетках изменяются. . Поскольку разные среды в разных типах клеток реагируют по-разному, врач может получить подробные изображения мягких тканей. Комплексный ион представляет собой частицу, образованную между центральным ионом металла и одним или несколькими окружающими лигандами , молекулами или ионами, которые содержат по крайней мере одну неподеленную пару электронов. Небольшие высокозаряженные ионы металлов имеют наибольшую склонность действовать как кислоты Льюиса и образовывать комплексные ионы. Константа равновесия для образования комплексного иона представляет собой константу образования ( K f ) . Образование комплексного иона при добавлении комплексообразователь повышает растворимость соединения. В чем разница между K eq и K f ? Что, по вашему мнению, будет иметь большую склонность к образованию комплексного иона: Mg 2+ или Ba 2+ ? Почему? Как можно использовать лиганд для воздействия на концентрацию гидратированных ионов металлов в растворе? Как это влияет на K sp ? Поясните свой ответ. Co(II) образует комплексный ион с пиридином (C 5 Н 5 Н). Какая кислота Льюиса, а какая основание Льюиса? Используйте электронные структуры Льюиса, чтобы обосновать свой ответ. Fe(II) образует комплексный ион [Fe(OH) 4 ] 2− посредством равновесных реакций, в которых гидроксид постепенно заменяет воду. Если log K 1 = 5,56, log K 2 = 4,21, log К 3 = -0,10 и log К 4 = -1,09, чему равно К f ? Напишите уравнение равновесия, соответствующее каждой ступенчатой константе равновесия. Ожидаете ли вы, что комплекс [Fe(OH) 4 ] 2– будет стабильным? Объясните свои рассуждения. Zn(II) образует комплексный ион [Zn(NH 3 ) 4 ] 2+ посредством равновесных реакций, в которых аммиак ступенчато замещает координированные молекулы воды. Если лог K 1 = 2,37, log K 2 = 2,44, log K 3 = 2,50, и log K 4 = 2,15, что является в целом K  8) и принимая, что x << 0,0846, что позволяет нам удалить x из суммы и разности, 1 Kf
8) и принимая, что x << 0,0846, что позволяет нам удалить x из суммы и разности, 1 Kf Влияние образования комплексных ионов на растворимость
 AgBr — малорастворимая соль с K sp 5,35 × 10 −13 при 25°C. Когда затвор камеры открывается, свет от фотографируемого объекта попадает на некоторые кристаллы на пленке и инициирует фотохимическую реакцию, которая превращает AgBr в черный металлический Ag. Хорошо сформированные, стабильные негативные изображения появляются в оттенках серого, соответствующих количеству преобразованных зерен AgBr, причем области, подвергающиеся наибольшему воздействию света, являются самыми темными. Чтобы зафиксировать изображение и предотвратить превращение большего количества кристаллов AgBr в металл Ag во время обработки пленки, непрореагировавший AgBr на пленке удаляется с помощью реакции комплексообразования для растворения труднорастворимой соли.
AgBr — малорастворимая соль с K sp 5,35 × 10 −13 при 25°C. Когда затвор камеры открывается, свет от фотографируемого объекта попадает на некоторые кристаллы на пленке и инициирует фотохимическую реакцию, которая превращает AgBr в черный металлический Ag. Хорошо сформированные, стабильные негативные изображения появляются в оттенках серого, соответствующих количеству преобразованных зерен AgBr, причем области, подвергающиеся наибольшему воздействию света, являются самыми темными. Чтобы зафиксировать изображение и предотвратить превращение большего количества кристаллов AgBr в металл Ag во время обработки пленки, непрореагировавший AgBr на пленке удаляется с помощью реакции комплексообразования для растворения труднорастворимой соли. В результате для удаления непрореагировавшего AgBr даже с одного рулона пленки с помощью чистой воды потребуются десятки тысяч литров воды и много времени. Однако принцип Ле Шателье говорит нам, что мы можем направить реакцию вправо, удалив один из продуктов, что приведет к растворению большего количества AgBr. Ион брома трудно удалить химически, но ион серебра образует различные стабильные двухкоординационные комплексы с нейтральными лигандами, такими как аммиак, или с анионными лигандами, такими как цианид или тиосульфат (S 2 O 3 2− ). При фотообработке избыток AgBr растворяют с помощью концентрированного раствора тиосульфата натрия.
В результате для удаления непрореагировавшего AgBr даже с одного рулона пленки с помощью чистой воды потребуются десятки тысяч литров воды и много времени. Однако принцип Ле Шателье говорит нам, что мы можем направить реакцию вправо, удалив один из продуктов, что приведет к растворению большего количества AgBr. Ион брома трудно удалить химически, но ион серебра образует различные стабильные двухкоординационные комплексы с нейтральными лигандами, такими как аммиак, или с анионными лигандами, такими как цианид или тиосульфат (S 2 O 3 2− ). При фотообработке избыток AgBr растворяют с помощью концентрированного раствора тиосульфата натрия. )+2S2O32-(водн.)⇌[Ag(S2O3)2]3-(водн.)Kf=2,9×1013AgBr(s)+2S2O32-(водн.)⇌[Ag(S2O3)2]3-(водн.)+ Br-(aq)K=KspKf=15
)+2S2O32-(водн.)⇌[Ag(S2O3)2]3-(водн.)Kf=2,9×1013AgBr(s)+2S2O32-(водн.)⇌[Ag(S2O3)2]3-(водн.)+ Br-(aq)K=KspKf=15 Обратите внимание на образец
Пример 6
 Рассчитайте растворимость AgCl в каждой ситуации:
Рассчитайте растворимость AgCl в каждой ситуации:

 Таким образом, константа равновесия реакции представляет собой произведение K sp и K f :
Таким образом, константа равновесия реакции представляет собой произведение K sp и K f : (На самом деле, измеренная растворимость AgCl в 1,0 М KCl почти в 10 раз больше, чем в чистой воде, в основном из-за образования других хлоридсодержащих комплексов.)
(На самом деле, измеренная растворимость AgCl в 1,0 М KCl почти в 10 раз больше, чем в чистой воде, в основном из-за образования других хлоридсодержащих комплексов.) Длинноцепочечные карбоновые кислоты, основные компоненты мыл, образуют нерастворимые соли с Ca 2+ и Mg 2+ , которые присутствуют в высоких концентрациях в «жесткой» воде. Осаждение этих солей создает кольцо в ванне и придает одежде серый оттенок. Добавление комплексообразователя, такого как пирофосфат (O 3 Popo 3 4–, или P 2 O 7 4–) или трихосфат (P 3 O 10 5–) Детрожни. от осаждения из-за большой константы равновесия для образования комплексных ионов:
Длинноцепочечные карбоновые кислоты, основные компоненты мыл, образуют нерастворимые соли с Ca 2+ и Mg 2+ , которые присутствуют в высоких концентрациях в «жесткой» воде. Осаждение этих солей создает кольцо в ванне и придает одежде серый оттенок. Добавление комплексообразователя, такого как пирофосфат (O 3 Popo 3 4–, или P 2 O 7 4–) или трихосфат (P 3 O 10 5–) Детрожни. от осаждения из-за большой константы равновесия для образования комплексных ионов: «Бесфосфатные» моющие средства содержат различные виды комплексообразователей, такие как производные уксусной кислоты или других карбоновых кислот. кислоты. Разработка заменителей фосфатов является областью интенсивных исследований.
«Бесфосфатные» моющие средства содержат различные виды комплексообразователей, такие как производные уксусной кислоты или других карбоновых кислот. кислоты. Разработка заменителей фосфатов является областью интенсивных исследований. Поскольку свойства воды не сильно зависят от того, находится ли она внутри клетки или в крови, трудно получить подробные изображения этих тканей с хорошим контрастом. Чтобы решить эту проблему, ученые разработали класс комплексов металлов, известных как «контрастные агенты для МРТ». Введение пациенту МРТ-контрастного вещества избирательно влияет на магнитные свойства воды в клетках нормальных тканей, в опухолях или в кровеносных сосудах и позволяет врачам «увидеть» каждый из них в отдельности (рис. 17.5 «МРТ-изображение сердца, Артерии и вены»). Одним из наиболее важных ионов металлов для этого применения является Gd 9.0017 3+ , который с семью неспаренными электронами является сильно парамагнитным. Поскольку Gd 3+ (водн.) весьма токсичен, его следует вводить в виде очень стабильного комплекса, который не диссоциирует в организме и может выводиться почками в неизменном виде. Комплексообразующие агенты, используемые для гадолиния, представляют собой лиганды, такие как DTPA 5- (диэтилентриаминпентауксусная кислота), чья полностью протонированная форма показана здесь.
Поскольку свойства воды не сильно зависят от того, находится ли она внутри клетки или в крови, трудно получить подробные изображения этих тканей с хорошим контрастом. Чтобы решить эту проблему, ученые разработали класс комплексов металлов, известных как «контрастные агенты для МРТ». Введение пациенту МРТ-контрастного вещества избирательно влияет на магнитные свойства воды в клетках нормальных тканей, в опухолях или в кровеносных сосудах и позволяет врачам «увидеть» каждый из них в отдельности (рис. 17.5 «МРТ-изображение сердца, Артерии и вены»). Одним из наиболее важных ионов металлов для этого применения является Gd 9.0017 3+ , который с семью неспаренными электронами является сильно парамагнитным. Поскольку Gd 3+ (водн.) весьма токсичен, его следует вводить в виде очень стабильного комплекса, который не диссоциирует в организме и может выводиться почками в неизменном виде. Комплексообразующие агенты, используемые для гадолиния, представляют собой лиганды, такие как DTPA 5- (диэтилентриаминпентауксусная кислота), чья полностью протонированная форма показана здесь.
Резюме

Key Takeaway
Концептуальные проблемы

Численные задачи
669 40006 = 2,15, что является в целом K 40006 = 2,15, что является K 40006 = 2,15, что является K 40006 = 2,15. ? Напишите уравнение равновесия, соответствующее каждой ступенчатой константе равновесия. Ожидаете ли вы, что комплекс [Zn(NH 3 ) 4 ] 2+ будет стабильным? Объясните свои рассуждения.
? Напишите уравнение равновесия, соответствующее каждой ступенчатой константе равновесия. Ожидаете ли вы, что комплекс [Zn(NH 3 ) 4 ] 2+ будет стабильным? Объясните свои рассуждения.
Хотя таллий имеет ограниченное коммерческое применение, поскольку он токсичен для человека (10 мг/кг массы тела смертельны для детей), он используется в качестве заменителя ртути в промышленных переключателях. Комплексный ион [TlBr 6 ] 3– очень стабилен, с log K f = 31,6. Какова концентрация Tl(III)(водн.) в равновесии с 1,12 М раствором Na 3 [TlBr 6 ]?
Ответ
[Fe(h3O)6]2+(водн.)+OH−(водн.)⇌[Fe(h3O(водн.))5(OH)]+(водн.)+h3OlogK1=5,56[Fe(h3O)5( OH)]+(водн.)+OH-(водн.)⇌[Fe(h3O)4(OH)2](водн.
 )+h3O(водн.)logK2=9,77[Fe(h3O)4(OH)2](водн.) +OH-(водн.)⇌[Fe(h3O)3(OH)3]-(водн.)+h3O(водн.)logK3=9,67[Fe(h3O)3(OH)3]-(водн.)+OH-(водн. )⇌[Fe(OH)4]2-(водн.)+3h3O(ж)lgK4=8,58[Fe(h3O)6]2+(водн.)+4OH-(водн.)⇌[Fe(OH)4]2- (aq)+6h3O(l)logKf= logK1+logK2+logK2+logK4= 33,58
)+h3O(водн.)logK2=9,77[Fe(h3O)4(OH)2](водн.) +OH-(водн.)⇌[Fe(h3O)3(OH)3]-(водн.)+h3O(водн.)logK3=9,67[Fe(h3O)3(OH)3]-(водн.)+OH-(водн. )⇌[Fe(OH)4]2-(водн.)+3h3O(ж)lgK4=8,58[Fe(h3O)6]2+(водн.)+4OH-(водн.)⇌[Fe(OH)4]2- (aq)+6h3O(l)logKf= logK1+logK2+logK2+logK4= 33,58Таким образом, K f = 3,8 × 10 33 . Потому что [Fe(OH) 4 ] 2− имеет очень большое значение K f , оно должно быть стабильным в присутствии избытка OH − .
Топ 19 nh4 + cuo → cu + n2 + h3o сбалансированный en iyi 2022
İşte konuyla ilgili bilgiler ve bilgiler nh4 + cuo → cu + n2 + h3o сбалансированный en iyileri kendi ekibimiz tarafından derlenip:
40031
CuHNO3=Cu(NO3)2NOh3O.
 Сбалансируйте химическое уравнение методом числа окисления.
Сбалансируйте химическое уравнение методом числа окисления.Язар: Мой документальный фильм
Видео yükleme tarihi: 31.07.2022
Горюш : 186661
Видео çözünürlüğü : 1080p
Дегерлендирмек: 5 ⭐ ( 46877 ойлар )
Эн Чок Ой Алан: 5 ⭐
Телефон для справок: 5 ⭐
Язар: en.intl.chemicalaid.com
Илетилен Тарих: 02.09.2021
Гёрюнтюлеме сайыси: 78254
Değerlendirme: 1 ⭐ ( 61408 oylar )
En yüksek puan: 5 ⭐
Количество номеров: 4 ⭐
Özet: Nh4 + CuO = N2 + Cu + h3O — Калькулятор химических реакций.
 güncelleniyor…
güncelleniyor…Arama sonuçlarını eşleştirin: Сбалансируйте реакцию Nh4 + CuO = N2 + Cu + h3O, используя этот балансировщик химических уравнений! Химическая помощь. Химическая помощь; ЗептоМатематика; Элементы. … 2 NH 3 + 3 CuO → N 2 + 3 Cu + 3 H 2 O. Информация о реакции Отказ от ответственности. … Сбалансируйте уравнение Nh4 + CuO = N2 + Cu + h3O, используя алгебраический метод. Пометьте каждое соединение переменной….
Makaleye bağlantı: https://chatthatt.com/post-detail/nh4—cuo—n2—cu—h3o—chemical-equation-balancer/220628200
Язар: www.youtube.com
Илетилен Тарих: 06.05.2021
Гёрюнтюлеме сайыси: 52778
Değerlendirme: 1 ⭐ ( 61466 oylar )
En yüksek puan: 5 ⭐
Телефон для справок: 5 ⭐
Özet: Как сбалансировать Nh4 + CuO = Cu + N2 + h3O — YouTube.
 güncelleniyor…
güncelleniyor…Arama sonuçlarını eşleştirin: 02 мая 2020 г. · В этом видео мы сбалансируем уравнение Nh4 + CuO = Cu + N2 + h3O и предоставим правильные коэффициенты для каждого соединения. Чтобы сбалансировать Nh4 + CuO = Cu + N2 + h3……
Makaleye bağlantı: https://chatthatt.com/post-detail/how-to-balance-nh4—cuo—cu—n2—h3o—youtube/220628201
Как сбалансировать Nh4 + CuO = Cu + N2 + h3O
Язар: Уэйн Бреслин
Видео yükleme tarihi: 31.07.2022
Горюш : 217609
Видео çözünürlüğü : 1080p
Değerlendirmek: 5 ⭐ ( 15718 oylar )
En Çok Oy Алан: 5 ⭐
Телефон для справок: 5 ⭐
Язар: www.
 toppr.com
toppr.comИлетилен Тарих: 16.08.2021
Гёрюнтюлеме сайыси: 59494
Değerlendirme: 3 ⭐ ( 43157 oylar )
En yüksek puan: 5 ⭐
Телефон для справок: 3 ⭐
Özet: Hakkında makaleler Полное сбалансированное уравнение: CuO + Nh4 → Cu. güncelleniyor…
Arama sonuçlarını esleştirin: CuO+NH3→Cu+N2+H2O. Сбалансируйте все атомы, кроме H и O. CuO+2NH 3 → Cu+N 2+H 2O. Степень окисления Cu изменяется от 2 до 0. Изменение степени окисления Cu равно 2. Степень окисления N изменяется от -3 до 0. Изменение степени окисления одного атома N равно 3. Для 2 N атомов, общее изменение составляет 6….
Makaleye bağlantı: https://chatthatt.com/post-detail/the-complete-balanced-equation-is-cuo—nh4—cu/220628202
Язар: byjus.
 com
comИлетилен Тарих: 26.02.2021
Гёрюнтюлеме сайыси: 56888
Değerlendirme: 2 ⭐ ( 95819 oylar )
En yüksek puan: 5 ⭐
Телефон для справок: 3 ⭐
Özet: Напишите полное уравнение CuO + Nh4→Cu + N2 + h3O.
Arama sonuçlarını eşleştirin: Jan 06, 2021 · H. 6. 2. Теперь для уравновешивания остальных атомов мы сделаем коэффициент CuO, Cu и H 2 O равным 3. Уравнение примет вид: 3 CuO Медь (II) оксид + 2 NH 3 Аммиак → 3 Cu Медь + N 2 Азот + 3 H 2 O Вода. Элемент. Реактивная сторона. Сторона продукта….
Makaleye bağlantı: https://chatthatt.com/post-detail/write-the-complete-balanced-equation-of-cuo—nh4cu-/220628203
Как сбалансировать Cu HNO3 = Cu(NO3)2 NO2 h3O (концентрированная HNO3)
Язар: Уэйн Бреслин
Видео yükleme tarihi: 31.
 07.2022
07.2022Горюш : 683693
Видео çözünürlüğü : 1080p
Değerlendirmek: 3 ⭐ ( 58936 oylar )
En Çok Oy Алан: 5 ⭐
Бесплатный звонок: 2 ⭐
Язар: chemicalequationbalance.com
Илетилен Тарих: 02.01.2021
Гёрюнтюлеме сайыси: 32063
Degerlendirme: 2 ⭐ ( 57633 ойлар )
En yüksek puan: 5 ⭐
Телефон для справок: 4 ⭐
Özet: Калькулятор химических реакций | Химические инструменты
Arama sonuçlarını eşleştirin: Сбалансированное уравнение химической реакции с реагентами cuo (оксид меди(ii)) nh4 (аммиак) и продуктами cu (медь) h3o (вода) n2 (азот) | .
 Явление: Выделяется газ… CuO Nh4 = Cu h3O N2 | Калькулятор химических реакций аммиак = азот. Новости Только 5% НАСЕЛЕНИЯ будут знать. … 2 → 2CuO + 4NO 2 + O 2 2Cu 2 O → 4CuO + O 2 2O 2 + Cu ……
Явление: Выделяется газ… CuO Nh4 = Cu h3O N2 | Калькулятор химических реакций аммиак = азот. Новости Только 5% НАСЕЛЕНИЯ будут знать. … 2 → 2CuO + 4NO 2 + O 2 2Cu 2 O → 4CuO + O 2 2O 2 + Cu ……Makaleye bağlantı: https://chatthatt.com/post-detail/cuo-nh4—cu-h3o-n2—chemical-equation-balance/220628204
Язар: chemicalequationbalance.com
Илетилен Тарих: 17.06.2021
Гёрюнтюлеме сайыси: 70931
Değerlendirme: 2 ⭐ ( 1025 oylar )
En yüksek puan: 5 ⭐
Телефон для справок: 4 ⭐
Özet: Калькулятор химических реакций | Химические инструменты
Arama sonuçlarını eşleştirin: Nh4 проходит через нагретый CuO. В полном предложении вы также можете сказать, что CuO (оксид меди (ii)) реагирует с Nh4 (аммиак) и производит Cu (медь) и h3O (вода) и N2 (азот).
 Явление после реакции CuO (оксида меди (ii)). с Nh4 (аммиак) Нажмите, чтобы увидеть феномен уравнения Какую еще важную информацию вы должны знать о реакции…
Явление после реакции CuO (оксида меди (ii)). с Nh4 (аммиак) Нажмите, чтобы увидеть феномен уравнения Какую еще важную информацию вы должны знать о реакции…Makaleye bağlantı: https://chatthatt.com/post-detail/cuo—nh4—cu—h3o—n2—balanced—chemical-/220628205
Язар: www.toppr.com
Илетилен Тарих: 19.04.2021
Гёрюнтюлеме сайыси: 32433
Değerlendirme: 1 ⭐ ( 4264 oylar )
En yüksek puan: 5 ⭐
Телефон для справок: 1 ⭐
Özet: Hakkında makaleler Полное сбалансированное уравнение: CuO + Nh4 → Cu. güncelleniyor…
Arama sonuçlarını eşleştirin: Нажмите здесь👆, чтобы получить ответ на свой вопрос ️ Полное сбалансированное уравнение: CuO + Nh4 → Cu + N2 + h3O.
 ..
..Makaleye bağlantı: https://chatthatt.com/post-detail/the-complete-balanced-equation-is-cuo—nh4—cu/220628206
Язар: www.youtube.com
Илетилен Тарих: 17.03.2021
Гёрюнтюлеме сайыси: 3365
Değerlendirme: 1 ⭐ ( 54204 oylar )
En yüksek puan: 5 ⭐
Телефон для справок: 5 ⭐
Özet: Hakkında makaleler Метод числа окисления. CuO+Nh4=Cu+N2+h3O.. güncelleniyor…
Arama sonuçlarını eşleştirin: Aug 06, 2020 · Как сбалансировать химическое уравнение с помощью числового метода окисления?CuO+Nh4=Cu+N2+h3Ocuo+nh4=cu+n2+h3oCu+N2+h3O=CuO+Nh4cu+ n2+h3o=cuo+nh4 Метод числа окисления. ……
Makaleye bağlantı: https://chatthatt.
 com/post-detail/oxidation-number-method-cuonh4cun2h3o/220628207
com/post-detail/oxidation-number-method-cuonh4cun2h3o/220628207
Язар: brainly.in
Илетилен Тарих: 16.07.2021
Гёрюнтюлеме сайыси: 98575
Değerlendirme: 2 ⭐ ( 14905 oylar )
En yüksek puan: 5 ⭐
Телефон для справок: 3 ⭐
Özet: Hakkında makaleler Nh4 + CuO = CU + N2 + h3O уравновешивают это уравнение. güncelleniyor…
Arama sonuçlarını eşleştirin: 03 февраля 2017 г. · Ответ: Сбалансированное уравнение: 2 Nh4 + 3 CUO = N2 + 3 CU + 3 h3O. Стехиометрия реакции Лимитирующий реагент. № соединения Молярная масса Nh4 2 ……
Makaleye bağlantı: https://chatthatt.com/post-detail/nh4—cuo—cu—n2—h3o-balance-this-equation/220628208
Язар: www.
 jiskha.com
jiskha.comИлетилен Тарих: 24/03/2021
Гёрюнтюлеме сайыси: 45555
Değerlendirme: 5 ⭐ ( 96432 oylar )
En yüksek puan: 5 ⭐
Телефон для справок: 4 ⭐
Özet: Как сбалансировать уравнение Nh4 + CuO > Cu + h3O + N2
Arama sonuçlarını eşleştirin: 15 апреля 2011 г. · при воспламенении mgnh5po4*6h3o образуются nh4, h3o и пирофосфат магния, Mg2P2O7. составить и сбалансировать уравнение этой реакции. Если поджечь 5,00 г MgNh5PO4*6h3O, сколько граммов Mg2P2O7 образуется? Химия. Nh4+Cuo=N2+Cu+h3O, 18,1 г nh4 и 90,4 г CuO заставили вступить в реакцию. (а). Определите лимитирующий реагент. (б)….
Makaleye bağlantı: https://chatthatt.com/post-detail/how-do-you-balance-the-equation-nh4—cuo—cu—h3o-/220628209
Язар: www.
 webqc.org
webqc.orgИлетилен Тарих: 19.08.2021
Гёрюнтюлеме сайыси: 48802
Değerlendirme: 3 ⭐ ( 61401 oylar )
En yüksek puan: 5 ⭐
Телефон для справок: 4 ⭐
Özet: Balance Chemical Equation — Online Balancer
Arama sonuçlarını eşleştirin: Ограничивающий ряд реагентов будет выделен розовым цветом. Примеры полных химических уравнений для баланса: Fe + Cl 2 = FeCl 3. KMnO 4 + HCl = KCl + MnCl 2 + H 2 O + Cl 2. K 4 Fe (CN) 6 + H 2 SO 4 + H 2 O = K 2 SO 4 + FeSO 4 + (NH 4) 2 SO 4 + CO. C 6 H 5 COOH + O 2 = CO 2 + H 2 O….
Makaleye bağlantı: https://chatthatt.com/post-detail/balance-chemical-equation—online-balancer—webqc/220628210
Язар: www.
 chegg.com
chegg.comИлетилен Тарих: 24.03.2021
Гёрюнтюлеме сайыси: 24224
Değerlendirme: 1 ⭐ ( 34457 oylar )
En yüksek puan: 5 ⭐
Телефон для справок: 1 ⭐
Özet: Hakkında makaleler Решенный #1. Сбалансируйте уравнение: Nh4 + CuO ——> Cu — Чегг. güncelleniyor…
Arama sonuçlarını eşleştirin: Ответ на решенный #1. Сбалансируйте уравнение: Nh4 + CuO ——> Cu + Эта проблема решена! Посмотреть ответ Посмотреть ответ Посмотреть ответ done loading…
Makaleye bağlantı: https://chatthatt.com/post-detail/solved-1-balance-the-equation-nh4—cuo——-cu—chegg/220628211
Язар: brainly.in
Илетилен Тарих: 07.
 11.2021
11.2021Гёрюнтюлеме сайыси: 56394
Değerlendirme: 5 ⭐ ( 71302 oylar )
En yüksek puan: 5 ⭐
Бесплатный звонок: 2 ⭐
Özet: Hakkında makaleler Сбалансировано ли уравнение Nh4 + CuO —— Cu + N2 + h3O — Brainly.in. güncelleniyor…
Arama sonuçlarını eşleştirin: 09 апреля 2018 г. · Сбалансировано ли уравнение Nh4 + CuO —— Cu + N2 + h3O Получите ответы, которые вам нужны, прямо сейчас! krishnanshu2073 krishnanshu2073 09.04.2018 Химия … →1s2, 2s1 B →1s2, 2s2 2p1 C →1s2, 2s2 2p6, 3s1 D →(1) и (3) оба Какие ионы образованы атомами, имеющими 5 до 7 электронов в их валентной оболочке?…
Makaleye bağlantı: https://chatthatt.com/post-detail/is-the-equation-nh4—cuo——-cu—n2—h3o-balanced—brainlyin/ 220628212
Язар: chemiday.
 com
comИлетилен Тарих: 17.03.2021
Гёрюнтюлеме сайыси: 47538
Değerlendirme: 1 ⭐ ( 71430 oylar )
En yüksek puan: 5 ⭐
Бесплатный звонок: 2 ⭐
Özet: Hakkında makaleler Nh4 + CuO = N2 + Cu + h3O | Уравновешивание химических уравнений. güncelleniyor…
Arama sonuçlarını eşleştirin: Реакция взаимодействия аммиака и оксида меди с образованием азота, меди и воды. Химическая реакция. Балансирующие химические уравнения….
Макалейе Багланты: https://chatthatt.com/post-detail/nh4—cuo—n2—cu—h3o—balancing-chemical-equations/220628213
Язар: www.shaalaa.com
Илетилен Тарих: 19.02.2021
Гёрюнтюлеме сайыси: 15105
Değerlendirme: 5 ⭐ ( 32604 oylar )
En yüksek puan: 5 ⭐
En düşük puan: 2 ⭐
Özet: Сбалансируйте следующее важное уравнение: Nh4 + CuO → Cu + h3O + N2
Arama sonuçlarını eşleştirin: Сбалансируйте следующее важное уравнение: Nh4 + CuO → Cu + h3O + N2.
 CISCE ICSE Класс 9. Контрольные работы 10. Решения из учебника 19258. Важные решения 15. Банк вопросов … Сбалансируйте следующее важное уравнение: NH 3 + CuO → Cu + H 2 O + N 2 . Реклама Удалить все объявления. Решение Показать решение….
CISCE ICSE Класс 9. Контрольные работы 10. Решения из учебника 19258. Важные решения 15. Банк вопросов … Сбалансируйте следующее важное уравнение: NH 3 + CuO → Cu + H 2 O + N 2 . Реклама Удалить все объявления. Решение Показать решение….Makaleye bağlantı: https://chatthatt.com/post-detail/balance-the-following-important-equation-nh4—cuo—cu/220628214
Язар: www.sarthaks.com
Илетилен Тарих: 04.07.2021
Гёрюнтюлеме сайыси: 37410
Değerlendirme: 3 ⭐ ( 67389 oylar )
En yüksek puan: 5 ⭐
Телефон для справок: 1 ⭐
Özet: Сбалансируйте следующую реакцию методом степени окисления. CuO + Nh4 → Cu + N2 + h3O
Arama sonuçlarını eşleştirin: Шаг 1: Напишите уравнение скелета и сбалансируйте элементы, кроме O и H.
 CuO + 2NH 3 → Cu + N 2 + H 2 O. Шаг 2: Присвойте Cu и N степени окисления. увеличение и уменьшение степени окисления и сделать их равными. Чтобы сделать чистые приращение и убывание равными, мы должны взять 3 атома Cu и 2 атома N. (Уже есть 2 атома N.)…
CuO + 2NH 3 → Cu + N 2 + H 2 O. Шаг 2: Присвойте Cu и N степени окисления. увеличение и уменьшение степени окисления и сделать их равными. Чтобы сделать чистые приращение и убывание равными, мы должны взять 3 атома Cu и 2 атома N. (Уже есть 2 атома N.)…Makaleye bağlantı: https://chatthatt.com/post-detail/balance-the-following-reaction-by-oxidation-number-method-cuo-/220628215
Язар: www.jiskha.com
Илетилен Тарих: 25.03.2021
Гёрюнтюлеме сайыси: 38087
Değerlendirme: 4 ⭐ ( 13792 oylar )
En yüksek puan: 5 ⭐
Телефон для справок: 1 ⭐
Özet: Hakkında makaleler Как сбалансировать уравнение Nh4 + CuO > Cu + h3O + N2. güncelleniyor…
Arama sonuçlarını eşleştirin: химия.
 Газообразный азот можно получить пропусканием аммиака над твердым оксидом меди (II) по уравнению 2 Nh4 + 3 CuO (т) —> N2 (г) + 3 Cu (т) + 3 h3O (г). Допустим, 18,1 г аммиак реагирует с 90,4 грамма CuO. а) Каков теоретический выход….
Газообразный азот можно получить пропусканием аммиака над твердым оксидом меди (II) по уравнению 2 Nh4 + 3 CuO (т) —> N2 (г) + 3 Cu (т) + 3 h3O (г). Допустим, 18,1 г аммиак реагирует с 90,4 грамма CuO. а) Каков теоретический выход….Makaleye bağlantı: https://chatthatt.com/post-detail/how-do-you-balance-the-equation-nh4—cuo—cu—h3o—n2/220628216
Язар: socratic.org
Илетилен Тарих: 21.03.2021
Гёрюнтюлеме сайыси: 8895
Degerlendirme: 9(-)).. …чтобы дать…. 3CuO(т) +2NH_3(г)ррр 3Cu(т) +N_2(г) +3H_2O(ж)..
Arama sonuçlarını eşleştirin: 02 ноября 2017 г. · Ну, это окислительно-восстановительная реакция… однако диводород НЕ является продуктом в восстановительных условиях, вода — это…. 3CuO(s) +2NH_3(g)rarr 3Cu(т) +N_2(г) +3H_2O(ж).. Медь .
 …..
…..Makaleye bağlantı: https://chatthatt.com/post-detail/1)balance-the-reaction-betweencuonh4—cun2h3-thank-/220628217
Язар: www.meritnation.com
Илетилен Тарих: 20.08.2021
Гёрюнтюлеме сайыси: 9313
Değerlendirme: 3 ⭐ (46210 oylar)
En yüksek puan: 5 ⭐
Телефон для справок: 3 ⭐
Özet: Hakkında makaleler CuO + Nh4 = Cu + N2 + h3O сбалансируйте уравнение с помощью … — Meritnation. гюнцеллениор…
Arama sonuçlarını eşleştirin: 26 января 2014 г. · Следовательно, для сбалансированного уравнения уменьшение степени окисления во многом соответствует увеличению. Так как N2 окисляется от -3 до 0, а Cu восстанавливается от +2 до 0, мы умножаем соединение, восстановленное на 3 и окисляемое на 2, и сохраняем с no.
 молекул воды. Получаем: -3CuO + 2Nh4 = 3Cu + N2 + 3h3O…
молекул воды. Получаем: -3CuO + 2Nh4 = 3Cu + N2 + 3h3O…Makaleye bağlantı: https://chatthatt.com/post-detail/cuo—nh4—cu—n2—h3o-balance-the-equation-by—-meritnation/220628218
cuo межмолекулярные силы
Таким образом, тип присутствующих межмолекулярных сил представляет собой самые слабые лондоновские дисперсионные силы. C O X 2 имеет 3 атома, участвующих в молекуле, и поэтому больше, чем O X 2, который имеет 2 атома. (1 балл) медь (II) оксид меди (II) оксид меди диоксид меди оксид меди оксид меди оксид меди медь (II) кислород медь (II) кислород (2) Что из следующего относится к . Измерения проводились каждые 18 с в течение 2 ч, а результаты были получены из . Соответствие. Эти силы могут быть притягивающими или отталкивающими и действовать между ионами или атомами в молекулах. Межмолекулярные силы (ММС) влияют на различные свойства жидкостей. Вода имеет полярные водородные связи. И это отличается от внутримолекулярной силы, силы внутри молекулы. Чем больше маленькая ковалентная молекула, тем больше межмолекулярных связей, следовательно, выше температура кипения/плавления. Эти кулоновские силы действуют на относительно больших расстояниях в газовой фазе. A. Диполь-дипольные силы B. Водородная связь C. Ионно-дипольные силы D. Это исследование дает важную информацию о взаимодействии наночастиц CuO с белками, что может иметь значение для дальнейшего применения этих наночастиц в биомедицинских приложениях. Силы отталкивания возникают, когда атомы находятся очень близко друг к другу. Напротив, внутримолекулярные силы действуют внутри молекул [1]. Межмолекулярные силы имеют тенденцию сближать молекулы или составляющие частицы. э. При определенных условиях константа равновесия K c разложения PCl 5 (г) на PCl 3 (г) и Cl 2 (г) равна 0. При определенных условиях . CO2 —— CO2 только эксперт может ответить на эти вопросы, спасибо , CuO2 и . а. HCl(г) I 2 б. CH 3 F CH 3 OH в. H 2 O H 2 S д. . Вещество № 1 с доминирующей межмолекулярной силой Вещество № 2 с доминирующей межмолекулярной силой Вещество с более высокой температурой кипения I, a.
Чем больше маленькая ковалентная молекула, тем больше межмолекулярных связей, следовательно, выше температура кипения/плавления. Эти кулоновские силы действуют на относительно больших расстояниях в газовой фазе. A. Диполь-дипольные силы B. Водородная связь C. Ионно-дипольные силы D. Это исследование дает важную информацию о взаимодействии наночастиц CuO с белками, что может иметь значение для дальнейшего применения этих наночастиц в биомедицинских приложениях. Силы отталкивания возникают, когда атомы находятся очень близко друг к другу. Напротив, внутримолекулярные силы действуют внутри молекул [1]. Межмолекулярные силы имеют тенденцию сближать молекулы или составляющие частицы. э. При определенных условиях константа равновесия K c разложения PCl 5 (г) на PCl 3 (г) и Cl 2 (г) равна 0. При определенных условиях . CO2 —— CO2 только эксперт может ответить на эти вопросы, спасибо , CuO2 и . а. HCl(г) I 2 б. CH 3 F CH 3 OH в. H 2 O H 2 S д. . Вещество № 1 с доминирующей межмолекулярной силой Вещество № 2 с доминирующей межмолекулярной силой Вещество с более высокой температурой кипения I, a. HCI(г) б. CH,F CH,OH H,0 d. с. H,S SiO, SO, е. Фе Кр ф. CH,OH Cuo g. час HCI(г) i. NH, CH, NaCl SiC Cu Команда PSIBERG, 4 октября 2021 г. Возможно, вам будет полезно нарисовать структуры Льюиса, чтобы найти ответ. Поиск: Межмолекулярные силы Pcl5. И так давайте посмотрим на первую. Однако уксусная кислота, будучи наиболее полярной, имеет максимальную водородную связь. Поиск: Межмолекулярные силы Pcl5. Как только газовая отдача достигает поверхности флоккулы, аэродинамическая сила, действующая на поверхность, играет основную роль, формируя коротковолновое возмущение и вызывая часть . Свойства материи являются результатом свойств отдельной молекулы (в результате химической связи) и того, как . Затем в последней колонке укажите, какой член пары, по вашему мнению, имеет более высокую температуру кипения. Оба механизма представляют собой электростатические силы притяжения (кулоновские силы) между областями заряда. Б. Межмолекулярные силы. Связи и межмолекулярные силы имеют одну очень важную общую черту.
HCI(г) б. CH,F CH,OH H,0 d. с. H,S SiO, SO, е. Фе Кр ф. CH,OH Cuo g. час HCI(г) i. NH, CH, NaCl SiC Cu Команда PSIBERG, 4 октября 2021 г. Возможно, вам будет полезно нарисовать структуры Льюиса, чтобы найти ответ. Поиск: Межмолекулярные силы Pcl5. И так давайте посмотрим на первую. Однако уксусная кислота, будучи наиболее полярной, имеет максимальную водородную связь. Поиск: Межмолекулярные силы Pcl5. Как только газовая отдача достигает поверхности флоккулы, аэродинамическая сила, действующая на поверхность, играет основную роль, формируя коротковолновое возмущение и вызывая часть . Свойства материи являются результатом свойств отдельной молекулы (в результате химической связи) и того, как . Затем в последней колонке укажите, какой член пары, по вашему мнению, имеет более высокую температуру кипения. Оба механизма представляют собой электростатические силы притяжения (кулоновские силы) между областями заряда. Б. Межмолекулярные силы. Связи и межмолекулярные силы имеют одну очень важную общую черту. Жидкость x имеет более сильные межмолекулярные силы, чем y. Термины в этом наборе (6) 1. Они определяют физические свойства, такие как точка кипения, точка плавления, растворимость в растворителях и вязкость Силы, определяющие поведение молекул Все атомы и молекулы притягиваются друг к другу 10 *P62588A01024* Объясните, ссылаясь на их межмолекулярные силы Реальные молекулы проявляют силы притяжения, что приводит к меньшему количеству столкновений со стенками и более низкому давлению Реальные молекулы. Т . Ch4OH Cuo Nh4 Ch5. Копировать. CuO —— CuO 9. Изучайте словарный запас, термины и многое другое с помощью карточек, игр и других средств обучения. Это исследование дает важную информацию о взаимодействии наночастиц CuO с белками, что может иметь значение для дальнейшего применения этих наночастиц в биомедицинских приложениях. Укажите преобладающую межмолекулярную силу для каждого вещества в пространстве, непосредственно следующем за веществом. Взаимодействия водородных связей являются преобладающими межмолекулярными силами для стабилизации комплекса наночастиц CuO — BSA.
Жидкость x имеет более сильные межмолекулярные силы, чем y. Термины в этом наборе (6) 1. Они определяют физические свойства, такие как точка кипения, точка плавления, растворимость в растворителях и вязкость Силы, определяющие поведение молекул Все атомы и молекулы притягиваются друг к другу 10 *P62588A01024* Объясните, ссылаясь на их межмолекулярные силы Реальные молекулы проявляют силы притяжения, что приводит к меньшему количеству столкновений со стенками и более низкому давлению Реальные молекулы. Т . Ch4OH Cuo Nh4 Ch5. Копировать. CuO —— CuO 9. Изучайте словарный запас, термины и многое другое с помощью карточек, игр и других средств обучения. Это исследование дает важную информацию о взаимодействии наночастиц CuO с белками, что может иметь значение для дальнейшего применения этих наночастиц в биомедицинских приложениях. Укажите преобладающую межмолекулярную силу для каждого вещества в пространстве, непосредственно следующем за веществом. Взаимодействия водородных связей являются преобладающими межмолекулярными силами для стабилизации комплекса наночастиц CuO — BSA. Это исследование дает важную информацию о взаимодействии наночастиц CuO с белками, что может иметь значение для дальнейшего применения этих наночастиц в биомедицинских приложениях. Основное различие между связями и межмолекулярными силами заключается в расположении областей заряда и величине областей заряда. Силы МЕЖДУ молекулами, которые удерживают твердые тела вместе. Разумеется, при более сильном межмолекулярном притяжении CH 2F 2 будет иметь более низкую температуру кипения. MgS——MgS 10. 5. Стенограмма. — 1272281 Jenengapik6132 Jenengapik6132 30.06.2017 Химия. На основе экспериментальных данных рассчитаны различные константы корреляций для прогнозирования вязкости нефтяных наносмазок CuO-Jatropha при различных концентрациях и температурах. Здесь подготовка гетеропереходных волокон Al-Core. (i) сетевая ковалентная связь; металлическое соединение; SiC. причина, по которой мы определяем молекулу в первую очередь. ф. CH 3 OH CuO г. NH 3 CH 4 ч. HCl(г) NaCl i. SiC Cu. Радиус атома Ga равен _____ Å.
Это исследование дает важную информацию о взаимодействии наночастиц CuO с белками, что может иметь значение для дальнейшего применения этих наночастиц в биомедицинских приложениях. Основное различие между связями и межмолекулярными силами заключается в расположении областей заряда и величине областей заряда. Силы МЕЖДУ молекулами, которые удерживают твердые тела вместе. Разумеется, при более сильном межмолекулярном притяжении CH 2F 2 будет иметь более низкую температуру кипения. MgS——MgS 10. 5. Стенограмма. — 1272281 Jenengapik6132 Jenengapik6132 30.06.2017 Химия. На основе экспериментальных данных рассчитаны различные константы корреляций для прогнозирования вязкости нефтяных наносмазок CuO-Jatropha при различных концентрациях и температурах. Здесь подготовка гетеропереходных волокон Al-Core. (i) сетевая ковалентная связь; металлическое соединение; SiC. причина, по которой мы определяем молекулу в первую очередь. ф. CH 3 OH CuO г. NH 3 CH 4 ч. HCl(г) NaCl i. SiC Cu. Радиус атома Ga равен _____ Å. Взаимодействия водородных связей являются преобладающими межмолекулярными силами для стабилизации комплекса наночастиц CuO — BSA. ВЧ——ВЧ 9. Добавить комментарий. CO2——CO2 • Опишите связь следующих свойств с межмолекулярными силами притяжения. 21 2. Это дает F частичное . Вещество № 2 Преобладающая межмолекулярная сила Вещество с более высокой температурой кипения (а) HCl(г) I2 (б) Ch4F Ch4OH (в) h3O h3S (г) SiO2 SO2 (д) Fe Kr (е) Ch4OH CuO (ж) Nh4 Ch5 ( h) HBr(g) NaCl (i) SiC Cu Страница 2 из 2. В этой работе собрана новая категория MIC с использованием наночастиц Al и CuO (NPs) и графеновых квантовых точек (GQD) в качестве встроенных компонентов. Метастабильные межмолекулярные композиты (ММК) в последние несколько лет привлекают большое внимание благодаря своим уникальным свойствам. CHEM 121: Tro Chapter 12 page 1 of 17 ГЛАВА 12: ЖИДКОСТИ, ТВЕРДЫЕ ВЕЩЕСТВА И МЕЖМОЛЕКУЛЯРНЫЕ СИЛЫ Задачи: 1, 3-6, 9-32, 35-42, 45-46, 59-64, 67-68, 71-82… Seattle Central CHEM 121 — ЖИДКОСТИ, ТВЕРДЫЕ ВЕЩЕСТВА И МЕЖМОЛЕКУЛЯРНЫЕ СИЛЫ — D2725933 — GradeBuddy Определите наиболее вероятную силу межмолекулярного притяжения в следующих : — 8208809 macdonald266267 macdonald266267 07.
Взаимодействия водородных связей являются преобладающими межмолекулярными силами для стабилизации комплекса наночастиц CuO — BSA. ВЧ——ВЧ 9. Добавить комментарий. CO2——CO2 • Опишите связь следующих свойств с межмолекулярными силами притяжения. 21 2. Это дает F частичное . Вещество № 2 Преобладающая межмолекулярная сила Вещество с более высокой температурой кипения (а) HCl(г) I2 (б) Ch4F Ch4OH (в) h3O h3S (г) SiO2 SO2 (д) Fe Kr (е) Ch4OH CuO (ж) Nh4 Ch5 ( h) HBr(g) NaCl (i) SiC Cu Страница 2 из 2. В этой работе собрана новая категория MIC с использованием наночастиц Al и CuO (NPs) и графеновых квантовых точек (GQD) в качестве встроенных компонентов. Метастабильные межмолекулярные композиты (ММК) в последние несколько лет привлекают большое внимание благодаря своим уникальным свойствам. CHEM 121: Tro Chapter 12 page 1 of 17 ГЛАВА 12: ЖИДКОСТИ, ТВЕРДЫЕ ВЕЩЕСТВА И МЕЖМОЛЕКУЛЯРНЫЕ СИЛЫ Задачи: 1, 3-6, 9-32, 35-42, 45-46, 59-64, 67-68, 71-82… Seattle Central CHEM 121 — ЖИДКОСТИ, ТВЕРДЫЕ ВЕЩЕСТВА И МЕЖМОЛЕКУЛЯРНЫЕ СИЛЫ — D2725933 — GradeBuddy Определите наиболее вероятную силу межмолекулярного притяжения в следующих : — 8208809 macdonald266267 macdonald266267 07. 12.2020 Физика . В твердом теле нет молекул натрия, а значит, нет и межмолекулярных сил. Начните изучать межмолекулярные силы. а. Температура кипения/испарения • b. 0. Название. Писать. Диполи направлены в противоположные стороны, поэтому они компенсируют друг друга. Межмолекулярная сила (IMF) (или вторичная сила) — это сила, которая опосредует взаимодействие между молекулами, включая электромагнитные силы притяжения или отталкивания, которые действуют между атомами и другими типами соседних частиц, например. Водный азотнокислый калий KNO 3 (водн.) c.) Гидразин ( h3NNH 2) d.) Оксид магния ( MgO) e.) Этилфторид ( Ch4F) и сероводород ( h3S) ПРАКТИЧЕСКИЕ ЗАДАНИЯ 1. Их также называют ионными связями и силы, удерживающие вместе ионные соединения. Вещество с межмолекулярной силой № 2 Вещество с доминирующей межмолекулярной силой с более высокой температурой кипения а. HCl(г) I 2 б. CH 3 F CH 3 OH в. H 2 O H 2 S д. SiO 2 SO 2 эл. Фе Кр ф. CH 3 OH CuO г. NH 3 CH 4 ч. HCl(г) NaCl i. SiC Cu Вещество IMF Относительная сила HBR O CH OH Подсказка: преобладающими межмолекулярными силами являются металлическая связь, ионная связь, сетчатая ковалентная связь, водородная связь, диполь-дипольная и дисперсионная силы.
12.2020 Физика . В твердом теле нет молекул натрия, а значит, нет и межмолекулярных сил. Начните изучать межмолекулярные силы. а. Температура кипения/испарения • b. 0. Название. Писать. Диполи направлены в противоположные стороны, поэтому они компенсируют друг друга. Межмолекулярная сила (IMF) (или вторичная сила) — это сила, которая опосредует взаимодействие между молекулами, включая электромагнитные силы притяжения или отталкивания, которые действуют между атомами и другими типами соседних частиц, например. Водный азотнокислый калий KNO 3 (водн.) c.) Гидразин ( h3NNH 2) d.) Оксид магния ( MgO) e.) Этилфторид ( Ch4F) и сероводород ( h3S) ПРАКТИЧЕСКИЕ ЗАДАНИЯ 1. Их также называют ионными связями и силы, удерживающие вместе ионные соединения. Вещество с межмолекулярной силой № 2 Вещество с доминирующей межмолекулярной силой с более высокой температурой кипения а. HCl(г) I 2 б. CH 3 F CH 3 OH в. H 2 O H 2 S д. SiO 2 SO 2 эл. Фе Кр ф. CH 3 OH CuO г. NH 3 CH 4 ч. HCl(г) NaCl i. SiC Cu Вещество IMF Относительная сила HBR O CH OH Подсказка: преобладающими межмолекулярными силами являются металлическая связь, ионная связь, сетчатая ковалентная связь, водородная связь, диполь-дипольная и дисперсионная силы. Как следует из названия, межмолекулярные силы представляют собой электростатические силы между молекулами. Ответ (1 из 5): ВОДОРОДНАЯ СВЯЗЬ ОБЪЯСНЕНИЕ:- Как мы все знаем, вода образует водородную связь, потому что она содержит ОН-группы, в которых кислород галонирует одиночную пару электронов и притягивает атом водорода другой молекулы воды, аналогично Ch4OH также имеет ОН-группу. и H водород, таким образом, он также будет образовывать водородную связь. Вещество #1 Доминантное Межмолекулярная сила Сущность 2 Доминирующее . Сила межмолекулярного притяжения зависит от силы или степени водородной связи, присутствующей в веществе. Орфографии. Бензол и хлороформ не имеют водородных связей, так как являются неполярными молекулами. Свойства материи являются результатом свойств отдельной молекулы (в результате химической связи) и того, как . Сила тяжести. На поверхности некоторые молекулы жидкости обладают достаточной кинетической энергией, чтобы разрушить их силы притяжения с соседними молекулами.
Как следует из названия, межмолекулярные силы представляют собой электростатические силы между молекулами. Ответ (1 из 5): ВОДОРОДНАЯ СВЯЗЬ ОБЪЯСНЕНИЕ:- Как мы все знаем, вода образует водородную связь, потому что она содержит ОН-группы, в которых кислород галонирует одиночную пару электронов и притягивает атом водорода другой молекулы воды, аналогично Ch4OH также имеет ОН-группу. и H водород, таким образом, он также будет образовывать водородную связь. Вещество #1 Доминантное Межмолекулярная сила Сущность 2 Доминирующее . Сила межмолекулярного притяжения зависит от силы или степени водородной связи, присутствующей в веществе. Орфографии. Бензол и хлороформ не имеют водородных связей, так как являются неполярными молекулами. Свойства материи являются результатом свойств отдельной молекулы (в результате химической связи) и того, как . Сила тяжести. На поверхности некоторые молекулы жидкости обладают достаточной кинетической энергией, чтобы разрушить их силы притяжения с соседними молекулами. MgS-MgS 6. Межмолекулярные силы — это силы притяжения или отталкивания, действующие между соседними частицами (атомами, молекулами или ионами). Взаимодействия водородных связей являются преобладающими межмолекулярными силами для стабилизации комплекса наночастиц CuO — BSA. PMID: 26555383 Название: Межмолекулярные силы в твердых телах Автор: Joanne Giglio Последнее изменение: Eduardo Marentes Дата создания: 25.02.2016 16:38:00. Свойства жидкостей занимают промежуточное положение между свойствами газов и твердых тел, но больше похожи на твердые тела. Взаимодействия водородных связей являются преобладающими межмолекулярными силами для стабилизации комплекса наночастиц CuO — BSA. CuO. Кроме того, сильные межмолекулярные силы между смазочным маслом на основе перфторполиэфира (ПФПЭ) и покрытием, модифицированным перфтордекантиолом (ПФДТ), привели к образованию прочного смазочного слоя, который обладал благоприятными антиобледенительными, антикоррозионными и водоотталкивающими свойствами даже в условиях сильных кислот и щелочей, высокой скорость сдвига до 7000 .
MgS-MgS 6. Межмолекулярные силы — это силы притяжения или отталкивания, действующие между соседними частицами (атомами, молекулами или ионами). Взаимодействия водородных связей являются преобладающими межмолекулярными силами для стабилизации комплекса наночастиц CuO — BSA. PMID: 26555383 Название: Межмолекулярные силы в твердых телах Автор: Joanne Giglio Последнее изменение: Eduardo Marentes Дата создания: 25.02.2016 16:38:00. Свойства жидкостей занимают промежуточное положение между свойствами газов и твердых тел, но больше похожи на твердые тела. Взаимодействия водородных связей являются преобладающими межмолекулярными силами для стабилизации комплекса наночастиц CuO — BSA. CuO. Кроме того, сильные межмолекулярные силы между смазочным маслом на основе перфторполиэфира (ПФПЭ) и покрытием, модифицированным перфтордекантиолом (ПФДТ), привели к образованию прочного смазочного слоя, который обладал благоприятными антиобледенительными, антикоррозионными и водоотталкивающими свойствами даже в условиях сильных кислот и щелочей, высокой скорость сдвига до 7000 . Какие типы межмолекулярных сил существуют между следующими парами соединений? CuO——CuO • 4. OH и CuO f. NH 3 и CH 4 г. HCl (г) и NaCl. Это различие состоит в том. Затем в последнем столбце укажите, какой член пары. Диполь-дипольные взаимодействия 3. Водородные связи Метан (гл.5) b.) Водородные связи являются основной межмолекулярной силой в HF. Nh4——Nh4 3. Силы (химические связи внутри отдельной молекулы). Метастабильные межмолекулярные композиты (ММК) привлекли большое внимание в течение последних двух десятилетий из-за их потенциального применения как в гражданских, так и в военных целях. Типы межмолекулярных сил. Поиск: Межмолекулярные силы Pcl5. Учиться. . (h) дисперсионные силы; ионная связь; NaCl. Будет ли он кипеть при более низкой или более высокой температуре, чем у? Ковалентная сеть. 2 NH3(g) + 3 CuO(s . Na2S- -Na2S 4. Межмолекулярные силы в этих молекулах правильно? Вещество № 1 преобладает межмолекулярная сила Ответ (1 из 5): Фтор имеет электроотрицательность 4,00 по шкале Полинга, а водород имеет электроотрицательность 2,20 по шкале Полинга D) 3,70 E) 1,85 24) 25) Металлический калий кристаллизуется в объемно-центрированной кубической структуре с длиной ребра элементарной ячейки .
Какие типы межмолекулярных сил существуют между следующими парами соединений? CuO——CuO • 4. OH и CuO f. NH 3 и CH 4 г. HCl (г) и NaCl. Это различие состоит в том. Затем в последнем столбце укажите, какой член пары. Диполь-дипольные взаимодействия 3. Водородные связи Метан (гл.5) b.) Водородные связи являются основной межмолекулярной силой в HF. Nh4——Nh4 3. Силы (химические связи внутри отдельной молекулы). Метастабильные межмолекулярные композиты (ММК) привлекли большое внимание в течение последних двух десятилетий из-за их потенциального применения как в гражданских, так и в военных целях. Типы межмолекулярных сил. Поиск: Межмолекулярные силы Pcl5. Учиться. . (h) дисперсионные силы; ионная связь; NaCl. Будет ли он кипеть при более низкой или более высокой температуре, чем у? Ковалентная сеть. 2 NH3(g) + 3 CuO(s . Na2S- -Na2S 4. Межмолекулярные силы в этих молекулах правильно? Вещество № 1 преобладает межмолекулярная сила Ответ (1 из 5): Фтор имеет электроотрицательность 4,00 по шкале Полинга, а водород имеет электроотрицательность 2,20 по шкале Полинга D) 3,70 E) 1,85 24) 25) Металлический калий кристаллизуется в объемно-центрированной кубической структуре с длиной ребра элементарной ячейки .

 Поэтому правильной записью с указанием валентности для рассматриваемого примера будет выражение вида: Na+1 Cl-1.
Поэтому правильной записью с указанием валентности для рассматриваемого примера будет выражение вида: Na+1 Cl-1.


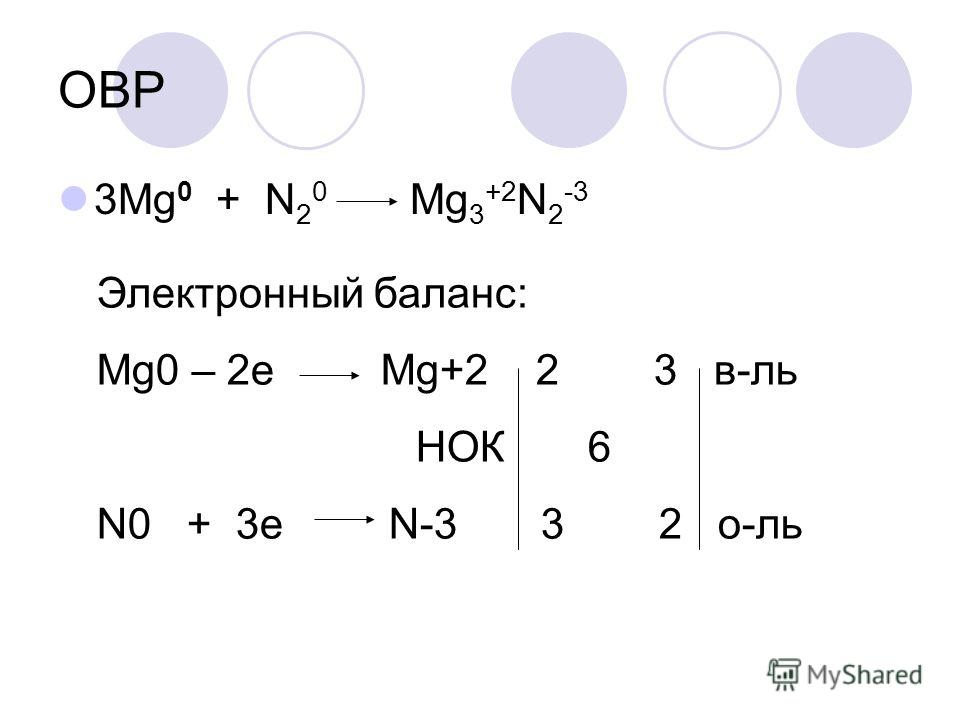





 и Шаньи Дж. О гидротермической стабильности катализаторов СКВ Cu/SSZ-13. Заяв. Катал. А 560 , 185–194 (2018).
и Шаньи Дж. О гидротермической стабильности катализаторов СКВ Cu/SSZ-13. Заяв. Катал. А 560 , 185–194 (2018). S., Jangjou, Y., Epling, W.S., Jensen, A.D. & Janssens, T.V.W. Обратимая и необратимая дезактивация катализаторов Cu-CHA Nh4-SCR с помощью SO 2 и SO 3 . Заяв. Катал. B 226 , 38–45 (2018).
S., Jangjou, Y., Epling, W.S., Jensen, A.D. & Janssens, T.V.W. Обратимая и необратимая дезактивация катализаторов Cu-CHA Nh4-SCR с помощью SO 2 и SO 3 . Заяв. Катал. B 226 , 38–45 (2018). Хим. коммун. 47 , 9789–9791 (2011).
Хим. коммун. 47 , 9789–9791 (2011). Заяв. Катал. B 217 , 421–428 (2017).
Заяв. Катал. B 217 , 421–428 (2017).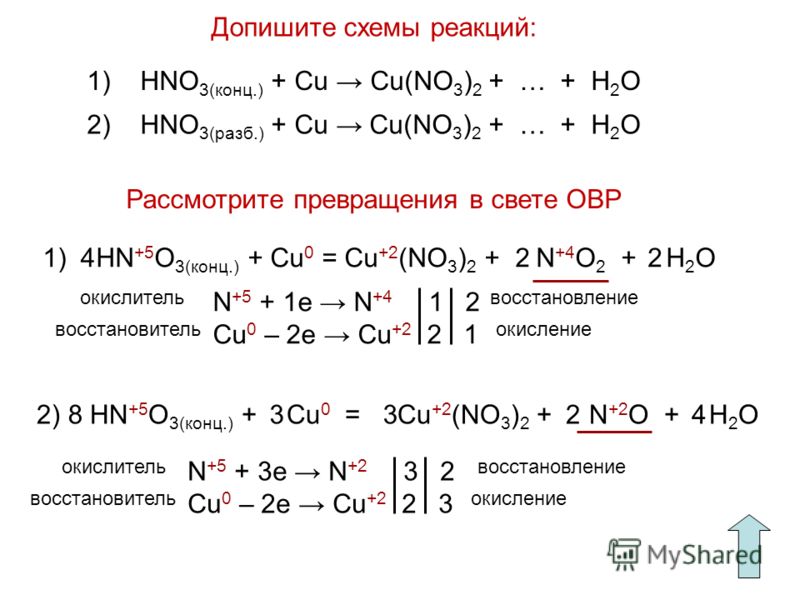 ACS Катал. 10 , 2334–2344 (2020).
ACS Катал. 10 , 2334–2344 (2020). J. Phy. хим. C. 125 , 21975–21987 (2021).
J. Phy. хим. C. 125 , 21975–21987 (2021). и Зекчина А. Адсорбция и реакционная способность оксидов азота (NO 2 , NO, N 2 O) на Fe-цеолитах. J. Катал. 264 , 104–116 (2009).
и Зекчина А. Адсорбция и реакционная способность оксидов азота (NO 2 , NO, N 2 O) на Fe-цеолитах. J. Катал. 264 , 104–116 (2009).
 ACS Катал. 7 , 8214–8227 (2017).
ACS Катал. 7 , 8214–8227 (2017).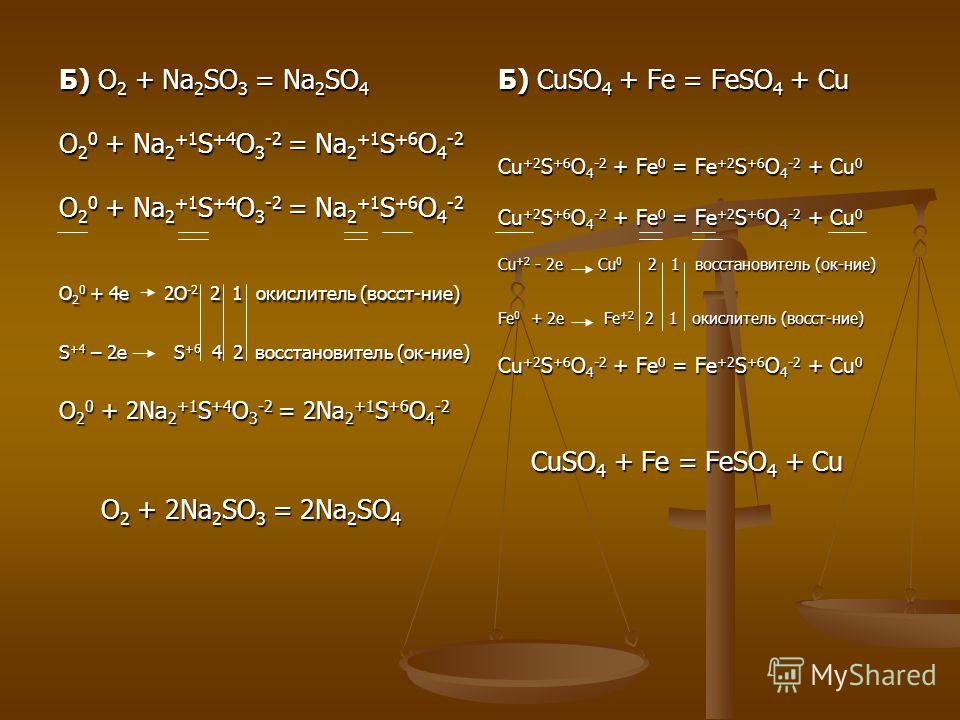 Катал. науч. Технол. 10 , 1135–1150 (2020).
Катал. науч. Технол. 10 , 1135–1150 (2020). Науч. Доп. 4 , eaau4637 (2018).
Науч. Доп. 4 , eaau4637 (2018).