| 1 | Найти производную — d/dx | бревно натуральное х | |
| 2 | Оценить интеграл | интеграл натурального логарифма x относительно x | |
| 3 | Найти производную — d/dx | 92)||
| 21 | Оценить интеграл | интеграл от 0 до 1 кубического корня из 1+7x относительно x | |
| 22 | Найти производную — d/dx | грех(2x) | |
| 23 | Найти производную — d/dx | 9(3x) по отношению к x||
| 41 | Оценить интеграл | интеграл от cos(2x) относительно x | |
| 42 | Найти производную — d/dx | 1/(корень квадратный из х) | |
| 43 | Оценка интеграла 9бесконечность | ||
| 45 | Найти производную — d/dx | х/2 | |
| 46 | Найти производную — d/dx | -cos(x) | |
| 47 | Найти производную — d/dx | грех(3x) | 92+1|
| 68 | Оценить интеграл | интеграл от sin(x) по x | |
| 69 | Найти производную — d/dx | угловой синус(х) | |
| 70 | Оценить предел | ограничение, когда x приближается к 0 из (sin(x))/x 92 по отношению к х | |
| 85 | Найти производную — d/dx | лог х | |
| 86 | Найти производную — d/dx | арктан(х) | |
| 87 | Найти производную — d/dx | бревно натуральное 5х92 |
Сверхэкспрессия TG2 усиливает дифференцировку эктомезенхимальных стволовых клеток в нейроноподобные клетки и способствует функциональному восстановлению у взрослых крыс после травмы спинного мозга
 Jin MC, Medress ZA, Azad TD, Doulames VM, Veeravagu A. Стволовые клетки Терапия острого повреждения спинного мозга у людей: обзор. Нейрохирургический фокус. 2019;46:E10. doi: 10.3171/2018.12.FOCUS18602. [PubMed] [CrossRef] [Академия Google]
Jin MC, Medress ZA, Azad TD, Doulames VM, Veeravagu A. Стволовые клетки Терапия острого повреждения спинного мозга у людей: обзор. Нейрохирургический фокус. 2019;46:E10. doi: 10.3171/2018.12.FOCUS18602. [PubMed] [CrossRef] [Академия Google]2. Кониг Н., Тролль С., Капуралин К., Адамейко И., Митречич Д., Альдскогиус Х., Шортланд П.Дж., Козлова Е.Н. Стволовые клетки нервного гребня мыши и предшественники нейронов, полученные из эмбриональных стволовых клеток, выживают и дифференцируются после трансплантации в модели отрыва дорсального корешка. J Tissue Eng Regen Med. 2017;11:129–137. doi: 10.1002/term.1893. [PubMed] [CrossRef] [Google Scholar]
3. Ричардсон С.М., Каламегам Г., Пушпарадж П.Н., Матта С., Мемик А., Хадемхоссейни А., Мобашери Р., Полетти Ф.Л., Хойланд Дж.А., Мобашери А. Мезенхимальные стволовые клетки в регенеративной медицине : Акцент на регенерацию суставного хряща и межпозвонкового диска. Методы. 2016;99:69–80. doi: 10.1016/j.ymeth.2015.09.015. [PubMed] [CrossRef] [Google Scholar]
4.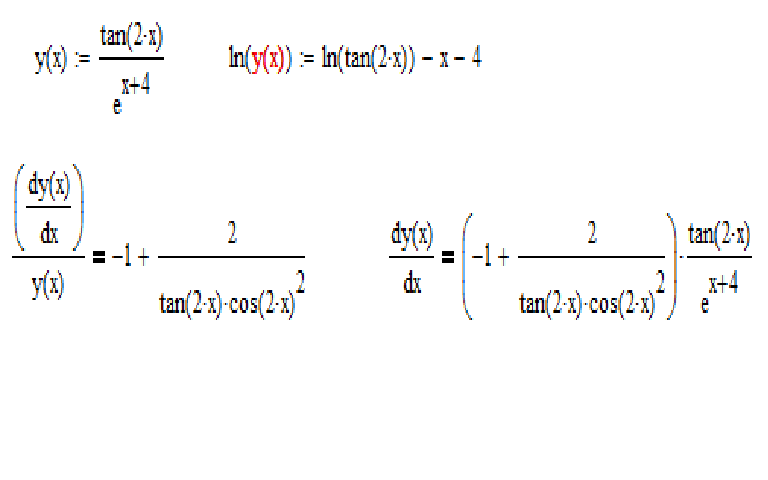 Zhang Z, He Q, Deng W, Chen Q, Hu X, Gong A, Cao X, Yu J, Xu X. Назальные эктомезенхимальные стволовые клетки: многолинейная дифференцировка и эффекты трансформации фибриновых гелей. Биоматериалы. 2015;49:57–67. doi: 10.1016/j.biomaterials.2015.01.057. [PubMed] [CrossRef] [Google Scholar]
Zhang Z, He Q, Deng W, Chen Q, Hu X, Gong A, Cao X, Yu J, Xu X. Назальные эктомезенхимальные стволовые клетки: многолинейная дифференцировка и эффекты трансформации фибриновых гелей. Биоматериалы. 2015;49:57–67. doi: 10.1016/j.biomaterials.2015.01.057. [PubMed] [CrossRef] [Google Scholar]
5. Liu J, Chen Q, Zhang Z, Zheng Y, Sun X, Cao X, Gong A, Cui Y, He Q, Jiang P. Фибриновые каркасы, содержащие эктомезенхимальные стволовые клетки усиливают поведенческие и гистологические улучшения в крысиной модели травмы спинного мозга. Клетки Ткани Органы. 2013;198:35–46. doi: 10.1159/000351665. [PubMed] [CrossRef] [Google Scholar]
6. Zhang J, Gao X, Zou H, Liu J, Zhang Z. Эктомезенхимальные стволовые клетки, полученные из слизистой оболочки носа крысы, дифференцируются в шванноподобные клетки, способствуя дифференцировке клеток PC12. и образующие миелин in vitro. Стволовые клетки 2015;2015:328957. дои: 10.1155/2015/328957. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7.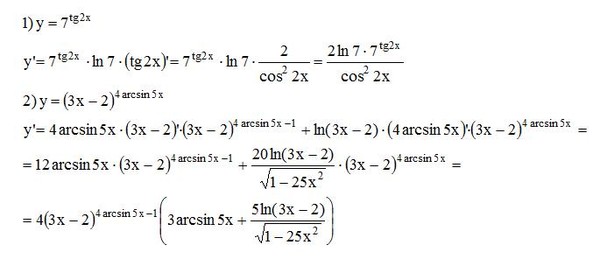 Абдалла Б., Кассем М. Мезенхимальные стволовые клетки человека: от фундаментальной биологии до клинических применений. Джин Тер. 2008;15:109–116. doi: 10.1038/sj.gt.3303067. [PubMed] [CrossRef] [Google Scholar]
Абдалла Б., Кассем М. Мезенхимальные стволовые клетки человека: от фундаментальной биологии до клинических применений. Джин Тер. 2008;15:109–116. doi: 10.1038/sj.gt.3303067. [PubMed] [CrossRef] [Google Scholar]
8. Sahni V, Kessler JA. Терапия стволовыми клетками при травмах спинного мозга. Нат Рев Нейрол. 2010;6:363–372. doi: 10.1038/nrneurol.2010.73. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
9. Badarau E, Collighan RJ, Griffin M. Последние достижения в разработке ингибиторов тканевой трансглютаминазы (TG2). Аминокислоты. 2013;44:119–127. doi: 10.1007/s00726-011-1188-4. [PubMed] [CrossRef] [Академия Google]
10. Белкин А.М. Внеклеточный TG2: новые функции и регуляция. FEBS J. 2011; 278:4704–4716. doi: 10.1111/j.1742-4658.2011.08346.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
11. Земсков Э.А., Джаниак А., Ханг Дж., Ваграй А., Белкин А.М. Роль тканевой трансглютаминазы во взаимодействиях клеток и матрикса. Фронт биосай.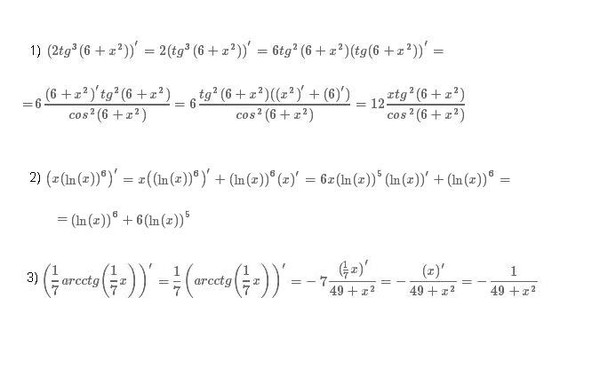 2006; 11:1057–1076. дои: 10.2741/1863. [PubMed] [CrossRef] [Google Scholar]
2006; 11:1057–1076. дои: 10.2741/1863. [PubMed] [CrossRef] [Google Scholar]
12. Коллиган Р.Дж., Гриффин М. Трансглютаминаза-2 сшивает матриксные белки: Биологическое значение и медицинские приложения. Аминокислоты. 2009 г.;36:659–670. doi: 10.1007/s00726-008-0190-y. [PubMed] [CrossRef] [Google Scholar]
13. Kanchan K, Fuxreiter M, Fésüs L. Физиологические, патологические и структурные последствия неферментативных белок-белковых взаимодействий многофункциональной трансглютаминазы человека 2. Cell Mol Life Sci. 2015;72:3009–3035. doi: 10.1007/s00018-015-1909-z. [PubMed] [CrossRef] [Google Scholar]
14. Лоранд Л., Грэм Р.М. Трансглютаминазы: сшивающие ферменты с плейотропными функциями. Nat Rev Mol Cell Biol. 2003; 4: 140–156. doi: 10.1038/nrm1014. [PubMed] [CrossRef] [Академия Google]
15. Soluri MF, Boccafoschi F, Cotella D, Moro L, Forestieri G, Autiero I, Cavallo L, Oliva R, Griffin M, Wang Z, et al. Картирование минимального домена сайта связывания фибронектина на трансглютаминазе 2 (TG2) и его значение в опосредовании передачи сигналов, адгезии и миграции в клетках, экспрессирующих TG2. FASEB J. 2019; 33:2327–2342. doi: 10.1096/fj.201800054RRR. [PubMed] [CrossRef] [Google Scholar]
FASEB J. 2019; 33:2327–2342. doi: 10.1096/fj.201800054RRR. [PubMed] [CrossRef] [Google Scholar]
16. Tucholski J. TG2 защищает клетки нейробластомы от стресса, вызванного повреждением ДНК, подавляет активацию p53. Аминокислоты. 2010;39: 523–532. doi: 10.1007/s00726-009-0468-8. [PubMed] [CrossRef] [Google Scholar]
17. Van Strien ME, Drukarch B, Bol JG, van der Valk P, van Horssen J, Gerritsen WH, Breve JJ, van Dam AM. Появление тканевой трансглютаминазы в астроцитах при поражениях рассеянным склерозом: роль в адгезии и миграции клеток? Мозговой патол. 2011; 21:44–54. doi: 10.1111/j.1750-3639.2010.00428.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Pitolli C, Pietroni V, Marekov L, Terrinoni A, Yamanishi K, Mazzanti C, Melino G, Candi E. Характеристика TG2 и TG1-TG2 эпидермис мыши с двойным нокаутом. Аминокислоты. 2017;49: 635–642. doi: 10.1007/s00726-016-2356-3. [PubMed] [CrossRef] [Google Scholar]
19. Джинн С.Л., Амайя А.К., Александр И.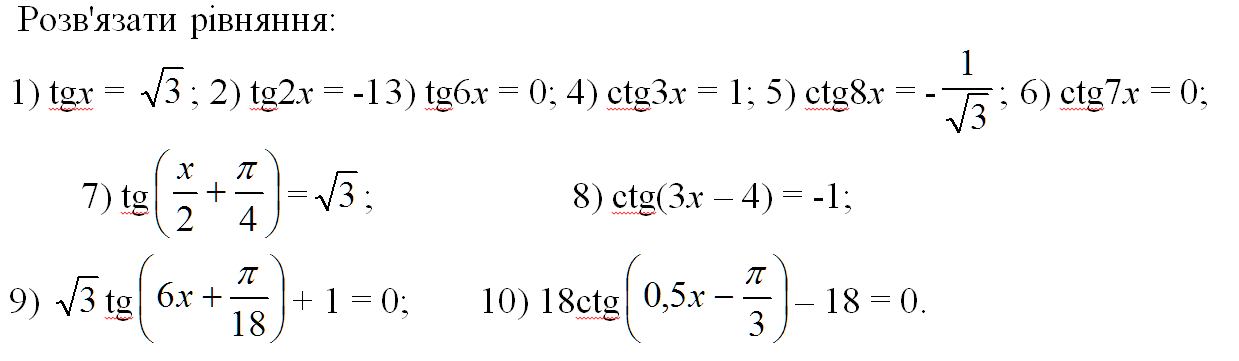 Е., Эдельштейн М., Абеди М.Р. Клинические испытания генной терапии по всему миру до 2017 года: обновление. Дж Джин Мед. 2018;20:e3015. doi: 10.1002/jgm.3015. [PubMed] [CrossRef] [Google Scholar]
Е., Эдельштейн М., Абеди М.Р. Клинические испытания генной терапии по всему миру до 2017 года: обновление. Дж Джин Мед. 2018;20:e3015. doi: 10.1002/jgm.3015. [PubMed] [CrossRef] [Google Scholar]
20. Qu Y, Zhao J, Wang Y, Gao Z. Заглушение эфрина B3 улучшает функциональное восстановление после травмы спинного мозга. Mol Med Rep. 2014; 9:1761–1766. doi: 10.3892/mmr.2014.2019. [PubMed] [CrossRef] [Академия Google]
21. Ribault A, Loinard C, Flamant S, Lim S, Tamarat R. Экзосомы, полученные из мезенхимальных стромальных клеток человека, способствуют заживлению ран в мышиной модели радиационного поражения. Цитотерапия. 2018;20:e2–e3. doi: 10.1016/j.jcyt.2018.03.007. [CrossRef] [Google Scholar]
22. Yuan X, Wu Q, Wang P, Jing Y, Yao H, Tang Y, Han R, He W, Li Z, Zhang H, Xiu R. Интраспинальное введение интерлейкина-7 способствует апоптозу нейронов и ограничивает функциональное восстановление через путь JAK/STAT5 после повреждения спинного мозга. Biochem Biophys Res Commun.
23. Чаглар Ю.С., Демирель А., Доган И., Гусейнов Р., Эроглу У., Озгурал О., Джансиз С., Бахадир Б., Килинч М.С., Аль-Бейати Э.С.М. Влияние рилузола на регенерацию спинного мозга методом гемисекции до травмы. Мировой нейрохирург. 2018;114:e247–e253. doi: 10.1016/j.wneu.2018.02.171. [PubMed] [CrossRef] [Google Scholar]
24. Chen Q, Zhang Z, Liu J, He Q, Zhou Y, Shao G, Sun X, Cao X, Gong A, Jiang P. Фибриновая матрица способствует дифференцировке ЭМСК, выделенных из слизистой оболочки носовых дыхательных путей, в миелинизирующие фенотипические шванноподобные клетки. Мол клетки. 2015; 38: 221–228. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Deng W, Shao F, He Q, Wang Q, Shi W, Yu Q, Cao X, Feng C, Bi S, Chen J, et al. EMSCs создают универсальную нишу за счет сборки липидного рафта между клетками для стимуляции нейрональной, но подавленной астроглиальной дифференцировки нервных стволовых клеток.
26. Egawa N, Lok J, Washida K, Arai K. Механизмы повреждения и восстановления аксонов после повреждения центральной нервной системы. Перевод инсульта Res. 2017; 8:14–21. doi: 10.1007/s12975-016-0495-1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Sun Y, Wu H, Chen G, Huang X, Shan Y, Shi H, Zhang Q, Zheng Y. Генетически сконструированный рекомбинантный аденовирус, экспрессирующий интерлейкин- 2 для лечения гепатоцеллюлярной карциномы. Mol Med Rep. 2018;17:300–306. [PubMed] [Google Scholar]
28. Sandner B, Ciatipis M, Motsch M, Soljanik I, Weidner N, Blesch A. Ограниченные функциональные эффекты подострой сингенной трансплантации стромальных клеток костного мозга после ушиба спинного мозга крысы. Трансплантация клеток. 2016;25:125–139. doi: 10.3727/096368915X687679. [PubMed] [CrossRef] [Google Scholar]
29. Li J, Guo W, Xiong M, Zhang S, Han H, Chen J, Mao D, Yu H, Zeng Y. Эритропоэтин облегчает рекрутирование мезенхимального ствола костного мозга. клеток в места повреждения спинного мозга. Эксперт Тер Мед. 2017; 13:1806–1812. doi: 10.3892/etm.2017.4182. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Эритропоэтин облегчает рекрутирование мезенхимального ствола костного мозга. клеток в места повреждения спинного мозга. Эксперт Тер Мед. 2017; 13:1806–1812. doi: 10.3892/etm.2017.4182. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Ibarretxe G, Crende O, Aurrekoetxea M, García-Murga V, Etxaniz J, Unda F. Стволовые клетки нервного гребня из тканей зубов: новая надежда для восстановления зубов и нервов. Стволовые клетки 2012;2012:103503. doi: 10.1155/2012/103503. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Zhang Z, Li Z, Deng W, He Q, Wang Q, Shi W, Chen Q, Yang W, Spector M, Gong A, et al. Эктодермальные мезенхимальные стволовые клетки способствуют дифференцировке и созреванию клеток-предшественников олигодендроцитов. Biochem Biophys Res Commun. 2016; 480:727–733. doi: 10.1016/j.bbrc.2016.10.115. [PubMed] [CrossRef] [Google Scholar]
32. Vanella L, Raciti G, Barbagallo I, Bonfanti R, Abraham N, Campisi A. Экспрессия тканевой трансглутаминазы во время дифференцировки нейронов мезенхимальных стволовых клеток человека. Лекарственные мишени для нейролептиков ЦНС. 2015;14:24–32. дои: 10.2174/1871527314666150116111339. [PubMed] [CrossRef] [Google Scholar]
Лекарственные мишени для нейролептиков ЦНС. 2015;14:24–32. дои: 10.2174/1871527314666150116111339. [PubMed] [CrossRef] [Google Scholar]
33. Hung CC, Lin CH, Chang H, Wang CY, Lin SH, Hsu PC, Sun YY, Lin TN, Shie FS, Kao LS, et al. Астроцитарный GAP43, индуцированный осью TLR4/NF-kB/STAT3, ослабляет опосредованную астроглиозом активацию микроглии и нейротоксичность. Дж. Нейроски. 2016;36:2027–2043. doi: 10.1523/JNEUROSCI.3457-15.2016. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
34. Locatelli F, Corti S, Donadoni C, Guglieri M, Capra F, Strazzer S, Salani S, Del Bo R, Fortunato F, Bordoni A, Коми ГП. Нейрональная дифференцировка Thy-1- и Sca-1-позитивных клеток костного мозга мышей. J Hematother Stem Cell Res. 2003; 12: 727–734. дои: 10.1089/15258160360732740. [PubMed] [CrossRef] [Google Scholar]
35. Stephens P, Grenard P, Aeschlimann P, Langley M, Blain E, Errington R, Kipling D, Thomas D, Aeschlimann D. Сшивание и функции G-белка трансглютаминазы 2 по-разному вносят вклад в реакцию заживления ран фибробластами. Дж. Клеточные науки. 2004; 117:3389–3403. doi: 10.1242/jcs.01188. [PubMed] [CrossRef] [Google Scholar]
Дж. Клеточные науки. 2004; 117:3389–3403. doi: 10.1242/jcs.01188. [PubMed] [CrossRef] [Google Scholar]
36. Nelea V, Nakano Y, Kaartinen MT. Распределение размеров и молекулярные ассоциации фибронектина плазмы и фибронектина, сшитого трансглутаминазой 2. Protein J. 2008;27:223–233. doi: 10.1007/s10930-008-9128-1. [PubMed] [CrossRef] [Google Scholar]
37. Чау Д.Ю., Браун С.В., Мазер М.Л., Хаттер В., Тинт Н.Л., Дуа Х.С., Роуз Ф.Р., Гаеммагами А.М. Амниотическая мембрана, модифицированная тканевой трансглютаминазой (TG-2): новый каркас для биомедицинских применений. Биомед Матер. 2012;7:045011. doi: 10.1088/1748-6041/7/4/045011. [PubMed] [CrossRef] [Google Scholar]
38. Павлюков М.С., Антипова Н.В., Балашова М.В., Шахпаронов М.И. Обнаружение конформационных изменений трансглютаминазы 2 в живой клетке. Biochem Biophys Res Commun. 2012; 421:773–779. doi: 10.1016/j.bbrc.2012.04.082. [PubMed] [CrossRef] [Google Scholar]
39. Li J, Li X, Jing Z, Kawazoe N, Chen G. Индукция хондрогенной дифференцировки мезенхимальных стволовых клеток человека биомиметическими наночастицами золота с настраиваемой плотностью RGD. Adv Healthc Mater. 2017:6. doi: 10.1002/adhm.201700317. [PubMed] [Google Scholar]
Индукция хондрогенной дифференцировки мезенхимальных стволовых клеток человека биомиметическими наночастицами золота с настраиваемой плотностью RGD. Adv Healthc Mater. 2017:6. doi: 10.1002/adhm.201700317. [PubMed] [Google Scholar]
40. Pollock K, Dahlenburg H, Nelson H, Fink KD, Cary W, Hendrix K, Annett G, Torrest A, Deng P, Gutierrez J, et al. Мезенхимальные стволовые клетки человека, генетически сконструированные для сверхэкспрессии нейротрофического фактора головного мозга, улучшают результаты в моделях болезни Гентингтона на мышах. Мол Тер. 2016;24:965–977. doi: 10.1038/mt.2016.12. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
41. Barde YA, Edgar D, Thoenen H. Очистка нового нейротрофического фактора из мозга млекопитающих. EMBO J. 1982; 1: 549–553. doi: 10.1002/j.1460-2075.1982.tb01207.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
42. Jia Y, Wu D, Zhang R, Shuang W, Sun J, Hao H, An Q, Liu Q. Мезенхимальные стволовые клетки костного мозга экспрессия трансгена Shh способствует функциональному восстановлению после повреждения спинного мозга у крыс.
